Патент на изобретение №2162082
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ ПАКЛИТАКСЕЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ТОРМОЖЕНИЯ РОСТА ОПУХОЛИ
(57) Реферат: Описываются новые соединения формулы 1, в которой R1-OC(O)Rx; R2 – гидрокси; R2′– водород; R6′– водород; R6 – водород; R8 – метил; R9-OC(O)Rx’; R7 и R7′ вместе образуют оксогруппу; R4 и R5 – фенил; р=0; Rd и Re – водород; Rf – водород, Rx – C1-6алкил или Rx представляет собой радикал формулы 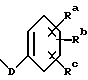 в которой D – связь или C1-6алкил и Ra и Rb и Rc – независимо водород, или их фармацевтически приемлемые соли. Эти соединения обладают противоопухолевой активностью и используются для получения фармацевтической композиции для торможения роста опухоли у носителя-млекопитающего. 3 с. и 4 з.п. ф-лы. 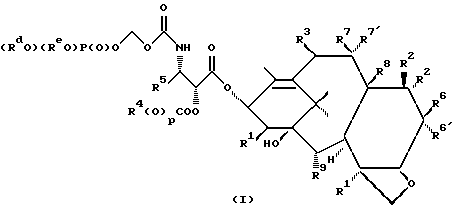
Изобретение касается противоопухолевых соединений. Более конкретно, изобретение предлагает новые производные паклитаксела, фармацевтические препараты, включающие их, и их применение в качестве противоопухолевых средств. Таксол (паклитаксел) представляет собой натуральный продукт, экстрагированный из коры тихоокеанского тиса, Taxus brevifolia. Он, как было доказано, обладает отличной противоопухолевой активностью в моделях животных ин виво, и последние исследования прояснили его уникальный способ действия, который включает аномальную полимеризацию тубулина и разрыв митоза. Недавно он был одобрен для лечения резистентного прогрессирующего рака яичников и молочной железы; и исследования, проведенные в лечении других видов рака, также дали многообещающие результаты. Результаты клинических исследований паклитаксела описываются многими авторами, такими как Rowinsky и Donehower в “The Clinical Pharmacology and Use of Antimicrotubule Agents in Cancer Chemotherapeutics,” Pharmac. Ther., 52:35-84, 1991; Spencer и Faulds в “Paclitaxel, A Review of its Pharmacodynamic and Pharmacokinetic Properties and Therapeutic Potential in the Treatment of Cancer,” Drugs, 48 (5) 794-847, 1994; и К.С. Nicolaou и др. в “Chemistry and Biology of Taxol,” Angew. Chem., Int. Ed. Engl., 33: 15-44, 1994, и в ссылках, указанных здесь. Было выявлено, что полусинтетический аналог паклитаксела, названный таксотером (досетаксел), также обладает хорошей противоопухолевой активностью в моделях животных. Таксотер сейчас проходит клинические испытания в Европе и США. Структуры паклитаксела и таксотера показаны ниже вместе с традиционной системой нумерации молекул, принадлежащих к классу; такая система нумерации используется также в этой заявке. 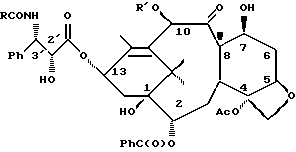 Таксол: R = Ph; R’ = ацетил Таксотер: R = т-бутокси; R’ = водород. Одним недостатком паклитаксела является его очень ограниченная растворимость в воде, что требует неводных фармацевтических носителей в приготовлении лекарственных средств. Обычно используется такой носитель, как Кремофор EL (Cremophor EL), который сам может давать нежелательные побочные действия у человека. Поэтому, ряд групп исследователей получили водорастворимые производные паклитаксела, некоторые из которых раскрываются в следующих ссылках: (a) Haugwitz и др., патент США N 4942184; (б) Kingston и др., патент США N 5059699; (в) Stella и др., патент США N 4960790; (г) Европейская патентная заявка 0558959 A1, опубликованная 8 сентября 1993 г.; (д) Vyas и др., Bioorganic & Medical Chemistry Letters 1993, 3:1357-1360; и (е) Nicolaou и др., Nature, 1993, 364:464-466 (ж) Европейская патентная заявка 0604910 A1, опубликованная 6 июля 1994. Соединения настоящего изобретения представляют собой водорастворимые фосфонооксиметила карбамат-производные паклитакселов и их фармацевтически приемлемые соли. Растворимость солей в воде облегчает приготовление фармацевтических препаратов. Это изобретение относится к новым противоопухолевым соединениям, представленным формулой I или их фармацевтически приемлемым солям 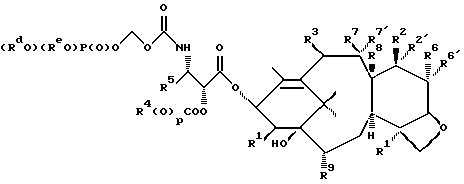 в которой R1 – гидрокси, -ОС(O)Rx или -OC(О)ORx; R2 – водород, гидрокси, -ОС(О)Rx или -OC(O)ORx; R2′ – водород, гидрокси или фторо; R6′ – водород или гидрокси; R6 – водород, или R2 и R6 вместе могут образовать оксирановое кольцо или связь; R3 – водород, гидрокси, C1-6алкилокси, -OCONR11R12, -ОС(О)Rx или -OC(O)ORx; R8 – метил или гидроксиметил, или R8 и R2 – вместе могут образовать циклопропановое кольцо; R9 – гидрокси или -OC(O)Rx; с оговоркой, что если R8 и R2 образуют циклопропановое кольцо, R2′ – водород; если R2 и R6 образуют оксирановое кольцо или двойную связь, R2′ и R6′ – водород; если R2 – гидрокси, -ОС(О)Rx или -OC(O)ORx, R2′ – водород; если R2′ – фторо, R2 – водород; один из R7 или R7′ – водород и другой – гидрокси, -ОС(О)Rx или -OC(O)ORx, или R7 и R7′ вместе могут образовать оксогруппу; R11 и R12 – независимо C1-6алкил, водород, арил или замещенный арил; R4 и R5 – независимо C1-6алкил, C2-6алкенил, C2-6алкинил, или -Z-R10; Z – прямая связь, C1-6алкил или C2-6алкенил; R10 – арил, замещенный арил, C3-6циклоалкил или гетероарил; p – 0 или 1; Rd и Re – независимо водород, C1-6алкил, арил, замещенный арил или фосфонозащитная группа; Rf – водород или гидрокси; Rx – C3-6циклоалкил, C2-6алкенил или C1-6алкил, все могут замещаться 1-6 теми же или другими атомами галогена; или Rx представляет собой радикал формулы 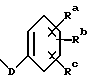 в которой D – связь или C1-6алкил; и Ra, Rb и Rc – независимо водород, нитро, амино, C1-6алкиламино, ди-C1-6алкиламино, галоген, C1-6алкил, гидрокси или C1-6алкокси. Другой аспект настоящего изобретения предусматривает, способ торможения опухоли в организме млекопитающего, который включает назначение указанному носителю-млекопитающему противоопухолевого эффективного количества соединения формулы I. И еще один аспект изобретения предусматривает фармацевтический препарат, который включает противоопухолевое эффективное количество соединения формулы I в комбинации с одним или несколькими фармацевтически приемлемыми носителями, наполнителями, разбавителями или адъювантами. В заявке, если не указано точно, или в контексте применяются следующие определения. Цифры в подстрочке после знака “С” определяют число атомов углерода, которое может содержать определенная группа. Например, “C1-6алкил” означает насыщенный углерод с прямой или разветвленной цепью с 1-6 атомами углерода; примеры включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, т-бутил, н-пентил, втор-пентил, изопентил и н-гексил. В зависимости от контекста “C1-6алкил” может также относиться к C1-6алкилену, который соединяет мостиком две группы; примеры включают пропан-1,3-диил, бутан-1,4-диил, 2-метил-бутан-1,4-диил и т.п. “C2-6алкенил” означает углерод с прямой или разветвленной цепью, имеющий по меньшей мере одну двойную связь углерод-углерод с 2-6 атомами углерода; примеры включают этенил, пропенил, изопропенил, бутенил, изобутенил, пентенил и гексенил. В зависимости от контекста “C2-6алкенил” может также относиться к C2-6алкендиилу, который образует мостик между двумя группами; примеры включают этилен-1,2-диил (винилен), 2-метил-2-бутен-1,4-диил, 2-гексен-1,6-диил и т. п. “C2-6алкинил” означает углерод с прямой или разветвленной цепью по меньшей мере с одной тройной связью углерод-углерод и с 2-6 атомами углерода; примеры включают этинил, пропинил, бутинил и гексинил. “Арил” означает ароматический углеводород с 6-10 атомами углерода; примеры включают фенил и нафтил. “Замещенный арил” означает арил, независимо замещенный от одной до пяти (но предпочтительно от одной до трех) группами, выбранными из C1-6алканоилокси, гидрокси, галогена, C1-6алкила, трифторометила, C1-6алкокси, арила, C2-6алкенила, C1-6алканоила, нитро, амино, C1-6алкиламино, ди-C1-6алкиламино и амидо. “Галоген” означает фтор, хлор, бром и йод. “Гетероарил” означает пяти- или шестичленное ароматическое кольцо, содержащее по меньшей мере один и до четырех неуглеродных атомов, выбранных из кислорода, серы и азота. Примеры гетероарила включают тиэнил, фурил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадизолил, оксадиазолил, тетразолил, тиатриазолил, оксатриазолил, пиридил, пиримидил, пиразинил, пиридазинил, триазинил, тетразинил и аналогичные кольца. “Гидрокси-защитные группы” включают, но не ограничиваются до эфиров, таких как метил, т-бутил, бензил, п-метоксибензил, п-нитробензил, аллил, тритил, метоксиметил, метоксиэтоксиметил, этоксиэтил, тетрагидропиранил, тетрагидротиопиранил, диалкилсилилэфиры, таких как диметилсилиловый эфир и триалкилсилиловые эфиры, такие как триметилсилиловый эфир, триэтилсилиловый эфир и т-бутилдиметилсилиловый эфир; эстеров, таких как бензоил, ацетил, фенилацетил, формил, моно-, ди- и тригалоацетила, таких как хлорацетил, дихлорацетил, трихлорацетил, трифторацетил; и карбонатов, таких как метил, этил, 2,2,2-трихлорэтил, аллил, бензил и п-нитрофенил. “Фосфоно” означает группу -P(О)(ОН)2 и “(фосфонооксиметил)-окси” означает -OCH2OP(O)(ОН)2. “Фосфонозащитные группы” означает части, которые можно использовать, чтобы блокировать или защитить фосфонофункциональную группу; предпочтительно такими защитными группами являются те, которые можно удалить способами, которые не влияют сильно на остальную часть молекулы. Подходящие фосфонооксизащитные группы хорошо известны специалистам данной, области техники и включают, например, группы бензила и аллила. Дополнительные примеры гидрокси и фосфоно защитных групп можно найти в типовых работах, таких как Greene и Wuts, Protective Groups in Organic Synthesis, 2 изд. 1991, John Wiley & Sons и McOmie; и Protective Groups in Organic Chemistry, 1975, Plenum Press. Способы введения и удаления защитных групп также можно найти в таких учебниках. “Фармацевтически приемлемая соль” означает соль металла или амина кислотной фосфоно группы, в которой катион не влияет существенным образом на токсичность или биологическую активность активного соединения. Подходящие соли металла включают соли лития, натрия, калия, кальция, бария, магния, цинка и алюминия. Предпочтительными солями металлов являются соли натрия и калия. Подходящими солями амина, например, являются аммиак, трометамин (ТРИС), триэтиламин, прокаин, бензатин, дибензиламин, хлоропрокаин, холин, диэтаноламин, триэтаноламин, этилендиамин, глюкамин, N-метилглюкамин, лизин, аргинин, этаноламин и другие. Термин “таксан” или “таксановое ядро” относится к частям со структурой: 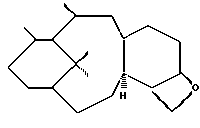 Группу циклопропана, которую можно построить из R8 и R2 формулы I, можно также назвать ” 7  ,8 ,8 -метано” группой, как в Tetrahedron Letters, т.35, N 43, стр. 7893-7896 (1994) или группой “циклопропа”, как в патенте США N 5254580, опубликованном 19 октября 1993 г. Если R2 и R6 образуют связь, между C7 и C6 будет двойная связь.
В соединениях формулы I примеры Rx включают метил, гидроксиметил, этил, н-пропил, изопропил, н-бутил, изобутил, хлорометил, 2,2,2-трихлороэтил, циклопропил, циклобутил, циклопентил, циклогексил, этенил, 2-пропенил, фенил, бензил, бромофенил, 4-аминофенил, 4-метиламинофенил, 4-метилфенил, 4-метоксифенил и другие. Примеры R4 и R5 включают 2-пропенил, изобутенил, 3-фуранил (3-фурил), 3-тиэтил, фенил, нафтил, 4-гидроксифенил, 4-метоксифенил, 4-фторофенил, 4-трифторометилфенил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, т- бутил, этенил, 2-пропенил, 2-пропинил, бензил, фенэтил, фенилэтенил, 3,4-диметоксифенил, 2-фуранил (2-фурил), 2-тиэнил, 2-(2-фуранил) этенил, 2-метилпропил, циклопропил, циклобутил, циклопентил, циклогексил, циклогексилэтил и другие.
Новые продукты с общей формулой I проявляют значительное действие торможения по отношению к аномальной клеточной пролиферации и обладают терапевтическими свойствами, которые позволяют лечить пациентов с патологическими состояниями, связанными с аномальной клеточной пролиферацией. Патологические состояния включают аномальную клеточную пролиферацию злокачественных или незлокачественных клеток в различных тканях и/или органах, включающих без ограничения мышечные, костные и/или соединительные ткани; кожу, головной мозг, легкие и половые органы; лимфатическую и/или почечную системы; клетки молочных желез и/или клетки крови; печень, пищеварительную систему и поджелудочную железу; щитовидную железу и/или надпочечники. Эти патологические состояния могут также включать псориаз; твердые опухоли; рак молочной железы, яичников, предстательной железы, головного мозга, кишечника, желудка, почки и/или рак яичка, саркому Капоши; холангиокарциному; хориокарциному; нейробластому; нефробластому; лимфогранулематоз; меланомы; множественные миеломы; хронический лимфоцитарный лейкоз; и острые или хронические гранулоцитарные лимфомы. Новые продукты по изобретению особенно полезны в лечении лимфом другого происхождения, кроме болезни Ходжкина (лимфогранулематоза), множественной миеломы, меланомы и рака яичника, мочеполовой системы, пищевода, легких и молочной железы. Продукты по изобретению можно применять при профилактике, для торможения появления или рецидива или для лечения этих патологических состояний.
Соединения этого изобретения можно получить технологией традиционных способов органической химии. Схема 1 (см. в конце текста), которая представляет способ получения соединений в объеме формулы I, показана только с целью иллюстрации и не должна рассматриваться как ограничивающая получение соединений любыми другими способами.
“Кислота” соединений формулы II представляет собой любую кислоту, которая способна присоединить протоны к C’ 3 аминогруппе. В качестве примера можно привести кислотные соли, образованные с минеральными кислотами, такими как HCl, H2SO4 или HNO3; или органическими кислотами, такими как трифторуксусная кислота, уксусная кислота, п-толуолсульфокислота, метансульфокислота и другие. Стадия (а) включает высвобождение основанием CЗ’-аминогруппы с последующей реакцией освобожденной аминогруппы с соединением формулы III, в которой R13 и R14 – независимо C1-6алкил, арил, замещенный арил или фосфоно защитная группа. Основанием может быть любое основание для нейтрализации кислоты, протонирующей аминогруппу, и которое действует как акцептор протонов, образованных во время реакции амина с хлороформатом формулы III. Примеры предпочтительного основания включают неорганическое основание или органическое основание, такое как диизопропилэтиламин, триэтиламин, пиридин, диметиламинопиридин и прочие.
Если R13 и/или R14 – представляют собой фосфонозащитную группу, ее удаляют в cтадии (b), чтобы получить дополнительные соединения в объеме формулы I.
Синтез соединений формулы II хорошо описан в нашей заявке PCT WO 94/14787, опубликованной 7 июля 1994 г. Вкратце их получают стадиями, включающими -метано” группой, как в Tetrahedron Letters, т.35, N 43, стр. 7893-7896 (1994) или группой “циклопропа”, как в патенте США N 5254580, опубликованном 19 октября 1993 г. Если R2 и R6 образуют связь, между C7 и C6 будет двойная связь.
В соединениях формулы I примеры Rx включают метил, гидроксиметил, этил, н-пропил, изопропил, н-бутил, изобутил, хлорометил, 2,2,2-трихлороэтил, циклопропил, циклобутил, циклопентил, циклогексил, этенил, 2-пропенил, фенил, бензил, бромофенил, 4-аминофенил, 4-метиламинофенил, 4-метилфенил, 4-метоксифенил и другие. Примеры R4 и R5 включают 2-пропенил, изобутенил, 3-фуранил (3-фурил), 3-тиэтил, фенил, нафтил, 4-гидроксифенил, 4-метоксифенил, 4-фторофенил, 4-трифторометилфенил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, т- бутил, этенил, 2-пропенил, 2-пропинил, бензил, фенэтил, фенилэтенил, 3,4-диметоксифенил, 2-фуранил (2-фурил), 2-тиэнил, 2-(2-фуранил) этенил, 2-метилпропил, циклопропил, циклобутил, циклопентил, циклогексил, циклогексилэтил и другие.
Новые продукты с общей формулой I проявляют значительное действие торможения по отношению к аномальной клеточной пролиферации и обладают терапевтическими свойствами, которые позволяют лечить пациентов с патологическими состояниями, связанными с аномальной клеточной пролиферацией. Патологические состояния включают аномальную клеточную пролиферацию злокачественных или незлокачественных клеток в различных тканях и/или органах, включающих без ограничения мышечные, костные и/или соединительные ткани; кожу, головной мозг, легкие и половые органы; лимфатическую и/или почечную системы; клетки молочных желез и/или клетки крови; печень, пищеварительную систему и поджелудочную железу; щитовидную железу и/или надпочечники. Эти патологические состояния могут также включать псориаз; твердые опухоли; рак молочной железы, яичников, предстательной железы, головного мозга, кишечника, желудка, почки и/или рак яичка, саркому Капоши; холангиокарциному; хориокарциному; нейробластому; нефробластому; лимфогранулематоз; меланомы; множественные миеломы; хронический лимфоцитарный лейкоз; и острые или хронические гранулоцитарные лимфомы. Новые продукты по изобретению особенно полезны в лечении лимфом другого происхождения, кроме болезни Ходжкина (лимфогранулематоза), множественной миеломы, меланомы и рака яичника, мочеполовой системы, пищевода, легких и молочной железы. Продукты по изобретению можно применять при профилактике, для торможения появления или рецидива или для лечения этих патологических состояний.
Соединения этого изобретения можно получить технологией традиционных способов органической химии. Схема 1 (см. в конце текста), которая представляет способ получения соединений в объеме формулы I, показана только с целью иллюстрации и не должна рассматриваться как ограничивающая получение соединений любыми другими способами.
“Кислота” соединений формулы II представляет собой любую кислоту, которая способна присоединить протоны к C’ 3 аминогруппе. В качестве примера можно привести кислотные соли, образованные с минеральными кислотами, такими как HCl, H2SO4 или HNO3; или органическими кислотами, такими как трифторуксусная кислота, уксусная кислота, п-толуолсульфокислота, метансульфокислота и другие. Стадия (а) включает высвобождение основанием CЗ’-аминогруппы с последующей реакцией освобожденной аминогруппы с соединением формулы III, в которой R13 и R14 – независимо C1-6алкил, арил, замещенный арил или фосфоно защитная группа. Основанием может быть любое основание для нейтрализации кислоты, протонирующей аминогруппу, и которое действует как акцептор протонов, образованных во время реакции амина с хлороформатом формулы III. Примеры предпочтительного основания включают неорганическое основание или органическое основание, такое как диизопропилэтиламин, триэтиламин, пиридин, диметиламинопиридин и прочие.
Если R13 и/или R14 – представляют собой фосфонозащитную группу, ее удаляют в cтадии (b), чтобы получить дополнительные соединения в объеме формулы I.
Синтез соединений формулы II хорошо описан в нашей заявке PCT WO 94/14787, опубликованной 7 июля 1994 г. Вкратце их получают стадиями, включающими(а) связывание оксазолина формулы V 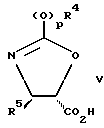 с C13-гидрокси таксана формулы VI 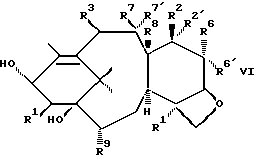 с получением соединения формулы VII 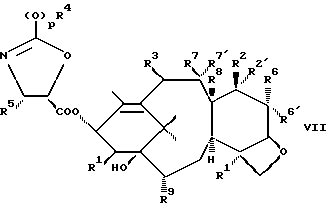 и (б) контактирование соединения формулы VII с кислотой, способной открыть оксазолиновое кольцо упомянутого соединения формулы VII с получением соединения формулы II или его соли. Оксазолины формулы V уже хорошо описаны в нашей заявке PCT WO 94/14787, опубликованной 7 июля 1994 г. В формулах II, III, V, VI и VII выше, p, Rf, R1, R2, R2′, R3, R4, R5, R6, R6′, R7, R7′, R8 и R9 имеют те же значения, что определены раньше. Сейчас уже есть много публикаций, раскрывающих превращение заместителей тексановой основы паклитаксела в другие группы. Используя эти известные способы или их очевидные варианты, можно легко получить таксаны формулы VI. Например, для преобразования C4-ацетокси в другие функциональные группы, см. S. H. Chen и др. J. Organic Chemistry 59, стр. 6156-6158 (1994) и заявку PCT WO 94/14787, опубликованную 7 июля 1994 г.; для превращения C2-бензоилокси в другие группы, см. S.H. Chen и др. Bioorganic and Medicinal Chemistry Letters т.4, N 3, стр.479-482 (1994) и европейскую патентную заявку 617034 A1, опубликованную 28 сентября 1994 г.; для модифицирования C10-ацетилокси, см. J. Kant и др. Tetrahedron Letters т.35, N 31, стр.5543-5546 (1994) и патент США 5294637, опубликованный 15 марта 1994 г.; для получения незамещенных производных (деокси) C10 и/или C7, см. европейскую патентную заявку 590267 A2, опубликованную 6 апреля 1994 г., и заявку PCT WO 93/06093, опубликованную 1 апреля 1993 г. ; для получения 7  ,8 ,8 -мeтaнo, 6 -мeтaнo, 6 ,7 ,7 -дигидрокси и 6,7-олефиновых групп, см. R. A. Johnson, Tetrahedron Letters, т.35, N 43, стр.7893 – 7896 (1994), патент США N 5254580, выданный 19 октября 1993 г., и европейскую патентную заявку 600517 A1, опубликованную 8 июня 1994 г.; для получения C7/C6 оксирана, см. X. Liang и G.I. Kingston Tetrahedron Letters, т. 36, N 17, стр. 2901-2904 (1995); для получения C7-эпи-фторо, см. G.Roth и др. Tetrahedron Letters, т.36, стр. 1609-1612 (1993); для получения C7 эстеров и карбонатов, см. патент США N 5272171, выданный 21 декабря 1993 г., и S. H. Chen и др. Tetrahedron, т. 49, N 14, стр. 2805-2828 (1993); для 9 -дигидрокси и 6,7-олефиновых групп, см. R. A. Johnson, Tetrahedron Letters, т.35, N 43, стр.7893 – 7896 (1994), патент США N 5254580, выданный 19 октября 1993 г., и европейскую патентную заявку 600517 A1, опубликованную 8 июня 1994 г.; для получения C7/C6 оксирана, см. X. Liang и G.I. Kingston Tetrahedron Letters, т. 36, N 17, стр. 2901-2904 (1995); для получения C7-эпи-фторо, см. G.Roth и др. Tetrahedron Letters, т.36, стр. 1609-1612 (1993); для получения C7 эстеров и карбонатов, см. патент США N 5272171, выданный 21 декабря 1993 г., и S. H. Chen и др. Tetrahedron, т. 49, N 14, стр. 2805-2828 (1993); для 9 – и 9 – и 9 -гидрокси таксанов, см. L.L. Klein, Tetrahedron Letters, т.34, N 13, стр. 2047-2050 (1993), заявку PCT WO 94/08984, опубликованную 28 апреля 1994 г. , патент США N 5352806, выданный 4 октября 1994 г., и заявку PCT WO 94/20485, опубликованную 15 сентября 1994 г.
Следующие конкретные примеры иллюстрируют синтез соединения по изобретению, и их не следует рассматривать как ограничивающие объем или сферу изобретения. Способ можно применить к вариациям, с тем, чтобы получить соединения, охваченные данным изобретением, но не раскрытые в нем конкретно. Кроме того, специалистам будут очевидны также вариации способов в получении того же соединения, но несколько отличным образом.
В следующих экспериментальных процедурах, если не указано иначе, все температуры даны в стоградусной шкале С. Спектральные характеристики ядерно-магнитного резонанса (ЯМР) относятся к химическим смещениям ( -гидрокси таксанов, см. L.L. Klein, Tetrahedron Letters, т.34, N 13, стр. 2047-2050 (1993), заявку PCT WO 94/08984, опубликованную 28 апреля 1994 г. , патент США N 5352806, выданный 4 октября 1994 г., и заявку PCT WO 94/20485, опубликованную 15 сентября 1994 г.
Следующие конкретные примеры иллюстрируют синтез соединения по изобретению, и их не следует рассматривать как ограничивающие объем или сферу изобретения. Способ можно применить к вариациям, с тем, чтобы получить соединения, охваченные данным изобретением, но не раскрытые в нем конкретно. Кроме того, специалистам будут очевидны также вариации способов в получении того же соединения, но несколько отличным образом.
В следующих экспериментальных процедурах, если не указано иначе, все температуры даны в стоградусной шкале С. Спектральные характеристики ядерно-магнитного резонанса (ЯМР) относятся к химическим смещениям ( ), выраженным в ppm по отношению к тетраметилсилану (ТМС) как эталону. Относительная площадь для различных смещений в спектральных данных протонного ЯМР соответствует числу атомов водорода определенного функционального типа в молекуле. Характер смещений относительно кратности указывается как широкий синглет (шир. с), широкий дублет (шир.д), широкий триплет (шир.т), широкий квартет (шир.кв), синглет (с), мультиплет (м), дублет (д), триплет (т), дублет дублетов (дд), дублет триплетов (дт) и дублет квартетов (д.кв). Для ЯМР спектроскопии используют такие растворители, как ацетон-Д6 (дейтерированный ацетон), ДМСО-Д6 (пердейтеродиметилсульфоксид), D2O (дейтерированная вода), CDCl3 (дейтерохлороформ) и другие традиционные дейтерированные растворители. Инфракрасное (ИК) спектральное описание включает только номера волн абсорбции (см-1), имеющие идентификационную величину функциональной группы.
Целит – зарегистрированный товарный знак Johns-Manville Products Corporat. на диатомовую землю.
Сокращения, используемые здесь, являются обычными сокращениями, широко используемыми в области техники. Некоторые из них: DAB (диацетилбаккатин III); MS (масс-спектрометрия); HRMS (масс-спектрометрия высокого разрешения); Ас (ацетил); Ph (фенил); об./об. (объем/объем); FAB (быстрая бомбардировка атомами); NOBA (м-нитробензиловый спирт); мин. (минуты); час (час(ы)); ВОС (т-бутоксикарбонил); CBZ (бензилоксикарбонил); Bn (бензил); Bz (бензоил); Troc (2,2,2-трихлороэтилоксикарбонил); DMS (диметилсилил); TBAF (фторид тетрабутиламмония); DMAP (4- диметиламинопиридин); Tes (триэтилсилил); DMSO (диметилсульфоксид, ДМСО); THF (тетрагидрофуран, ТГФ); HMDS (гексаметилдисилазан); MeOTF (метилтрифлат, метилтрифторацетат).
1. Получение О-хлорометил-S-бутилкарбонотиоата. ), выраженным в ppm по отношению к тетраметилсилану (ТМС) как эталону. Относительная площадь для различных смещений в спектральных данных протонного ЯМР соответствует числу атомов водорода определенного функционального типа в молекуле. Характер смещений относительно кратности указывается как широкий синглет (шир. с), широкий дублет (шир.д), широкий триплет (шир.т), широкий квартет (шир.кв), синглет (с), мультиплет (м), дублет (д), триплет (т), дублет дублетов (дд), дублет триплетов (дт) и дублет квартетов (д.кв). Для ЯМР спектроскопии используют такие растворители, как ацетон-Д6 (дейтерированный ацетон), ДМСО-Д6 (пердейтеродиметилсульфоксид), D2O (дейтерированная вода), CDCl3 (дейтерохлороформ) и другие традиционные дейтерированные растворители. Инфракрасное (ИК) спектральное описание включает только номера волн абсорбции (см-1), имеющие идентификационную величину функциональной группы.
Целит – зарегистрированный товарный знак Johns-Manville Products Corporat. на диатомовую землю.
Сокращения, используемые здесь, являются обычными сокращениями, широко используемыми в области техники. Некоторые из них: DAB (диацетилбаккатин III); MS (масс-спектрометрия); HRMS (масс-спектрометрия высокого разрешения); Ас (ацетил); Ph (фенил); об./об. (объем/объем); FAB (быстрая бомбардировка атомами); NOBA (м-нитробензиловый спирт); мин. (минуты); час (час(ы)); ВОС (т-бутоксикарбонил); CBZ (бензилоксикарбонил); Bn (бензил); Bz (бензоил); Troc (2,2,2-трихлороэтилоксикарбонил); DMS (диметилсилил); TBAF (фторид тетрабутиламмония); DMAP (4- диметиламинопиридин); Tes (триэтилсилил); DMSO (диметилсульфоксид, ДМСО); THF (тетрагидрофуран, ТГФ); HMDS (гексаметилдисилазан); MeOTF (метилтрифлат, метилтрифторацетат).
1. Получение О-хлорометил-S-бутилкарбонотиоата.
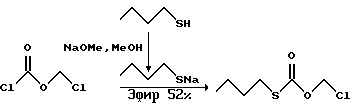 О-хлорометил-S-бутилкарбонотиат получали по способу, описанному Folkman и Lund в Synthesis, 1990, 1159. Бутантиол (16.0 мл, 200 мМ) по каплям добавляли к раствору метоксида натрия в метаноле (43 мл, 200 мМ, 25 вес.%, Aldrich), охлажденному до 0oC и полученную смесь перемешивали 2 часа. Затем реакционную смесь концентрировали в вакууме и полученное твердое вещество суспендировали в безводном этиловом эфире (300 мл). Затем этот гетерогенный раствор охлаждали до -78oC и в течение 40 минут каплями добавляли раствор хлороформата хлорометила (17.6 мл, 200 мМ) в эфире (70 мл). Полученный раствор перемешивали при -78oC еще два часа и затем реакционную смесь согревали до комнатной температуры и перемешивали 13 часов. Далее реакционную смесь фильтровали под разрежением, используя прокладку из целита, собранные соли промывали эфиром и фильтрат концентрировали в вакууме. Полученное остаточное масло очищали дробной перегонкой (т.кип. 103-107oC, вакуум в системе приблизительно 2500-3000 Па, т.кип. 99-101oC, 2400 Па); средняя фракция дала нужный О-хлорометил-S-бутилкарбонотиоат (18 г, 52%). 1H ЯМР (300 МГц, CDCl3)  5.72 (2H, с), 2.90 (2H, дд, Дж = 8.7 Гц), 1.63-1.51 (2H, м), 1.45-1.31 (2H, м), 0.91-0.82 (3H, м).
2. Получение О-йодометил-S-бутилкарбонотиоата 5.72 (2H, с), 2.90 (2H, дд, Дж = 8.7 Гц), 1.63-1.51 (2H, м), 1.45-1.31 (2H, м), 0.91-0.82 (3H, м).
2. Получение О-йодометил-S-бутилкарбонотиоата Раствор О-хлорометил-S-бутилкарбонотиоата (10.0 г, 0.054 М) в ацетоне (10 мл) добавляли к раствору йодида натрия (16.4 г, 0.108 М, 2 эквив.). и бикарбоната натрия (0.461 г, 0.0054 М, 0.1 эквив.) в ацетоне (200 мл) при комнатной температуре. Далее реакционную смесь согревали до 45oC и перемешивали 2 часа. В этот момент аликвоту реакционной смеси концентрировали в вакууме и остаточное масло исследовали 1H ЯМР, который показал потребление исходного материала и образование одного продукта. Остающуюся реакционную смесь фильтровали с использованием прокладки из целита и фильтрат концентрировали в вакууме. Далее полученное масло разделяли между водой и пентаном и органический слой промывали водными растворами 5% бикарбоната натрия, 1% тиосульфата натрия и рассолом. Водные слои экстрагировали пентаном и соединенные органические слои высушивали над сульфатом натрия и концентрировали в вакууме. Полученное остаточное масло очищали анализом 1H ЯМР и нужный О-йодометил-S-бутилкарбонотиоат использовали без дальнейшей очистки. 1H ЯМР (300 МГц, CDCl3)  5.93 (2H, с), сдвиг по полю вниз от соответствующего хлоро соединения, 2.83 (2H, дд, Дж = 8.7, 8.7 Гц), 1.62-1.51 (2H, м), 1.48-1.36 (2H, м), 0.92- 0.84 (3H, м).
3. Получение соли дибензилфосфата тетрабутиламмония 5.93 (2H, с), сдвиг по полю вниз от соответствующего хлоро соединения, 2.83 (2H, дд, Дж = 8.7, 8.7 Гц), 1.62-1.51 (2H, м), 1.48-1.36 (2H, м), 0.92- 0.84 (3H, м).
3. Получение соли дибензилфосфата тетрабутиламмония(BnO)2P(O)ОН + HON(Bu)4 —> (BnO)2P(O)ON(Bu)4, Дибензилфосфат добавляли (15.0 г, 0.054 М) к раствору гидроксида тетрабутиламмония (40 вес.% в воде, Aldrich, 35.0 г, 0.054 М) в воде при комнатной температуре и полученный гомогенный раствор охлаждали в бане с ацетоном и сухим льдом до полного отвердевания. 4. Получение О-дибензилфосфонооксиметил-S-бутилкарбонотиоата 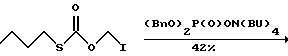 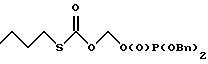 Раствор О-йодометил-S-бутилкарбонотиоата (неочищенный, 0.054 М) в ТГФ (20 мл) добавляли к раствору дибензилфосфата тетрабутиламмония (28.5 г, 0.054 М) в ТГФ (150 мл) при комнатной температуре и полученную смесь перемешивали 24 часа. Затем реакционную смесь фильтровали с использованием прокладки из целита и фильтрат концентрировали в вакууме. Остаточное масло очищали флеш хроматографией (элюирование гексанами/этилацетатом), после чего средняя фракция дала нужный O- дибензилфосфонооксиметил-S-бутилкарбонотиоат (10.0 г, 42.5%) в виде светло-желтого масла. 1H ЯМР (300 МГц, CDCl3)  7.34 (10H, шир.с), 5.62 (2H, д, Дж = 14.0 Гц), 5.05 (4H, д, Дж = 7.8 Гц), 2.82 (2H, дд, Дж = 7.3 Гц), 1.62-1.51 (2H, м), 1.41-1.30 (2H, м), 0.89 (3H, дд, Дж = 9.4 Гц).
5. Получение О-дибензилфосфонооксиметила хлороформата 7.34 (10H, шир.с), 5.62 (2H, д, Дж = 14.0 Гц), 5.05 (4H, д, Дж = 7.8 Гц), 2.82 (2H, дд, Дж = 7.3 Гц), 1.62-1.51 (2H, м), 1.41-1.30 (2H, м), 0.89 (3H, дд, Дж = 9.4 Гц).
5. Получение О-дибензилфосфонооксиметила хлороформата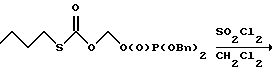 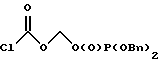 Перегнанный хлорид сульфурила (1.29 мл, 0.0160 М, 1.2 экв.) добавляли одной порцией к раствору О-дибензилфосфонооксиметил-S-бутилкарбонотиоата (5.7 г, 0.0134 М, 1.0 эквив.) в дихлорметане, охлажденном до -40oC. Реакционную смесь перемешивали при этой температуре 20 минут, после чего охлаждающую баню убирали и реакционную смесь согревали до комнатной температуры и перемешивали 3 часа. Затем ее концентрировали в вакууме и остаточное масло подвергали высокому вакууму, чтобы удалить побочные продукты реакции и остающийся хлорид сульфурила. 1H ЯМР анализ неочищенного хлорформата показал приблизительно 60% превращение исходного материала О-дибензилфосфонооксиметил-S-бутилкарбонотиоата в соответствующий хлорформат, который использовали без дальнейшей очистки в следующем преобразовании. 1H ЯМР, Выбранные резонансы хлорформата (300 МГц, CDCl3)  5.59 (2H, д, Дж = 14.0 Гц, сдвиг вверх по полю относительно соответствующего тиокарбоната), 5.10 (4H, д, Дж = 7.8 Гц, сдвиг вниз по полю относительно соответствующего тиокарбоната).
6. Получение N-дебензоил-N-([(дибензилфосфоноокси)метил] – окси] карбонил-2-О-бензоилпаклитаксела (1a) 5.59 (2H, д, Дж = 14.0 Гц, сдвиг вверх по полю относительно соответствующего тиокарбоната), 5.10 (4H, д, Дж = 7.8 Гц, сдвиг вниз по полю относительно соответствующего тиокарбоната).
6. Получение N-дебензоил-N-([(дибензилфосфоноокси)метил] – окси] карбонил-2-О-бензоилпаклитаксела (1a)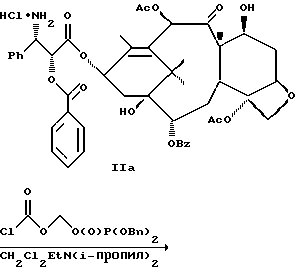 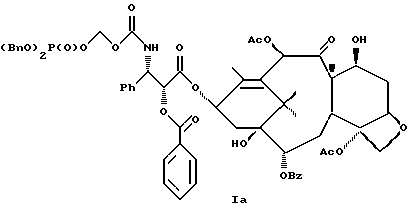 К раствору хлорформата (приблизительно 0.0080 М, 1.7 экв. при 60% превращении) в дихлорметане, охлажденному до 0oC, добавляли диизопропилэтиламин (4.7 мл, 0.0208 М, 5 эквив.) с последующим добавлением N-дебензоил-2-О-бензоилпаклитаксела гидрохлорида (11a) (4.0 г, 0.00449 мМ). Затем добавляли еще диизопропилэтиламин (4.7 мл, 0.0208 М), охлаждающую баню удаляли, и реакционную смесь согревали до комнатной температуры и перемешивали еще 1.5 часа. Затем ее разбавляли этилацетатом и гасили добавлением насыщенного водного бикарбоната натрия. Далее органический слой удаляли и промывали насыщенным водным раствором хлорида аммония, а потом рассолом. Водные слои вновь экстрагировали этилацетатом и соединенные органические слои высушивали над сульфатом натрия и концентрировали в вакууме с получением светло-желтого маслянистого твердого вещества. Очистка сырого твердого вещества флеш хроматографией (с элюированием гексаном/этилацетатом) дала 2.9 г (55%) нужного дибензилфосфата в виде твердого вещества белого цвета. 1H ЯМР (300 МГц, CDCl3)  8.19-8.11 (2H, м), 7.98-7.89 (2H, м), 7.61-7.18 (21H, м), 7.10-7.07 (1H, м), 6.43 (1H, дд, Дж = 8.6, 8.6 Гц), 6.12 (1H, д, Дж = 9.9 Гц), 5.78-5.61 (4H, м), 5.18 (1H, дд, Дж = 5.2 Гц, 14.2 Гц), 5.01-4.92 (2H, м), 4.75-4.55 (2H, м), 4.51-4.42 (1H, м), 4.31-4.27 (2H, м), 3.86 (1H, д, Дж = 7.2 Гц), 3.62 (1H, шир.с), 2.67-1.65 (16H, м, включая синглеты на 2.51,2.23, 2.01 и 1.22, 3H каждый), 1.21 (3H, с), 1.15 (3H, с); 8.19-8.11 (2H, м), 7.98-7.89 (2H, м), 7.61-7.18 (21H, м), 7.10-7.07 (1H, м), 6.43 (1H, дд, Дж = 8.6, 8.6 Гц), 6.12 (1H, д, Дж = 9.9 Гц), 5.78-5.61 (4H, м), 5.18 (1H, дд, Дж = 5.2 Гц, 14.2 Гц), 5.01-4.92 (2H, м), 4.75-4.55 (2H, м), 4.51-4.42 (1H, м), 4.31-4.27 (2H, м), 3.86 (1H, д, Дж = 7.2 Гц), 3.62 (1H, шир.с), 2.67-1.65 (16H, м, включая синглеты на 2.51,2.23, 2.01 и 1.22, 3H каждый), 1.21 (3H, с), 1.15 (3H, с);Масс спектроскопия (M+Na+) 1210. 7. Получение N-дебензоил-N-[(фосфонооксиметил)окси] карбонил-2-О- бензоилпаклитаксела (Ib) 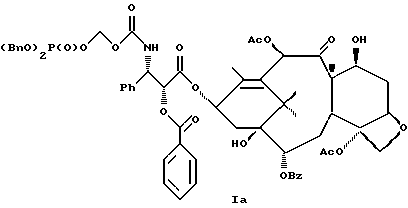  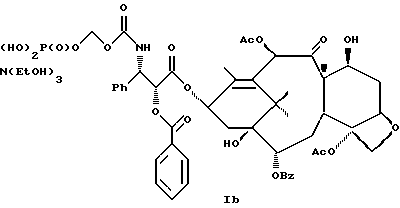 Этилацетат (200 мл) добавляли к 10% палладированному углю (3.0 г) в аппарате для гидрирования. Затем добавляли раствор N- дебензоил-N-[[(дибензилфосфоноокси) метил] окси]карбонил-2-О- бензоилпаклитаксела (Ia) (2.9 г, 0.0024 М) в этилацетате (50 мл) и реактор крепили к аппарату гидрирования. Далее реакционную смесь откачивали приблизительно на 1 минуту, используя вакуум в системе и подвергали ее давлению водородом в 50 ф/дюйм2 (-3.51 кг/см2) и встряхиванию в течение 12 часов. Потом реакционную смесь фильтровали через воронку из матированного стекла (с мелкими порами), во время этого процесса добавляли метанол (приблизительно 50 мл) чтобы полностью растворить свободную от фосфата кислоту и облегчить процесс фильтрации. Аликвоту фильтрата, содержащего пролекарство, концентрировали в вакууме и анализировали на ЖХВР (чистота продукта составляла 85%). К остающемуся фильтрату добавляли раствор триэтаноламина в этилацетате (0.1 М, 23 мл, 0.0023 М, 0.95 эквив. ) и полученный раствор концентрировали в вакууме. Сырую соль пролекарства очищали хроматографией на C18, со средним давлением. В этом процессе сырая соль амина фосфата поглощалась 5% ацетонитрилом в воде (примерно 50-80 мл) и в виде суспензии подавалась на колонну C18 (уравновешенную 5% ацетонитрилом в воде). В элюировании использовали следующий градиент (5% ацетонитрил: 95% воды, 10%: 90%, 15%:85%, 20%:80%, 25%: 75%, 30%: 70%), и фракции, содержащие соединение Ib (> 95% чистоты по ЖХВР) соединялись и концентрировались в вакууме с удалением ацетонитрила. Остающийся водный раствор соединения lb замораживали и воду удаляли лиофилизацией с получением 1.34 г (51%) соединения Ib в виде легкого твердого вещества белого цвета. 1H ЯМР (300 МГц, CD3OD:CDCl3 приблизительно 2:1 об./об.)  8.11-8.02 (4H, м), 7.66-7.35 (11H, м), 7.24 (1H, м, дд, Дж = 7.2, 7.2 Гц), 6.24 (1H, дд, Дж = 8.7, 8.7 Гц), 5.65-5.43 (3H, м), 4.97 (1H, д, Дж = 8.4 Гц), 4.37 (1H, дд, Дж = 6.5, 10.7 Гц), 4.25-4.19 (2H, м), 3.85-3.79 (7H, м), 3.33-3.29 (6H, м), 2.54-1.66 (16H, м, включая синглеты на 2.49, 2.16, 1.97 и 1.66, 3H каждый), 1.18 (3H, с), 1.13 (3H, с); 8.11-8.02 (4H, м), 7.66-7.35 (11H, м), 7.24 (1H, м, дд, Дж = 7.2, 7.2 Гц), 6.24 (1H, дд, Дж = 8.7, 8.7 Гц), 5.65-5.43 (3H, м), 4.97 (1H, д, Дж = 8.4 Гц), 4.37 (1H, дд, Дж = 6.5, 10.7 Гц), 4.25-4.19 (2H, м), 3.85-3.79 (7H, м), 3.33-3.29 (6H, м), 2.54-1.66 (16H, м, включая синглеты на 2.49, 2.16, 1.97 и 1.66, 3H каждый), 1.18 (3H, с), 1.13 (3H, с);Масс спектроскопия (М-1) 1006 (устойчивая). Следуя процедурам, описанным здесь, можно синтезировать следующие соединения в объеме этого изобретения. 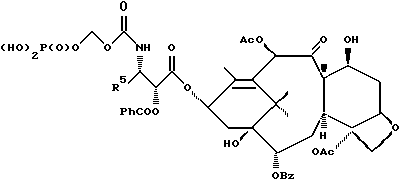 R5  3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил 3-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил 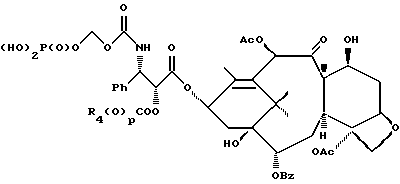 R4(O)p  3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил 3-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил 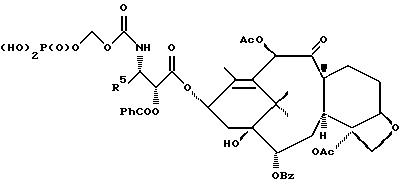 R5  3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил 3-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил 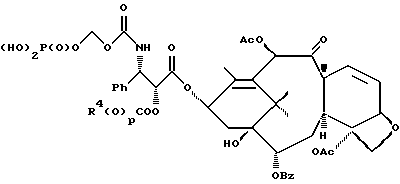 R4(O)p  3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил 3-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил 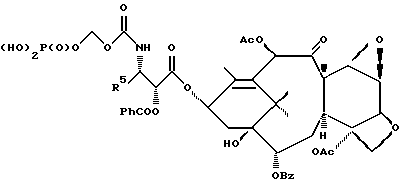 R5 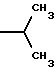 3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил 3-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил 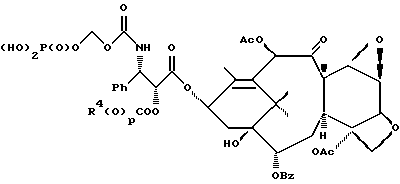 R4(O)p 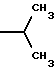 3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил З-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил 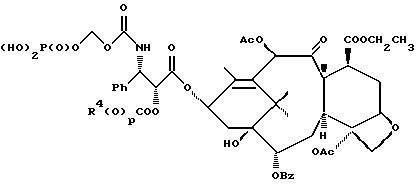 R4(O)p  3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил 3-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил 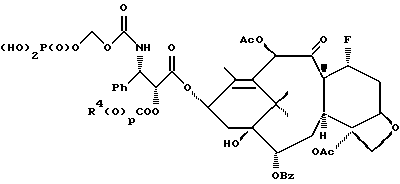 R4(O)p  3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил 3-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил 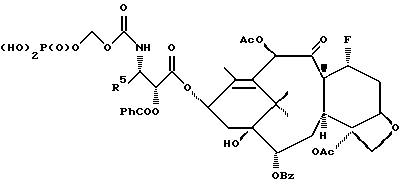 R5  3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил 3-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил 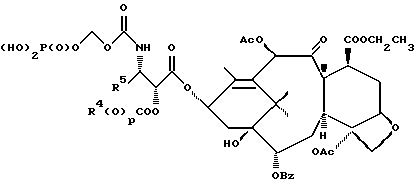 R5  3-фурил 2-фурил п-фторофенил п-хлорофенил п-метилфенил п-метоксифенил п-бромофенил п-гидроксифенил п-аминофенил п-нитрофенил 2-тиэнил 3-тиэнил циклогексил циклопентил циклобутил циклопропил изобутенил изопропил изобутил Соединение формулы I настоящего изобретения представляет собой эффективное средство торможения опухоли и полезно для лечения людей и животных. Например, соединения полезны в лечении опухолей в эксперименте ин виво, описанном в ЕР патентной заявке 604910 A1, опубликованной 6 июля 1994 г. В одном исследовании гибридным мышам Balb/c DBA2F1 (CDF1) подкожно имплантировали 0.1 мл 2% (вес/об.) культуры легочной карциномы M109 (как описано в W. Rose “Evaluation of Madison 109 Lung Carcinoma as a Model for Screening Antitumer Drugs” Cancer Treatment Reports, 65, N 3-4, стр.299-312 (1981)). Тестуемые соединения и эталонное лекарство, паклитаксел назначали группе мышей внутривенно; каждая группа получала соединение с разной дозировкой, и три или четыре разные дозировки оценивали на соединение. Кроме того, тестуемые соединения таким же образом оценивались в оральном назначении. Мышей наблюдали ежедневно на выживание до момента наступления смерти или приблизительно до 90 дня после пересадки опухоли, в зависимости от того, что имело место первым. Одна группа мышей на эксперимент оставалась нелеченной и служила контрольной группой. Опухоли также замерялись раз или два в неделю и их размер в мм использовался для определения веса опухоли в соответствии с опубликованной процедурой (ibid). Среднее время выживания мышей, леченных соединением (Л) сравнивали со средним временем выживания контрольных мышей (К). Соотношение двух величин для каждой группы мышей, леченных соединением, умножали на 100 и выражали как процентное отношение (т.е.% Л/К). Кроме того, определяли также разницу между средним временем для леченных групп и средним временем для контрольной группы, в течение которого опухоль вырастала до 1 г, выраженную как Л-К величины в днях. Чем больше величина Л-К, тем больше задержка в первичном росте опухоли. Соединения, показывающие% Л/К  125% и/или Л-К 125% и/или Л-К  4.0 дней, считаются активными в этой M109 SC модели.
В соответствии с вышеописанным протоколом оценивали соединение Ib (как соль триэтаноламина). В одном испытании при введении внутривенно в дозировках от 20 до 45 мг/кг/инъек. раз в день в течение 5 дней, начиная с 4-го дня после имплантации опухоли, Л/К величины составляли от 132 до 145% и Л-К величины составляли от 8.8 до 14.0. Когда соединение вводили орально, в дозировках от 200 до 400 мг/кг/дозу раз в день в течение 5 дней, начиная с 4-го дня после имплантации опухоли, его Л/К величины составляли от 132 до 179% и Л-К величины – от 10.5 до 24.3 дня.
Таким образом, еще один аспект данного изобретения касается способа торможения роста опухолей у людей и/или других млекопитающих, который включает введение носителю опухоли эффективного противоопухолевого количества соединения формулы I.
Для лечения ряда опухолей соединение формулы Ш настоящего изобретения можно применять как и паклитаксел, см. Physician’s Desk Reference, 49 изд. Medical Economics, стр. 682, 1995 г. Дозировки, режим и схема назначения соединений этого изобретения конкретно не ограничены; опытный онколог без лишних экспериментов может определить соответствующую схему лечения для введения данного соединения. Таким образом, соединение формулы I можно вводить любым подходящим способом назначения, парентерально или орально. Парентеральное назначение включает внутривенное, внутрибрюшинное, внутримышечное и подкожное введение.
Дозы, применяемые для реализации методов в соответствии с изобретением, являются такими, которые позволяют проводить профилактическое лечение или вызвать максимальную терапевтическую ответную реакцию. Дозы различны в зависимости от типа назначения, конкретного выбранного продукта и личных характеристик пациента. В общем, дозы должны быть такими, которые эффективны в лечении нарушений, вызванных аномальной клеточной пролиферацией. Продукты по изобретению можно назначать с частотой, необходимой для достижения нужного терапевтического эффекта. Некоторые пациенты могут проявлять быструю ответную реакцию на относительно высокие или низкие дозы, и затем лечение следует продолжать на низких дозировках или постепенно сократить. Для внутривенного введения дозировка может быть, например, в пределах от около 20 до около 500 мг/м2 в течение 1-100 часов. Для орального введения дозировка может быть в пределах от 5 до 1000 мг/кг/день веса тела пациента. Конкретная применяемая доза будет корректироваться в зависимости от конкретной композиции, способа введения и конкретной локализации, носителя и типа опухоли. В определении дозировки следует принимать во внимание многие факторы, которые меняют действие лекарства. Это возраст, вес, пол, режим питания и физическое состояние пациента.
Настоящее изобретение также предусматривает фармацевтические препараты (композиции), содержащие противоопухолевое эффективное количество соединения формулы I в комбинации с одним или несколькими фармацевтически приемлемыми носителями, наполнителями, разбавителями или адъювантами. Композиции можно приготовить в соответствии с традиционными методами. Примеры технологии приготовления паклитаксела или его производных можно найти, например, в патентах США N 4960790 и 4814470, которые можно использовать для приготовления лекарственных средств с соединением этого изобретения. Например, соединение формулы I можно приготовить в форме таблеток, пилюлей, порошковых смесей, капсул, инъекционных растворов, растворов, суппозиториев, эмульсий, дисперсий, смесей для введения с пищей и в других подходящих формах. Его можно также сделать в форме стерильных твердых композиций, например, высушенных при температуре ниже 0o, и, при желании, скомбинированных с другими фармацевтически приемлемыми наполнителями. Такие твердые композиции можно восстановить стерильной водой, физиологическим раствором или смесью воды и органического растворителя, такого как пропиленгликоль, этанол и другие, либо другой стерильной инъекционной средой непосредственно перед применением для парентерального введения.
Типичные фармацевтически приемлемые носители представляют собой маннит, мочевину, декстраны, лактозу, картофельный и кукурузный крахмалы, стеарат магния, тальк, растительные масла, полиалкиленовые гликоли, этилцеллюлозу, поли(винилпирролидон), карбонат кальция, этилолеат, изопропилмиристат, бензилбензоат, карбонат натрия, желатин, карбонат калия, кремневую кислоту. Фармацевтический препарат может еще содержать нетоксичные дополнительные вещества, такие как эмульгирующие, консервирующие, смачивающие агенты и прочие, например сорбитана монолаурат, триэтаноламина олеат, полиоксиэтилена моностеарат, глицерила трипальмитат, диоктил натрия сульфосукцинат и другие. 4.0 дней, считаются активными в этой M109 SC модели.
В соответствии с вышеописанным протоколом оценивали соединение Ib (как соль триэтаноламина). В одном испытании при введении внутривенно в дозировках от 20 до 45 мг/кг/инъек. раз в день в течение 5 дней, начиная с 4-го дня после имплантации опухоли, Л/К величины составляли от 132 до 145% и Л-К величины составляли от 8.8 до 14.0. Когда соединение вводили орально, в дозировках от 200 до 400 мг/кг/дозу раз в день в течение 5 дней, начиная с 4-го дня после имплантации опухоли, его Л/К величины составляли от 132 до 179% и Л-К величины – от 10.5 до 24.3 дня.
Таким образом, еще один аспект данного изобретения касается способа торможения роста опухолей у людей и/или других млекопитающих, который включает введение носителю опухоли эффективного противоопухолевого количества соединения формулы I.
Для лечения ряда опухолей соединение формулы Ш настоящего изобретения можно применять как и паклитаксел, см. Physician’s Desk Reference, 49 изд. Medical Economics, стр. 682, 1995 г. Дозировки, режим и схема назначения соединений этого изобретения конкретно не ограничены; опытный онколог без лишних экспериментов может определить соответствующую схему лечения для введения данного соединения. Таким образом, соединение формулы I можно вводить любым подходящим способом назначения, парентерально или орально. Парентеральное назначение включает внутривенное, внутрибрюшинное, внутримышечное и подкожное введение.
Дозы, применяемые для реализации методов в соответствии с изобретением, являются такими, которые позволяют проводить профилактическое лечение или вызвать максимальную терапевтическую ответную реакцию. Дозы различны в зависимости от типа назначения, конкретного выбранного продукта и личных характеристик пациента. В общем, дозы должны быть такими, которые эффективны в лечении нарушений, вызванных аномальной клеточной пролиферацией. Продукты по изобретению можно назначать с частотой, необходимой для достижения нужного терапевтического эффекта. Некоторые пациенты могут проявлять быструю ответную реакцию на относительно высокие или низкие дозы, и затем лечение следует продолжать на низких дозировках или постепенно сократить. Для внутривенного введения дозировка может быть, например, в пределах от около 20 до около 500 мг/м2 в течение 1-100 часов. Для орального введения дозировка может быть в пределах от 5 до 1000 мг/кг/день веса тела пациента. Конкретная применяемая доза будет корректироваться в зависимости от конкретной композиции, способа введения и конкретной локализации, носителя и типа опухоли. В определении дозировки следует принимать во внимание многие факторы, которые меняют действие лекарства. Это возраст, вес, пол, режим питания и физическое состояние пациента.
Настоящее изобретение также предусматривает фармацевтические препараты (композиции), содержащие противоопухолевое эффективное количество соединения формулы I в комбинации с одним или несколькими фармацевтически приемлемыми носителями, наполнителями, разбавителями или адъювантами. Композиции можно приготовить в соответствии с традиционными методами. Примеры технологии приготовления паклитаксела или его производных можно найти, например, в патентах США N 4960790 и 4814470, которые можно использовать для приготовления лекарственных средств с соединением этого изобретения. Например, соединение формулы I можно приготовить в форме таблеток, пилюлей, порошковых смесей, капсул, инъекционных растворов, растворов, суппозиториев, эмульсий, дисперсий, смесей для введения с пищей и в других подходящих формах. Его можно также сделать в форме стерильных твердых композиций, например, высушенных при температуре ниже 0o, и, при желании, скомбинированных с другими фармацевтически приемлемыми наполнителями. Такие твердые композиции можно восстановить стерильной водой, физиологическим раствором или смесью воды и органического растворителя, такого как пропиленгликоль, этанол и другие, либо другой стерильной инъекционной средой непосредственно перед применением для парентерального введения.
Типичные фармацевтически приемлемые носители представляют собой маннит, мочевину, декстраны, лактозу, картофельный и кукурузный крахмалы, стеарат магния, тальк, растительные масла, полиалкиленовые гликоли, этилцеллюлозу, поли(винилпирролидон), карбонат кальция, этилолеат, изопропилмиристат, бензилбензоат, карбонат натрия, желатин, карбонат калия, кремневую кислоту. Фармацевтический препарат может еще содержать нетоксичные дополнительные вещества, такие как эмульгирующие, консервирующие, смачивающие агенты и прочие, например сорбитана монолаурат, триэтаноламина олеат, полиоксиэтилена моностеарат, глицерила трипальмитат, диоктил натрия сульфосукцинат и другие.
Формула изобретения
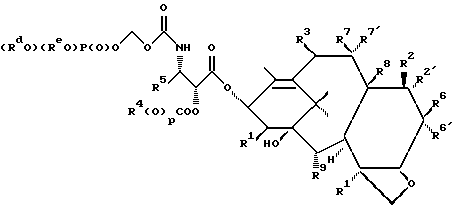 в которой R1 – OC(O)Rx; R2 – гидрокси, R2′ – водород; R6′ – водород; R6 – водород; R3 – -OC(O)Rx; R8 – метил; R9 – -OC(O)Rx; R7 и R7′ вместе образуют оксогруппу; R4 и R5 – фенил; p = 0; Rd и Re – независимо водород или фенил, замещенный C1-6 алкилом, Rf – водород; Rx – C1-6алкил или Rx – радикал формулы 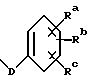 в которой D – связь или C1-C6 алкил; Ra, Rb и Rc – независимо водород. 2. Соединение по п.1, где R1 представляет собой -OC(O)Rx; R2 – гидрокси; R2′ – водород; R3 – -OC(O)Rx, R8 – метил; R6 и R6′ – водород; R9 – -OC(O)Rx, R7 и R7′ вместе образуют оксогруппу; R4 и R5 – фенил, p = 0; Rd и Re – водород; Rf – водород; Rx – C1-6алкил или Rx – радикал формулы 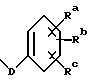 в которой D – связь; Ra, Rb и Rc – независимо водород. 3. Соединение по п. 2, которое представляет собой N-дебензоил-N-[(фосфонооксиметил)окси]карбонил-2-0-бензоилпаклитаксел. 4. Триэтаноламиновая соль соединения по п.3. 5. Фармацевтическая композиция, обладающая противоопухолевой активностью, включающая эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. 6. Способ торможения роста опухоли у носителя-млекопитающего, включающий введение млекопитающему соединения по п.1 в эффективном количестве, тормозящем рост опухоли. 7. Способ по п.6, отличающийся тем, что соединение по п.1 вводят млекопитающему оральным методом. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 06.06.2007
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
