Патент на изобретение №2162079
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ 4-МЕРКАПТО-БЕНЗОИЛГУАНИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат: Изобретение относится к 4-меркапто-бензоилгуанидинам формулы (I), где R1 обозначает А; R2 обозначает А, незамещенный или замещенный F, Cl, Br фенил, пиридил; А – алкил с 1-6 С-атомами, и их физиологически приемлемым солям, способу их получения и фармацевтической композиции на их основе. Предлагаемые соединения и фармацевтическая композиция ингибируют Na+/Н+-антипорт и тем самым предотвращают сердечные заболевания и проявляют кардиозащитное действие. Они могут найти применение для лечения и профилактики аритмии, стенокардии, инфаркта и патологических гипоксических и ишемических повреждений. 3 с. и 1 з.п.ф-лы, 1 табл. 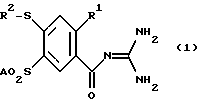
Изобретение относится к орто-замещенным производным 4-меркапто-бензоилгуанидина формулы (I) 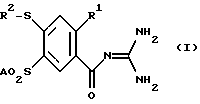 где R1 обозначает A, CF3, CH2F, CHF2 или C2F5; R2 обозначает H, A, циклоалкил с 3-7 C-атомами, Ph или Гет; Гет обозначает одно- или двухядерный, насыщенный, ненасыщенный или ароматический гетероцикл с 1-4 атомами азота, кислорода и/или серы, связанный через N или C, который незамещен или может быть однократно, двукратно или трехкратно замещен с помощью Гал, CF3, A, OH, OA, SH, SA, NH2, NHA, NA2, CN, NO2 и/или карбонильного кислорода; A обозначает алкил с 1-6 C-атомами; Гал обозначает F, Cl, Br или J; и Ph обозначает незамещенный или однократно-, двукратно- или трехкратнозамещенный с помощью A, OA, NH2, NHA, NA2, F, Cl, Br и/или CF3 фенил; а также к их физиологически приемлемым солям. В основу изобретения положена задача нахождения новых соединений с ценными свойствами, в особенности таких, которые можно применять для приготовления лекарственных средств. Найдено, что соединения формулы (I) и их физиологически приемлемые соли при хорошей совместимости обладают ценными фармакологическими свойствами. В случае новых соединений речь идет об ингибиторах целлюлярного Na+/H+-антипортера, т. е. о биологически активных веществах, которые подавляют механизм Na+/H+-обмена в клетках (Dusing и др., Med. Klin. 87, 378-384 (1992)) и которые таким образом представляют собой хорошие антиаритмические средства, пригодные в особенности для лечения аритмий, которые наступают как следствие недостатка кислорода. Самым известным биологически активным веществом группы ацилгуанидинов является амилорид. Это вещество, однако, обладает в первую очередь снижающим кровяное давление и салуретическим действием, что нежелательно в особенности при лечении нарушений сердечного ритма, в то время как антиаритмические свойства выражены только очень слабо. Кроме того, структурно подобные соединения известны, например, из европейского патента N 0416499. Предметом изобретения являются соединения формулы (I), а также их физиологически приемлемые соли. Предлагаемые согласно изобретению вещества настоящей заявки обладают кардиозащитным действием и поэтому пригодны особенно для лечения инфаркта, профилактики инфаркта и для лечения стенокардии. Далее вещества противодействуют всем патологическим гипоксическим и ишемическим повреждениям, так что можно лечить вызываемые вследствие этого первично или вторично заболевания. Биологически активные вещества также хорошо пригодны для профилактики. На основании защитных действий этих веществ при патологических, гипоксических или ишемических ситуациях отсюда следуют дальнейшие возможности применения при хирургических вмешательствах для защиты временно недостаточно обеспечиваемых (кровью) органов, при трансплантациях органов для защиты извлекаемых органов, при ангиопластических вмешательствах в сосуды и сердце, при, ишемиях нервной системы, при терапии шоковых состояний и для профилактического предотвращения эссенциальной гипертонии. Далее соединения можно также использовать в качестве терапевтических средств в случае обусловленных пролиферацией клеток заболеваний, как артериосклерозы, диабетические поздние осложнения, опухолевые заболевания, фибротические заболевания, в особенности легких, печени и почек, а также гипертрофии и гиперплазии органов. Сверх того, вещества пригодны для диагностики с целью распознавания заболевания, которые сопровождаются повышенной активностью Na+/H+-анипортета, например в эритроцитах, тромбоцитах или лейкоцитах. Действия соединений можно определять с помощью само по себе известных методов, которые указаны, например, N.Ecсobales и J.Figueroa в J. Membrane Biol. 120, 41-49 (1991) или L.Counillon, W.Scholz, H.J. Lang и J.Pouyssigur в Мol. Pharmacol. 44, 1041-1045 (1993). В качестве подопытных животных пригодны, например, мыши, крысы, морские свинки, собаки, кошки, обезьяны или свиньи. Поэтому соединения можно применять в качестве биологически активных веществ лекарственных средств в медицине и ветеринарии. Далее они могут найти применение в качестве промежуточных продуктов для получения других биологически активных веществ лекарственных средств. В указанных формулах A обозначает разветвленную или неразветвленную (линейную) алкильную группу с 1-6, предпочтительно 1-4, в особенности 1, 2 или 3 C-атомами, в частности, предпочтительно метил, далее предпочтительно этил, пропил, изопропил, бутил, изобутил, далее, предпочтительно, втор-бутил, трет. -бутил, пентил, изопентил (3-метилбутил), гексил или изогексил (4-метилпентил). R1 предпочтительно обозначает A, в особенности метил или этил. R2 обозначает A; фенил; 2-, 3- или 4-хлорфенил; 2-, 3- или 4-фторфенил или Гет. Особенно предпочтительно, наряду с нижеуказанными значениями, Гет обозначает пиридил, пиримидил, триазолил, тиазолил или частично или полностью гидрированные производные этих остатков, которые также могут быть замещены, как указано. Ph обозначает предпочтительно незамещенный или однократно замещенный с помощью F, Cl, Br, A, OA, NH2, NHA, NA2 или CF3 фенил. Гал обозначает предпочтительно F, Cl или Br. Гет предпочтительно обозначает 2- или 3-фурил, 2- или 3-тиенил; 1-, 2- или 3-пирролил; 1-, 2-, 4- или 5-имидазолил; 1-, 3-, 4- или 5-пиразолил; 2-, 4- или 5-оксазолил; 3-, 4- или 5-изоксазолил; 2-, 4- или 5-тиазолил; 3-, 4- или 5-изотиазолил; 2-, 3- или 4-пиридил; 2-, 4-, 5- или 6-пиримидинил; далее предпочтительно 1,2,3-триазолил-1-, -4- или -5-ил; 1,2,4-триазол-1-, -3- или -5-ил; 1- или 5-тетразолил, 1,2,3-оксадиазол-4- или -5-ил; 1,2,4-оксадиазол-3- или -5-ил; 1,3,4-тиадиазол-2- или -5-ил; 1,2,4-тиадиазол-3- или -5-ил; 1,2,3-тиадиазол-4- или -5-ил; 2-, 3-, 4-, 5- или 6-2H-тиопиранил; 2-, 3- или 4-4H-тиопиранил; 3- или 4-пиридазинил; пиразинил; 2-, 3-, 4-, 5-, 6- или 7-бензофурил; 2-, 3-, 4-, 5-, 6- или 7-бензотиенил; 1-, 2-, 3-, 4-, 5-, 6- или 7-индолил; 1-, 2-, 4- или 5-бензимидазолил; 1-, 3-, 4-, 5-, 6- или 7-бензопиразолил; 2-, 4-, 5-, 6- или 7-бензоксазолил; 3-, 4-, 5-, 6- или 7-бензизоксазолил; 2-, 4-, 5-, 6- или 7-бензтиазолил; 2-, 4-, 5-, 6- или 7-бензизотиазолил; 4-, 5-, 6- или 7-бенз-2,1,3-оксадиазолил; 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолинил; 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолинил; 1-, 2-, 3-, 4- или 9-карбазолил; 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8- или 9-акридинил; 3-, 4-, 5-, 6-, 7- или 8-циннолинил; 2-, 4-, 5-, 6-, 7- или 8-хиназолинил. Гетероциклические остатки также могут быть частично или полностью гидрированы. Гет, следовательно, также может обозначать, например, 2,3-дигидро-2-, -3-, -4- или -5-фурил; 2,5-дигидро-2-, -3-, -4- или -5-фурил; тетрагидро-2- или -3-фурил; 1,3-диоксолан-4-ил; тетрагидро-2- или-3-тиенил, 2,3-дигидро-1-, -2-, -3-, -4- или -5-пирролил; 2,5-дигидро-1-, -2-, -3-, -4- или -5-пирролил; 1-, 2- или 3-пирролидинил; тетрагидро-1-, -2- или -4-имидазолил; 2,3-дигидро-1-, -2-, -3-, -4- или -5-пиразолил, тетрагидро-1-, -3- или -4-пиразолил; 1,4-дигидро-1-, -2-, -3- или -4-пиридил; 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5- или -6-пиридил; 1,2,3,6-тетрагидро-1-, -2-, -3-, -4-, -5- или -6-пиридил; 1-, 2-, 3- или 4-пиперидинил; 2-, 3- или 4-морфолинил, тетрагидро-2-, -3- или -4-пиранил; 1,4-диоксанил; 1,3-диоксан-2-, -4- или -5-ил; гексагидро-1-, -3- или -4-пиридазинил; гексагидро-1-, -2-, -4- или -5-пиримидинил; 1-, 2- или 3-пиперазинил; 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5-, -6-, -7- или -8-хинолинил; 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5-, -6-, -7- или -8-изохинолинил. Вообще имеет значение то, что все остатки, как например A, которые могут многократно содержаться в молекуле, могут быть одинаковыми или разными, т.е. могут быть независимы друг от друга. Соответственно этому предметом изобретения являются, в частности, те соединения формулы (I), в которых по меньшей мере один из указанных остатков имеет одно из вышеуказанных предпочтительных значений. Некоторые предпочтительные группы соединений могут быть выражены нижеследующими формулами (Ia)-(Ih), которые соответствуют формуле (I) и где подробнее не указанные остатки имеют указанное в случае формулы (I) значение, однако, где: в Ia: R1 обозначает метил или этил; в Ib: R1 обозначает метил или этил и R2 обозначает A; в Ic: R1 обозначает метил или этил и R2 обозначает 2-тиазолил, 4,5-дигидро-тиазол-2-ил; 1,2,4-триазол-3-ил или 1,2,4-(4-метилтриазол-3-ил); в Id: R1 обозначает метил или этил и R2 обозначает имидазолил, пиридил или пиримидинил; в Ie: R1 обозначает метил или этил и R2 обозначает пиридил или пиримидинил; в If: R1 обозначает метил или этил и R2 обозначает фенил, фторфенил или хлорфенил; в Ig: R1 обозначает метил или этил и R2 обозначает метил, этил, пропил, изопропил или бутил; в Ih: R1 обозначает метил или этил и R2 обозначает циклогексил или циклопентил. Далее особенно предпочтительны те соединения, которые имеют указанные в (Ia)-(Ih) предпочтительные значения, в случае которых, однако, дополнительно – SO2A обозначает метилсульфонил. Предметом изобретения, далее, является способ получения соединений формулы (I) по п. 1 формулы изобретения, а также их солей, отличающийся тем, что соединение формулы (II) 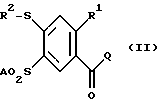 где R1, R2 и A имеют вышеуказанные значения, а Q обозначает Cl, Br, OA, O-CO-A, O-CO-Ph, OH или другую реакционноспособную, этерифицированную до сложноэфирной, OH-группу, соответственно, легко нуклеофильно замещаемую удаляемую группу, вводят во взаимодействие с гуанидином; или бензоилгуанидин формулы (III) 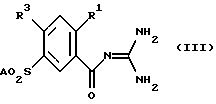 где R1 и A имеют вышеуказанные значения, и R3 обозначает F, Cl, Br, J или другую пригодную удаляемую группу, вводят во взаимодействие с соединением формулы (IV) R2 – S – H, (IV) где R2 имеет вышеуказанные значения, или с производным от него солеобразным соединением, тиолятом; или обычно соответствующее формуле (I) соединение, которое, однако, вместо одного или нескольких атомов водорода содержит одну или несколько восстанавливаемых групп и/или одну или несколько дополнительных C-C- и/или C-N-связей, обрабатывают восстановителем; или обычно соответствующее формуле (I) соединение, которое, однако, вместо одного или нескольких атомов водорода содержит одну или несколько сольволизируемых групп, обрабатывают с помощью сольволизирующего средства; и/или полученное основание формулы (I) путем обработки кислотой превращают в одну из его солей. Соединение формулы (I), впрочем, получают само по себе известными способами, которые описаны в литературе (например, в Губен-Вейл, Методы органической химии, изд. Georg Thieme, Штутгарт; Органические реакции, John Wiley and Sons, межд. , Нью-Йорк, а также в вышеуказанной патентной заявке), а именно при реакционных условиях, которые известны и пригодны для указанных взаимодействий. При этом можно использовать также сами по себе известные, здесь подробнее не упомянутые, варианты. Исходные вещества в желательном случае также можно получать in situ, таким образом, что их не выделяют из реакционной смеси, а тотчас вводят во взаимодействие далее до получения соединений формулы (I). Предпочтительно соединение формулы (I) получают тем, что активированное производное карбоновой кислоты формулы (II), причем особенно предпочтительно обозначает C1 или -O-CH3, вводят во взаимодействие с гуанидином. Особенно пригодны также варианты реакции, при которых свободную карбоновую кислоту (= ОН) само по себе известным образом превращают в соответствующее активированное производное и затем его непосредственно, без промежуточного выделения вводят во взаимодействие с гуанидином. Способами, при которых излишне промежуточное выделение, являются, например, активирование с помощью карбонилдиимидазола, дициклогексилкарбодиимида или по варианту Mukayama (Angew. Chem. 91, 788-812 (1979)). Карбоновые кислоты формулы (II) получают, например, путем нуклеофильного ароматического замещения, исходя из пригодных производных бензойной кислоты, с помощью соответствующих тиолов, соответственно тиофенолов. Взаимодействие осуществляют по аналогии с реакцией соединений формул (III) и (IV). Она описывается ниже. Взаимодействие реакционноспособного производного карбоновой кислоты формулы (II) с гуанидином осуществляют само по себе известным образом, предпочтительно в протонном или апротонном, полярном или аполярном инертном органическом растворителе. Пригодные растворители указываются ниже для взаимодействия соединений формул (III) и (IV). Особенно предпочтительными растворителями являются, однако, метанол, ТГФ, диметоксиэтан, диоксан, вода или приготовляемые из них смеси. В качестве реакционной температуры пригодны, например, температуры от 20oC до температуры кипения растворителя. Время реакции составляет от 5 минут до 12 часов. Целесообразно использовать во время реакции улавливатель кислоты. Для этого пригодны любые виды оснований, которые сами не мешают протеканию реакции. Особенно пригодно, однако, применение неорганических оснований, как карбонат калия, или органических оснований, как триэтиламин или пиридин, или, однако, избыток гуанидина. Соединение формулы (I) по п.1, далее, можно получать тем, что бензоилгуанидин формулы (III) вводят во взаимодействие с соединением формулы (IV). Исходные вещества формулы (III) можно получать простым образом путем взаимодействия соответственно замещенных бензойных кислот или производимых от них реакционноспособных производных кислот, как например галоидангидриды, сложные эфиры или ангидриды, с гуанидином, при реакционных условиях, которые сами по себе известны и в общем обычны для получения амидов. Особенно пригодны опять такие варианты реакции, которые указываются выше для взаимодействия соединения формулы (II) с гуанидином. Тиолы или тиофенолы, соответственно тиоляты, формулы (IV), точно так же, как способы их получения, сами по себе известны. Если они неизвестны, то их можно получать само по себе известными способами. Получение соединения формулы (II), а также взаимодействие соединения формулы (II) с соединением формулы (IV), осуществляют само по себе известным образом, предпочтительно в протонном или апротонном, полярном инертном органическом растворителе. Предпочтительный вариант, разумеется, также состоит в том, что компоненты реакции непосредственно, без добавки растворителя, вводят во взаимодействие друг с другом. При получении соединения формулы (II) или при взаимодействии соединения формулы (III) с соединением формулы (IV) также целесообразно работать в присутствии основания или с избытком основного компонента. В качестве оснований предпочтительно пригодны, например, гидроксиды, карбонаты, алкоголяты щелочных или щелочноземельных металлов, или органические основания, как триэтиламин или пиридин, которые также применяют в избытке, и тогда одновременно они могут служить в качестве растворителей. В качестве инертных растворителей в особенности пригодны спирты, как метанол, этанол, изопропанол, н-бутанол или трет.-бутанол, простые эфиры, как диэтиловый эфир, ТГФ или диоксан; простые гликолевые эфиры, как простой этиленгликольмонометиловый или -моноэтиловый эфир (метилгликоль или этилгликоль), этиленгликольдиметиловый простой эфир (диглим); кетоны, как ацетон или бутанон; нитрилы, как ацетонитрил; нитро-соединения, как нитрометан или нитробензол; сложные эфиры, как этилацетат, амиды, как гексаметилтриамид фосфорной кислоты; сульфоксиды, как диметилсульфоксид (ДМСО); хлорированные углеводороды, как дихлорметан, хлороформ, трихлорэтилен, 1,2-дихлорэтан или тетрахлорид углерода; углеводороды, как бензол, толуол или ксилол. Далее, пригодны смеси этих растворителей друг с другом. Далее соединения формулы (I) можно получать тем, что их высвобождают из их функциональных производных путем сольволиза, в особенности путем гидролиза. Предпочтительными исходными веществами для сольволиза, соответственно гидрогенолиза, являются такие, которые обычно соответствуют формуле (I), однако, вместо одной или нескольких свободных амино-групп и/или гидроксильных групп содержат соответствующие защищенные амино- и/или гидроксильные группы, предпочтительно такие, которые вместо H-атома, связанного с N-атомом, содержат защитную для амино-функции группу, в особенности такие, которые вместо NH-группы содержат R’-N-группу, где R’ обозначает защитную для амино-функции группу; или такие, которые вместо H-атома гидроксильной группы содержат защитную для гидроксильной функции группу, например такие, которые соответствуют формуле (I), однако вместо одной OH-группы содержат OR”-группу, где R” обозначает защитную для гидроксильной функции группу. В молекуле исходного вещества могут присутствовать также несколько, одинаковых или разных, защищенных амино- и/или гидроксильных групп. Если имеющиеся защитные группы отличны друг от друга, то во многих случаях их можно отщеплять селективно. Выражение “защитная для амино-функции группа” общеизвестно и относится к группам, которые пригодны для защиты (блокирования) амино-группы от химических взаимодействий, которые, однако, легко удаляются после того, как в другом месте молекулы прошла желательная химическая реакция. Типичными для таких групп являются в особенности незамещенные или замещенные ацильные, арильные (например, 2,4-динитрофенил – (ДНФ)), аралкоксиметильные (например, бензилоксиметил – БОМ) или аралкильные (например, бензил, 4-нитробензил, трифенилметил) группы. Так как защитные для амино-функции группы после желательной реакции (или последовательности реакций) удаляют, то их род и величина, впрочем, не критические; однако, предпочтительны таковые с 1-20, в особенности 1-8, C-атомами. Выражение “ацильная группа” в связи с настоящим способом нужно понимать в самом широком смысле. Оно охватывает производимые от алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфокислот ацильные группы, а также в особенности алкоксикарбонильные, арилоксикарбонильные и прежде всего аралкоксикарбонильные группы. Примерами такого рода ацильных групп являются алканоил, как ацетил, пропионил, бутирил; аралканоил, как фенилацетил; ароил, как бензоил или толуоил; арилоксиалканоил, как феноксиацетил; алкоксикарбонил, как метоксикарбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, изопропоксикарбонил, трет.-бутоксикарбонил (БОК), 2-иодэтоксикарбонил; аралкоксикарбонил, как бензилоксикарбонил (CBZ), 4-метоксибензилоксикарбонил, 9-флуоренилметоксикарбонил (FMOC). Предпочтительными защитными для амино-функции группами являются БОК, ДНФ и БОМ, далее CBZ, бензил и ацетил. Выражение “защитная для гидроксильной функции группа” также общеизвестно и относится к группам, которые пригодны для защиты гидроксильной группы от химических взаимодействий, которые, однако, легко удаляются после того, как в другом месте молекулы прошла желательная химическая реакция. Типичными для таких групп являются вышеуказанные, незамещенные или замещенные, арильные, аралкильные или ацильные группы, далее, также алкильные группы. Природа и величина защитных для гидроксильной функции групп не критические, так как их снова удаляют после желательной химической реакции или последовательности реакций; предпочтительны группы с 1-20, в особенности 1-10, C-атомами. Примерами защитных для гидроксильной функции групп являются, между прочим, трет.-бутил, бензил, п-нитробензоил, п-толуолсульфонил и ацетил, причем особенно предпочтительны бензил и ацетил. Используемые в качестве исходных веществ функциональные производные соединений формулы (I) можно получать обычными способами, которые описаны, например, в указанных стандартных работах и патентных заявках, например, путем взаимодействия соединений, которые соответствуют формулам (II) и (III), причем, однако, по меньшей мере одно из этих соединений вместо H-атома содержит защитную группу. Высвобождение соединений формулы (I) из их функциональных производных, в зависимости от используемой защитной группы, осуществляют, например, с помощью сильных кислот, целесообразно с помощью трифторуксусной кислоты или хлорной кислоты, однако, также с помощью других сильных неорганических кислот, как соляная или серная кислота, сильных органических карбоновых кислот, как трихлоруксусная кислота, или сульфокислот, как бензол- или п-толуолсульфокислота. Присутствие дополнительно инертного растворителя возможно, однако не всегда требуется. В качестве инертных растворителей предпочтительно пригодны органические, например карбоновые, кислоты, как уксусная кислота; простые эфиры, как тетрагидрофуран (ТГФ) или диоксан; амиды, как диметилформамид (ДМФ); галогенированные углеводороды, как дихлорметан; далее, также спирты, как метанол, этанол или изопропанол, а также вода. Далее принимают во внимание смеси вышеуказанных растворителей. Трифторуксусную кислоту предпочтительно используют в избытке без добавки другого растворителя; хлорную кислоту используют в виде смеси из уксусной кислоты и 70%-ной хлорной кислоты в соотношении 9:1. Температуры реакции отщепления целесообразно составляют примерно от 0 до примерно 50oC, предпочтительно работают при 15-30oC (комнатная температура). БОК-группу можно отщеплять, например, предпочтительно с помощью 40%-ной трифторуксусной кислоты в дихлорметане или с помощью примерно 3-5 н. HCl в диоксане при 15-60oC; МОС-группу можно отщеплять с помощью примерно 5-20%-ного раствора диметиламина, диэтиламина или пиперидина в ДМФ при 15-50oC. Отщепление ДНФ-группы осуществляют, например, также с помощью примерно 3-10%-ного раствора 2-меркапто-этанола в смеси ДМФ с водой при 15-30oC. Гидрогенолитически удаляемые защитные группы (например, БОМ, CBZ или бензил) можно отщеплять, например, путем обработки водородом в присутствии катализатора (например, катализатора на основе благородного металла, как палладий, целесообразно на носителе, как уголь). В качестве растворителей при этом пригодны вышеуказанные, в особенности, например, спирты, как метанол или этанол, или амиды, как ДМФ. Гидрогенолиз, как правило, осуществляют при температурах примерно от 0 до 100oC и давлениях примерно 1-200 бар, предпочтительно при 20-30oC и давлении 1-10 бар. Гидрогенолиз CBZ-группы хорошо протекает, например, в присутствии 5-10%-ного палладия -на-угле в метаноле при 20-30oC. Основание формулы (I), далее, можно переводить с помощью кислоты в соответствующую соль присоединения кислоты. Для этого превращения принимают во внимание кислоты, которые дают физиологически приемлемые соли. Так, можно применять неорганические кислоты, например серную кислоту, азотную кислоту, галогенводородные кислоты, как соляная кислота или бромоводородная кислота, фосфорные кислоты, как орто-фосфорная кислота, сульфаминовую кислоту; далее, органические кислоты, в особенности алифатические, ациклические, аралифатические, ароматические или гетероциклические одно- или многоосновные карбоновые, сульфоновые или серные кислоты, например как муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, бензойная кислота, салициловая кислота, 2- или 3-фенилпропионовая кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- или этансульфокислота, этандисульфокислота, 2-гидрокси-этансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталин-моно- или -ди-сульфокислоты, лаурилсерная кислота. Соединения формулы (I) и их физиологически приемлемые соли можно применять для приготовления фармацевтических композиций, в особенности нехимическим путем. При этом их вместе по меньшей мере с одним твердым, жидким и/или полужидким носителем или вспомогательным веществом, и в случае необходимости в комбинации с одним или несколькими другими биологически активными веществами, можно доводить до пригодной дозировочной формы. Предметом изобретения, далее, являются средства, особенности фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I) и/или одну из его физиологически приемлемых солей. Эти композиции можно применять в качестве лекарственных средств в медицине или ветеринарии. В качестве носителей принимают во внимание органические или неорганические вещества, которые пригодны для кишечного (например, орального), парентерального или топического применения (введения) и не реагируют с новыми соединениями, например, как вода, растительные масла, бензиловые спирты, полиэтиленгликоли, триацетат глицерина, желатина, углеводы, как лактоза или крахмал, стеарат магния, тальк, ланолин, вазелин. Для орального применения в особенности служат таблетки, драже, капсулы, сиропы, соки или капли; для ректального применения служат свечи; для парентерального применения служат растворы, предпочтительно масляные или водные растворы, далее, суспензии, эмульсии или имплантаты; для топического применения служат мази, кремы, пасты, лосьоны, гели, пульверизуемые препараты, пены, аэрозоли, растворы (например, растворы в спиртах, как этанол или изопропанол, ацетонитриле, ДМФ, диметилацетамиде, 1,2-пропандиоле или их смесях друг с другом и/или с водой) или порошки (пудры). Новые соединения можно также лиофилизировать и полученные лиофилизаты применять, например, для приготовления препаратов для инъекций. В особенности для топического применения принимают во внимание также липосомальные композиции. Указанные композиции могут быть стерилизованы и/или могут содержать вспомогательные вещества, как смазки, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для влияния на осмотическое давление, буферные вещества, красители, вкусовые вещества и/или ароматические вещества. Если желательно, они также могут содержать одно или несколько других биологически активных веществ, например один или несколько витаминов. Соединения формулы (I) и их физиологически приемлемые соли можно вводить людям или животным, в частности млекопитающим, как обезьяны, собаки, кошки, крысы или мыши, и применять при терапевтическом лечении организма человека или животного, а также при борьбе с заболеваниями, в особенности при терапии и/или профилактике нарушений сердечно-сосудистое системы. Поэтому они пригодны для лечения аритмий, в особенности, когда они вызываются недостатком кислорода; стенокардии; инфарктов; ишемий нервной системы, как, например, инсульт или отеки мозга; шоковых состояний и для профилактики. Далее вещества можно использовать в качестве терапевтических средств при заболеваниях, при которых играют роль пролиферации клеток, как артериосклерозы, диабетические поздние осложнения, опухолевые заболевания, фиброзы, а также гипертрофии и гиперплазии органов, в особенности при заболеваниях простаты. При этом предлагаемые согласно изобретению вещества, как правило, вводят по аналогии с известными антиаритмическими средствами, например, как апридин, предпочтительно в дозировках примерно 0,01-5 мг, в особенности 0,02-0,5 мг, на дозировочную единицу. Суточная доза предпочтительно составляет примерно 0,0001-0,1, в особенности 0,0003-0,01 мг/кг веса тела. Специальная доза для каждого определенного пациента зависит, однако, от самых различных факторов, например от эффективности используемого специального соединения, от возраста, веса тела, общего состояния здоровья, пола, от стоимости, от момента и пути введения, от скорости выделения, комбинации лекарственных средств и тяжести соответствующего заболевания, которое имеет значение для терапии. Предпочтительно оральное введение. В нижеследующих примерах выражение “обычная обработка” обозначает: добавляют, если необходимо, воду, экстрагируют с помощью органического растворителя, как этилацетат, разделяют, органическую фазу сушат над сульфатом натрия, отфильтровывают, выпаривают и очищают путем хроматографии и/или кристаллизации. Пример 1. К раствору из 1,5 г гуанидина, растворенных в 20 мл простого этиленгликольдиметилового эфира, при комнатной температуре прикапывают 1,8 г хлорангидрида 2-метил-4-(4-пиридилтио)-5-метилсульфонил-бензойной кислоты [получают путем взаимодействия 2-метил-4-хлор-5-метилсульфонил-бензойной кислоты с 4-меркаптопиридином в присутствии NaOCH3 при 180oC и последующего хлорирования с помощью SOCl2], растворенных в 20 мл простого этиленгликольдиметилового эфира, и реакционную смесь перемешивают в течение 3-х часов при 25oC. Затем обрабатывают как обычно и очищают путем хроматографии на силикагеле (этилацетат + 15% метанола). Получают N-диаминометилен-2- метил-4-(4-пиридилтио)-5-метилсульфонил-бензамид в виде вязкого масла; М++1 (FAB) = 365. Аналогичным образом, путем взаимодействия гуанидина с хлорангидридом 2-метил-4-(4-хлорфенилтио)-5-метилсульфонил-бензойной кислоты получают N-диаминометилен-2-метил-4-(4-хлорфенилтио)-5-метилсульфонил-бензамид; т. пл. 245-247oC; (метансульфонат с т.пл. выше 250oC); с хлорангидридом 2-метил-4-(3-хлорфенилтио)-5-метилсульфонил-бензойной кислоты получают N-диаминометилен-2-метил-4-(3-хлорфенилтио)-5- метилсульфонил-бензамид; т.пл. 198-202oC; метансульфонат, т.пл. 213-215oC; с хлорангидридом 2-метил-4-(2-хлорфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-метил-4-(2- хлорфенилтио)-5-метилсульфонил-бензамид, т.пл. 184-187oC (метансульфонат с т.пл. выше 250oC); с хлорангидридом 2-метил-4-фенилтио-5-метилсульфонил-бензойной кислоты получают N-диаминометилен-2-метил-4-фенилтио-5- метилсульфонил-бензамид, т. пл. 125-139oC; с хлорангидридом 2-метил-4-(4-фторфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-метил-4-(4- фторфенилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-метил-4-(3-фторфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-метил-4-(3- фторфенилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-метил-4-(2-фторфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-метил-4-(2- фторфенилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-метил-4-(3-пиридилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-метил-4-(3- пиридилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-метил-4-(2-пиримидинилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-метил-4-(2- пиримидинилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-метил-4-(2-пиридилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-метил-4-(2- пиридилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-метил-4-2-(1,4,5,6-тетрагидропиримидинилтио)- 5-метилсульфонил-бензойной кислоты получают N-диаминометилен-2-метил- 4-2-(1,4,5,6-тетрагидропиримидинилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-метил-4-(4,5-дигидротиазол-2-ил-тио)-5- метилсульфонил-бензойной кислоты получают N-диаминометилен-2-метил-4- (4,5-дигидротиазол-2-ил-тио)-5-метилсульфонил-бензамид; с хлорангидридом 2-метил-4-[2-(4-N-метил-1,2,4-триазол-3-ил- тио)]-5-метилсульфонил-бензойной кислоты получают N-диаминометилен-2- метил-4-[2-(4-N-метил-1,2,4-триазол-3-ил-тио)]-5-метилсульфонил- бензамид. Пример 2. 0,9 г N-диаминометилен-2-метил-4-(4-пиридилтио)-5- метилсульфонилбензамида (получают согласно примеру 1) суспендируют в 100 мл воды, смешивают с 1 М раствором HCl и затем подвергают сушке вымораживанием. Получают N-диаминометилен-2-метил-4-(4-пиридилтио)-5- метилсульфонил-бензамид-дигидрохлорид, т.пл.>250oC. Аналогичным образом, путем обработки с помощью водной HCl и последующей сушкой вымораживанием из N-диаминометилен-2-метил-4-фенилтио-5-метилсульфонил- бензамида получают N-диаминометилен-2-метил-4-фенилтио-5- метилсульфонил-бензамид-гидрохлорид, т.пл. > 260oC; из N-диаминометилен-2-метил-4-(2-пиридилтио)-5-метилсульфонил бензамида получают N-диаминометилен-2-метил-4-(2-пиридилтио)- 5-метилсульфонил-бензамид-дигидрохлорид; из N-диаминометилен-2-метил-4-(3-фторфенилтио)-5-метилсульфонил- бензамида получают N-диаминометилен-2-метил-4-(3-фторфенилтио)-5- метилсульфонил-бензамид-гидрохлорид; из N-диаминометилен-2-метил-4-(4-фторфенилтио-5-метилсульфонил- бензамида получают N-диаминометилен-2-метил-4-(4-фторфенилтио)-5- метилсульфонил-бензамид-гидрохлорид; из N-диаминометилен-2-метил-4-(4-хлофенилтио)-5-метилсульфонил- бензамида получают N-диаминометилен-2-метил-4-(4-хлорфенилтио)-5- метилсульфонил-бензамид-гидрохлорид; из N-диаминометилен-2-метил-4-метилтио-5-метилсульфонил- бензамида получают N-диаминометилен-2-метил-4-метилтио-5- метилсульфонил-бензамид-гидрохлорид, т.пл. > 260oC; из N-диаминометилен-2-метил-4-(2-хлорфенилтио)-5-метилсульфонил- бензамида получают N-диаминометилен-2-метил-4-(2-хлорфенилтио)-5- метилсульфонил-бензамид-гидрохлорид. Пример 3. 2,9 г N-диаминометилен-2-метил-4-хлор-5-метилсульфонил-бензамида [получают путем взаимодействия хлорангидрида 2-метил-4-хлор-5- метилсульфонил-бензойной кислоты с гуанидином согласно примеру 1] и 700 мг тиометилата натрия в 30 мл ДМФ перемешивают в течение 2-х часов при 90oC. Затем добавляют 30 мл воды со льдом и реакционную смесь подкисляют с помощью 20 мл 1 н. HCl. Образовавшийся осадок отсасывают и сырой продукт очищают путем хроматографии на силикагеле (этилацетат +10% метанола). Получают N-диаминометилен-2-метил-4-метилтио-5-метилсульфонил-бензамид, т.пл. 220-222oC. Аналогичным образом, путем взаимодействия N-диаминометилен-2- метил-4-хлор-5-метилсульфонил-бензамида с тиопропилатом натрия получают N-диаминометилен-2-метил-4- пропилтио-5-метилсульфонил-бензамид, т.пл. 215-218oC; метансульфонат, т.пл. 195-197oC; с тиопропилатом натрия получают N-диаминометилен-2-метил-4- изопропилтио-5-метилсульфонил-бензамид, т.пл. (метансульфонат) 185-186oC; с тиоэтилатом натрия получают N-диаминометилен-2-метил-4- этилтио-5-метилсульфонил-бензамид, т.пл. 238-240oC; метансульфонат, т.пл. 152-154oC; с тио-трет.-бутилатом натрия получают N-диаминометилен-2-метил- 4-трет. -бутилтио-5-метилсульфонил-бензамид, т.пл. 110-115oC; метансульфонат, т.пл. 200-202oC; с циклогексилтиолатом натрия получают N-диаминометилен-2-метил- 4-циклогексилтио-5-метилсульфонил-бензамид; с циклопентилтиолатом натрия получают N-диаминометилен-2-метил- 4-циклопентилтио-5-метилсульфонил-бензамид. Аналогичным образом, путем взаимодействия N-диаминометилен-2- этил-4-хлор-5-метилсульфонил-бензамида с тиометилатом натрия получают N-диаминометилен-2-этил-4- метилтио-5-метилсульфонил-бензамид; с тиопропилатом натрия получают N-диаминометилен-2-этил-4- пропилтио-5-метилсульфонил-бензамид; с тиоизопропилатом натрия получают N-диаминометилен-2-этил-4- изопропилтио-5-метилсульфонил-бензамид; с тиоэтилатом натрия получают N-диаминометилен-2-этил-4-этилтио- 5-метилсульфонил-бензамид; с циклогексилтиолатом натрия получают N-диаминометилен-2-этил- 4-циклогексилтио-5-метилсульфонил-бензамид; с циклопентилтиолатом натрия получают N-диаминометилен-2-этил- 4-циклопентилтио-5-метилсульфонил-бензамид. Пример 4. Аналогично примеру 1, путем взаимодействия гуанидина с хлорангидридом 2-этил-4-(4-пиридилтио)-5-метилсульфонил-бензойной кислоты [получают путем взаимодействия 2-этил-4-хлор-5- метилсульфонил-бензойной кислоты с 4-меркаптопиридином в присутствии NaOCH3 при 180oC и последующего хлорирования с помощью SOCl2] получают N-диаминометилен-2-этил-4-(4-пиридилтио)-5- метилсульфонил-бензамид. Аналогичным образом, путем взаимодействия гуанидина с хлорангидридом 2-этил-4-(4-хлорфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-этил-4-(4- хлорфенилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-(3-хлорфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-этил-4-(3- хлорфенилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-(2-хлорфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-этил-4-(2- хлорфенилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-фенилтио-5-метилсульфонил-бензойной кислоты получают N-диаминометилен-2-этил-4-фенилтио-5- метилсульфонил-бензамид; с хлорангидридом 2-этил-4-(4-фторфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-этил-4-(4- фторфенилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-(3-фторфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-этил-4-(3- фторфенилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-(2-фторфенилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-этил-4-(2- фторфенилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-(3-пиридилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-этил-4-(3- пиридилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-(2-пиримидинилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-этил-4-(2- пиримидинилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-(2-пиридилтио)-5-метилсульфонил- бензойной кислоты получают N-диаминометилен-2-этил-4-(2- пиридилтио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-[2-(1,4,5,6- тетрагидропиримидинилтио)]-5-метилсульфонил-бензойной кислоты получают N-диаминометилен-2-этил-4-[2-(1,4,5,6- тетрагидропиримидинилтио)]-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-(4,5-дигидро-тиазол-2-ил-тио)- 5-метилсульфонил-бензойной кислоты получают N-диаминометилен- 2-этил-4-(4,5-дигидро-тиазол-2-ил-тио)-5-метилсульфонил-бензамид; с хлорангидридом 2-этил-4-[2-(4-N-метил-1,2,4-триазол-3-ил- тио)]-5-метилсульфонил-бензойной кислоты получают N-диаминометилен- 2-этил-4-[2-(4-N-метил-1,2,4-триазол-3-ил-тио)]-5-метилсульфонил- бензамид. Нижеследующие примеры относятся к фармацевтическим композициям. Пример А. Стеклянные пузырьки с препаратом для инъекции В раствор из 100 г биологически активного вещества формулы (I) и 5 г динатрийгидрофосфата в 3 л дважды перегнанной воды с помощью 2 н. соляной кислоты устанавливают pH 6,5, раствор стерильно фильтруют, заполняют им стеклянные пузырьки для препарата для инъекции, лиофилизируют в стерильных условиях и стерильно закрывают. Каждый стеклянный пузырек с препаратом для инъекции содержит 5 мг биологически активного вещества. Пример Б. Свечи Расплавляют смесь из 20 г биологически активного вещества формулы (I) вместе со 100 г соевого лецитина и 1400 г масла какао, выливают в формы и оставляют охлаждаться. Каждая свеча содержит 20 мг биологически активного вещества. Пример В. Раствор Готовят раствор из 1 г биологически активного вещества формулы (I), 9,38 г NaH2PO4  2H2O, 28,48 г Na2HPO4 2H2O, 28,48 г Na2HPO4  12H2O и 0,1 г бензальконийхлорида в 940 мл дважды перегнанной воды. Устанавливают pH 6,8, доливают до общего объема 1 л и стерилизуют путем облучения. Этот раствор можно применять в форме глазных капель.
Пример Г. Мазь 12H2O и 0,1 г бензальконийхлорида в 940 мл дважды перегнанной воды. Устанавливают pH 6,8, доливают до общего объема 1 л и стерилизуют путем облучения. Этот раствор можно применять в форме глазных капель.
Пример Г. МазьСмешивают 500 мг биологически активного вещества формулы (I) с 99,5 г вазелина в асептических условиях. Пример Д. Таблетки Смесь из 1 кг биологически активного вещества формулы (I), 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния обычным образом прессуют в таблетки таким образом, что каждая таблетка содержит 10 мг биологически активного вещества. Пример Е. Драже Аналогично примеру Д прессуют таблетки, на которые затем обычным образом наносят покрытие из сахарозы, картофельного крахмала, талька, траганта и красителя. Пример Ж. Капсулы 2 кг биологически активного вещества формулы (I) обычным образом вносят в твердые желатиновые капсулы так, что каждая капсула содержит 20 мг биологически активного вещества. Пример З. Ампулы Раствор из 1 кг биологически активного вещества формулы (I) в 60 л дважды перегнанной воды стерильно фильтруют, разливают в ампулы, лиофилизируют в стерильных условиях и стерильно закрывают. Каждая ампула содержит 10 мг биологически активного вещества. Фармакологические данные Определяли биологическую (ингибирующую) активность соединений общей формулы (I) 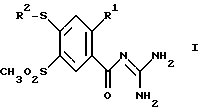 Ингибирование Na+-обмена определяли на эритроцитах кролика по методу, описанному Duesing с сотр., Med. Clin. 87, 378-384 (1992), активность выражена величиной IC50, соответствующей 50%-ному ингибированию Na+/H+-антипорта (Na+-обмена) на эритроцитах кролика. Полученные результаты приведены в таблице 1. Полученные результаты демонстрируют значительное ингибирование Na+/H+-зависимого Na+-обмена соединениями формулы (I) по сравнению с известным соединением, в качестве которого использовали 3-метилсульфонил-4-(4-пиридилтио) бензоилгуанидин, описанный в примере 1 заявки EP 0602523. Приведенные фармакологические данные характеризуют предлагаемые согласно изобретению соединения формулы (I) в качестве ингибиторов Na+/H+-антипорта. Предлагаемые соединения ингибируют Na+/H+-антипорт, тем самым предотвращают сердечные заболевания и проявляют кардиозащитное действие, вследствие чего пригодны для лечения и профилактики аритмии, стенокардии, инфаркта, патологических гипоксических и ишемических повреждений. Формула изобретения
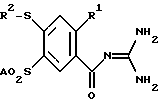 где R1 обозначает А; R2 обозначает А, незамещенный или замещенный F, Cl, Br фенил, пиридил; А означает алкил с 1 – 6 С-атомами, а также их физиологически приемлемые соли. 2. 4-меркапто-бензоилгуанидины формулы I по п.1, представляющие собой: а) N-динаминометилен-2-метил-4-(4-пиридилтио)-5-метилсульфонил-бензамид, б) N-диаминометилен-2-метил-4-метилтио-5-метилсульфонил-бензамид, в) N-диаминометилен-2-метил-4-изопропилтио-5-метилсульфонил-бензамид, г) N-диаминометилен-2-метил-4-фенилтио-5-метилсульфонил-бензамид, д) N-диаминометилен-2-метил-4-(3-хлорфенилтио)-5-метилсульфонил-бензамид, а также их физиологически приемлемые соли. 3. Способ получения 4-меркапто-бензоилгуанидинов формулы I, а также их солей, отличающийся тем, что соединение формулы II 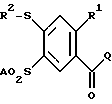 где R1, R2 и А имеют указанные в п.1 значения; Q обозначает Cl, Br, OA, O-CO-A, O-CO-Ph, ОН, или другую реакционноспособную, этерифицированную до сложноэфирной ОН-группу, или легко нуклеофильно замещаемую удаляемую группу, вводят во взаимодействие с гуанидином. 4. Фармацевтическая композиция, ингибирующая Na+/H+-антипорт, содержащая активное вещество и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного вещества она содержит по меньшей мере один 4-меркаптобензоилгуанидин формулы I по п.1 и/или одну из его физиологически приемлемых солей в эффективном количестве и по меньшей мере один твердый, жидкий или полужидкий носитель или вспомогательное вещество. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 31.01.2004
Извещение опубликовано: 20.10.2005 БИ: 29/2005
|
||||||||||||||||||||||||||
