Патент на изобретение №2162076
|
||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ N-АЦИЛ-2-АРИЛЦИКЛОАЛКИЛАМИНА, СТИМУЛИРУЮЩИЕ СИНТЕЗ МЕЛАТОНИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ МЕЛАТОНИНСТИМУЛИРУЮЩЕГО СВЯЗЫВАНИЯ
(57) Реферат: Описываются новые производные N-ацил-2-арилциклоалкиламина формулы I или II, стимулирующие синтез мелатонина, в которой X – галоген, водород, C1-4-алкил или OR5, где R5 представляет собой водород, C1-4-перфторалкил, C1-4-фторалкил, C1-4-пердейтероалкил, C1-20-алкил, C4-20-алкциклоалкил, C2-20-карбонитрилоалкил, C3-22-карбоалкоксиалкил, C3-20-алкенил, C3-20-алкинил, C9-20-фенилалкил, C9-20-фенилалкенил, C9-20-фенилалкинил, C2-20-гидроксиалкил, C8-20-фенилоксиалкил, C7-20-пиридилалкил или C6-20-пиррилалкил; Y – водород или галоген; Z – водород, галоген, циано, фенил, C7-20-фенилалкил, C8-20-фенилалкинил или C2-20-алкамидо; R в обоих случаях является водородом, галогеном или C1-4-алкилом; n равно 1 или 2; G – двухвалентный метилен, этилен или C1-4-алкметиленовый фрагмент; R1 – водород; C1-4-алкил или бензил; R2 – C1-6-алкил, C2-6-алкенил, C3-6-циклоалкил, C2-4-алкоксиалкил, C1-4-трифторметилалкил, C2-8-алкилтиоалкил или NR3R4, где R3 и R4 независимо друг от друга выбирают из водорода и C1-4-алкила, но R3 и R4 не могут одновременно быть водородом. Новые производные N-ацил-2-арилциклопропилметиламина обладают лекарственными и биологически активными свойствами. Эти соединения стимулируют синтез мелатонина, что делает их полезными для лечения некоторых заболеваний. Описывается также способ их получения. 3 с. и 16 з.п.ф-лы, 6 табл. 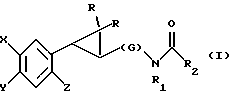 или 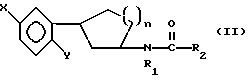
Предметом настоящего изобретения являются новые производные N-ацил-2-арилциклопропилметиламина, обладающие лекарственными и биологически активными свойствами, способы их получения, содержащие их фармацевтические составы и способы их применения. Эти соединения стимулируют синтез мелатонина, что делает их полезными для лечения некоторых заболеваний. Мелатонин (i; N-ацетил-5-метокситриптамин) является гормоном, который синтезируется и выделяется, главным образом, шишковидным телом. У млекопитающих уровни мелатонина подчиняются циклическому, циркадному ритму, причем самые высокие уровни наблюдаются в темный период циркадного цикла. Мелатонин участвует в трансдукции фотопериодической информации и, по-видимому, модулирует различные функции нервной и эндокринной систем у позвоночных, в том числе половую активность, вес тела и обмен веществ у фотопериодических млекопитающих, управление циркадными ритмами и изменение физиологии сетчатки глаза. 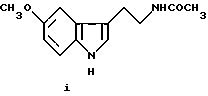 Результаты последних исследований показали, что мелатонин осуществляет биологическое воздействие с помощью определенных рецепторов. Использование биологически активного, меченого радиоактивным изотопом агониста [i125]-2-иодмелатонина позволило идентифицировать высокоаффинные рецепторы мелатонина в центральной нервной системе животных разных видов. В литературе сообщалось о клонировании потомства одного такого высокоаффинного рецептора мелатонина из меланоцитов лягушки. В результате проведения авторадиографических исследований было установлено, что рецепторы мелатонина расположены в нескольких определенных структурах мозга млекопитающих. Хотя существуют значительные различия в распределении рецепторов даже у близких видов, как правило, наибольшая плотность центров связывания наблюдается в несвязанных ядрах гипоталамуса. У людей характерное связывание [i125] -2-иодмелатонина в гипоталамусе полностью происходит в надхиазматических ядрах, что позволяет с большой степенью уверенности предположить, что рецепторы мелатонина расположены на участке биологических часов человека. Было установлено, что экзогенное введение мелатонина позволяет синхронизировать циркадные ритмы у крыс (Cassone и др., J. Biol. Rhymes, 1, 219-229, 1986). Мелатонин вводят людям с целью лечения нарушений суточного ритма организма, вызываемых десинхронизацией циркадных ритмов (Arendt и др., Br. Med. J., 292, 1170, 1986). Кроме того, применение однократной дозы мелатонина в качестве снотворного рассматривалось Вуртманом в международной заявке на патент WO 94/07487. Центры связывания мелатонина были обнаружены в разных тканях тела человека, например в сетчатке глаза, надхиазматических ядрах, селезенке и т.д. Из этого следует, что мелатонин выполняет несколько физиологических функций и не отличается высокой избирательностью. В случае применения мелатонина велика вероятность возникновения побочных явлений. Агонисты мелатонина должны оказывать более избирательное действие, чем мелатонин, и вызывать значительно меньше побочных явлений. Приемлемые агонисты мелатонина способны устранить недостатки, присущие мелатонину, в результате чего их действие становится более предсказуемым и, возможно, более продолжительным. Агонисты мелатонина особенно полезны для лечения хронобиологических нарушений. Кроме того, их можно использовать для дальнейшего изучения воздействия рецепторов мелатонина и лечения вызываемых ими заболеваний, таких как депрессия, синдром смещения времени наибольшей работоспособности, нарушения сна, глаукома, половые расстройства, рак, нарушения иммунной и нейроэндокринной систем. Помимо простых индоловых производных самого мелатонина были созданы различные амидные структуры, которые использовались в качестве лигандов мелатонина. Эти амидные структуры можно представить общей формулой 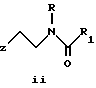 в которой Z представляет собой арильную или гетероарильную систему, присоединяемую цепью их двух углеродных атомов к амидной группе. Ниже приводятся несколько типичных примеров. Йоус и др. в заявке на европейский патент EPA 527687A рассматривают в качестве лигандов мелатонина этиламины, имеющие циклические заместители 1, 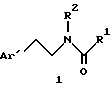 в которой Ar’ помимо прочего представляет собой замещенный или незамещенный бензо[b] тиофен-3-ил, бензимидазол-1-ил, бензо[b]фуран-3-ил, 1,2-бензизокcазол-3-ил 1,2-бензизотиазол-3-ил или индазол-3-ил; R1 помимо прочего представляет собой алкильную или циклоалкильную группу; и R2 является водородом или низшим алкилом. Ланглоис и др. в заявке на патент Австралии AU-A 48729/93 в качестве лигандов, стимулирующих синтез мелатонина, описывают арилалкил(тио)амиды формулы 2 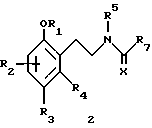 в которой R1 – водород или низший алкил; R2 – водород, галоген или низший алкил; R3 и R4 являются одинаковыми или разными группами, представляя среди прочего водород, галоген или низший алкил; R5 – водород или низший алкил; X – сера или кислород; и R7 представляет собой среди прочего низший алкил или алкилен. Однако в этих противопоставленных материалах не говорится о новых производных арилциклопропилметиламина, стимулирующих синтез мелатонина по настоящему изобретению. Ранее было представлено несколько соединений, содержащих структурные элементы, характерные для соединений по настоящему изобретению, хотя ни в одном из противопоставленных материалов не указывалось на стимулирование этими соединениями синтеза мелатонина. Матсуда и др. в международной заявке на патент WO 95/22521 описывают 1-фенил-2-(1-аминоалкил)-N, N-диэтилциклопропанкарбоксамиды формулы 3 в качестве антагонистов рецепторов N-метил-D-аспартата (NMDA), у которых R1 помимо прочего представляет собой C1-C5линейную насыщенную алифатическую группу, C1-C5линейную ненасыщенную алифатическую группу, разветвленную алифатическую группу или фенильную группу, которая может быть замещена одним-тремя заместителями, выбираемыми независимо друг от друга из группы, включающей галоген, C1-C4алкил, нитро, амино, гидрокси и C1-C4алкокси. 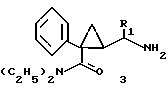 Производные 1,2-диарилциклопропана формулы 4 рассматриваются в заявке на патент NE 6701256 в качестве веществ, стимулирующих центральную нервную систему, 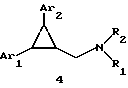 Ar1 и Ar2 представляют собой независимо или необязательно замещенный фенил; R1 помимо прочего представляет собой водород, низший алкил или ацил; R2 помимо прочего является алкилом, циклоалкилом или аралкилом. Настоящее изобретение относится к соединениям формулы I или II, которые стимулируют синтез мелатонина и, таким образом, могут использоваться для лечения вызываемых им заболеваний: 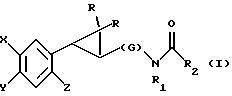 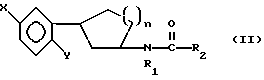 в которых X – галоген, водород, C1-4алкил или OR5, где R5 представляет собой водород, C1-4перфторалкил, C1-4фторалкил, C1-4пердейтероалкил, C1-20алкил, C4-20алкциклоалкил, C2-20карбонитрилалкил, C3-22карбоалкоксиалкил, C3-20алкенил, C3-20алкинил, C9-20аралкил, C9-20аралкенил, C9-20алкинил, C2-20гидроксиалкил, C8-20арилоксиалкил, C7-20пиридилалкил или C6-20пиррилалкил; Y – водород или галоген; z – водород, галоген, циано, арил, C7-20аралкил, C8-20арилкинил или C2-20алкамидо; R в обоих случаях представляет собой водород, галоген или C1-4алкил; G – двухвалентный метилен, этилен или C1-4алкметилен; R1 представляет собой водород, C1-4алкил или бензил; и R2 – C1-6алкил, C2-6алкенил, C3-6циклоалкил, C2-4алкоксиалкил, C1-4трифторметилалкил, C2-8алкилтиоалкил или NR3R4, где R3 и R4 независимо друг от друга выбирают из водорода и C1-4алкила, но R3 и R4 не могут быть одновременно водородом. Предметом настоящего изобретения являются соединения формулы I или II, способы их получения и применения и составы для лечения определенных заболеваний. Соединениями формулы I или II являются: 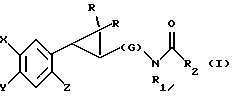 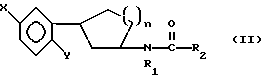 в которых X – галоген, водород, C1-4алкил или OR5, где R5 представляет собой водород, C1-4перфторалкил, C1-4фторалкил, C1-4пердейтероалкил, C1-20алкил, C4-20алкциклоалкил, C2-20карбонитрилалкил, C3-22карбоалкоксиалкил, C3-20алкенил, C3-20алкинил, C9-20аралкил, C9-20аралкенил, C9-20аралкинил, C2-20гидроксиалкил, C8-20арилоксиалкил, C7-20пиридилалкил или C6-20пиррилалкил; X – водород или галоген; Z – водород, галоген, циано, арил, C7-20аралкил, C8-20арилкинил или C2-20алкамидо; P в обоих случаях представляет собой водород, галоген или C1-4алкил; G – двухвалентный метилен, этилен или C1-4алкметилен; R1 – водород, C1-4алкил или бензил; и R2 – C1-6алкил, C2-6алкенил, C3-6циклоалкил, C2-4алкоксиалкил, C1-4трифторметилалкил, C2-8алкилтиоалкил или NR3R4, где R3 и R4 независимо друг от друга выбирают из водорода и C1-4алкила, но R3 и R4 не могут одновременно быть водородом. Следует отметить, что используемый здесь термин “галоген” означает фтор, хлор, бром и иод; термин “алкил” относится к насыщенным углеводородным радикалам с прямолинейной или разветвленной цепью; “фторалкил” означает монофторзамещенные насыщенные углеводородные радикалы с прямолинейной и разветвленной цепью; “алкенил” означает углеводородный радикал с прямолинейной и разветвленной цепью, содержащий углерод-углеродную двойную связь; “циклоалкил” означает насыщенные циклические углеводородные радикалы; “алкокси” означает алкильный радикал, присоединенный к молекуле с помощью атома кислорода; “алкилтиоалкил” означает алкильный радикал, присоединенный к другому с помощью атома серы; “арилоксиалкил” означает алкильный радикал, присоединенный к необязательно замещенной фенильной группе с помощью атома кислорода; “алкциклоалкил” означает алкильный радикал, присоединенный к насыщенному циклическому углеводородному радикалу; “карбонитрилалкил” означает алкильный радикал, присоединенный к нитрильному радикалу с помощью атома углерода; “карбоалкоксиалкил” означает алкильный радикал, присоединенный непосредственно к карбоалкоксильному радикалу; “гидроксиалкил” означает алкильный радикал, присоединенный к атому углерода с помощью атома кислорода; “пиридилалкил” означает пиридильный радикал, присоединенный непосредственно к конечному атому углерода алкильного радикала; “пиррилалкил” означает пиррильный радикал, присоединенный непосредственно к конечному атому углерода алкильного радикала; “трифторметилалкил” означает трифторзамещенную метильную группу, присоединенную непосредственно к алкильному радикалу; “перфторалкил” означает насыщенные фторуглеродные радикалы с прямолинейной и разветвленной цепью; “пердейтероалкил” означает насыщенные дейтероуглеродные радикалы с прямолинейной и разветвленной цепью; “циано” означает радикал, содержащий углерод-азотную тройную связь; “алкинил” означает углеродные радикалы с прямолинейной и разветвленной цепью, содержащие углерод-углеродную тройную связь; “аралкил”, “аралкенил” и “аралкинил” (или соответственно “арилалкил”, “арилалкенил” и “арилалкинил”) означают радикалы, в которых необязательно замещенная фенильная группа присоединена к конечному атому углерода соответственно алкильного, алкенильного или алкинильного радикала; “алкамидо” (или “алкиламидо”) относится к NC(O)-алкильным группам, содержащим указанное число атомов углерода; “алкметилен” (или “алкилметилен”) означает алкильный радикал, присоединенный непосредственно к метеновому радикалу. “Бензил” или “Bn” означает фенилметильную группу, -CH2-фенил. Фенильные группы, если они имеются, содержат заместители, выбираемые из группы, включающей водород, галоген, трифторметил и C1-4алкокси. Числа, указанные в виде подстрочных индексов после символа “C”, означают число атомов углерода в группе. На основании биологических тестов предпочтительными были признаны следующие соединения формулы I. Все эти соединения отличаются сродством связывания в отношении рецептора мелатонина человека при значениях IC50, равных 600 нм или меньше. Предпочтительными соединениями формулы I являются такие соединения, в которых R1 является водородом, R2 – C1-4алкилом, X и Z независимо друг от друга представляют водород или галоген, и X является OR5, где R5 – C1-20алкил, C3-20алкенил, C3-20алкинил и C9-20аралкил, аралкенил или аралкинил. Желательно, чтобы в радикале R5 отсутствовали атомы O, N и S. Особенно предпочтительны соединения, в которых R2 является C1-4алкилом. Ниже представлены предпочтительные соединения по настоящему изобретению: (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]-2- метоксиацетамид, (+)-(транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид, (-)-(транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]пропанамид, (транс)-N-[[2-(4-хлор-3-метоксифенил)циклопропил]метил]бутанамид, (-)-(транс)-N-[[2-(3-метоксифенил)циклопропил]метил]-2- метилпропанамид, (транс)-N-[[2-[3-(6-фенилгексил)окси]фенил]циклопропил]метил] бутанамид, (транс)-N-[[2-(2-бром-5-метоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]ацетамид, (-)-(транс)-N-[[2-(2,4-дибром-5-метоксифенил)циклопропил] метил] бутанамид, (транс)-N-[[2-(2-иод-5-метоксифенил)циклопропил]метил]бутанамид, (-)-(транс)-N-[[2-(2-иод-5-метоксифенил)циклопропил]метил] бутанамид, (транс)-N-[[2-[3-(гептилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[3-(2-пропенилокси)фенил]циклопропил]метил] бутанамид, (транс)-N-[[2-[3-[(7-фенилгептил)окси] фенил] циклопропил]метил] бутанамид, (транс)-N-[[2-(3-[(этоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-[(3-октилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[3-(нонилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[(3-децилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[(3-ундецилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[(3-додецилокси)фенил]циклопропил]метил]бутанамид, (транс)-N- [[2-[(2-фенилэтил)окси]фенил]циклопропил]метил] бутанамид, (транс)-N-[[2-[3-[3-(3-метоксифенил)пропокси] фенил] циклопропил] метил] бутанамид, (-)-(транс)-N-[[2-(5-метокси-2-(фенилэтинил)фенил)циклопроп-1-ил] метил] бутанамид, (транс)-N-[[3-(3-метоксифенил)-2,2-дифтор-1-циклопроп-1-ил] метил] бутанамид, (-)-(транс)-N-[[2-(3-метоксифенил)циклопроп-1-ил]метил]циклопропан карбоксамид, (-)-(транс)-N-[[2-[3-[3-(3-метоксифенил)пропокси] фенил] циклопроп-1-ил] метил]бутанамид, (-)-(транс)-N-[[2-(3-метоксифенил)циклопроп-1-ил] метил] – N’-метилмочевина, (-)-(транс)-N-[[2-(3-метоксифенил)циклопроп-1-ил]метил] пропанамид, (-)-(транс)-N-[[2-(3-метоксифенил)циклопроп-1- ил]метил]ацетамид, (-)-(транс)-3,3,3-трифтор-N-[[2-(3-метоксифенил) циклопроп-1-ил]-метил] пропанамид, (транс)-N-[[2-(3-[(3,7,11-триметилдодека-2,6,10-триен-1- ил)-окси]фенил] циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-[3-[(4-фенилбут-1-ил)окси]фенил]циклопроп-1-ил] метил]бутанамид, (транс)-N-[[2-[3-[(5-фенилпент-1-ил)окси] фенил] циклопроп-1-ил] метил)бутанамид, (транс)-N-[2-[(3-тридейтерометоксифенил)циклопроп-1-ил] метил]бутанамид, (транс)-N-[[2-[3-[(3-циклогексилпроп-1-ил)окси]фенил]циклопроп- 1-ил]метил]бутанамид, (транс)-N-[[2-[3-[(3-циклопентилпроп-1-ил)окси]фенил]циклопроп- 1-ил]метил]бутанамид, (транс)-N-[[2-[3-[2-[3-(трифторметил)фенил]этокси]фенил] циклопpoп-1-ил] метил]бутaнaмид, (транс)-N-[[2-[3-[[2-(3-метоксифенил)циклопроп-1- ил] метокси] фенил] циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(4-хлор-3-метоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]-2- метилтиоацетамид, (транс)-N-[[2-[3-[3-(3-метоксифенил)пропокси] фенил] циклопропил] метил] бутанамид, (-)-(транс)-N-[[2-(4-иoд-3-мeтoкcифeнил)циклoпpoп-1- ил] метил]-бутанамид, (-)-(транс)-N-[[2-(5-метокси-2 (фенилэтил)циклопроп-1-ил]метил] бутанамид, (-)-(транс)-N-[[2-(4-метокси-[1,1′-бифенил] -2-ил- циклопроп-1-ил]метил] бутанамид, (-)-(транс)-N-[[2-(4-метокси-4′-(трифторметил)[1,1′- бифенил]-2-ил]циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(3-бромфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(3-бромфенил)циклопроп-1-ил]метил]ацетамид, (транс)-N-[[2-(3-бромфенил)циклoпpoп-1-ил]метил]пpопанамид, (-)-(транс)-N-[[2-[2-иод-5-[3-(3-метоксифенил) пpoпoкcи]фенил]циклопроп-1-ил]метил]бутaнaмид, (транс)-N-[[2-[3-[(3-фенилпpоп-1-ил)окси] фенил] циклопроп-1-ил]метил] бутанамид, (транс)-N-[[2-[3[(3-феноксипроп-1-ил)окси] фенил] циклопроп-1-ил]метил] бутанамид, (транс)-N-[[2-[3-[(3-димeтилoктa-2,6-диен-1-ил) окси] фенил]циклoпpoп-1-ил]метил]бутанамид, (транс)-N-[[2-[3-(5-метилгексилокси)фенил] циклопроп- 1-ил]метил]бутанамид, (транс)-N-[[2-[3-(4-метил-3-пентен-1-ил- окси)фенил] циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-[3-[(3-циклогексилбут-1-ил)окcи] фенил]циклопроп- 1-ил]метил]бутанамид, (транс)-N-[[2-[3-[2-[2-(трифторметил)фенил]этокси]фенил] циклопроп-1-ил] метил]бутанамид, (транс)-N-[[2-[3-[2-(3-фторфенил) этoкcи]фенил]циклопроп-1-ил]-метил]бутанамид, (транс)-N-[[2-[3-[3-(4-метоксифенил)пропокси] фенил] циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-[3-[2-(2-фторфенил) этокcи]фенил]циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-[3-[2-(2-метоксифенил) этокси]фенил]циклопроп-1-ил]метил] бутанамид, (-)-(транс)-N-[[2-(3-фторфенил)циклопропил]метил]бутанамид, (-)-(транс)-N-[[2-(3-фторфенил)циклопроп-1-ил]метил] 2-метил-пропанамид, (-)-(транс)-N-[[2-(2-бром-5-фторфенил)циклопроп-1- ил]метил]бутанамид, (-)-(транс)-N-[[2-(4-бром-3-фторфенил)циклопроп-1-ил] метил]бутанамид, (-)-(транс)-N-[[2-(5-фтор-2-иодфенил)циклопроп-1-ил] метил]бутанамид, (-)-(транс)-N-[[2-(3-фтор-4-иодфенил) циклопроп-1-ил]метил]бутанамид, (транс)-N-[[3-(3-метокcифенил)-2,2-дифтоp-1-циклопроп-1- ил]метил]бутанамид, (транс)-N-[[3-(3-метоксифенил)-2,2-дифтор-1-циклопроп- 1-ил] метил]-2-метилпропанамид, (транс)-N-[[2-(3-бромфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(3-бромфенил)циклoпpoп-1-ил]метил]ацетамид, (транс)-N-[[2-(3-метилфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(3-бромфенил)циклопроп-1-ил]метил]пропанамид, (транс)-N-[[2-(3-метилфенил)циклопроп-1-ил]метил]- 2-метилпропанамид, (транс)-N-[[2-(3-метилфенил)циклопроп-1-ил]метил]ацетамид, (транс)-N-[[2-(3-хлорфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(3-хлорфенил)циклопроп-1-ил]метил]пропанамид, (транс)-N-[[2-(3-хлорфенил)циклопроп-1-ил]метил]ацетиамид, (транс)-N-[[2-(3-хлорфенил)циклопроп-1-ил]метил] циклопропанкарбоксамид, (транс)-N-[[2-(2,5-дифторфенил)циклопроп-1-ил]метил]ацетамид (транс)-N-[[2-(2,5-дифторфенил)циклопроп-1-ил]метил]пропанамид, (транс)-N-[[2-(2,5-дифторфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(2,5-дифторфенил)циклопроп-1-ил] метил] циклопропанкарбоксамид, (транс)-N-[[2-[3-(пентафторэтил)фенил]циклопроп-1-ил]метил] бутанамид, (-)-(транс)-N-[(2-фенилциклопроп-1-ил)метил]бутанамид, (транс)-N-[(2-фенилциклопроп-1-ил)метил]ацетамид, (транс)-N-[(2-фенилциклопроп-1-ил)метил]бутанамид, (транс)-N-[2-[(3-этилфенил)циклопроп-1-ил]метил]ацетамид, (транс)-N-[2-[(3-этилфенил)циклопроп-1-ил]метил]пропанамид, (транс)-N-[2-[(3-этилфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[2-[(3-этилфенил)циклопроп-1-ил]метил] циклопропанкарбоксамид, (транс)-N-[[2-[3-(трифторметил)фенил]циклопроп-1-ил]метил] бутанамид, (транс)-N-[[2-(3-трифторметил)фенил] циклопроп-1-ил] метил]-2- метилпропанамид, (-)-(транс)-N-[[2-(2-бром-5-фторфенил)циклопроп-1-ил]метил] бутанамид, (транс)-N-[[2-(3-метилфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[2-[(3-этилфeнил)циклопроп-1-ил]метил]бутанамид, (цис)-N-[3-метоксифенил)циклогексил]ацетамид, (цис)-N-[3-метоксифенил)циклогексил]-2-метил-пропанамид, (цис)-N-[3-метоксифенил)циклогексил]бутанамид, (цис)-N-этил-N’-[3-метоксифенил)циклогексил]мочевина, N-[3-метоксифенил)циклопентил]бутанамид. Получение соединений формулы I. Соединения формулы I можно получить в соответствии со следующими схемами реакций (способы получения 1-8). Группы R, R1, R2, R3, R4, X, Y, Z, G и R5 имеют вышеуказанные значения. Способ получения 1 (см. схему 1). В полученных соединениях формулы I R1 и R – водород, G – метилен, а другие заместители имеют вышеуказанные значения. Способ получения 2 (см. схему 2). В соединении формулы I, полученном в соответствии со способом получения 2, группа R2 – алкил, NHR3 или NR3R4 (вышеуказанные значения), G – метилен; R1 и R – водород. Способ получения 3 (см. схему 3). В соединениях формулы I, полученных в соответствии со способом получения 3, R1, R, Y и Z – водород, а G – метилен. Способы получения 4, 5 (см. схему 4). В соединениях формулы I, полученных в соответствии со способом получения 4, G – метилен; Y, R1 и R – водород, а Z – Br или I. В соединениях формулы I, полученных в соответствии со способом получения 5, Y и Z – Br или I, G – метилен, а R1 и R – водород. Способ получения 6 (см. схему 5). В соединениях формулы I, полученных в соответствии со способом получения 6, R1 – C1-4алкил или бензил, G – метилен, R-Н, и R2, X, Y, Z имеют вышеуказанные значения. Способы получения 7,8 (см. схему 6). В соединениях формулы I, полученных в соответствии со способами получения 7 и 8, G – метилен, X – OR5, R1 и R – водород, а Y, Z, R2 и R5 имеют вышеуказанные значения. Способ получения 9 (см. схему 7). В соединениях формулы I, полученных в соответствии со способом получения 9, X – OCH3, G – метилен, Z – фенилалкил или гидроциннамил, a R1, R и Y – водород. Способы получения 10, 11 (см. схему 8). В соединениях формулы I, полученных в соответствии со способом получения 10, X – OCH3, G – метилен, Z – циано, a R1, R и Y – водород. В соединениях формулы I, полученных в соответствии со способом получения 11, X – OCH3, G – метилен, Z – фенил, a R1, R и Y – водород. Способ получения 12 (см. схему 9). В соединениях формулы I, полученных в соответствии со способом получения 12, X – OCH3, R – фтор, G – метилен, a Z, R1 и Y – водород. Способ получения 13 (см. схему 10). В соединениях формулы I, полученных в соответствии со способом получения 13, X – OCH3, Z – алкамидо, G – метилен, a R, R1 и Y водород. Способ получения 14 (см. схему 11). В соединениях формулы I, полученных в соответствии со способом получения 14, X – OCH3, G – алкметилен, a R, R1, Z и Y – водород. Способ получения 15 (см. схему 12). В соединениях формулы I, полученных в соответствии со способом получения 15, X – 2-гидроксиэтил, G – метилен, a R, R1, Z и Y – водород. Способ получения 16 (см. схему 13). В соединениях формулы I, полученных в соответствии со способом получения 16, X – OCH3, G – этилен, a R, R1, Z и Y – водород. Способ получения 17 (см. схему 14). В соединениях формулы 1, полученных в соответствии со способом получения 17, X – OCH3, G – метилен, R – метил, а R1, Z, и Y – водород. Получение соединений формулы II. Соединения формулы II получали по методу, описанному в способе получения 18. Металлорганическое соединение (1), например реактив Гриньяра или литиевый реагент, конденсировали с соответствующим циклоалкеноном (2) в присутствии соли меди (1), такой как CuBr, CuI, CuBr  Me2S или подобной соли, с образованием 3-арил-циклоалканона (3). Альтернативно соединение 1 может быть конденсировано с 3-алкокси-циклоалканоном (4), в результате чего после ацетализации, каталитической гидрогенизации и удаления защитной группы образуется соединение 3. Приемлемыми катализаторами для этого являются палладированный уголь и подобные катализаторы. Циклоалканон, представляющий собой соединение 3, можно превратить в соединения формулы I с помощью стандартных способов, таких как конденсация с гидроксиамином, с последующей каталитической гидрогенизацией и ацилированием. Приемлемыми катализаторами для этого являются скелетный никелевый катализатор гидрирования, палладированный уголь и подобные катализаторы. Приемлемыми ацилирующими реагентами являются галогениды карбоновой кислоты, ангидриды, ацилимидазолы, алкилизоцианаты и карбоновые кислоты в присутствии конденсирующих агентов, таких как карбонилимидазол, карбодиимиды и другие.
Способ получения 18 (см. схему 15).
Если специально не указано, все заместители в соединениях формулы I, полученных в соответствии со способами получения 1-17, могут иметь любые значения, приведенные выше для формулы I.
Получение соединений формулы I включает следующие стадии, описываемые ниже для каждого из способов 1-17.
Способ получения 1 (реакции a-d).
(i) В результате обработки выпускаемых промышленностью альдегидов формулы II гидридом натрия и цианометилфосфонатом с последующим циклопропанированием с использованием метилида диметилоксосульфония были получены промежуточные циклопропаннитрилы формулы III.
(ii) В результате каталитического восстановления нитрилов формулы III водородом в присутствии оксида платины с последующим ацилированием полученного амина соответствующим ацилхлоридом были получены соединения формулы I, в которой 1 является водородом.
Способ получения 2 (реакции a-g).
(i) В результате обработки выпускаемых промышленностью коричных кислот формулы IV тионилхлоридом, нагреваемым с обратным холодильником, с последующим ацилированием хлористоводородным N,O-диметилгидроксиламином в присутствии пиридина были получены ненасыщенные N-метил, N-метоксиамиды, которые циклопропанировали с использованием метилида диметилоксофосфония, в результате чего были получены промежуточные соединения формулы V.
(ii) В результате восстановления амидов формулы V с помощью алюмогидрида лития были получены альдегиды формулы VI.
(iii) Альдегиды формулы VI превращали в оксимы с помощью хлористоводородного гидроксиламина и гидроксида натрия и восстанавливали гидридом литийаммония, в результате чего были получены амины формулы VII.
(iv) Соединения формулы VII ацилировали с помощью соответствующих ацилирующих агентов, таких как ацилхлориды, карбамоилхлориды или изоцианаты, с образованием соединений формулы I, в которой R1 – водород, а R2 – алкил, NR3R4 или NHR3, как указывалось выше.
Способ получения 3 (реакции a-e).
(i) В результате восстановления известных гомохиральных сультамов формулы VIII алюмогидридом лития были получены спирты формулы IX в виде отдельных энантиомеров.
(ii) В результате превращения спиртов формулы IX в соответствующие сложные эфиры метансульфоновой кислоты с помощью метансульфонилхлорида и триэтиламина с последующим образованием азида при использовании азида натрия в диметилформамиде и восстановления алюмогидридом лития были получены энантиочистые амины формулы X.
(iii) Амины формулы X ацилировали соответствующими ацилхлоридами с образованием соединений формулы I, в которой R1 – водород, Y и Z – водород.
Способ получения 4.
Амиды формулы XI, полученные в соответствии со способами получения I, II или III, обрабатывали ацетатом таллия (III) и 1 эквивалентом брома или иода с образованием соединений формулы I, в которой Y – водород, Z – бром или иод, а R1 – водород.
Способ получения 5.
Амиды формулы XI, полученные в соответствии со способами получения I, II или III, обрабатывали ацетатом таллия (III) и 2 или более эквивалентами брома или иода с образованием соединений формулы I, в которой Y и Z – бром или иод, а R1 – водород.
Способ получения 6.
Амиды формулы XII, полученные в соответствии со способами получения I, II или III, обрабатывали гидридом натрия и соответствующим алкил- или бензилгалогенидом с образованием соединений формулы I, в которой R1 является C1-4алкилом или бензилом.
Способ получения 7.
(i) Амиды формулы XIII, полученные в соответствии со способами получения I, II или III, обрабатывали трибромидом бора с образованием соединений формулы XIV.
(ii) Амиды формулы XIV обрабатывали основанием, а полученные алкоксиды алкилировали соответствующими алкилиодидами или алкилбромидами с образованием соединений формулы I, в Me2S или подобной соли, с образованием 3-арил-циклоалканона (3). Альтернативно соединение 1 может быть конденсировано с 3-алкокси-циклоалканоном (4), в результате чего после ацетализации, каталитической гидрогенизации и удаления защитной группы образуется соединение 3. Приемлемыми катализаторами для этого являются палладированный уголь и подобные катализаторы. Циклоалканон, представляющий собой соединение 3, можно превратить в соединения формулы I с помощью стандартных способов, таких как конденсация с гидроксиамином, с последующей каталитической гидрогенизацией и ацилированием. Приемлемыми катализаторами для этого являются скелетный никелевый катализатор гидрирования, палладированный уголь и подобные катализаторы. Приемлемыми ацилирующими реагентами являются галогениды карбоновой кислоты, ангидриды, ацилимидазолы, алкилизоцианаты и карбоновые кислоты в присутствии конденсирующих агентов, таких как карбонилимидазол, карбодиимиды и другие.
Способ получения 18 (см. схему 15).
Если специально не указано, все заместители в соединениях формулы I, полученных в соответствии со способами получения 1-17, могут иметь любые значения, приведенные выше для формулы I.
Получение соединений формулы I включает следующие стадии, описываемые ниже для каждого из способов 1-17.
Способ получения 1 (реакции a-d).
(i) В результате обработки выпускаемых промышленностью альдегидов формулы II гидридом натрия и цианометилфосфонатом с последующим циклопропанированием с использованием метилида диметилоксосульфония были получены промежуточные циклопропаннитрилы формулы III.
(ii) В результате каталитического восстановления нитрилов формулы III водородом в присутствии оксида платины с последующим ацилированием полученного амина соответствующим ацилхлоридом были получены соединения формулы I, в которой 1 является водородом.
Способ получения 2 (реакции a-g).
(i) В результате обработки выпускаемых промышленностью коричных кислот формулы IV тионилхлоридом, нагреваемым с обратным холодильником, с последующим ацилированием хлористоводородным N,O-диметилгидроксиламином в присутствии пиридина были получены ненасыщенные N-метил, N-метоксиамиды, которые циклопропанировали с использованием метилида диметилоксофосфония, в результате чего были получены промежуточные соединения формулы V.
(ii) В результате восстановления амидов формулы V с помощью алюмогидрида лития были получены альдегиды формулы VI.
(iii) Альдегиды формулы VI превращали в оксимы с помощью хлористоводородного гидроксиламина и гидроксида натрия и восстанавливали гидридом литийаммония, в результате чего были получены амины формулы VII.
(iv) Соединения формулы VII ацилировали с помощью соответствующих ацилирующих агентов, таких как ацилхлориды, карбамоилхлориды или изоцианаты, с образованием соединений формулы I, в которой R1 – водород, а R2 – алкил, NR3R4 или NHR3, как указывалось выше.
Способ получения 3 (реакции a-e).
(i) В результате восстановления известных гомохиральных сультамов формулы VIII алюмогидридом лития были получены спирты формулы IX в виде отдельных энантиомеров.
(ii) В результате превращения спиртов формулы IX в соответствующие сложные эфиры метансульфоновой кислоты с помощью метансульфонилхлорида и триэтиламина с последующим образованием азида при использовании азида натрия в диметилформамиде и восстановления алюмогидридом лития были получены энантиочистые амины формулы X.
(iii) Амины формулы X ацилировали соответствующими ацилхлоридами с образованием соединений формулы I, в которой R1 – водород, Y и Z – водород.
Способ получения 4.
Амиды формулы XI, полученные в соответствии со способами получения I, II или III, обрабатывали ацетатом таллия (III) и 1 эквивалентом брома или иода с образованием соединений формулы I, в которой Y – водород, Z – бром или иод, а R1 – водород.
Способ получения 5.
Амиды формулы XI, полученные в соответствии со способами получения I, II или III, обрабатывали ацетатом таллия (III) и 2 или более эквивалентами брома или иода с образованием соединений формулы I, в которой Y и Z – бром или иод, а R1 – водород.
Способ получения 6.
Амиды формулы XII, полученные в соответствии со способами получения I, II или III, обрабатывали гидридом натрия и соответствующим алкил- или бензилгалогенидом с образованием соединений формулы I, в которой R1 является C1-4алкилом или бензилом.
Способ получения 7.
(i) Амиды формулы XIII, полученные в соответствии со способами получения I, II или III, обрабатывали трибромидом бора с образованием соединений формулы XIV.
(ii) Амиды формулы XIV обрабатывали основанием, а полученные алкоксиды алкилировали соответствующими алкилиодидами или алкилбромидами с образованием соединений формулы I, вкоторой X – OR5 и R1 – водород. Способ получения 8. (i) Амиды формулы XIII, полученные в соответствии со способами получения I, II или III, обрабатывали трибромидом бора с образованием соединений формулы XIV. (ii) Амиды формулы XIV добавляли к полученному раствору пригодного спирта, трифенилфосфина и диэтилазодикарбоксилата с образованием соединений формулы I, в которой X – OR5 и R1 – водород. Способ получения 9. (i) Амиды формулы I, в которой Z является Br или I, полученные в соответствии со способом получения IV, соединяли с фенилацетиленом под слоем тетракис(трифенилфосфин) палладия (0) с образованием соединений формулы I, в которой Z является фенилацетиленом. (ii) Амиды формулы I, полученные выше, гидрировали над катализатором в виде палладированного угля с образованием соединений формулы I, в которой Z является гидроциннамилом. Способ получения 10. (i) Амиды формулы I, в которой Z является иодом, полученные в соответствии со способом получения IV, нагревали с обратным холодильником в пиридине в присутствии цианида меди (I) с образованием соединений формулы I, в которой Z является циано. Способ получения 11. (i) Амиды формулы I, в которой Z является иодом, полученные в соответствии со способом получения IV, подвергали взаимодействию с осуществлением реакции сочетания по методу Мицонобу в присутствии водного раствора гидроксида бария, фенилборной кислоты, тетракис(трифенилфосфин) палладия (0) и диметоксиэтана с образованием соединений формулы I, в которой Z является фенилом. Способ получения 12 (реакции a-h). (i) В результате восстановления натриевым боргидридом 3-метоксикоричной кислоты (XV) с последующей обработкой иодом и хлористоводородной кислотой был получен аллиловый спирт формулы XVI. (ii) Соединения формулы XVI ацилировали уксусным ангидридом в пиридине с образованием аллилацетата формулы XVII. (iii) Аллилацетат формулы XVII циклопропанировали путем обработки хлордифторацетатом натрия в диглиме, нагреваемом с обратным холодильником, в результате чего был получен дифторциклопропан формулы XVIII. (iv) Дифторциклопропан формулы XVIII обрабатывали гидроксидом калия в метаноле с образованием соответствующего спирта формулы XIX. (v) Спирт формулы XIX превращали в мезилат путем обработки метансульфонилхлоридом в дихлорметане в присутствии триэтиламина. Мезилат вываривали вместе с диметилформамидом и обрабатывали азидом натрия с образованием соответствующего азида. Этот азид восстанавливали с помощью алюмогидрида лития с образованием амина формулы XX. (vi) Амин формулы XX превращали в амиды формулы I, в которой R является фтором, путем ацилирования ацилхлоридом в присутствии триэтиламина. Способ получения 13 (реакции a, b). (i) Оксим формулы XXI, полученный в соответствии со способом получения II, превращали в диамин формулы XXII путем каталитической гидрогенизации на палладированном угле в уксусной кислоте. (ii) Диамин формулы XXII диацилировали путем обработки двумя эквивалентами ацилхлорида в присутствии триэтиламина с образованием амидов формулы I, в которой Z является алкамидо. Способ получения 14 (реакции a-d). (i) Спирт формулы IX, полученный в соответствии со способом получения III, окисляли по методу Сверна, в результате чего был получен карбоксальдегид, который обрабатывали бромидом метилмагния с образованием смеси диастереометов. Эпимеры отделяли посредством хроматографии, что позволило получить чистые спирты формулы XXIII. (ii) Спирт формулы XXIII превращали в фталимид формулы XXIV путем обработки фталимидом, диэтилазодикарбоксилатом и трифенилфосфином. (iii) Фталимид формулы XXIV обрабатывали гидразином в этаноле с образованием амина формулы XXV. (iv) В результате ацилирования амина формулы XXV ацилхлоридом в присутствии триэтиламина были получены соединения формулы I, в которой 6 является алкметиленом. Способ получения 15. (i) Фенол формулы XIV, полученный в соответствии со способом получения VII, превращали в соль натрия путем обработки гидроксидом натрия и нагревания с обратным холодильником вместе с этиленкарбонатом в толуоле, что позволило получить амиды формулы I, в которой R5 является 2-гидроксиэтилом. Способ получения 16 (реакции a-c). (i) Спирт формулы IX, полученный в соответствии со способом получения III, обрабатывали метансульфонилхлоридом в присутствии триэтиламина, в результате чего был получен мезилат, который затем превращали в нитрил формулы XXVI путем обработки цианидом натрия в диметилформамиде. (ii) Нитрил формулы XXVI восстанавливали алюмогидридом лития в тетрагидрофуране с образованием амина формулы XXVI. (iii) Амин формулы XXVII ацилировали хлорангидридом в присутствии триэтиламина с образованием амидов формулы I, в которой G является этиленом. Способ получения 17 (реакции a-e). (i) Выпускаемый промышленностью сложный этиловый эфир 3-метоксикоричной кислоты циклопропанировали с помощью илида, полученного из иодида изопропилтрифенилфосфония и бутиллития с образованием циклопропана формулы XXVI. (ii) Циклопропан формулы XXVI превращали в спирт формулы XXIX путем восстановления алюмогидридом лития в тетрагидрофуране. (iii) Спирт формулы XXIX обрабатывали метансульфонилхлоридом и триэтиламином в дихлорметане с образованием мезилата, который затем превращали в азид формулы XXX путем обработки азидом натрия в диметилформамиде. (iv) Азид формулы XXX восстанавливали алюмогидридом лития в тетрагидрофуране с образованием амина формулы XXXI. (v) Амин формулы XXXI ацилировали ацилгалогенидом и триэтиламином с образованием амидов формулы I, в которой R является метилом. Реагенты, растворители и условия реакции, используемые при выполнении вышеописанных подготовительных стадий, хорошо известны специалистам в области органического синтеза. Все стадии представляют собой обычные органические реакции, многократно описанные в научной литературе. Эти подготовительные методы могут быть изменены с целью получения других соединений, входящих в объем настоящего изобретения, но отдельно не рассматриваемых. Кроме того, соединения формулы I включают все фармацевтически приемлемые сольваты, причем предпочтительными сольватами являются гидраты. В объем настоящего изобретения входят также геометрические и оптические изомеры, например смеси энантиомеров, отдельные энантиомеры и диастереомеры, которые образуются в результате структурной асимметрии определенных соединений данного ряда. Предпочтение, как правило, отдается транс-циклопропановым стереоизомерам. Разделение или стереоспецифический синтез отдельных изомеров производится с помощью различных методов, которые хорошо известны специалистам в этой области. Это изобретение далее включает меченные радиоактивным изотопом соединения, рассмотренные выше, в частности соединения, меченные радиоактивным иодом, например I1232, I123, I125 или I131; такие меченные радиоактивным изотопом соединения используются в качестве определенных высокоаффинных рецепторов и, таким образом, могут применяться в анализах связывания рецепторов, авторадиографических исследованиях и в других in vitro и in vivo биологических тестах, которые выполняются для фармакологического изучения новых средств, стимулирующих синтез мелатонина. В приведенном ниже разделе “Описание предпочтительных вариантов осуществления настоящего изобретения” дается более подробное описание синтеза соединений формулы I и промежуточных соединений формул II-XXXI. Соединения по настоящему изобретению характеризуются сродством с рецепторами эндогенного гормона шишковидного тела, мелатонином, как было установлено в результате анализа связывания рецепторов, и являются его агонистами, о чем свидетельствуют результаты функционального анализа. Ниже описываются биологические тесты. Как указывалось выше, мелатонин имеет непосредственное отношение к регулированию разных биологических ритмов и оказывает биологическое действие в результате взаимодействия с определенными рецепторами. Известно, что введение агонистов мелатонина является весьма полезным при лечении связанных с ним различных заболеваний. Такими заболеваниями являются депрессия, нарушение суточного ритма организма, синдром смещения времени наибольшей работоспособности, нарушения сна, глаукома, некоторые половые расстройства, рак, нарушения иммунной и нейроэндокринной систем. Систематическое введение соединений формулы I может производиться по схеме лекарственного лечения самим мелатонином. Дозировка и схема лекарственного лечения определяются лечащим врачом с учетом таких факторов, как возраст, пол и физическое состояние больного, способ введения и характер заболевания. Можно использовать пероральный, чрескожный, подкожный, внутривенный, внутримышечный, ректальный, транс-буккальный, назальный и глазной способы введения. Одно или несколько соединений по настоящему изобретению смешивали с фармацевтически приемлемыми количествами одного или нескольких известных фармацевтических наполнителей, в результате чего получали композицию, предназначенную для введения желаемым способом. Как правило, такие составы содержат один или несколько носителей или разбавителей. Приемлемыми носителями являются твердые, полутвердые и жидкие вещества, которые способны смешиваться или совместимы с активным агентом (агентами). Подходящими носителями являются лактоза, декстроза, сахароза, сорбит, маннит, крахмалы, аравийская камедь, фосфат кальция, альгиниты, трагант, желатин, силикат кальция, микрокристаллическая целлюлоза, поливинилпирролидон, целлюлоза, вода, сироп, метилцеллюлоза, метил- и пропилгидроксибензоаты, тальк, стеарат магния, минеральное масло и другие. Возможно применение смесей. Другими полезными наполнителями являются смазки, увлажнители, гелеобразующие вещества, эмульгаторы, антикоагулянты, красители, ароматизаторы, высушивающие вещества и другие. Возможно применение смесей. Как правило, композиции, включающие соединения по настоящему изобретению, содержат 0,10-10% активного вещества и 99,90-90% или другое приемлемое количество наполнителя. Дозировка определяется лечащим врачом с учетом состояния больного. Однако суточные дозы от 0,1 мг до 100 мг оказываются полезными для лечения нарушений сна, циркадного ритма и других заболеваний. Способы лечения с использованием соединений по настоящему изобретению включают стадию (стадии) введения одной или нескольких доз указанного соединения больному, предпочтительно млекопитающему, например человеку, нуждающемуся в таком лечении. Соединения по настоящему изобретению, способы их получения и биологическое действие станут понятнее после рассмотрения следующих примеров, которые приводятся для иллюстрации и никоим образом не ограничивают объем настоящего изобретения. В следующих примерах температуры выражены в градусах шкалы Цельсия (oC), температуры плавления не скорректированы. Спектральные характеристики протонного ядерного магнитного резонанса (ЯМР) относятся к химическим сдвигам (  ) выраженным в величинах м.д., по сравнению с тетраметилсиланом, используемым в качестве эталона. Относительная площадь, указанная для сигналов ЯМР при различных химических сдвигах, соответствует числу атомов водорода определенного типа в молекуле.
Мультиплетность сигналов представлена как широкий синглет, синглет, триплет или мультиплет. Спектры ЯМР получены при использовании растворов соединений в дейтеро-диметилсульфоксиде (DMSO6) или дейтеро-хлороформе (CDCl3). Описания инфракрасных спектров включают только числа абсорбционных волн (см-1), позволяющие идентифицировать функциональные группы; определения инфракрасного спектра производились с использованием в качестве разбавителя бромистого калия (KBr). Результаты элементных анализов даны в весовых процентах.
Ниже приводятся примеры, подробно описывающие получение типичных соединений формулы I и синтезированных промежуточных соединений. Специалистам в этой области хорошо известно, что в результате замены используемых веществ и способов можно получить другие соединения, описываемые в настоящем изобретении. Приведенное выше описание изобретения и нижеследующие примеры позволяют полностью осуществить настоящее изобретение.
Примеры.
В примерах 1-139 описывается получение и отличительные особенности соединений формулы I. В примерах 140-144 представлена аналогичная информация для соединений формулы II.
Пример 1 (способ получения 1).
Получение (транс)-N-[[2-(2-фтор-5-метоксифенил)-циклопропил] метил]-2-метилпропанамида.
Стадия i.
(a) (транс)-3-(2-фтор-5-метоксифенил)-2-пропеннитрил.
К суспензии NaH (6,90 г, 60% дисперсия в минеральном масле, 173 ммоля) в тетрагидрофуране (500 мл), находившейся при 0oC, по каплям добавляли диэтилцианометилфосфонат (30,10 г, 170 ммолей). Вслед за этим по каплям добавляли раствор 2-фтор-5-метоксибензальдегида (24,5 г, 159 ммолей) в тетрагидрофуране (50 мл). Полученную суспензию оставляли для нагревания до комнатной температуры. Через 18 часов добавляли воду (200 мл) и экстрагировали полученный раствор с помощью EtOAc. Органические фракции соединяли, промывали рассолом, сушили над MgSO4 и концентрировали с образованием белого воскообразного твердого вещества. Это вещество очищали путем перегонки по методу Кюгельрора, что позволило получить указанное в заголовке соединение, 24,3 г (86%), температура плавления 56-57oC; ) выраженным в величинах м.д., по сравнению с тетраметилсиланом, используемым в качестве эталона. Относительная площадь, указанная для сигналов ЯМР при различных химических сдвигах, соответствует числу атомов водорода определенного типа в молекуле.
Мультиплетность сигналов представлена как широкий синглет, синглет, триплет или мультиплет. Спектры ЯМР получены при использовании растворов соединений в дейтеро-диметилсульфоксиде (DMSO6) или дейтеро-хлороформе (CDCl3). Описания инфракрасных спектров включают только числа абсорбционных волн (см-1), позволяющие идентифицировать функциональные группы; определения инфракрасного спектра производились с использованием в качестве разбавителя бромистого калия (KBr). Результаты элементных анализов даны в весовых процентах.
Ниже приводятся примеры, подробно описывающие получение типичных соединений формулы I и синтезированных промежуточных соединений. Специалистам в этой области хорошо известно, что в результате замены используемых веществ и способов можно получить другие соединения, описываемые в настоящем изобретении. Приведенное выше описание изобретения и нижеследующие примеры позволяют полностью осуществить настоящее изобретение.
Примеры.
В примерах 1-139 описывается получение и отличительные особенности соединений формулы I. В примерах 140-144 представлена аналогичная информация для соединений формулы II.
Пример 1 (способ получения 1).
Получение (транс)-N-[[2-(2-фтор-5-метоксифенил)-циклопропил] метил]-2-метилпропанамида.
Стадия i.
(a) (транс)-3-(2-фтор-5-метоксифенил)-2-пропеннитрил.
К суспензии NaH (6,90 г, 60% дисперсия в минеральном масле, 173 ммоля) в тетрагидрофуране (500 мл), находившейся при 0oC, по каплям добавляли диэтилцианометилфосфонат (30,10 г, 170 ммолей). Вслед за этим по каплям добавляли раствор 2-фтор-5-метоксибензальдегида (24,5 г, 159 ммолей) в тетрагидрофуране (50 мл). Полученную суспензию оставляли для нагревания до комнатной температуры. Через 18 часов добавляли воду (200 мл) и экстрагировали полученный раствор с помощью EtOAc. Органические фракции соединяли, промывали рассолом, сушили над MgSO4 и концентрировали с образованием белого воскообразного твердого вещества. Это вещество очищали путем перегонки по методу Кюгельрора, что позволило получить указанное в заголовке соединение, 24,3 г (86%), температура плавления 56-57oC;спектр ЯМР 1H (300 МГц, CDCl3)  : 3.79 (с,3H), 5.98 (д, J = 16.1 Гц, 1H), 6.85-6.90 (м,1H), 6.91-6.93 (м,1H), 6.99 (т,J= 6.5 Гц,1H), 7.43 (д, J = 16.1 Гц,1H); : 3.79 (с,3H), 5.98 (д, J = 16.1 Гц, 1H), 6.85-6.90 (м,1H), 6.91-6.93 (м,1H), 6.99 (т,J= 6.5 Гц,1H), 7.43 (д, J = 16.1 Гц,1H);масс-спектр (изобутан-DCl) m/e 177. Результаты анализа, высчитанные для C10H8NOF: C 67.79, H 4.55, N 7.91; обнаружено: C 67.41, H 4.44, N 7.86. (b) (транс)-2-(2-фтор-5-метоксифенил)циклопропанкарбонитрил. К суспензии NaH (1,73 г, 71 ммоля) в диметилсульфоксиде (40 мл) небольшими порциями добавляли твердый йодистый триметилсульфоксоний (15,9 г, 72 ммоля). После прекращения вспенивания (40 минут) по каплям добавляли раствор (транс)-3-(2-фтор-5-метоксифенил)-2-пропеннитрила (4,26 г, 24 ммоля) в диметилсульфоксиде (10 мл), поддерживая температуру в интервале 35 -40oC. Эту смесь перемешивали в течение 18 часов при комнатной температуре, после чего по каплям добавляли насыщенный раствор NH4Cl (100 мл) и экстрагировали этилацетатом. Органические фракции собирали, промывали рассолом, сушили (K2CO3) и концентрировали с образованием красного масла, которое очищали посредством хроматографии на колонке из силикагеля (смесь CH2Cl2 и гексана в соотношении 60: 40), в результате чего было получено указанное в заголовке соединение в виде светлого масла (46%); спектр ЯМР 1H (300 МГц, CDCl3)  : 0.82-0.88 (м,2H), 1.65-1.75 (м,1H), 2.55-2.62 (м,1H), 3.75 (с,3H), 6.50-6.55 (м,1H), 6.60- 6.70 (м,1H), 6.92 (т, J=6.5 Гц,1H).
Стадия ii.
(c) (транс)-2-(2-фтор-5-метоксифенил)циклопропанметанамин.
Суспензию (транс)-2-(2-фтор-5-метоксифенил)циклопропанкарбонитрила (5,0 г, 26 ммолей), PtO2 (200 мг) и CHCl3 (10 мл) в этиловом спирте (65 мл) гидрировали в аппарате Парра в течение 3 часов при давлении 3,85 ат. Катализатор фильтровали через пробку из целита, а растворители удаляли. Полученную хлористоводородную соль распределяли между CH2Cl2 и 10% K2CO3. Органический слой отделяли, сушили над K2CO3 и концентрировали с образованием указанного в заголовке соединения в виде свободного амина, 3,8 г (74%); : 0.82-0.88 (м,2H), 1.65-1.75 (м,1H), 2.55-2.62 (м,1H), 3.75 (с,3H), 6.50-6.55 (м,1H), 6.60- 6.70 (м,1H), 6.92 (т, J=6.5 Гц,1H).
Стадия ii.
(c) (транс)-2-(2-фтор-5-метоксифенил)циклопропанметанамин.
Суспензию (транс)-2-(2-фтор-5-метоксифенил)циклопропанкарбонитрила (5,0 г, 26 ммолей), PtO2 (200 мг) и CHCl3 (10 мл) в этиловом спирте (65 мл) гидрировали в аппарате Парра в течение 3 часов при давлении 3,85 ат. Катализатор фильтровали через пробку из целита, а растворители удаляли. Полученную хлористоводородную соль распределяли между CH2Cl2 и 10% K2CO3. Органический слой отделяли, сушили над K2CO3 и концентрировали с образованием указанного в заголовке соединения в виде свободного амина, 3,8 г (74%);спектр ЯМР 1H (250 МГц, CDCl3)  : 0.79-0.82 (м,1H), 0.90-0.95 (м,1H), 1.49 (широкий синглет,2H), 1.70-1.76 (м,1H), 1.82-1.86 (м,1H), 2.60-2.74 (м, 2H), 3.75 (с,3H), 6.35-6.42 (м,1H), 6.50-6.62(м,1H), 6.85-6.90 (м,1H).
(d) (транс)-N-[[2-(2-фтор-5-метоксифенил)циклопропил] – метил] -2-метилпpопанамид.
К перемешиваемому с помощью магнитной мешалки раствору (транс)-2-(2-фтор-5-метоксифенил) циклопропанметанамида (600 мг, 3,1 ммоля), Et3N (909 мг, 9,0 ммолей) в сухом дихлорметане (15 мл), находившемуся при 0oC, по каплям добавляли изобутирилхлорид (352 мг, 3,3 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. Растворители удаляли, а остаток растворяли в этилацетате (100 мл) и последовательно промывали водой, 5% лимонной кислотой, 5% K2CO3, рассолом и сушили над K2CO3. После концентрирования посредством ротационного выпаривания было получено неочищенное масло, которое затем очищали путем перегонки по методу Кюгельрора. Перекристаллизация полученного твердого вещества из смеси простого этилового эфира и гексана (1:1) позволила получить 380 мг (47%) указанного в заголовке соединения; температура плавления 93-94oC; : 0.79-0.82 (м,1H), 0.90-0.95 (м,1H), 1.49 (широкий синглет,2H), 1.70-1.76 (м,1H), 1.82-1.86 (м,1H), 2.60-2.74 (м, 2H), 3.75 (с,3H), 6.35-6.42 (м,1H), 6.50-6.62(м,1H), 6.85-6.90 (м,1H).
(d) (транс)-N-[[2-(2-фтор-5-метоксифенил)циклопропил] – метил] -2-метилпpопанамид.
К перемешиваемому с помощью магнитной мешалки раствору (транс)-2-(2-фтор-5-метоксифенил) циклопропанметанамида (600 мг, 3,1 ммоля), Et3N (909 мг, 9,0 ммолей) в сухом дихлорметане (15 мл), находившемуся при 0oC, по каплям добавляли изобутирилхлорид (352 мг, 3,3 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. Растворители удаляли, а остаток растворяли в этилацетате (100 мл) и последовательно промывали водой, 5% лимонной кислотой, 5% K2CO3, рассолом и сушили над K2CO3. После концентрирования посредством ротационного выпаривания было получено неочищенное масло, которое затем очищали путем перегонки по методу Кюгельрора. Перекристаллизация полученного твердого вещества из смеси простого этилового эфира и гексана (1:1) позволила получить 380 мг (47%) указанного в заголовке соединения; температура плавления 93-94oC;спектр ЯМР 1H (300 МГц, CDCl3)  : 0.82-0.88 (м,1H), 0.97-1.03 (м,1H), 1.13 (д, J= 8.1 Гц, 6H), 1.14-1.24 (м,1H), 1.85-1.91 (м,1H), 2.25-2.30 (м, 1H), 2.93-3.02 (м,1H), 3.52 (двойной триплет, J=7.8, 13.8 Гц,1H), 3.72 (c, 3H), 5.74 (широкий синглет,1H), 6.42-6.44 (м,1H), 6.59-6.64 (м,1H), 6.91 (т, J=6.5 Гц,1H); : 0.82-0.88 (м,1H), 0.97-1.03 (м,1H), 1.13 (д, J= 8.1 Гц, 6H), 1.14-1.24 (м,1H), 1.85-1.91 (м,1H), 2.25-2.30 (м, 1H), 2.93-3.02 (м,1H), 3.52 (двойной триплет, J=7.8, 13.8 Гц,1H), 3.72 (c, 3H), 5.74 (широкий синглет,1H), 6.42-6.44 (м,1H), 6.59-6.64 (м,1H), 6.91 (т, J=6.5 Гц,1H);инфракрасный спектр (пленка NaCl) 3298, 2962, 1642, 1546, 1502, 1428 см-1; масс-спектр (изобутан-DCl) m/e 253. Результаты анализа, высчитанные для C15H20NO2F: C 67.90, H 7.60, N 5.28; обнаружено: C 68.18, H 7.77, N 5.24. Пример 2 (способ получения 2). Получение (транс)-N-[[2-(3-метоксифенил)циклопропил]метил] бутанамида. Стадия i. (a) (b) (транс)-N-метокси-N-метил-3-(3-метоксифенил)- 2-пропенамид. Раствор 3-метоксикоричной кислоты (75,0 г, 0,42 моля) в тионилхлориде (250 мл) нагревали с обратным холодильником в течение 1 часа. Большую часть тионилхлорида отгоняли, полученный остаток обрабатывали дихлорметаном, а оставшийся тионилхлорид удаляли путем совместной перегонки с образованием хлорангидрида 3-метоксикроичной кислоты, который имел достаточно высокую чистоту для использования без дальнейшей очистки. К раствору хлорангидрида 3-метоксикоричной кислоты (0,42 моля) в сухом дихлорметане (500 мл), находившемуся при 0oC, добавляли пиридин (186 мл, 2,3 моля) и хлористоводородный N, O- диметилгидроксиламин (45,17 г, 0,46 моля). Полученный раствор перемешивали в течение 18 часов при комнатной температуре, разбавляли дихлорметаном (200 мл) и последовательно промывали 1 н. раствором HCl, насыщенным раствором бикарбоната натрия и рассолом. Затем его сушили над MgSO4 и концентрировали в условиях вакуума с образованием указанного в заголовке соединения в виде темного масла (88,43 г, 95%); спектр ЯМР 1H (300 МГц, CDCl3)  : 3.25 (с,3H), 3.68 (с,3H), 3.84 (с, 3H), 6.82-6.86 (м, 1H), 7.00 (д, J=16.1 Гц,1H), 7.10 (широкий синглет,1H), 7.15-7.20 (м,1H), 7.32 (т, J =6.6 Гц,1H), 7.72 (д, J =16.0 Гц,1H).
(c) (транс)-N-метокси-N-метил-2-(3-метоксифенил)- циклопропанкарбоксиамид.
К суспензии NaH (16,27 г, 0,68 моля) в диметилформамиде (375 мл) небольшими порциями добавляли твердый йодистый триметилсульфоксоний (149,16 г, 0,68 моля). После прекращения вспенивания (40 минут) по каплям добавляли раствор (транс)-N- метокси-N-метил-3-(3-метоксифенил)-2-пропенамида (50 г, 0,23 моля) в диметилсульфоксиде (50 мл), поддерживая температуру в интервале 35-40oC. Эту смесь перемешивали в течение 18 часов при комнатной температуре, после чего по каплям добавляли насыщенный раствор NH4Cl (400 мл) и экстрагировали этилацетатом. Органические вещества собирали, промывали рассолом, сушили (K2CO3) и концентрировали с образованием красного масла, которое затем очищали путем перегонки по методу Кюгельрора (130oC, 0,5 мм Hg), в результате чего было получено указанное в заголовке соединение в виде белого воска (52,47 г, 100%); : 3.25 (с,3H), 3.68 (с,3H), 3.84 (с, 3H), 6.82-6.86 (м, 1H), 7.00 (д, J=16.1 Гц,1H), 7.10 (широкий синглет,1H), 7.15-7.20 (м,1H), 7.32 (т, J =6.6 Гц,1H), 7.72 (д, J =16.0 Гц,1H).
(c) (транс)-N-метокси-N-метил-2-(3-метоксифенил)- циклопропанкарбоксиамид.
К суспензии NaH (16,27 г, 0,68 моля) в диметилформамиде (375 мл) небольшими порциями добавляли твердый йодистый триметилсульфоксоний (149,16 г, 0,68 моля). После прекращения вспенивания (40 минут) по каплям добавляли раствор (транс)-N- метокси-N-метил-3-(3-метоксифенил)-2-пропенамида (50 г, 0,23 моля) в диметилсульфоксиде (50 мл), поддерживая температуру в интервале 35-40oC. Эту смесь перемешивали в течение 18 часов при комнатной температуре, после чего по каплям добавляли насыщенный раствор NH4Cl (400 мл) и экстрагировали этилацетатом. Органические вещества собирали, промывали рассолом, сушили (K2CO3) и концентрировали с образованием красного масла, которое затем очищали путем перегонки по методу Кюгельрора (130oC, 0,5 мм Hg), в результате чего было получено указанное в заголовке соединение в виде белого воска (52,47 г, 100%);спектр ЯМР 1H (300 МГц, CDCl3)  : 0.82-0.88 (м,1H), 1.20-1.30 (м,1H), 1.59-1.62 (м, 1H), 2.40-2.45 (м,1H), 3.22 (с,3H), 3.68 (c,3H), 3.79 (c,3H), 6.61-6.72 (м,3H), 7.18 (т, J=6.0 Гц,1H).
Стадия ii.
(d) (транс)-2-(3-метоксифенил)циклопропанкарбоксальдегид.
К быстро перемешиваемой суспензии алюмогидрида лития (7,74 г, 204 ммоля) в тетрагидрофуране (800 мл), находившейся при температуре -45oC, по каплям добавляли раствор (транс)-N-метокси-N-метил-2-(3-метоксифенил) циклопропанкарбоксамида (40 г, 171 ммоля) в тетрагидрофуране (100 мл), поддерживая температуру ниже -40oC. После окончания добавления охлаждающую ванну удаляли, а реакционную смесь оставляли для нагревания до 5oC, а потом сразу же вновь охлаждали до -45oC. По каплям осторожно добавляли раствор бисульфата калия (40 г, 300 ммолей) в воде (120 мл), поддерживая температуру ниже -30oC. После окончания добавления охлаждающую ванну удаляли, а суспензию перемешивали при комнатной температуре в течение 30 минут. Полученную смесь фильтровали через целит и фильтровальную лепешку промывали простым эфиром. Соединенные фильтраты промывали холодным 1 н. раствором HCl, 5% K2CO3, рассолом и сушили над MgSO4. После концентрирования посредством ротационного выпаривания было получено указанное а заголовке соединение в виде светлого масла (29,9 г, 99%); : 0.82-0.88 (м,1H), 1.20-1.30 (м,1H), 1.59-1.62 (м, 1H), 2.40-2.45 (м,1H), 3.22 (с,3H), 3.68 (c,3H), 3.79 (c,3H), 6.61-6.72 (м,3H), 7.18 (т, J=6.0 Гц,1H).
Стадия ii.
(d) (транс)-2-(3-метоксифенил)циклопропанкарбоксальдегид.
К быстро перемешиваемой суспензии алюмогидрида лития (7,74 г, 204 ммоля) в тетрагидрофуране (800 мл), находившейся при температуре -45oC, по каплям добавляли раствор (транс)-N-метокси-N-метил-2-(3-метоксифенил) циклопропанкарбоксамида (40 г, 171 ммоля) в тетрагидрофуране (100 мл), поддерживая температуру ниже -40oC. После окончания добавления охлаждающую ванну удаляли, а реакционную смесь оставляли для нагревания до 5oC, а потом сразу же вновь охлаждали до -45oC. По каплям осторожно добавляли раствор бисульфата калия (40 г, 300 ммолей) в воде (120 мл), поддерживая температуру ниже -30oC. После окончания добавления охлаждающую ванну удаляли, а суспензию перемешивали при комнатной температуре в течение 30 минут. Полученную смесь фильтровали через целит и фильтровальную лепешку промывали простым эфиром. Соединенные фильтраты промывали холодным 1 н. раствором HCl, 5% K2CO3, рассолом и сушили над MgSO4. После концентрирования посредством ротационного выпаривания было получено указанное а заголовке соединение в виде светлого масла (29,9 г, 99%);спектр ЯМР 1H (300 МГц, CDCl3)  : 1.49-1.58 (м,1H), 1.65-1.73 (м,1H), 2.10-2.19 (м,1H), 2.58-2.67 (м,1H), 3.80 (с,3H), 6.66-6.78 (м,3H), 7.21 (т, J=6.6 Гц,1H), 9.32 (д, J=2.0 Гц,1H).
Стадия iii.
(e)(f) (транс)-2-(3-метоксифенил)циклопропанметанамин.
Раствор (транс)-2-(3-метоксифенил)циклопропанкарбоксальдегида (31,0 г, 176 ммолей), хлористоводородного гидроксиламина (38,57 г, 555 молей), этанола (200 мл), воды (120 мл) и 10 н. раствора NaOH (55 мл, 555 ммолей) нагревали с обратным холодильником (паровая баня) в течение 18 часов. Этот раствор охлаждали до комнатной температуры, разбавляли водой (1 л), последовательно промывали 1 н. раствором HCl, водой, рассолом и сушили над K2CO3. После концентрирования путем ротационного выпаривания было получено 30,98 г (92%) оксима, который сразу же использовали на следующей стадии. Оксим (30,98 г, 162 ммоля) вываривали с тетрагидрофураном (50 мл) и по каплям добавляли к суспензии алюмогидрида лития (9,2 г, 242 ммоля) в тетрагидрофуране (300 мл), которая находилась при температуре -45oC, поддерживая температуру ниже -40oC. Реакционную смесь оставляли для нагревания до комнатной температуры, перемешивали в течение 4 часов и вновь охлаждали до -45oC. Затем по каплям осторожно добавляли раствор бисульфата калия (55 г, 404 ммоля) в воде (200 мл). Охлаждающую ванну удаляли, а суспензию перемешивали при комнатной температуре в течение 30 минут. Полученную пасту фильтровали через целит, а фильтровальную лепешку промывали простым этиловым эфиром. Соединенные фильтраты экстрагировали 12 н. раствором HCl, кислые вытяжки подщелачивали (50% NaOH) и экстрагировали дихлорметаном. Органические вещества соединяли, промывали рассолом, сушили (K2CO3) и концентрировали в условиях вакуума с образованием указанного в заголовке соединения в виде светлого масла (17,62 г, 56%, две стадии); : 1.49-1.58 (м,1H), 1.65-1.73 (м,1H), 2.10-2.19 (м,1H), 2.58-2.67 (м,1H), 3.80 (с,3H), 6.66-6.78 (м,3H), 7.21 (т, J=6.6 Гц,1H), 9.32 (д, J=2.0 Гц,1H).
Стадия iii.
(e)(f) (транс)-2-(3-метоксифенил)циклопропанметанамин.
Раствор (транс)-2-(3-метоксифенил)циклопропанкарбоксальдегида (31,0 г, 176 ммолей), хлористоводородного гидроксиламина (38,57 г, 555 молей), этанола (200 мл), воды (120 мл) и 10 н. раствора NaOH (55 мл, 555 ммолей) нагревали с обратным холодильником (паровая баня) в течение 18 часов. Этот раствор охлаждали до комнатной температуры, разбавляли водой (1 л), последовательно промывали 1 н. раствором HCl, водой, рассолом и сушили над K2CO3. После концентрирования путем ротационного выпаривания было получено 30,98 г (92%) оксима, который сразу же использовали на следующей стадии. Оксим (30,98 г, 162 ммоля) вываривали с тетрагидрофураном (50 мл) и по каплям добавляли к суспензии алюмогидрида лития (9,2 г, 242 ммоля) в тетрагидрофуране (300 мл), которая находилась при температуре -45oC, поддерживая температуру ниже -40oC. Реакционную смесь оставляли для нагревания до комнатной температуры, перемешивали в течение 4 часов и вновь охлаждали до -45oC. Затем по каплям осторожно добавляли раствор бисульфата калия (55 г, 404 ммоля) в воде (200 мл). Охлаждающую ванну удаляли, а суспензию перемешивали при комнатной температуре в течение 30 минут. Полученную пасту фильтровали через целит, а фильтровальную лепешку промывали простым этиловым эфиром. Соединенные фильтраты экстрагировали 12 н. раствором HCl, кислые вытяжки подщелачивали (50% NaOH) и экстрагировали дихлорметаном. Органические вещества соединяли, промывали рассолом, сушили (K2CO3) и концентрировали в условиях вакуума с образованием указанного в заголовке соединения в виде светлого масла (17,62 г, 56%, две стадии);спектр ЯМР 1H (300 МГц, CDCl3)  : 0.80-0.95 (м,2H), 1.31-1.35 (м,1H), 1.70-1.79 (м,1H), 2.28 (широкий синглет,2H), 2.70- 2.74 (м,2H), 3.79 (с,3H), 6.60-6.71 (м,3H), 7.17 (т, J=6.4 Гц,1H).
Стадия iv.
(g) (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору (транс)-[2-(3-метоксифенил)циклопропанметанамина (1,02 г, 5,8 ммоля) и Et3N (1,60 мл, 11,5 ммоля) в сухом дихлорметане (20 мл), находившемуся при температуре 0oC, по каплям добавляли бутирилхлорид (0,69 г, 6,4 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Растворители удаляли. Остаток вываривали с EtOAc (100 мл) и последовательно промывали водой, 5% лимонной кислотой, 5% K2CO3, рассолом и сушили над K2CO3. После концентрирования путем ротационного выпаривания получали неочищенный продукт, который затем очищали посредством испарительной хроматографии (силикагель, смесь 40% EtOAc и гексана) с образованием 1,01 г (71%) указанного в заголовке соединения; : 0.80-0.95 (м,2H), 1.31-1.35 (м,1H), 1.70-1.79 (м,1H), 2.28 (широкий синглет,2H), 2.70- 2.74 (м,2H), 3.79 (с,3H), 6.60-6.71 (м,3H), 7.17 (т, J=6.4 Гц,1H).
Стадия iv.
(g) (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору (транс)-[2-(3-метоксифенил)циклопропанметанамина (1,02 г, 5,8 ммоля) и Et3N (1,60 мл, 11,5 ммоля) в сухом дихлорметане (20 мл), находившемуся при температуре 0oC, по каплям добавляли бутирилхлорид (0,69 г, 6,4 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Растворители удаляли. Остаток вываривали с EtOAc (100 мл) и последовательно промывали водой, 5% лимонной кислотой, 5% K2CO3, рассолом и сушили над K2CO3. После концентрирования путем ротационного выпаривания получали неочищенный продукт, который затем очищали посредством испарительной хроматографии (силикагель, смесь 40% EtOAc и гексана) с образованием 1,01 г (71%) указанного в заголовке соединения;спектр ЯМР 1H (300 МГц, CDCl3)  : 0.85-0.95 (м,5H), 1.22-1.31 (м,1H), 1.62 (к, J= 7.1 Гц,2H), 1.73-1.77 (м,1H), 2.13 (т, J 7.7 Гц,2H), 3.15-3.36 (м,2H), 3.76 (с,3H), 5.59 (с,1H), 6.55-6.69 (м,3H), 7.15 (т, J=6.5 Гц,1H); : 0.85-0.95 (м,5H), 1.22-1.31 (м,1H), 1.62 (к, J= 7.1 Гц,2H), 1.73-1.77 (м,1H), 2.13 (т, J 7.7 Гц,2H), 3.15-3.36 (м,2H), 3.76 (с,3H), 5.59 (с,1H), 6.55-6.69 (м,3H), 7.15 (т, J=6.5 Гц,1H);инфракрасный спектр (пленка NaCl) 3302, 2862, 1732, 1644 см-1; масс-спектр (изобутан-DCl) m/e 247. Результаты анализа, высчитанные для C15H21NO2: C 72.84, H 8.56, N 5.66; обнаружено: C 72.71, H 8.50, N 5.62. Пример 3 (способ получения 3). 3a. Получение (+)-(транс)-N-[[2-(3-метоксифенил)циклопропил] метил]бутанамида. Стадия i. (a) (+)-(транс)-2-(3-метоксифенил)циклопропанметанол. К суспензии алюмогидрида лития (0,65 г, 17,1 ммоля) в тетрагидрофуране (45 мл), находившейся при температуре -45oC, по каплям добавляли раствор (2’S)-N-(1S,2S)-2-(3-метоксифенил)циклопропанкарбонил борнан-10′,2′-сультама (3,36 г, 8,6 ммоля), полученный по методу Валлгарда Дж., Аппельберга У., Шереха И, и Хакселя У. (J.Chem.Soc. Penkin Trans. 1, стр. 461-470, 1994 г.), в тетрагидрофуране (20 мл). Охлаждающую ванну удаляли, а реакционную смесь оставляли для нагревания до комнатной температуры, после чего ее сразу же вновь охлаждали до -45oC. Осторожно добавляли раствор бикарбоната калия (3,9 г, 29 ммолей) в воде (15 мл), повысив температуру до -5oC. Полученную пасту перемешивали при комнатной температуре в течение 1 часа, фильтровали через целит, а фильтровальную лепешку промывали простым этиловым эфиром. Соединенные фильтраты промывали холодным (0oC) 1 н. раствором HCl, 5% K2CO3, рассолом, сушили (K2CO3) и концентрировали с образованием неочищенного воска. После растирания в порошок вместе с гексаном, фильтрования осажденного хирального вспомогательного вещества и последующего концентрирования фильтрата было получено указанное в заголовке соединение в виде светлого масла (1,33 г, 87%); спектр ЯМР 1H (300 МГц, CDCl3)  : 0.90-1.00 (м,2H), 1.21- 1.25 (м,1H), 1.52-1.59 (широкий синглет, 1H), 1.78-1.85 (м,1H), 3.60 (двойной дублет, J= 5.0,> 1 Гц,2H), 3.80 (с,3H), 6.60-6.72 (м, 3H), 7.20 (м, J=7.5 Гц,1H); : 0.90-1.00 (м,2H), 1.21- 1.25 (м,1H), 1.52-1.59 (широкий синглет, 1H), 1.78-1.85 (м,1H), 3.60 (двойной дублет, J= 5.0,> 1 Гц,2H), 3.80 (с,3H), 6.60-6.72 (м, 3H), 7.20 (м, J=7.5 Гц,1H);[  ]2D0 55,5o (с=1, CH2Cl2).
Стадия ii.
(b) (c) (+)-(транс)-1-(азидометил)-2-(3-метоксифенил)- циклопропан.
К раствору (+)-(транс)-2-(3-метоксифенил)циклопропанметанола (1,33 г, 7,5 ммоля) и триэтиламина (1,57 мл, 11,3 ммоля) в дихлорметане (25 мл), находившемуся при температуре 0oC, по каплям добавляли метансульфонилхлорид (950 мг, 8,3 ммоля). После окончания добавления ледяную баню удаляли и продолжали перемешивание в течение 30 минут. Полученный раствор обрабатывали дихлорметаном (100 мл), промывали водой, насыщенным раствором NaHCO3 и сушили над K2CO3. После концентрирования путем ротационного выпаривания было получено 1,78 г неочищенного масла. Мезилат растворяли в диметилформамиде (25 мл), обрабатывали азидом натрия (980 мг, 15 ммолей) и продолжали перемешивать при комнатной температуре в течение 18 часов. Полученную смесь концентрировали, остаток растворяли в простом этиловом эфире, промывали водой, рассолом, а растворители удаляли посредством ротационного выпаривания, что позволило получить 1,11 г (73%, две стадии) светлого масла; ]2D0 55,5o (с=1, CH2Cl2).
Стадия ii.
(b) (c) (+)-(транс)-1-(азидометил)-2-(3-метоксифенил)- циклопропан.
К раствору (+)-(транс)-2-(3-метоксифенил)циклопропанметанола (1,33 г, 7,5 ммоля) и триэтиламина (1,57 мл, 11,3 ммоля) в дихлорметане (25 мл), находившемуся при температуре 0oC, по каплям добавляли метансульфонилхлорид (950 мг, 8,3 ммоля). После окончания добавления ледяную баню удаляли и продолжали перемешивание в течение 30 минут. Полученный раствор обрабатывали дихлорметаном (100 мл), промывали водой, насыщенным раствором NaHCO3 и сушили над K2CO3. После концентрирования путем ротационного выпаривания было получено 1,78 г неочищенного масла. Мезилат растворяли в диметилформамиде (25 мл), обрабатывали азидом натрия (980 мг, 15 ммолей) и продолжали перемешивать при комнатной температуре в течение 18 часов. Полученную смесь концентрировали, остаток растворяли в простом этиловом эфире, промывали водой, рассолом, а растворители удаляли посредством ротационного выпаривания, что позволило получить 1,11 г (73%, две стадии) светлого масла;ЯМР 1H (300 МГц, CDCl3)  : 0.85-0.92 (м,2H), 1.41-1.45 (м,1H), 1.80-1.83 (м,1H), 3.25-3.38 (м,1H), 3.48-3.58 (м,1H), 3.83 (с, 3H), 6.70-6.78 (м, 3H), 7.21 (м,J=7.8 Гц,1H).
(d) (+)-(транс)-2-(3-метоксифенил)циклопропанметанамин.
К перемешиваемой суспензии алюмогидрида лития (455 мг, 12 ммолей) в тетрагидрофуране (20 мл), находившейся при температуре -30oC, добавляли раствор (+)-(транс)-1-(азидометил)-2-(3-метоксифенил) циклопропана (1,11 г, 5,5 ммоля) в тетрагидрофуране (10 мл), поддерживая температуру ниже -30oC. После окончания добавления суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Реакционную смесь охлаждали до -45oC и по каплям осторожно добавляли раствор KHSO4 (2,6 г) в воде (20 мл). Полученную суспензию перемешивали при комнатной температуре в течение 30 минут, фильтровали через целит, а фильтровальную лепешку хорошо промывали простым этиловым эфиром. Фильтраты собирали, экстрагировали 1 н. раствором HCl, а кислые слои подщелачивали (30% NaOH). Основный раствор экстрагировали CH2Cl2, суши ли (K2CO3) и концентрировали с образованием 400 мг (41%) указанного в заголовке соединения в виде светлого масла; : 0.85-0.92 (м,2H), 1.41-1.45 (м,1H), 1.80-1.83 (м,1H), 3.25-3.38 (м,1H), 3.48-3.58 (м,1H), 3.83 (с, 3H), 6.70-6.78 (м, 3H), 7.21 (м,J=7.8 Гц,1H).
(d) (+)-(транс)-2-(3-метоксифенил)циклопропанметанамин.
К перемешиваемой суспензии алюмогидрида лития (455 мг, 12 ммолей) в тетрагидрофуране (20 мл), находившейся при температуре -30oC, добавляли раствор (+)-(транс)-1-(азидометил)-2-(3-метоксифенил) циклопропана (1,11 г, 5,5 ммоля) в тетрагидрофуране (10 мл), поддерживая температуру ниже -30oC. После окончания добавления суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Реакционную смесь охлаждали до -45oC и по каплям осторожно добавляли раствор KHSO4 (2,6 г) в воде (20 мл). Полученную суспензию перемешивали при комнатной температуре в течение 30 минут, фильтровали через целит, а фильтровальную лепешку хорошо промывали простым этиловым эфиром. Фильтраты собирали, экстрагировали 1 н. раствором HCl, а кислые слои подщелачивали (30% NaOH). Основный раствор экстрагировали CH2Cl2, суши ли (K2CO3) и концентрировали с образованием 400 мг (41%) указанного в заголовке соединения в виде светлого масла;спектр ЯМР 1H (300 МГц, CDCl3)  : 0.86-0.95 (м,2H), 1.24-1.31 (м,1H), 1.72-1.79 (м, 1H), 2.10-2.40 (широкий синглет,2H), 2.70- 2.74 (м,2H), 3.79 (с,3H), 6.60-6.72 (м,3H), 7.15 (м, J=7,8 Гц, 1H).
Стадия iii.
(e) (+)-(транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору (+)- (транс)-2-(3-метоксифенил)циклопропанметанамина (400 мг, 2,3 ммоля) и Et3N (1,1 мл, 7,9 ммоля) в сухом дихлорметане (15 мл), находившемуся при температуре 0oC, по каплям добавляли бутирилхлорид (269 мг, 2,5 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. Растворители удаляли, остаток вываривали вместе с EtOAc (100 мл) и последовательно промывали водой, 5% лимонной кислотой, 5% K2CO3г рассолом и сушили над K2CO3. После концентрирования путем ротационного выпаривания был получен неочищенный продукт, который затем очищали посредством испарительной хроматографии (силикагель, смесь 1% метилового спирта и CH2Cl2), что позволило получить 310 мг (56%) указанного в заголовке соединения в виде светлого масла; : 0.86-0.95 (м,2H), 1.24-1.31 (м,1H), 1.72-1.79 (м, 1H), 2.10-2.40 (широкий синглет,2H), 2.70- 2.74 (м,2H), 3.79 (с,3H), 6.60-6.72 (м,3H), 7.15 (м, J=7,8 Гц, 1H).
Стадия iii.
(e) (+)-(транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору (+)- (транс)-2-(3-метоксифенил)циклопропанметанамина (400 мг, 2,3 ммоля) и Et3N (1,1 мл, 7,9 ммоля) в сухом дихлорметане (15 мл), находившемуся при температуре 0oC, по каплям добавляли бутирилхлорид (269 мг, 2,5 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. Растворители удаляли, остаток вываривали вместе с EtOAc (100 мл) и последовательно промывали водой, 5% лимонной кислотой, 5% K2CO3г рассолом и сушили над K2CO3. После концентрирования путем ротационного выпаривания был получен неочищенный продукт, который затем очищали посредством испарительной хроматографии (силикагель, смесь 1% метилового спирта и CH2Cl2), что позволило получить 310 мг (56%) указанного в заголовке соединения в виде светлого масла;спектр ЯМР 1H (300 МГц, CDCl3)  : 0.86-0.95 (м,5H), 1.22- 1.31 (м,1H), 1.54-1.83 (м, 3H), 2.08 (т, J=7.7 Гц,2H), 3.16-3.36 (м, 2H), 3.76 (с,3H), 5.59 (широкий синглет,1H), 6.55-6.76 (м,3H), 7.17 (т, J=7.8 Гц,1H); : 0.86-0.95 (м,5H), 1.22- 1.31 (м,1H), 1.54-1.83 (м, 3H), 2.08 (т, J=7.7 Гц,2H), 3.16-3.36 (м, 2H), 3.76 (с,3H), 5.59 (широкий синглет,1H), 6.55-6.76 (м,3H), 7.17 (т, J=7.8 Гц,1H);инфракрасный спектр (пленка NaCl) 3296, 2962, 1644, 1604, 1550, 1494 см-1; масс-спектр (изобутан-DCl) m/e 247; [  ]2D0 +57,2o (c=1, CH2Cl2).
Результаты анализа, высчитанные для C15H21NO2 ]2D0 +57,2o (c=1, CH2Cl2).
Результаты анализа, высчитанные для C15H21NO2  0,15H2O 0,15H2OC 72.05, H 9.59, N 5.60; обнаружено: C 71.97, H 8.59, N 5.60. 3. (-)-(транс-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид Указанное в заголовке соединение синтезировали представленным выше способом из (2’R)-N-(1R, 2R)-2-(3- метоксифенил)-циклопропанкарбонил]борнан-10′, 2′-сультама, полученного по методу Валлгарда Дж., Аппельберга У., Шереха И. и Хакселя У. (J. Chem. Soc. Perkin Trans.I стр. 461-470, 1994 г.); спектр ЯМР 1H (300 МГц, CDCl3)  : 0.86-0.95 (м,5H), 1.22-1.31 (м,1H), 1.54-1.83 (м,3H), 2.08 (к, J=7.7 Гц,2H), 3.16-3.36 (м,2H), 3.76 (c,3H), 5.59 (широкий синглет,1H), 6.55-6.76 (м,3H), 7.17 (м, 1 =7.8 Гц,1H); : 0.86-0.95 (м,5H), 1.22-1.31 (м,1H), 1.54-1.83 (м,3H), 2.08 (к, J=7.7 Гц,2H), 3.16-3.36 (м,2H), 3.76 (c,3H), 5.59 (широкий синглет,1H), 6.55-6.76 (м,3H), 7.17 (м, 1 =7.8 Гц,1H);инфракрасный спектр (пленка NaCl) 3294, 2962, 1644, 1604, 1559, 1495 см-1; масс-спектр (изобутан-DCl) m/e 247. Пример 4 (способ получения 4). 4a. Получение (транс)-N-[[2-(2-иод-5-метоксифенил)циклопропил] метил] бутанамида. К перемешиваемому раствору (транс)-N-[[2-(3-метоксифенил) циклопропил] метил] бутанамида (120 мг, 0,49 ммоля) и TI(OAc)3 (522 мг, 1,5 ммоля) в CCl4 (10 мл) добавляли раствор I2 (139 мг, 0,55 ммоля) в CCl4 (20 мл). Полученную суспензию нагревали с обратным холодильником в течение 18 часов. Затем ее охлаждали до комнатной температуры, фильтровали через спекшуюся стекломассу с порами среднего размера, а фильтрат промывали насыщенным раствором тиосульфата натрия, рассолом и сушили (K2CO3). После концентрирования путем ротационного выпаривания было получено 150 мг оранжевого масла, которое очищали посредством хроматографии (силикагель, смесь 40% EtOAc и гексана), что позволило получить 108 мг (60%) указанного в заголовке соединения в виде белого твердого вещества, температура плавления 84 -86oC; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.87-1.01 (м,5H), 1.07-1.23 (м,1H), 1.59-1.71 (м, 2H), 1.84-1.90 (м,1H), 2.16 (т, J=7.8 Гц, 2H), 3.16-3.25 (м, 1H), 3.46-3.53 (м,1H), 3.73 (с,3H), 5.83 (широкий синглет,1H), 6.45-6.50 (м, 2H), 7.66 (д, J=8.5 Гц,1H); : 0.87-1.01 (м,5H), 1.07-1.23 (м,1H), 1.59-1.71 (м, 2H), 1.84-1.90 (м,1H), 2.16 (т, J=7.8 Гц, 2H), 3.16-3.25 (м, 1H), 3.46-3.53 (м,1H), 3.73 (с,3H), 5.83 (широкий синглет,1H), 6.45-6.50 (м, 2H), 7.66 (д, J=8.5 Гц,1H);инфракрасный спектр (пленка NaCl) 3304, 2962, 1636, 1555, 1444, 1416 см-1; масс-спектр (изобутан-DCl) m/e 373. Результаты анализа, высчитанные для C15H20NO2I: C 48.27, H 5.40, N 3.75; обнаружено: C 48.24, H 5.41, N 3.53. 4b. Получение (транс)-N-[[2-(2-иод-5-фторфенил)-циклопропил] метил]бутанамида. К перемешиваемому раствору (транс)-N-[[2-(3-фторфенил)- циклопропил]метил] бутанамида (1,0 г, 4,3 ммоля), TI(OAc)3 (2,5 г, 6,5 ммоля) и тетрафторамина (15 мл) в ацетонитриле (15 мл) добавляли раствор NaI (705 мг, 4,7 ммоля) в воде (2 мл). Полученную суспензию нагревали при температуре 55oC в течение 12 часов. Затем ее охлаждали до комнатной температуры, фильтровали через спекшуюся стекломассу с порами среднего размера, а фильтрат промывали насыщенным раствором тиосульфата натрия, рассолом и сушили (K2CO3). После концентрирования путем ротационного выпаривания было получено 1,26 г оранжевого масла, которое очищали посредством хроматографии (силикагель, смесь 35% EtOAc и гексана), что позволило получить 371 мг (25%) указанного в заголовке соединения в виде белого твердого вещества: температура плавления 66-68oC; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.91- 0.99 (м,5H), 1.00-1.15 (м,1H), 1.70 (к, J=7.5 Гц,2H), 1.89-1.92 (м,1H), 2.17 (т, J= 7.2 Гц,2H), 3.28-3.32 (м, 1H), 3.43-3.50 (м, 1H), 5.67 (широкий синглет,1H), 6.59-6.67 (м,2H), 7.71-7.76 (м,1H); : 0.91- 0.99 (м,5H), 1.00-1.15 (м,1H), 1.70 (к, J=7.5 Гц,2H), 1.89-1.92 (м,1H), 2.17 (т, J= 7.2 Гц,2H), 3.28-3.32 (м, 1H), 3.43-3.50 (м, 1H), 5.67 (широкий синглет,1H), 6.59-6.67 (м,2H), 7.71-7.76 (м,1H);инфракрасный спектр (пленка NaCl) 3417, 3294, 2962, 1638, 1554, 1448, 1412 см-1; масс-спектр (ESI) m/e 361. Результаты анализа, высчитанные для C14H17NOFI: C 46.55, H 4.74, N 3.88; обнаружено: C 46.57, H 4.68, N 3.85. Пример 5 (способ получения 5). Получение (транс)-N-[(2-(2,4-дибром-5-метоксифенил)циклопропил] метил] бутанамида К перемешиваемому раствору N-[[2-(3-метоксифенил)циклопропил] метил] бутанамида (190 мг, 0,77 ммоля) и TI(OAc)3 (881 мг, 2,3 ммоля) в CCl4 (20 мл), находившемуся при температуре 0oC, по каплям добавляли раствор Br2 (238 мг, 1,5 ммоля) в CCl4 (10 мл). После окончания добавления эту суспензию фильтровали через спекшуюся стекломассу с порами среднего размера, а фильтрат промывали насыщенным раствором тиосульфата натрия, рассолом, сушили (K2CO3) и концентрировали с образованием светлого масла. После очистки посредством хроматографии (силикагель, смесь 35% EtOAc и гексана) было получено 185 мг (62%) указанного в заголовке соединения в виде белого твердого вещества: температура плавления 114-115oC; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.90-1.02 (м,5H), 1.04-1.16 (м,1H), 1.60-1.69 (м,2H), 1.89-1.93 (м,1H), 2.16 (т, J=7.8 Гц,2H), 3.04-3.16 (м,1H), 3.49-3.54 (м,1H), 3.82 (с,3H), 5.77 (широкий синглет,1H), 6.44 (с,1H), 7.66 (с,1H); : 0.90-1.02 (м,5H), 1.04-1.16 (м,1H), 1.60-1.69 (м,2H), 1.89-1.93 (м,1H), 2.16 (т, J=7.8 Гц,2H), 3.04-3.16 (м,1H), 3.49-3.54 (м,1H), 3.82 (с,3H), 5.77 (широкий синглет,1H), 6.44 (с,1H), 7.66 (с,1H);инфракрасный спектр (пленка NaCl) 3290, 2960, 1632, 1550, 1474, 1442 см-1; масс-спектр: m/e 405. Результаты анализа, высчитанные для C15H19NO2Br2: C 44.47, H 4.73, N 3.46; обнаружено: C 44.59, H 4.65, N 3.16. Пример 6 (способ получения 6). Получение (транс)-N-[[2-(3-метоксифенил)циклопропил] метил] -N-(фенилметил)бутанамида. Перемешиваемый с помощью магнитной мешалки раствор (транс)-N-[[2-(3-метокcифенил)циклопропил] метил]бутанамида (1,0 г, 4,0 ммоля) и NaH (105 мг, 4,4 ммоля) в диметилформамиде (10 мл) обрабатывали бензилбромидом (750 мг, 4,4 ммоля). Полученную суспензию перемешивали в течение 18 часов при комнатной температуре, разбавляли простым этиловым эфиром (100 мл) и быстро охлаждали водой (100 мл). Слои разделяли, после чего органическую фазу промывали водой, рассолом, сушили (K2CO3) и концентрировали с образованием неочищенного масла, которое очищали посредством испарительной хроматографии (силикагель, смесь 45% EtOAc и гексана) с образованием 580 мг (43%) указанного в заголовке соединения в виде светлого масла; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.78-0.98 (м,4H), 1.17-1.33 (м,1H), 1.60- 1.79 (м, 4H), 2.27-2.44 (м,2H), 3.17-3.33 (м,1H), 3.51-3.61 (м,1H), 3.77 (широкий синглет, 3H), 4.46-4.82 (м,2H), 6.50-6.72 (м,3H), 7.10-7.34 (м,6H); : 0.78-0.98 (м,4H), 1.17-1.33 (м,1H), 1.60- 1.79 (м, 4H), 2.27-2.44 (м,2H), 3.17-3.33 (м,1H), 3.51-3.61 (м,1H), 3.77 (широкий синглет, 3H), 4.46-4.82 (м,2H), 6.50-6.72 (м,3H), 7.10-7.34 (м,6H);инфракрасный спектр (пленка NaCl) 2962, 1644, 1604, 1454, 1210 см-1; масс-спектр (изобутан-DCl) m/e 337. Результаты анализа, высчитанные для C22H27NO2  0,1H2O: 0,1H2O:C 77.88, H 8.08, N 4.13; обнаружено: C 77.87, H 8.12, N 3.89. Пример 7 (способ получения 7). Получение (транс)-N-[[2-[3-(2-пропенилокси)фенил]циклопропил] метил]бутанамида. Стадия i. (a) (транс)-N-[[2-(3-гидроксифенил)циклопропил]метил]- бутанамид. К перемешиваемому раствору (транс)-N-[[2-(3-метоксифенил) циклопропил] метил] бутанамида (3,50 г, 14,2 ммоля) в дихлорметане (50 мл), находившемуся при температуре -78oC, по каплям добавляли BBr4 (28,4 мл, 1 н. раствор в CH2Cl2, 28,4 ммоля). После окончания добавления охлаждающую ванну удаляли и продолжали перемешивать в течение 18 часов. Полученный раствор выливали на смесь льда с водой (100 мл) и экстрагировали 2,5 н. раствором NaOH. Основные вытяжки собирали, промывали дихлорметаном и подкисляли (концентрированная HCl). Кислый раствор экстрагировали дихлорметаном, органические вещества собирали, промывали рассолом, сушили (MgSO4) и концентрировали с образованием 2,49 г (75%) указанного в заголовке соединения: спектр ЯМР 1H (300 МГц, DMSO-d6)  : 0.72-0.84 (м,5H), 1.09-1.15 (м,1H), 1.42-1.54 (м, 2H), 1.63-1.69 (м,1H), 2.02 (т, J= 5,0 Гц,2H), 2.99-3.11 (м, 2H), 6.39-6.50 (м,3H), 6.98 (т, J=7.8 Гц,1H), 7.91 (с,1H), 9.19 (широкий синглет,1H); : 0.72-0.84 (м,5H), 1.09-1.15 (м,1H), 1.42-1.54 (м, 2H), 1.63-1.69 (м,1H), 2.02 (т, J= 5,0 Гц,2H), 2.99-3.11 (м, 2H), 6.39-6.50 (м,3H), 6.98 (т, J=7.8 Гц,1H), 7.91 (с,1H), 9.19 (широкий синглет,1H);инфракрасный спектр (пленка NaCl) 3300, 2964, 1642, 1585, 1542, 1466 см-1; масс-спектр (изобутан-DCl) m/e 233. Результаты анализа, высчитанные для C14H19NO2  0,1H2O: 0,1H2O:C 71.52, H 8.23, N 5.96; обнаружено: C 71.53, H 8.32, N 5.92. Стадия ii. (b) (транс)-N-[[(2-пропен-1-илоксифенил)циклопропил]- метил]бутанамид. К быстро перемешиваемому раствору (транс)-N-[[2-(3-гидpoкcифенил) циклoпpoпил] метил] бутанамида (0,8 г, 3,4 ммоля) и KOH (210 мг, 3,74 ммоля) в этаноле (15 мл) добавляли аллилиодид (622 мг, 3,7 ммоля). После перемешивания в течение 18 часов суспензию разбавляли простым этиловым эфиром (100 мл) и промывали водой, 2 н. раствором NaOH, рассолом, сушили (K2CO3) и концентрировали с образованием неочищенного остатка. Полученное вещество очищали посредством хроматографии (силикагель, смесь 40% EtOAc и гексана), что позволило получить 320 мг (34%) указанного в заголовке соединения; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.70-0.94 (м,5H), 1.12-1.32 (м,1H), 1.58-1.84 (м, 3H), 2.20 (т: J=6.0 Гц,2H), 3.15-3.36 (м,2H), 4.48 (д, J=5.6 Гц, 2H), 5.24 (д, J=10.0 Гц,1H), 5.40 (д, J=17.2 Гц,1H), 5.56 (широкий синглет,1H), 5.96-6.07 (м,1H), 6.57-6.70 (м,3H), 7.13 (т, J=7.2 Гц,1H); : 0.70-0.94 (м,5H), 1.12-1.32 (м,1H), 1.58-1.84 (м, 3H), 2.20 (т: J=6.0 Гц,2H), 3.15-3.36 (м,2H), 4.48 (д, J=5.6 Гц, 2H), 5.24 (д, J=10.0 Гц,1H), 5.40 (д, J=17.2 Гц,1H), 5.56 (широкий синглет,1H), 5.96-6.07 (м,1H), 6.57-6.70 (м,3H), 7.13 (т, J=7.2 Гц,1H);инфракрасный спектр (пленка NaCl) 3296, 2962, 1644, 1607, 1548, 1494 см-1; масс-спектр m/e 273. Результаты анализа, высчитанные для C17H23NO2  0,20(H2O): 0,20(H2O):C 73.72, H 8.52, N 5.06; обнаружено: C 73.77, H 8.63, N 5.00. Пример 8 (способ получения 8). Получение (транс)-N-[[2-[3-(метилэтокси)фенил]циклопропил] метил]бутанамида. К быстро перемешиваемому раствору (транс)-N-[[2-(3- гидроксифенил)циклопропил] метил] бутанамида (390 мг, 1,7 ммоля), трифенилфосфина (498 мг, 1,9 ммоля) и изопропанола (150 мг, 2,5 ммоля) в тетрагидрофуране (10 мл), находившемуся при температуре 0oC, в виде одной порции добавляли диэтилазодикарбоксилат (331 мг, 1,9 ммоля). После перемешивания в течение 2 часов эту суспензию разбавляли простым этиловым эфиром (100 мл), промывали водой, 2 н. раствором NaOH и рассолом, сушили (K2CO3) и концентрировали с образованием неочищенного воска. Полученное вещество очищали посредством хроматографии (силикагель, смесь 35% EtOAc и гексана), что позволило получить 144 мг (31%) указанного в заголовке соединения; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.85-0.94 (м,5H), 1.22-1.24 (м,1H), 1.29 (д, J= 6.7 Гц,6H), 1.58-1.68 (м,2H), 1.70-1.77 (м,1H), 2.14 (т, J=6.0 Гц, 2H), 3.14-3.36 (м, 2H), 4.44-4.54 (м,1H), 5.81 (широкий синглет,1H), 6.53-6.67 (м,3H), 7.13 (т, J=7.2 Гц,1H); : 0.85-0.94 (м,5H), 1.22-1.24 (м,1H), 1.29 (д, J= 6.7 Гц,6H), 1.58-1.68 (м,2H), 1.70-1.77 (м,1H), 2.14 (т, J=6.0 Гц, 2H), 3.14-3.36 (м, 2H), 4.44-4.54 (м,1H), 5.81 (широкий синглет,1H), 6.53-6.67 (м,3H), 7.13 (т, J=7.2 Гц,1H);инфракрасный спектр (пленка NaCl) 3294, 2974, 1644, 1610, 1550, 1492 см-1; масс-спектр m/e 275. Результаты анализа, высчитанные для C17H25NO2: C 74.14, H 9.15, N 5.09; обнаружено: C 73.77, H 8.99, N 4.82. Пример 9 (способ получения 9). 9a. Получение (-)-(транс)-N-[[2-(5-метокси-2-фенилэтинил)фенил] циклопропил]метил]бутанамида. (a) (-)-(транс)-N-[[2-(5-метокси-2-фенилэтинил)фенилциклопропил] метил] бутанамид. Перемешиваемую суспензию (транс)-N-[[2-(2-иод-5-метоксифенил) циклопропил]метил]бутанамида (400 мг, 1,1 ммоля), фенилацетилена (133 мг, 1,3 ммоля) и Pd(Ph3P)4 (63 мг, 0,05 ммоля) в триэтиламине (10 мл) нагревали с обратным холодильником в течение 18 часов, охлаждали до комнатной температуры и разбавляли простым этиловым эфиром (100 мл), промывали водой, рассолом, сушили (K2CO3) и концентрировали в условиях вакуума с образованием 400 мг красного масла. После очистки посредством хроматографии (силикагель, смесь 30% EtOAc и гексана) было получено 220 мг белого твердого вещества (58%): температура плавления 107-108oC; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.78 (т, J=7.5 Гц,3H), 0.94-0.98 (м, 1H), 1.14-1.16 (м,2H), 1.40- 1.56 (м,2H), 1.78-1.93 (м, 2H), 2.25-2.31 (м, 1H), 2.80-2.99 (м,1H), 3.74-3.83 (м,1H), 3.79 (с,3H), 5.84 (широкий синглет, 1H), 6.41 (с,1H), 6.71 (д,J=4 Гц, 1H), 7.16-7.61 (м,6H); : 0.78 (т, J=7.5 Гц,3H), 0.94-0.98 (м, 1H), 1.14-1.16 (м,2H), 1.40- 1.56 (м,2H), 1.78-1.93 (м, 2H), 2.25-2.31 (м, 1H), 2.80-2.99 (м,1H), 3.74-3.83 (м,1H), 3.79 (с,3H), 5.84 (широкий синглет, 1H), 6.41 (с,1H), 6.71 (д,J=4 Гц, 1H), 7.16-7.61 (м,6H);инфракрасный спектр (пленка NaCl) 3310, 2960, 2214, 1638, 1544, 1502, 1428 см-1; масс-спектр (ESl) m/e 347. Результаты анализа, высчитанные для C23H25NO2: C 79.51, H 7.25, N 4.03; обнаружено: C 79.28, H 7.21, N 3.78. 9b. Получение (-)-(транс)-N-[[2-(5-метокси-2- фенилэтил)фенил]циклопропил]метил]бутанамидa (b) (-)-(транс)-N-[[2-(5-метокси-2-фенилэтил]фенил]- циклопропил]метил] бутанамид. Суспензию (-)-(транс)-N-[[2-(5-метокси-2-фенилэтинил)фенил] циклопропил] метил] бутанамида (100 мг, 0,28 ммоля), 20% палладированного угля (50 мг) в этаноле (25 мл) встряхивали под слоем водорода (аппарат Парра, 3,5 ат) в течение 18 часов. Полученную суспензию фильтровали через целит и концентрировали в условиях вакуума с образованием светлого масла (100 мг, 100%): спектр ЯМР 1H (300 МГц, CDCl3)  : 0.90-0.94 (м,5H), 1.25-1.30 (м,1H), 1.60-1.66 (м, 1H), 1.71-1.79 (м, 2H), 2.05-2.15 (м,2H), 2.88-2.98 (м,4H), 3.20-3.35 (м, 2H), 3.77 (с, 3H), 5.57 (широкий синглет,1H), 6.47 (с,1H), 6.66-6.68 (м,1H), 7.05 (д,J=4 Гц,1H), 7.17-7.32 (м,5H); : 0.90-0.94 (м,5H), 1.25-1.30 (м,1H), 1.60-1.66 (м, 1H), 1.71-1.79 (м, 2H), 2.05-2.15 (м,2H), 2.88-2.98 (м,4H), 3.20-3.35 (м, 2H), 3.77 (с, 3H), 5.57 (широкий синглет,1H), 6.47 (с,1H), 6.66-6.68 (м,1H), 7.05 (д,J=4 Гц,1H), 7.17-7.32 (м,5H);инфракрасный спектр (пленка NaCl) 3294, 2960, 1644, 1548, 1498, 1454 см-1; масс-спектр (ESI) m/e 351. Результаты анализа высчитанные для C23H29NO2  0,25(H2O): 0,25(H2O):C 77.60, H 8.41, N 3.58; обнаружено: C 77.48, H 8.41, N 3.58. Пример 10 (способ получения 10). Получение (-)-(транс)-N-[[2-(2-циано-5-метоксифенил)циклопропил] метил] бутанамида. В 100 мл колбу с круглым основанием, оснащенную обратным холодильником и хлоркальциевой трубкой, вводили (транс) – N-[[2-(2-иод-5-метоксифенил)циклопропил] метил]бутанамид (200 мг, 0,6 ммоля), порошкообразный цианид меди (I) (106 мг, 1,2 ммоля) и безводный пиридин (2 мл). Эту смесь затем нагревали при температуре 185oC в течение 18 часов. Реакционную смесь быстро охлаждали путем добавления 50% водного раствора аммиака (30 мл), после чего экстрагировали толуолом (3х50 мл). Органические вещества соединяли, промывали водой, 1 н. раствором HCl, рассолом и сушили над MgSO4. После фильтрования и концентрирования в условиях вакуума было получено 310 мг неочищенного масла, которое очищали посредством хроматографии (силикагель, смесь 45% EtOAc и гексана) с образованием светлого масла (120 мг, 74%): спектр ЯМР 1H (300 МГц, CDCl3)  : 0.93 (т, J=6.0 Гц,3H), 0.96- 0.99 (м, 1H), 1.10-1.16 (м,1H), 1.20-1.28 (м,1H), 1.64-1.71 (м,2H), 2.03-2.10 (м,1H), 2.20 (т, J=7.8 Гц,2H), 2.72-2.79 (м,1H), 3.82 (с,3H), 3.85-3.92 (м,1H), 6.27 (широкий синглет, 1H), 6.56 (с,1H), 6.73 (д, J=8.4 Гц,1H), 7.53 (д, J=8.7 Гц,1H); : 0.93 (т, J=6.0 Гц,3H), 0.96- 0.99 (м, 1H), 1.10-1.16 (м,1H), 1.20-1.28 (м,1H), 1.64-1.71 (м,2H), 2.03-2.10 (м,1H), 2.20 (т, J=7.8 Гц,2H), 2.72-2.79 (м,1H), 3.82 (с,3H), 3.85-3.92 (м,1H), 6.27 (широкий синглет, 1H), 6.56 (с,1H), 6.73 (д, J=8.4 Гц,1H), 7.53 (д, J=8.7 Гц,1H);инфракрасный спектр (пленка NaCl) 3300, 2964, 2218, 1646, 1606, 1564 см-1; масс-спектр (ESI) m/e 272. Результаты анализа, высчитанные для C16H20N2O2  0,25(H2O): 0,25(H2O):C 69.41, H 7.46, N 10.12, обнаружено: C 69.41, H 7.46, N 10.00. Пример 11 (способ получения 11). Получение (-)-(транс)-N-[[2-(2-фенил-5-метоксифенил)циклопропил] метил] бутанамида. К перемешиваемой суспензии (транс)-N-[[2-(2-иод-5-метоксифенил) циклопропил} метил} бутанамида (210 мг, 0,56 ммоля), гидроксида бария (265 мг, 0,84 ммоля) и воды (1 мл) в диметиловом эфире (6 мл) в виде одной порции добавляли смесь Pd(Ph3P)4 (12 мг, 0,01 ммоля) и фенилборной кислоты (75 мг, 0,62 ммоля). Полученную смесь нагревали с обратным холодильником в течение 18 часов, разбавляли толуолом, промывали водой, рассолом, сушили над K2CO3 и концентрировали в условиях вакуума с образованием красного воска. После очистки посредством хроматографии (силикагель, смесь 35% EtOAc и гексана) было получено 145 мг (85%) светлого масла; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.69- 0.79 (М,1H), 0.89 (т, J= 7.2 Гц, 3H), 0.93-0.98 (м,1H), 1.01-1.08 (м,1H), 1.51-1.64 (м,2H), 1.79-1.86 (м, 1H), 2.01 (т: J=7.2 Гц,2H), 2.78-2.86 (м,1H), 3.21- 3.30 (м,1H), 3.79 (с, 3H), 5.04 (широкий синглет,1H), 6.50 (с,1H), 6.74 (д, J=8.4 Гц,1H), 7.12 (д, J=8.5 Гц,1H), 7.30-7.43 (м,5H); : 0.69- 0.79 (М,1H), 0.89 (т, J= 7.2 Гц, 3H), 0.93-0.98 (м,1H), 1.01-1.08 (м,1H), 1.51-1.64 (м,2H), 1.79-1.86 (м, 1H), 2.01 (т: J=7.2 Гц,2H), 2.78-2.86 (м,1H), 3.21- 3.30 (м,1H), 3.79 (с, 3H), 5.04 (широкий синглет,1H), 6.50 (с,1H), 6.74 (д, J=8.4 Гц,1H), 7.12 (д, J=8.5 Гц,1H), 7.30-7.43 (м,5H);инфракрасный спектр (пленка NaCl) 3296, 2962, 1644, 1610, 1550, 1482 см-1; масс-спектр (ESI) m/e 323. Результаты анализа, высчитанные для C21H25NO2  0,5(H2O): 0,5(H2O):C 75.87, H 7.88, N 4.21; обнаружено: C 75.95, H 7.86, N 4.15. Пример 12 (способ получения 12). Получение (  )-(транс)-[2,2-дифтор-3-(3-метоксифенил) циклопропилметил] бутанамида.
Стадия i.
(a) ( )-(транс)-[2,2-дифтор-3-(3-метоксифенил) циклопропилметил] бутанамида.
Стадия i.
(a) ( )-(транс)-3-(3-метоксифенил)-проп-2-ен-1-ол.
Раствор 3-метокси-коричной кислоты (50,24 г, 281 ммоль) в 400 мл безводного тетрагидрофурана добавляли к перемешиваемой с помощью магнитной мешалки суспензии борогидрида натрия (12,80 г, 338 ммолей) в 500 мл безводного тетрагидрофурана, находившейся при комнатной температуре. Суспензию перемешивали до тех пор, пока не прекращалось выделение газа, охлаждали до 0oC и в течение 1 часа добавляли раствор иода (35,77 г, 141 ммоля) в безводном тетрагидрофуране (500 мл). Эту суспензию перемешивали в течение 3 часов и по каплям добавляли 4 н. раствор хлористоводородной кислоты (100 мл). Полученную суспензию экстрагировали простым диэтиловым эфиром (3х500 мл) и соединенные органические порции промывали 3 н. раствором NaOH (3х500 мл), рассолом (500 мл), сушили (MgSO4), фильтровали и концентрировали в условиях вакуума. После перегонки по методу Кюгельрора (0,5 мм) получили указанное в заголовке соединение в виде светлой жидкости (23,12 г, 50%); )-(транс)-3-(3-метоксифенил)-проп-2-ен-1-ол.
Раствор 3-метокси-коричной кислоты (50,24 г, 281 ммоль) в 400 мл безводного тетрагидрофурана добавляли к перемешиваемой с помощью магнитной мешалки суспензии борогидрида натрия (12,80 г, 338 ммолей) в 500 мл безводного тетрагидрофурана, находившейся при комнатной температуре. Суспензию перемешивали до тех пор, пока не прекращалось выделение газа, охлаждали до 0oC и в течение 1 часа добавляли раствор иода (35,77 г, 141 ммоля) в безводном тетрагидрофуране (500 мл). Эту суспензию перемешивали в течение 3 часов и по каплям добавляли 4 н. раствор хлористоводородной кислоты (100 мл). Полученную суспензию экстрагировали простым диэтиловым эфиром (3х500 мл) и соединенные органические порции промывали 3 н. раствором NaOH (3х500 мл), рассолом (500 мл), сушили (MgSO4), фильтровали и концентрировали в условиях вакуума. После перегонки по методу Кюгельрора (0,5 мм) получили указанное в заголовке соединение в виде светлой жидкости (23,12 г, 50%);спектр ЯМР 1H (300 МГц, CDCl3)  : 3.82 (с,3H), 4.34 (д,J=6 Гц, 2H), 6.37 (двойной триплет, J=15.6 Гц,1H), 6.60 (д,J=15 Гц,1H), 6.80 (двойной дублет, J= 8,1=1 Гц,1H), 6.93 (т,J=1 Гц,1H), 7.00 (д,J=8 Гц,1H), 7.24 (т, J=8 Гц,1H).
Стадия iii.
(b) (3-(3-метоксифенил)аллиловый эфир ( : 3.82 (с,3H), 4.34 (д,J=6 Гц, 2H), 6.37 (двойной триплет, J=15.6 Гц,1H), 6.60 (д,J=15 Гц,1H), 6.80 (двойной дублет, J= 8,1=1 Гц,1H), 6.93 (т,J=1 Гц,1H), 7.00 (д,J=8 Гц,1H), 7.24 (т, J=8 Гц,1H).
Стадия iii.
(b) (3-(3-метоксифенил)аллиловый эфир ( )-(транс)-уксусной кислоты.
В перемешиваемый с помощью магнитной мешалки раствор ( )-(транс)-уксусной кислоты.
В перемешиваемый с помощью магнитной мешалки раствор ( )- (транс)-3-(3-метоксифенил)-проп-2-ен-1-ола (22,35 г, 136 ммолей) в безводном пиридине (115 мл), находившийся при температуре 0oC, по каплям добавляли уксусный ангидрид (16,0 мл, 170 ммолей). После окончания добавления ледяную баню удаляли, раствор оставляли для нагревания до комнатной температуры и перемешивали в течение 24 часов. Полученный раствор концентрировали с условиях вакуума, а остаток вываривали вместе с простым диэтиловым эфиром (300 мл), промывали 1 н. раствором HCl (2х300 мл), 5% NaHCO3 (200 мл), водой (200 мл), рассолом (200 мл), сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с образованием светлой жидкости. После испарительной хроматографии (элюирование смесью 5% простого диэтилового эфира и гексана) и перегонки полученной жидкости по методу Кюгельрора (0,5 мм) был получен требуемый продукт в виде светлой жидкости (16,95 г, 60%); )- (транс)-3-(3-метоксифенил)-проп-2-ен-1-ола (22,35 г, 136 ммолей) в безводном пиридине (115 мл), находившийся при температуре 0oC, по каплям добавляли уксусный ангидрид (16,0 мл, 170 ммолей). После окончания добавления ледяную баню удаляли, раствор оставляли для нагревания до комнатной температуры и перемешивали в течение 24 часов. Полученный раствор концентрировали с условиях вакуума, а остаток вываривали вместе с простым диэтиловым эфиром (300 мл), промывали 1 н. раствором HCl (2х300 мл), 5% NaHCO3 (200 мл), водой (200 мл), рассолом (200 мл), сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с образованием светлой жидкости. После испарительной хроматографии (элюирование смесью 5% простого диэтилового эфира и гексана) и перегонки полученной жидкости по методу Кюгельрора (0,5 мм) был получен требуемый продукт в виде светлой жидкости (16,95 г, 60%);спектр ЯМР 1H (300 МГц, CDCl3)  : 2.11 (с,3H), 3.81 (с,3H), 4.73 (д,J=6 Гц, 2H), 6.28 (двойной триплет, J=15.6 Гц,1H), 6.63 (д, J=15 Гц,1H), 6.82 (двойной дублет, J=8, 1 Гц,1H), 6.92 (т, J=1 Гц, 1H), 6.99 (д, J=8 Гц,1H), 7.24 (т, J=8 Гц,1H).
Стадия iii.
(c) 2,2-дифтор-3-(3-метоксифенил)циклопропилметиловый эфир : 2.11 (с,3H), 3.81 (с,3H), 4.73 (д,J=6 Гц, 2H), 6.28 (двойной триплет, J=15.6 Гц,1H), 6.63 (д, J=15 Гц,1H), 6.82 (двойной дублет, J=8, 1 Гц,1H), 6.92 (т, J=1 Гц, 1H), 6.99 (д, J=8 Гц,1H), 7.24 (т, J=8 Гц,1H).
Стадия iii.
(c) 2,2-дифтор-3-(3-метоксифенил)циклопропилметиловый эфир  )-(транс)-уксусной кислоты.
Раствор (3-(3-метоксифенил) аллилового эфира ( )-(транс)-уксусной кислоты.
Раствор (3-(3-метоксифенил) аллилового эфира ( )-(транс)- уксусной кислоты (1,63 г, 7.90 ммоля) в безводном диглиме нагревали с обратным холодильником, а затем в течение 1 часа по каплям добавляли раствор хлордифторацетата натрия (9,02 г, 59,2 ммоля) в безводном диглиме (25 мл). Полученную суспензию охлаждали до комнатной температуры и выливали на 200 мл льда. Эту суспензию экстрагировали простым диэтиловым эфиром (4х200 мл), а соединенные органические экстракты промывали водой (3х400 мл), рассолом (400 мл), сушили (MgSO4), фильтровали и концентрировали в условиях вакуума. После перегонки по методу Кюгельрора (0,5 мм) было получено 1,59 г (79%) продукта в виде светлого масла: )-(транс)- уксусной кислоты (1,63 г, 7.90 ммоля) в безводном диглиме нагревали с обратным холодильником, а затем в течение 1 часа по каплям добавляли раствор хлордифторацетата натрия (9,02 г, 59,2 ммоля) в безводном диглиме (25 мл). Полученную суспензию охлаждали до комнатной температуры и выливали на 200 мл льда. Эту суспензию экстрагировали простым диэтиловым эфиром (4х200 мл), а соединенные органические экстракты промывали водой (3х400 мл), рассолом (400 мл), сушили (MgSO4), фильтровали и концентрировали в условиях вакуума. После перегонки по методу Кюгельрора (0,5 мм) было получено 1,59 г (79%) продукта в виде светлого масла:спектр ЯМР 1H (300 МГц, CDCl3)  : 2.10 (с,3H), 2.24 (дважды двойной триплет, J= 15, 7.5, 7 Гц,1H), 2.63 (двойной дублет, J=15, 7.5 Гц,1H), 3.80 (с, 3H), 4.19-4.25 (м,1H), 4.31-4.37 (м,1H), 6.74-6.83 (м,3H), 7.25 (т, J=8 Гц,1H).
Стадия iv.
(d) ( : 2.10 (с,3H), 2.24 (дважды двойной триплет, J= 15, 7.5, 7 Гц,1H), 2.63 (двойной дублет, J=15, 7.5 Гц,1H), 3.80 (с, 3H), 4.19-4.25 (м,1H), 4.31-4.37 (м,1H), 6.74-6.83 (м,3H), 7.25 (т, J=8 Гц,1H).
Стадия iv.
(d) ( )-(транс)-(2,2-дифтор-3-(3-метоксифенил)циклопропил] метанол.
Перемешиваемый с помощью магнитной мешалки раствор гидроксида калия (2,39 г, 42,6 ммоля) в смеси метанола и тетра-гидрофурана с соотношением 3:1 (88 мл) обрабатывали 2,2-дифтор-3- (3-метоксифенил) циклопропилметиловым эфиром )-(транс)-(2,2-дифтор-3-(3-метоксифенил)циклопропил] метанол.
Перемешиваемый с помощью магнитной мешалки раствор гидроксида калия (2,39 г, 42,6 ммоля) в смеси метанола и тетра-гидрофурана с соотношением 3:1 (88 мл) обрабатывали 2,2-дифтор-3- (3-метоксифенил) циклопропилметиловым эфиром  )-(транс)-уксусной кислоты (4,16 г, 16,2 ммоля). Этот раствор перемешивали в течение 2 часов и концентрировали в условиях вакуума. Остаток вываривали вместе с простым диэтиловым эфиром (200 мл) и водой (200 мл), слои разделяли, водный слой экстрагировали простым диэтиловым эфиром (2х200 мл), органические экстракты промывали насыщенным раствором NaHCO3 (300 мл), водой (300 мл), рассолом (300 мл), сушили (MgSO4), фильтровали и и концентрировали в условиях вакуума с образованием 3,42 г (99%) светлого масла, которое использовали без дальнейшей очистки: )-(транс)-уксусной кислоты (4,16 г, 16,2 ммоля). Этот раствор перемешивали в течение 2 часов и концентрировали в условиях вакуума. Остаток вываривали вместе с простым диэтиловым эфиром (200 мл) и водой (200 мл), слои разделяли, водный слой экстрагировали простым диэтиловым эфиром (2х200 мл), органические экстракты промывали насыщенным раствором NaHCO3 (300 мл), водой (300 мл), рассолом (300 мл), сушили (MgSO4), фильтровали и и концентрировали в условиях вакуума с образованием 3,42 г (99%) светлого масла, которое использовали без дальнейшей очистки:спектр ЯМР 1H (300 МГц, CDCl3)  : 1.60 (широкий синглет,1H), 2.15-2.36 (м, 1H), 2.60 (дважды двойной дублет, J=15, 7.5, 1.5 Гц, 1H), 3.81 (с,3H), 3.83-3.98 (м, 2H), 6.77 (т, J=1 Гц,1H), 6.81 (д,J= 8 Гц, 1H), 6.82 (двойной дублет, J=8, 1 Гц,1H), 7.26 (т, J=8 Гц,1H).
Стадия v.
(e) (f) (a) ( : 1.60 (широкий синглет,1H), 2.15-2.36 (м, 1H), 2.60 (дважды двойной дублет, J=15, 7.5, 1.5 Гц, 1H), 3.81 (с,3H), 3.83-3.98 (м, 2H), 6.77 (т, J=1 Гц,1H), 6.81 (д,J= 8 Гц, 1H), 6.82 (двойной дублет, J=8, 1 Гц,1H), 7.26 (т, J=8 Гц,1H).
Стадия v.
(e) (f) (a) ( )-(транс)-[2, 2-дифтор-3-(3-метоксифенил) циклопропил]метанамин.
К перемешиваемому с помощью магнитной мешалки раствору спирта (3,27 г, 15,3 ммоля), триэтиламина (3,14 г, 31,0 ммоль) и CH2Cl2 (50 мл), находившемуся при 0oC под слоем азота, в течение 15 минут по каплям добавляли метансульфонилхлорид (2,8 г, 24,4 ммоля). Раствор перемешивали в течение 30 минут, разбавляли CH2Cl2 (200 мл) и последовательно промывали водой (200 мл) и насыщенным раствором NaHCO3 (200 мл), сушили (K2CO3), фильтровали и концентрировали в условиях вакуума при температуре 5oC. Остаток вываривали с безводным диметилформамидом (50 мл), обрабатывали азидом натрия (1,96 г, 30,1 ммоля) и перемешивали в течение 14 часов. Полученный раствор выливали в воду (500 мл), экстрагировали простым диэтиловым эфиром (4х250 мл), соединенные экстракты промывали водой (4х500 мл), рассолом (2х300 мл), сушили (MgSO4), фильтровали и концентрировали в условиях вакуума (осторожно !) с образованием светлого масла. Это масло вываривали с безводным простым диэтиловым эфиром (40 мл) и по каплям добавляли к перемешиваемой с помощью магнитной мешалки суспензии алюмогидрида лития (1,16 г, 30,6 ммоля) в безводном простом диэтиловом эфире (60 мл), находившейся при температуре -30oC. Суспензию оставляли для нагревания в течение 3 часов, вновь охлаждали до -30oC и по каплям добавляли раствор KHSO4 (2,6 г, 19 ммолей) в воде (20 мл). Полученную суспензию оставляли для нагревания до комнатной температуры, перемешивали в течение 1 часа и фильтровали через целит с последующим элюированием простым диэтиловым эфиром (400 мл). Слои разделяли и органический слой экстрагировали 1 н. раствором HCl (3х100 мл), соединенные водные экстракты подщелачивали 50% NaOH и экстрагировали CH2Cl2 (3х150 мл). Органическую часть промывали рассолом (200 мл), сушили (K2CO3), фильтровали и концентрировали в условиях вакуума с образованием 1,23 г (38%) светлого масла; )-(транс)-[2, 2-дифтор-3-(3-метоксифенил) циклопропил]метанамин.
К перемешиваемому с помощью магнитной мешалки раствору спирта (3,27 г, 15,3 ммоля), триэтиламина (3,14 г, 31,0 ммоль) и CH2Cl2 (50 мл), находившемуся при 0oC под слоем азота, в течение 15 минут по каплям добавляли метансульфонилхлорид (2,8 г, 24,4 ммоля). Раствор перемешивали в течение 30 минут, разбавляли CH2Cl2 (200 мл) и последовательно промывали водой (200 мл) и насыщенным раствором NaHCO3 (200 мл), сушили (K2CO3), фильтровали и концентрировали в условиях вакуума при температуре 5oC. Остаток вываривали с безводным диметилформамидом (50 мл), обрабатывали азидом натрия (1,96 г, 30,1 ммоля) и перемешивали в течение 14 часов. Полученный раствор выливали в воду (500 мл), экстрагировали простым диэтиловым эфиром (4х250 мл), соединенные экстракты промывали водой (4х500 мл), рассолом (2х300 мл), сушили (MgSO4), фильтровали и концентрировали в условиях вакуума (осторожно !) с образованием светлого масла. Это масло вываривали с безводным простым диэтиловым эфиром (40 мл) и по каплям добавляли к перемешиваемой с помощью магнитной мешалки суспензии алюмогидрида лития (1,16 г, 30,6 ммоля) в безводном простом диэтиловом эфире (60 мл), находившейся при температуре -30oC. Суспензию оставляли для нагревания в течение 3 часов, вновь охлаждали до -30oC и по каплям добавляли раствор KHSO4 (2,6 г, 19 ммолей) в воде (20 мл). Полученную суспензию оставляли для нагревания до комнатной температуры, перемешивали в течение 1 часа и фильтровали через целит с последующим элюированием простым диэтиловым эфиром (400 мл). Слои разделяли и органический слой экстрагировали 1 н. раствором HCl (3х100 мл), соединенные водные экстракты подщелачивали 50% NaOH и экстрагировали CH2Cl2 (3х150 мл). Органическую часть промывали рассолом (200 мл), сушили (K2CO3), фильтровали и концентрировали в условиях вакуума с образованием 1,23 г (38%) светлого масла;спектр ЯМР 1H (300 МГц, CDCl3)  : 1.42 (широкий синглет,2H), 1.97-2.08 (м, 1H), 2.44- 2.52 (м,1H), 2.91-3.10 (м,2H), 3.80 (с,3H), 6.76 (т, J=1 Гц, 1H), 6.81 (д, J=8 Гц,1H), 6.81 (двойной дублет, J=8, 1 Гц,1H), 7.23 (т, J=8 Гц,1H).
Стадия v.
(h) ( : 1.42 (широкий синглет,2H), 1.97-2.08 (м, 1H), 2.44- 2.52 (м,1H), 2.91-3.10 (м,2H), 3.80 (с,3H), 6.76 (т, J=1 Гц, 1H), 6.81 (д, J=8 Гц,1H), 6.81 (двойной дублет, J=8, 1 Гц,1H), 7.23 (т, J=8 Гц,1H).
Стадия v.
(h) ( )-(транс)-[2,2-дифтор-3-(3-метоксифенил)циклопропилметил] бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору ( )-(транс)-[2,2-дифтор-3-(3-метоксифенил)циклопропилметил] бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору ( )- (транс)-[2,2-дифтор-3-(3-метоксифенил)циклопропил] метанамина (672 мг, 3,16 ммоля) и триэтиламина (1,5 мл) в безводном CH2Cl2 (20 мл) по каплям добавляли раствор бутирилхлорида (370 мг, 3,47 ммоля) в безводном CH2Cl2 (3 мл). Раствор перемешивали в течение 48 часов и концентрировали в условиях вакуума. Остаток вываривали с CH2Cl2 (100 мл) и промывали 1 н. раствором HCl (100 мл), 1 н. раствором NaOH (100 мл), рассолом (100 мл), сушили (K2CO3), фильтровали и концентрировали в условиях вакуума. После испарительной хроматографии (элюирование смесью гексанов и этилацетата с соотношением 2:1) был получен требуемый продукт в виде светлого масла, который после выстаивания затвердевал и превращался в воскообразное вещество: )- (транс)-[2,2-дифтор-3-(3-метоксифенил)циклопропил] метанамина (672 мг, 3,16 ммоля) и триэтиламина (1,5 мл) в безводном CH2Cl2 (20 мл) по каплям добавляли раствор бутирилхлорида (370 мг, 3,47 ммоля) в безводном CH2Cl2 (3 мл). Раствор перемешивали в течение 48 часов и концентрировали в условиях вакуума. Остаток вываривали с CH2Cl2 (100 мл) и промывали 1 н. раствором HCl (100 мл), 1 н. раствором NaOH (100 мл), рассолом (100 мл), сушили (K2CO3), фильтровали и концентрировали в условиях вакуума. После испарительной хроматографии (элюирование смесью гексанов и этилацетата с соотношением 2:1) был получен требуемый продукт в виде светлого масла, который после выстаивания затвердевал и превращался в воскообразное вещество:спектр ЯМР 1H (300 МГц, CDCl3)  : 0.92 (т, J=7.4 Гц,3H), 1.64 (секстет, J= 7.4 Гц,2H), 2.09-2.21 (м,1H), 2.16 (т,J=7.4 Гц,2H), 2.51 (двойной дублет, J= 13.8, 7.4 Гц, 1H), 3.19-3.22 (м,1H), 3.76 (с,3H), 3.77-3.85 (м,1H),5.90 (широкий синглет, 1H), 6.70 (с,1H), 6.75 (д, J=8 Гц,1H), 6.77 (двойной дублет,J=8, 1 Гц,1H), 7.20 (т, J=8 Гц,1H); : 0.92 (т, J=7.4 Гц,3H), 1.64 (секстет, J= 7.4 Гц,2H), 2.09-2.21 (м,1H), 2.16 (т,J=7.4 Гц,2H), 2.51 (двойной дублет, J= 13.8, 7.4 Гц, 1H), 3.19-3.22 (м,1H), 3.76 (с,3H), 3.77-3.85 (м,1H),5.90 (широкий синглет, 1H), 6.70 (с,1H), 6.75 (д, J=8 Гц,1H), 6.77 (двойной дублет,J=8, 1 Гц,1H), 7.20 (т, J=8 Гц,1H);инфракрасный спектр (пленка NaCl) 3302, 2960, 1644, 1552, 1288, 1266, 1250, 1160 см-1; масс-спектр (изобутан-DCl) m/e 282 (M-H–). Результаты анализа, высчитанные для C15H19NO2F2: C 63.59, H 6.76, N 4.94; обнаружено: C 63.59, H 6.83, N 4.85. Пример 13 (способ получения 13). Получение (транс)-N-[[2-(2-бутириламино-5-метоксифенил) циклопропил] метил]бутанамидa. Стадия i. (a) (транс)-N-[[2-(2-амино-5-метоксифенил)циклопропан] метило]амин. В сосуд Парра выливали суспензию (транс)-2-(2-нитро-5- метоксифенил)циклопропанкарбоксальдегидоксима (1,0 г, 4,2 ммоля), 10% палладированного угля (100 мг) и HOAc (25 мл) и в течение 18 часов встряхивали ее в атмосфере водорода (3,5 ат). Полученное вещество фильтровали через целит, вываривали с водой (300 мл) и подщелачивали 10 н. раствором NaOH. Этот продукт затем экстрагировали с помощью CH2Cl2, экстракты соединяли, сушили над K2CO3 и концентрировали в условиях вакуума с образованием 800 мг (100%) красного масла: спектр ЯМР 1H (300 МГц, CDCl3)  : 0.78-0.85 (м,1H), 1.34-1.39 (м,1H), 1,59-1.69 (м, 1H), 1.77-1.83 (м,1H), 1.88 (широкий синглет, 2H), 3.10-3.38 (м, 2H), 3.66 (с,3H), 6.39 (д,J=6.0 Гц,1H), 6.50-6.59 (м,1H), 6.61 (широкий синглет, 2H), 6.78-6.97 (м,1H).
Стадия ii.
(b) (транс)-N-[[2-(2-бутириламино-5-метоксифенил)циклопропил] метил]бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору (транс)-N-[[2-(2-амино-5-метоксифенил)циклопропан] метил]амина (400 мг, 2,2 ммоля) и Et3N (0,86 мл, 6,6 ммоля) в сухом CH2Cl2 (15 мл), находившемуся при температуре 0oC, по каплям добавляли бутирилхлорид (256 мг, 2,4 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. После концентрирования путем ротационного выпаривания был получен продукт, который затем очищали посредством испарительной хроматографии (силикагель, смесь 30% EtOAc и гексана), что позволило получить 250 мг (44%) светлого масла; : 0.78-0.85 (м,1H), 1.34-1.39 (м,1H), 1,59-1.69 (м, 1H), 1.77-1.83 (м,1H), 1.88 (широкий синглет, 2H), 3.10-3.38 (м, 2H), 3.66 (с,3H), 6.39 (д,J=6.0 Гц,1H), 6.50-6.59 (м,1H), 6.61 (широкий синглет, 2H), 6.78-6.97 (м,1H).
Стадия ii.
(b) (транс)-N-[[2-(2-бутириламино-5-метоксифенил)циклопропил] метил]бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору (транс)-N-[[2-(2-амино-5-метоксифенил)циклопропан] метил]амина (400 мг, 2,2 ммоля) и Et3N (0,86 мл, 6,6 ммоля) в сухом CH2Cl2 (15 мл), находившемуся при температуре 0oC, по каплям добавляли бутирилхлорид (256 мг, 2,4 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. После концентрирования путем ротационного выпаривания был получен продукт, который затем очищали посредством испарительной хроматографии (силикагель, смесь 30% EtOAc и гексана), что позволило получить 250 мг (44%) светлого масла;спектр ЯМР 1H (300 МГц, CDCl3)  : 0.75-1.04 (м,3H), 1.50-1.76 (м,5H), 2.10 (т, J= 8.1 Гц,2H), 2.45 (т, J=8.0 Гц,2H), 2.68- 1.78 (м,1H), 3.69 (c, 3H), 3.72-3.78 (м, 2H), 6.27 (д, J=2.0 Гц,1H), 6.36 (широкий синглет,1H), 6.63 (двойной дублет, J= 7.8, 2.7 Гц, 1H), 7.50 (д, J=8.7 Гц,1H), 7.89 (широкий синглет,1H); : 0.75-1.04 (м,3H), 1.50-1.76 (м,5H), 2.10 (т, J= 8.1 Гц,2H), 2.45 (т, J=8.0 Гц,2H), 2.68- 1.78 (м,1H), 3.69 (c, 3H), 3.72-3.78 (м, 2H), 6.27 (д, J=2.0 Гц,1H), 6.36 (широкий синглет,1H), 6.63 (двойной дублет, J= 7.8, 2.7 Гц, 1H), 7.50 (д, J=8.7 Гц,1H), 7.89 (широкий синглет,1H);инфракрасный спектр (пленка NaCl) 3290, 2961, 1647, 1534, 1425 см-1; масс-спектр (ESI) m/e 332. Результаты анализа, высчитанные для C19H28N2O3  0,4H2O: 0,4H2O:C 67.19, H 8.54, N 8.24; обнаружено: C 67.58, H 8.19, N 7.77. Пример 14 (способ получения 14). Получение (-)-(транс)-N-[1-2-(3-метоксифенил)циклoпpoпил]этил] бутaнaмидa (изомер A). Стадия i. (a) (-)-(транс)-1-[2-(3-метоксифенил)циклопропил] этанол (изомер A) и (-)-(транс)-1-[2-(3-метоксифенил)циклопропил]этанол (изомер B). Диметилсульфоксид (3,98 мл, 56 ммолей) по каплям добавляли к раствору оксалилхлорида (2 М раствор в CH2Cl2, 19,5 мл, 39 ммолей) в метиленхлориде (20 мл), находившемуся при температуре -78oC. Вслед за этим по каплям добавляли раствор (-)-(транс)-[2-(3-метоксифенил)циклопропил]метанола (5,0 г, 28 ммолей) в дихлорметане (10 мл). Этот раствор перемешивали в течение 30 минут, после чего медленно добавляли триэтиламин (16,2 мл, 112 ммоля) и полученную суспензию оставляли для нагревания до комнатной температуры. Эту суспензию перемешивали в течение 30 минут, разбавляли CH2Cl2 (100 мл), промывали водой, сушили над K2CO3 и концентрировали в условиях вакуума с образованием 5,8 г альдегида, который использовали без дальнейшей очистки. Альдегид вываривали с тетрагидрофураном (10 мл) и по каплям добавляли к раствору бромида метилмагния (3 М раствор в простом этиловом эфире, 23,3 мл, 70 ммолей) в тетрагидрофуране (25 мл), находившемуся при температуре 0oC. Этот раствор перемешивали при 0oC в течение 2 часов, после чего добавляли 2 н. раствор HCl (20 мл) в EtOAc. Полученную суспензию промывали водой, рассолом, сушили (K2CO3) и концентрировали в условиях вакуума с образованием 5,5 г неочищенного масла. После очистки посредством хроматографии на силикагеле (смесь 25% EtOAc и гексана) были получены два диастереомера, (изомер А) 1,66 г, первая полоса, и (изомер В) 1,64 г, вторая полоса: (изомер A) Rf= 0,45 (смесь 25% EtOAc с гексанами); спектр ЯМР 1H (300 МГц, CDCl3)  : 0.84-0.94 (м,2H), 1.19-1.27 (м,1H), 1.30 (д, J= 6,3 Гц, 3H), 1.83-2.02 (м,1H), 3.32-3.38 (м,1H), 3.77 (с,3H), 6.60-6.73 (м,3H), 7.12 (т,J=7.8 Гц,1H); : 0.84-0.94 (м,2H), 1.19-1.27 (м,1H), 1.30 (д, J= 6,3 Гц, 3H), 1.83-2.02 (м,1H), 3.32-3.38 (м,1H), 3.77 (с,3H), 6.60-6.73 (м,3H), 7.12 (т,J=7.8 Гц,1H);[  ]2D0 -49,0o (c=1, CH2Cl2).
(изомер В) Rf = 0,40 (смесь 25% EtOAc с гексанами); ]2D0 -49,0o (c=1, CH2Cl2).
(изомер В) Rf = 0,40 (смесь 25% EtOAc с гексанами);спектр ЯМР 1H (300 МГц, CDCl3)  : 0.93-1.00 (м,2H), 1,21-1.29 (м,1H), 1.32 (д, J= 6.3 Гц, 3H), 1.75-1.78 (м,1H), 3.33-3.38 (м,1H), 3.77 (с,3H), 6.59-6.69 (м,3H), 7.15 (т,J=7.8 Гц,1H); : 0.93-1.00 (м,2H), 1,21-1.29 (м,1H), 1.32 (д, J= 6.3 Гц, 3H), 1.75-1.78 (м,1H), 3.33-3.38 (м,1H), 3.77 (с,3H), 6.59-6.69 (м,3H), 7.15 (т,J=7.8 Гц,1H);[  ]2D0 -55,3o (с=1, CH2Cl2).
Стадия ii.
(b) (-)-(транс)-2-[1-[2-(3-метоксифенил)циклопропил] этил] изоиндол-1,3-дион (изомер A).
Диэтилазодикарбоксилат (1,79 г, 10,3 ммоля) по каплям добавляли к перемешиваемому раствору (-)-(транс)-1-[2-(3- метоксифенил)циклопропил]этанола (изомер A) (1,66 г, 8,6 ммоля), трифенилфосфина (2,69 г, 10,3 ммоля) и фталимида (1,52 г, 10,3 ммоля) в тетрагидрофуране (75 мл), находившемуся при 0oC. Реакционную смесь оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. Растворитель удаляли в условиях вакуума, полученный остаток вываривали с EtOAc (150 мл) и последовательно промывали 1 н. раствором HCl, 1 н. раствором NaOH и рассолом. После сушки над K2CO3, фильтрования и концентрирования в условиях вакуума было получено 2,6 г (94%) продукта в виде воскообразного белого твердого вещества: ]2D0 -55,3o (с=1, CH2Cl2).
Стадия ii.
(b) (-)-(транс)-2-[1-[2-(3-метоксифенил)циклопропил] этил] изоиндол-1,3-дион (изомер A).
Диэтилазодикарбоксилат (1,79 г, 10,3 ммоля) по каплям добавляли к перемешиваемому раствору (-)-(транс)-1-[2-(3- метоксифенил)циклопропил]этанола (изомер A) (1,66 г, 8,6 ммоля), трифенилфосфина (2,69 г, 10,3 ммоля) и фталимида (1,52 г, 10,3 ммоля) в тетрагидрофуране (75 мл), находившемуся при 0oC. Реакционную смесь оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. Растворитель удаляли в условиях вакуума, полученный остаток вываривали с EtOAc (150 мл) и последовательно промывали 1 н. раствором HCl, 1 н. раствором NaOH и рассолом. После сушки над K2CO3, фильтрования и концентрирования в условиях вакуума было получено 2,6 г (94%) продукта в виде воскообразного белого твердого вещества:спектр ЯМР 1H (300 МГц, CDCl3)  : 0.80-0.92 (м,2H), 1.48-1.60 (м,4H), 1.81-1.88 (м,1H), 1.91-2.00 (м,1H), 3.76 (с,3H), 6.58-6.70 (м,3H), 7.15 (т, J=7,8 Гц,1H), 7.24-7.80 (м,4H).
Стадия iii.
(c) (-)-(транс)-1-[2-(3-метоксифенил)циклопропил]этиламин (изомер A).
Раствор (-)-(транс)-2-[1-[2-(3-метоксифенил) циклопропил] этил] изоиндол-1,3-диона (изомер A) (2,6 г, 8,1 ммоля) и гидразина (827 г, 25,6 ммоля) в этаноле (75 мл) перемешивали при комнатной температуре в течение 18 часов. Полученную белую пасту разбавляли этанолом (100 мл), обрабатывали 10 н. раствором HCl (10 мл) и перемешивали в течение 1 часа. Этот раствор обрабатывали EtOAc (200 мл) и экстрагировали 1 н. раствором HCl. Кислые вытяжки соединяли, промывали простым этиловым эфиром, подщелачивали (10 н. раствор NaOH) и экстрагировали CH2Cl2. Органические вещества сушили над K2CO3 и концентрировали в условиях вакуума с образованием 1,1 г неочищенного масла. После очистки посредством хроматографии на силикагеле (смесь 10% метилового спирта и CH2Cl2) было получено светлое масло (600 мл, 40%): : 0.80-0.92 (м,2H), 1.48-1.60 (м,4H), 1.81-1.88 (м,1H), 1.91-2.00 (м,1H), 3.76 (с,3H), 6.58-6.70 (м,3H), 7.15 (т, J=7,8 Гц,1H), 7.24-7.80 (м,4H).
Стадия iii.
(c) (-)-(транс)-1-[2-(3-метоксифенил)циклопропил]этиламин (изомер A).
Раствор (-)-(транс)-2-[1-[2-(3-метоксифенил) циклопропил] этил] изоиндол-1,3-диона (изомер A) (2,6 г, 8,1 ммоля) и гидразина (827 г, 25,6 ммоля) в этаноле (75 мл) перемешивали при комнатной температуре в течение 18 часов. Полученную белую пасту разбавляли этанолом (100 мл), обрабатывали 10 н. раствором HCl (10 мл) и перемешивали в течение 1 часа. Этот раствор обрабатывали EtOAc (200 мл) и экстрагировали 1 н. раствором HCl. Кислые вытяжки соединяли, промывали простым этиловым эфиром, подщелачивали (10 н. раствор NaOH) и экстрагировали CH2Cl2. Органические вещества сушили над K2CO3 и концентрировали в условиях вакуума с образованием 1,1 г неочищенного масла. После очистки посредством хроматографии на силикагеле (смесь 10% метилового спирта и CH2Cl2) было получено светлое масло (600 мл, 40%):спектр ЯМР 1H (300 МГц, CDCl3)  : 0.85-0.98 (м,2H), 1.10- 1.20 (м,1H), 1.25 (д, J=6.0 Гц,3H), 1.70-1.79 (м,1H), 2.30 (широкий синглет,2H), 2.48-2.52 (м,1H), 3.75 (с,3H), 6.58-6.75 (м,3H), 7.15 (т,J=7.0 Гц,1H).
Стадия iv.
(d) (-)-(транс)-N-[1-[2-(3-метоксифенил)циклопропил] этил] бутанамин (изомер A).
К перемешиваемому с помощью магнитной мешалки раствору (-)-(транс)-1-[2-(3-метоксифенил)циклопропил]этиламина (изомер A) (200 мг, 1,1 ммоля) и E3 (0,46 мл, 3,3 ммоля) в сухом дихлорметане (15 мл), находившемуся при 0oC, по каплям добавляли бутирилхлорид (127 мг, 1,2 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Растворитель удаляли в условиях вакуума, остаток вываривали с EtOAc (100 мл), последовательно промывали водой, 5% лимонной кислотой, 5% K2CO3, рассолом и сушили над K2CO3. После фильтрования и концентрирования в условиях вакуума был получен неочищенный продукт, который очищали посредством испарительной хроматографии (силикагель, смесь 40% EtOAc и гексана), что позволило получить 100 мг (39%) указанного в заголовке соединения: Rf = 0,75 (смесь 10% метилового спирта и CDCl3); : 0.85-0.98 (м,2H), 1.10- 1.20 (м,1H), 1.25 (д, J=6.0 Гц,3H), 1.70-1.79 (м,1H), 2.30 (широкий синглет,2H), 2.48-2.52 (м,1H), 3.75 (с,3H), 6.58-6.75 (м,3H), 7.15 (т,J=7.0 Гц,1H).
Стадия iv.
(d) (-)-(транс)-N-[1-[2-(3-метоксифенил)циклопропил] этил] бутанамин (изомер A).
К перемешиваемому с помощью магнитной мешалки раствору (-)-(транс)-1-[2-(3-метоксифенил)циклопропил]этиламина (изомер A) (200 мг, 1,1 ммоля) и E3 (0,46 мл, 3,3 ммоля) в сухом дихлорметане (15 мл), находившемуся при 0oC, по каплям добавляли бутирилхлорид (127 мг, 1,2 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Растворитель удаляли в условиях вакуума, остаток вываривали с EtOAc (100 мл), последовательно промывали водой, 5% лимонной кислотой, 5% K2CO3, рассолом и сушили над K2CO3. После фильтрования и концентрирования в условиях вакуума был получен неочищенный продукт, который очищали посредством испарительной хроматографии (силикагель, смесь 40% EtOAc и гексана), что позволило получить 100 мг (39%) указанного в заголовке соединения: Rf = 0,75 (смесь 10% метилового спирта и CDCl3);спектр ЯМР 1H (300 МГц, CDCl3)  : 0.85-0.97 (м,4H), 1.04-1.17 (м,2H), 1.24 (д, J=6.6 Гц,3H), 1.61-1.73 (м,2H), 1.77-1.83 (м,1H), 2.19 (т,J=7.6 Гц, 2H), 3.54-3.66 (м,1H), 3.77 (с,3H), 5.59 (с,1H), 6.57-6.71 (м,3H), 7.15 (т, J=7.6 Гц,1H); : 0.85-0.97 (м,4H), 1.04-1.17 (м,2H), 1.24 (д, J=6.6 Гц,3H), 1.61-1.73 (м,2H), 1.77-1.83 (м,1H), 2.19 (т,J=7.6 Гц, 2H), 3.54-3.66 (м,1H), 3.77 (с,3H), 5.59 (с,1H), 6.57-6.71 (м,3H), 7.15 (т, J=7.6 Гц,1H);инфракрасный спектр (пленка NaCl) 3291, 2963, 1640, 1543, 1455 см-1; масс-спектр (ESI) m/e 261. Результаты анализа, высчитанные для C16H23NO2: C 73.53, H 8.87, N 5.36; обнаружено: C 73.48, H 8.86, N 5.25. Пример 15 (способ получения 15). Получение (транс)-N-[[2-(3-(метилокси)фенил]циклопропи]метил] бутанамида Раствор (транс)-N-[[2-(3-гидpoкcифeнил)циклопропил] метил] – бутанамида (342 мг, 1,47 ммоля) и гидроксида натрия (58 мг, 1,45 ммоля) в безводном метаноле (10 мл) концентрировали в условиях вакуума, а остаток измельчали в порошок под слоем безводного толуола (3 мл). Эту суспензию обрабатывали раствором этиленкарбоната (259 мг, 2,94 ммоля) в безводном толуоле (5 мл). Полученную смесь нагревали с обратным холодильником в течение 12 часов, охлаждали до комнатной температуры и обрабатывали 3 н. раствором NaOH (100 мл), льдом (50 г) и простым диэтиловым эфиром (100 мл). Водный слой отделяли и экстрагировали свежим простым диэтиловым эфиром (2х100 мл). Соединенные органические экстракты промывали водой (200 мл), рассолом (200 мл), сушили (K2CO3), фильтровали и концентрировали в условиях вакуума. После испарительной хроматографии полученного масла (смесь гексана и этилацетата с соотношением 1:2) было получено 178 мг (44%) указанного в заголовке соединения в виде светлого масла; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.84-0.92 (м,2H), 0.91 (т,J=7.4 Гц, 2H), 1.21-1.32 (м,1H), 1.63 (секстет, J=7.4 Гц,2H), 1.72-1.78 (м,1H), 2.13 (т, J=7.4 Гц, 2H), 2.30 (широкий синглет, 1H), 3.16-3.34 (м,2H), 3.91 (т, J= 4.5 Гц,2H), 4.03 (т,J=4.5 Гц, 2H), 5.75 (широкий синглет,1H), 6.58 (т, J=1.5 Гц, 1H), 6.63 (д, J=8.0 Гц,1H), 6.68 (дважды двойной дублет, 0=8.0, 1.5, 1.5 Гц, 1H), 7.13 (т,J=8.0 Гц,1H); : 0.84-0.92 (м,2H), 0.91 (т,J=7.4 Гц, 2H), 1.21-1.32 (м,1H), 1.63 (секстет, J=7.4 Гц,2H), 1.72-1.78 (м,1H), 2.13 (т, J=7.4 Гц, 2H), 2.30 (широкий синглет, 1H), 3.16-3.34 (м,2H), 3.91 (т, J= 4.5 Гц,2H), 4.03 (т,J=4.5 Гц, 2H), 5.75 (широкий синглет,1H), 6.58 (т, J=1.5 Гц, 1H), 6.63 (д, J=8.0 Гц,1H), 6.68 (дважды двойной дублет, 0=8.0, 1.5, 1.5 Гц, 1H), 7.13 (т,J=8.0 Гц,1H);инфракрасный спектр (пленка NaCl) 3300, 3076, 2962, 1644, 1610, 1582, 1552 см-1; масс-спектр m/e 276 (M-H–). Результаты анализа, высчитанные для C16H23NO3: C 69.29, H 8.36, N 5.05; обнаружено: C 68.99, H 8.39, N 4.93. Пример 16 (способ получения 16). Получение (-)-(транс)-N-[[2-(3-метоксифенил)цикпопропил] этил] бутанамида. Стадия i. (a) (-)-(транс)-1-(цианометил)-2-(3-метоксифенил)циклопропан. К перемешиваемому с помощью магнитной мешалки раствору (-)-(транс)-2-(3-метоксифенил)циклопропанметанола (1,60 г, 8,8 ммоля) и триэтиламина (1,9 мл, 13,2 ммоля) в дихлорметане (150 мл), находившемуся при 0oC, по каплям добавляли метансульфонилхлорид (1,21 г, 10,6 ммоля). После окончания добавления ледяную баню удаляли и продолжали перемешивать в течение 1 часа. Этот раствор обрабатывали дихлорметаном (150 мл), промывали насыщенным раствором NaHCO3 и сушили K2CO3. После концентрирования в условиях вакуума было получено 1,78 г неочищенного масла, которое использовали без дальнейшей очистки. Мезилат растворяли в диметилформамиде (100 мл), обрабатывали цианидом натрия (862 мг, 17,6 ммоля) и перемешивали на паровой бане в течение 4 часов. Этот раствор концентрировали в условиях вакуума, остаток растворяли в простом этиловом эфире (100 мл), промывали водой, рассолом и удаляли растворитель в условиях вакуума с образованием 1,41 г (85%) светлого масла; спектр ЯМР 1H (300 МГц, CDCl3)  : 0.90-1.09 (м,2H), 1.23-1.30 (м,1H), 1.81-1.92 (м, 1H), 2.52-2.60 (м,2H)., 3.78 (с,3H), 6.58- 6.72 (м,3H), 7.19 (т, J=8.0 Гц,1H).
(b) (-)-(транс)-2-(3-метоксифенил)циклопропанэтиламин.
К перемешиваемой суспензии алюмогидрида лития (650 мг, 17 ммолей) в тетрагидрофуране (50 мл), находившейся при температуре -45oC, добавляли раствор (-)-(транс)-1-(цианометил)-2-(3- метоксифенил)циклопропана (1,41 г, 7,5 ммоля) в тетрагидрофуране (25 мл), поддерживая температуру ниже -30oC. После окончания добавления суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Затем ее вновь охлаждали до -45oC и по каплям осторожно добавляли 1 н. раствор HCl (50 мл). Полученную суспензию перемешивали при комнатной температуре в течение 30 минут, фильтровали через целит и тщательно промывали фильтровальную лепешку простым этиловым эфиром. Фильтраты соединяли, экстрагировали 1 н. раствором HCl, а кислые слои подщелачивали (30% NaOH). Основный раствор экстрагировали с помощью CH2Cl2, сушили (K2CO3) и концентрировали в условиях вакуума с образованием 500 мг (39%) светлого масла: : 0.90-1.09 (м,2H), 1.23-1.30 (м,1H), 1.81-1.92 (м, 1H), 2.52-2.60 (м,2H)., 3.78 (с,3H), 6.58- 6.72 (м,3H), 7.19 (т, J=8.0 Гц,1H).
(b) (-)-(транс)-2-(3-метоксифенил)циклопропанэтиламин.
К перемешиваемой суспензии алюмогидрида лития (650 мг, 17 ммолей) в тетрагидрофуране (50 мл), находившейся при температуре -45oC, добавляли раствор (-)-(транс)-1-(цианометил)-2-(3- метоксифенил)циклопропана (1,41 г, 7,5 ммоля) в тетрагидрофуране (25 мл), поддерживая температуру ниже -30oC. После окончания добавления суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Затем ее вновь охлаждали до -45oC и по каплям осторожно добавляли 1 н. раствор HCl (50 мл). Полученную суспензию перемешивали при комнатной температуре в течение 30 минут, фильтровали через целит и тщательно промывали фильтровальную лепешку простым этиловым эфиром. Фильтраты соединяли, экстрагировали 1 н. раствором HCl, а кислые слои подщелачивали (30% NaOH). Основный раствор экстрагировали с помощью CH2Cl2, сушили (K2CO3) и концентрировали в условиях вакуума с образованием 500 мг (39%) светлого масла:спектр ЯМР 1H (300 МГц, CDCl3)  : 0.75-0.82 (м,1H), 0.88-0.96 (м,1H), 1.00-1.11 (м, 1H), 1.45-1.70 (м,3H), 2.62 (широкий синглет,2H), 2.88 (т, J= 7.5 Гц,2H), 3.77 (с,3H), 6.52-6.70 (м,3H), 7.18 (т, J=8.0 Гц,1H).
(c) (-)-(транс)-N-[[2-(3-метоксифенил)циклопропил]этил] бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору (-)- (транс)-2-(3-метоксифенил)циклопропанэтиламина (400 мг, 2,2 ммоля) и Et3N (0,86 мл, 6,6 ммоля) в сухом дихлорэтане (15 мл), находившемуся при 0oC, по каплям добавляли бутирилхлорид (256 мг, 24 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. После концентрирования в условиях вакуума был получен неочищенный продукт, который затем очищали посредством испарительной хроматографии (силакагель, смесь 30% EtOAc и гексана), что позволило получить 250 мг (44%) светлого масла: : 0.75-0.82 (м,1H), 0.88-0.96 (м,1H), 1.00-1.11 (м, 1H), 1.45-1.70 (м,3H), 2.62 (широкий синглет,2H), 2.88 (т, J= 7.5 Гц,2H), 3.77 (с,3H), 6.52-6.70 (м,3H), 7.18 (т, J=8.0 Гц,1H).
(c) (-)-(транс)-N-[[2-(3-метоксифенил)циклопропил]этил] бутанамид.
К перемешиваемому с помощью магнитной мешалки раствору (-)- (транс)-2-(3-метоксифенил)циклопропанэтиламина (400 мг, 2,2 ммоля) и Et3N (0,86 мл, 6,6 ммоля) в сухом дихлорэтане (15 мл), находившемуся при 0oC, по каплям добавляли бутирилхлорид (256 мг, 24 ммоля). Полученную суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 18 часов. После концентрирования в условиях вакуума был получен неочищенный продукт, который затем очищали посредством испарительной хроматографии (силакагель, смесь 30% EtOAc и гексана), что позволило получить 250 мг (44%) светлого масла:спектр ЯМР 1H (300 МГц, CDCl3)  : 0.70-0.81 (м,1H), 0.88-1.01 (м,5H), 1.54- 1.68 (м, 5H), 2.12 (т,J=7.2 Гц,2H), 3.29-3.36 (м, 2H), 3.77 (с,3H), 5.75 (широкий синглет,1H), 6.54-6.71 (м,3H), 7.14 (т,J=7.8 Гц,1H); : 0.70-0.81 (м,1H), 0.88-1.01 (м,5H), 1.54- 1.68 (м, 5H), 2.12 (т,J=7.2 Гц,2H), 3.29-3.36 (м, 2H), 3.77 (с,3H), 5.75 (широкий синглет,1H), 6.54-6.71 (м,3H), 7.14 (т,J=7.8 Гц,1H);инфракрасный спектр (пленка NaCl) 3295, 2962, 1644, 1604, 1551, 1494 см-1; масс-спектр (ESI) m/e 261; [  ]2D0 -66,3o (с=1, CH2Cl2).
Результаты анализа, высчитанные для C16H26NO2 ]2D0 -66,3o (с=1, CH2Cl2).
Результаты анализа, высчитанные для C16H26NO2 0,20H2O: 0,20H2O:C 72.53, H 6.90, N 5.29; обнаружено: C 72.67, H 9.03, N 5.29. Пример 17 (способ получения 17). Получение (транс)-N-[[3-(3-метоксифенил)-2,2-диметил-1- циклопропил]метил]бутанамида. Стадия i. (a) Этиловый эфир (транс)-3-(3-метоксифенил)-2,2- диметилциклопропанкарбоновой кислоты. К перемешиваемому раствору иодида изопропилтрифенилфосфония (50 г, 116 ммолей) в тетрагидрофуране (250 мл), находившемуся при 0oC, по каплям добавляли бутиллитий (2,3 М раствор в гексане, 42,2 мл, 115,6 ммоля), поддерживая температуру ниже 5oC. Этот раствор перемешивали в течение 1 часа, по каплям вливали раствор этилового эфира коричной кислоты (18,33 г, 89 ммолей) в тетрагидрофуране (50 мл), оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Полученную суспензию быстро охлаждали насыщенным раствором NH4Cl (200 мл) и экстрагировали этилацетатом. Органические экстракты соединяли, промывали рассолом, сушили (K2CO3) и концентрировали с образованием светло-коричневого твердого вещества. Это твердое вещество очищали путем перегонки по методу Кюгельрора (110oC, 0,5 мм) с образованием 13,0 г (59%) светлого масла: спектр ЯМР 1H (300 МГц, CDCl3)  : 0.95 (с,3H), 1.12 (т, J=6.5 Гц, 3H), 1.36 (с,3H), 1.95 (д, J=6.0 Гц,1H), 2.62 (д, =6.0 Гц,1H), 3.80 (с,3H), 4.12 (к,J=7.0Гц,2H), 6.65-6.68 (м,2H), 7.18-7.26 (м,2H).
Стадия ii.
(b) (транс)-3-(3-метоксифенил)-2,2-диметил-циклопропил – метанол.
К суспензии алюмогидрида лития (4,21 г, 111 ммолей) в тетрагидрофуране (200 мл), находившейся при температуре -45oC, по каплям добавляли раствор этилового эфира (транс)-3-(3- метоксифенил) -2,2-диметил-циклопропанкарбоновой кислоты (12,5 г, 50,4 ммоля) в тетрагидрофуране (20 мл). Охлаждающую ванну удаляли и реакционную смесь оставляли для нагревания до комнатной температуры, после чего сразу же вновь охлаждали до -45oC. Осторожно добавляли раствор KHSO4 (24 г, 177 ммолей) в воде (50 мл), повышая температуру до -5oC. Полученную пасту перемешивали при комнатной температуре в течение 1 часа, фильтровали через целит, а фильтровальную лепешку промывали простым этиловым эфиром. Соединенные фильтраты промывали холодным (0oC) 1 н. раствором HCl (3 раза), 5% K2CO3 (1 раз), рассолом (1 раз), сушили (K2CO3) и концентрировали с образованием 10,1 г (97%) светлого масла: : 0.95 (с,3H), 1.12 (т, J=6.5 Гц, 3H), 1.36 (с,3H), 1.95 (д, J=6.0 Гц,1H), 2.62 (д, =6.0 Гц,1H), 3.80 (с,3H), 4.12 (к,J=7.0Гц,2H), 6.65-6.68 (м,2H), 7.18-7.26 (м,2H).
Стадия ii.
(b) (транс)-3-(3-метоксифенил)-2,2-диметил-циклопропил – метанол.
К суспензии алюмогидрида лития (4,21 г, 111 ммолей) в тетрагидрофуране (200 мл), находившейся при температуре -45oC, по каплям добавляли раствор этилового эфира (транс)-3-(3- метоксифенил) -2,2-диметил-циклопропанкарбоновой кислоты (12,5 г, 50,4 ммоля) в тетрагидрофуране (20 мл). Охлаждающую ванну удаляли и реакционную смесь оставляли для нагревания до комнатной температуры, после чего сразу же вновь охлаждали до -45oC. Осторожно добавляли раствор KHSO4 (24 г, 177 ммолей) в воде (50 мл), повышая температуру до -5oC. Полученную пасту перемешивали при комнатной температуре в течение 1 часа, фильтровали через целит, а фильтровальную лепешку промывали простым этиловым эфиром. Соединенные фильтраты промывали холодным (0oC) 1 н. раствором HCl (3 раза), 5% K2CO3 (1 раз), рассолом (1 раз), сушили (K2CO3) и концентрировали с образованием 10,1 г (97%) светлого масла:спектр ЯМР 1H (300 МГц, CDCl3)  : 0.85 (с,3H), 1.25 (с,3H), 1.78 (д, J= 6.0 Гц,1H), 3.62-3.72 (м,3H), 3.79 (с,3H), 3.82 (двойной дублет, J=7, 10 Гц, 1H), 6.70-6.78 (м,2H), 7.20 (т, J=7.5 Гц, 1H), 7.35 (м,1H).
Стадия iii.
(c) (транс)-(3-(3-метоксифенил)-2,2-диметил-циклопропил) -метил) азид.
К раствору (транс)-(3-(3-метоксифенил)-2,2-диметил- циклопропил)метанола (10,0 г, 48,5 ммоля) и триэтиламина (10,1 мл, 72,8 ммоля) в дихлорметане (100 мл), находившемуся при 0oC, по каплям добавляли метансульфонилхлорид (6,11 г, 53,4 ммоля). После окончания добавления ледяную баню удаляли и продолжали перемешивать в течение 30 минут. Реакционную смесь разбавляли дихлорметаном (100 мл), промывали водой, насыщенным раствором NaHCO3 и сушили над K2CO3. После концентрирования в условиях вакуума было получено 13,09 г окрашенного масла, пригодного для использования на следующей стадии.
Вышеуказанный мезилат растворяли в диметилформамиде (100 мл), обрабатывали азидом натрия (3,78 г, 58,2 ммоля) и перемешивали при комнатной температуре в течение 18 часов. Эту смесь концентрировали, а остаток растворяли в простом этиловом эфире, промывали водой (1 раз), рассолом (1 раз) и удаляли растворители в условиях вакуума, что позволило получить 10,1 г светлого масла, пригодного для использования без дальнейшей очистки: : 0.85 (с,3H), 1.25 (с,3H), 1.78 (д, J= 6.0 Гц,1H), 3.62-3.72 (м,3H), 3.79 (с,3H), 3.82 (двойной дублет, J=7, 10 Гц, 1H), 6.70-6.78 (м,2H), 7.20 (т, J=7.5 Гц, 1H), 7.35 (м,1H).
Стадия iii.
(c) (транс)-(3-(3-метоксифенил)-2,2-диметил-циклопропил) -метил) азид.
К раствору (транс)-(3-(3-метоксифенил)-2,2-диметил- циклопропил)метанола (10,0 г, 48,5 ммоля) и триэтиламина (10,1 мл, 72,8 ммоля) в дихлорметане (100 мл), находившемуся при 0oC, по каплям добавляли метансульфонилхлорид (6,11 г, 53,4 ммоля). После окончания добавления ледяную баню удаляли и продолжали перемешивать в течение 30 минут. Реакционную смесь разбавляли дихлорметаном (100 мл), промывали водой, насыщенным раствором NaHCO3 и сушили над K2CO3. После концентрирования в условиях вакуума было получено 13,09 г окрашенного масла, пригодного для использования на следующей стадии.
Вышеуказанный мезилат растворяли в диметилформамиде (100 мл), обрабатывали азидом натрия (3,78 г, 58,2 ммоля) и перемешивали при комнатной температуре в течение 18 часов. Эту смесь концентрировали, а остаток растворяли в простом этиловом эфире, промывали водой (1 раз), рассолом (1 раз) и удаляли растворители в условиях вакуума, что позволило получить 10,1 г светлого масла, пригодного для использования без дальнейшей очистки:спектр ЯМР 1H (300 МГц, CDCl3)  : 0.85 (с,3H), 1.30 (с,3H), 1.39-1.42 (м, 1H), 1.80 (д, J=6.0 Гц,1H), 3.30 (двойной дублет, J=8,10 Гц,1H), 3.51 (двойной дублет, J=6.0, 8.3 Гц, 1H), 3.80 (с,3H), 6.68-6.79 (м,3H), 7.20 (т, J=7.5 Гц,1H).
Стадия iv.
(d) (транс)-(3-(3-метоксифенил)-2,2-диметил-циклопропил) -метил)амин.
Перемешиваемую суспензию алюмогидрида лития (4,80 г, 126,6 ммоля) в тетрагидрофуране (100 мл) при температуре -30oC обрабатывали раствором (транс)-(3-(3-метоксифенил)-2,2- диметилциклопропил метил азида (6,48 г, 30,14 ммоля) в тетрагидрофуране (10 мл), поддерживая температуру ниже -30oC. После окончания добавления суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Эту суспензию охлаждали до -45oC и по каплям (осторожно!) добавляли раствор KHSO4 (16 г) в воде (20 мл). Полученную суспензию перемешивали при комнатной температуре в течение 30 минут, фильтровали через целит, а фильтровальную лепешку тщательно промывали простым этиловым эфиром. Фильтраты соединяли, экстрагировали 1 н. раствором HCl (2 раза) и кислые слои подщелачивали (30% NaOH). Основный раствор экстрагировали CH2Cl2 (3 раза), сушили (K2CO3) и концентрировали с образованием 2,80 г (47%) светлого масла: : 0.85 (с,3H), 1.30 (с,3H), 1.39-1.42 (м, 1H), 1.80 (д, J=6.0 Гц,1H), 3.30 (двойной дублет, J=8,10 Гц,1H), 3.51 (двойной дублет, J=6.0, 8.3 Гц, 1H), 3.80 (с,3H), 6.68-6.79 (м,3H), 7.20 (т, J=7.5 Гц,1H).
Стадия iv.
(d) (транс)-(3-(3-метоксифенил)-2,2-диметил-циклопропил) -метил)амин.
Перемешиваемую суспензию алюмогидрида лития (4,80 г, 126,6 ммоля) в тетрагидрофуране (100 мл) при температуре -30oC обрабатывали раствором (транс)-(3-(3-метоксифенил)-2,2- диметилциклопропил метил азида (6,48 г, 30,14 ммоля) в тетрагидрофуране (10 мл), поддерживая температуру ниже -30oC. После окончания добавления суспензию оставляли для нагревания до комнатной температуры и перемешивали в течение 4 часов. Эту суспензию охлаждали до -45oC и по каплям (осторожно!) добавляли раствор KHSO4 (16 г) в воде (20 мл). Полученную суспензию перемешивали при комнатной температуре в течение 30 минут, фильтровали через целит, а фильтровальную лепешку тщательно промывали простым этиловым эфиром. Фильтраты соединяли, экстрагировали 1 н. раствором HCl (2 раза) и кислые слои подщелачивали (30% NaOH). Основный раствор экстрагировали CH2Cl2 (3 раза), сушили (K2CO3) и концентрировали с образованием 2,80 г (47%) светлого масла:спектр ЯМР 1H (300 МГц, CDCl3)  : 0.82 (с,3H), 1.22 (с,3H), 1.60-1.68 (м, 4H), 2.75-2.92 (м,2H), 3.78 (с,3H), 6.68-6.75 (м,3H), 7.15 (т,J=7.5Гц, 1H).
Стадия v.
(e) (транс)-N-[[3-(3-метоксифенил)-2,2-диметил-1- циклопропил]метил]бутанамид.
(3-(3-метоксифенил)-2,2-диметилциклопропил)метил)амин (620 мг, 3,0 ммоля) ацилировали бутирилхлоридом (0,34 мл, 3,3 ммоля), как описывалось в примере 1, что позволило получить 550 мг (67%) светлого масла: : 0.82 (с,3H), 1.22 (с,3H), 1.60-1.68 (м, 4H), 2.75-2.92 (м,2H), 3.78 (с,3H), 6.68-6.75 (м,3H), 7.15 (т,J=7.5Гц, 1H).
Стадия v.
(e) (транс)-N-[[3-(3-метоксифенил)-2,2-диметил-1- циклопропил]метил]бутанамид.
(3-(3-метоксифенил)-2,2-диметилциклопропил)метил)амин (620 мг, 3,0 ммоля) ацилировали бутирилхлоридом (0,34 мл, 3,3 ммоля), как описывалось в примере 1, что позволило получить 550 мг (67%) светлого масла:спектр ЯМР 1H (300 МГц, CDCl3)  : 0.80 (с,3H), 0.90 (т,J=7.4 Гц, 3H), 1.23 (с, 3H), 1.23-1.30 (м,1H), 1.58-1.71 (м,3H), 2.14 (т, J= 7.3 Гц,2H), 3.39 (т,0=5.4 Гц,2H), 3.76 (с,3H), 5.50 (широкий синглет,1H), 6.65-6.71 (м, 3H), 7.15 (т, J=7.8 Гц,1H); : 0.80 (с,3H), 0.90 (т,J=7.4 Гц, 3H), 1.23 (с, 3H), 1.23-1.30 (м,1H), 1.58-1.71 (м,3H), 2.14 (т, J= 7.3 Гц,2H), 3.39 (т,0=5.4 Гц,2H), 3.76 (с,3H), 5.50 (широкий синглет,1H), 6.65-6.71 (м, 3H), 7.15 (т, J=7.8 Гц,1H);инфракрасный спектр (пленка NaCl) 3294, 2964, 1642, 1550, 1490, 1456, 1274 см-1; масс-спектр m/e 275,39. Результаты анализа, высчитанные для C17H25NO2: C 74.14, H 9.15, N 5.09; обнаружено: C 73,95, H 9.21, N 5.11. В таблице 1 приведены химические данные для соединений формулы I, в которой X – OCH3, R – водород, G – метилен, а другие заместители имеют указанные в таблице значения. В таблице 2 приведены химические данные для соединений формулы I, в которой R1 и R – водород, G – метилен, а R2, X, Y и Z имеют значения, указанные в таблице. В таблице 3 приведены химические данные для соединений формулы I, в которой X – OCH3, Y и Z – водород и R1 – водород. Заместители R, G и R2 имеют значения, указанные в таблице. Получение соединений формулы II из 2-циклоалкенона. Пример 140: Смесь цис- и транс-N-[3-(3-метоксифенил)циклопентил] бутанамида. Раствор 2-циклопентанона (8,21 г, 0,1 моля) в тетрагидрофуране (50 мл) по каплям добавляли к реактиву Гриньяра, полученному из 3-броманизола (18,7 г, 0,1 моля) и металлического магния (2,5 г) в тетрагидрофуране (200 мл). Раствор перемешивали в течение 18 часов, после чего охлаждали путем медленного добавления 3 н. раствора HCl (75 мл). Эту смесь перемешивали в течение 1 часа и разбавляли простым этиловым эфиром (200 мл). Органический слой отделяли, дважды экстрагировали водой и дважды рассолом. Органический раствор концентрировали до образования янтарного масла, которое хроматографировали на силикагеле с использованием в качестве элюента смеси CH2Cl2 и гексанов, что позволило получить требуемый циклопентанон (2,0 г, 10,5%, инфракрасный спектр: 1734 см-1). Раствор вышеуказанного циклопентанона (1,9 г, 10 ммолей), хлористоводородного гидроксиламина (2,8 г, 40 ммолей) и гидроксида натрия (4 мл 10 н. раствора, 40 ммолей) в этаноле (150 мл) нагревали с обратным холодильником в течение 18 часов. Эту смесь охлаждали, а затем гидрировали на скелетном никелевом катализаторе под давлением 4,2 ат в течение 4 часов. Смесь фильтровали, а фильтрат концентрировали в условиях вакуума. Остаток растворяли в ацетонитриле (100 мл) и HCl (2 мл 12 н. раствора), после чего раствор концентрировали в условиях вакуума. Остаток растирали в порошок с ацетонитрилом, в результате чего было получено липкое твердое вещество, которое перекристаллизовывали из этанола с образованием хлористоводородного амина в виде белого порошка (0,5 г, 26,2%). Раствор промежуточного вещества, представляющего собой соль амина (0.5 г, 2,62 ммоля), в пиридине (10 мл) охлаждали в ледяной бане, добавляя при этом бутирилхлорид (0,363 мл, 3,5 ммоля). Реакционную смесь перемешивали в течение 4 часов при комнатной температуре, а затем концентрировали. Остаток растворяли в метиленхлориде (50 мл) и дважды экстрагировали 1 н. раствором HCl (30 мл). Органический слой концентрировали и неочищенный продукт хроматографировали на силикагеле с использованием в качестве элюента смеси метиленхлорида и этилацетата, что позволило получить смесь цис- и транс-N-[3- (3-метоксифенил)циклопентил]бутанамида в виде светлого масла (0,3 г, 43,6%). Высчитано для C16H23NO2: C 74.53, H 6.67, N 5.36. Обнаружено: C 73.18, H 8.79, N 5.36. Масс-спектр (изобутан-DCl): 262 (M+Н). Инфракрасный спектр (пленка): 3288, 2960, 1638, 1548, 1264, 698 см-1. Получение соединений формулы II из 3-алкокси-циклоалкенона. Пример 141: (Цис)-N-[3-(3-метоксифенил)циклогексил]бутанамид. Раствор 3-(2-пропилокси)-1-циклогексенона (28,0 г, 0,182 моля) в тетрагидрофуране (100 мл) по каплям добавляли к реактиву Гриньяра, полученному из 3-броманизола (37,4 г, 0,2 моля) и металлического магния (6,08 г, 0,25 моля), в тетрагидрофуране (400 мл). Этот раствор перемешивали в течение 3 часов, а затем охлаждали путем медленного добавления 3 н. раствора HCl (150 мл). Эту смесь перемешивали в течение 10 часов и разбавляли простым этиловым эфиром (400 мл). Органический слой отделяли, дважды экстрагировали водой (100 мл) и дважды рассолом. Органический раствор концентрировали до образования янтарного масла, которое перегоняли по методу Кюгельрора с образованием промежуточного энона в виде бледно-янтарного масла (35,1 г, 95,5%). Спектр ПМР (CDCl3, 300 МГц)  : 2.17 (м,2H), 2.50 (т,2H), 2.77 (т,2H), 3.85 (с, 3H), 6.41 (с,1H), 6.97 (двойной дублет,1H), 7.06 (т,1H), 7.15 (д, 1H), 7.30 (т,1H); : 2.17 (м,2H), 2.50 (т,2H), 2.77 (т,2H), 3.85 (с, 3H), 6.41 (с,1H), 6.97 (двойной дублет,1H), 7.06 (т,1H), 7.15 (д, 1H), 7.30 (т,1H);инфракрасный спектр (пленка): 1663 см-1. Смесь вышеуказанного янтарного масла (35,1 г, 0,174 моля), этиленгликоля (15 г, 0,242 моля) и пара-толуолсульфокислоты (0,5 г) в толуоле (200 мл) нагревали с обратным холодильником под конденсационным горшком Дина-Старка в течение 18 часов. Добавляли еще одну порцию пара-толуолсульфокислоты (0,5 г) и продолжали нагревание в течение 24 часов. Полученный раствор охлаждали и дважды экстрагировали насыщенным раствором карбоната натрия (100 мл), дважды водой и дважды рассолом. Органический слой концентрировали до образования коричневого масла, которое перегоняли по методу Кюгельрора с образованием промежуточного кеталя в виде светлого масла, которое отверждали. Спектр ПМР (CDCl3), 300 МГц)  : 1.85 (т,2H), 2.4- 2.5 (м,2H), 2.66 (широкий синглет, 2H), 3.84 (c,3H), 4.04 (c,4H), 6.17 (м,1H), 6.80 (двойной дублет,1H), 8.95 (т,1H), 7.00 (д,1H), 7.25 (т,1H).
Раствор промежуточного масла в этаноле (200 мл) гидрировали на 10% палладированном угле (1 г) под давлением 4.2 ат в течение 18 часов. Эту смесь фильтровали, а фильтрат перемешивали с 3 н. раствором HCl (75 мл) в течение 4 часов. Раствор концентрировали и трижды экстрагировали этилацетатом (200 мл). Органические экстракты сушили вместе с рассолом и концентрировали. Маслянистый остаток перегоняли по методу Кюгельрора с образованием промежуточного кетона в виде светлого масла (29,97 г, 95%).
Спектр ПМР (CDCl3), 300 МГц) : 1.85 (т,2H), 2.4- 2.5 (м,2H), 2.66 (широкий синглет, 2H), 3.84 (c,3H), 4.04 (c,4H), 6.17 (м,1H), 6.80 (двойной дублет,1H), 8.95 (т,1H), 7.00 (д,1H), 7.25 (т,1H).
Раствор промежуточного масла в этаноле (200 мл) гидрировали на 10% палладированном угле (1 г) под давлением 4.2 ат в течение 18 часов. Эту смесь фильтровали, а фильтрат перемешивали с 3 н. раствором HCl (75 мл) в течение 4 часов. Раствор концентрировали и трижды экстрагировали этилацетатом (200 мл). Органические экстракты сушили вместе с рассолом и концентрировали. Маслянистый остаток перегоняли по методу Кюгельрора с образованием промежуточного кетона в виде светлого масла (29,97 г, 95%).
Спектр ПМР (CDCl3), 300 МГц)  : 1.73-1.95 (м,2H), 2.05-2.2 (м,2H), 2.33-2.63 (м, 4H), 2.95-3.07 (м,1H), 3.87 (с,3H), 6.70-6.85 (наложение,3H), 7.20-7.30 (м,1H).
Инфракрасный спектр (пленка): 1711 см-1.
Раствор вышеуказанного кетона (10,86 г, 53,24 ммоля) в этаноле (150 мл) добавляли к смеси сульфата гидроксиламина (12,31 г, 0,15 ммоля) и 10 н. раствора гидроксида натрия (15 мл), после чего нагревали с обратным холодильником в течение 6 часов. Эту смесь охлаждали и гидрировали на скелетном никелевом катализаторе (2 г) под давлением 4,2 ат в течение 16 часов. Полученную смесь фильтровали, а фильтрат концентрировали до образования липкого остатка. Этот остаток распределяли между этилацетатом и водой. Органический слой отделяли, дважды экстрагировали водой (75 мл) и трижды 3 н. раствором HCl (в общей сложности 100 мл). Кислые вытяжки подщелачивали 50% гидроксидом натрия и трижды экстрагировали этилацетатом (100 мл). Органические экстракты сушили над рассолом и концентрировали. Остаток растворяли в ацетонитриле (50 мл) и по каплям добавляли 12 н. раствор HCl, что позволило получить промежуточный хлористоводородный амин в виде белого осадка, который фильтровали и сушили на воздухе (2,54 г, 19,8%).
Раствор промежуточной соли амина (0,53 г, 2,59 ммоля) в пиридине (10 мл) охлаждали в ледяной бане, добавляя с помощью шприца бутирилхлорид (0,33 мл, 3,2 ммоля). Реакционную смесь перемешивали в течение 2 часов при комнатной температуре, а потом концентрировали. Остаток растворяли в метиленхлориде (30 мл) и дважды экстрагировали 1 н. раствором HCl (30 мл). Органический слой концентрировали и неочищенный продукт хроматографировали на силикагеле с использованием в качестве элюента смеси метиленхлорида и этилацетата, что позволило получить ( : 1.73-1.95 (м,2H), 2.05-2.2 (м,2H), 2.33-2.63 (м, 4H), 2.95-3.07 (м,1H), 3.87 (с,3H), 6.70-6.85 (наложение,3H), 7.20-7.30 (м,1H).
Инфракрасный спектр (пленка): 1711 см-1.
Раствор вышеуказанного кетона (10,86 г, 53,24 ммоля) в этаноле (150 мл) добавляли к смеси сульфата гидроксиламина (12,31 г, 0,15 ммоля) и 10 н. раствора гидроксида натрия (15 мл), после чего нагревали с обратным холодильником в течение 6 часов. Эту смесь охлаждали и гидрировали на скелетном никелевом катализаторе (2 г) под давлением 4,2 ат в течение 16 часов. Полученную смесь фильтровали, а фильтрат концентрировали до образования липкого остатка. Этот остаток распределяли между этилацетатом и водой. Органический слой отделяли, дважды экстрагировали водой (75 мл) и трижды 3 н. раствором HCl (в общей сложности 100 мл). Кислые вытяжки подщелачивали 50% гидроксидом натрия и трижды экстрагировали этилацетатом (100 мл). Органические экстракты сушили над рассолом и концентрировали. Остаток растворяли в ацетонитриле (50 мл) и по каплям добавляли 12 н. раствор HCl, что позволило получить промежуточный хлористоводородный амин в виде белого осадка, который фильтровали и сушили на воздухе (2,54 г, 19,8%).
Раствор промежуточной соли амина (0,53 г, 2,59 ммоля) в пиридине (10 мл) охлаждали в ледяной бане, добавляя с помощью шприца бутирилхлорид (0,33 мл, 3,2 ммоля). Реакционную смесь перемешивали в течение 2 часов при комнатной температуре, а потом концентрировали. Остаток растворяли в метиленхлориде (30 мл) и дважды экстрагировали 1 н. раствором HCl (30 мл). Органический слой концентрировали и неочищенный продукт хроматографировали на силикагеле с использованием в качестве элюента смеси метиленхлорида и этилацетата, что позволило получить ( )-цис-N- [3-(3-метоксифенил)циклогексил]бутирамид в виде светлого масла (0,45 г, 62,7%).
Высчитано для C17H25NO2 )-цис-N- [3-(3-метоксифенил)циклогексил]бутирамид в виде светлого масла (0,45 г, 62,7%).
Высчитано для C17H25NO2 0,2H2O: C 73.18, H 9.18, N 5.02.
Обнаружено: C 73.27, H 9.17, N 5.01.
Масс-спектр (изобутан-DCl): 276 (M+H).
Инфракрасный спектр (пленка): 3286, 2932, 1640, 1548, 1268, 698 см-1.
Спектр CMP (CDCl3) 0,2H2O: C 73.18, H 9.18, N 5.02.
Обнаружено: C 73.27, H 9.17, N 5.01.
Масс-спектр (изобутан-DCl): 276 (M+H).
Инфракрасный спектр (пленка): 3286, 2932, 1640, 1548, 1268, 698 см-1.
Спектр CMP (CDCl3)  : 13.68, 19.25, 25.05, 32.93, 38.93, 41.10, 43.12, 48.43, 55.12, 111.18, 112.70, 119.11, 129.31, 147.87, 159.60, 171.98 частей на миллион.
Пример 142: ( : 13.68, 19.25, 25.05, 32.93, 38.93, 41.10, 43.12, 48.43, 55.12, 111.18, 112.70, 119.11, 129.31, 147.87, 159.60, 171.98 частей на миллион.
Пример 142: ( )-цис-N-[3-(3-метоксифенил)-циклогексил] 2-метил-пропанамид.
Это соединение было получено в соответствии со способом, описанным в примере 2, и выделено в виде белого порошка (0,49 г, 68,3%, температура плавления 89 -92oC).
Высчитано для C17H25NO2 )-цис-N-[3-(3-метоксифенил)-циклогексил] 2-метил-пропанамид.
Это соединение было получено в соответствии со способом, описанным в примере 2, и выделено в виде белого порошка (0,49 г, 68,3%, температура плавления 89 -92oC).
Высчитано для C17H25NO2 0,09H2O: C 73.71, H 9.16, N 5.06.
Обнаружено: C 73.78, H 9.16, N 5.01.
Масс-спектр (изобутан-DCl): 276 (M+H).
Инфракрасный спектр (пленка): 3290, 2930, 1642, 1544, 1236, 698 см-1.
Спектр CMP (CDCl3) 0,09H2O: C 73.71, H 9.16, N 5.06.
Обнаружено: C 73.78, H 9.16, N 5.01.
Масс-спектр (изобутан-DCl): 276 (M+H).
Инфракрасный спектр (пленка): 3290, 2930, 1642, 1544, 1236, 698 см-1.
Спектр CMP (CDCl3)  : 19.60, 19.67, 25.08, 32.91, 32.96, 35.78, 41.17, 43.16, 48.31, 55.15, 111.23, 112.73, 119.14, 129.33, 147.91, 159.66, 175.97 частей на миллион.
Пример 143: ( : 19.60, 19.67, 25.08, 32.91, 32.96, 35.78, 41.17, 43.16, 48.31, 55.15, 111.23, 112.73, 119.14, 129.33, 147.91, 159.66, 175.97 частей на миллион.
Пример 143: ( )-цис-N-[3-(3-метоксифенил)- циклогексил]ацетамид.
Это соединение было получено в соответствии со способом, описанным в примере 2, и выделено в виде светлого масла (0,25 г, 38,8%).
Высчитано для C15H21NO2 )-цис-N-[3-(3-метоксифенил)- циклогексил]ацетамид.
Это соединение было получено в соответствии со способом, описанным в примере 2, и выделено в виде светлого масла (0,25 г, 38,8%).
Высчитано для C15H21NO2 0,1H2O: C 72.29, H 8.59, N 5.60.
Обнаружено: C 72.31, H 8.58, N 5.62.
Масс-спектр (изобутан-DCl): 248 (M+H).
Инфракрасный спектр (пленка): 3284, 2932, 1652, 1554, 1270, 698 см-1.
Спектр CMP (CDCl3) 0,1H2O: C 72.29, H 8.59, N 5.60.
Обнаружено: C 72.31, H 8.58, N 5.62.
Масс-спектр (изобутан-DCl): 248 (M+H).
Инфракрасный спектр (пленка): 3284, 2932, 1652, 1554, 1270, 698 см-1.
Спектр CMP (CDCl3)  : 23.56, 25.07, 32.93, 33.01, 40.95, 43.12, 48.71, 55.15, 111.23, 112.73, 119.13, 129.34, 147.84, 159.65, 169.08 частей на миллион.
Пример 144: (Цис)-N-этил-N’-[3-(3-метоксифенил)-циклогекси] мочевина.
Соединение было получено в соответствии со способом, описанным в примере 2, и было выделено в виде светлого масла (0,36 г, 49,2%).
Высчитано для C16H24N2O2 : 23.56, 25.07, 32.93, 33.01, 40.95, 43.12, 48.71, 55.15, 111.23, 112.73, 119.13, 129.34, 147.84, 159.65, 169.08 частей на миллион.
Пример 144: (Цис)-N-этил-N’-[3-(3-метоксифенил)-циклогекси] мочевина.
Соединение было получено в соответствии со способом, описанным в примере 2, и было выделено в виде светлого масла (0,36 г, 49,2%).
Высчитано для C16H24N2O2 0,35H2O: C 67.98, H 8.81, N 9.91.
Обнаружено: C 67.92, H 9.01, N 9.99.
Масс-спектр (изобутан-DCl): 277 (M+H).
Инфракрасный спектр (пленка): 2930, 1632, 1570, 1268, 1156, 1048 см-1.
Спектр CMP (CDCl3) 0,35H2O: C 67.98, H 8.81, N 9.91.
Обнаружено: C 67.92, H 9.01, N 9.99.
Масс-спектр (изобутан-DCl): 277 (M+H).
Инфракрасный спектр (пленка): 2930, 1632, 1570, 1268, 1156, 1048 см-1.
Спектр CMP (CDCl3)  : 15.39, 25.15, 33.07, 33.58, 35.35, 41.61, 43.25, 49.67, 55.12, 111.13, 112.13, 119.13, 129.30, 147.93, 157.67, 159.58 частей на миллион.
Пример 145 (измерение мелатонинстимулирующего связывания).
Мелатонинстимулирующее связывание, вызываемое соединениями формулы 1, определяли с помощью модифицированного метода Репперта С.М. и др. (Neuron, т. 13, стр. 1177-1185, 1994). Активными считались соединения со значениями IC50, равными 600 нм или меньше. Ниже описываются реактивы, мембраны и другие параметры, используемые при выполнении этого анализа.
Реагенты.
(a) 50 ммолей трис-буфера, содержащего 12,5 ммоля MgCl2 и 2 ммоля этилендиаминтетрауксусной кислоты (pH 7,4 при температуре 37oC).
(b) Промывочный буфер: 20 ммолей трис-основания, содержащего 2 ммоля MgCl2 (pH 7,4 при комнатной температуре).
(c) c-Хлормелатонин (конечная концентрация, равная 10-5 молей).
(d) 2-(I125)-Иодмелатонин (конечная концентрация, равная 100 пм).
(Источник NEN).
Приготовление мембраны.
кДНК человека (MLIA человека) в пкДНКИ вводили в COS-1 клетки по методу введения диэтиламиноэтил-декстрина. Через три дня после удаления сред планшеты промывали забуференным физиологическим раствором; клетки удаляли с помощью сбалансированного солевого раствора Хэнкса и осаждали центрифугированием. Надосадочную жидкость удаляли, а капли осадка замораживали. Для получения мембранных гомогенатов капли осадка оттаивали и вновь суспендировали в триметилолэтановом буфере, трис-основании, MgCl2, этилендиаминтетрауксусной кислоте (pH 7,4 при температуре 37oC) и добавляли апротинин, лейпептин и фенилметилсульфонилфторид. Клетки гомогенизировали и центрифугировали, полученный осадок вновь суспендировали в триметилолэтане и замораживали. Во время анализа небольшую аликвоту оттаивали на льду и вновь суспендировали в триметилолэтановом буфере.
Инкубация.
При температуре 37oC в течение 1 часа. Реакцию прекращали фильтрованием.
В таблице 4 представлены показатели мелатонинстимулирующего действия соединений формулы I, в которой X – OCH3, R – водород, G – метилен, а другие заместители имеют значения, указанные в таблице.
В таблице 5 представлены показатели мелатонинстимулирующего действия соединений формулы I, в которой R1 и R – водород, G – метилен, a R2, X, Y и Z имеют значения, указанные в таблице.
В таблице 6 представлены показатели мелатонинстимулирующего действия соединений формулы I, в которой X – OCH3, Y и Z – водород и R1 – водород. Заместители R, G и R2 имеют значения, указанные в таблице.
В объем настоящего изобретения входят все обоснованные варианты, которые могут быть осуществлены специалистом в этой области. : 15.39, 25.15, 33.07, 33.58, 35.35, 41.61, 43.25, 49.67, 55.12, 111.13, 112.13, 119.13, 129.30, 147.93, 157.67, 159.58 частей на миллион.
Пример 145 (измерение мелатонинстимулирующего связывания).
Мелатонинстимулирующее связывание, вызываемое соединениями формулы 1, определяли с помощью модифицированного метода Репперта С.М. и др. (Neuron, т. 13, стр. 1177-1185, 1994). Активными считались соединения со значениями IC50, равными 600 нм или меньше. Ниже описываются реактивы, мембраны и другие параметры, используемые при выполнении этого анализа.
Реагенты.
(a) 50 ммолей трис-буфера, содержащего 12,5 ммоля MgCl2 и 2 ммоля этилендиаминтетрауксусной кислоты (pH 7,4 при температуре 37oC).
(b) Промывочный буфер: 20 ммолей трис-основания, содержащего 2 ммоля MgCl2 (pH 7,4 при комнатной температуре).
(c) c-Хлормелатонин (конечная концентрация, равная 10-5 молей).
(d) 2-(I125)-Иодмелатонин (конечная концентрация, равная 100 пм).
(Источник NEN).
Приготовление мембраны.
кДНК человека (MLIA человека) в пкДНКИ вводили в COS-1 клетки по методу введения диэтиламиноэтил-декстрина. Через три дня после удаления сред планшеты промывали забуференным физиологическим раствором; клетки удаляли с помощью сбалансированного солевого раствора Хэнкса и осаждали центрифугированием. Надосадочную жидкость удаляли, а капли осадка замораживали. Для получения мембранных гомогенатов капли осадка оттаивали и вновь суспендировали в триметилолэтановом буфере, трис-основании, MgCl2, этилендиаминтетрауксусной кислоте (pH 7,4 при температуре 37oC) и добавляли апротинин, лейпептин и фенилметилсульфонилфторид. Клетки гомогенизировали и центрифугировали, полученный осадок вновь суспендировали в триметилолэтане и замораживали. Во время анализа небольшую аликвоту оттаивали на льду и вновь суспендировали в триметилолэтановом буфере.
Инкубация.
При температуре 37oC в течение 1 часа. Реакцию прекращали фильтрованием.
В таблице 4 представлены показатели мелатонинстимулирующего действия соединений формулы I, в которой X – OCH3, R – водород, G – метилен, а другие заместители имеют значения, указанные в таблице.
В таблице 5 представлены показатели мелатонинстимулирующего действия соединений формулы I, в которой R1 и R – водород, G – метилен, a R2, X, Y и Z имеют значения, указанные в таблице.
В таблице 6 представлены показатели мелатонинстимулирующего действия соединений формулы I, в которой X – OCH3, Y и Z – водород и R1 – водород. Заместители R, G и R2 имеют значения, указанные в таблице.
В объем настоящего изобретения входят все обоснованные варианты, которые могут быть осуществлены специалистом в этой области.
Формула изобретения
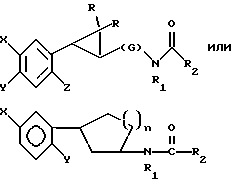 в которой Х – галоген, водород, С1-4-алкил или OR5 где R5 представляет собой водород, С1-4-перфторалкил, С1-4-фторалкил, С1-4-пердейтероалкил, С1-20-алкил, С4-20-алкциклоалкил, С2-20-карбонитрилоалкил, С3-22-карбоалкоксиалкил, С3-20-алкенил, С3-20-алкинил, С9-20-фенилалкил, С9-20-фенилалкенил, С9-20-фенилалкинил, С2-20-гидроксиалкил, С8-20-фенилоксиалкил, С7-20-пиридилалкил или С6-20-пиррилалкил; Y – водород или галоген; Z – водород, галоген, циано, фенил, С7-20-фенилалкил, С8-20-фенилалкинил или С2-20-алкамидо; R в обоих случаях является водородом, галогеном или С1-4-алкилом; n равно 1 или 2; G – двухвалентный метилен, этилен или С1-4-алкметиленовый фрагмент; R1 – водород, С1-4-алкил или бензил; R2 – С1-6-алкил, C2-6-алкенил, С3-6-циклоалкил, С2-4-алкоксиалкил, С1-4-трифторметилалкил, С2-8-алкилтиоалкил или N R3 R4, где R3 и R4 независимо друг от друга выбирают из водорода и С1-4-алкила, но R3 и R4 не могут одновременно быть водородом. 2. Соединение формулы I, отличающееся тем, что R1 – водород, R2 – С1-6-алкил, С2-6-алкенил или С3-6-циклоалкил, Y и Z – водород, Х – метокси. 3. Соединение по п.2, которое выбирают из группы, включающей: (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид, (-)-(транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]пропанамид, (+)-(транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]ацетамид, (-)-(транс)-N-[[2-(3-метоксифенил)циклопропил]метил]-2-метилпропанамид. 4. Соединение по п.2, где один или несколько заместителей X, Y и Z являются галогеном. 5. Соединение по п.4, которое выбирают из группы, включающей: (транс)-N-[[2-(4-хлор-3-метоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(4-хлор-5-метоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(2,4-дибром-5-метоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(2-иод-5-метоксифенил)циклопропил]метил]бутанамид, (-)-(транс)-N-[[2-(2-иод-3-метоксифенил)циклопропил]метил]бутанамид. 6. Соединение по п.1, где R1 – водород, R2 – алкил, алкенил или циклоалкил, X и Y – водород, R5-С2-20-алкил, С9-20-аралкил или С3-20-алкенил. 7. Соединение по п.6, которое выбирают из группы, включающей: (транс)-N-[[2-(3-[(этоксифенил)циклопропил]метил]бутанамид, (транс)-N-[[2-[(3-(октилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[(3-(децилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[(3-ундецилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[(3-додецилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[3-(гептилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[3-(нонилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[3-(2-пропенилокси)фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[3-(6-фенилгексил)окси]фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[3-[(7-фенилгептил)окси]фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[3-[(2-фенилэтил)окси]фенил]циклопропил]метил]бутанамид, (транс)-N-[[2-[3-[(3-(3-метоксифенил)пропокси] фенил] циклопропил]метил] бутанамид. 8. Способ мелатонинстимулирующего связывания введением терапевтического количества активного вещества, отличающийся тем, что в качестве активного вещества используют соединение по п.1. 9. Фармацевтическая композиция, предназначенная для мелатонинстимулирующего связывания, содержащая активное вещество и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве активного вещества она содержит соединение формулы I по п.1 в эффективном количестве. 10. Соединение по п.1, которое представляет собой (-)-(транс)-N-[[2-(2-иод-5-метоксифенил)циклопропил]метил]бутанамид. 11. Соединение по п.1, которое представляет собой (-)-(транс)-N-[[2-(3-метоксифенил)циклопропил]метил]бутанамид. 12. Соединение по п.1, которое представляет собой (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]пропанамид. 13. Соединение по п.1, которое представляет собой (транс)-N-[[2-(3-метоксифенил)циклопропил]метил]пропанамид. 14. Соединение по п. 1, которое представляет собой (транс)-N-[[2-(4-хлор-3-метоксифенил)циклопропил]метил]бутанамид. 15. Соединение по п.1, которое представляет собой (транс)-N-[[3-(3-метоксифенил)-2,2-дифтор-1-циклопроп-1-ил]метил]бутанамид. 16. Соединение по п.1, которое представляет собой (транс)-N-[[3-(3-метоксифенил)-2,2-дифтор-1-циклопроп-1-ил]метил]пропанамид. 17. Соединение по п. 1, которое представляет собой (транс)-N-[[2-(5-фтор-2-иодфенил)циклопроп-1-ил]метил]бутанамид. 18. Соединение по п.1, которое выбирают из группы, включающей: (транс)-N-[[2-(3-хлорфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(3-бромфенил)циклопроп-1-ил]метил]бутанамид, (-)-(транс)-N-[[2-(3-фторфенил)циклопропил]метил]бутанамид, (транс)-N-[[2-(2,5-дифторфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(2-бром-5-фторфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(3-метилфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(3-этилфенил)циклопроп-1-ил]метил]бутанамид, (транс)-N-[[2-(3-трифторметокси)фенил]циклопроп-1-ил]метил]бутанамид. 19. Соединение по п.1, которое выбирают из группы, включающей: (цис)-N-[3-(3-метоксифенил)циклогексил]ацетамид, (цис)-N-[3-(3-метоксифенил)циклогексил]-2-метил-пропанамид, (цис)-N-[3-(3-метоксифенил)циклогексил]бутанамид, (цис)-N-этил-N’-[3-(3-метоксифенил)циклогексил], мочевину, N-[3-(3-метоксифенил)циклопентил]бутанамид. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 07.06.2005
Извещение опубликовано: 27.12.2006 БИ: 36/2006
|
||||||||||||||||||||||||||
