|
|
(21), (22) Заявка: 2005126819/15, 12.03.2004
(24) Дата начала отсчета срока действия патента:
12.03.2004
(30) Конвенционный приоритет:
12.03.2003 US 60/454,125
(43) Дата публикации заявки: 20.01.2006
(46) Опубликовано: 20.12.2008
(56) Список документов, цитированных в отчете о
поиске:
WO 01/35974 А1, 25.05.2001. WO 00/20411 A1, 13.04.2000. US 6245759 B1, 12.06.2001. реферат базы данных PubMed: Weiss R.B. et al. A phase II trial of didemnin В in myeloma Investigational New Drugs 1994 12:41-43 [on line] PMID: 12593035 [найдено 06.12.2007]. US 6030943 А, 29.02.2000. Классификация опухолевых болезней гемопоэтической и лимфо-идной
(85) Дата перевода заявки PCT на национальную фазу:
24.08.2005
(86) Заявка PCT:
US 2004/007606 (12.03.2004)
(87) Публикация PCT:
WO 2004/070421 (23.09.2004)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
БАРНЕДЖИ Дебабрата (US),
БЕРТИНО Джозеф Р. (US),
ФЭРКЛОТ Глинн Томас (US),
ГУРЕЙ Сайдам (US),
ХИМЕНО Хосе (ES)
(73) Патентообладатель(и):
ФАРМА МАР, С.А. (ES)
|
(54) УСОВЕРШЕНСТВОВАННОЕ ЛЕЧЕНИЕ ОПУХОЛЕЙ
(57) Реферат:
Предложено применение аплидина для получения лекарственного средства для лечения лейкемии или лимфомы с помощью комбинированной терапии с использованием аплидина и другого лекарственного средства, выбранного из группы, состоящей из метотрексата, цитозина арабинозида, митоксантрона, винбластина, метилпреднизолона и доксирубицина, соответствующие способы лечения (варианты), фармацевтическая композиция и набор. Показан синергизм противоракового действия перечисленных средств при сочетании с аплидином. 5 н. и 29 з.п. ф-лы, 15 ил., 11 табл.
(56) (продолжение):
Область, к которой относится изобретение
Настоящее изобретение относится к комбинациям аплидина или аналогов аплидина с другими противоопухолевыми средствами и к применению этих комбинаций для лечения рака, в частности для лечения лейкозов и лимфом.
Предпосылки к созданию изобретения
Аплидин (Дегидродидемнин B) представляет собой циклический депсипептид, выделенный из Средиземноморского оболочника, Aplidium albicans, и является объектом международной заявки WO 9109485. Он относится к соединениям, известным как дидемины, и имеет следующую структуру:
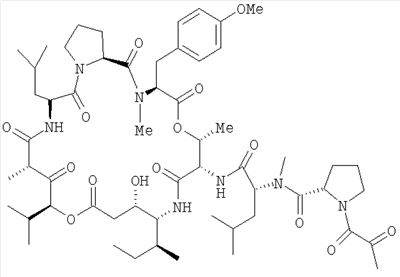
Дополнительную информацию об аплидине, аналогах аплидина, их применениях, фармацевтических композициях и синтезе можно найти в патентных заявках WO 981352, WO 9942125, WO 0176616, WO 0135974, WO 0230441 и WO 0202596. Авторы заявки приводят содержание этих заявок РСТ в качестве конкретной ссылки.
И у животных, и у людей в доклинических испытаниях и на I стадии клинических испытаний было показано, что это вещество обладает цитотоксическим эффектом в отношении широкого спектра типов опухолей, в том числе лейкоза и лимфомы. Смотри, например:
Faircloth G. et al. «Dehydrodidemnin B (DDE) a new marine derived anticancer agent with activity against experimental tumour models», 9th NCI-EORTC Symp New Drugs Cancer Ther (March 12-15, Amsterdam) 1996, Abst 111;
Faircloth G. et al. «Preclinical characterisation of aplidine, a new marine anticancer depsipeptide», Proc Amer Assoc Cancer Res 1997, 38: Abst 692;
Depenbrock H, Peter R, Faircloth GT, Manzanares I, Jimeno J, Hanauske AR. «In vitro activity of Aplidine, a new marine-derived anti-cancer compound, on freshly explanted clonogenic human tumour cells and haematopoietic precursor cells» Br. J. Cancer, 1998; 78: 739-744;
Faircloth G, Grant W, Nam S, Jimeno J, Manzanares I, Rinehart K. «Schedule-dependency of Aplidine, a marine depsipeptide with antitumor activity», Proc. Am. Assoc. Cancer Res. 1999:40:394;
Broggini M, Marchini S, D’Incalci M, Taraboletti G, Giavazzi R, Faircloth G, Jimeno J. «Aplidine blocks VEGF secretion and VEGF/VEGF-R1 autocrine loop in a human leukemic cell line», Clin Cancer Res 2000; 6 (suppl): 4509;
Erba E, Bassano L, Di Liberti G, Muradore I, Chiorino G, Ubezio P, Vignati S, Codegoni A, Desiderio MA, Faircloth G, Jimeno J и Dincaici M. «Cell cycle phase perturbations and apoptosis in tumour cells induced by aplidine», Br J Cancer 2002; 86: 1510-1517;
Paz-Ares L, Anthony A, Pronk L, Twelves C, Alonso S, Cortes-Funes H, Celli N, Gomez C, Lopez-Lazaro L, Guzman C, Jimeno J, Kaye S. «Phase I clinical and pharmacokinetic study of aplidine, a new marine didemnin, administered as 24-hour infusion weekly» Clin. Cancer Res. 2000; 6 (suppl): 4509;
Raymond E, Ady-Vago N, Baudin E, Ribrag V, Faivre S, Lecot F, Wright T, Lopez Lazaro L, Guzman C, Jimeno J, Ducreux M, Le Chevalier T, Armand JP. «A phase I and pharmacokinetic study of aplidine given as a 24-hour continuous infusion every other week in patients with solid tumor and lymphoma», Clin. Cancer Res. 2000; 6 (suppl): 4510;
Maroun J, Belanger K, Seymour L, Soulieres D, Charpentier D, Goel R, Stewart D, Tomiak E, Jimeno J, Matthews S. «Phase I study of aplidine in a 5 day bolus q 3 weeks in patients with solid tumors and lymphomas», Clin. Cancer Res. 2000; 6 (suppl): 4509;
Izquierdo MA, Bowman A, Martinez M, Cicchella B, Jimeno J, Guzman C, Germa J, Smyth J.: «Phase I trial of Aplidine given as a 1 hour intravenous weekly infusion in patients with advanced solid tumors and lymphoma», Clin. Cancer Res. 2000; 6 (suppl): 4509.
Изучение механизма показало, что аплидин может блокировать секрецию VEGF в клетках ALL-MOLT4 и цитотоксическая активность наблюдалась in vitro при низких концентрациях (5 нМ) в AML и ALL пробах, полученных у больных детей с первичным или рецидивирующим ALL и AML. По-видимому, аплидин вызывает блокаду как G1, так и G2 в лейкозных клетках, подвергавшихся действию лекарственных средств in vitro. Кроме регуляции по типу отрицательной обратной связи VEGF рецептора, до сих пор мало что известно о механизмах действия аплидина.
На I стадии клинических исследований с аплидином L-карнитин вводили в качестве 24-часовой подготовки к лечению или вводили вместе с аплидином для профилактики миелотоксичности, смотри, например, WO 0230441. Было доказано, что совместное введение L-карнитина способно улучшать восстановление после мышечной токсичности, индуцированной лекарственным средством, и позволило повысить дозу аплидина.
Таким образом, на I стадии клинических исследований аплидин не проявил миелотоксичности при максимально переносимых дозах, за исключением умеренной лимфопении. Эти характеристики делают аплидин потенциально эффективным средством для лечения лейкоза. Добавление аплидина во время химиотерапии лейкоза могло повысить эффективность лечения без необходимости снижения дозы лекарственного средства из-за повышающейся миелотоксичности и подтвержденной антилейкемической активности. Особенно это относится к лечению рецидивирующего ALL и первичного, и рецидивирующего AML, поскольку они являются заболеваниями с неблагоприятным прогнозом, которые в настоящее время лечат комбинациями миелотоксичных лекарственных средств.
Краткое изложение сущности изобретения
Авторам впервые удалось установить, что аплидин и аналоги аплидина усиливают действие других противораковых средств и, следовательно, могут успешно использоваться в комбинированной терапии рака. Данное изобретение относится к фармацевтическим композициям, фармацевтическим лекарственным формам, наборам и способам лечения рака с использованием этой комбинированной терапии.
В соответствии с одним из аспектов изобретения авторы предлагают эффективную комбинированную терапию на основе аплидина и аналогов аплидина, используя другие лекарственные средства, которые являются эффективными для лечения рака. Предпочтительно другое лекарственное средство является эффективным для лечения лейкоза и/или лимфомы. Наиболее предпочтительно, другое лекарственное средство выбрано из группы, включающей метотрексат, цитозин-арабинозид, митоксантрон, винбластин, метилпреднизолон и доксорубицин.
В еще одном варианте осуществления изобретение относится к способу лечения первичного и/или метастазирующего рака, который заключается во введении пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества аплидина или аналога аплидина, или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата и терапевтически эффективного количества другого лекарственного средства, эффективного для лечения рака, или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата, вводимого до, во время или после введения аплидина или аналога аплидина.
Предпочтительно другое лекарственное средство является эффективным для лечения лейкоза и/или лимфомы. Наиболее предпочтительно другое лекарственное средство выбрано из группы, включающей метотрексат, цитозин-арабинозид, митоксантрон, винбластин, метилпреднизолон и доксорубицин. Другие лекарственные средства могут образовывать часть единой композиции или вводиться как отдельная композиция одновременно или в другое время.
Рак, на который может быть направлено лечение, предпочтительно представляет собой лейкоз или лимфому, наиболее предпочтительно ALL (острый лимфомный лейкоз), AML (острый миелобластный лейкоз), CML, MML (миеломоноцитарный лейкоз) или CLL (хронический лимфоцитарный лейкоз).
В другом аспекте изобретение относится к способу повышения терапевтической эффективности лекарственного средства, эффективного для лечения рака, предпочтительно лекарственного средства, эффективного для лечения лейкоза и/или лимфомы, наиболее предпочтительно лекарственного средства, выбранного из группы, включающей метотрексат, цитозин-арабинозид, митоксантрон, винбластин, метилпреднизолон и доксорубицин, или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, заключающийся во введении пациенту, нуждающемуся в этом, некоторого количества аплидина или аналога аплидина, или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата. Аплидин или аналог аплидина вводят до, во время или после введения другого лекарственного средства.
Аплидин или аналог аплидина способен повышать терапевтическую эффективность некоторых противоопухолевых лекарственных средств. В одном из аспектов результатом является синергизм, а не аддитивность. Такие синергетические комбинации являются предпочтительным аспектом настоящего изобретения. Синергизм может быть обнаружен с помощью метода Chou-Talalay или другими методами. В других случаях может быть обнаружен антагонизм.
Еще в одном аспекте изобретение относится к фармацевтической композиции, содержащей аплидин или аналог аплидина, или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, и другое лекарственное средство, эффективное для лечения рака. Предпочтительно другое лекарственное средство является средством, эффективным для лечения лейкоза и/или лимфомы. Наиболее предпочтительно другое лекарственное средство выбрано из группы, включающей метотрексат, цитозин-арабинозид, митоксантрон, винбластин, метилпреднизолон и доксорубицин.
Изобретение также относится к набору, использующемуся для лечения или профилактики рака, который содержит лекарственную форму аплидина или аналога аплидина, или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата, лекарственную форму другого лекарственного средства, эффективного для лечения рака, или его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата и инструкции по применению каждого действующего вещества в комбинации для лечения или профилактики рака. Предпочтительно другое лекарственное средство является средством, эффективным для лечения лейкоза и/или лимфомы. Наиболее предпочтительно другое лекарственное средство выбрано из группы, включающей метотрексат, цитозин-арабинозид, митоксантрон, винбластин, метилпреднизолон и доксорубицин.
Еще в одном аспекте изобретение относится к применению аплидина для лечения хронического лимфолейкоза.
Краткое описание чертежей
Фиг.1. Аплидин ингибирует рост CLL клеток в культуре.
Фиг.2. Аплидин является эффективным ингибитором преB-ALL клеток в культуре.
Фиг.3. Кривая цитотоксическая доза – ответ CCRF-CEM (Фиг.3A), SKI-DLCL (Фиг.3B) и K562 (3C) клеток после лечения аплидином в течение 96 часов.
Фиг.4. Chou-Talalay анализ комбинации аплидина и AraC в CCRF-CEM клетках.
Фиг.5. Chou-Talalay анализ комбинации аплидина и AraC в SKI-DLCL клетках.
Фиг.6. Chou-Talalay анализ комбинации аплидина и митоксантрона в CCRF-CEM клетках.
Фиг.7. Chou-Talalay анализ комбинации аплидина и митоксантрона в SKI-DLCL клетках.
Фиг.8. Chou-Talalay анализ комбинации аплидина и метотрексата в CCRF-CEM клетках.
Фиг.9. Chou-Talalay анализ комбинации аплидина и доксорубицина в CCRF-CEM клетках.
Фиг.10. Chou-Talalay анализ комбинации аплидина и винбластина в CCRF-CEM клетках.
Фиг.11. Chou-Talalay анализ комбинации аплидина и доксорибуцина в SKI-DLCL клетках.
Фиг.12. Chou-Talalay анализ комбинации аплидина и винбластина в SKI-DLCL клетках.
Фиг.13. Chou-Talalay анализ комбинации аплидина и метилпреднизолона в SKI-DLCL клетках.
Фиг.14. Комбинация IC20 аплидина снижала IC50 AraC в CCRF-CEM (Фиг.14A) и SKI-DLCL (Фиг.14B) клетках после инкубации в течение 96 часов.
Фиг.15. Действие аплидина на размер опухоли in vivo как взятого в отдельности средства и в комбинации с AraC.
Подробное описание изобретения
Под «раком» понимают опухоли, новообразования и любые другие злокачественные ткани или клетки. Настоящее изобретение относится к применению аплидина или аналогов аплидина в комбинации для лечения рака вообще, но более предпочтительно для лечения различных лейкозов и лимфом.
Для изучения возможного усиления действия других противораковых средств аплидином авторы провели систематическое изучение комбинаций лекарственных средств для возможного применения при лейкозах и лимфомах. Было обнаружено, что аплидин является эффективным цитотоксическим средством in vitro в отношении первичных клеток, полученных у пациентов с преB-ALL (DM4), а также и в отношении свежих клеток, полученных у шести пациентов с хроническим лимфолейкозом (CLL). Значение IC50 составило 10 нМ в течение 3-дневной экспозиции с DM4 линией и после 11-дневной экспозиции с первичными CLL пробами.
Изучения лекарственной комбинации проводили на стабильной клеточной линии, а не на первичных клетках. Авторы изобретения изучали три клеточные линии viz. K562, CCRF-CEM и SKI-DLCL, представляющие собой острый миелолейкоз, лимфобластную лимфому и диффузную В-клеточную крупноклеточную лимфому соответственно. Данные в примерах показывают, что аплидин усиливает действие метотрексата, цитозин-арабинозида, митоксантрона, винбластина, метилпреднизолона, а также доксорубицина в K562, CCRF-CEM и SKI-DLCL клетках, снижая IC50 для этих лекарственных средств.
Таким образом, авторами изобретения было обнаружено, что аплидин является эффективным цитотоксическим средством в отношении клеток некоторых гематологических злокачественных опухолей. Существенно то, что авторы впервые установили, что аплидин ингибирует рост CLL клеток в культуре. Также было обнаружено, что аплидин усиливает цитотоксичность лекарственных средств, используемых для лечения лейкозов, таких как метотрексат (MTX), цитозин-арабинозид (AraC), митоксантрон (Mitox), винбластин (Vinb), метилпреднизолон (Metpred) и доксорубицин (DOX).
Лейкоз классифицируют по тому, насколько быстро он прогрессирует. Острый лейкоз развивается быстро и может распространиться в организме в течение нескольких недель или месяцев. Напротив, хронический лейкоз развивается медленно и постепенно ухудшается на протяжении многих лет.
Кроветворные (гематопоэтические) клетки при остром лейкозе остаются на стадии незрелости, поэтому они очень быстро делятся и накапливаются. Следовательно, при остром лейкозе необходимо немедленное лечение, иначе заболевание может привести к летальному исходу в течение нескольких месяцев. К счастью, некоторые подтипы острого лейкоза поддаются лечению доступными способами терапии и они излечимы. У детей часто развиваются острые формы лейкоза, лечение которых отличается от лечения лейкоза взрослых.
При хроническом лейкозе кроветворные клетки зрелые, или дифференцированные, но не «нормальные». Они остаются в кровотоке намного дольше, чем нормальные лейкоциты, и они не способны как следует бороться с инфекцией.
Лейкоз также классифицируют по типу делящихся лейкоцитов, то есть лимфоцитов (клетки иммунной системы), гранулоцитов (клетки, разрушающие бактерии) или моноцитов (макрофагобразующие клетки). В том случае, если аномальные лейкоциты представляют собой главным образом гранулоциты или моноциты, лейкоз классифицируют как миелогенный, или миелоидный лейкоз. С другой стороны, если аномальные клетки крови возникают из лимфоцитов костного мозга, рак называют лимфолейкозом.
Другие злокачественные заболевания, известные как лимфомы, развиваются из лимфоцитов в лимфатических узлах, селезенке и других органах. Такие злокачественные заболевания возникают не из костного мозга и имеют биологическое действие, отличное от лимфолейкоза.
Существует большое количество различных типов лейкозов, но наиболее часто встречаются четыре типа. Эта классификация основана на том, является ли лейкоз острым или хроническим, миеломным или лимфоцитарным.
Острый миелолейкоз (AML) – также известен как острый нелимфоцитарный лейкоз (ANLL) – является наиболее часто встречающейся формой лейкоза взрослых. Большинство пациентов находятся в пенсионном возрасте (приблизительный возраст диагностирования 65 лет), и мужчины больше подвержены, чем женщины. К счастью, благодаря последним достижениям в лечении, AML можно удерживать в состоянии ремиссии (ослабление заболевания) приблизительно у 60-70% взрослых, получающих соответствующее лечение. Исходные показатели ответа на лечение составляют приблизительно 65-75%, а итоговые показатели эффективности лечения составляют порядка более 40-50%.
Хронический миеломный лейкоз (CML) известен как миелопролиферативное заболевание, то есть заболевание, при котором клетки костного мозга пролиферируют (размножаются) вне ткани костного мозга. CML легко диагностировать, поскольку он является генетически специфичным, то есть имеет маркер, который легко выявляется под микроскопом. Около 95% пациентов с CML имеют генетическую транслокацию между хромосомами 9 и 22 в лейкозных клетках. Филадельфийская хромосома вызывает неконтролируемую репродукцию и пролиферацию всех типов лейкоцитов и тромбоцитов (факторы свертывания крови). CML пока еще не лечится стандартными химиотерапевтическими или иммунотерапевтическими способами.
Острый лимфоцитарный лейкоз (ALL) – также известен как острый лимфобластный лейкоз – представляет собой злокачественное заболевание, вызываемое аномальным ростом и развитием ранних агранулоцитарных лейкоцитов или лимфоцитов. Лейкоз возникает в бластных клетках костного мозга (В-клетки), тимуса (Т-клетки) и лимфатических узлах. ALL встречается главным образом у детей, чаще у детей в возрасте 4 года.
Хронический лимфоцитарный лейкоз (CLL) является наиболее распространенным лейкозом в Северной Америке и в Европе. Это заболевание возникает у пожилых людей и, очень редко, среди людей моложе 50-летнего возраста. Число больных CLL мужчин превосходит число больных женщин в среднем как 2 к 1. Считается, что CLL является результатом постепенного накопления зрелых, долгоживущих лимфоцитов. Следовательно, это злокачественное заболевание вызывается не столько чрезмерным ростом, сколько чрезвычайно длительным периодом жизни и накоплением злокачественных клеток. Хотя скорость накопления различна у отдельных людей, большая опухолевая нагрузка со временем вызывает осложнения у всех пациентов с CLL.
Композиции по настоящему изобретению могут содержать оба компонента (лекарственного средства) в одном фармацевтически приемлемом составе. Альтернативно данные компоненты можно получить отдельно и вводить в комбинации друг с другом. В настоящем изобретении могут быть использованы различные фармацевтически приемлемые композиции, хорошо известные специалистам в данной области. Выбор соответствующей композиции для применения по настоящему изобретению может быть осуществлен по стандартной методике специалистом в данной области, исходя из пути введения и характеристик растворимости компонентов данной композиции.
Примеры фармацевтических композиций, содержащих аплидин или аналог аплидина, включают в себя жидкости (растворы, суспензии или эмульсии) с подходящей композицией для внутривенного введения, и они могут содержать соединение в чистом виде или в сочетании с каким-либо носителем, или другими фармакологически активными соединениями. Растворенный аплидин в значительной степени разрушается при нагревании и под действием света, и были разработаны лиофилизированные лекарственные формы, смотри публикацию WO 99/42125, приведенную здесь в качестве ссылки.
Введение аплидина или композиций по настоящему изобретению основано на схеме введения дозы предпочтительно путем внутривенной инфузии. Предпочтительно используемая длительность инфузии составляет до 72 часов, более предпочтительно от 1 до 24 часов, наиболее предпочтительно около 1, около 3 или около 24 часов. Особенно предпочтительными являются инфузии короткой продолжительности, что позволяет проводить лечение, не оставляя пациента на ночь в стационаре. Однако, если требуется, инфузии могут быть 24-часовыми или даже более длительными. Инфузию можно осуществлять в подходящие интервалы с различными режимами, например раз в неделю, два раза в неделю или чаще, повторно каждую неделю, необязательно, с интервалом обычно в одну неделю.
Подходящие дозы соединений данной комбинации будут применяться в зависимости от конкретной композиции, пути введения и конкретного расположения хозяина и опухоли, на которые направлено лечение. Следует учитывать другие факторы, такие как возраст, массу тела, пол, режим питания, время введения, скорость экскреции, состояние организма, сочетания с лекарственными средствами, реакции чувствительности и тяжесть заболевания. Введение может осуществляться непрерывно или периодически в максимально переносимой дозе. Дополнительные указания по приему аплидина даны в публикации WO 0135974, которая включена здесь в качестве ссылки в полном объеме.
В настоящем изобретении могут быть использованы аналоги аплидина, вместо APL самого аплидина. В основном такие соединения описаны в WO 0202596. Примеры соединений по настоящему изобретению включают в себя предпочтительные соединения, которые даны в WO 0202596, и, в частности, авторы приводят в описании изобретения для выдачи патента обсуждение предпочтительных соединений и связанных с ними аспектов, приведенных в WO 0202596. Более предпочтительно аналоги близки к аплидину по структуре и обычно отличаются от аплидина по одной аминокислоте или концевой боковой цепи. В циклической части молекулы или в боковой цепи могут быть различные аминокислоты. Многочисленные примеры таких соединений приведены в WO 0202596, и они подходят для использования в настоящем изобретении.
Примеры
Пример 1
Аплидин испытывали на различных первичных клетках, полученных у пациентов с гематологическими злокачественными заболеваниями. Используемые клетки представляли собой
– свежие клетки, полученные у шести пациентов с хроническим лимфолейкозом,
– первичные клетки, полученные у пациента с преB-ALL (DM4).
Пробы получали с учетом предварительного согласия пациента и CLL клетки выделяли путем центрифугирования в градиенте плотности финола («histopaque»). Используемая среда представляла собой RPMI, дополненную 10% аутологичной сывороткой и L-глутамином. Культуры инкубировали с 10 нМ аплидином и выживаемость клеток определяли на 3, 7, 11 и 18 сутки по сравнению с выживаемостью необработанных клеток и STI 571 (0,5 мМ).
Результаты этих исследований представлены на фиг.1-2.
Пример 2
Для изучения возможного усиления действия других противораковых средств авторы изобретения провели изучение комбинаций лекарственных средств для возможного использования при лейкозах и лимфомах.
Изучение комбинации лекарственных средств проводили на стабильных клеточных линиях, а не на первичных клетках. Были изучены три клеточные линии, viz. K562, как модель острого миелолейкоза, CEM, представляющей острый лимфолейкоз, и SKI-DLCL, представляющей диффузную крупноклеточную лимфому. Комбинированные исследования с IC20 и IC50 дозами аплидина с рядом доз метотрексата, цитозин-арабинозида и доксорубицина проводили для определения возможности аплидина усиливать действие этих лекарственных средств.
Результаты приведены в таблице 1.
| Таблица 1 |
| Дополнительное лекарственное средство |
IC50 Dox |
IC50 MTX |
IC50 Ara-C |
| Без аплидина |
18 нМ |
5 нМ |
30 нМ |
| IC20 аплидина (0,5 нМ) |
1 нМ |
500 pM |
6 нМ |
| p<0,01, p<0,05, p<0,05 |
Несомненно, эти данные показывают, что аплидин усиливает действие доксорубицина, метотрексата и цитозин-арабинозида, существенно снижая IC50 для этих лекарственных средств.
Пример 3. In vitro исследования для определения действия аплидина как самостоятельного лекарственного средства на клеточные линии CCRF-CEM, SKI-DLCL и K562.
Клетки CCRF-CEMS, SKI-DLCL и K562 выращивали в среде RPMI 1640, дополненной 10% FCS. Для определения цитотоксического действия аплидина на все клеточные линии и для получения значений IC50 аплидина в этих клеточных линиях клетки помещали в 96-луночные планшеты и инкубировали в течение 96 часов во влажной камере с 5% CO2. Выживаемость клеток определяли с помощью XTT анализа в автоматизированном считывателе для планшет. Авторами было обнаружено, что аплидин обладает цитотоксичностью в отношении всех клеточных линий с величиной IC50 0,5-1,0 нМ (фиг.3).
Пример 4. Изучение in vitro действия аплидина + комбинации лекарственных средств с заданными дозами IC50:IC50 на все клеточные линии.
Метотрексат, цитозин-арабинозид C (ara-C), митоксантрон, метилпреднизолон, винбластин и доксорубицин тестировали в сочетании с аплидином.
Для анализа комбинаций лекарственных средств использовали метод Chou-Talalay. В том случае, когда индекс комбинирования (CI), полученный этим методом, составляет менее 1, тогда лекарственные средства являются синергистами; в том случае, когда CI равен 1, данные лекарственные средства являются аддитивными, и, если CI составляет более 1, то данные лекарственные средства являются антагонистами.
Все исследования цитотоксичности проводили с использованием XTT или MTS. Авторы впервые определили величину IC50 этих лекарственных средств на клеточных линиях SKI-DLCL, CCRF-CEM и K562. Была изучена комбинация лекарственных средств с использованием заданных соотношений IC50 (аплидин):IC50 (Средство X).
В таблице 2 показана комбинация аплидина и Ara-C с величиной (IC50:IC50) в клетках CCRF-CEM.
| Таблица 2 |
| Соотношение |
Доза APL |
Доза AraC |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
0,5 нМ |
0 |
52,7 |
| IC50(AraC) |
0 |
10 нМ |
56,4 |
| x16 |
8 нМ |
160 нМ |
4,7 |
| x8 |
4 нМ |
80 нМ |
7,9 |
| x4 |
2 нМ |
40 нМ |
7,6 |
| x2 |
1 нМ |
20 нМ |
7,8 |
| IC50:IC50 |
0,5 нМ |
10 нМ |
10,6 |
| x1/2 |
0,25 нМ |
5 нМ |
16,2 |
| x1/4 |
1,125 нМ |
2,5 нМ |
36,7 |
| x1/8 |
0,0625 нМ |
1,25 нМ |
70,8 |
Результаты Chou-Talalay анализа комбинации аплидина и Ara-C в CCRF-CEM клетках представлены на фиг.4. Индекс CI для данной комбинации в клетках CCRF-CEM составляет 0,469.
В таблице 3 показана комбинация аплидина и Ara-C с величиной (IC50:IC50) в клетках SKI-DLCL.
| Таблица 3 |
| Соотношение |
Доза APL |
Доза AraC |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
0,5 нМ |
0 |
50 |
| IC50(AraC) |
0 |
30 нМ |
50 |
| x16 |
8 нМ |
480 нМ |
12 |
| x8 |
4 нМ |
240 нМ |
10,7 |
| x4 |
2 нМ |
120 нМ |
14,1 |
| x2 |
1 нМ |
60 нМ |
17,4 |
| IC50:IC50 |
0,5 нМ |
30 нМ |
23,1 |
| x1/2 |
0,25 нМ |
15 нМ |
25,4 |
| x1/4 |
1,125 нМ |
7,5 нМ |
25,5 |
| x1/8 |
0,0625 нМ |
3,75 нМ |
50,8 |
Результаты Chou-Talalay анализа комбинации аплидина и Ara-C в клетках SKI-DLCL представлены на фиг. 5. Индекс CI для данной комбинации в клетках SKI-DLCL составляет 0,306.
В таблице 4 показана комбинация аплидина и Ara-C с величиной (IC50:IC50) в клетках K562.
| Таблица 4 |
| Соотношение |
Доза APL |
Доза AraC |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
1 нМ |
0 |
50 |
| IC50(AraC) |
0 |
30 нМ |
50 |
| x16 |
16 нМ |
480 нМ |
11,8 |
| x8 |
8 нМ |
240 нМ |
15,2 |
| x4 |
4 нМ |
120 нМ |
15,5 |
| x2 |
2 нМ |
60 нМ |
17 |
| IC50:IC50 |
1 нМ |
30 нМ |
22,1 |
| x1/2 |
0,5 нМ |
15 нМ |
25,6 |
| x1/4 |
0,25 нМ |
7,5 нМ |
31,1 |
| x1/8 |
0,125 нМ |
3,75 нМ |
44,2 |
Индекс CI для данной комбинации в клетках K562 составляет 0,502.
В таблице 5 показана комбинация аплидина и митоксантрона с величиной (IC50:IC50) в клетках CCRF-CEM.
| Таблица 5 |
| Соотношение |
Доза APL |
Доза митоксантрона |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
0,5 нМ |
0 |
50 |
| IC50(Mitox) |
0 |
30 нМ |
56 |
| x16 |
8 нМ |
480 нМ |
9,9 |
| x8 |
4 нМ |
240 нМ |
11,6 |
| x4 |
2 нМ |
120 нМ |
11,9 |
| x2 |
1 нМ |
60 нМ |
13,8 |
| IC50:IC50 |
0,5 нМ |
30 нМ |
20,6 |
| x1/2 |
0,25 нМ |
15 нМ |
39,7 |
| x1/4 |
1,125 нМ |
7,5 нМ |
60,7 |
| x1/8 |
0,0625 нМ |
3,75 нМ |
76,5 |
Результаты Chou-Talalay анализа комбинации аплидина и митоксантрона в клетках CCRF-CEM представлены на фигуре 6. Индекс CI для данной комбинации в клетках CCRF-CEM составляет 0,911.
В таблице 6 показана комбинация аплидина и митоксантрона с величиной (IC50:IC50) в клетках SKI-DLCL.
| Таблица 6 |
| |
Доза APL |
Доза митоксантрона |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
0,5 нМ |
0 |
50 |
| IC50(Mitox) |
0 |
5 нМ |
50 |
| x16 |
8 нМ |
80 нМ |
17 |
| x8 |
4 нМ |
40 нМ |
29 |
| x4 |
2 нМ |
20 нМ |
22,6 |
| x2 |
1 нМ |
10 нМ |
19,9 |
| IC50:IC50 |
0,5 нМ |
5 нМ |
32,2 |
| x1/2 |
0,25 нМ |
2,5 нМ |
53,1 |
| x1/4 |
1,125 нМ |
1,25 нМ |
58,6 |
| x1/8 |
0,0625 нМ |
0,625 нМ |
70,1 |
Результаты Chou-Talalay анализа комбинации аплидина и митоксантрона в клетках SKI-DLCL представлены на фиг.7. Индекс CI для данной комбинации в клетках SKI-DLCL составляет 0,646.
В таблице 7 показана комбинация аплидина и митоксантрона с величиной (IC50:IC50) в клетках K562.
| Таблица 7 |
| |
Доза APL |
Доза митоксантрона |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
1 нМ |
0 |
50 |
| IC50(Mitox) |
0 |
7,5 нМ |
50,7 |
| x16 |
16 нМ |
120 нМ |
9,9 |
| x8 |
8 нМ |
60 нМ |
11,6 |
| x4 |
4 нМ |
30 нМ |
11,9 |
| x2 |
2 нМ |
15 нМ |
13,8 |
| IC50:IC50 |
1 нМ |
7,5 нМ |
20,6 |
| x1/2 |
0,5 нМ |
3,75 нМ |
39,7 |
| x1/4 |
0,25 нМ |
1,8 нМ |
60,7 |
| x1/8 |
0,125 нМ |
0,9 нМ |
76,5 |
Индекс CI данной комбинации в клетках K562 составляет 0,487.
В таблице 8 показана комбинация аплидина и метотрексата с величиной (IC50:IC50) в клетках CCRF-CEM.
| Таблица 8 |
| Соотношение |
Доза APL |
Доза метотрексата |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
0,5 нМ |
0 |
50 |
| IC50(MTX) |
0 |
10 нМ |
50 |
| x16 |
8 нМ |
160 нМ |
5 |
| x8 |
4 нМ |
80 нМ |
13 |
| x4 |
2 нМ |
40 нМ |
11 |
| x2 |
1 нМ |
20 нМ |
12 |
| IC50:IC50 |
0,5 нМ |
10 нМ |
20 |
| x1/2 |
0,25 нМ |
5 нМ |
30 |
| x1/4 |
1,125 нМ |
2,5 нМ |
88 |
| x1/8 |
0,0625 нМ |
1,25 нМ |
100 |
Результаты Chou-Talalay анализа комбинации аплидина и метотрексата в клетка CCRF-CEM представлены на фиг.8. Индекс CI для данной комбинации в клетках CCRF-CEM составляет 0,950.
Результаты Chou-Talalay анализа комбинации аплидина и доксорубицина в клетках CCRF-CEM представлены на фиг.9. Индекс CI для данной комбинации в клетках CCRF-CEM составляет 1,952.
Результаты Chou-Talalay анализа комбинации аплидина и винбластина в клетках CCRF-CEM представлены на фиг.10. Индекс CI для данной комбинации в клетках CCRF-CEM составляет 2,046.
В таблице 9 показана комбинация аплидина и доксорубицина с величиной (IC50:IC50) в клетках SKI-DLCL.
| Таблица 9 |
| Соотношение |
Доза APL |
Доза доксорубицина |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
0,5 нМ |
0 |
50 |
| IC50(Doxo) |
0 |
5 нМ |
50 |
| x16 |
8 нМ |
80 нМ |
9,4 |
| x8 |
4 нМ |
40 нМ |
8,6 |
| x4 |
2 нМ |
20 нМ |
8 |
| x2 |
1 нМ |
10 нМ |
9,7 |
| IC50:IC50 |
0,5 нМ |
5 нМ |
21 |
| x1/2 |
0,25 нМ |
2,5 нМ |
40 |
| x1/4 |
1,125 нМ |
1,25 нМ |
45 |
| x1/8 |
0,0625 нМ |
0,625 нМ |
49 |
Результаты Chou-Talalay анализа комбинации аплидина и доксорубицина в клетках SKI-DLCL представлены на фиг.11. Индекс CI для данной комбинации в клетках SKI-DLCL составляет 0,478.
В таблице 10 показана комбинация аплидина и винбластина с величиной (IC50:IC50) в клетках SKI-DLCL.
| Таблица 10 |
| Соотношение |
Доза APL |
Доза винбластина |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
0,5 нМ |
0 |
50 |
| IC50(Vinb) |
0 |
4 нМ |
50 |
| x16 |
8 нМ |
64 нМ |
15 |
| x8 |
4 нМ |
32 нМ |
17 |
| x4 |
2 нМ |
16 нМ |
17 |
| x2 |
1 нМ |
8 нМ |
21 |
| IC50:IC50 |
0,5 нМ |
4 нМ |
29 |
| x1/2 |
0,25 нМ |
2 нМ |
25 |
| x1/4 |
1,125 нМ |
1 нМ |
28 |
| x1/8 |
0,0625 нМ |
0,5 нМ |
38 |
Результаты Chou-Talalay анализа комбинации аплидина и винбластина в клетках SKI-DLCL представлены на фиг.12. Индекс CI для данной комбинации в клетках SKI-DLCL составляет 0,760.
В таблице 11 показана комбинация аплидина и метилпреднизолона с величиной (IC50:IC50) в клетках SKI-DLCL.
| Таблица 11 |
| |
Доза APL |
Доза метилпреднизолона |
Выживаемость (% от контроля) |
| Контроль |
0 |
0 |
100 |
| IC50(APL) |
0,5 нМ |
0 |
50 |
| IC50(Metpred) |
0 |
160 нМ |
51 |
| x16 |
8 нМ |
2560 нМ |
10,8 |
| x8 |
4 нМ |
1280 нМ |
17,3 |
| x4 |
2 нМ |
640 нМ |
16,7 |
| x2 |
1 нМ |
320 нМ |
17,4 |
| IC50:IC50 |
0,5 нМ |
160 нМ |
24,7 |
| x1/2 |
0,25 нМ |
80 нМ |
32,4 |
| x1/4 |
1,125 нМ |
40 нМ |
39,1 |
| x1/8 |
0,0625 нМ |
20 нМ |
50 |
Результаты Chou-Talalay анализа комбинации аплидина и метилпреднизолона в клетках SKI-DLCL представлены на фиг.13. Индекс CI для данной комбинации в клетках SKI-DLCL составляет 0,646.
Пример 5.
Также проводились исследования цитотоксического действия комбинации IC20 (APL) с различными дозами AraC на клеточных линиях CCRF-CEM и SKI-DLCL. Аплидин в обеих клеточных линиях усиливал действие AraC, величина IC50 AraC была снижена с 30 до 1,6 нМ в клеточной линии SKI-DLCL и с 10 до 0,8 нМ в клеточной линии CCRF-CEM соответственно (фиг.14). Данные были получены после инкубирования клеток в течение 96 часов и с использованием ХТТ анализа. Результаты представляют средние значения трех различных опытов.
Пример 6. Исследования In vivo.
Были проведены опыты in vivo для изучения действия аплидина в отдельности и в комбинации с другими лекарственными средствами для лечения лимфолейкозов.
Определение максимальной переносимой дозы (MTD) у C.B.-17 scid/scid (мышей SCID)
С этой целью использовали in vivo модель лимфомы человека у мышей SCID. В частности, использовали клетки CCRF-CEMS и мышей CB.17 scid/scid. На основании опыта работы с этой моделью было оценено медикаментозное лечение с использованием данного ксенотрансплантата (Lacerda J.F. et al. Blood 85 (10): 2675-2679 (1995)). Мы обнаружили, что общая доза 1 мг/кг в неделю, которую вводили пятью ежедневными дозами, составляет максимальную дозу аплидина, которую могут переносить мыши.
Определение in vivo противоопухолевого эффекта аплидина, взятого в отдельности и в комбинации с AraC, на модели ксенотрансплантата у мышей SCID
Мышам SCID подкожно в правый бок инокулировали 107 лейкозных клеток CEM-T. Их наблюдали дважды в неделю на обнаружение образования опухоли в месте инокуляции. После регистрации пальпируемой опухоли парентерально вводили аплидин как самостоятельное средство и в комбинации с несколькими дозами AraC для определения противоопухолевого эффекта. Мыши были рандомизированы для введения только аплидина в дозах 0,75 мг/кг и 1 мг/кг, только AraC 50 мг/кг или комбинации аплидина и AraC для всех комбинаций доз. Доза AraC, выбранная для данной комбинации, представляет собой дозу, при которой подавлялся рост опухоли, но не наблюдалось регрессии опухоли. Все лекарственные средства вводили внутрибрюшинно, и размер опухоли сравнивали с контрольной группой мышей, не получавших никакого лечения, а для комбинированных групп сравнивали с размерами опухоли при лечении отдельно взятым средством.
Было обнаружено, что наиболее эффективная комбинация составляет AraC (50 мг/кг) + аплидин (0,75 мг/кг) (фиг.15).
Эти сведения в отношении аплидина могут быть распространены на аналоги аплидина, производные и родственные соединения. Например, настоящее изобретение предлагает комбинацию соединения, например соединений, представленных в публикации WO 0202596, с противораковым лекарственным средством, предпочтительно лекарственным средством против лейкоза или лимфомы, особенно метотрексатом, цитозин-арабинозидом, митоксантроном, винбластином, метилпреднизолоном или доксорубицином.
Формула изобретения
1. Применение аплидина для получения лекарственного средства для лечения лейкемии или лимфомы с помощью комбинированной терапии с использованием аплидина и другого лекарственного средства, выбранного из группы, состоящей из метотрексата, цитозина арабинозида, митоксантрона, винбластина, метилпреднизолона и доксирубицина.
2. Применение аплидина по п.1 для получения лекарственного средства для лечения лейкемии.
3. Применение аплидина по п.2, где указанная лейкемия является хроническим лимфоцитарным лейкозом.
4. Применение аплидина по п.1 для получения лекарственного средства для лечения лимфомы.
5. Применение аплидина по п.1, где аплидин и другое лекарственное средство являются частью единого лекарственного средства.
6. Применение аплидина по п.1, где аплидин и другое лекарственное средство вводят в виде отдельных лекарственных средств одновременно или в разное время.
7. Применение аплидина для получения лекарственного средства по любому из пп.1-6, где другое лекарственное средство представляет собой метотрексат.
8. Применение аплидина для получения лекарственного средства по любому из пп.1-6, где другое лекарственное средство представляет собой цитозин арабинозид.
9. Применение аплидина для получения лекарственного средства по любому из пп.1-6, где другое лекарственное средство представляет собой митоксантрон.
10. Применение аплидина для получения лекарственного средства по любому из пп.1-6, где другое лекарственное средство представляет собой винбластин.
11. Применение аплидина для получения лекарственного средства по любому из пп.1-6, где другое лекарственное средство представляет собой метилпреднизолон.
12. Применение аплидина для получения лекарственного средства по любому из пп.1-6, где другое лекарственное средство представляет собой доксирубицин.
13. Способ лечения лейкемии или лимфомы, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества аплидина и терапевтически эффективного количества другого лекарственного средства, эффективного для лечения рака, вводимого до, во время или после введения аплидина, где другое лекарственное средство выбрано из группы, состоящей из метотрексата, цитозина арабинозида, митоксантрона, винбластина, метилпреднизолона и доксирубицина.
14. Способ по п.13, где указанным раком является лейкемия.
15. Способ по п.14, где указанная лейкемия является хроническим лимфоцитарным лейкозом.
16. Способ по п.13, где раком является лимфома.
17. Способ по любому из пп.13-16, где другое лекарственное средство представляет собой метотрексат.
18. Способ по любому из пп.13-16, где другое лекарственное средство представляет собой цитозин арабинозид.
19. Способ по любому из пп.13-16, где другое лекарственное средство представляет собой митоксантрон.
20. Способ по любому из пп.13-16, где другое лекарственное средство представляет собой винбластин.
21. Способ по любому из пп.13-16, где другое лекарственное средство представляет собой метилпреднизолон.
22. Способ по любому из пп.13-16, где другое лекарственное средство представляет собой доксирубицин.
23. Способ повышения терапевтической эффективности лекарственного средства при лечении лейкемии или лимфомы с помощью комбинированной терапии аплидином, где указанное лекарственное средство выбрано из группы, состоящей из метотрексата, цитозина арабинозида, митоксантрона, винбластина, метилпреднизолона и доксорубицина, и аплидин вводится до, во время или после введения другого лекарственного средства.
24. Способ по п.23, где раком является лейкемия.
25. Способ по п.24, где указанная лейкемия является хроническим лимфоцитарным лейкозом.
26. Способ по п.23, где раком является лимфома.
27. Способ по любому из пп.23-26, где другим лекарственным средством является метотрексат.
28. Способ по любому из пп.23-26, где другим лекарственным средством является цитозин арабинозид.
29. Способ по любому из пп.23-26, где другим лекарственным средством является митоксантрон.
30. Способ по любому из пп.23-26, где другим лекарственным средством является винбластин.
31. Способ по любому из пп.23-26, где другим лекарственным средством является метилпреднизолон.
32. Способ по любому из пп.23-26, где другим лекарственным средством является доксорубицин.
33. Фармацевтическая композиция, содержащая аплидин и другое лекарственное средство, выбранное из группы, состоящей из метотрексата, цитозина арабинозида, митоксантрона, винбластина, метилпреднизолона и доксорубицина, для лечения лейкемии или лимфомы.
34. Набор для применения при лечении или профилактики лейкемии или лимфомы, содержащий лекарственную форму аплидина, лекарственную форму другого лекарственного средства, выбранного из группы, состоящей из метотрексата, цитозина арабинозида, митоксантрона, винбластина, метилпреднизолона и доксорубицина, и инструкцию для применения каждого средства в комбинации.
РИСУНКИ
|
|