|
|
(21), (22) Заявка: 2006141418/15, 22.04.2005
(24) Дата начала отсчета срока действия патента:
22.04.2005
(30) Конвенционный приоритет:
24.04.2004 KR 10-2004-0028514
04.09.2004 KR 10-2004-0070650
21.12.2004 KR 10-2004-0109805
(43) Дата публикации заявки: 27.05.2008
(46) Опубликовано: 20.12.2008
(56) Список документов, цитированных в отчете о
поиске:
SUH J.S. at al. Triacylglycerol, 1-palmitoyl-2-linoleoyl-3-acetyl-RAC-glycerol isolated from bovine udder and its synthetic enantiomer can potentiate the mitogenic activity for mouse peritoneal macrophages. Cell. Physiol. Biochem. 2003; 13(6):415-22. WO 99/26640 A1, 03.06.1999. RU 2154492 C2, 20.08.2000. WO 99/00116 A2, 07.01.1999. OUYANG Y. at al.
(85) Дата перевода заявки PCT на национальную фазу:
24.11.2006
(86) Заявка PCT:
KR 2005/001175 (22.04.2005)
(87) Публикация PCT:
WO 2005/112912 (01.12.2005)
Адрес для переписки:
103735, Москва, ул. Ильинка, 5/2, ООО “Союзпатент”, пат.пов. А.П.Агурееву
|
(72) Автор(ы):
КИМ Санг-Хи (KR)
(73) Патентообладатель(и):
КИМ Санг-Хи (KR)
|
(54) ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО, ПРОТИВОРАКОВОЕ СРЕДСТВО И ЗДОРОВАЯ ПИЩА, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ МОНОАЦЕТИЛДИАЦИЛГЛИЦЕРИНА
(57) Реферат:
Изобретение относится к медицине, а именно к диетологии, и раскрывает применение производных моноацетилдиацилглицерина, экстрагированных из оленьего рога, в качестве средства, подавляющего нарушение клеток в результате аутоиммунной реакции. Пероральное применение производных моноацетилдиацилглицерина задерживает развитие индуцированного рака у хомячков путем активации лимфоцитов, моноцитов и дендритных клеток, а также индукции апоптоза раковых клеток вследствие усиления цитотоксичности иммунных клеток по отношению к раковым клеткам. Также при индукции септического шока у мышей продемонстрирован 100%-ный уровень выживаемости даже через 120 часов, достигаемый контролем иммунитета и подавляющим эффектом апоптоза. Производные моноацетилдиацилглицерина в соответствии с настоящим изобретением могут эффективно применяться как средство для лечения сепсиса и рака и как здоровая пища для предотвращения рака или аутоиммунных заболеваний. 4 н. и 7 з.п.ф-лы, 16 ил. 6 табл.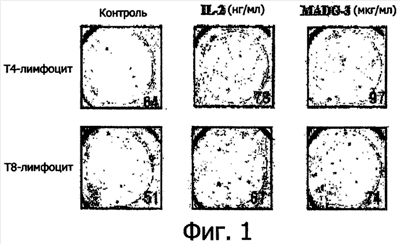
(56) (продолжение):
CLASS=”b560m”Suppression of interleukin-2 by the putative endogenous cannabinoid 2-arachidonyl-glycerol is mediated through down-regulation of the nuclear factor of activated Т cells. Mol. Pharmacol. 1998 Apr; 53(4):676-83.
Область техники, к которой относится изобретение
Это изобретение имеет отношение к применению иммуномодулирующего средства, к лечебным ресурсам и здоровой пище, содержащей в качестве эффективного ингредиента производные моноацетилдиацилглицерина, экстрагированные из оленьего рога.
Уровень техники
Олений рог (по латыни Cervi parvu cornu) представляет собой заготовленный и высушенный необызвестленный рог любого животного семейства оленьих. В традиционной восточной медицине Кореи широко используют оленьи рога, а также женьшень из-за их различных заявленных медицинских эффектов. При традиционном применении оленьих рогов ограничиваются только несколькими видами семейств оленьих: Cervus Nippon Temminick var. Mantchuricus Swinhoe (далее C.N.) и Cervus elaphus L.. Полагают, что олений рог обладает целым рядом лечебных эффектов. Известно, что он эффективен в тонизирующих средствах для стимулирования роста и развития, гемопоэза, для лечения нервных расстройств, лечения сердечной недостаточности, и, как правило, он улучшает функцию пяти плотных внутренних органов и шести полых внутренностей (Dong-euibogam, классическая медицинская литература в Корее). Другие книги в традиционной медицине, имеющие отношение к эффектам оленьих рогов, также сообщают о тонизирующих эффектах, питательном эффекте, эффектах на повышение жизнеспособности, включающих улучшение сердечной функции, эффектах снятия усталости, повышении иммунитета. Было предпринято много усилий для открытия полного химического состава оленьего рога. В результате было обнаружено, что он содержит активные ингредиенты, такие как свободные аминокислоты, следовые (металлические) элементы, гексозу, пентозу, гексозамин, уроновую кислоту, сиаловую кислоту, мукополисахариды (например, гиалуроновую кислоту, хондроитин А), различные жирные кислоты, простагландины. Также было сообщено, что в экстрактах из оленьих рогов были обнаружены гликолипид, фосфолипид, холестерин, гипоксантин, холест-5-ен-3 ,7 ,7 -диол, сложный эфир холестерина, полиамин. Другие авторы сообщали о присутствии эстрона и рецептора эстрадиола (report NIH Korea, Vol.22, p. 359, 1985; Korean Biochem. J, Vol.9, No.3, p.153, 1976; Korean Biochem. J, Vol.9, No.4, p. 215, 1976; Korean Biochem. J, Vol.10, No.1. p. 1, 1977; Shoykugaku Zasshi, 43(2), p 173, 1989). -диол, сложный эфир холестерина, полиамин. Другие авторы сообщали о присутствии эстрона и рецептора эстрадиола (report NIH Korea, Vol.22, p. 359, 1985; Korean Biochem. J, Vol.9, No.3, p.153, 1976; Korean Biochem. J, Vol.9, No.4, p. 215, 1976; Korean Biochem. J, Vol.10, No.1. p. 1, 1977; Shoykugaku Zasshi, 43(2), p 173, 1989).
Иммунитет представляет собой защитный механизм, охраняющий живой организм от различных патогенов. Иммунодефицит возникает из-за дефекта в компонентах иммунной системы, указывающего на то, что иммунная система не способна отвечать на различные антигены. Иммунодефицит в значительной степени делится на врожденный или первичный иммунодефицит и приобретенный или вторичный иммунодефицит. В случае врожденного иммунодефицита, как и следовало ожидать, отсутствуют В-клетки или Т-клетки, поэтому его можно лечить только с помощью генной терапии, введением антител или трансплантацией костного мозга. С другой стороны, в случае приобретенного иммунодефицита все факторы, имеющие отношение к иммунитету, естественно существуют, но имеет место нарушение в иммунных реакциях, поэтому иммунодефицит может быть повышен с помощью активации функций иммунных факторов. В последнее время увеличилось количество аутоиммунных заболеваний, таких как артрит, атопия, слабоумие и сепсис. Аутоиммунные заболевания возникают из-за чрезмерного усиления иммунной функции. Для лечения аутоиммунных заболеваний применяли иммунный супрессор, но иммунный супрессор также часто вызывает подавление иммунитета. Основываясь на раскрытии механизма иммунитета, было предпринято много попыток для разработки иммунного регулятора для контроля над иммунитетом. Целью этих попыток является усиление защитной силы живого организма против патогенов и минимизация побочных эффектов с помощью контроля за активацией и супрессией иммунной функции иммунными регуляторами, которые могут неспецифично стимулировать иммунные клетки. Иммунные регуляторы могут лечить едва ли не все заболевания живого организма, такие как рак, сепсис, дегенеративный артрит, инфекция, слабоумие, старение, диабет, анемия, заболевание кожи, астма, атопия, стресс, нервное расстройство, физическая усталость, синдром хронической усталости и остеопороз. На сегодняшний день в качестве иммунного регулятора использовали химические соединения, композиции микроорганизмов, биологические продукты и т.д. Большинство этих иммунных регуляторов ограничены в применении, так как они имеют склонность вызывать только один эффект (или иммунную активацию, или супрессию). Таким образом, они могут вызывать побочные эффекты и быть токсичными сами по себе. Чтобы преодолеть указанные выше проблемы, главными мишенями для разработки иммунных регуляторов являются продукты питания, не обладающие токсичностью, эффективные ингредиенты, экстрагированные из природных источников и традиционные лекарственные травы; а также эксперименты для выяснения их эффектов в качестве лекарственных средств для клинических испытаний. Но эти иммунные регуляторы все еще обладают или активирующим или подавляющим эффектом на иммунитет.
Число случаев рака, главной причины смертности в Корее, каждый год увеличивается. Химиотерапия или радиотерапия при лечении рака не только убивают раковые клетки, но также разрушают нормальные клетки костного мозга, в особенности кроветворные клетки, регулирующие иммунитет и гемопоэз, что приводит к нарушениям в иммунной системе и кроветворных органах (Korean J. BRM., 1, р. 23, 1993; Korean J. BRM., 4, p. 47, 1994; Crit Rev Oncol Hematol. 1, p.227, 1984). Сепсис является серьезным заболеванием, приводящим в более чем к 45% смертельному исходу, он вызывается тяжелой системной инфекцией, ведущей к системному воспалительному ответу. Он возникает, когда инфицированные организмы в избыточной степени отвечают на эндотоксин грамотрицательных бактерий. Несмотря на то что при лечении септического шока применяли антибиотики, стероид или «Ксигрис» (Eli Lilly company), уровень смертности от септического шока остается все еще высоким, так как эти антибиотики, стероид или «Ксигрис» неэффективны против сепсиса.
Авторы настоящего изобретения выделили различные ингредиенты из рога оленя C.N., который, как известно, обладает превосходными фармацевтическими эффектами как народное средство, и затем обнаружили, что один из этих эффективных ингредиентов рога оленя C.N., моноацетилдиацилглицерин, демонстрирует значительную иммунную регуляторную активность in vivo. За счет его иммунных регуляторных эффектов рог оленя C.N. можно применять при лечении септического шока и как противораковое средство, не вызывающее токсичности in vivo. Авторы настоящего изобретения подтвердили, что моноацетилдиацилглицерол настоящего изобретения может быть применен как безопасное средство, усиливающее иммунитет, как иммуномодулирующее средство, как средство для лечения септического шока и как противораковое средство.
Раскрытие изобретения
Таким образом, целью настоящего изобретения является обеспечение иммуномодулирующего средства, средства для лечения септического шока, противоракового средства и здоровой пищи, содержащей производные моноацетилдиацилглицерина в качестве эффективного ингредиента. Здоровые продукты питания предназначены для модулирования иммунитета, предупреждения или лечения септического шока и рака.
Для достижения указанной выше цели настоящее изобретение обеспечивает иммуномодулирующее средство, содержащее в качестве эффективного ингредиента производные моноацетилдиацилглицерола, представленные ниже формулой (1):
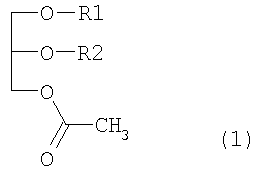
где R1/R2 является 9-октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
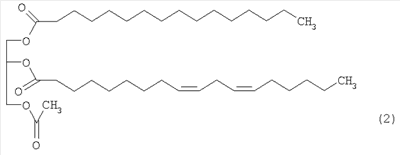
Предпочтительными являются указанные выше производные моноацетилдиацилглицерина, представленные ниже формулой (2):
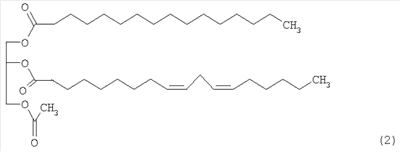
Настоящее изобретение также обеспечивает средство лечения СПИДа, сепсиса и противораковое средство, содержащее производные моноацетилдиацилглицерина с формулой 1 в качестве эффективного активного ингредиента. Настоящее изобретение, кроме того, обеспечивает продукты здорового питания, содержащие производные моноацетилдиацилглицерина с формулой 1 в качестве эффективного активного ингредиента для модуляции иммунитета или предупреждения рака.
Краткое описание чертежей
Фиг.1 представляет собой набор фотографий, демонстрирующих активность Т-клеток (Т-4 и Т-8) контрольной группы, группы, обработанной IL-2 (20 нг/мл), и группы, обработанной соединением 3 (1 мкг/мл). Каждое число указывает количество пятен, захвативших специфические антитела к IL-2.
Фиг.2 представляет собой график, показывающий высвобождение цитокинов после того, как Т-лимфоциты активируются соединением 3,
Контрольная группа: обработанная анти-CD3 и анти-CD28,
Экспериментальная группа: обработанная анти-CD3, анти-CD28 и соединением 3 (0,1 мкг/мл).
Фиг.3 представляет собой набор фотографий, демонстрирующих морфологию мышиных дендритных клеток, происходящих из мышиных клеток костного мозга, после обработки GM-CSF (20 нг/мл), IL-4 (20 нг/мл) и TNF- (5 нг/мл). (5 нг/мл).
А: микрофотография, сделанная сразу после инокуляции мышиных клеток костного мозга с плотностью 1×106 клеток/мл (×100).
В: микрофотография, демонстрирующая стволовые клетки костного мозга круглых костей через три дня культивирования. Эти клетки формировали кластер, который вырастал на дне лунки клеточного культурального планшета (×400).
С: микрофотография растущих зрелых дендритных клеток, которые формируют кластер на 6-й или 7-й день культивирования (×400), эта небольшая фотография представляет собой увеличенную фотографию индивидуальной клетки (×2).
D: микрофотография дендритных клеток, которые формируют специфические небольшие и длинные выпячивания на 9-й день культивирования (×1000), эта небольшая фотография представляет собой увеличенную фотографию индивидуальной клетки (×2).
Фиг.4 представляет собой набор фотографий, демонстрирующих результаты FACS, анализа экспрессии специфических маркеров дендритных клеток, специфических маркеров моноцитов и специфических маркеров гранулоцитов, на 11-й день культивирования клеток костного мозга, выделенных из мышей Balb/c AnN. (Здесь для установки линии маркеров (прямая линия) применяют окрашивание изомерного контроля с помощью IgG хомячка и IgG2a крысы.
Применяют следующие маркеры:
CD80 и CD86 как специфические маркеры костимуляции,
CD11 и DEC-205 как специфические маркеры дендритных клеток,
CD 14 и F4/80 как специфические маркеры моноцитов/макрофагов,
Gr-1 как специфический маркер гранулоцитов.
Фиг.5 представляет собой фотографию электрофоретического разделения, демонстрирующую эффекты соединения 3 на дендритные клетки и экспрессию адгезивных молекул.
| Дорожка 1: Vcam-1 |
Дорожка 2: Icam-1 |
Дорожка 3: Icam-2 |
| Дорожка 4: VLA-4 |
Дорожка 5: VLA-5 |
Дорожка 6: LFA-1 |
| Дорожка 7: GAPDH |
|
|
| (+): Группа, обработанная соединением 3 |
|
|
| (-): Контрольная группа |
|
|
Фиг.6 представляет собой набор фотографий, демонстрирующих результаты образования опухоли вблизи места инъекции, через 4 недели после внутривенной инъекции опухоли (KIGB-5) и обработки в следующих условиях.
А: Контрольная группа RPMI
В: Группа, обработанная BMSC
С: Группа, обработанная BMSC+Ad/ Е1. Е1.
Фиг.7 представляет собой набор фотографий, демонстрирующих результаты образования опухоли вблизи места инъекции, через 8 недель после внутривенной инъекции опухоли (KIGB-5) и обработки в следующих условиях.
А: Контрольная группа RPMI
В: Группа, обработанная BMSC (2,5×106 клеток/день)
С: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/ Е1 (50 MOI). Е1 (50 MOI).
D: Группа, обработанная дендритными клетками (5×106 клеток/день) + лизатом опухоли
F: Группа, обработанная соединением 3 (50 мг/кг/день)
Фиг.8 и 9 представляют собой набор фотографий, демонстрирующих значительное и микроскопическое обнаружение метастазных поражений легких в каждой группе, через 8 недель после внутривенной инъекции опухоли (KIGB-5).
На фиг.8
А: Контрольная группа RPMI
В: Группа, обработанная BMSC (2,5×106 клеток/день)
С: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/ Е1 (50 MOI). Е1 (50 MOI).
D: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/IL-2 (50 MOI).
На фиг.9
А: Контрольная группа RPMI
В: Группа, обработанная дендритными клетками (5×106 клеток/день) + лизатом опухоли
С: Группа, обработанная соединением 3 (25 мг/кг/день).
Фиг.10 представляет собой набор фотографий, демонстрирующих опухоли легких и их размеры в каждой группе, через 12 недель после внутривенной инъекции опухоли (KIGB-5).
А: Контрольная группа RPMI
В: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/ Е1 (50 MOI) Е1 (50 MOI)
С: Группа, обработанная BMSC (2,5×106 клеток/день)
D: Группа, обработанная DC (5×106 клеток/день) + лизатом опухоли
Е: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/IL-2 (50 MOI)
F: Группа, обработанная BMSC (2,5×106 клеток/день)+Ad/IL-2 (50 MOI)+соединением 3 (25 мг/кг/день)
G: Группа, обработанная соединением 3 (25 мг/кг/день).
Фиг.11 представляет собой набор фотографий, демонстрирующих обнаружение крупных метастазных поражений легких в каждой группе сирийских золотых хомячков, получавших различные дозировки соединения 3, через 8 недель после инъекции клеток билиарного рака (5×105 клеток).
А: Контрольная группа PBS
В: Группа, обработанная соединением 3 (10 мг/кг/день)
С: Группа, обработанная соединением 3 (25 мг/кг/день)
D: Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.12 представляет собой набор фотографий, демонстрирующих обнаружение микроскопических метастазных поражений легких в каждой группе сирийских золотых хомячков, получавших различные дозировки соединения 3, через 8 недель после инъекции клеток билиарного рака (5×105 клеток).
А: Контрольная группа PBS
В: Группа, обработанная соединением 3 (10 мг/кг/день)
С: Группа, обработанная соединением 3 (25 мг/кг/день)
D: Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.13 представляет собой набор фотографий, демонстрирующих обнаружение крупных метастазных поражений легких в каждой группе мышей С57В 1/6, получавших различное лечение, через 4 недели после внутривенной инъекции клеток меланомы (2×104 клеток).
А: Контрольная группа PBS
В: Группа, обработанная дендритными клетками (4×105 клеток/день) + лизатом опухоли
С: Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.14 представляет собой набор фотографий, демонстрирующих обнаружение микроскопических метастазных поражений легких в каждой группе мышей С57В 1/6, получавших различное лечение, через 4 недели после внутривенной инъекции клеток меланомы (2×104 клеток).
А: Контрольная группа PBS
В: Группа, обработанная дендритными клетками (4×105 клеток/день) + лизатом опухоли
С: Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.15 представляет собой график, демонстрирующий степень выживаемости клеток каждой группы, подвергавшейся воздействию в течение 6 недель после внутривенной инъекции клеток меланомы (2×104 клеток).
Контрольная группа RPMI
Группа, обработанная дендритными клетками (5×106 клеток/день) + лизатом опухоли
Группа, обработанная соединением 3 (50 мг/кг/день).
Фиг.16 представляет собой график, демонстрирующий цитотоксичность Т-лимфоцитов, активированных соединением 3, по отношению к клеткам меланомы.
Контроль 1: Группа, обработанная анти-CD3, анти-CD28
Контроль 2: Группа, обработанная анти-CD3, анти-CD28 и IL-2 (20 нг/мл)
Экспериментальная группа: Группа, обработанная анти-CD3, анти-CD28 и соединением 3 (1 мкг/мл).
Осуществление изобретения
Ниже настоящее изобретение описано в деталях.
Настоящее изобретение обеспечивает иммуномодулирующее средство, средство для лечения СПИДа, лечения сепсиса и противораковое средство, содержащее в качестве эффективного активного ингредиента производные моноацетилдиацилглицерина, представленные формулой 1. Соединение, представленное формулой 1, настоящего изобретения является одним из пяти следующих соединений:
1) 1-олеоил-2-2-пальмитоил-3-ацетилглицерин (R1/R2=9-октадеценоил/гексадеканоил, далее по тексту «соединение 1»)
2) 1-пальмитоил-2-олеоил-3-ацетилглицерин (R1/R2=гексадеканоил/9-октадеценоил, далее по тексту «соединение 2»)
3) 1-пальмитоил-2-линолеил-3-ацетилглицерин (R1/R2=гексадеканоил/9,12-октадекадиеноил, далее по тексту «соединение 3»)
4) 1-пальмитоил-2-линоленоил-3-ацетилглицерин (R1/R2=гексадеканоил/9,12,15-октадекатриеноил, далее по тексту «соединение 4»)
5) 1-пальмитоил-2-арахидоноил-3-ацетилглицерин (R1/R2=гексадеканоил/5,8,11,14-эйкозатетраеноил, далее по тексту «соединение 5»).
Любое из производных моноацетилдиацилглицерина, представленное формулой 1, доступно, и, в частности, предпочтительным является соединение 3. Соединение настоящего изобретения было экстрагировано из рогов оленей C.N. или произведено с помощью общепринятого метода органического синтеза. Типичный метод экстракции имеет следующие стадии. Более подробно, хлороформенные экстракты рогов оленя C.N. получают сначала экстракцией рогов оленя C.N. гексаном и затем экстракцией остатка после гексановой экстракции хлороформом. Количества гексана и хлороформа, применяемые в процессе экстракции, достаточно для того, чтобы пропитать олений рог. Обычно гексан и хлороформ применяются в соотношении примерно 4-5 л на 1 кг рогов оленя C.N. Хлороформенный экстракт рогов оленя C.N., полученный в результате такого процесса экстракции, фракционируют и очищают с помощью серии колоночных хроматографий на силикагеле и TLC (тонкослойной хроматографии). Элюент для последовательных стадий экстракции отбирают из смеси хлороформ/метанол, гексан/этилацетат. Чтобы синтезировать производные моноацетилдиацилглицерина химическим путем, например, 1-пальмитоилглицерин отделяют от обоих продуктов реакции, глицерина и пальмитиновой кислоты. Целевой моноацетилдиацилглицерин можно синтезировать путем этерификации 1-пальмитоилглицерина соединениями карбоновой кислоты, такой как уксусная кислота и линолевая кислота, и при необходимости очистить. Другой способ синтеза производных моноацетилдиацилглицерина представляет собой ацетолиз фосфатидилхолина.
Моноацетилдиацилглицериновое соединение в соответствии с настоящим изобретением представляет собой иммуномодулирующее средство. Модуляция иммунитета включает усиление аномально нарушенного иммунитета или поддержание баланса аномально повышенного иммунитета. Следовательно, моноацетилдиацилглицериновые соединения в соответствии с настоящим изобретением обладают эффектами не только на предупреждение и лечение различных заболеваний, но также на подавление, предупреждение и лечение аутоиммунных заболеваний, таких как артрит, атопия, слабоумие и сепсис, возникающие в результате аутоиммунных реакций.
В регулировании иммунной функции важно не увеличение числа Т-клеток, которые отвечают за иммунитет, а продолжительность активации Т-клеток, соотношение Т4- и Т8-клеток. Авторы настоящего изобретения обрабатывали Т4- и Т8-лимфоциты производными моноацетилдиацилглицерина для исследования иммуномодулирующего эффекта производных моноацетилдиацилглицерина изобретения. В результате было подтверждено, что в этих клетках повышалась секреция IL-2, одного из цитокинов (см. фиг.1). После обработки клеток соединением 3 настоящего изобретения с помощью Bio-plex, который способен одновременно измерять огромное количество цитокинов, исследовали секрецию цитокина в Т-клетках. В результате секреция IL-2, IL-4 и IL-5 была значительно выше в группе, обработанной соединением 3, чем в контрольной группе (см. фиг.2). Увеличившийся в наибольшем количестве цитокин IL-4 представляет собой полифункциональный цитокин, называемый противовоспалительным цитокином, который секретируется из Th2, которые дифференцировались из Т4-клеток. Из-за подавления дифференциации Т4 в Th1 IL-4 может подавлять повреждение клеток, возникающее в результате аутоиммунной реакции, выполняя важную роль для противоракового эффекта и регулирования иммунного ответа (Annu. Rev. Immunol. 1999. 17:701-738). Соединения настоящего изобретения влияют как на повышение иммунитета с помощью стимуляции секреции IL-2, так и на модуляцию иммунитета с помощью стимуляции секреции IL-4. Соединения настоящего изобретения также могут поддерживать соотношение Т4 и Т8 в норме с помощью усиления и активации не только Т4, но также и Т8, которые являются цитотоксичными иммунными клетками. Поэтому изобретение эффективно для лечения побочных эффектов и заболеваний, возникающих из-за аномального усиления или подавления иммунной системы. В модели септического шока эти эффекты усиления иммунитета могут работать в направлении стимуляции секреции IL-4 и ингибирования апоптоза. В результате уровень смертности от сепсиса значительно снижается. Следовательно, производные моноацетилдиацилглицерина в соответствии с настоящим изобретением полезны для лечения аутоиммунных заболеваний, например, для предупреждения и лечения сепсиса, так как эти соединения повышают секрецию IL-4.
Было известно, что взаимодействие между клетками стимулирует различные кроветворные клетки и иммунные клетки, и особенно важно для иммунной системы взаимодействие между дендритными клетками. Авторы настоящего изобретения исследовали эффект производных моноацетилдиацилглицерина на взаимодействие между выделенными и индуцированными дендритными клетками и TCR (рецептор Т-клеток). В исследовании проводили ПЦР-анализ в режиме реального времени DC (дендритных клеток), обработанных соединением 3, чтобы измерить экспрессию адгезивных молекул-посредников взаимодействия между DC и TCR. В результате по сравнению с контролем повышалась экспрессия адгезивных молекул, таких как Vcam-1, Icam-1, Icam-2, VLA-4, VLA-5 и LFA-1 (см. фиг.5). Приведенные выше результаты подтвердили, что производные моноацетилдиацилглицерина в соответствии с настоящим изобретением обладают эффектом не только на активацию Т-клеток, но также специфическим противораковым эффектом через активацию дендритных клеток, которые дают возможность Т-клетке узнавать антиген раковых клеток.
Приведенные выше результаты подтвердили, что производные моноацетилдиацилглицерина в соответствии с настоящим изобретением обладают эффектом усиления иммунитета с помощью повышения секреции цитокинов через активацию Т-клеток и с помощью активации пролиферации и стимуляции кроветворных клеток и иммунных клеток через повышение экспрессии внутриклеточных адгезивных молекул. В результате было подтверждено, что эти соединения имеют возможность применения в качестве иммунотерапии при различных заболеваниях. Например, производные моноацетилдиацилглицерина в соответствии с настоящим изобретением могут применяться для лечения или в качестве здоровой пищи для усиления иммунитета у пациентов, больных СПИДом, через пролиферативный эффект Т4- и Т8-клеток. На ранней стадии болезни пациентов со СПИДом снижался уровень Т4, но серьезной вспышки заболевания не происходило. С другой стороны, на последней фазе заболевания СПИДом у пациентов снижался уровень Т8 и происходила вспышка заболевания. Следовательно, соотношение Т4 и Т8 является важным фактором, и абсолютное количество Т4 и Т8 также является важным фактором. Кроме того, авторы настоящего изобретения подтвердили, что при различных аутоиммунных заболеваниях эффективна модуляция иммунной функции с помощью повышения секреции IL-4. Чтобы исследовать возможность применения соединений в соответствии с настоящим изобретением для предупреждения и лечения септического шока, проводили CLP-тест (цекальная лигатура и пункция) на мышах. В результате все протестированные мыши выжили до 120 часов. Следовательно, это подтверждает, что производные моноацетилдиацилглицерина в соответствии с настоящим изобретением были эффективны для предупреждения и лечения сепсиса. Приведенные выше результаты подтвердили, что производные моноацетилдиацилглицерина в соответствии с настоящим изобретением были полезны в качестве идеального иммуномодулирующего средства, вызывающего как повышение иммунитета, так и регулирующего иммунную функцию.
Кроме того, чтобы исследовать возможность применения соединений в соответствии с настоящим изобретением для предупреждения и лечения рака, авторы настоящего изобретения исследовали противораковый эффект соединений против билиарного рака и злокачественной меланомы, которые, как известно, относятся к неизлечимым формам рака. Во-первых, авторы настоящего изобретения индуцировали рак у хомячка внутривенной или подкожной инъекцией KIBG-5, клеточной линии билиарного рака. Затем хомячку вводили RPMI, BMSC, аденовирус/ Е1, дендритные клетки + лизат опухоли, соединение 3, аденорирус/IL-2 и смеси. Наблюдение за результатом проводили через 4 недели. В результате при наблюдении невооруженным глазом или с помощью микроскопа в группах, подвергнутых воздействию дендритных клеток + лизата опухоли, соединения 3 и аденорируса/IL-2, не происходило образование опухоли (см. фиг.6), Кроме того, опухолевые клетки вводили внутривенно и наблюдения проводили через 8 недель. В результате образовывались метастазные поражения легких во всех группах, за исключением группы, которой вводили BMSC + аденовирус/IL-2. По результатам биопсии только незначительное поражение было обнаружено в группе, которой вводили дендритные клетки + лизат опухоли, и в группе, которой вводили соединение 3 (см. фиг.7, фиг.8 и фиг.9). И далее, опухолевые клетки вводили подкожно и наблюдение проводили через 12 недель. В результате опухоль возникала во всех группах, за исключением группы, которой вводили BMSC + аденовирус/hIL-2, и группы, которой вводили BMSC+Ad/hIL-2 + соединение 3 (см. фиг.10). Образование опухоли тормозилось соединением 3 дозо-зависимым способом (см. фиг.11 и 12). Как было объяснено выше, авторы настоящего изобретения индуцировали метастазирующий рак у хомячка с помощью инъекции клеток билиарного рака (KIBG) и затем хомячка подвергали воздействию производных моноацетилдиацилглицерина настоящего изобретения. В результате было подтверждено, что развитие рака значительно ингибировалось в результате воздействия соединений настоящего изобретения. Е1, дендритные клетки + лизат опухоли, соединение 3, аденорирус/IL-2 и смеси. Наблюдение за результатом проводили через 4 недели. В результате при наблюдении невооруженным глазом или с помощью микроскопа в группах, подвергнутых воздействию дендритных клеток + лизата опухоли, соединения 3 и аденорируса/IL-2, не происходило образование опухоли (см. фиг.6), Кроме того, опухолевые клетки вводили внутривенно и наблюдения проводили через 8 недель. В результате образовывались метастазные поражения легких во всех группах, за исключением группы, которой вводили BMSC + аденовирус/IL-2. По результатам биопсии только незначительное поражение было обнаружено в группе, которой вводили дендритные клетки + лизат опухоли, и в группе, которой вводили соединение 3 (см. фиг.7, фиг.8 и фиг.9). И далее, опухолевые клетки вводили подкожно и наблюдение проводили через 12 недель. В результате опухоль возникала во всех группах, за исключением группы, которой вводили BMSC + аденовирус/hIL-2, и группы, которой вводили BMSC+Ad/hIL-2 + соединение 3 (см. фиг.10). Образование опухоли тормозилось соединением 3 дозо-зависимым способом (см. фиг.11 и 12). Как было объяснено выше, авторы настоящего изобретения индуцировали метастазирующий рак у хомячка с помощью инъекции клеток билиарного рака (KIBG) и затем хомячка подвергали воздействию производных моноацетилдиацилглицерина настоящего изобретения. В результате было подтверждено, что развитие рака значительно ингибировалось в результате воздействия соединений настоящего изобретения.
Проводили внутривенную инъекцию клеток злокачественной меланомы в хвост мышей, чтобы вызвать там рак. Затем вводили RPMI, дендритные клетки (DC), лизат опухоли и соединение 3 индивидуально или в виде смеси. В результате в контрольной группе, которой вводили RPMI, образовывались метастазные поражения легких, но в группах, которым вводили соединение 3 и дендритные клетки + лизат опухоли, поражений обнаружено не было (см. фиг.13 и 14). Кроме того, в течение 6 недель после инъекции опухоли проводили наблюдение за группами, которым вводили соединение 3 и дендритные клетки + лизат опухоли, что привело к 90%-ному уровню выживаемости (см. фиг.15). На основании результатов, приведенных выше, авторы настоящего изобретения подтвердили, что соединение 3 активирует Т-клетки (Т4 и 8), что указывает на то, что соединение 3 обладает противораковым эффектом. Поэтому авторы настоящего изобретения провели цитотоксический тест Т-клеток, активированных соединением 3, по отношению к злокачественной меланоме in vitro. В результате цитотоксичность значительно увеличивалась, если Т-клетки обрабатывали соединением 3, по сравнению с Т-клетками, не обработанными соединением 3, и также цитотоксичность увеличивалась с увеличением количества Т-клеток (см. фиг.16). Как объяснялось ранее, было подтверждено, что производные моноацетилдиацилглицерина настоящего изобретения ингибируют развитие рака и демонстрируют цитотоксичность в отношении раковых клеток, возникающую в результате активации Т-клеток, указывающую на то, что соединения настоящего изобретения могут эффективно применяться в качестве противоракового средства.
Лечение с помощью продукта настоящего изобретения в качестве противоракового средства, по-видимому, является многообещающим в случае рака желчных протоков, рака почек и меланомы, но другие формы злокачественных заболеваний также перспективны в качестве мишеней.
Автор настоящего изобретения в настоящий момент получил опытные капсулы и таблетки, содержащие производные моноацетилдиацилглицерина в качестве эффективного активного ингредиента. Иммуномодулирующее средство, средство лечения СПИДа, сепсиса и противораковое средство настоящего изобретения предпочтительно включают производные моноацетилдиацилглицерина в количестве от 20 до 100 вес.% от общего веса средства, более предпочтительно от 30 до 100 вес.%. Если количество моноацетилдиацилглицеринов слишком велико или слишком мало, в действительности трудно принимать лекарственное средство и от этого нет никакой пользы. Также предпочтительно принимать средство для лечения сепсиса, противораковое средство и иммуномодулирующее средство принимать перорально от одного до трех раз в день или от одного до четырех раз в день в дозировке 50 мг/кг. Композиции (средства) в соответствии с настоящим изобретением могут дополнительно включать один или несколько фармацевтически приемлемых носителей, в дополнение к эффективному ингредиенту их вводят в состав фармацевтической формы. Носитель может быть выбран из группы, состоящей из солевого раствора, забуференного солевого раствора, воды, глицерина и этанола, но выбор не ограничен этими соединениями. Пригодна любая фармацевтически приемлемая композиция, известная в этой области техники (Remingtons Pharmaceutical Science (the latest edition). Mack Publishing Company, Easton PA). Композицию настоящего изобретения можно принимать внутрь перорально и применять в общепринятых формах фармацевтических композиций. Композицию настоящего изобретения можно получить для перорального приема путем смешивания с общепринятыми наполнителями, сухими разбавителями, связующими веществами, смачивающими веществами, дезинтегрирующими веществами, разбавителями, такими как поверхностно-активное вещество или эксипиент. Эффективную дозировку композиции настоящего изобретения можно определить в зависимости от возраста, пола, состояния здоровья, поглощения эффективного ингредиента, скорости инактивации, экскреции и совместного применения других лекарственных средств. Например, дозировка для перорального введения может быть от 0,24 до 9,0 г в день, но не ограничиваться только этими значениями. Настоящее изобретение также включает фармацевтические композиции в дозировочных единицах. Это означает, что композиции присутствуют в виде индивидуальных форм, например таблеток, таблеток, покрытых оболочкой, капсул, пилюль, суппозиториев и ампул, содержание активного соединения в которых соответствует части или нескольким индивидуальным дозам. Дозировочные единицы могут содержать, например, 1, 2, 3 или 4 индивидуальные дозировки или 1/2, 1/3 или 1/4 часть индивидуальной дозировки. Индивидуальная дозировка содержит количество активного соединения, которое вводят в один прием и которое обычно соответствует целой, 1/2, 1/3 или 1/4 дневной дозировки. Твердые композиции для перорального введения представляют собой таблетки, пилюли, порошки и капсулы, жидкие композиции для перорального применения представляют собой суспензии, растворы, эмульсии и сиропы, и указанные выше композиции в дополнение к обычно используемым простым растворителям, таким как вода и жидкий парафин, могут содержать различные эксипиенты, такие как увлажняющие средства, подсластители, ароматизаторы и консерванты. Соединения настоящего изобретения могут применяться не только в составе композиций для перорального употребления, но также в виде композиций для инъекций. Например, водную или масляную суспензию для стерильной инъекции можно получить в соответствии с известным методом с помощью диспергирующих средств, увлажняющих средств или эмульсий. Любой фармацевтически приемлемый растворитель включает воду, раствор Рингера или изотонический раствор NaCl. Стерильное усваивающееся масло применяют в качестве растворителя или диспергирующей среды, и может включать нераздражающее усваивающееся масло, включающее моноглицерид, диглицерид и полипропиленгликоль, и жирную кислоту, такую как олеиновую кислоту.
Настоящее изобретение также обеспечивает иммуномодулирующую и противораковую здоровую пищу, содержащую производные моноацетилдиацилглицерина в качестве эффективных ингредиентов. В настоящем изобретении «здоровая пища» включает продукт питания, пищевую и целебную добавку для лечения или предупреждения различных заболеваний и поддержания баланса функций организма. Здоровая пища, полученная по настоящему изобретению, содержит моноацетилдиацилглицерины в количестве от 0,02 до 100 вес.%. В случае применения соединений настоящего изобретения в качестве здоровой пищи с соединением по изобретению можно применять в соответствии с общепринятым методом, например, используя исходные соединения или используя смеси соединений с другими продуктами питания или пищевыми ингредиентами. Эффективное количество смеси соединений зависит от целей их применения (предупреждение, здоровье или терапевтическое лечение). В случае применения для предупреждения нарушения предпочтительное количество производных моноацетилдиацилглицерина составляет от 0,02 до 2 вес.% от общего количества продукта здоровой пищи, предпочтительно от 0,2 до 0,6 вес.%. Если количество моноацетилдиацилглицеринов слишком велико или слишком мало, то получить здоровую пищу затруднительно и она неэффективна. Эффективный ингредиент также является безопасным при долговременном введении, имеющем цель контроля или защиты здоровья, что подтверждено цитотоксическим тестом. Без всяких ограничений можно приготовить любые виды пищи, содержащие композицию настоящего изобретения. Например, мясная колбаса, хлеб, супы, напитки, чай, алкогольные напитки и витаминный комплекс представляют собой продукты питания, которые изготавливают в качестве здоровой пищи, содержащей композицию настоящего изобретения. В случае если здоровую пищу применяют в качестве пищевых или целебных добавок для лечения или предупреждения заболевания, предпочтительное количество производных моноацетилдиацилглицерина составляет от 20 до 100 вес.% от общего количества здоровой пищи, предпочтительно от 30 до 100 вес.%, более предпочтительно от 35 до 95 вес.%. Потребление может составлять от 0,18 до 9,0 г в день, но не ограничивается только этими количествами. Композиции включают таблетки и капсулы.
Как было объяснено ранее, производные моноацетилдиацилглицерина настоящего изобретения активируют Т-клетки, способствуя секреции цитокинов, повышают секрецию адгезивных молекул между клетками для стимуляции кроветворных клеток и иммунных клеток для того, чтобы не только улучшить иммунитет, но также предотвратить и вылечить аутоиммунные заболевания и рак.
Далее для более ясного понимания настоящего изобретения будут представлены предпочтительные экспериментальные примеры. Однако настоящее изобретение не ограничивается экспериментальными примерами, представленными ниже.
ПРИМЕРЫ
Экспериментальный пример 1. Влияние производных моноацетилдиацилглицерина на пролиферацию Т-клеток и моноядерных клеток.
Экспериментальный пример 1-1. Влияние производных моноацетилдиацилглицерина на пролиферацию Т-клеток
Спленоциты получали из селезенки мышей линии C57BL/6 (предоставлены Asan Institute for Life Sciences Animal Lab., Seoul, Korea). Затем суспензии единичных клеток получали с помощью повторной аспирации и промывания. Эритроциты удаляли, используя клорид аммония, и затем пропускали через нейлоновую вату для удаления обломков и агрегатов. Т-клетки очищали с помощью магнитных шариков (MACS bead, Miltenyi Biotec, bergich gladbach, Germany), содержащих антитела к козьим IgG (MACS bead, Miltenyi Biotec, bergich gladbach, Germany) или антитела к мышиному CD8 (MACS bead, Miltenyi Biotec, bergich gladbach, Germany) (Turner and Dockrell (1996) Immunology, 87:339-342).
Суспензию Т-клеток суспендировали в среде Дюльбекко в модификации Искова (IMDM, Gibco, Grand Island, NY) с добавлением 10%-ной фетальной бычьей сыворотки (далее везде “FBS”) (Gibco, Grand Island, NY). Жизнеспособные клетки в количестве 5×104 штук на лунку культивировали в 96-луночном планшете с 1 мкг/мл соединения 1, соединения 2, соединения 4 и соединения 5, 0,01, 0,1, 1 мкг/мл соединения 3 (синтезированного и предоставленного Department of Chemistry, Ewha Womans University, Seoul, Korea) или 20 нг/мл IL-2. На 6-й день клетки инкубировали с 1 мкКи 3H-тимидина/лунку в течение 24 час. На 7-й день клетки собирали и рассчитывали индекс включения (далее везде “SI”) с помощью математической формулы 1, приведенной ниже.
Математическая формула 1
SI=3H-тимидин, адсорбированный в лунках экспериментальной группы (СРМ в образце)/3H-тимидин, адсорбированный в лунках контрольной группы (СРМ в контроле).
В результате в группе, обработанной производными моноацетилдиацилглицерина, был повышенный SI Т-клеток с поглощением тимидина 2,05, который был сходен с индексом группы, обработанной IL-2 (табл.1).
| Таблица 1 |
| Экспериментальная группа |
SI |
| IL-2 (20 нг/мл)* |
2,05±0,24 |
| соединение 1 (1 мкг/мл)* |
2,01±0,43 |
| соединение 2 (1 мкг/мл)* |
2,03±0,54 |
| соединение 3 (0,01 мкг/мл)** |
1,83±0,32 |
| соединение 3 (0,1 мкг/мл)* |
1,96±0,18 |
| соединение 3 (1 мкг/мл)* |
2,05±0,64 |
| соединение 4 (1 мкг/мл)* |
1,98±0,26 |
| соединение 5 (1 мкг/мл)* |
2,02±0,38 |
| *Р<0,05, **Р<0,005. Каждый тест проводили в трех повторах и повторяли три раза. |
Экспериментальный пример 1-2. Влияние производных моноацетилдиацилглицерина на пролиферацию моноцитов
Моноциты получали из цельной крови человека, используя Histopaque 1077. И затем моноциты в количестве 5×106 клеток/мл оставляли на 3 часа в СО2-инкубаторе (5% CO2) для связывания с флаконом для тканевых культур. Через 3 часа несвязавшиеся клетки удаляли, а связавшиеся клетки помещали в 96-луночные планшеты в среду RPMI 1640 (Gibco, Grand Island, NY) с добавлением 10% FBS. Жизнеспособные клетки в количестве 5×104 штук/лунку культивировали в 96-луночных планшетах с 1 мкг/мл соединений 1-5. На 6-й день клетки инкубировали с 1 мкКи 3H-тимидина/лунку в течение 24 час. На 7-й день клетки собирали и измеряли включение 3H-тимидина. С помощью указанной выше математической формулы 1 рассчитывали SI. В результате группа, обработанная соединениями 1-5, имела повышенный по сравнению с контрольной группой SI моноцитов, равный 10,68 и указывающий на то, что соединения стимулировали пролиферацию моноцитов (табл.2).
| Таблица 2 |
| Группа, подвергнутая обработке |
SI(±S.E.) |
| Контрольная группа, не подвергнутая обработке |
1 |
| соединение 1 (1 мкг/мл)* |
9,97±0,10 |
| соединение 2 (1 мкг/мл)* |
10,42±0,15 |
| соединение 3 (1 мкг/мл)* |
10,68±0,13 |
| соединение 4 (1 мкг/мл)* |
10,21±0,18 |
| соединение 5 (1 мкг/мл)* |
9,75±0,09 |
| *Р<0,001. Каждый тест проводили в трех повторах и повторяли три раза. |
Экспериментальный пример 2. Влияние соединения 3 на активность Т-клеток
Экспериментальный пример 2-1. Измерение цитокина с помощью Elispot
Elispot bioassay (иммуноферментный анализ ESAT-6) является очень чувствительным количественным анализом для измерения цитокина, связанного с мембраной, так как дно каждой лунки планшетов Elispot, используемых в этом анализе, было покрыто специфическими антителами к цитокину. Таким образом, для измерения активности Т-клеток проводили анализ Elispot. Т-клетки в количестве 2×106 клеток на каждую лунку засевали в стерильный 24-луночный планшет для тканевых культур (Nunc, Denmark) с последующей обработкой различными концентрациями соединения 3 (0,01, 0,1, 1 мкг/мл) или IL-2 (20 нг/мл). На 7-й день клетки собирали, затем клетки сеяли в количестве 5×105 штук на мультитестовый планшет (Elispot system kit, AID, Straberg, Germany), покрытый соответствующим первичным антителом (мышиный IL-2). После того как планшет инкубировали в течение 24 час в CO2-инкубаторе (5% СО2), происходила секреция цитокинов клетками, которые захватывались первичными антителами (мышиный IL-2), определяемыми с помощью коммерческих наборов фирмы Elispot “mouse IL-2 Elispot kits” в соответствии с инструкцией фирмы-производителя. Каждый образец анализировали в двойных повторах. Подсчет клеток, продуцирующих IL-2, с помощью набора Elispot проводили на ридере Elispot (AID Elispot Reader System). Результаты показали, что группа, обработанная соединением 3, демонстрировала увеличение активности Т4 в 1,52 раза по сравнению с контрольной группой и увеличение активности Т8 в 1,46 раза (фиг.1).
Экспериментальный пример 2-2. Измерение цитокина с помощью Bio-plex
Bio-plex способен одновременно измерять огромное количество цитокина в лунке. Поэтому, для того чтобы количественно оценить 8 типов цитокинов Th1/Th2-каналов, которые секретируются при активации Т-клеток, применяли набор Bio-plex. Стерильные 24-луночные планшеты для тканевых культур (Nunc, Denmark) обрабатывали анти-CD3 и анти-CD28. Затем планшеты инокулировали Т-клетками в количестве 2×106 клеток/мл. Чтобы активировать Т-клетки, туда же вносили 0,1, 1 мкг/мл соединения 3 и затем культивировали в течение 5 дней. На 5-й день получали культуральные растворы на различных стадиях и затем центрифугировали. Полученные супернатанты и цитокин, секретированный в них, количественно оценивали с помощью набора Bio-plex в соответствии с инструкцией фирмы-производителя (Bio-rad). В результате в группе, получавшей соединением 3, секретировались три типа цитокинов (IL-2, IL-4 и IL-5) из 8 типов цитокинов (IL-2, IL-4, IL-5, IL-10, IL-12, INF- , GM-CSF, TNF- , GM-CSF, TNF- ), и их количество было выше, чем в контрольной группе, не обработанной соединением 3 (фиг.2). ), и их количество было выше, чем в контрольной группе, не обработанной соединением 3 (фиг.2).
Экспериментальный пример 3. Анализ пролиферации Т-клеток
Чтобы подтвердить влияние соединения 3 на иммуноциты пациентов со СПИДом, проводили следующий эксперимент. Сначала с помощью Hisopaque 1077 из периферической крови пациентов со СПИДом получали одноядерные клетки человека. Эритроциты удаляли с помощью хлорида аммония и затем пропускали через нейлоновую вату для удаления обломков и агрегатов. Т-клетки очищали с помощью магнитных шариков (антитело к CD3 человека) (MACS bead, Miltenyi Biotec, bergich gladbach, Germany). Суспензии Т-клеток суспендировали в среде Дюльбекко в модификации Искова (IMDM, Gibco, Grand Island, NY) с добавлением 10%-ной фетальной бычьей сыворотки (далее везде “FBS”) (Gibco, Grand Island, NY). Жизнеспособные клетки в количестве 5×104 на лунку (в трех повторах) культивировали в 96-луночном планшете с 0,01, 0,1, 1 мкг/мл соединения 3 или IL-2 (20 нг/мл). На 6-й день клетки инкубировали с 1 мкКи 3H-тимидина/лунку в течение 24 час. На 7-й день клетки собирали и измеряли включение 3H-тимидина. Индекс стимуляции SI (Stimulation Index) рассчитывали с помощью указанной выше математической формулы 1. В результате у пациентов со СПИДом анализ пролиферации Т-клеток показал, что в группе, обработанной соединением 3, индекс стимуляции Т-клеток, измеренный с помощью включения тимидина, увеличился от 1,5 до 3,9 раза у всех пациентов (четыре из четырех) по сравнению с контролем, как видно из табл.3. В целом результат стимуляции соединением 3 был сравним со стимуляцией с помощью IL-2.
| Таблица 3 |
| |
Индекс стимуляции (SI) |
| 1 |
2 |
3 |
4 |
| IL-2 (20 нг/мл) |
1,41 |
4,17 |
1,29 |
6,54 |
| соединение 3 (1 мкг/мл) |
2,23 |
3,87 |
1,48 |
3,49 |
Экспериментальный пример 4. Влияние соединения 3 на экспрессию адгезивных молекул дендритных клеток
Экспериментальный пример 4-1. Культура дендритных клеток
Клетки костного мозга получали из бедра и большой берцовой кости мышей Balb/c AnN (Park, J. Et al. (2003) J. Korean Med. Sci., 18: 372-380). Клетки промывали три раза в RPMI и затем получали одноядерные клетки. Эти одноядерные клетки оставляли для связывания с флаконом для тканевых культур на 3 часа в RPMI и 10%-ной FBS. После инкубации прикрепившиеся клетки (моноциты) удаляли, а неприкрепившиеся клетки помещали в 100 миллиметровые чашки для тканевых культур в концентрации 1×105 клеток/мл в среде RPMI плюс 10%-ная FBS, дополненной 20 нг/мл мышиного rGM-CSF (R&D systems, Minneapolis, MN, USA), 10 нг/мл мышиного IL-4 (R&D systems) и 2,5 нг/мл мышиного TNF- (R&D systems). Культуральные чашки подпитывали каждые 3 дня. На 6-й день культивирования добавляли мышиный TNF- (R&D systems). Культуральные чашки подпитывали каждые 3 дня. На 6-й день культивирования добавляли мышиный TNF- (R&D systems). После этого мышиный TNF- (R&D systems). После этого мышиный TNF- (R&D systems) добавляли каждые 3 дня до 11-го дня. Созревшие дендритные клетки собирали для ПЦР-анализа в режиме реального времени для исследования адгезивных молекул. В результате, если круглые гранулоциты культивировали в течение трех дней, эти клетки формировали кластер, который рос на дне лунки планшета для клеточных культур, а созревшие дендритные клетки росли, образуя группу на 6-й или 7-й день культивирования. А на 9-й день культивирования, в частности, дендритные клетки формировали небольшие, но длинные выпячивания (фиг.3). (R&D systems) добавляли каждые 3 дня до 11-го дня. Созревшие дендритные клетки собирали для ПЦР-анализа в режиме реального времени для исследования адгезивных молекул. В результате, если круглые гранулоциты культивировали в течение трех дней, эти клетки формировали кластер, который рос на дне лунки планшета для клеточных культур, а созревшие дендритные клетки росли, образуя группу на 6-й или 7-й день культивирования. А на 9-й день культивирования, в частности, дендритные клетки формировали небольшие, но длинные выпячивания (фиг.3).
Экспериментальный пример 4-2. Определение фенотипа дендритных клеток
Подсчитывали те клетки, которые имели большие размеры и не окрашивались Трипановым синим, и исследовали морфологию каждой клетки. Клетки в количестве 1×106 клеток/мл культивировали и затем промывали, а затем фиксировали с помощью 1%-ного раствора параформальдегида. Проводили проточный цитометрический анализ фиксированных клеток с помощью FACScan (Beckton Dickinson, Mountain View, CA, U.S.A.), дающий определение фенотипа с помощью антител к следующим маркерам; изотипический контроль к IgG хомячка, крысиный IgG 2a, маркер DC: DEC 205(NLDC-145) и CD11C, молекула костимуляции/адгезии: CD 80(B7-1) и CD 86(B7-2), маркер макрофагов: CD14 и F4/80, маркер гранулоцитов: Gr-1 (Pharmingen, Hamburg, Germany). В результате уровни специфических молекулярных маркеров костимуляции CD80 и С86 и специфических маркеров дендритных клеток CD11С и DEC-205 были высокими. В противоположность этому уровни специфических маркеров моноцитов CD14 и F4/89 и специфического маркера гранулоцитов Gr-1 были понижены. Результат указывает на то, что выделенные в настоящем изобретении дендритные клетки имеют точный фенотип дендритных клеток и их чистота составляет 97-98% (фиг.4).
Экспериментальный пример 4-3. Обработка и экспрессия адгезивных молекул
Общеизвестно, что в стимуляцию различных кроветворных клеток и иммунных клеток вовлечены межклеточные взаимодействия. Поэтому авторы настоящего изобретения попытались подтвердить, влияет или нет соединение 3 на различные адгезивные молекулы указанных клеток. В частности, дендритные клетки, культивированные в примере, упомянутом выше, обрабатывали 1 мкг/мл соединения 3, а затем проводили ПЦР-анализ в режиме реального времени.
Для ПЦР-анализа в режиме реального времени применяли следующие праймеры: Icam-1 (SEQ. ID. No1 и No2), Icam-2 (SEQ. ID. No3 и No4), Vcam-1 (SEQ. ID. No5 и No6), VLA-4 (SEQ. ID. No7 и No8), VLA-5 (SEQ. ID. No9 и No10), LFA-1 (SEQ. ID. No11 и No12) и GAPDH (SEQ. ID. No13 и No14). Реакционные наборы, применяемые здесь, представляли собой смешанный раствор 2 мкл ДНК, 10-кратного буферного раствора, 1,5 мкл MgCl2, 2 мкл dNTPs, 0,5 мкл прямого праймера, 0,5 мл обратного праймера, 0,2 мкл полимеразы и 15,8 мкл дистиллированной воды.
Суммарную РНК, полученную из дендритных клеток и MS-5, клеток низкой плотности, культивированных с олиго(А)-праймером, обратно транскрибировали и проводили ПЦР-анализ при 94°С в течение 30 с, при 65°С в течение 30 с и при 72°С в течение 50 с. ПЦР-анализ проводили в итоге 34 раза, и количество ПЦР-продуктов каждый сеанс удваивалось. Экспрессию адгезивных молекул, таких как Vcam-1, Icam-1, Icam-2, VLA-4, VLA-5 и LFA-1, подтверждали с помощью ПЦР-анализа в режиме реального времени. Для количественной оценки проводили ПЦР-анализ GAPDH для подтверждения соответствующей кДНК. Результаты показали, что экспрессия адгезивных молекул, Icam-2, VLA-5, LFA-1 на дендритных клетках, обработанных соединением 3, значительно увеличивалась по сравнению с контролем (фиг.5).
Экспериментальный пример 5. Изучение противоракового эффекта соединения 3 с помощью подкожной инъекции (местная модель) и внутривенной инъекции (системная модель)
Экспериментальный пример 5-1. Модель билиарного рака у хомячков
Шестинедельные самки сирийского золотого хомячка (Harian, Indianapolis, India, USA) содержались в специальном блоке, свободном от патогена. Клетки KJBG-5 (5×105 штук) (Molecular therapy. Vol.3, No.4, pp431-437), суспендированные в 100 мкл среды RPMI 1640, не содержавшей сыворотки, вводили внутривенно через бедренную вену. И также клетки KJBG-5 (5×105 штук), суспендированные в 100 мкл среды RPMI 1640, не содержавшей сыворотки, вводили подкожно в бок хомячков. Хомячков, инъецированных KIBG-5, делили на следующие 7 групп;
1) Контрольная группа, обработанная средой RPMI,
2) Экспериментальная группа, обработанная немодифицированными клетками BMSC (2,5×106) (Leukemia & Lymphoma, Vol.44, No.11, pp 1973-1978),
3) Экспериментальная группа, обработанная клетками BMSC, модифицированными Ad/ Е1 50 MOI ((Leukemia&Lymphoma, Vol.44, No.11, pp 1973-1978), Е1 50 MOI ((Leukemia&Lymphoma, Vol.44, No.11, pp 1973-1978),
4) Экспериментальная группа, обработанная DC + лизатом опухоли (5×106),
5) Экспериментальная группа, обработанная клетками BMCS, модифицированными Ad/hIL-2 50 MOI (Leukemia&Lymphoma, Vol.44, No.11, pp 1973-1978),
6) Экспериментальная группа, обработанная клетками BMCS, модифицированными Ad/hIL-2 50 MOI + экспериментальная группа, обработанная соединением 3 (25 мг/кг/день),
7) Экспериментальная группа, обработанная соединением 3 (25 мг/кг/день).
Через одну неделю после инъекции раковых клеток (группа, обработанная BMSC), каждому хомячку вновь вводили 2,5×106 клеток BMSC. В группе, обработанной DC + лизатом опухоли, каждому хомячку вводили 5×106 клеток DC и лизат опухоли (с помощью подкожной инъекции или внутривенной инъекции) на первой, второй, третьей, четвертой, шестой, восьмой неделе с последующим наблюдением в течение 12 недель. В группе, обработанной соединением 3, за одну неделю до инъекции KIBG-5-клеток давали соединением 3 (25 мг/кг/день) с помощью перорального введения, которое продолжалось 2 недели с однонедельным перерывом в течение восьми недель.
В результате через 4 недели после инъекции раковых клеток опухоль образовалась в группе, обработанной RPMI, которая была контролем для группы, обработанной BMSC, и в группе, обработанной BMSC Ad/ E1, но опухоли не было обнаружено в группе, обработанной DC + лизатом опухоли, в группе, обработанной соединением 3, и в группе, обработанной BMSC+Ad/IL-2 (фиг.6). Более того, через 8 недель после инъекции раковых клеток множественные метастазные поражения легких были обнаружены в группе, обработанной RPMI, которая является контролем, в группе, обработанной BMSC+Ad/ E1, но опухоли не было обнаружено в группе, обработанной DC + лизатом опухоли, в группе, обработанной соединением 3, и в группе, обработанной BMSC+Ad/IL-2 (фиг.6). Более того, через 8 недель после инъекции раковых клеток множественные метастазные поражения легких были обнаружены в группе, обработанной RPMI, которая является контролем, в группе, обработанной BMSC+Ad/ E1, и только одно небольшое поражение легкого было обнаружено в группе, обработанной DC + лизатом опухоли, и в группе, обработанной соединением 3. Но не было обнаружено поражений в группе, обработанной BMSC+Ad/IL-2 (фиг.7, 8, 9). Кроме того, через 12 недель после подкожной инъекции раковых клеток опухоль образовалась в группе, обработанной RPMI, которая была контролем, в группе, обработанной BMSC, в группе, обработанной BMSC+Ad/ E1, и только одно небольшое поражение легкого было обнаружено в группе, обработанной DC + лизатом опухоли, и в группе, обработанной соединением 3. Но не было обнаружено поражений в группе, обработанной BMSC+Ad/IL-2 (фиг.7, 8, 9). Кроме того, через 12 недель после подкожной инъекции раковых клеток опухоль образовалась в группе, обработанной RPMI, которая была контролем, в группе, обработанной BMSC, в группе, обработанной BMSC+Ad/ Е1, в группе, обработанной BMSC+Ad/ Е1, в группе, обработанной BMSC+Ad/ E1, и в группе, обработанной DC + лизатом опухоли, и опухоль, имеющая размер менее 5 мм, была обнаружена у одной мыши в группе, обработанной BMSC+Ad/hIL-2, но в группе, обработанной BMSC+Ad/IL-2 + соединением 3, опухоли обнаружено не было (фиг.10). E1, и в группе, обработанной DC + лизатом опухоли, и опухоль, имеющая размер менее 5 мм, была обнаружена у одной мыши в группе, обработанной BMSC+Ad/hIL-2, но в группе, обработанной BMSC+Ad/IL-2 + соединением 3, опухоли обнаружено не было (фиг.10).
С другой стороны, шестинедельные самки сирийского золотого хомячка содержались в специальном блоке, свободном от патогена. Клетки KIBG-5 (5×105 штук), суспендированные в 100 мкл среды RPMI 1640, не содержавшей сыворотки, вводили внутривенно через бедренную вену. Хомячков делили на следующие 4 группы: 1) контрольная группа PBS, 2) группа, обработанная соединением 3 (10 мг/кг/день), 3) группа, обработанная соединением 3 (25 мг/кг/день), 4) группа, обработанная соединением 3 (50 мг/кг/день). За одну неделю до инъекции опухолевых клеток давали соединение 3 (10, 25 или 50 мг/кг/день) с помощью перорального введения, которое продолжалось 2 недели с однонедельным перерывом в течение 12 недель. Животных из каждой группы умерщвляли на 4-й, 8-й, 12-й неделе для патологического исследования. Макроскопические данные на 4-й неделе, опухоль развивалась в месте инъекции в контрольной группе. В группах, принимавших соединение 3 (10, 25 или 50 мг/кг/день), присутствия опухолей не наблюдалось. На 8-й неделе в контрольной группе наблюдали множественные метастазные поражения в обоих легких. В группе, принимавшей соединение 3 (25 или 50 мг/кг/день), невооруженным глазом не было обнаружено никаких метастазных поражений легких, но в группе, принимавшей соединение 3 (25 мг/кг/день), с помощью микроскопа было обнаружено одно незначительное поражение. В группе, принимавшей соединение 3 (10 мг/кг/день), в левом легком была обнаружена опухоль (фиг.11 и 12).
Экспериментальный пример 5-2. Меланомная модель на мышах (C57BL/6)
Шестинедельные самки мышей C57BL/6 (предоставлены Asan Institute for Life Sciences Animal La., Seoul, Korea) содержались в специальном блоке, свободном от патогена.
Клетки B16F10 (2×104 штук), суспендированные в 100 мкл среды RPMI 1640, не содержавшей сыворотки, вводили внутривенно через хвостовую вену. За неделю до инъекции опухолевых клеток воздействию были подвергнуты следующие три группы.
1) Контрольная группа, обработанная средой RPMI,
2) Группа, обработанная дендритными клетками (DC) (5×105 клеток/день) + лизатом опухоли,
3) Группа, обработанная соединением 3 (50 мг/кг/день).
В случае группы, обработанной DC + лизатом опухоли, за одну неделю перед инъекцией меланомы 5×105 клеток DC, смешанных с лизатом опухоли, вводили инъекцией в брюшную полость и продолжали вводить каждую неделю. В случае группы, получавшей соединение 3, каждой мыши вводили 50 мг/кг/день соединения 3. За неделю до инъекции меланомы (B16F10) вводили перорально соединение 3 (50 мг/кг/день) и продолжали вводить 2 недели с однонедельным перерывом в течение 6 недель. В результате макроскопические наблюдения контрольной группы на 4-й недели показали множественные метастазные поражения в обоих легких. Группа, обработанная соединением 3, и группа, которой вводили DC + лизат опухоли, демонстрировали отсутствие признаков заболевания в легких (фиг.13, 14) и показали 90%-ный уровень выживаемости при наблюдении в течение 6 недель после инъекции меланомы (B16F10) (фиг.15).
Основываясь на предположении, что противораковые эффекты соединения 3 объясняются активацией Т-клеток соединением 3, изучали цитотоксичность Т-клеток, активированных соединением 3, по отношению к клеткам злокачественной меланомы. В результате, если отношение Т-клеток, активированных соединением 3, к клеткам меланомы составляло 100:1, цитотоксичность повышалась на 42% (фиг.16).
Экспериментальный пример 6. Тест на токсичность соединения 3
Синтезированное соединение 3 растворяли в 5%-ном растворе этанола, который вводили перорально в дозировке 0,1 мл/20 г. Контрольной группе вводили 5%-ный раствор этанола. В качестве тестируемых животных использовали мышей IRC, помещенных в приспособление SPF. Перед введением лекарственного средства мышей не кормили в течение одного дня, обеспечивали им свободный доступ к воде и кормили после введения препаратов. Создавали группы от восьми до десяти мышей ICR весом 25-35 г. Тестируемое вещество вводили перорально однократно в увеличивающихся дозировках от 62,5 мг/кг, 125 мг/кг, 250 мг/кг, 500 мг/кг, 1,0 г/кг до 2,0 г/кг. Со дня введения препаратов невооруженным взглядом наблюдали за количеством выживших животных и фиксировали любые указания на аномалии в течение 14 дней. LD50 рассчитывали с помощью метода Lichfield-Wilcoxon ( – acute toxicity test. Realize Inc., Tokyo, 1988), а изменения веса рассчитывали с помощью математической формулы 2, приведенной ниже. – acute toxicity test. Realize Inc., Tokyo, 1988), а изменения веса рассчитывали с помощью математической формулы 2, приведенной ниже.
Математическая формула 2
Скорость прироста веса (%) = (Вес на 14-й день – Вес в начале исследования)÷(Вес в начале исследования)×100
Результаты приведены в табл.4. Токсичность отсутствовала при введении 62,5 мг/кг-2 г/кг соединения 3. Это наблюдение указывает на то, что LD50 была выше, чем 2 г/кг. При наблюдении невооруженным взглядом в течение 14 дней после введения любые указания на аномалии отсутствовали. Вес животных в группе, которой вводили соединение 3, постоянно увеличивался так же, как у контрольных животных. Как показано в табл.5, не наблюдали изменения веса (повышения или снижения), вызванного введением соединения 3.
Таблица 4
Уровень смертности при введении соединения 3 (%) |
| Дозировка соединения 3 (мг/кг) |
0 |
62,5 |
125 |
250 |
500 |
1000 |
2000 |
| Число погибших мышей/число мышей, принимавших препарат перорально |
0/10 |
1/8 |
0/8 |
1/8 |
2/9 |
0/9 |
0/9 |
| LD50 |
0 |
12,5 |
30 |
12,5 |
22,2 |
0 |
0 |
| Таблица 5 |
| Повышение веса через 14 дней после перорального введения соединения 3 |
| Дозировка соединения 3 (мг/кг) |
0 |
62,5 |
125 |
250 |
500 |
1000 |
2000 |
| Вес через 14 дней после введения препарата (г) |
38,7±1,1 |
34,3±0,1 |
38,1±1,3 |
35,6±1,4 |
36,5±1,9 |
35,5±1,1 |
35,9±2,7 |
| Скорость прироста веса (%) |
16,9 |
11,9 |
17,3 |
11,2 |
10,1 |
9,5 |
14,4 |
Долгосрочный тест на гепатотоксичность проводили на крысах при дозировке соединения 3 100 мг/кг веса тела/день, вводимого перорально в течение 4 недель, и следили за тестом на функции печени, за липидным профилем, активностью цитохрома С-450. В конце 4-й недели проводили гистологические исследования печени. Существенных неблагоприятных эффектов обнаружено не было.
Экспериментальный пример 7. Тест CLP (цекальное лигирование и пункция)
Тест CLP проводили для подтверждения влияния соединения 3 на предупреждение или лечение септического шока. Самцов инбредной линии мышей С3Н/HeN в возрасте 7-10 недель (весом 20-25 г) разделяли на группы. После того как мышам вводили соединение 3 в количестве 50 мг/кг/день в течение 2 недель с перерывом в 1 неделю, мышей анестезировали с помощью кетамина (80 мг/кг) и ромпуна (16 мг/кг). С помощью модели CLP у анестезированных мышей индуцировали септический шок. Через час после индукции септического шока вводили 50 мг/кг соединения 3 и затем такое же воздействие продолжали в течение 3 дней каждые 24 часа. Контрольной группе вводили перорально PBS+5%-ный раствор этанола. Уровень выживаемости группы, получавшей соединение 3, и контрольной группы после различных временных промежутков показан в табл.6. Группы, получавшие соединение 3, демонстрировали уровень выживаемости в 100% даже после 120 часов.
Таблица 6
Уровень выживаемости при септическом шоке |
| Уровень выживаемости после различных временных промежутков |
0 час Уровень выживаемости |
24 час Уровень выживаемости |
48 час Уровень выживаемости |
72 час Уровень выживаемости |
96 час Уровень выживаемости |
120 час Уровень выживаемости |
| Группа, обработанная PBS (контроль) |
100% |
60% |
40% |
40% |
40% |
40% |
| соединение 3 (50 мг/кг) |
100% |
100% |
100% |
100% |
100% |
100% |
Производственный пример 1. Получение лекарственных ресурсов, содержащих в качестве эффективного ингредиента соединение 3
После того как в экспериментах, указанных выше, было подтверждено, что соединение 3 обладает превосходной иммуномодулирующей и противораковой активностью, авторы настоящего изобретения получили лекарственное средство, содержащее соединение 3 в качестве эффективного ингредиента. Кроме того, следующий производственный пример лекарственного средства, содержащего соединение 3 в качестве эффективного ингредиента, может быть применен не только для получения лекарственного средства, но также для получения здоровой пищи. Если специально не указано, в производственном примере символ % означает вес.%.
Производственный пример 1-1. Изготовление мягких желатиновых капсул
Производственный пример 1-1-1
| Соединение 3 |
30% |
| Витамин С |
4,5% |
| Витамин D3 |
0,001% |
| Сульфат магния |
0,1% |
| Воск |
10% |
| Пальмовое масло |
25% |
| Сафлоровое масло (Carthamus tinctorius) |
30,399% |
Производственный пример 1-1-2
| Соединение 3 |
31,25% |
| Масло семян энотеры |
59,75% |
| Соевое масло |
6,7% |
Уксусный эфир витамина Е (DL- -токоферолацетат) -токоферолацетат) |
2,1% |
| Соевый лецитин |
0,2% |
Производственный пример 1-1-3
Уксусный эфир витамина Е (DL- -токоферолацетат) 2,0% -токоферолацетат) 2,0%
Производственный пример 1-2. Изготовление таблеток
| Соединение 3 |
30% |
| Витамин С |
10% |
| Витамин D3 |
0,001% |
| Сульфат магния |
0,1% |
| Кристаллическая целлюлоза |
25,0% |
| Лактоза |
32,999% |
| Стеарат магния |
2% |
Производственный пример 1-3. Изготовление композиции для инъекций
| Соединение 3 |
2% |
| Пропиленгликоль |
35% |
| Моноглицерид |
8% |
| Этанол |
5% |
| Вода |
50% |
Композицию для инъекций получали общепринятым методом с применением указанных выше композиций и их состава.
Производственный пример 2. Получение лекарственных ресурсов, содержащих соединения 1, 2, 4 и 5 в качестве эффективных ингредиентов
Мягкие желатиновые капсулы, таблетки и суспензии для инъекций изготавливали тем же способом и в том же составе, как описано в указанном выше производственном примере 1, за исключением того, что соединение 3 заменяли на соединение 1, 2, 4 и 5 в том же соотношении.
Производственный пример 3. Изготовление здоровой пищи, содержащей соединение 3 в качестве эффективного ингредиента
После того как в Примерах, указанных выше, было подтверждено, что соединение 3 обладает превосходной иммуномодулирующей активностью, активностью против септического шока и противораковой активностью, авторы настоящего изобретения получили здоровую пищу, содержащую соединение 3 в качестве эффективного ингредиента.
Производственный пример 3-1. Изготовление напитков
| Мед |
522 мг |
| Амид липоевой кислоты |
5 мг |
| Никотинамид |
10 мг |
| Натриевая соль рибофлавина гидрохлорида |
3 мг |
| Пиридоксин гидрохлорид |
2 мг |
| Инозитол |
30 мг |
| Ортокислота |
50 мг |
| Соединение 3 |
0,48-1,28 мг |
| Вода |
200 мл |
Напиток получали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-2. Изготовление жевательной резинки
| Основа резинки |
20% |
| Сахар |
76,36% |
| Соединение 3 |
0,24-0,64% |
| Фруктовый ароматизатор |
1% |
| Вода |
2% |
Жевательную резинку изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-3. Изготовление конфет
| Сахар |
50-60% |
| Крахмальный сироп |
39,26-49,66% |
| Соединение 3 |
0,24-0,64% |
| Апельсиновый ароматизатор |
0,1% |
Конфеты изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-4. Изготовление бисквита
| Мука твердых сортов 1-го класса |
88 кг |
| Мука для кексов 1-го класса |
76,4 кг |
| Рафинированный сахар |
16,5 кг |
| Соль |
2,5 кг |
| Глюкоза |
2,7 кг |
| Пальмовый жир |
40,5 кг |
| Аммоний |
5,3 кг |
| Пищевая сода |
0,6 кг |
| Гидросульфат натрия |
0,55 кг |
| Рисовая мука |
5,0 кг |
| Витамин В1 |
0,003 кг |
| Витамин В2 |
0,003 кг |
| Молочный ароматизатор |
0,16 кг |
| Вода |
71,1 кг |
| Сухое цельное молоко |
4 кг |
| Заменитель сухого молока |
1 кг |
| Фосфат кальция одноосновный |
0,1 кг |
| Аэрозольная соль |
1 кг |
| Аэрозольное молоко |
25 кг |
| Соединение 3 |
0,2-0,5 кг |
Бисквит изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-5. Изготовление мороженого
| Молочный жир |
10,0% |
| Сухое вещество молока, не содержащее жира |
10,8% |
| Сахар |
12,0% |
| Крахмальный сироп |
3,0% |
| Эмульгирующий стабилизатор (взбитый) |
0,5% |
| Ароматизатор (клубника) |
0,15% |
| Вода |
63,31-62,91% |
| Соединение 3 |
0,24-0,64% |
Мороженое изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 3-6. Изготовление шоколада
| Сахар |
34,36-34,76% |
| Масло какао |
34% |
| Кокосовое волокно |
15% |
| Кокосовый порошок |
15% |
| Лецитин |
0,5% |
| Ванильный ароматизатор |
0,5% |
| Соединение 3 |
0,24-0,64% |
Шоколад изготавливали на основе указанных выше композиций и их состава общепринятым методом.
Производственный пример 4. Изготовление здоровой пищи, содержащей соединения 1, 2, 4 и 5 в качестве эффективного ингредиента
Напиток, жевательную резинку, конфеты, бисквит, мороженое и шоколад изготавливали тем же способом и в том же составе, как описано в указанном выше производственном примере 1, за исключением того, что соединение 3 заменяли на соединение 1, 2, 4 и 5 в том же соотношении.
Преимущества заявленного изобретения
Как было объяснено ранее, производные моноацетилдиацилглицерина, содержащие соединение 3, демонстрируют значительный эффект на иммуномодуляцию, включая повышение иммунитета. При индукции рака у хомячков с помощью инъекции раковой клеточной линии развитие рака задерживалось через активацию лимфоцитов, моноцитов и дендритных клеток, которые являются важными факторами для активизации иммунитета, и апоптоз раковой клетки индуцировался усилением цитотоксичности иммунной клетки по отношению к раковой клетке. Также при индукции септического шока у мышей продемонстрирован 100%-ный уровень выживаемости даже через 120 часов, достигаемый контролем иммунитета и подавляющим эффектом апоптоза. Следовательно, производные моноацетилдиацилглицерина в соответствии с настоящим изобретением могут эффективно применяться как иммуномодулирующее средство, средство для лечения сепсиса и рака и как здоровая пища для иммуномодуляции или предупреждения рака.
Формула изобретения
1. Средство для лечения аутоиммунного заболевания, подавляющее нарушение клеток в результате аутоиммунной реакции, содержащее производное моноацетилдиацилглицерина, представленное формулой 1, в качестве эффективного активного ингредиента
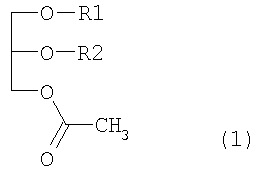
где R1/R2 является 9-октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
2. Средство по п.1, в котором производные моноацетилдиацилглицерина, представленные формулой 1, являются моноацетилдиацилглицерином, представленным формулой 2, приведенной ниже
3. Средство по п.1, в котором производные моноацетилдиацилглицерина стимулируют в Т-клетках секрецию цитокинов, выбранных из группы, включающей IL-2, IL-4 и IL-5.
4. Средство по п.1, в котором производные моноацетилдиацилглицерина стимулируют секрецию IL-4 и пролиферацию и активацию как Т4-, так и Т8-клеток.
5. Средство по п.1, в котором производные моноацетилдиацилглицерина составляют от 20 до 100 вес.% от общего веса иммуномодулирующего средства.
6. Лекарственное средство от сепсиса, содержащее в качестве эффективного активного ингредиента производные моноацетилдиацилглицерина, представленные формулой 1

в которой, R1/R2 является октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
7. Противораковое средство, содержащее в качестве эффективного активного ингредиента производные моноацетилдиацилглицерина, представленные формулой 1

в которой, R1/R2 является 9-октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
8. Противораковое средство по п.7, которое применяют для лечения рака желчных протоков, рака почек или злокачественной меланомы.
9. Противораковое средство по п.7, которое активирует дендритные клетки, которые дают возможность Т-клеткам узнавать антиген раковых клеток.
10. Здоровая пища для предотвращения рака или аутоиммунного заболевания, содержащая в качестве эффективного активного ингредиента производные моноацетилдиацилглицерина, представленные формулой 1

в которой, R1/R2 является 9-октадеценоил(олеоил)/(гексадеканоил(пальмитоил), гексадеканоил(пальмитоил)/(9-октадеценоил(олеоил), гексадеканоил(пальмитоил)/9,12-октадекадиеноил(линолеоил), гексадеканоил(пальмитоил)/9,12,15-октадекатриеноил(линоленоил) или гексадеканоил(пальмитоил)/5,8,11,14-эйкозатетраеноил(арахидоноил).
11. Здоровая пища по п.10, в которой производные моноацетилдиацилглицерина составляют от 0,02 до 100 вес.% от общего веса этой пищи.
Приоритет по пунктам:
21.12.2004 – пп.1-6, 10-11;
24.04.2004 – пп.7-9.
РИСУНКИ
|
|