|
|
(21), (22) Заявка: 2007112605/28, 04.04.2007
(24) Дата начала отсчета срока действия патента:
04.04.2007
(46) Опубликовано: 27.11.2008
(56) Список документов, цитированных в отчете о
поиске:
SU 1449885 A1, 07.01.1989. RU 2230312 C1, 10.06.2004. SU 1249429 A1, 07.08.1986. SU 709991 A, 15.01.1980.
Адрес для переписки:
367001, РД, г.Махачкала, ул. М. Гаджиева, 43а, ДГУ, УИС, пат.пов. Х.М.Мугутдиновой, рег. № 1069
|
(72) Автор(ы):
Владимирова Валентина Федоровна (RU),
Чавтараев Ахмет Амужадович (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования Дагестанский государственный университет (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ЖЕЛЕЗА (II) В ЭЛЕКТРОЛИТАХ ЖЕЛЕЗНЕНИЯ
(57) Реферат:
Изобретение относится к области физико-химических методов анализа, а точнее к методу ионометрии. Способ определения концентрации железа (II) в электролитах железнения включает измерение потенциала стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения и определение по его величине концентрации ионов Fe2+ методом градуировочного графика. Для приготовления раствора, используемого для построения градуировочного графика и опытного раствора электролита железнения, используют соль железа (II) и хлорид калия, а в качестве градуировочного графика используют зависимость потенциала Е от 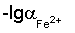 в интервале подчинимости стеклянного электрода нернстовской функции, где потенциал Е – это потенциал стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения, а в интервале подчинимости стеклянного электрода нернстовской функции, где потенциал Е – это потенциал стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения, а 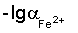 это отрицательный десятичный логарифм концентрации железа (II). Изобретение позволяет устранить трудоемкость и длительность анализа: время выполнения единичного определения составляет 50-60 с. 3 табл., 1 ил. это отрицательный десятичный логарифм концентрации железа (II). Изобретение позволяет устранить трудоемкость и длительность анализа: время выполнения единичного определения составляет 50-60 с. 3 табл., 1 ил.
Изобретение относится к области физико-химических методов анализа, а точнее к методу ионометрии, использующему в качестве индикаторного электрода стеклянный электрод, селективный к катионам водорода (рН-электрод). Наиболее эффективно изобретение может быть использовано для анализа электролитов железнения, а также других жидких сред, содержащих катионы Fe2+.
Известно, что для контроля содержания Fe2+ в электролитах используют метод дихроматометрического титрования с дифениламином или его производными в качестве индикатора (Основы аналитической химии. В 2 кн. Кн.2. Методы химического анализа: Учеб. для вузов./ Ю.А.Золотов, Е.Н.Дорохова, В.И.Фадеева и др. Под ред. Ю.А.Золотова. – М.: Высш. шк., 1996. – С.94).
Метод основан на протекании окислительно-восстановительной реакции между дихромат-ионами и катионами Fe2+.
К недостаткам метода относится необходимость проведения титрования с индикатором дифениламином в присутствии фосфорной кислоты, связывающей образующиеся при реакции ионы Fe2+ в комплекс и тем самым понижающей окислительный потенциал раствора. Это усложняет и удорожает анализ. При титровании образуются также ионы Cr3+, придающие раствору зеленую окраску, которая затрудняет фиксирование точки эквивалентности; этот факт может обусловить недопустимую погрешность анализа.
Наиболее близким по технической сущности является метод определения ионов Fe2+ в электролитах железнения, широко используемый в практике заводских химических лабораторий (Гальванические покрытия в машиностроении. Справочник. В 2-х томах. / Под ред. М.А.Шлугера, Л.Д.Тока. – М.: Машиностроение, 1985. – Т.2. 1985. С.76). Это метод перманганатометрического определения Fe2+ путем титрования анализируемого раствора, содержащего Fe2+, подкисленного раствором серной кислоты, стандартным раствором перманганата калия до появления бледно-розового окрашивания при достижении точки эквивалентности.
Недостатками известного метода определения ионов Fe2+ в электролитах железнения является то, что вследствие неустойчивости перманганата калия (KMnO4) как в сухом состоянии, так и в растворе стандартный раствор его готовят в течение не менее десяти дней, по прошествии которых отделяют продукт разложения KMnO4 (MnO2) путем фильтрования и затем стандартизируют его по щавелевой кислоте или ее соли. Стандартные растворы последних следует приготовить заранее. Все сказанное свидетельствует о трудоемкости и длительности проведения анализа.
Приготовленный стандартный раствор KMnO4 периодически необходимо вновь стандартизировать, т.к. этот раствор по-прежнему остается неустойчивым, и поэтому титр его меняется.
Метод перманганатометрического определения Fe2+ в солянокислой среде (а ведь целый ряд электролитов железнения является солянокислым) дает искаженные результаты в результате протекания конкурирующей реакции между MnO4 – и ее Cl– в кислой среде. Для предупреждения этой реакции вводится защитная смесь Циммермана-Рейнгардта (она содержит MnSO4, Н3РО4, Н2SO4). Использование этой смеси удорожает анализ электролита железнения на содержание железа.
Используемые в известном методе реактивы (щавелевая кислота или ее соли, MnSO4, Н3РО4, H2SO4, KMnO4) опасны для живого организма (См. Я.М.Грушко. Вредные органические соединения в промышленных выбросах в атмосферу. Л., Химия, 1986, с.167-168; Вредные химические вещества. Неорганические соединения V-VIII групп: Спр. авт.изд. / А.Л.Бандман, Н.В.Волкова, Т.Д.Грехова и др. Под ред. В.А.Филова и др. – Л.: Химия, 1989, С.405-422.
Таким образом, метод перманганатометрического определения Fe2+ в электролитах железнения характеризуется рядом недостатков: трудоемкостью и длительностью приготовления стандартного раствора KMnO4; необходимостью периодической стандартизации раствора KMnO4; дополнительными затратами на реактивы при анализе соляно-кислых электролитов железнения; использованием токсичных веществ.
Задачей настоящего изобретения является повышение эффективности метода определения ионов Fe2+ в электролитах железнения.
Технический результат состоит в повышении чувствительности, точности и воспроизводимости результатов параллельных опытов; устранении трудоемкости и длительности времени анализа; решении в определенной степени экологической проблемы (охраны живого организма и окружающей среды от сбросов отработанных растворов соединений марганца, фосфора, щавелевой кислоты, оксалатов, серной кислоты); сокращении списка реактивов, необходимых для выполнения анализа.
Технический результат достигается тем, что в основе лежит селективность стеклянного рН-электрода к H+, концентрация которого согласно уравнению реакции гидролиза:
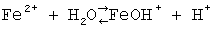
эквивалентна концентрации ионов Fe2+. Таким образом, зависимость «Потенциал Е – 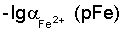 » в интервале подчинимости стеклянного электрода нернстовской функции служит градуировочным графиком для определения ионов железа Fe2+. » в интервале подчинимости стеклянного электрода нернстовской функции служит градуировочным графиком для определения ионов железа Fe2+.
Сущность изобретения состоит в определении концентрации железа (II) в электролитах железнения, включает измерение потенциала стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения и определение по его величине концентрации ионов Fe2+ методом градуировочного графика, при этом для приготовления раствора, используемого для построения градуировочного графика и опытного раствора электролита железнения, используют соль железа (II) и хлорид калия, в качестве градуировочного графика используют зависимость потенциала Е от 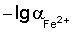 в интервале подчинимости стеклянного электрода нернстовской функции, где потенциал Е – это потенциал стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения, a в интервале подчинимости стеклянного электрода нернстовской функции, где потенциал Е – это потенциал стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения, a 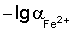 – это отрицательный десятичный логарифм концентрации железа (II). – это отрицательный десятичный логарифм концентрации железа (II).
Такой способ решения поставленной задачи позволяет повысить эффективность метода определения ионов Fe2+ в электролитах железнения, так как повышается чувствительность метода определения Fe2+ благодаря использованию стеклянного рН-электрода, весьма чувствительного к ионам H+; повышается точность и воспроизводимость результатов анализа, поскольку показания снимаются инструментальным методом (в работе использован иономер универсальный марки ЭВ-74), в отличие от визуального (субъективного) способа фиксирования точки эквивалентности в известном методе, на основании которой производятся расчеты содержания Fe2+ в электролитах железнения; устраняется трудоемкость и длительность выполнения единичного анализа, т.к. все те операции известного метода по приготовлению и стандартизации раствора KMnO4 в предлагаемом методе отсутствуют; решается в определенной степени экологическая проблема благодаря отсутствию необходимости использования щавелевой кислоты (или ее солей), солей марганца, фосфорной и серной кислоты; сокращается список реактивов, необходимых для выполнения анализа (См. предыдущий пункт), что удешевляет анализ. В предлагаемом методе необходимы реактивы: соль железа (II) – для приготовления серии растворов при построении градуировочного графика и хлорид калия – для создания постоянной ионной силы всех растворов указанной серии и опытного раствора электролита железнения.
Предлагаемый метод был опробован на примере определения ионов Fe2+ в электролите железнения состава (г/л): FeSO4·Н2О – 200, H2SO4 – 2. Исследования выполнены на иономере универсальном марки ЭВ-74 в режиме измерения потенциала стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения.
Для получения серии стандартных растворов готовился раствор №1 (табл.1) путем перенесения навески FeSO4·7Н2О, взятой на аналитических весах, в мерную колбу емкостью 50 мл, внесения туда же измерительной пипетной аликвоты Н2SO4 (р=1,84) и доведения объема раствора дистиллированной водой до метки. При расчете аликвоты Н2SO4 учитывалась необходимость создания такого молярного концентрационного соотношения Fe2+ и Н2SO4, которое имеет место в опытном электролите железнения (35:1). Методика приготовления последующих растворов серии дана в табл.1.
Таблица 1
Данные по приготовлению серии стандартных растворов для построения градуировочного графика для определения железа в электролите железнения |
| № раствора |
Концентрация Fe2+, M |
pFe |
Способ приготовления растворов |
| 1 |
100 |
0 |
Используют 1М FeSO4·7H2O и 0.029М H2SO4 |
| 2 |
10-1 |
1 |
5 мл раствора №1+4,5 мл 1М KCl разбавляют водой до объема 50 мл |
| 3 |
10-2 |
2 |
5 мл раствора №2+4,5 мл 1М KCl разбавляют водой до объема 50 мл |
| 4 |
10-3 |
3 |
5 мл раствора №3+4,5 мл 1М KCl разбавляют водой до объема 50 мл |
| 5 |
10-4 |
4 |
5 мл раствора №4+4,5 мл 1М KCl разбавляют водой до объема 50 мл |
| 6 |
10-5 |
5 |
5 мл раствора №5+4,5 мл 1М KCl разбавляют водой до объема 50 мл |
| 7 |
10-6 |
6 |
5 мл раствора №6+4,5 мл 1М KCl разбавляют водой до объема 50 мл |
Далее поочередно в каждом растворе (аликвота каждого раствора – 20 мл), переходя от меньших концентраций к большим, измеряли потенциал стеклянного рН-электрода (см. чертеж 1). Участок графической зависимости для области pFe 5-0 с коэффициентом наклона к оси абсцисс, равным теоретическому значению (59/n мВ, где n=1), можно рассматривать как градуировочный график для определения Fe. Время отклика стеклянного электрода на изменение концентрации Fe2+ составило 3 с. Точка перегиба, отвечающая pFe=5, есть предельная концентрация ионов Fe2+, ниже которой определение Fe2+ практически невозможно. Итак, чувствительность предлагаемого метода определения железа – 10-5 моль/л.
Для определения Fe2+ в опытном электролите в аликвоту последнего погружали оба электрода, определяли потенциал стеклянного электрода и, пользуясь градуировочным графиком, определяли концентрацию Fe2+ в моль/л, а затем делали пересчет на содержание железа в опытном электролите (в г/л). Данные пяти параллельных опытов с проведенной статистической обработкой результатов представлены в табл.2.
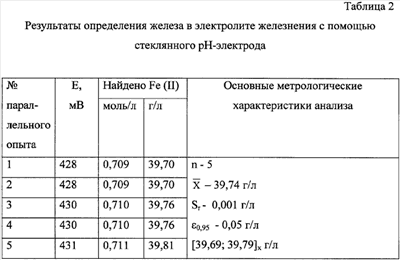
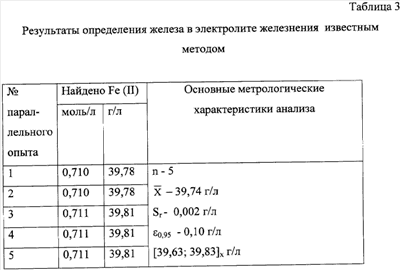
С целью сравнительной оценки предлагаемого и известного методов проведено определение Fe2+ в опытном электролите железнения известным методом (табл.3). Анализ таблиц 2 и 3 показывает, что воспроизводимость результатов в предлагаемом методе лучше, чем в известном методе, о чем свидетельствует более низкое значение относительного стандартного отклонения Sr; точность определения железа в электролите железнения выше в предлагаемом методе, о чем свидетельствует более низкое значение максимальной допустимой погрешности  0,95 по сравнению с известным методом. 0,95 по сравнению с известным методом.
Предложенный метод определения железа в электролитах железнения по сравнению с известным методом позволяет устранить трудоемкость и длительность анализа, поскольку в нем не требуется проведение операций приготовления стандартного раствора щавелевой кислоты (или ее соли), раствора KMnO4, выдерживания его в течение не менее десяти дней для завершения реакции разложения KMnO4, удаления путем фильтрования продукта разложения (MnO2), стандартизации раствора KMnO4, повторной проверки титра раствора KMnO4 путем титриметрического анализа.
Метод позволяет также повысить чувствительность определения Fe2+ до 10-5 моль/л (что соответствует pFe=5); это обусловлено высокой селективностью стеклянного рН-электрода к катионам водорода.
Предлагаемый метод определения железа в электролитах железнения характеризуется экспрессностью – время выполнения единичного определения (без затрат времени на получение градуировочного графика «Потенциал – pFe») составляет 50-60 с.
По данным статистической обработки результатов предлагаемый метод определения железа в электролите железнения характеризуется лучшей воспроизводимостью и более высокой точностью результатов по сравнению с таковыми для известного метода (относительное стандартное отклонение Sr и максимальная допустимая погрешность  0,95 составляет 0,001 г/л и 0,05 г/л соответственно, против 0,002 г/л и 0,10 г/л – для известного метода соответственно). 0,95 составляет 0,001 г/л и 0,05 г/л соответственно, против 0,002 г/л и 0,10 г/л – для известного метода соответственно).
Формула изобретения
Способ определения концентрации железа (II) в электролитах железнения, включающий измерение потенциала стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения и определение по его величине концентрации ионов Fe2+ методом градуировочного графика, при этом для приготовления раствора, используемого для построения градуировочного графика и опытного раствора электролита железнения, используют соль железа (II) и хлорид калия, в качестве градуировочного графика используют зависимость потенциала Е от 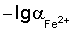 в интервале подчинимости стеклянного электрода нернстовской функции, где потенциал Е это потенциал стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения, а в интервале подчинимости стеклянного электрода нернстовской функции, где потенциал Е это потенциал стеклянного рН-электрода относительно хлорид-серебряного электрода сравнения, а 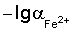 это отрицательный десятичный логарифм концентрации железа (II). это отрицательный десятичный логарифм концентрации железа (II).
РИСУНКИ
|
|