Патент на изобретение №2339642
|
||||||||||||||||||||||||||
(54) СПОСОБЫ ПОЛУЧЕНИЯ ЭПЛЕРЕНОНА
(57) Реферат:
Изобретение относится к улучшенным способам получения фармацевтически полезного соединения – эплеренона: (9
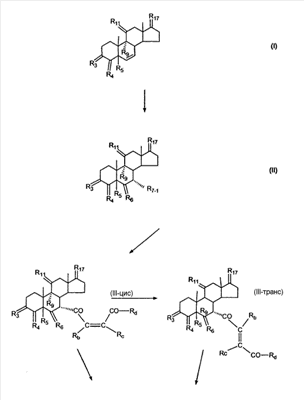
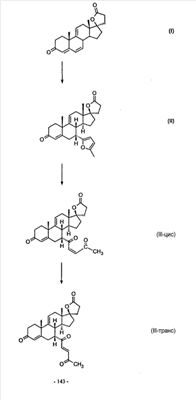
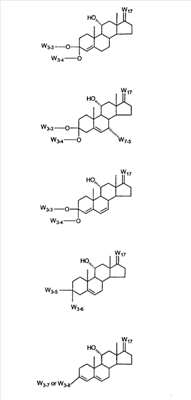
1. Область изобретения Настоящее изобретение относится к способу преобразования 3-енольного эфира Настоящее изобретение относится к способу преобразования Настоящее изобретение также относится к новым способам и новым промежуточным соединениям для получения фармацевтически полезного соединения эплеренона. Также изобретение относится к способам преобразования 11 2. Уровень техники Известно, что преобразование 3-кето- В J. Org. Chem., 29, 601 (1964) говорится о том, что
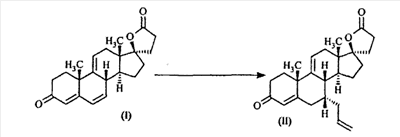
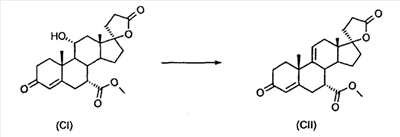
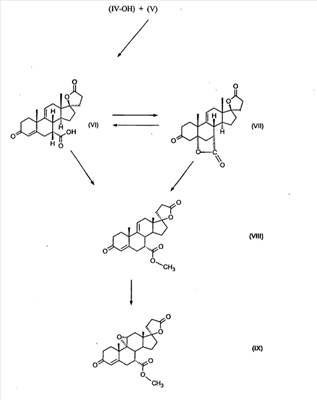
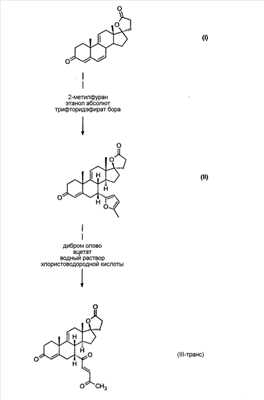
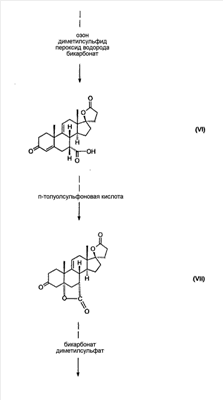
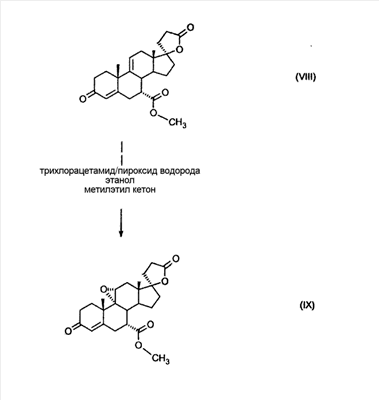
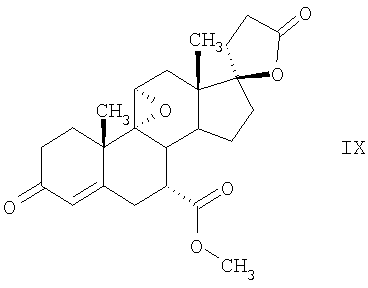
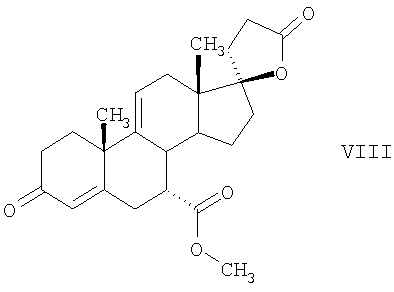
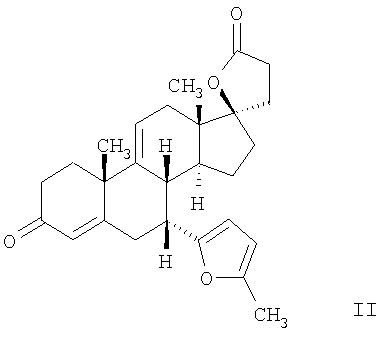
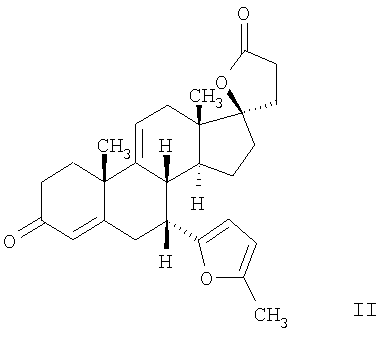
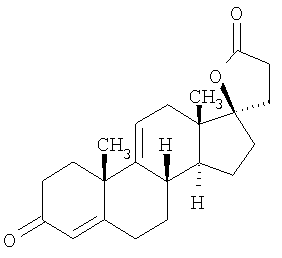
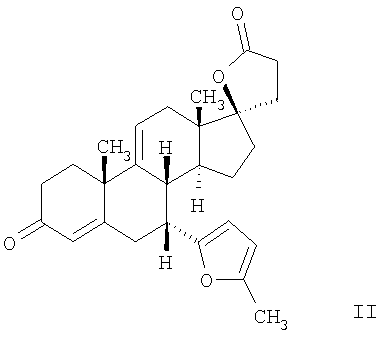
Эплеренон, также известный как эпоксимексренон, является полезным фармацевтическим агентом и химически представляет собой 9 В международной публикации WO98/25948 PCT заявки PCT/US97/23090 описан эплеренон и много различных способов получения эплеренона. В частности, смотри схемы 1-10. В патенте США В патенте США В Het., 25, 399 (1987) и Bull. Soc. Chim. Fr. 131, 900 (1994) описано использование трифторидбордиэтилэфирата для катализируемого связующего добавления нестероидного 2-метилфурана к Способы связующего добавления карбоновых нуклеофильных реагентов к 9(11)-насыщенным-
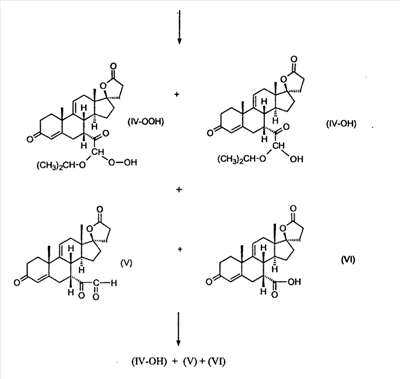
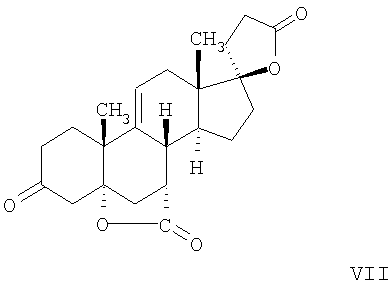
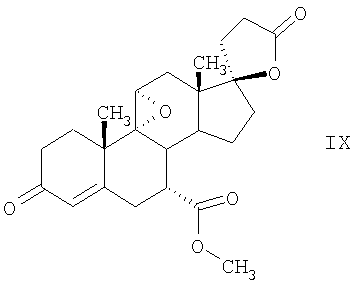
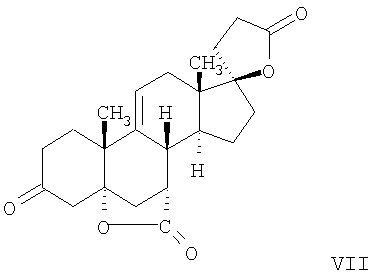
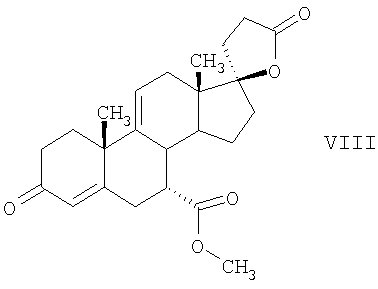
В Helv. Chim. Acta, 80, 566 (1997) и патенте США В J. Am. Chem. Soc.79, 3120 (1957), J. Am. Chem. Soc.82, 6136 (1960), и J. Org. Chem.27, 1192 (1962) описано разложение нестероидных ендионов до карбоновых кислот через гидроксигидропероксидные промежуточные соединения и не алкоксигидропероксидные промежуточные соединения. Способ по настоящему изобретению включает стероидные ендионы. Известен окислительный разрыв связей фуранов до карбоновых кислот или производных карбоновой кислоты путем прямого озонолиза. Однако выходы продукта обычно достаточно низкие. В J. Org. Chem., 61, 9126 (1996) сообщается, что 2,5-дизамещенный фуран при озонировании подвергается скорее частичному разложению до енольного ацетата, чем полному разложению до карбоновой кислоты. В Het., 34, 895 (1992) сообщается о прямом озонировании 2-замещенного фурана с получением, после этерификации, метилового эфира с выходом 59%. В J. Am. Chem. Soc. 101, 259 (1979) сообщается о прямом озонировании 2-замещенного фурана с получением, после этерификации, метилового эфира с выходом 55%. В J. Am. Chem. Soc., 107, 7762 (1985) сообщается о прямом озонировании 2-сахар-замещенного фурана, с получением, после восстановления бораном, простого спирта с выходом 50%. В Tet. Lett., 34, 7323 (1993) сообщается о прямом озонировании 2-замещенного фурана с получением, после этерификации, метилового эфира с выходом 60%. В Carb. Res., 150, 163 (1986) сообщается о прямом озонировании 2-сахар-замещенного фурана с получением, после восстановления трифенилфосфином, затем гидридом литий алюминия, простого спирта с выходом 11%. В Tet. Lett., 22, 141 (1981) сообщается о прямом озонировании 2-замещенного фурана с получением, после окисления, карбоновой кислоты с выходом приблизительно 30%. В J. Am. Chem. Soc., 109, 2082 (1987) сообщается о прямом озонировании 2-замещенного фурана, с получением, после этерификации, метилового эфира с выходом 77%. В Tet. Lett., 39, 7013 (1998) сообщается о прямом озонировании 2-замещенного фурана с получением, после этерификации, метилового эфира с выходом 78%-87%. В J. Org. Chem., 54, 2085 (1989) сообщается о прямом озонировании двух 2-замещенных фуранов с получением карбоновой кислоты с выходом 89-95%, однако в этом исследовании 2-замещенные фураны были очень простыми (то есть они не содержали какой-либо иной активной функциональной группы, кроме фурана). Нет описаний двух стадий разрыва связей фурана и затем окислительного разложения до карбоновой кислоты, которая дает высокие выходы продукта. В J. Org. Chem.63, 7505 (1998) описывается использование диброматина, бикарбоната натрия и водного ацетона для разрыва связей нестероидных фуранов с получением ендионов. Способ по настоящему изобретению включает стероидные фураны. В Chem. Lett., 1771 (1983) описывается использование хлористоводородной кислоты в эфире для катализа изомеризации не-стероидных цис-ендионов до транс-ендионов. Способ по настоящему изобретению включает стероидные ендионы. В J. Am. Chem. Soc.,79, 3120 (1957), J. Am. Chem. Soc., 82, 6136 (1960) и J. Org. Chem., 27, 1192 (1962) описывается разложение ендионов до карбоновых кислот через промежуточные соединения алкоксигидропероксида путем использования озона и агента окислительного расщепления. Выходы продукта не очень высокие. Например, выход бензойной кислоты из транс-дибензоилэтилена составлял 54%. После этого способа метоксигидропероксид (IV-OOH) (где R7-2 = -CH3) давал 65,2/34,8 смесь желаемой карбоновой кислоты (VI) и В Drugs of the Future, 24, 488 (1999) описывается преобразование 5,7-лактона (VII) в соответствующий метиловый эфир (VIII) путем обработки В международной публикации WO98/25948 главным образом описаны (5,7)-17-бислактоны и 3 защищенные формы. В международной публикации WO98/25948 описано преобразование стероидной 7 В международной публикации WO98/25948 описано преобразование (5,7)-17-бислактона в соответствующий 7 Эплеренон представляет собой 9(11) Известно, что карбоновая кислота может быть получена из (замещенного) фурана в одну стадию путем озонолиза. Однако выход продукта довольно низок. Более того, известно, что эти фураны могут распадаться до ендионов. Также известно, что ендионы могут быть окислены до карбоновых кислот. В Bulletin of the Chemical Society of Japan, 52, 3377-3380 (1979) описывается, что н-(1,1,2,2,3,3,3)гексафторпропил-диэтиламин, В J. Org. Chem., 2187-2195(1964) описывается взаимодействие 11 В Tetrahedron Letters, 1065-1069 (1962) также описывается взаимодействие 11 В Стероиды, 29, 2187 (1964) описывается взаимодействие стероидных спиртов с 2-хлор-1,1,2-трифтортриэтиламином для замены гидроксильной группы фтором. В настоящем изобретении 2-хлор-1,1,2-трифтортриэтиламин не используется, он не участвует в замене гидроксильной группы атомом фтора. В J. Fluorine Chem., 109, 25-31 (2001) описано и оценено применение 1,1,2,2-тетрафторэтил-N,N-диметиламина, а также реагента Яровенко-Ракша и Ишикава в качестве фторирующих и дегидратирующих агентов. Хотя в документе описаны примеры реакций элиминирования как для алифатических, так и для циклических систем, основным использованием является использование в качестве фторирующего агента. Единственным примером для стероида было взаимодействие 1,1,2,2-тетрафторэтил-N,N-диметиламина с холестерином с получением продукта, содержащего фтор в положении C-3 холестерина. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Описан способ получения где R31 и R32 являются (1) одинаковыми или различными и представляют собой C1-C3 алкил и (2) взятые вместе с присоединенным -O-C-O-, образуют циклический кеталь, содержащий 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 равно 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H, C1-C3 алкил, который включает (1) взаимодействие
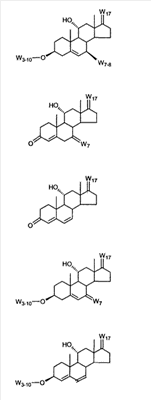
где R3 представляет собой C1-C3 алкил, CH3-CO-,
RSi-1RSi-2RSi-3Si-, где RSi-1, RSi-2 и RSi-3 являются одинаковыми или различными и представляют собой C1-C4 алкил; с улавливателем водорода (a hydride abstractor) и спиртом, выбранным из группы, включающей спирты формулы: (a) R31-OH, где R31 такой, как определено выше, (b) R32-OH, где R32 такой, как определено выше, (c) HO-(CH2)-(CR33R34)n1-(CH2)-OH, где n1, R33 и R34 такие, как определено выше, (d) HO-CH2-CH2-OH. Также описан 7 где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H, другой из R4-1 и R4-2, взятый вместе с R5, образует вторую связь между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; (II) R3 представляет собой R3-3:R3-4 и R4 представляет собой R4-3:R4-4, где один из R3-3 и R3-4 представляет собой -O-R31, где R31 представляет собой C1-C3 алкил, другой из R3-3 и R3-4, взятый вместе с одним из R4-3 и R4-4, образует вторую связь между атомами углерода, к которым они присоединены, а другой из R4-3 и R4-4 представляет собой -H; R6 представляет собой R6-3:R6-4, где один из R6-3 и R6-4, взятый вместе с R5, образует вторую связь между атомами углерода, к которым они присоединены, а другой из R6-3 и R6-4 представляет собой -H; (III) R3 представляет собой -(CH2)-(CR33R34)n1-(CH2)-, где n1 равно 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6, взятый вместе с R5, образует вторую связь между атомами углерода, к которым они присоединены, а другой из R6-5 и R6-6 представляет собой -H; (IV) R3 представляет собой где R7-1 представляет собой молекулярный фрагмент формулы (-A1) или формулы (-A2) где X1 представляет собой: -S-, -O- или -NX1-1– и где X1-1 представляет собой: -H, C1-C4 алкил, -CO-OX1-2, где X1-2 представляет собой C1-C4 алкил или -CH2– -CO-X1-2, где X1-2 такой, как определено выше, -CO- -SO2-(C1-C3 алкил), -SO2– C1-C4 алкилами, C1-C4 алкокси; где Rb выбран из группы, содержащей -Н, C1-C4 алкил или фенил, необязательно замещенный 1 или 2 группами C1-C4 алкилами, C1-C4 алкокси, где Rc выбран из группы, содержащей: -H, C1-C4 алкил, C1-C4 алкокси, -O-Si(R)3, где R являются одинаковыми или различными, и представляют собой -H, C1-C4 алкил, – -F, -Cl, -Br, -I, -CO-OCH3 и -CO-Rc-1, где Rc-1 представляет собой C1-C4 алкил или – где Rd выбран из группы, содержащей -H, -C C1-C10 алкил; C1-C4 алкокси; -CH2-ORd-1, где Rd-1 представляет собой -H или C1-C4 алкил, -CH2-N(Rd-6)2, где два Rd-6 являются одинаковыми или различными и представляют собой: C1-C4 алкил, – -CO-Rd-6a, где Rd-6a представляет собой C1-C4 алкил или – -CH2-O-CO-Rd-1, где Rd-1 такой, как определено выше, -CH(ORd-1)2, где Rd-1 такой, как определено выше, и где два Rd-1, взятые вместе, представляют собой: -CH2-CH2-, -CH2-CH2-CH2-, -CH2-C(CH3-)2-CH2-, -CH(-O-CO-Rd-1)2, где Rd-1 такой, как определено выше, -Si(R)3, где R такой, как определено выше, -O-Si(R)3, где R такой, как определено выше, -Sn(Rb-1)3, где Rb-1 такой, как определено выше, -S-Rd-5, где Rd-5 представляет собой C1-C4 алкил или – -N(Rd-6)2, где Rd-6 такой, как определено выше, где Rc и Rd взяты вместе с атомами, к которым они присоединены, образуют
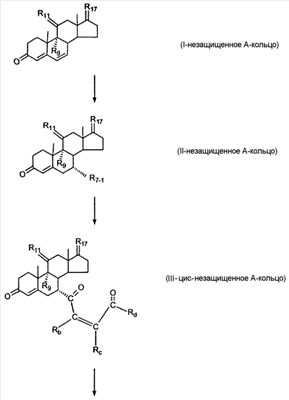
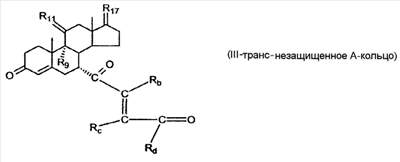
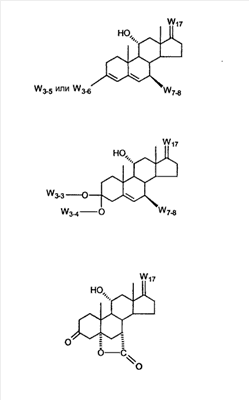
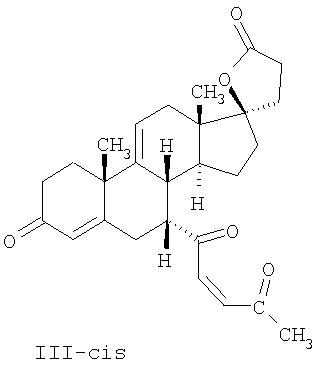
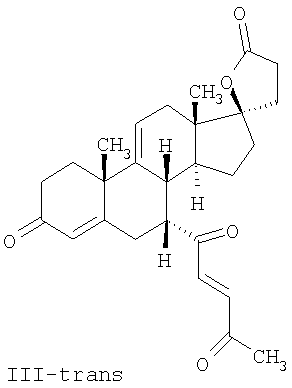
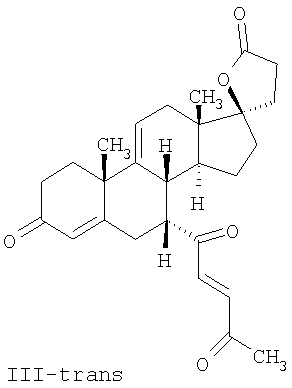
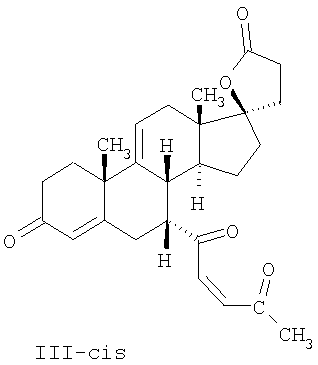
где E1 являются одинаковыми или различными и представляют собой: -H, C1-C4 алкил, F, -Cl, -Br, -I, -OE1-1, где E1-1 представляет собой: -H, C1-C4 алкил, – -SiE1-2E1-3E1-4, где E1-2, E1-3 и E1-4 являются одинаковыми или различными и представляют собой C1-C4 алкил или C1-C4 алкокси, -S-E1-5, где E1-5 представляет собой C1-C4 алкил или – -S-(O)1-2-E1-5, где E1-5 такой, как определено выше, -N(Rd-6)2, где два Rd-6 являются одинаковыми или различными и являются такими, как определено выше, -P(O)(O-E1-1)2, где E1-1 такой, как определено выше, -Si(R)3, где R такой, как определено выше; где E1 такой, как определено выше, и где M представляет собой: (1) =O, (2) =N-E2, где E2 выбран из группы, содержащей -H, C1-C4 алкил, C1-C4 алкенил, содержащий 1 или 2 двойные связи, C1-C4 алкинил, содержащий 1 тройную связей, -CO-OE2-1, где E2-1 представляет собой -H или C1-C4 алкил, -C(E2-1)2-OE2-2, где E2-1 являются одинаковыми или различными и являются такими, как определено выше, и где E2-2 представляет собой C1-C4 алкил, – -Si(R)3, где три R являются одинаковыми или различными и такие, как определены выше, -OE2-2, где E2-2 такой, как определено выше, -S-E2-3, где E2-3 представляет собой C1-C4 алкил или – -S-(O)1-2-E2-3, где E2-3 такой, как определено выше, -N(Rd-6)2, где два Rd6 являются одинаковыми или различными и такие, как определено выше; -Si(R)3, где три R такие, как определено выше; (3) =C(E2)2, где E2 являются одинаковыми или различными и являются такими, как определено выше, где E1 и E2 взяты вместе с атомами, к которым они присоединены, образуют кольцо, содержащее от 5 до 7 членов, необязательно содержащее от 3 до 5 -O-, -S-, -N=, -NX1-1-, где X1-1 такой, как определено выше, -CE2=, где E2 такой, как определено выше, -C(Rb)2-, где Rb такой, как определено выше, и необязательно содержащий 1 или 2 дополнительных двойных связей; где E2 такой, как определено выше; где R9 представляет собой: (1) -H, (2) -OH, (3) -O-(гидрокси-защитную группу), где гидрокси-защитная группа выбрана из группы, содержащей -Si(-CH3)3, -Si(-CH2-CH3)3, -CO-CH3, -CO-H и -SiH(CH3)2, (4) -F; где R11 представляет собой: (1) =O, (2) -H:-H, (3) (a) -H, (b) -O-R11-3, где R11-3 представляет собой: (i) -H, (ii) гидрокси-защитную группу, где гидрокси-защитная группа такая, как определено выше, и где R11-2 представляет собой: (a) -H, (b) -O-R11-4, где R11-4 представляет собой: (i) -H, (ii) гидрокси-защитную группу, где гидрокси-защитная группа такая, как определено выше, при условии, что один из R11-1 и R11-2 должен быть -H, (4) R11-5:R11-6, где один из R11-5 или R11-6 и R9 взяты вместе с R9, образуют вторичную связь между C-9 и C-11, и другой из R11-5 или R11-6 представляет собой -H, (5) где R17 представляет собой: (1) = O; (2) (a) -H, (b) -C (c) -C (d) -C (i) -H, (ii) -Si(R17-1-2)3, где R17-1-2 являются одинаковыми или различными и представляют собой C1-C4 алкил, (iii) 1-этоксиэтил, (iv) 2-тетрагидропиранил, (e) -C (f) -CH2-CH2-CH2-OH, (g) -CH2-CH2-CH2-O-(гидрокси-защитная группа), где гидрокси-защитная группа такая, как определено выше, (h) -CH2-CH2-CO-O и где R17-2 представляет собой -OH; (3) (a) -CO-CH3, (b) -CO-CH2-OH, (c) -CO-CH2-O-CO-(CH2)0-3-CH3; (4) (5) (6) -O-CH(OR17-9)-CH2-CH2 (7) -OH. Далее описан цис-ендион формулы (III-цис) и транс-ендион формулы (III-транс) где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взяты вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; (III) R3 представляет собой C1-C3 алкил и R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H; (IV) R3 представляет собой где R9, R11 R17 такие, как определено выше; где Rb выбран из группы, включающей -H, C1-C4 алкил или фенил, необязательно замещенный 1 или 2 группами C1-C4 алкил, C1-C4 алкокси, где Rc выбран из группы, включающей: -H, C1-C4 алкил, C1-C4 алкокси, -O-Si(R)3, где все R являются одинаковыми или различными и представляют собой -H, C1-C4 алкил, – -F, -Cl, -Br, -I, -CO-OCH3 и -CO-Rc-1, где Rc-1 представляет собой C1-C4 алкил или – где Rd выбран из группы, включающей -H, -C C1-C10 алкил; C1-C4 алкокси; -CH2-ORd-1, где Rd-1 представляет собой -H или C1-C4 алкил, -CH2-N(Rd-6)2, где два Rd-6 являются одинаковыми или различными и представляют собой: C1-C4 алкил, – -CO-Rd-6a, где Rd-6a представляет собой C1-C4 алкил или – -CH2-O-CO-Rd-1, где Rd-1 такой, как определено выше, -CH(ORd-1)2, где Rd-1 такой, как определено выше, и где два Rd-1, взятые вместе, представляют собой: -CH2-CH2-, -CH2-CH2-CH2-, -CH2-C(CH3-)2-CH2-, -CH(-O-CO-Rd-1)2, где Rd-1 такой, как определено выше, -Si(R)3, где R такой, как определено выше, -O-Si(R)3, где R такой, как определено выше, -Sn(Rb-1)3, где Rb-1 такой, как определено выше, -S-Rd-5, где Rd-5 представляет собой C1-C4 алкил или – -N(Rd-6)2, где Rd-6 такой, как определено выше, где Rc и Rd взяты вместе с атомами, к которым они присоединены, с образованием
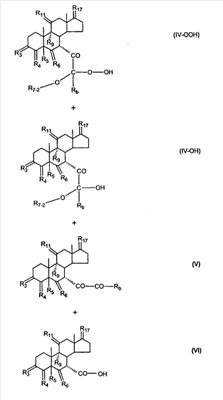
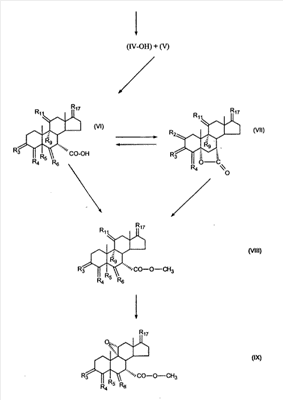
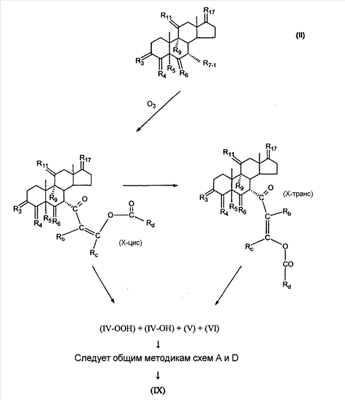
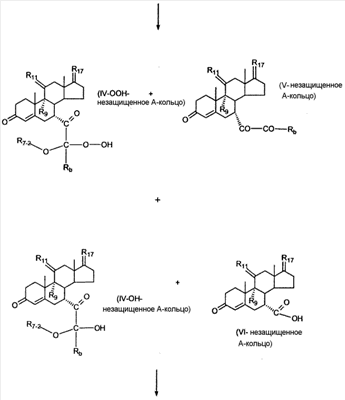
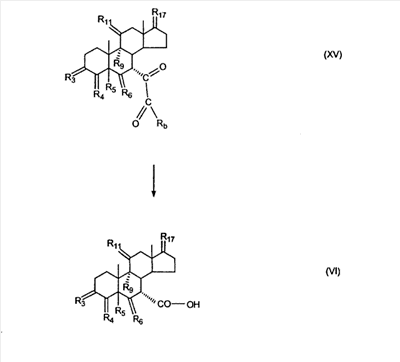
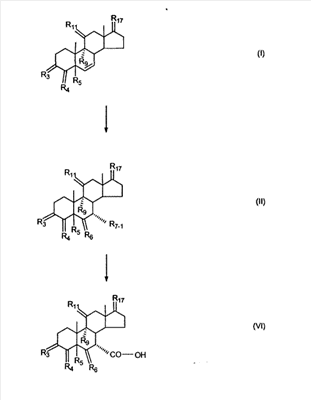
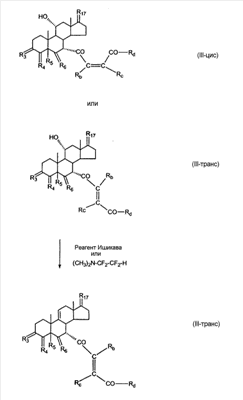
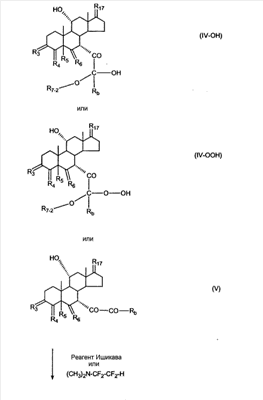
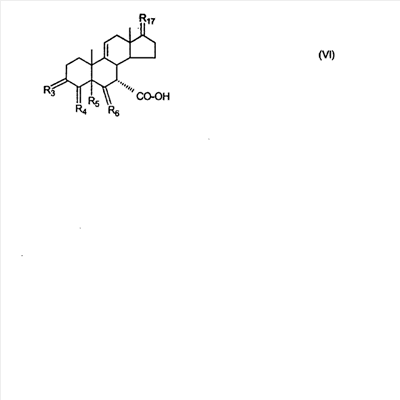
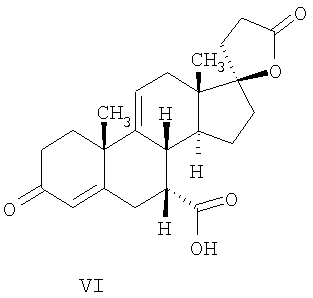
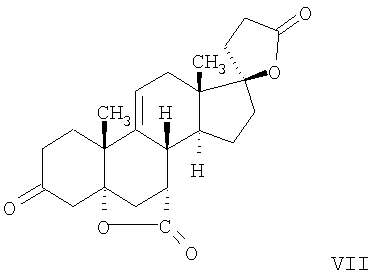
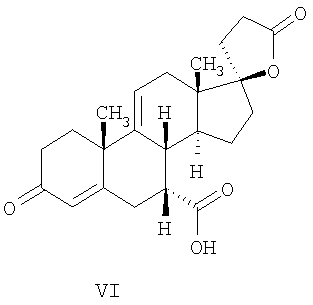
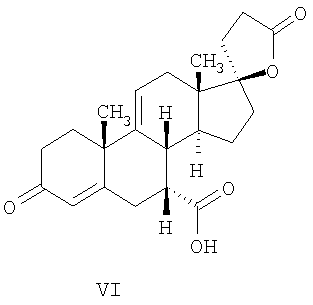
где E1 являются одинаковыми или различными и представляют собой: -H, C1-C4 алкил, -F, -Cl, -Br, -I, -OE1-1, где E1-1 представляет собой: -H, C1-C4 алкил, – -SiE1-2-E1-3E1-4, где E1-2-, E1-3 и E1-4 являются одинаковыми или различными и представляют собой C1-C4 алкил или C1-C4 алкокси, -S-E1-5, где E1-5 представляет собой C1-C4 алкил или – -S-(O)1-2-E1-5, где E1-5 такой, как определено выше, -N(Rd-6)2, Rd-6 являются одинаковыми или различными и являются такими, как определено выше, -P(O)(O-E1-1)2, где E1-1- такой, как определено выше, -Si(R)3, где R такой, как определено выше. Далее описано гидрокси-соединение формулы (IV-OH) и гидроперокси-соединение (IV-O-OH) где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс) и где R9, R11 R17 и Rb такие, как определено выше, и где R7-2 представляет собой -H и C1-C4 алкил, необязательно замещенный одним или двумя -OH. Описано бискарбонильное соединение формулы (V) где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 R17 и Rb такие, как определено выше. Также описан цис-оксиендион формулы (X-цис) и транс-ендион формулы (X-транс) где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 R17, Rb, Rc и Rd такие, как определено выше. Далее описан 7 где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 R17, Rb и Rd такие, как определено выше. Дополнительно описана 7 где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 R17 и Rb такие, как определено выше. Описан способ получения 7 где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H, и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; (II) R3 представляет собой R3-3:R3-4 и R4 представляет собой R4-3:R4-4, где один из R3-3 и R3-4 представляет собой -O-R31, где R31 представляет собой C1-C3 алкил, другой из R3-3 и R3-4 взят вместе с одним из R4-3 и R4-4 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R4-3 и R4-4 представляет собой -H; R6 представляет собой R6-3:R6-4, где один из R6-3 и R6-4 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-3 и R6-4 представляет собой -H; (III) R3 представляет собой
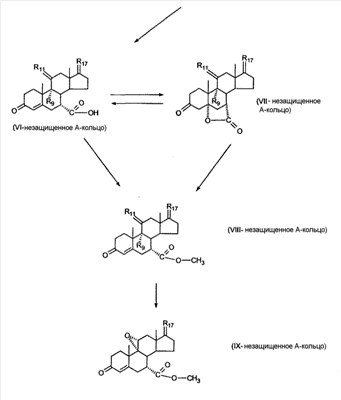
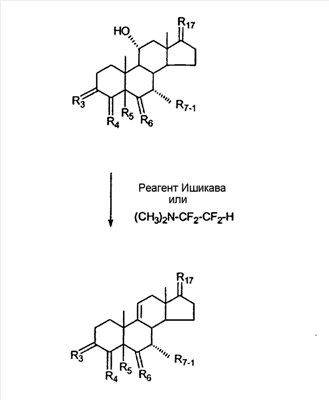
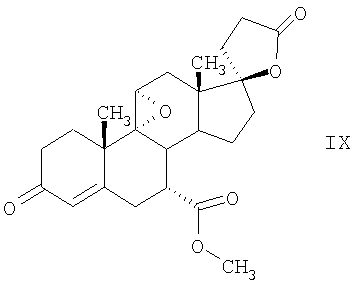
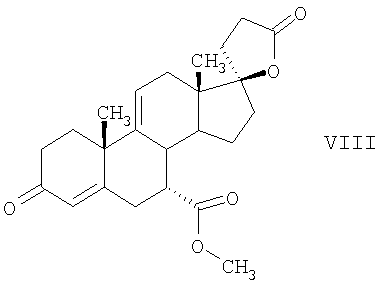
C1-C3 алкил, и R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H; (IV) R3 представляет собой где R7-1, R9, R11 и R17, такие, как определено выше; который включает: (1) взаимодействие где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H, и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; (I-кеталь) R3 представляет собой R3-9:R3-10, где R3-9 представляет собой -O-R31 и R3-10 представляет собой -O-R32, где R31 и R32 являются одинаковыми или различными и выбраны из группы, включающей C1-C3 алкил, и R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой R4-9:R4-10, где один из R4-9 и R4-10 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R4-9 и R4-10 представляет собой -H; где R9, R11 и R17 такие, как определено выше, аддуктом, выбранным из соединений (a) формулы (A) или где X1, Rb, Rc и Rd такие, как определено выше, и где Ra выбран из группы, включающей -H, -ZnL, -BL, -SiL3, -SnL3, -Cu, -CuL, -AlL2, -HgL, -Ag, -MgL, -Li и -COOH, где L представляет собой -OH, C1-C4 алкил, -F, -Cl, -Br, -I, -CN, -O(C1-C3 алкил), 2-тиенил, (CH3)2C(O-)-C(O-)C(CH3)2 и (b) формулы (A’) где Rb, Rc и Rd такие, как определено выше; (c) формулы (A”) где Re представляет собой: C1-C4 алкил, -CO-(C1-C4 алкил или – -Si(R)3, где R такой, как определено выше, и где X1, Rb, Rc и Rd такие, как определено выше; (d) формулы (B) где Ra, E1 и M такие, как определено выше; (e) формулы (C) где Ra и E2 такие, как определено выше; (f) формулы (D1, D2 и D3) где Ra такой, как определено выше, в присутствии: (1) кислоты Льюиса, (2) протонной кислоты с pKa, равным < приблизительно 5, или (3) соли вторичного амина формулы где: RS-2 представляет собой -H, C1-C4 алкил, – RS-3 представляет собой -H, C1-C4 алкил; RS-4 представляет собой -H, C1-C4 алкил, – RS-5 представляет собой -H, C1-C4 алкил, – и где RS-2 представляет собой -H, C1-C4 алкил, – RS-4 представляет собой -H, C1-C4 алкил, – RS-5 представляет собой -H, C1-C4 алкил, – с кислотой с pKa, равным < приблизительно 2. Также описан способ очистки 7 (1) кристаллизацию 7 Далее описан способ получения цис-ендиона формулы (III-цис) где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R7-1, R7-2, R9, R11, R17, Rb, Rc, Rd такие, как определено выше; который включает: (1) взаимодействие 7 где R3, R4, R5, R6, R7-1, R9, R11 и R17 такие, как определено выше; с агентом, выбранным из группы, включающей: (a) галогенирующий агент в присутствии воды и основания, конъюгированная кислота которого имеет pKa, равный > приблизительно 8, (b) подающий кислород агент, (c) электрохимическое окисление, (d) хинон в присутствии воды или (e) нехиноновые окислители. Далее описан способ получения транс-ендиона формулы (III-транс) где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11, R17, Rb, Rc и Rd такие, как определено выше; который включает: (1) взаимодействие цис-ендиона формулы (III-цис) где R3, R4, R5, R6, R9, R11, R17, Rb, Rc и Rd такие, как определено выше, с катализатором изомеризации, выбранным из группы, включающей: (a) сильную кислоту с pKa, равным < приблизительно 2; (b) третичный амин, конъюгированная кислота которого имеет pKa > приблизительно 8, и (c) соль третичного амина, конъюгированная кислота которого имеет pKa > приблизительно 8, (d) I2, (e) (C1-C4)3P, (f) (g) нагревание до приблизительно 80°. Описан способ получения гидрокси-соединения формулы (IV-OH) или гидроперокси-соединения формулы (IV-OOH) или бискарбонильного соединения формулы (V) или карбоновой кислоты формулы (VI) или их смеси, где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R7-2, R9, R11, R17, Rb такие, как определено выше; который включает: (1) взаимодействие цис-ендиона формулы (III-цис) или транс-ендиона формулы (III-транс) или их смеси, где R3, R4, R5, R6, R9, R11, R17, Rb, Rc и Rd такие, как определено выше, с озоном в присутствии спирта формулы R7-2-OH, где R7-2 такой, как определено выше. Также описан способ получения гидрокси-соединения формулы (IV-OH) где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R7-2, R9, R11, R17 и Rb такие, как определено выше; который включает: (1) взаимодействие гидроперокси-соединения формулы (IV-OOH) где R3, R4, R5, R6, R9, R11, R17, Rb и R7-2 такие, как определено выше, с гидроперокси-деокислительным агентом. Далее описан способ получения карбоновой кислоты формулы (VI) или ее фармацевтически приемлемой соли, где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 и R17 такие, как определено выше; который включает: (1) взаимодействие гидроперокси-соединения формулы (IV-OOH) где R3, R4, R5, R6, R9, R11, R1 Rb и R7-2 такие, как определено выше; с образующим карбоновую кислоту агентом, выбранным из группы, включающей: (a) теплоту, (b) основание, конъюгированная кислота которого имеет pKa, равный приблизительно 5 или выше, (c) кислоту, которая имеет pKa менее чем приблизительно 3, (d) ацилирующий агент. Далее описан способ получения карбоновой кислоты формулы (VI) где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 и R17 такие, как определено выше; который включает: (1) взаимодействие гидрокси-соединения формулы (IV-OH) или бискарбонильного соединения формулы (V) или их смеси, где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11, R17 и Rb такие, как определено выше; с агентом окислительного отщепления. Описан способ получения 5,7-лактона формулы (VII) где (Va) R2 представляет собой -H:-H; R3 представляет собой = O; R4 представляет собой -H:-H; (Vb) R2 представляет собой -H:-H; R3 представляет собой R3a:R3b, где оба R3a и R3b представляют собой -OH и R4 представляет собой -H:-H; где R9, R11 и R17 такие, как определено выше; который включает: (1) взаимодействие карбоновой кислоты формулы (VI) где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; (III) R3 представляет собой C1-C3 алкил, и R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H; (IV) R3 представляет собой где R9, R11 и R17 такие, как определено выше; с реакционной средой, которая имеет pH менее чем приблизительно 5. Также описан способ получения 5,7-лактона формулы (VII) где (Va) R2 представляет собой -H:-H, R3 представляет собой =O и R4 представляет собой -H:-H; где R9, R11 и R17 такие, как определено выше; который включает: (1) взаимодействие карбоновой кислоты формулы (VI) где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; где R9, R11 и R17 такие, как определено выше; в безводных условиях с безводной реакционной средой при pH менее чем приблизительно 5. Описан способ получения 5,7-лактона формулы (VII) где (Vc) R2 представляет собой -H:-H, R3 представляет собой -O-R3a:-O-R3b, где R3a и R3b одинаковы и представляют собой C1-C3 алкил, или где R3a и R3b взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил и R4 представляет собой -H:-H; (VI) R2 представляет собой -H:-H; R3 представляет собой R3c:R3d и R4 представляет собой R4c:R4d, где один из R3c и R3d взят с одним из R4c или R4d с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R3c и R3d представляет собой CH3-O- или C2H5-O-; и другой из R4c и R4d представляет собой -H; или (VII) R2 представляет собой R2e:R2f и R3 представляет собой R3e:R3f, где один из R2e и R2f взят с одним из R3e или R3f с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R2e и R2f представляет собой -H, и другой из R3e и R3f представляет собой CH3-O- или C2H5-O-; или смесь; где R9, R11 и R17 такие, как определено выше; где (III) R3 представляет собой C1-C3 алкил, и R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H; (IV) R3 представляет собой где R9, R11 и R17 такие, как определено выше; с по меньшей мере каталитическим количеством кислоты. Описан способ получения сложного метилового эфира формулы (VIII) где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; где R9, R11 и R17 такие, как определено выше; который включает: (1) взаимодействие 5,7-лактона формулы (VII) где R4 представляет собой -H:-H и где R3, R9, R11 и R17 указаны выше, с основанием, и (2) взаимодействие реакционной смеси со стадии (1) с метилирующим агентом. Также описан способ получения карбоновой кислоты формулы (VI) или ее фармацевтически приемлемых солей, где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; где R9, R11, R17 такие, как определено выше; который включает: (1) взаимодействие 5,7-лактона формулы (VII) где R4 представляет собой -H:-H; и где R3, R9, R11 и R17 такие, как определено выше, с реакционной средой, которая имеет pH > 7. Далее описан способ получения цис-оксиендиона формулы (X-цис) где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11, R17, Rb, Rc и Rd такие, как определено выше; который включает: (1) взаимодействие 7 где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R7-1, R9, R11 и R17 такие, как определено выше; с озоном в присутствии C1-C4 спирта, и (2) взаимодействие смеси со стадии (1) с гидроперокси-деокислительным агентом. Далее описан способ получения транс-оксиендиона формулы (X-транс) где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11, R17, Rb, Rc и Rd такие, как определено выше; который включает: (1) взаимодействие цис-оксиендиона формулы (X-цис) где R3, R4, R5, R6, R9, R11, R17, Rb, Rc и Rd такие, как определено выше, с катализатором изомеризации, выбранным из группы, включающей: (a) сильную кислоту с pKa, равным < приблизительно 2; (b) третичный амин, конъюгированная кислота которого имеет pKa > приблизительно 8, и (c) соль третичного амина, конъюгированная кислота которого имеет pKa > приблизительно 8, (d) I2, (e) (C1-C4)3P, (f) (g) нагревание до приблизительно 80°. Описан способ получения гидрокси-соединения формулы (IV-OH) где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R7-2, R9, R11, R17 и Rb такие, как определено выше; или гидроперокси-соединения формулы (IV-OOH) где R3, R4, R5, R6, R7-2, R9, R11, R17 и Rb такие, как определено выше, или бискарбонильного соединения формулы (V) где R3, R4, R5, R6, R9, R11, R17 и Rb такие, как определено выше, или карбоновой кислоты формулы (VI) где R3, R4, R5, R6, R9, R11 и R17 такие, как определено выше, или его смеси, которая включает: (1) взаимодействие оксиендиона формулы (X-цис) где R3, R4, R5, R6, R9, R11, R17, Rb, Rc и Rd такие, как определено выше, или оксиендиона формулы (X-транс) где R3, R4, R5, R6, R9, R11, R17, Rb, Rc и Rd такие, как определено выше, или их смеси с озоном в присутствии спирта формулы R7-2-OH, где R7-2 такой, как определено выше. Также описан способ получения карбоновой кислоты формулы (VI) или его соли, где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 и R17 такие, как определено выше; который включает: (1) взаимодействие 7 где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R7-1, R9, R11 и R17 такие, как определено выше; с агентом, выбранным из группы, включающей: (a) галогенирующий агент в присутствии воды и основания, конъюгированная кислота которого имеет pKa, равную > приблизительно 8, (b) подающий кислород агент, (c) электрохимическое окисление, (d) хинон в присутствии воды или (e) нехиноновые окислители; и (2) взаимодействие реакционной смеси со стадии (1) с озоном в присутствии спирта формулы R7-2-OH, где R7-2 такой, как определено выше; (3) взаимодействие реакционной смеси со стадии (2) с гидроперокси-деокислительным агентом, и (4) взаимодействие реакционной смеси со стадии (3) с агентом окислительного отщепления. Описан способ получения карбоновой кислоты формулы (VI) или его соли, где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 и R17 такие, как определено выше; который включает: (1) взаимодействие 7 где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R7-1, R9, R11, R17 такие, как определено выше (1) с озоном в присутствии спирта формулы R7-2-OH, где R7-2 такой, как определено выше; (2) взаимодействие реакционной смеси со стадии (1) с гидроперокси-деокислительным агентом, и (3) взаимодействие реакционной смеси со стадии (2) с агентом окислительного отщепления. Также описан способ получения карбоновой кислоты формулы (VI) где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11 и R17 такие, как определено выше, который включает: (1) взаимодействие цис-оксиендиона формулы (X-цис) или транс-оксиендиона формулы (X-транс) или их смеси, где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R9, R11, R17, Rb, Rc и Rd такие, как определено выше, с агентом окислительного отщепления. Также описан способ получения который включает: (1) взаимодействие 11 с N-фторалкиламиновым реагентом формулы (CVI) где: Z1 представляет собой C1-C4 алкил; Z2 представляет собой C1-C4 алкил, и где Z1 и Z2 вместе с присоединенным атомом азота образуют 5- или 6-членный гетероцикл, выбранный из группы, включающей пирролидинил, пиперазинил, пиперидинил и морфолинил; Z3 представляет собой -F или -CF3. Далее описан способ получения где W5 представляет собой: (1) отсутствует, когда есть двойная связь между C4 и C5; (2) W6 представляет собой W6-1:W6-2, где один из W6-1 или W6-2 взят вместе с W5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из W6-1 и W6-2 представляет собой -H; (3) W5 представляет собой где W6 представляет собой: (1) -H;-H; (2) представляет собой W6-3:W6-4, где один из W6-3 и W6-4 взят вместе с W5 с образованием двойной связи между C-5 и C-6 и другой из W6-3 и W6-4 представляет собой -H; (3) представляет собой W6-3:W6-4 и W7 представляет собой W7-3:W7-4, где один из W6-3 и W6-4 взят вместе с одним из W7-3 или W7-4 с образованием двойной связи между C-6 и C-7, другой из W6-3 и W6-4 представляет собой -H, другой из W7-3 и W7-4 представляет собой -H; где W7 представляет собой: (1) (a) -H, (b) -C (c) -C (d) -CH=CH-CH3, (e) -CO-OH, (f) -CO-OW7-5A, где W7-5A представляет собой: (i) C1-C4 алкил, (ii) – (g) – (h) -CO-SW7-5A, где W7-5A такой, как определено выше, (i) -CO-CH=CH-O-CO-W7-5A, где W7-5A такой, как определено выше, (j) -CO-CO-H, (k) -CH2-NO2, (l) -S-CO-W7-5A, где W7-5A такой, как определено выше, (m) 5-метилфур-2-ил, (n) 5-трет-бутилфур-2-ил, и W7-6 представляет собой -H; (3) (a) -H, (b) -O-CO-(C1-C4 алкил), (c) -O-CO-OW7-8A, где W7-8A представляет собой: (i) C1-C4 алкил, (ii) – (iii) -CH2– (1) взаимодействие 11 где W5, W6 и W7 такие, как определено выше, с N-фторалкиламинным реагентом формулы (CVI) где: Z1 представляет собой C1-C4 алкил; Z2 представляет собой C1-C4 алкил и где Z1 и Z2 вместе с присоединенным атомом азота образуют 5- или 6-членный гетероцикл, выбранный из группы, включающей пирролидинил, пиперазинил, пиперидинил и морфолинил; Z3 представляет собой -F или -CF3. Далее описан способ получения где R17 представляет собой (1) =O; (3) (a) -CO-CH3, (b) -CO-CH2-OH, (c) -CO-CH2-O-CO-(CH2)0-3-CH3; (4) (5) (6) -O-CH(OR17-9)-CH2-CH2 (7) -(CH2)1-2-CH=CH2 и R17-12 представляет собой -OH; где R3, R4, R5 и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс) и где R7-1 такой, как определено выше, который включает взаимодействие 11 где R3, R4, R5, R6 R7-1 и R17 такие, как определено выше, с N-фторалкиламиновым реагентом формулы (CVI). Описан способ получения где R17 представляет собой: (1) =O; (3) (a) -CO-CH3, (b) -CO-CH2-OH, (c) -CO-CH2-O-CO-(CH2)0-3-CH3; (4) (5) (6) -O-CH(OR17-9)-CH2-CH2 (7) -(CH2)1-2-CH=CH2 и R17-12 представляет собой -OH; где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где Rb, Rc и Rd такие, как определено выше, который включает взаимодействие 11 или 11 где R3, R4, R5, R6, R17, Rb, Rc и Rd такие, как определено выше, с N-фторалкиламинным реагентом формулы (CVI). Также описан способ получения или его соли, где R17 представляет собой: (1) =O; (3) (a) -CO-CH3, (b) -CO-CH2-OH, (c) -CO-CH2-O-CO-(CH2)0-3-CH3; (4) (5) (6) -O-CH(OR17-9)-CH2-CH2 (7) -(CH2)1-2-CH=CH2 и R17-12 представляет собой -OH; где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендион (III-цис) и (III-транс), который включает (1) взаимодействие 11 или 11 или 11 где R3, R4, R5, и R6 такие, как описано для цис- и транс-ендиона (III-цис) и (III-транс), и где R7-2, R17 и Rb, такие, как определено выше, с N-фторалкиламинным реагентом формулы (CVI), и (2) взаимодействие реакционной смеси со стадии (1) с агентом окислительного отщепления. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Эплеренон представляет собой 9 На СХЕМЕ А представлен общий способ по изобретению, когда аддукт находится в 7 -R7-1 представляет собой (-A2). На СХЕМЕ H представлен общий способ по изобретению, когда -R7-1 представляет собой (-B), (-C), (-D1), (-D2) или (-D3). Первой стадией в способе по СХЕМЕ A является получение 7 где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; (II) R3 представляет собой R3-3:R3-4 и R4 представляет собой R4-3:R4-4, где один из R3-3 и R3-4 представляет собой -O-R31, где R31 представляет собой C1-C3 алкил, другой из R3-3 и R3-4 взят вместе с одним из R4-3 и R4-4 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R4-3 и R4-4 представляет собой -H; R6 представляет собой R6-3:R6-4, где один из R6-3 и R6-4 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-3 и R6-4 представляет собой -H; (III) R3 представляет собой C1-C3 алкил, и R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H; (IV) R3 представляет собой где R7-1 представляет собой фрагмент молекулы формулы (-A1) или формулы (-A2) где X1 представляет собой: -S-, -O- или -NX1-1– и где X1-1 представляет собой: -H, C1-C4 алкил, -CO-OX1-2, где X1-2 представляет собой C1-C4 алкил или -CH2– -CO-X1-2, где X1-2 такой, как определено выше, -CO- -CO-O-(C1-C4 алкил), -SO2-(C1-C3 алкил), -SO2– C1-C4 алкил, C1-C4 алкокси; где Rb выбран из группы, включающей -H, C1-C4 алкил или фенил, необязательно замещенный 1 или 2 группами C1-C4 алкил, C1-C4 алкокси, где Rc выбран из группы, включающей: -H, C1-C4 алкил, C1-C4 алкокси, -O-Si(R)3, где все R являются одинаковыми или различными и представляют собой -H, C1-C4 алкил, – -F, -Cl, -Br, -I, -CO-OCH3 и -CO-Rc-1, где Rc-1 представляет собой C1-C4 алкил или – где Rd выбран из группы, включающей -H, -C C1-C10 алкил; C1-C4 алкокси; -CH2-ORd-1, где Rd-1 представляет собой -H или C1-C4 алкил, -CH2-N(Rd-6)2, где два Rd-6 являются одинаковыми или различными и представляют собой: C1-C4 алкил, – -CO-Rd-6a, где Rd-6a представляет собой C1-C4 алкил или – -CH2-O-CO-Rd-1, где Rd-1 такой, как определено выше, -CH(ORd-1)2, где Rd-1 такой, как определено выше, и где два Rd-1, взятые вместе, представляют собой: -CH2-CH2-, -CH2-CH2-CH2-, -CH2-C(CH3-)2-CH2-, -CH(-O-CO-Rd-1)2, где Rd-1 такой, как определено выше, -Si(R)3, где R такой, как определено выше, -O-Si(R)3, где R такой, как определено выше, -Sn(Rb-1)3, где Rb-1 такой, как определено выше, -S-Rd-5, где Rd-5 представляет собой C1-C4 алкил или – -N(Rd-6)2, где Rd-6 такой, как определено выше, где Rc и Rd взяты вместе с атомами, к которым они присоединены, с образованием
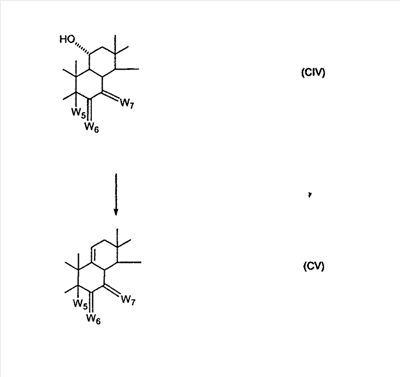
где E1 являются одинаковыми или различными и представляют собой: -H, C1-C4 алкил, -F, -Cl, -Br, -I, -OE1-1, где E1-1 представляет собой: -H, C1-C4 алкил, – -SiE1-2-E1-3E1-4, где E1-2-, E1-3 и E1-4 являются одинаковыми или различными и представляют собой C1-C4 алкил или C1-C4 алкокси, -S-E1-5, где E1-5 представляет собой C1-C4 алкил или – -S-(O)1-2-E1-5, где E1-5 такой, как определено выше, -N(Rd-6)2, где два Rd-6 являются одинаковыми или различными и являются такими, как определено выше, -P(O)(O-E1-1)2, где E1-1 такой, как определено выше, -Si(R)3, где R такой, как определено выше; где E1 такой, как определено выше, и где M представляет собой: (1) =O, (2) =N-E2, где E2 выбран из группы, включающей -H C1-C4 алкил, C1-C4 алкенил, содержащий 1 или 2 двойные связи, C1-C4 алкинил, содержащий 1 тройную связь, -CO-OE2-1, где E2-1 представляет собой -H или C1-C4 алкил, -C(E2-1)2-OE2-2, где E2-1 являются одинаковыми или различными и являются такими, как определено выше, и где E2-2 представляет собой C1-C4 алкил, – -Si(R)3, где три R являются одинаковыми или различными и являются такими, как определено выше, -OE2-2, где E2-2 такой, как определено выше, -S-E2-3, где E2-3 представляет собой C1-C4 алкил или – -S-(O)1-2-E2-3, где E2-3 такой, как определено выше, -N(Rd-6)2, где два Rd6 являются одинаковыми или различными и являются такими, как определено выше; -Si(R)3, где три R такие, как определено выше; (3) =C(E2)2, где E2 являются одинаковыми или различными и являются такими, как определено выше, где E1 и E2 взяты вместе с атомами, к которым они присоединены, с образованием кольца, содержащего от 5 до 7 членов, необязательно, содержащий от 3 до 5 -O-, -S-, -N=, -NX1-1-, где X1-1 такой, как определено выше, -CE2=, где E2 такой, как определено выше, -C(Rb)2-, где Rb такой, как определено выше, и, необязательно, содержащий 1 или 2 дополнительные двойные связи; где E2 такой, как определено выше; где R9 представляет собой: (1) -H, (2) -OH, (3) -O-(гидрокси-защитная группа), где гидрокси-защитная группа выбрана из группы, включающей -Si(-CH3)3, -Si(-CH2-CH3)3, -CO-CH3, -CO-H и -SiH(CH3)2, (4) -F; где R11 представляет собой: (1) =O, (2) -H:-H, (3) (a) -H, (b) -O-R11-3, где R11-3 представляет собой: (i) -H, (ii) гидрокси-защитная группа, где гидрокси-защитная группа такая, как определено выше, и где R11-2 представляет собой: (a) -H, (b) -O-R11-4, где R11-4 представляет собой: (i) -H, (ii) гидрокси-защитная группа, где гидрокси-защитная группа такая, как определено выше, при условии, что один из R11-1 и R11-2 должен представлять собой -H, (4) R11-5:R11-6, где один из R11-5 или R11-6 и R9 взяты вместе с R9 с образованием второй связи между C-9 и C-11 и другой из R11-5 или R11-6 представляет собой -H, (5) где R17 представляет собой: (1) =O; (2) (a) -H, (b) -C (c) -C (d) -C (i) -H, (ii) -Si(R17-1-2)3, где R17-1-2 являются одинаковыми или различными и представляют собой C1-C4 алкил, (iii) 1-этоксиэтил, (iv) 2-тетрагидропиранил, (e) -C (f) -CH2-CH2-CH2-OH, (g) -CH2-CH2-CH2-O-(гидрокси-защитная группа), где гидрокси-защитная группа такая, как определено выше, (h) -CH2-CH2-CO-O- и где R17-2 представляет собой -OH; (3) (a) -CO-CH3, (b) -CO-CH2-OH, (c) -CO-CH2-O-CO-(CH2)0-3-CH3; (4) (5) (6) -O-CH(OR17-9)-CH2-CH2 (7) -(CH2)1-2-CH=CH2 и R17-12 представляет собой -OH; который включает: (1) взаимодействие где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H, и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; (I-кеталь) R3 представляет собой R3-9:R3-10, где R3-9 представляет собой -O-R31 и R3-10 представляет собой -O-R32, где R31 и R32 являются одинаковыми или различными и выбраны из группы, включающей C1-C3 алкил, и R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой R4-9:R4-10, где один из R4-9 и R4-10 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R4-9 и R4-10 представляет собой -H; где R9, R11 и R17 такие, как определено выше, аддуктом, выбранным из соединений (a) формулы (A) или где X1, Rb, Rc и Rd такие, как определено выше, и где Ra выбран из группы, включающей -H, -ZnL, -BL, -SiL3, -SnL3, -Cu, -CuL, -AlL2, -HgL, -Ag, -MgL, -Li и -COOH, где L представляет собой -OH, C1-C4 алкил, -F, -Cl, -Br, -I, -CN, -O(C1-C3 алкил), 2-тиенил, (CH3)2C(O-)-C(O-)C(CH3)2 и (b) формулы (A’) где Rb, Rc и Rd такие, как определено выше; (c) формулы (A”) где Re представляет собой: C1-C4 алкил, -CO-(C1-C4 алкил или – -Si(R)3, где R такой, как определено выше, и где X1, Rb, Rc и Rd такие, как определено выше; (d) формулы (B) где Ra, E1 и M такие, как определено выше; (e) формулы (C) где Ra и E2 такие, как определено выше; (f) формулы (D1, D2 и D3) где Ra такой, как определено выше, в присутствии: (1) кислоты Льюиса, (2) протонной кислоты с pKa, равным < приблизительно 5, или (3) соли вторичного амина формулы где RS-2 представляет собой -H, C1-C4 алкил, – RS-3 представляет собой -H, C1-C4 алкил; RS-4 представляет собой -H, C1-C4 алкил, – RS-5 представляет собой -H, C1-C4 алкил, – и где RS-2 представляет собой -H, C1-C4 алкил, – RS-4 представляет собой -H, C1-C4 алкил, – RS-5 представляет собой -H, C1-C4 алкил, – с кислотой, имеющей pKa, равный < приблизительно 2. Для Для 7 R31 представляет собой C1-C3 алкил, другой из R3-3 и R3-4 взят вместе с одним из R4-3 и R4-4 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R4-3 и R4-4 представляет собой -H; R6 представляет собой R6-3:R6-4, где один из R6-3 и R6-4 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-3 и R6-4 представляет собой -H; представляет собой Для 7 (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; (III) R3 представляет собой -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H; (III) R3 представляет собой -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 1 и R33 и R34 оба представляют собой C1 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H. Для 7 (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H, и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H. Что касается стероидного C-кольца, то является предпочтительным, когда R9 и R11 представляют собой: (a) R11 представляет собой R11-5:R11-6, где один из R11-5 или R11-6 и R9 взят вместе с R9 с образованием второй связи между C-9 и C-11 и другой из R11-5 или R11-6 представляет собой -H, (b) (c) R9 представляет собой -H и R11 представляет собой (a) R11 представляет собой R11-5:R11-6, где один из R11-5 или R11-6 и R9 взят вместе с R9 с образованием второй связи между C-9 и C-11 и другой из R11-5 или R11-6 представляет собой -H. Что касается стероидного D-кольца, то является предпочтительным, когда R17 выбран из группы, включающей: (a) (b) =O; (c) (d) -C Что касается 7 -ZnL представляет собой -Cl, -Br, -I; -BL представляет собой катехолат, два -OH, HO-CH2-CH2-OH, HO-CH2-CH2-CH2-OH, HO-CH2-C(CH3)2-CH2-OH; -SiL3 представляет собой C1 алкил; -SnL3 представляет собой C1 или н-C4 алкил; -CuL представляет собой 2-тиенил или -CN и -AlL2 представляет собой C1-C2 алкил. Когда Ra представляет собой Cu, тогда могут быть две Ra группы для одного Cu, в этом случае Cu является анионным. Предпочтительные значения заместителей R3, R4, R5, R6, R7-1, R9, R11, R17, Ra, Rb, Rc, Rd и X1 являются предпочтительными не столько для Является предпочтительным, когда кислотный реагент представляет собой кислоту Льюиса. Кислота Льюиса должна быть достаточно электрофильной, чтобы образовывать комплекс с BX3, AlX3, SnX2, SnX4, SiX4, MgX2, ZnX2, TiX4, Rh(acac)(CH2CH2)2(2,2′-бис(дифенилфосфино)-1,1′-бинафтил), Rh(CH3-C Rh(acac)(CH2CH2)2(dppb), LiClO4, K10 Монтмориллонитовый клей, Yb(OTf)3, LiCo(B9C2H11)2, PdX2, CrX3, FeX3, CoX3, NiX2, SbX5, InX3, Sc(OTf)3,
(R)3SiX, где R представляет собой C1-C4 алкил и – Pd(CH3-CO-O–)2; комплекс BF3-диэтиловый эфир; комплекс BF3-уксусная кислота; комплекс BF3-метил-трет-бутиловый эфир; комплекс BF3-ди-н-бутиловый эфир; комплекс BF3-диметиловый эфир; комплекс BF3-диметилсульфид; комплекс BF3-фенол; комплекс BF3-фосфорная кислота и комплекс BF3-тетрагидрофуран. Является предпочтительным, когда кислота Льюиса выбрана из группы, включающей BF3, комплекс BF3-диэтиловый эфир, комплекс BF3-уксусная кислота, комплекс BF3-метил-трет-бутиловый эфир, комплекс BF3-ди-н-бутиловый эфир, комплекс BF3-диметиловый эфир, комплекс BF3-диметилсульфид, комплекс BF3-фенол, комплекс BF3-фосфорная кислота и комплекс BF3-тетрагидрофуран. Более предпочтительно, когда кислота Льюиса представляет собой BF3-диэтилэфират. Он является даже еще более предпочтительным, чем BF3-диэтилэфират, и используется в присутствии C1-C3 спирта, и еще более предпочтительным является использование BF3-диэтилэфирата в присутствии C2 спирта. Используемые кислоты с pKa, равным < приблизительно 5, выбраны из группы, включающей муравьиную кислоту, уксусную кислоту, пропионовую кислоту, бензойную кислоту, сернистую кислоту, фтористоводородную кислоту, фторборную кислоту, п-толуолсульфоновую кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту, трифторметансульфоновую кислоту, перхлорную кислоту, трифторуксусную и трихлоруксусную кислоты. Является предпочтительным, когда кислота с pKa, равным < приблизительно 5, представляет собой уксусную кислоту. Когда осуществляют преобразование C1-C6 спирты, смесь растворителей из C1-C6 спиртов и растворитель, выбранный из группы, включающей ацетонитрил, нитрометан, толуол, метиленхлорид и уксусную кислоту. Один фактор следует учесть при выборе кислоты Льюиса и растворителя – это чувствительность кислоты к 7 Используемые 7 17 11 9 17 11 11 11 7 По сравнению с использованием 7 Следующая стадия в способе по СХЕМЕ A представляет собой преобразование 7 (a) галогенирующий агент в присутствии воды и основания, конъюгированная кислота которого имеет pKa, равный > приблизительно 8, (b) подающий кислород агент, (c) электрохимическое окисление, (d) хинон в присутствии воды или (e) нехиноновые окислители. Является предпочтительным, когда агент представляет собой галогенирующий агент. Используемые галогенирующие агенты включают такие, которые выбраны из группы, включающей дибромдиметилгидантоин, дихлордиметилгидантоин, дийоддиметилгидантоин, н-хлорсукцинамид, н-бромсукцинамид, н-йодсукцинамид, трихлоризоциануроновую кислоту, трет-бутилгипохлорит и 3-бром-1-хлор-5,5-диметилгидантоин; является предпочтительным, когда галогенирующий агент представляет собой дибромдиметилгидантоин. Когда используемый галогенирующий агент берется в количестве, которое должно составлять по меньшей мере один эквивалент галогенирующего агента; предпочтительно используют от приблизительно 1,0 до приблизительно 1,05 эквивалентов галогенирующего агента. Более предпочтительно, когда количество галогенирующего агента составляет приблизительно 1,01 эквивалентов. Дело в том, что требуется один эквивалент для завершения реакции, и любой избыток необходимо гасить. Подходящие гасящие агенты включают бисульфит, изобутилвиниловый эфир, 2-метилфуран и гипофосфорную кислоту. Используемые агенты, отдающие кислород, включают такие, которые выбраны из группы, включающей: перкислоту, синглетный кислород с последующими либо фосфитом, либо тиомочевиной, триплетный кислород, пероксид водорода с кетоном, выбранным из группы, включающей Q4-CO-Q5, где Q4 и Q5 являются одинаковыми или различными и представляют собой: C1-C4 алкил, необязательно замещенный от 1 до 9 -Cl или -F, и где Q4 и Q5 взяты вместе с присоединенным атомом углерода с образованием циклического кетона, содержащего от 5 до 7 членов и кетонов формулы: и пероксид водорода в сочетании с метилтриоксорением, трихлорацетонитрил/пероксид водорода, трихлорацетамид/пероксид водорода, DDQ/вода, п-хлоранил/вода,
(a) пербензойную кислоту, необязательно замещенную 1 или 2 -Cl или -NO2, (b) перкарбоновые кислоты формулы Cn2(Q6)2n2+1-CO3H, где n2 представляет собой от 1 до 4 и Q6 представляет собой -H, -Cl или -F, (c) перфталевую кислоту и (d) магния пероксифталат. Имеющийся избыток агента, отдающего кислород, также должен быть погашен, как это делается для галогенирующих агентов. Основание требуется для нейтрализации кислоты, образуемой в процессе преобразования 7 В способе по СХЕМЕ A цис-ендион (III-цис) может быть преобразован в соответствующий транс-ендион (III-транс) или он может быть преобразован в перокси-соединение (IV-OOH), гидрокси-соединение (IV-OH), бискарбонильное соединение (V), или карбоновую кислоту (VI), или их смесь. Когда используется термин «карбоновая кислота (VI)», то касается и охватывает ее фармацевтически приемлемые соли. Такие соли включают соли натрия, калия, лития, магния, тетрабутиламмония и соли карбоновой кислоты с DBU, тетраметилгуанидином, триэтиламином и другими. Тип конкретного катиона не является важным, поскольку в конце концов он удаляется, когда образуется кислота, которая в конечном счете представляет собой сложный метиловый эфир (VIII) и эплеренон (IX), для которого требуется сложный метиловый эфир в 7 Когда цис-ендион (III-цис) преобразуют в соответствующий транс-ендион (III-транс), цис-ендион (III-цис) подвергают взаимодействию с катализатором изомеризации, которым может быть любой химический агент, включая: (a) сильную кислоту с pKa, равным < приблизительно 2; (b) третичный амин, конъюгированная кислота которого имеет pKa > приблизительно 8, и (c) соль третичного амина, конъюгированная кислота которого имеет pKa > приблизительно 8, (d) I2, (e) (C1-C4)3P, (f) (g) нагревание до приблизительно 80°. Является предпочтительным, когда катализатор изомеризации представляет собой сильную кислоту с pKa, равным < приблизительно 2. Когда катализатор изомеризации представляет собой сильную кислоту с pKa, равным < приблизительно 2, используемые сильные кислоты с pKa, равным < приблизительно 2, включают такие, которые выбраны из группы, включающей хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, фтористоводородную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту, трихлоруксусная кислоту и трифторуксусную кислоту, является предпочтительным, когда сильная кислота с pKa, равным < приблизительно 2, представляет собой хлористоводородную кислоту. Когда катализатор изомеризации представляет собой сильную кислоту с pKa, равным < приблизительно 2, является предпочтительным, когда его применяют в безводной форме или используют в виде водной смеси, таким образом, реакцию осуществляют в виде двухфазной системы с отделяемой водной фазой. Когда катализатор изомеризации представляет собой третичный амин, конъюгированная кислота которого имеет pKa > приблизительно 8, используемые третичные амины, конъюгированная кислота которых имеет pKa > приблизительно 8, включают такие, которые выбраны из группы, включающей (Q3)3N, где Q3 представляет собой C1-C3 алкил, DBU, DBN, DABCO, пиридин, п-диметиламинопиридин и пирролидинилпиридин. Когда катализатор изомеризации представляет собой соль третичного амина, конъюгированная кислота которого имеет pKa > приблизительно 8, является предпочтительным, когда соль третичного амина, конъюгированная кислота которого имеет pKa > приблизительно 8, представляет собой пиридин гидрохлорид. Независимо от того, какой химический агент используется, требуется только каталитическое количество. Например, после образования цис-ендиона (III-цис) для осуществления преобразования в соответствующий транс-ендион (III-транс) является достаточным только добавление имеющегося в продаже хлороформа, содержащего обычные примеси хлористоводородной кислоты, см. ПРИМЕР 4, Часть 2. Изомеризация цис-ендиона (III-цис) в соответствующий транс-ендион (III-транс) может быть осуществлена при 20-25° (комнатная температура). При комнатной температуре реакция протекает обычным образом. Представляется необходимым отслеживать протекание реакции обычными способами, такими как ЖХ или ТЖХ, чтобы обеспечить не слишком длительное ее протекание. Если реакция протекает слишком долго, то происходит преобразование 7 По способу СХЕМЫ A следующая стадия представляет собой преобразование либо цис-ендиона (III-цис), или транс-ендиона (III-транс), или их смеси в соответствующее гидроперокси (IV-OOH) соединение, гидрокси (IV-OH) соединение, бискарбонильное (V) соединение и/или карбоновую кислоту (VI) или их смеси. Цис-ендион (III-цис), или транс-ендион (III-транс), или их смесь преобразуют в соответствующее гидрокси-соединение, перокси-соединение (IV-OOH), или бискарбонильное соединение (V), или карбоксильное соединение (VI) путем взаимодействия цис-ендиона (III-цис), или транс-ендиона (III-транс), или их смеси с озоном в присутствии спирта формулы R7-2-OH, где R7-2 представляет собой -H или C1-C4 алкил, необязательно замещенный одним или двумя -OH. Такой спирт включает воду, метанол, этанол, пропиловый спирт, изопропиловый спирт, этиленгликоль, глицерин и тому подобное. Является предпочтительным, когда R7-2 представляет собой -H, C1 или представляет собой изо-C3; более предпочтительно, когда R7-2- представляет собой смесь из -H, C1 и изо-C3. Это значит, что смесь воды, метанола и изопропанола является предпочтительным R7-2-OH. Стероидные исходные продукты должны быть в растворе используемого растворителя, который будет растворять их при пониженных температурах, которые являются предпочтительными для осуществления этой реакции. Метиленхлорид представляет собой предпочтительный растворитель. Температуры реакции могут быть от таких низких, как приблизительно -100°, до приблизительно 40°. Является предпочтительным, когда температура составляет от приблизительно -78° до приблизительно -20°; более предпочтительно, когда температура составляет приблизительно -50°. Более низкая температура более избирательна; более высокая температура менее избирательна. Однако в действительности используемая температура будет зависеть от конкретных используемых реагентов и желаемой степени селективности. Реакцию можно проводить до тех пор, пока количество исходного продукта не уменьшится до небольшого количества. Подачу озона следует прекратить, когда исходный продукт израсходуется или озон будет разрушать продукт путем взаимодействия с Гидроперокси-соединение (IV-OOH) может быть преобразовано в соответствующее гидрокси-соединение (IV-OH) путем взаимодействия гидроперокси-соединения (IV-OOH) с гидроперокси-деокислительным агентом. Является предпочтительным использование мягкого гидроперокси-деокислительного агента, который, во-первых, осуществляет деокисление, и, во-вторых, не присоединяется к молекуле стероида. Используемые гидроперокси-деокислительные агенты включают такие, которые выбраны из группы, включающей: Q1Q2S, где Q1 и Q2 являются одинаковыми или различными и представляют собой C1-C4 алкил или фенил, бисульфит, сульфит, тиосульфат, тетрагидротиофен, гидросульфит, тиомочевину, бутилвиниловый эфир, (C1-C4 алкил)3 фосфин, трифенилфосфин, и тетраметилэтилен. Является предпочтительным, когда гидроперокси-деокислительный агент представляет собой диметилсульфид. Когда гидроперокси-деокислительный агент представляет собой бисульфит и сульфит, натрий и калий являются предпочтительными катионами. Необходим один эквивалент гидроперокси-деокислительного агента, но обычно используют более одного эквивалента, например приблизительно два эквивалента, чтобы быть уверенным в том, что всё гидроперокси-соединение (IV-OOH) восстановлено. Реакцию проводят при 20-25° и обычно завершают в течение приблизительно 1 часа. Гидрокси-соединение (IV-OH) может быть выделено и очищено, однако является предпочтительным не выделять и очищать, а проводить реакцию in situ, без его выделения и очистки. Является предпочтительным, когда гидрокси-соединение (IV) представляет собой 17 Гидроперокси-соединение (IV-OOH) может быть преобразовано в соответствующую карбоновую кислоту (VI) путем взаимодействия гидроперокси-соединения (IV-OOH) с образующим карбоновую кислоту агентом, выбранным из группы, включающей: (a) теплоту, (b) основание, конъюгированная кислота которого имеет pKa, равный приблизительно 5 или выше, (c) кислоту, которая имеет pKa менее чем приблизительно 3, (d) ацилирующий агент. Когда образующий карбоновую кислоту агент представляет собой (a) теплоту, реакционная смесь должна быть нагрета в интервале от приблизительно 30° до приблизительно 120°; предпочтительно от приблизительно 80° до приблизительно 90°. Когда образующий карбоновую кислоту агент представляет собой (b) основание, конъюгированная кислота которого имеет pKa, равный приблизительно 5 или выше, используемые основания включают неорганические основания, выбранные из группы, включающей гидроксид, бикарбонат и карбонат, и органические основания, выбранные из группы, включающей (Q3)3N, где Q3 представляет собой C1-C3 алкил, DBU, DBN, DABCO, пиридин и п-диметиламинопиридин. Является предпочтительным, когда основание представляет собой бикарбонат. Достаточное количество основания необходимо для нейтрализации образуемой стероидной кислоты и любых дополнительных кислотных побочных продуктов. Когда образующий карбоновую кислоту агент представляет собой (c) кислоту, которая имеет pKa менее чем приблизительно 3, используемые кислоты включают такие, которые выбраны из группы, включающей хлористоводородную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту и органические кислоты формулы Rкислота-1-COOH, где Rкислота-1 представляет собой -H и C1-C3 алкил, необязательно замещенный от 1 до 3 -Cl и -F; предпочтительными являются муравьиная кислота и трифторуксусная кислота. В то время как каталитические количества кислоты являются достаточными, определенный эквивалент является предпочтительным. Когда образующий карбоновую кислоту агент представляет собой (d) ацилирующий агент, используемые ацилирующие агенты выбраны из группы, включающей Rкислота-2-CO-O-CO-Rкислота-2, где Rкислота-2 представляет собой -H, C1-C3 алкил, необязательно замещенный от 1 до 3 -Cl и -F, и – Является предпочтительным, когда ацилирующий агент представляет собой уксусный ангидрид или трифторуксусный ангидрид. Требуется один эквивалент ацилирующего агента. Когда используется ацилирующий агент, является предпочтительным использование его с катализатором ацилирования. Предпочтительные катализаторы ацилирования представляют собой: пиридин и п-диметиламинопиридин (DMAP). Что касается растворителей, является важным осуществлять способ в гомогенных реакционных условиях с целью избежать разложения гидроперокси-соединения (IV-OOH). Это означает, что используют однофазную среду. Поэтому выбор растворителя будет зависеть от используемого образующего карбоновую кислоту агента. В том случае, когда необходима вода для растворения образующего карбоновую кислоту агента, например, когда образующий карбоновую кислоту агент представляет собой бикарбонат, тогда необходим смешивающийся с водой органический растворитель, такой как ацетон, метанол, ДМФ или изопропанол. Когда образующий карбоновую кислоту агент представляет собой пиридин, тогда органическим растворителем может быть не смешивающийся с водой органический растворитель, такой как ацетонитрил, метиленхлорид или этилацетат. Однако выбор растворителя зависит от природы используемого образующего карбоновую кислоту агента, как это известно специалисту в данной области. За исключением образующего карбоновую кислоту агента (a) теплота, другие образующие кислоту агенты (b), (c) и (d) – все они могут реагировать при 20-25°. Реакция протекает довольно быстро и обычно осуществляется в течение менее одного часа. Оба соединения, гидрокси-соединение (IV-OH) и бискарбонильное соединение (V), преобразуются в соответствующую карбоновую кислоту (VI) одинаковым образом. Способ включает взаимодействие гидрокси-соединения (IV-OH), или бискарбонильного соединения (V), или их смеси с агентом окислительного отщепления. Используемые агенты окислительного отщепления выбраны из группы, включающей: (1) пероксид водорода с образующим карбоновую кислоту агентом, выбранным из группы, включающей: (a) теплоту, (b) основание, конъюгированная кислота которого имеет pKa, равный приблизительно 5 или выше, (c) кислоту, которая имеет pKa менее чем приблизительно 3, (d) ацилирующий агент и катализатор ацилирования; (2) KHSO5; (3) пероксид водорода с кетоном, выбранным из группы, включающей Q4-CO-Q5, где Q4 и Q5 являются одинаковыми или различными и представляют собой: C1-C4 алкил, необязательно замещенный от 1 до 9 -Cl или -F, где Q4 и Q5 взяты вместе с присоединенным атомом углерода с образованием циклического кетона, содержащего от 5 до 7 членов, и кетонов формулы: и (4) пероксид водорода в сочетании с метилтриоксорением, (5) (6) перкислоты, выбранные из группы, включающей (a) пербензойную кислоту, необязательно замещенную 1 или 2 -Cl или -NO2, (b) перкарбоновые кислоты формулы Cn2(Q6)2n2+1-CO3H, где n2 представляет собой от 1 до 4 и Q6 представляет собой -H, -Cl или -F, (c) перфталевую кислоту, (d) пероксифталат магния. Является предпочтительным, когда агент окислительного отщепления представляет собой пероксид водорода с образующим карбоновую кислоту агентом. Когда образующие карбоновую кислоту агенты представляют собой: (a) теплоту, (b) основание, конъюгированная кислота которого имеет pKa, равный приблизительно 5 или выше, (c) кислоту, которая имеет pKa менее чем приблизительно 3, или (d) ацилирующий агент и катализатор ацилирования, они должны быть использованы таким же образом, как описано выше для преобразования гидроперокси-соединения (IV-OOH) в соответствующую карбоновую кислоту (VI). Как указано выше, требуется один эквивалент агента окислительного отщепления. Обычно используют два эквивалента и реакцию контролируют, таким образом, когда реакция приближается к завершению, ее останавливают, или гасят, и обрабатывают перед воздействием агента окислительного отщепления на Есть несколько способов преобразования карбоновой кислоты (VI) в соответствующий 5,7-лактон (VII), где C- и D-кольца исходной карбоновой кислоты (VI) и продукта 5,7-лактона являются одинаковыми. Способы отличаются в зависимости от природы стероидного A-/B-кольца исходной карбоновой кислоты (VI). Используют различные реагенты и получают 5,7-лактоны (VII) с различными стероидными A-/B-кольцами. По одному из этих способов получают 5,7-лактон формулы (VII) где (Va) R2 представляет собой -H:-H; R3 представляет собой = O; R4 представляет собой -H:-H; (Vb) R2 представляет собой -H:-H; R3 представляет собой R3a:R3b, где оба R3a и R3b представляют собой: -OH и R4 представляет собой -H:-H; где R9, R11 и R11 такие, как определено выше, который включает: (1) взаимодействие карбоновой кислоты формулы (VI) где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H, и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; (III) R3 представляет собой C1-C3 алкил, и R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащей 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H; (IV) R3 представляет собой где R9, R11 и R17 такие, как определено выше; с реакционной средой, которая имеет pH менее чем приблизительно 5. Преобразование карбоновой кислоты (VI) в соответствующий 5,7-лактон (VII) представляет собой равновесную реакцию. Более низкий pH, используемый для реакционной среды, сдвигает реакционное равновесие к 5,7-лактону (VII), однако желательно поддерживать pH менее чем 5 и предпочтительно в области от 1 до 5. Является предпочтительным осуществлять реакцию в безводных условиях; в безводных условиях является предпочтительным, когда кислота представляет собой сильную кислоту с pKa менее чем приблизительно 2. Используемые сильные кислоты включают такие, которые выбраны из группы, включающей фторсульфоновую, хлорсульфоновую, бензолсульфоновую, п-толуолсульфоновую, метансульфоновую, трифторметансульфоновую, трифторуксусную, трихлоруксусную, хлористоводородную, серную, фосфорную и азотную; является предпочтительным, когда кислота представляет собой бензолсульфоновую, п-толуолсульфоновую или метансульфоновую кислоту. Альтернативно, способ может быть осуществлен с использованием водной кислоты в качестве катализатора. В таких условиях является предпочтительным осуществлять способ в двухфазной системе. Количество используемой кислоты не является очень важным фактором и может быть от каталитического до избытка. Основания также могут быть использованы для катализа реакции карбоновой кислоты (VI) в соответствующий 5,7-лактон (VII), и их также используют в каталитическом количестве. Используемые основания включают такие, которые выбраны из группы, включающей гидроксид, бикарбонат, карбонат, DBU, DBN, DABCO, пиридин, п-диметиламинопиридин, Q7-COO–, где Q7 представляет собой -H, C1-C3 алкил или – (Q3)3N, где Q3 представляет собой C1-C3 алкил; предпочтительными являются: гидроксид, бикарбонат, карбонат, триэтиламин или пиридин. Растворители для преобразования карбоновой кислоты (VI) в соответствующий 5,7-лактон (VII) способствуют в установлении равновесия реакции. Является предпочтительным использовать растворитель, в котором исходная карбоновая кислота (VI) растворима и в котором 5,7-лактон (VII) нерастворим. Таким образом 5,7-лактон (VII) высаживается из реакционного раствора, и создается сдвиг реакционного равновесия к желаемому 5,7-лактону (VII). Предпочтительный растворитель представляет собой ацетон. Эту реакцию проводят от приблизительно 0° до приблизительно 25°, и она завершается в течение нескольких часов. В зависимости от pH реакционной среды и используемого растворителя достигают соотношения карбоновая кислота (VI)/5,7-лактон (VII), равного < 95/5. Поскольку эта стадия способа представляет собой равновесную реакцию, pH реакционной среды позволяет контролировать состояние равновесия, как это известно специалисту в данной области. Второй способ получения 5,7-лактона формулы (VII) где (Va) R2 представляет собой -H:-H, R3 представляет собой =O и R4 представляет собой -H:-H; где R9, R11 и R17 такие, как определено выше, включает: (1) взаимодействие карбоновой кислоты формулы (VI) где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; где R9, R11 и R17 такие, как определено выше; в безводных условиях с безводной реакционной средой с pH менее чем приблизительно 5. Является предпочтительным, когда реакционная среда содержит кислоту, которая имеет pKa, равный < приблизительно 4. Используемые кислоты, которые имеют pKa, равный < приблизительно 4, включают такие, которые выбраны из группы, включающей фторсульфоновую, хлорсульфоновую, бензолсульфоновую, п-толуолсульфоновую, метансульфоновую, трифторметансульфоновую, трифторуксусную, трихлоруксусную, хлористоводородную, серную, фосфорную и азотную. Является предпочтительным, когда кислота представляет собой бензолсульфоновую, п-толуолсульфоновую или метансульфоновую. Является также предпочтительным, когда карбоновая кислота (VI) взаимодействует с кислотой в двухфазной системе. Способ также включает взаимодействие карбоновой кислоты (VI) с каталитическим количеством основания. Используемые основания включают такие, которые выбраны из группы, включающей гидроксид, бикарбонат, карбонат, DBU, DBN, DABCO, пиридин, п-диметиламинопиридин, Q7-COO–, где Q7 представляет собой -H, C1-C3 алкил или – (Q3)3N, где Q3 представляет собой C1-C3 алкил. Третий способ получения 5,7-лактона формулы (VII) где (Vc) R2 представляет собой -H:-H, R3 представляет собой -O-R3a:-O-R3b, где R3a и R3b одинаковые и представляют собой C1-C3 алкил, или где R3a и R3b взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил и R4 представляет собой -H:-H; (VI) R2 представляет собой -H:-H; R3 представляет собой R3c:R3d и R4 представляет собой R4c:R4d, где один из R3c и R3d взят с одним из R4c или R4d с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R3c и R3d представляет собой CH3-O- или C2H5-O-; и другой из R4c и R4d представляет собой -H; или (VII) R2 представляет собой R2e:R2f и R3 представляет собой R3e:R3f, где один из R2e и R2f взят с одним из R3e или R3f с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R2e и R2f представляет собой -H, и другой из R3e и R3f представляет собой CH3-O- или C2H5-O-; или смесь; где R9, R11 и R17 такие, как определено выше, включает: (1) взаимодействие карбоновой кислоты формулы (VI) где (III) R3 представляет собой C1-C3 алкил, и R31 и R32 взяты вместе с присоединенным -O-C-O- с образованием циклического кеталя, содержащего 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H и C1-C3 алкил; R4 представляет собой -H:-H; R6 представляет собой R6-5:R6-6, где один из R6-5 и R6-6 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из R6-5 и R6-6 представляет собой -H; (IV) R3 представляет собой где R9, R11 и R17 такие, как определено выше; с по меньшей мере каталитическим количеством кислоты. Является предпочтительным, когда кислота имеет pKa, равный < приблизительно 4, и представляет собой такую, как определено выше. Настоящее изобретение включает способ получения сложного метилового эфира формулы (VIII) где (I) R3 представляет собой = O; R4 представляет собой R4-1:R4-2, где один из R4-1 и R4-2 представляет собой -H и другой из R4-1 и R4-2 взят вместе с R5 с образованием второй связи между атомами углерода, к которым они присоединены; R6 представляет собой -H:-H; где R9, R11 и R17 такие, как определено выше, который включает: (1) взаимодействие 5,7-лактона формулы (VII) где R4 представляет собой -H:-H и где R3, R9, R11 и R17 указаны выше, с основанием, и (2) взаимодействие реакционной смеси со стадии (1) с метилирущим агентом. Основание должно быть достаточно сильным для раскрытия 5,7-лактона (VII), но такого типа, который не взаимодействует c метилирущим агентом, слабый нуклеофил. Используемые основания включают такие, которые выбраны из группы, включающей бикарбонат, карбонат, гидроксид и RоснованиеO–, где Rоснование представляет собой C1-C4 алкил. Является предпочтительным, когда основание представляет собой бикарбонат. Требуемое количество основания составляет от приблизительно 1 до приблизительно 1,5 эквивалентов. Используемые метилирующие агенты включают такие, которые выбраны из группы, включающей диметилсульфат, метилйодид, метилбромид, триметилфосфат, диметилкарбонат и метилхлорформиат; предпочтительным является диметилсульфат. Количество используемого метилирующего агента должно быть таким же, что и количество эквивалентов используемого основания, или очень слабый избыток относительно его. Предпочтительный способ представляет собой взаимодействие последовательным образом в виде двухстадийной реакции сначала с основанием и затем с метилирущим агентом. Если всю реакцию проводят в одну стадию, основание взаимодействует с метилирущим реагентом, что создает необходимость использования большего количества основания и большего количества метилирующего агента. Более эффективным путем является сначала взаимодействие 5,7-лактона (VII) с по меньшей мере одним эквивалентом основания, предпочтительно от приблизительно 1 до приблизительно 1,5 эквивалентов, и затем взаимодействие карбоксилатной соли кислоты (VI), которая образуется, с метилирущим агентом. Выбор растворителя будет зависеть от используемого основания. Если основание является водорастворимым, таким как бикарбонат или гидроксид, тогда является предпочтительной смесь из воды и смешивающегося с водой органического растворителя. Такие смешивающиеся с водой органические растворители включают метанол, этанол, изопропанол, ацетон, ТГФ и ДМФ. Если основание является водорастворимым и растворитель представляет собой смесь из воды и несмешивающегося с водой растворителя, тогда используется катализатор фазового переноса, такой как тетрабутиламмонийбисульфат или трибутилметиламмонийхлорид. Если основание является растворимым в смешивающемся с водой органическом растворителе, таком, который также растворяет и 5,7-лактон (VII), такой смешивающийся с водой органический растворитель является подходящим. Температура реакции зависит от реакционной способности метилирующего агента. Если используется агент, такой как диметилкарбонат, реакция будет протекать медленно, и может быть необходимым нагревание до приблизительно 150°. С другой стороны, если используется более реакционно-способный агент, такой как диметилсульфат, реакция проходит приблизительно за 1 час при 40°. Хотя теоретически должно быть достаточно одного эквивалента основания и одного эквивалента метилирующего агента, на практике необходимо более одного эквивалента для оптимальных условий проведения реакциий проведения реакции. 5,7-Лактон (VII) может быть преобразован в соответствующую карбоновую кислоту (соль) (VI) путем взаимодействия 5,7-лактона формулы (VII) с реакционной средой, которая имеет pH > 7. Реакция подобна преобразованию 5,7-лактона (VII) в сложный метиловый эфир (VIII), за исключением того, что не используется метилирующий агент. Поскольку используется только основание, образуемый продукт представляет собой соль карбоновой кислоты (VI). Далее, поскольку метилирующий агент не представлен, количество используемого основания не является критическим. Если желательна кислотная форма карбоновой кислоты (VI), то солевая форма может быть подкислена до образуемой соответствующей кислотной формы карбоновой кислоты (VI), как это известно специалистам в данной области. Существует много альтернативных путей использования настоящего изобретения, как представлено на схеме A, как будет объяснено далее и известно специалистам в данной области. Например, стероидное A-кольцо может быть защищено в виде соединения (I-P), смотри СХЕМУ B и последующие разъяснения, в процессе преобразования (I) в (II) или использовано в незащищенном виде (I). Далее, C- и D-кольца могут иметь разнообразные функциональные группы в процессе осуществления различных стадий способа. Функциональные группы C-кольца включают, например, 9 -SiH(CH3)2. Иногда A-кольцо, если только оно уже не является требуемой НА СХЕМЕ B описан способ получения где R31 и R32 (1) одинаковые или различные и представляют собой C1-C3 алкил, и (2) взяты с присоединенным -O-C-O- с образованием циклической кетали, содержащей 5 или 6 атомов, формулы -(CH2)-(CR33R34)n1-(CH2)-, где n1 представляет собой 0 или 1; где R33 и R34 являются одинаковыми или различными и представляют собой -H, C1-C3 алкил, получают из соответствующего
где R3 представляет собой C1-C3 алкил, CH3–-CO-,
RSi-1RSi-2RSi-3Si-, где RSi-1, RSi-2 и RSi-3 являются одинаковыми или различными и представляют собой C1-C4 алкил; путем взаимодействия (a) R31-OH, где R31 такой, как определено выше, (b) R32-OH, где R32 такой, как определено выше, (c) HO-(CH2)-(CR33R34)n1-(CH2)-OH, где n1, R33 и R34 такие, как определено выше, (d) HO-CH2-CH2-OH, путем (1) взаимодействия DDQ, п-хлоранил, o-хлоранил, Mn+3, Mn+7, Pb+4, Pd+2, Ru+8, Cr+6, o-йодоксибензойная кислота, o-йодоксибензойная кислота, комплекс с ДМСО, o-йодоксибензойная кислота, комплекс с 4-метоксипиридин-N-оксидом, N-метилморфолин-N-оксидом, триметиламин-N-оксидом, йодная кислота (HIO3), пентоксид йода (I2O5), церий аммоний нитрат, йодозобензол, йодбензолбистрифторацетат, йодбензолдиацетат, тритилфторборат, и путем электрохимического окисления с каталитическим количеством отщепляющего водород агента. Является предпочтительным, когда агент, отщепляющий гидрид, представляет собой п-хлоранил или DDQ, более предпочтительно DDQ. Требуется один эквивалент агента, отщепляющего гидрид; большее количество вредит проведению процесса, только образуются отходы. Является предпочтительным, когда спирт представляет собой неопентилгликоль, также известный как диметилпропиленгликоль или 2,2-диметил-1,3-пропандиол. Растворитель необходим для растворения 3-алкилового енольного эфира (3-алкиловый енольный эфир) исходного продукта. Подходящие растворители включают метиленхлорид, ацетонитрил, ТГФ и тому подобное. Реакцию можно проводить при температуре в области приблизительно от -78° до приблизительно 40°, предпочтительной является приблизительно -15°. Реакция протекает очень быстро, и она завершается за несколько минут при -15°. Полностью способ предпочтительно осуществлять в по существу безводных условиях. Термин 17 17 НА СХЕМЕ C описано, что 7 НА СХЕМЕ C далее описано, что цис-оксиендион (X-цис) может быть преобразован в соответствующий транс-оксиендион (X-транс). Процесс осуществляют тем же способом, и тем же путем, что и для цис-ендиона (III-цис), как на схеме A, преобразуют в соответствующий транс-ендион (III-транс). Цис-оксиендион (X-цис), или транс-оксиендион (X-транс), или их смесь может быть преобразован в соответствующее гидроперокси-соединение (IV-OOH), и/или гидрокси-соединение (IV-OH), и/или бискарбонильное соединение (V), и/или карбоновую кислоту (VI) или их смесь тем же способом, и таким же путем цис-ендион (III-цис), или транс-ендион (III-транс), или их смесь преобразуют в соответствующее гидроперокси-соединение (IV-OOH), и/или гидрокси-соединение (IV-OH), и/или бискарбонильное соединение (V), и/или карбоновую кислоту (X) или их смесь. Гидроперокси-соединение (IV-OOH), и/или гидрокси-соединение (IV-OH), и/или бискарбонильное соединение (V), и/или карбоновую кислоту (X) или их смесь затем преобразуют в эплеренон (IX) тем же способом, как было обсуждено выше для способа по СХЕМЕ A. Цис-оксиендион (X-цис), или транс-оксиендион (X-транс), или их смесь может быть преобразован в соответствующую карбоновую кислоту (VI) путем взаимодействия с агентом окислительного отщепления тем же способом и таким же путем, как гидрокси-соединение (IV-OH) и/или бискарбонильное соединение (V) преобразовано в соответствующую карбоновую кислоту (VI). НА СХЕМЕ D представлен предпочтительный способ по изобретению (когда R7-1 представляет собой (-A1) относительно стероидного A-/B-кольца, где стероидное A-кольцо не защищено. Однако, с учетом различных заместителей стероидных C- и D-колец и сочетания различных возможных заместителей, в некоторых случаях может быть предпочтительно защитить стероидное A-кольцо, как это понятно специалисту в данной области. Но обычно является предпочтительным, когда стероидное A-кольцо не защищено, и предпочтительный способ будет таким, как представлено на схеме D. НА СХЕМЕ Е представлен предпочтительный способ по изобретению с предпочтительными заместителями для каждого промежуточного продукта для преобразования НА СХЕМЕ F описан обратимый характер преобразования карбоновой кислоты (VI) в 5,7-лактон (VII). НА СХЕМЕ G описан общий способ по изобретению, когда аддукт -R7-1 представляет собой циклический аддукт (-А2). 7 НА СХЕМЕ Н описан общий способ по изобретению, когда аддукт R7-1 представляет собой (-В), (-С), (-D1), (-D2) и (-D3). Способ по СХЕМЕ Н представляет собой двухстадийный способ. Первая стадия способа представляет собой преобразование Вторая стадия представляет собой окислительное отщепление 7 (d) формулы (B) (e) формулы (C) (f) формулы (D1, D2 и D3) где Ra, E1, E2, M такие, как определено выше, в присутствии: (1) кислоты Льюиса, (2) протонной кислоты с pKa, равным < приблизительно 5, или (3) соли вторичного амина формулы и с кислотой с pKa, равным < приблизительно 2. Кислота Льюиса как ускоряет конъюгированное связывание, так и облегчает образование 7 Аддукты (-B) и (-C) преобразуются в -CO-OH карбоновой кислоты (VI) при обработке одним или несколькими окислительными агентами. Окислительный(ые) агент(ы) должен(ны) быть способны расщеплять C=M двойную связь до углерод-кислородной двойной связи, расщеплять C-Rb2 прямую связь до углерод-кислородной прямой связи и расщеплять углерод-углеродную тройную связь до карбоновой кислоты. Выбор окислительного(ых) агента(ов) зависит от трудности окисления заместителя -CRb2=M или -C Аллильный аддукт (-D1) преобразуют в -CO-OH карбоновой кислоты (VI) путем изомеризации двойной связи в -CH=CH-CH3 с последующим озонолизом с окислительной обработкой (такой как хлоритом натрия). Изомеризация двойной связи может быть осуществлена любым из следующих реагентов, трихлоридом родия в этаноле при кипячении с обратным холодильником, HRuCl[P(- Пропаргиловый аддукт (-D2) преобразуют в функциональную группу -CO-OH карбоновой кислоты (VI) с помощью основания или катализируемой переходным металлом изомеризацией в аддукт (-C), когда Rc2 представляет собой C1 алкил, который расщепляют способом, обсуждаемым выше. Подходящие основания для изомеризации (-D2) в (-C) включают амид натрия в аммиаке или ТГФ, 3-аминопропиламид калия (известный как Алленильный аддукт (-D3) преобразуют в функциональную группу -CO-OH карбоновой кислоты (VI) путем озонолиза с окислительной обработкой (такой как хлоритом натрия). Настоящее изобретение включает четырехстадийный способ преобразования 7 (1) взаимодействия 7 (a) галогенирующий агент в присутствии воды и основания, конъюгированная кислота которого имеет pKa, равный > приблизительно 8, (b) подающий кислород агент, (c) электрохимическое окисление, (d) хинон в присутствии воды или (e) нехиноновые окислители; и (2) взаимодействие реакционной смеси со стадии (1) с озоном в присутствии спирта формулы R7-2-OH; (3) взаимодействие реакционной смеси со стадии (2) с гидроперокси-деокислительным агентом и (4) взаимодействие реакционной смеси со стадии (3) с агентом окислительного отщепления. Каждая их этих стадий была подробно обсуждена выше, когда обсуждались отдельные стадии способа. Этот способ объединяет те же самые стадии, и они осуществляются теми же методами и теми же путями, как обсуждено выше. Настоящее изобретение включает трехстадийный способ преобразования 7 (1) взаимодействие 7 (2) взаимодействие реакционной смеси со стадии (1) с гидроперокси-деокислительным агентом и (3) взаимодействие реакционной смеси со стадии (2) с агентом окислительного отщепления. Каждая их этих стадий была подробно обсуждена выше, когда обсуждались отдельные стадии способа. Этот способ объединяет те же самые стадии, и они осуществляются теми же методами и теми же путями, как обсуждено выше. Карбоновая кислота (VI) может быть легко преобразована в ее таутомерно-подобный бислактон (VII) путем взаимодействия с кислотой, смотри ПРИМЕР 34, стадия (2). В способе по изобретению он представляет собой карбоновую кислоту (VI), которую преобразуют в сложный метиловый эфир (VIII) и сразу в эплеренон (IX). Можно выделить и очистить эту карбоновую кислоту (VI) путем кристаллизации. Однако существует опасность, что она будет изомеризоваться в бислактон (VII), который является более термодинамически стабильным. Поэтому с практической точки зрения более предпочтительным является не останавливаться в конце ПРИМЕРА 34, стадия (1), но воздействовать на реакционную смесь и выделить и кристаллизовать бислактон (VII). Однако легче и предпочтительнее осуществить способ, проиллюстрированный в ПРИМЕРЕ 34, через стадию (2), очистить образовавшийся бислактон (VII) и затем обратно преобразовать бислактон (VII) в карбоновую кислоту (VI) для преобразования в сложный метиловый эфир (VIII). Эплеренон (IX) представляет собой фармацевтический агент, используемый для лечения гиперальдостеронизма, отека, гипертензиии, хронической сердечной недостаточности, смотри патент США 4559332. Настоящее изобретение также включает новый способ преобразования 11 11 Для 11 (1) W1 представляет собой -H:-H и W2 представляет собой -H:-H или W1 представляет собой W1-1:W1-2 и W2 представляет собой W2-1:W2-2, где один из W1-1 или W1-2 взят вместе с одним из W2-1 или W2-2 с образованием второй связи между атомами углерода, к которым они присоединены, и другой или W1-,1, или W1-2 и W2-1, или W2-2 представляет собой -H; W3 представляет собой =O, W4 представляет собой W4-1:W4-2, где один из W4-1 и W4-2 взят вместе с W5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из W4-1 и W4-2 представляет собой -H; (2) W3 представляет собой =O, W4 представляет собой -H:-H и W5 имеет (3) W3 представляет собой -O-W3-3:-O-W3-4; W4 представляет собой W4-3:W4-4, где один из W4-3 и W4-4 взят вместе с W5 с образованием второй связи между атомами, к которым они присоединены, и другой из W4-3 и W4-4 представляет собой -H; W3-3 и W3-4 представляют собой: (a) одинаковые или различные и представляют собой C1-C5 алкил, (b) взяты вместе с образованием циклической группы, выбранной из группы, включающей: (i) -CH2-CH2-, (ii) -CH2-CH2-CH2-, (iii) -CH2-C(CH3)2-CH2-; и где W1 и W2 такие, как определено выше; (4) W3 представляет собой -O-W3-3:-O-W3-4; W4 представляет собой -H:-H; W5 образует вторую связь между C5 и C6; W3-3 и W3-4- такие, как определено выше; (5) W3 представляет собой W3-5:W3-6, где (a) один из W3-5 и W3-6 представляет собой -H и другой из W3-5 и W3-6 представляет собой: (i) -O- W3-5A, где W3-5A представляет собой C1-C3 алкил, (ii) -O-CO-W3-5A, где W3-5A такой, как определено выше, (iii) -N(W3-5A)2, где W3-5A такой, как определено выше, (iv) пиперазинил, (v) морфолинил, (vi) пиперидинил, (b) W3-5 и W3-6 взяты вместе с атомом углерода, к которому они присоединены, с образование циклической группы, включая: (i) -O-CH2-CH2-O-, (ii) -O-CH2-CH2-CH2-O-, (iii) -O-CH2-C(CH3)2-CH2-O-, и где W4 представляет собой -H:-H; W5 образует вторую связь между C5 и C6; (6) W3 представляет собой W3-7:W3-8 и где W4 представляет собой W4-7:W4-8, где (a) один из W3-7 и W3-8 представляет собой: (i) -O- W3-7A, где W3-7A представляет собой C1-C3 алкил, (ii) -O-CO-W3-7A, где W3-7A такой, как определено выше, (iii) -N(W3-7A)2, где W3-7A такой, как определено выше, (iv) пиперазинил, (v) морфолинил, (vi) пиперидинил, и где другой из W3-7 и W3-8 взят вместе с одним из W4-7 и W4-8 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из W4-7 и W4-8 представляет собой -H; W5 образует вторую связь между C5 и C6; (7) W3 представляет собой (a) -O-CO-W3-10A, где W3-10A представляет собой C1-C3 алкил, (b) -O-CO-O-W3-10B, где W3-10B представляет собой (i) C1-C4 алкил, (ii) – (iii) -CH2– (8) W3 представляет собой W5 и образует вторую связь между атомами, к которым они присоединены, и другой из W4-9 и W4-10 представляет собой -H; и где W1 и W2 такие, как определено выше. Более предпочтительно, когда функциональными группами стероидного A-кольца являются: (1) W1 представляет собой -H:-H и W2 представляет собой -H:-H или W1 представляет собой W1-1:W1-2 и W2 представляет собой W2-1:W2-2, где один из W1-1 или W1-2 взят вместе с одним из W2-1 или W2-2 с образованием второй связи между атомами углерода, к которым они присоединены, и другой или W1-1, или W1-2 и W2-1, или W2-2 представляет собой -H; W3 представляет собой =O, W4 представляет собой W4-1:W4-2, где один из W4-1 и W4-2 взят вместе с W5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из W4-1 и W4-2 представляет собой -H; (7) W3 представляет собой (a) -O-CO-W3-10A, где W3-10A представляет собой C1-C3 алкил, (b) -O-CO-O-W3-10B, где W3-10B представляет собой (i) C1-C4 алкил, (ii) – (iii) -CH2– Еще более предпочтительно, когда функциональными группами стероидного A-кольца являются: (1) W1 представляет собой -H:-H и W2 представляет собой -H:-H или W1 представляет собой W1-1:W1-2 и W2 представляет собой W2-1:W2-2, где один из W1-1 или W1-2 взят вместе с одним из W2-1 или W2-2 с образованием второй связи между атомами углерода, к которым они присоединены, и другой или W1-1, или W1-2 и W2-1, или W2-2 представляет собой -H; W3 представляет собой =O, W4 представляет собой W4-1:W4-2, где один из W4-1 и W4-2 взят вместе с W5 с образованием второй связи между атомами углерода, к которым они присоединены, и другой из W4-1 и W4-2 представляет собой -H; Для 11 где W17 представляет собой: (1) =O, (2) (a) W17-1 и W17-2 взяты вместе с присоединенным атомом углерода с образованием эпоксида формулы (b) W17-1 и W17-2 взяты вместе с присоединенным атомом углерода с образованием лактона формулы (3) (a) W17-3 представляет собой: (i) -H, (ii) -O-CO-W17-3A, где W17-3A представляет собой -H или -CO-W17-3B, где W17-3B представляет собой C1-C4 алкил или – (b) W17-4 представляет собой -CO-CH3; (4) (a) W17-5 представляет собой: (i) -O-CO-W17-5A, где W17-5A представляет собой C1-C4 алкил или – (b) W17-6 представляет собой: (i) -CO-CH2-O-W17-6A, где W17-6A представляет собой C1-C4 алкил или – Для соединения эплеренонового типа является предпочтительным, когда W17 представляет собой: (1) =O, (2) (a) W17-1 и W17-2 взяты вместе с присоединенным атомом углерода с образованием эпоксида формулы (b) W17-1 и W17-2 взяты вместе с присоединенным атомом углерода с образованием лактона формулы Более предпочтительно, когда для соединения эплеренонового типа W17 представляет собой: (1) =O, (2) (b) W17-1 и W17-2 взяты вместе с присоединенным атомом углерода с образованием лактона формулы Для прогестеронов и гидроксипротестеронов является предпочтительным, когда W17 представляет собой:(3) (a) W17-3 представляет собой: (i) -H, (ii) -O-CO-W17-3A, где W17-3A представляет собой -H или -CO-W17-3B, где W17-3B представляет собой C1-C4 алкил или – (b) W17-4 представляет собой -CO-CH3. Для кортикоидов является предпочтительным, когда W17 представляет собой: (4) (a) W17-5 представляет собой: (i) -O-CO-W17-5A, где W17-5A представляет собой C1-C4 алкил или – (b) W17-6 представляет собой: (i) -CO-CH2-O-W17-6A, где W17-6A представляет собой C1-C4 алкил или – Предпочтительные комбинации стероидных A-, B- и D-колец, особенного для соединений эплеренонового типа, включают кольцевые системы, представленные на СХЕМЕ C. 11 В способе по настоящему изобретению исходные 11 где: Z1 представляет собой C1-C4 алкил; Z2 представляет собой C1-C4 алкил и где Z1 и Z2, вместе с присоединенным атомом азота, образуют 5- или 6-членный гетероцикл, выбранный из группы, включающей пирролидинил, пиперазинил, пиперидинил и морфолинил; Z3 представляет собой -F или -CF3. Является предпочтительным, когда Z1 и Z2 представляют собой: C1-C3 алкил. Более предпочтительно, когда Z1 и Z2 представляют собой C1 алкил или C2 алкил. Является предпочтительным, когда N-фторалкиламин (CVI) представляет собой N-(1,1,2,3,3,3-гексафторпропил)диэтиламин, который известен как реагент Ишикава или 1,1,2,2-тетрафторэтил-N,N-диметиламин. Способ по изобретению предпочтительно осуществлять с использованием приблизительно 1 эквивалента 11 11 Является предпочтительным осуществлять способ по настоящему изобретению в растворителе, который является сухим (KF представляет собой < 0,5%), такой как ацетонитрил.
Функциональная группа стероидного C-кольца Настоящее изобретение также включает ряд способов преобразования 11 ОПРЕДЕЛЕНИЯ и ПОЛОЖЕНИЯ Определения и объяснения, представленные далее, предназначены для терминов, используемых во всех материалах, включая как описание, так и формулу изобретения. I. УСЛОВНЫЕ ОБОЗНАЧЕНИЯ ДЛЯ ФОРМУЛ и ОПРЕДЕЛЕНИЯ Химические формулы, описывающие различные соединения или фрагменты молекул в описании и в формуле изобретения, могут содержать различные заменяемые заместители, помимо представленных структурными характеристиками. Эти заменяемые заместители обозначены буквой или буквой с последующим цифровым индексом, например “Z1” или “Ri“, где “i” представляет собой целое число. Эти заменяемые заместители являются либо моновалентными, либо бивалентными, то есть они характеризуют группу, присоединенную к формуле одной или двумя химическими связями. Например, группа Z1 может представлять собой бивалентный заместитель, если присоединена к формуле CH3-C(=Z1)H. Группы Ri и Rj могут представлять собой моновалентные заместители, если присоединены к формуле CH3-CH2-C(Ri)(Rj)H2. Когда химические формулы изображены в линейном виде, так, как указано выше, заменяемые заместители, помещенные в круглые скобки, присоединены к атому, фигурирующему сразу слева от заменяемых заместителей. Когда два или более следующих друг за другом заменяемые заместители помещены в круглые скобки, каждый из следующих друг за другом заменяемых заместителей присоединен к атому, фигурирующему сразу перед скобками, и не включен в скобки. Так, в формулах выше оба Ri и Rj присоединены к предшествующему атому углерода. Также, для любой молекулы с установленной системой нумерации атомов углерода, такой как стероиды, эти атомы углерода обозначены как Ci, где “i” представляет собой целое число, соответствующее номеру атома углерода. Например, C6 обозначает положение 6 или номер атома углерода в стероидном ядре, как обычно обозначают специалисты в области стероидной химии. Подобным образом, термин “R6” представляет различный заместитель (либо моновалентный, либо бивалентный) в C6 положении. Химические формулы или их фрагменты, изображенные линейным образом, представляют атомы в линейной цепи. Символ “-” обычно обозначает связь между двумя атомами в цепи. Поэтому CH3-О-CH2-CH(Ri)-CH3 обозначает 2-замещенное-1-метоксипропановое соединение. Аналогичным образом, символ “=” обозначает двойную связь, например CH2=C(Ri)-O-CH3, и символ “ Химические формулы циклических (кольцо) соединений или фрагментов молекул могут быть представлены в линейном виде. Так, соединение 4-хлор-2-метилпиридин может быть представлено в линейном виде как N*=C(CH3)-CH=CCl-CH=C*H, при условии, что атомы, помеченные звездочкой (*), присоединены друг к другу с образованием кольца. Подобным образом, циклический фрагмент молекулы 4-(этил)-1-пиперазинил может быть представлен как -N*-(CH2)2-N(C2H5)-CH2-C*H2. Для жесткой циклической (кольцо) структуры любого представленного здесь соединения относительно плоскости кольца определена ориентация для заместителей, присоединенных к каждому атому углерода жесткого циклического соединения. Для насыщенных соединений, которые имеют два заместителя, присоединенные к атому углерода, который является частью циклической системы, -C(X1)(X2)- два заместителя могут быть либо в аксиальном, либо в экваториальном положении относительно кольца и могут меняться между аксиальным/экваториальным положениями. Однако положения двух заместителей относительно кольца и относительно друг друга остаются фиксированными. Несмотря на то, что любой заместитель может находиться скорее в плоскости кольца (экваториальный), чем над или под плоскостью (аксиальный), один заместитель всегда находится над другим. В химических структурных формулах, изображающих такие соединения, заместитель (X1), который находится “ниже” другого заместителя (X2), будет обозначаться как имеющий альфа ( Когда возможный заместитель является бивалентным, валентности могут быть взяты вместе или отдельно, или обе в определении этой переменной. Например, переменные Ri, присоединенные к атому углерода, такому как -C(=Ri)-, могут быть бивалентными и будут обозначать оксо или кето, образуя таким образом карбонильную группу (-CO-), или в виде двух отдельных присоединенных моновалентных заместителей -C( Поскольку бивалентный переменный радикал может обозначаться в виде двух отдельных моновалентных переменных заместителей, два отдельных моновалентных переменных заместителя могут быть определены как взятые вместе с образованием бивалентного переменного радикала. Например, в формуле -C1(Ri)H-C2(Rj)H- (C1 и C2 произвольно обозначают первый и второй атомы углерода, соответственно) Ri и Rj могут быть определены как взятые вместе с образованием (1) второй связи между C1 и C2 или (2) бивалентной группы, такой как окса (-O-), и формулы, таким образом, описывает эпоксид. Когда Ri и Rj, взятые вместе, образуют более сложный радикал, такой как группа -X-Y-, тогда ориентация радикала является такой, что C1 в вышеуказанной формуле присоединен к X и C2 присоединен к Y. Таким образом, в соответствии с обозначением, “… Ri и Rj, взятые вместе, образуют -CH2-CH2-O-CO-…”, означает лактон, в котором карбонил присоединен к C2. Однако когда изложено следующим образом “… Rj и Ri, взятые вместе, образуют -CO-O-CH2-CH2-“, это означает лактон, в котором карбонильная группа присоединена к C1. Количество атомов углерода в переменных заместителях указывается одним из двух описанных далее способов. По первому способу используется префикс к полному названию группы заместителя, например, таким образом, как “C1-C4“, где обе цифры, “1” и “4”, являются целыми числами, соответствующие минимуму и максимуму числа атомов углеродов в заместителе. Префикс отделен от заместителя пробелом. Например, “C1-C4 алкил” представляет собой алкил, состоящий из от 1 до 4 атомов углерода (включая его изомерные формы, если специально не оговорено иного). Всякий раз, когда дается такой единичный префикс, префикс обозначает полное число атомов углерода, содержащихся в указанном заместителе. Таким образом, C2-C4 алкоксикарбонил представляет собой группу CH3-(CH2)n-0-CO-, где n представляет собой ноль, один или два. Согласно другому способу, содержание атомов углерода только каждой части определения представлено отдельным указанием, путем заключения определения “Ci-Cj” в скобки и расположения его сразу (без использования пробела) перед той частью определения, которое описывают. Согласно данному необязательному определению (C1-C3)алкоксикарбонил имеет то же значение, что и C2-C4 алкоксикарбонил, поскольку “C1-C3” относится только к количественному содержанию атомов углерода в алкокси-группе. Подобным образом, поскольку как C2-C6 алкоксиалкил, так и (C1-C3)алкокси(C1-C3)алкил описывают алкоксиалкильные группы, содержащие от 2 до 6 атомов углерода, два определения отличаются, поскольку первое определение допускает, что либо алкокси, либо алкильная часть сама по себе содержит 4 или 5 атомов углерода, тогда как последнее определение ограничивает каждую из этих групп 3 атомами углерода. Когда пункты формулы изобретения содержат довольно сложный (циклический) заместитель, в конце фразы, описывающей название/обозначение конкретного заместителя, будет указание (в скобках), которое соответствует тому же названию/обозначению на одной из схем, в которой также представлены химические структурные формулы данного конкретного заместителя. II. ОПРЕДЕЛЕНИЯ Все температуры выражены в градусах Цельсия. ТСХ относится к тонкослойной хроматографии. ЖХ относится к жидкой хроматографии. ВСТЖХ относится к жидкой хроматографии c внешним стандартом. ТГФ относится к тетрагидрофурану. DMAP относится к п-диметиламинопиридину. DDQ относится к 2,3-дихлор-5,6-дициано-1,4-бензохинону. DBU относится к 1,8-диазабицикло[5.4.0]ундец-7-ену. DBN относится к 1,5-диазабицикло[4.3.0]нон-5-ену. DABCO относится к 1,4-диазабицикло[2.2.2]октану. Хроматография (колоночная и флеш-хроматография) относится к очистке/разделению соединения и описывается в виде носителя, элюента. Понятно, что подходящие фракции отбираются и концентрируются с получением желаемого(ых) соединения(ий). Карбоновая кислота (VI) включает ее фармацевтически приемлемые соли. СМР относится к C-13 магнитной резонансной спектроскопии, химические сдвиги выражены в м.д. ( ЯМР относится к ядерной (протонной) магнитной резонансной спектроскопии, химические сдвиги выражены в м.д. (d) относительно внутреннего стандарта TMS. В настоящем изобретении термины превращение/преобразование или превратить/преобразовать используют взаимозаменяемо, и они означают одно и то же, реакцию одного соединения с образованием другого соединения описанным способом. TMS относится к триметилсилилу. Оксон относится к KHSO5. – MS относится к масс-спектроскопии, выраженной в единицах m/e, m/z или mass/charge. [M + H]+ относится к положительному иону исходного радикала плюс атом водорода. EI относится к электронному удару. CI относится к химической ионизации. FAB относится к бомбардировке быстрыми атомами. Фармацевтически приемлемый относится к таким свойствам /или веществам, которые являются приемлемыми для пациента с фармакологической/токсикологической точки зрения и для химика-изготовителя фармацевтического препарата с точки зрения физикохимии композиции, препарата, стабильности, приемлемости для пациента и биодоступности. Когда используют пары растворителей, соотношение используемых растворителей представлено в виде объем/объем (об/об). Когда используется растворение твердого продукта в растворителе, соотношение твердого продукта и растворителя представлено в виде масса/объем (мас./об.).
Эплеренон представляет собой 9 Неопентилгликоль представляет собой HO-CH2-C(CH3)2-CH2-OH. Йодозобензол представляет собой Йодбензолбистрифторацетат представляет собой Йодбензолдиацетат представляет собой Тритилфторборат, как известно, обозначается также как трифенилкарбений фторборат и представляет собой acac представляет собой ацетилацетонат. dppb представляет собой дифенилфосфинобутан. Tf относится к трифторметансульфонат. Диметилсульфид представляет собой CH3SCH3. Реагент Ишикава представляет собой N-(1,1,2,2,3,3,3)гексафторпропилдиэтиламин. “Агент окислительного отщепления” представляет собой реагент, который окисляет бискарбонильное соединение (V) или гидрокси-соединение (IV-OH) до карбоновой кислоты (VI). “Гидроперокси-деокислительный агент” представляет собой реагент, который удаляет атом кислорода из гидропероксидного соединения (IV-OOH) с получением соответствующего гидрокси-соединения (IV-OH). “Деокислительный агент” представляет собой реагент, который удаляет один атом кислорода из молекулы. “Гидроперокси-деокислительный агент” представляет собой, таким образом, конкретный вид деокислительного агента. “Образующий карбоновую кислоту агент” представляет собой реагент, который вызывает перегруппировку гидропероксидного соединения (IV-OOH) в карбоновую кислоту (VI). “Агент, отдающий кислород” представляет собой реагент, который подает атом кислорода в 7 ПРИМЕРЫ Без дополнительных уточнений, представляется, что любой специалист в данной области может, используя вышеуказанное описание, реализовать настоящее изобретение в его полном объеме. Следующие подробные примеры описывают получение различных соединений и/или выполнение различных способов изобретения и истолковываются только как иллюстративные, а не ограничивающие каким-либо образом вышеуказанные описания. Эти специалисты в данной области быстро определят необходимые варианты способов как в отношении реагентов и условий реакции, так и техники. Пример 1 17 17 Пример 2 17 17 Пример 3 17
Фильтрат концентрировали до образования пены, которую растворяли в этилацетате (40 мл), концентрировали до приблизительно 20 мл, высеивали, разбавляли циклогексаном (20 мл), концентрировали до приблизительно 30 мл, охлаждали до 0° в течение выходных, затем фильтровали, промывали этилацетат/циклогексаном (1/2) и сушили, с получением дополнительного указанного в заголовке соединения. Пример 4 17 Стадия A: 17 Смесь 17 Стадия B: 17 Концентрат (Стадия A) помещали в хлороформ (100 мл) и смесь перемешивали при 20-25° в течение 20 часов, во время чего преобразование цис-ендиона в транс-ендион считали завершенным по данным измерений ТСХ и LC (цис/транс = 1,1/98,9). Затем смесь концентрировали и концентрат помещали в этилацетат (20 мл) при 20-25° и разбавляли циклогексаном (80 мл), что вызывает кристаллизацию. Суспензию охлаждали, фильтровали и осадок промывали циклогексаном и сушили при пониженном давлении при 50° с получением указанного в заголовке соединения, СМР (CDCl3) 13,98, 23,28, 27,08, 28,66, 29,01, 31,26, 32,77, 33,61, 34,01, 35,22, 35,28, 40,48, 40,51, 42,41, 44,43, 48,13, 94,77, 118,81, 126,03, 135,89, 137,04, 142,16, 165,21, 176,32, 197,81, 198,26 и 200,18 Пример 5 17 Стадия A: 17 Смесь из 17 Стадия B: 17 Затем смесь стадии А гасили диметилсульфидом (340 мкл, 288 мг, 4,630 ммоль, 3,66 эквивалентов), нагревали до 20-25°, перемешивали при 20-25° в течение 50 минут, с получением смеси из указанного в заголовке соединения. Стадия C: 17 Затем смесь стадии B обрабатывали пероксидом водорода (70% водный, 430 мкл, 560 мг, содержащий 392 мг (11,52 ммоль, 9,12 эквивалентов) пероксида водорода) и раствор бикарбоната калия (637,7 мг, 6,369 ммоль, 5,04 эквивалентов) в воде (8 мл). Полученную двухфазную смесь разбавляли достаточным количеством метанола для получения однофазной смеси (5 мл), которую затем перемешивали при 20-25° в течение 16 часов, затем разбавляли до 500 мл объема метанолом с целью ЖХ-исследования. ЖХ-исследование показало при сравнении с известным соединением, что получено указанное в заголовке соединение. 20,0 мл Порцию 500 мл раствора удаляли и далее разбавляли метанолом до объема 50 мл. Этот раствор (содержащий 17,3 мг [0,0450 ммоль] карбоновой кислоты по LC) концентрировали до небольшого объема, разбавляли водой, подкисляли хлористоводородной кислотой (1 н.) и экстрагировали метиленхлоридом (2 x). Каждый из двух экстрактов промывали последовательно водой, затем объединяли и концентрировали. Концентрат помещали в метанол/толуол (1/1; 2 мл) и обрабатывали смесью триметилсилилдиазометана, (CH3)3SiCHN2, в гексане (2,0 M, 0,25 мл, 0,50 ммоль, 11,1 эквивалентов). ТСХ-анализ (этилацетат/циклогексан; 66/34) показал получение указанного в заголовке соединения, Rf = 0,23; LC-анализ (чувствительность 210 нм) показал аналогичную известному образцу задержку и получение указанного в заголовке соединения. Пример 6 17 Остаток 500 мл смеси стадии C примера 5 (479 мл, содержащий 414,4 мг [1,0777 ммоль] 17 Пример 7 17 Струю O3/O2 (озон/кислород) пропускали через охлажденную (-78o) смесь 17 Пример 8 17 После перемешивания реакционной смеси примера 7, 17 Пример 9 17 Струю озон/кислорода пропускали через охлажденную (-78º) смесь 17 Пример 10 5 17 Пример 11 17 Струю озона/кислорода пропускали через охлажденную (-79º) смесь 17 Пример 12 11 Смесь 11 Фильтрат концентрировали. Концентрат помещали в этилацетат (30 мл подогретый), охлаждали до 10o и фильтровали, с получением второй порции кристаллов, указанного в заголовке соединения. Пример 13 17 Смесь из 11 Пример 14 9 Смесь 9 Заданная структура подтверждена кристаллографическим анализом с помощью рентгеновских лучей. Пример 15 17 Струю озона/кислорода пропускали через охлажденную (-55o) смесь 17 Пример 16 17 Струю озона/кислорода пропускали через охлажденную (-55o) смесь 17 Пример 17 5 5 Пример 18 17 11 Пример 19 17 11 Пример 20 17 11 Пример 21 17 Следуя общему способу примера 3, используя аналогичные реагенты и делая незначительные изменения, получали указанное в заголовке соединение, СМР (100 МГц, CDCl3) 198,56, 176,53, 167,45, 152,74, 149,99, 142,84, 126,24, 119,73, 107,12, 105,89, 95,19, 44,08, 42,39, 41,90, 40,78, 38,52, 37,57, 35,39, 34,18, 33,93, 32,93, 31,26, 29,14, 26,83, 23,18, 14,12 и 13,38 Пример 22 17 Следуя общему способу примера 4, стадия А, используя аналогичные реагенты и делая незначительные изменения, получали указанное в заголовке соединение, СМР (100 МГц, CDCl3) 202,28, ~200, 199,05, 177,19, 166,56, 142,34, 138,49, 134,39, 126,37, 119,90, 95,57, 49,63, 44,90, 42,39, 41,08, 41,04, 35,82, 35,75, 34,49, 34,07, 33,25, 31,71, 30,12, 29,64, 27,49, 23,76 и 14,34 Пример 23 17 Следуя общему способу примера 9, используя аналогичные реагенты и делая незначительные изменения, получали указанное в заголовке соединение, СМР (100 МГц, CDCl3) 203,54, 199,91, 177,51, 168,98, 142,42, 125,05, 117,89, 105,90, 95,58, 55,82, 44,21, 44,21, 42,17, 41,21, 40,37, 35,33, 34,84, 33,62, 33,16, 32,38, 30,79, 28,84, 26,72, 23,02 и 13,55 Пример 24 17 Смесь Пример 25 5 Смесь 17 Пример 26 17 Смесь 5 Пример 27 17 Смесь Пример 28 11 Смесь 11 UV Пример 29 11 Смесь 11 Пример 30 11 Смесь 11 Пример 31 17 Реагент Ишикава (Ishikawa) (2,4 mK, 13,7 ммоль) добавляли к смеси 11 MS для C27H33O4. Вычислено: 421,238 (M + H+). Найдено: 421,2 m/z. Пример 32 9 Смесь 17 Пример 33 7 Смесь 17 Продукт еще раз хроматографировали (силикагель, 60 г; градиентное элюирование этилацетатом/циклогексаном, 15% Пример 34 5 Стадия (1) – 17 Смесь 17 Колонка: Supelco Discovery RP амид C16; 5 Поток: 1 мл/мин Определение: УФ; 240 нм Подвижная фаза: A: 950 г вода; 39 г ацетонитрил; 1,0 г трифторуксусная кислота B: 754 г ацетонитрил; 39 г вода; 1,0 г трифторуксусная кислота Градиент: T0: 80% A/20%B T15: 20% A/80%B T15,1: 80% A/20%B T20: 80% A/20%B Время пробега: 20 минут Поток: 1 мл/мин Объем введения: 5 Получение образца: 5 Наибольший реакционный пик ТХ (72%) был при 10,52 минут; время удержания известного стандарта карбоновой кислоты (VI) 10,52 минут. Стадия (2) – 5 Полученную органическую фазу, содержащую 17 Пример 35 17 11 Пример 36 17 11 Пример 37 17 11 Пример 38 17 11 СХЕМА А где R7-1 представляет собой (-A1) СХЕМА А – продолжение СХЕМА А – продолжение СХЕМА В СХЕМА С СХЕМА D где R7-1 представляет собой (-А1) СХЕМА D – продолжение СХЕМА D – продолжение (III-цис), или (III-транс), или смесь (III-цис) и (III-транс) (IV-ОН незащищенное кольцо А)+(V-незащищенное кольцо А)+ (VI-незащищенное кольцо А) СХЕМА D – продолжение (IV-ОН незащищенное кольцо А)+(V-незащищенное кольцо А) СХЕМА Е СХЕМА Е – продолжение (III-цис), или (III-транс), или смесь (III-цис) и (III-транс) СХЕМА Е – продолжение СХЕМА F СХЕМА G где R7-1 представляет собой (-А2) СХЕМА G – продолжение СХЕМА Н где R7-1 представляет собой (-В), (-С) или (-D1,-D2, -D3) СХЕМА I СХЕМА J СХЕМА K СХЕМА K – продолжение СХЕМА K – продолжение СХЕМА L СХЕМА М СХЕМА N СХЕМА N – продолжение СХЕМА О СХЕМА О – продолжение СХЕМА О – продолжение
Формула изобретения
1. Способ получения соединения формулы IX 2. Способ по п.1, дополнительно включающий взаимодействие соединения формулы (II) с агентом, выбранным из группы, состоящей из 3. Способ по п.2, дополнительно включающий взаимодействие соединения формулы III-cis с катализатором изомеризации с образованием соединения формулы III-trans 4. Способ по п.3, где катализатор изомеризации выбран из группы, состоящей из 5. Способ по п.3, дополнительно включающий взаимодействие соединения формулы III-cis или соединения III-trans или их смесей с озоном в присутствии спирта с образованием карбоновой кислоты соединения формулы VI 6. Способ по п.3, дополнительно включающий взаимодействие соединения формулы VI с кислотой, в реакционной среде, имеющей рН ниже, чем около 5 с получением соединения формулы VII. 7. Способ получения соединения формулы IX 8. Способ по п.7, где соединение формулы III-trans получено взаимодействием соединения формулы III-cis с катализатором изомеризации. 9. Способ по п.8, где соединение формулы III-cis получено превращением соединения формулы II 10. Способ по п.1 или 9, где соединение формулы II получено взаимодействием соединения формулы I 11. Способ получения соединения формулы IX
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция в тексте формулы изобретения
Извещение опубликовано: 10.03.2009 БИ: 07/2009
TH4A – Переиздание описания изобретения к патенту Российской Федерации
Причина переиздания: Коррекция в тексте формулы изобретения
Извещение опубликовано: 20.07.2009 БИ: 20/2009
|
||||||||||||||||||||||||||

 517
517 ,11
,11 -гидроксипрегн-4-ен-3-он-7
-гидроксипрегн-4-ен-3-он-7 -лактон, метиловый эфир) с использованием новых промежуточных продуктов. Способы проводят с использованием преобразования
-лактон, метиловый эфир) с использованием новых промежуточных продуктов. Способы проводят с использованием преобразования  4,6-3-кетостероида или его кеталя в соответствующую
4,6-3-кетостероида или его кеталя в соответствующую  метилйодида в основной среде
метилйодида в основной среде . Способ метилирования по настоящему изобретению представляет собой последовательный процесс.
. Способ метилирования по настоящему изобретению представляет собой последовательный процесс. 
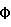 -CO- или
-CO- или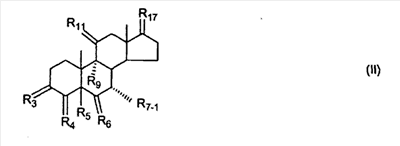


 ,
, N,
N, 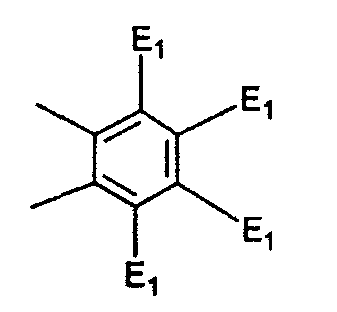





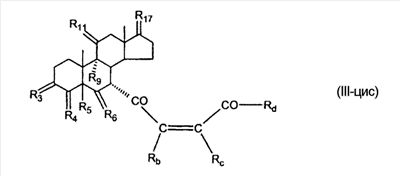
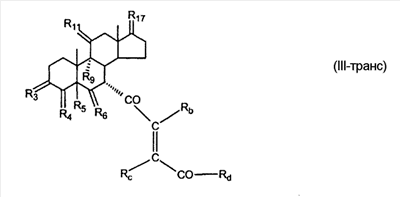
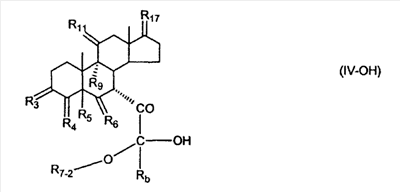
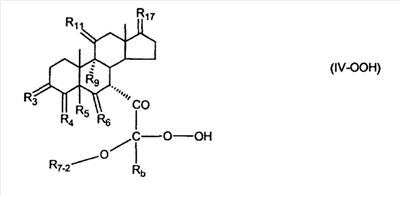
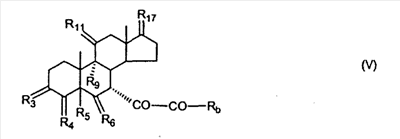
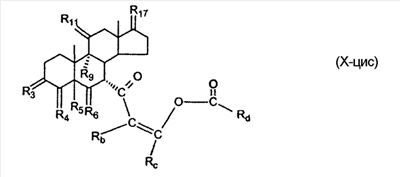
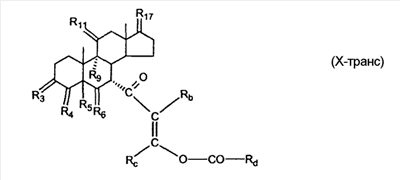
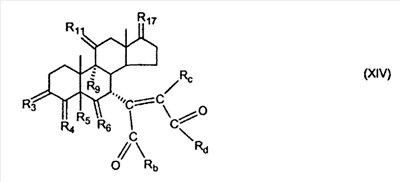
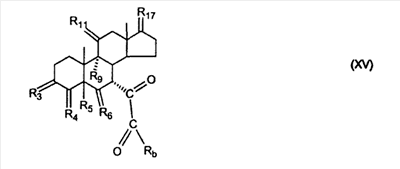
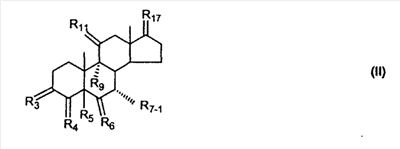
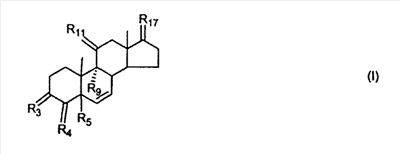


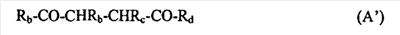




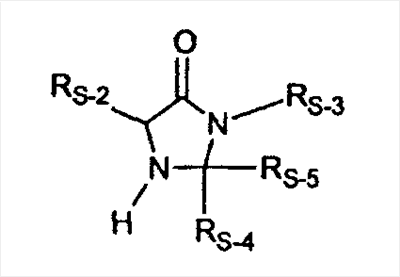
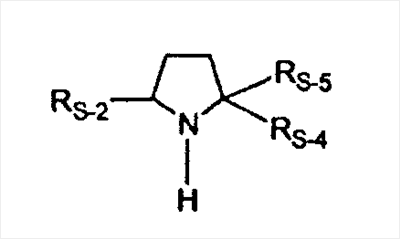
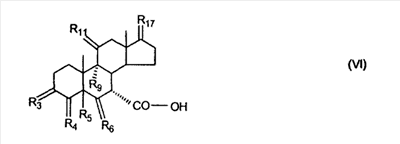
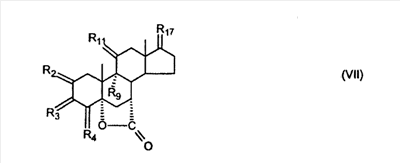
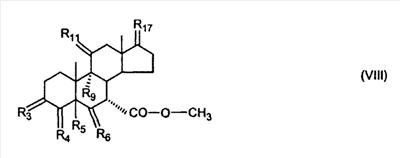
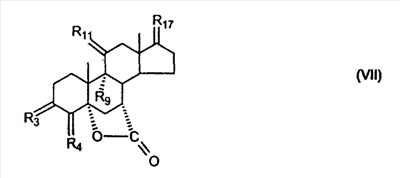
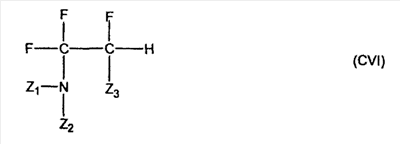

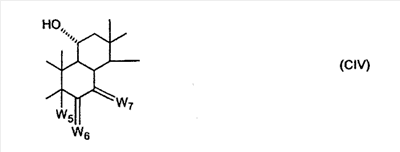
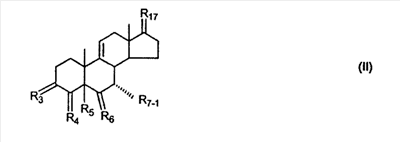
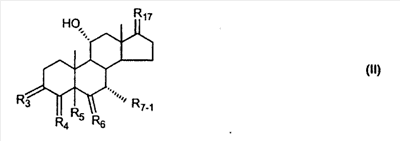
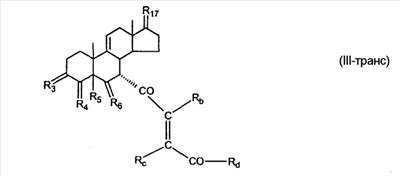
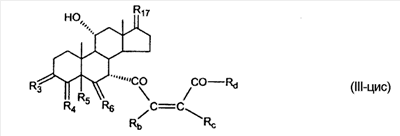
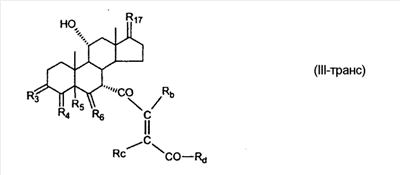
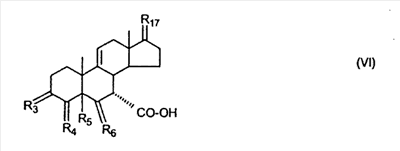
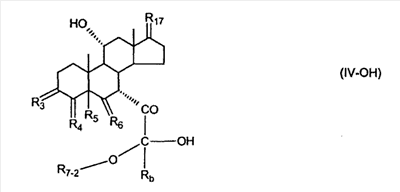
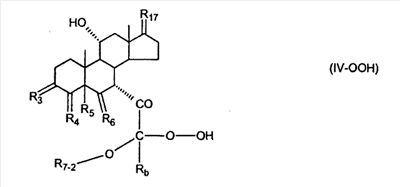
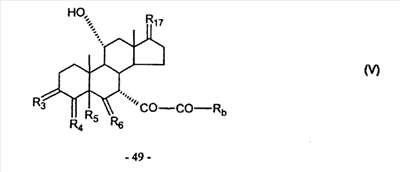
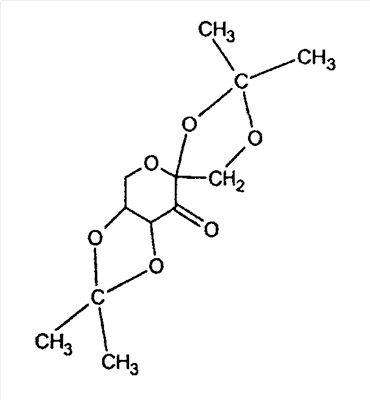



 ) относительно внутреннего стандарта TMS.
) относительно внутреннего стандарта TMS. относится к фенилу (C6H5).
относится к фенилу (C6H5).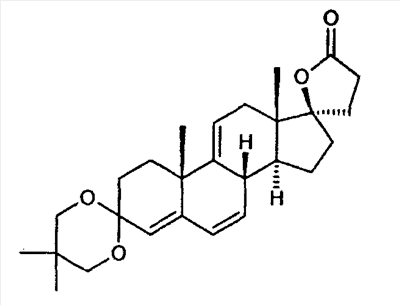
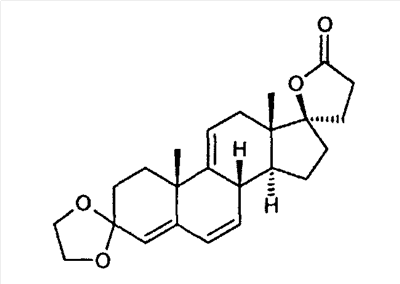
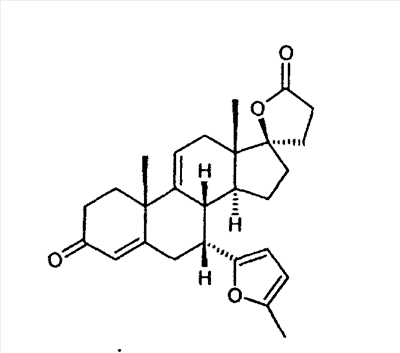
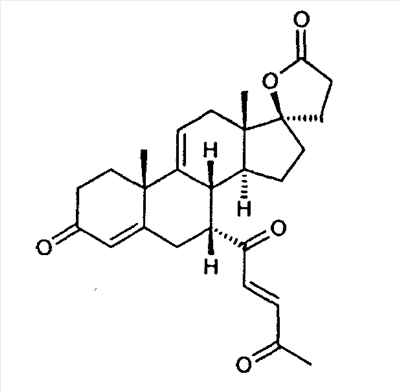
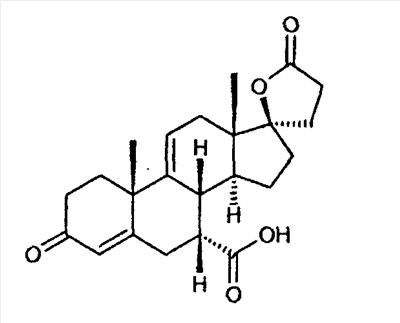
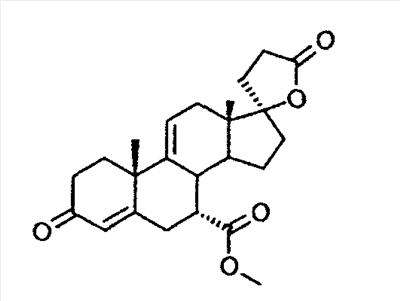
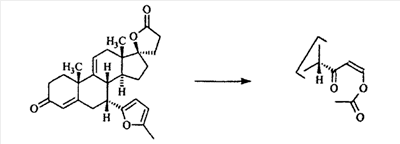
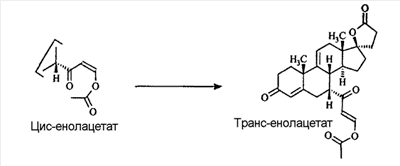
 70% этилацетат/циклогексан), с получением указанного в заголовке соединения. Затем данное вещество подвергали кристаллизации из этилацетат/гептан (70/30), с получением указанного в заголовке соединения в чистом виде, СМР (100 МГц, CDCl3) 199,25, 198,39, 176,41, 166,79, 166,39, 149,00, 142,57, 125,67, 118,20, 113,11, 94,90, 47,75, 44,40, 42,40, 40,45, ~40, 35,63, 35,25, 34,01, 33,56, 32,73, 31,29, 29,04, 27,14, 23,32, 20,47 и 13,98
70% этилацетат/циклогексан), с получением указанного в заголовке соединения. Затем данное вещество подвергали кристаллизации из этилацетат/гептан (70/30), с получением указанного в заголовке соединения в чистом виде, СМР (100 МГц, CDCl3) 199,25, 198,39, 176,41, 166,79, 166,39, 149,00, 142,57, 125,67, 118,20, 113,11, 94,90, 47,75, 44,40, 42,40, 40,45, ~40, 35,63, 35,25, 34,01, 33,56, 32,73, 31,29, 29,04, 27,14, 23,32, 20,47 и 13,98 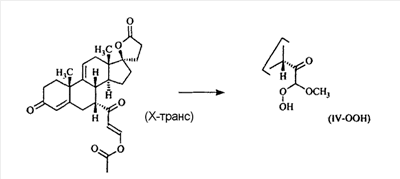
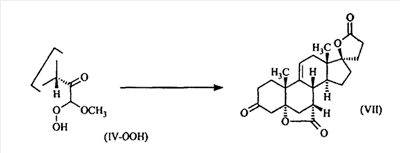
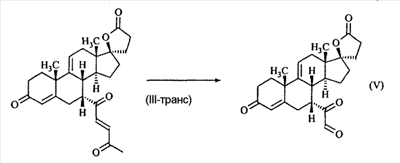
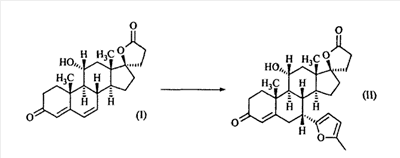
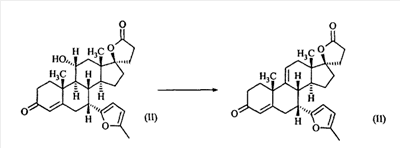
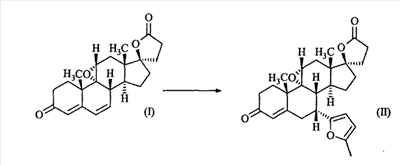
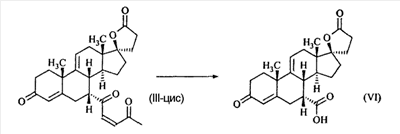
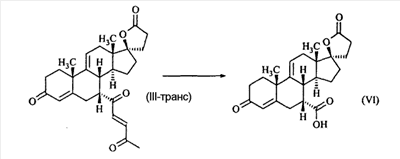
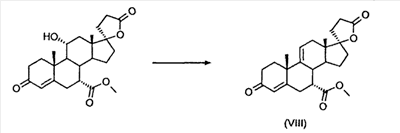

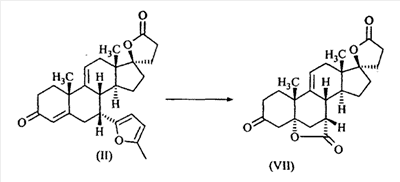


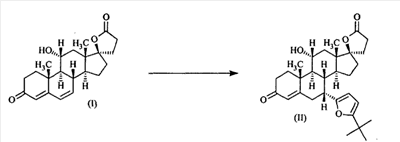
 max = 238 m
max = 238 m .
.