Патент на изобретение №2339620
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ОКСАЛАТ N, N-ДИМЕТИЛ-2-N, N-ДИМЕТИЛАМИНОМЕТИЛПИРИДИЛ-3-КАРБАМАТ, ОБЛАДАЮЩИЙ АНТИХОЛИНЭСТЕРАЗНОЙ АКТИВНОСТЬЮ И СПОСОБНОСТЬЮ УЛУЧШАТЬ КОГНИТИВНЫЕ ФУНКЦИИ
(57) Реферат:
Изобретение относится к области органической химии и касается получения приемлемого для фармацетических целей оксалата N,N-диметил-2-N,N-диметиламинометилпиридил-3-карбамата, обладающего антихолинэстеразной и антиамнестической активностью, который в отличие от других солей этой структуры не является гигроскопическим соединением. Технический результат: полученное соединение обладает более высокой антихолинэстеразной активностью чем ривастигмин (экселон), что дает основание рассматривать его как потенциальное лекарственное средство для лечения различных деменций. 8 табл.
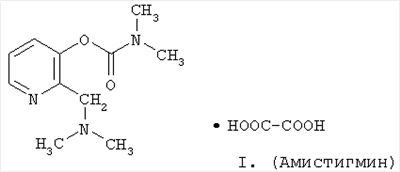
Изобретение относится к химии и медицине и касается получения фармацевтически приемлемого оксалата N,N-диметил-2-N,N-диметиламинометилпиридил-карбамата, обладающего антихолинэстеразными и антиамнестическими свойствами. Ранее дигидрохлорид этой структуры под названием аминостигмин описан как соединение, обладающее антихолинэстеразной активностью /1/, а также как лекарственный препарат, используемый в инъекционной лекарственной форме в качестве антидота при отравлении холиноблокирующими веществами /2/, но не использовался для лечения различных деменций. Существенным недостатком аминостигмина является гигроскопичность, что в значительной степени затрудняет его стандартизацию и усложняет производство лекарственных форм. Целью настоящего изобретения является создание фармацевтически приемлемого потенциального лекарственного средства ряда 3-оксипиридина, обладающего антихолинэстеразной активностью и способностью улучшать когнитивные функции. Следует подчеркнуть, что для решения поставленной задачи была синтезирована большая группа солей основания N,N-диметил-2-N,N-диметиламинометилпиридил-3-карбамата с различными органическими и неорганическими кислотами и лишь оксалат N,N-диметил-2-N,N-диметиламинометилпиридил-3-карбамата(I) не проявил гигроскопических свойств. Соединение I получают взаимодействием основания N,N-диметил-2-N,N-диметиламинометилпиридил-3-карбамата /3/ со щавелевой кислотой в среде органического растворителя, например ацетона. Строение I подтверждено данными элементного анализа, ПМР- и масс-спектров. Пример. Получение оксалата N,N-диметил-2-N,N-диметиламинометилпиридил-3-карбамата (I, амистигмин). К раствору 1,89 г (0,02 моля) щавелевой кислоты в 1 5 мл ацетона при 20°С постепенно прибавляют раствор 4,47 г (0,02 моля) N,N-диметил-2-N,N-диметиламинометилпиридил-3-карбамата в 15 мл ацетона. Смесь перемешивают 30 мин, осадок отфильтровывают, промывают 5 мл ацетона и сушат, получают 5,23 г (83,55%), ТПЛ 155-157°С (из изо-С3Н7ОН). Найдено, %: С 49,7; Н 6,40; N 13,42. С13Н19N3О6. Вычислено, %: С 49,83; Н 6,11; N 13,42. Изучение фармакологической активности амистигмина проводили в сравнении с его аналогом по действию ривастигмином (экселоном), который применяется в качестве средства, улучшающего когнитивные функции у больных с различными деменциями, в частности, при болезни Альцгеймера /4/. В нашей стране ривастигмин (экселон) используется ограниченно из-за высокой стоимости. В условиях in vitro с использованием коммерческих препаратов ацетилхолин-эстеразы эритроцитов человека и бутирилхолинэстеразы сыворотки лошадей амистигмин по антихолинэстеразной активности, определяемой по величинам констант ингибирования (KJ), существенно (на 2 порядка в отношении ацетилхолинэстеразы и на 1 порядок – бутирилхолинэстеразы) превосходит ривастигмин (табл.1). При этом, если амистигмин эффективно ингибирует оба фермента, то ривастигмин (экселон) ингибирует бутирилхолинэстеразу на 1 порядок сильнее, чем ацетилхолинэстеразу. В условиях ex vivo (на выделенных препаратах ацетилхолинэстеразы головного мозга и крови крыс, время инкубации 10 мин) амистигмин по антихолинэстеразной активности, определяемой по величинам k1 и IC50, также существенно (на 3 порядка) превосходит ривастигмин (экселон) (табл.2 и 3). В опытах на крысах изучали влияние однократного перорального введения амистигмина и ривастигмина (экселона) в эквитоксических дозах на нарушения обучения и памяти, вызываемые скополамином, с использованием метода условной реакции пассивного избегания /5/. Установлено, что под влиянием скополамина число животных, сохранивших навык условной реакции пассивного избегания, снижается (табл.4). Амистигмин вызывает мало зависимое от дозы ослабление амнестического эффекта скополамина. В целом аналогичные результаты получены и при изучении ривастигмина (экселона). При этом не установлено существенных различий в антиамнестическом действии исследуемых препаратов. В опытах на крысах изучали влияние однократного перорального введения амистигмина и ривастигмина (экселона) в эквитоксических дозах на нарушения памяти и обучения, вызываемые электрошоком, с использованием метода условной реакции пассивного избегания /5/. Установлено, что на этой модели амнезии (в отличие от приведенных выше данных, полученных на скополаминовой модели) как амистигмин, так и ривастигмин (экселон) оказывали слабое (статистически недостоверное) антиамнестическое действие (табл.5). В опытах на мышах изучали влияние однократного перорального введения амистигмина и ривастигмина (экселона) в эквитоксических дозах на нарушения памяти и обучения, вызываемые электрошоком, с использованием метода условной реакции пассивного избегания /5/. Установлено, что у интактных животных амистигмин вызывает зависимое от дозы достоверное улучшение обучаемости (отмечается существенное увеличение латентного периода захода животных в темный отсек камеры). В целом, сходный эффект отмечается и под влиянием ривастигмина (экселона) в эквитоксических дозах (средняя колонка табл.6). У мышей, получавших после обучения электрошок (без введения исследуемых препаратов) отмечается существенное ухудшение условно-рефлекторной деятельности, что проявляется 3-кратным уменьшением латентного периода захода в темный отсек камеры. Введение амистигмина, равно как и ривастигмина (экселона), сразу после обучения (до электрошока) приводит к зависимому от дозы существенному ослаблению амнестического эффекта электрошока (латентный период увеличивается более чем в 2 раза) (правая колонка табл.6). В опытах на крысах изучали влияние многократного (5 дней) перорального введения амистигмина и ривастигмина (экселона) в эквитоксических дозах на нарушения памяти и обучения, при многократном (5 дней) введении скополамина с использованием метода условной реакции активного избегания /6/. Установлено, что введение скополамина за 30-60 мин до сеанса обучения существенно нарушает процесс запоминания информации (табл.7). Амистигмин, начиная со 2 дня обучения, в отличие от ривастигмина, существенно уменьшает нарушение обучения, вызываемые скополамином (табл.8). Таким образом, заявляемое соединение (амистигмин) по антихолинэстеразной активности и по способности улучшать когнитивные функции превосходит используемый в клинической практике для лечения деменций препарат ривастигмин (экселон), в связи с чем оно представляет интерес в качестве потенциального антиамнестического средства.
Список литературы 1. Прозоровский В.Б., Павлова Л.В., Панова П.А. и др. – Хим.-фарм. журнал, 1991, № 1, 87-88. 2. Машковский М.Д. Лекарственные средства. Москва, Новая Волна. 2005, с.202. 3. John A., Aeschlimann, Arthur Stempel, Pat. US 2,512,732, June 27, 1950; Chem. Abstr., v.44, № 19-20, p.8961-8962 (1950). 4. Гаврилова С.И. Фармакотерапия болезни Альцгеймера. Москва, Пульс, 2003, с.115. 5. Андреева Н.И., Ленина В.В., Калинкина М.А. и др. – Хим.-фарм. журнал, 2005, № 1, с.6-9. 6. Буреш Я., Бурешова О., Хьюстон Д.П. Методики и основные эксперименты по изучению мозга и поведения. Москва, Высшая школа, 1991, 399 с.
Формула изобретения
Оксалат N, N-диметил-2-N, N-диметиламинометилпиридил-3-карбамата, отличающийся от других солей, например дигидрохлорида, отсутствием гигроскопичности, обладающий антихолинэстеразной активностью и улучшающий когнитивные функции.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||