|
|
(21), (22) Заявка: 2006103696/15, 08.02.2006
(24) Дата начала отсчета срока действия патента:
08.02.2006
(43) Дата публикации заявки: 20.08.2007
(46) Опубликовано: 20.11.2008
(56) Список документов, цитированных в отчете о
поиске:
PIATEC A.S. et al. Genotypic analysis of Mycobacterium tuberculosis in two distinct populations using molecular beacons: implications for rapid susceptibility testing. Antimicrob. Agents Chemother. 2000, Jan. 44(1), pp.103-104. VICTOR T.C. et al. Detection of mutations in drug resistance genes of Mycobacterium tuberculosis by dot-blot hybridization
Адрес для переписки:
191036, Санкт-Петербург, Лиговский пр., 2-4, НИИ фтизиопульмонологии, патентный отдел
|
(72) Автор(ы):
Мокроусов Игорь Владиславович (RU),
Оттен Татьяна Фердинановна (RU),
Нарвская Ольга Викторовна (RU),
Вишневский Борис Израилевич (RU)
(73) Патентообладатель(и):
Федеральное государственное учреждение “Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии Федерального агентства по здравоохранению и социальному развитию” (RU),
Федеральное государственное учреждение науки “Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии им. Пастера Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека” (RU)
|
(54) СПОСОБ ЭКСПРЕССНОГО ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ К ИЗОНИАЗИДУ У МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА
(57) Реферат:
Изобретение относится к медицине, а именно к фтизиатрии, и касается способа экспрессного определения устойчивости к изониазиду у микобактерий туберкулеза. Сущность изобретения включает определение специфических мутаций в кодоне 315 гена katG методом ПЦР с использованием двух внешних праймеров для фрагмента 669-1103 и внутреннего обратного аллельспецифического праймера, 3 -конец которого соответствует 2-му основанию в кодоне 315 katG AGC, и при амплификации фрагмента ДНК длиной 435 пн и отсутствии амплификации фрагмента ДНК длиной 292 пн судят о наличии штаммов с мутацией АСС и АСА в указанном кодоне, устойчивых к изониазиду. Преимущество изобретения заключается в повышении чувствительности. 2 ил. -конец которого соответствует 2-му основанию в кодоне 315 katG AGC, и при амплификации фрагмента ДНК длиной 435 пн и отсутствии амплификации фрагмента ДНК длиной 292 пн судят о наличии штаммов с мутацией АСС и АСА в указанном кодоне, устойчивых к изониазиду. Преимущество изобретения заключается в повышении чувствительности. 2 ил.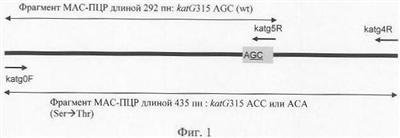
(56) (продолжение):
CLASS=”b560m”strategy. Tubercle and Lung disease. 1999, v.79, №6, pp.343-348. VAN DOORN H.R. et al. Detection of a point mutation associated with high-level resistance in Mycobacterium tuberculosis by using real-time PCR-technology with 3-minor groove binder DNA probes. J. Clin. Microbiol. 2003, oct. 41 (10), pp.4630-4635.
Изобретение относится к медицине, а именно к фтизиатрии, и может быть использовано для лабораторного определения устойчивости к изониазиду у микобактерий туберкулеза.
Эффективное применение современных схем лечения туберкулеза затруднено селекцией и циркуляцией штаммов Mycobacterium tuberculosis, устойчивых к основным противотуберкулезным препаратам первого ряда, в частности к рифампицину (RIF), изониазиду (INH), стрептомицину. Мультирезистентными считаются штаммы МБТ, устойчивые к RIF и INH. В то время как устойчивость к RIF связана с мутациями в коротком участке одного гена (rpoB), развитие устойчивости к INH находится под контролем сложной системы, включающей гены katG, inhA, kasA, ahpC, ndh [1-3]. В то же время, многочисленные исследования показали, что наиболее часто маркером устойчивости к INH являются мутации в гене katG [1, 2]. Изониазид, применяемый в терапии, подвергается каталитической активации в микробной клетке; эту функцию выполняет каталаза-пероксидаза, продукт гена katG [1, 2]. Основной путь развития устойчивости к INH, опосредованный изменениями в katG, состоит в отборе спонтанных мутаций, которые снижают каталазную активность, но сохраняют достаточный для жизнедеятельности микробной клетки уровень пероксидазной активности фермента. Мутация в кодоне 315 AGC ACC (Ser ACC (Ser Thr) является примером такой мутации, обеспечивающей высокий уровень устойчивости к INH (1-10 mg/l) [4]. Эта мутация выявляется у большинства циркулирующих INH-устойчивых штаммов МБТ в странах с высоким уровнем заболеваемости туберкулезом [1, 2, 5], в том числе и в России (до 94%) [6-8]. Thr) является примером такой мутации, обеспечивающей высокий уровень устойчивости к INH (1-10 mg/l) [4]. Эта мутация выявляется у большинства циркулирующих INH-устойчивых штаммов МБТ в странах с высоким уровнем заболеваемости туберкулезом [1, 2, 5], в том числе и в России (до 94%) [6-8].
Традиционные фенотипические методы определения лекарственной чувствительности требуют больших затрат времени (до 1,5 месяцев), и даже внедрение более современных методов (например, Bactec – 6-10 дней) не позволяет обеспечить экспрессный анализ. Применение молекулярно-генетических методов исследования генетических детерминант устойчивости, не требующих длительного культивирования, позволяет решить эту проблему. Применяемые в настоящее время многочисленные методы определения мутаций в katG315 включали прямое секвенирование ДНК, анализ полиморфизма одноцепочечной ДНК, полиморфизма длины продуктов кливазного расщепления и полиморфизма длины фрагментов рестрикции, метод “молекулярных маячков” и дот-гибридизацию [3-11]. Недостатками указанных методов являются трудоемкость и длительность, сложность и/или высокая стоимость оборудования, не всегда достаточная воспроизводимость и неоднозначная интерпретация результата.
В качестве прототипа предлагается метод полимеразной цепной реакции (ПЦР) фрагмента гена katG в “реальном времени” (метод “молекулярных маячков” [10]); при этом внутренний олигонуклеотид взаимодействует с продуктом ПЦР только при отсутствии в нем мутаций резистентности, что сопровождается флуоресценцией. Метод требует использования специального термоциклера, стоимость которого в 3-6 раз превышает стоимость оборудования для стандартной ПЦР, и агарозного гель-электрофореза.
Задачей предлагаемого изобретения является разработка способа быстрой и надежной детекции устойчивости микобактерий туберкулеза к изониазиду на основе выявления мутаций в кодоне 315 гена katG.
Поставленная задача достигается определением специфических мутаций в гене katG315 методом ПЦР с аллель-специфическим праймером для кодона 315. При отсутствии мутаций в данном кодоне происходит аллель-специфическая амплификация фрагмента гена katG; наличие мутации в позиции, соответствующей 3′-концу праймера, ведет к неспариванию праймера и матрицы и неспособности полимеразы к синтезу комплементарного фрагмента. Таким образом, наличие мутации (INH-резистентного фенотипа) приводит к отсутствию индикаторного фрагмента. Обратный аллель-специфический праймер соответствует по своему 3′-концу второму основанию кодона 315 (Фиг.1). При этом выявляются мутации и во втором, и в третьем основаниях данного кодона, обеспечивающих устойчивость к INH у более 90% INH-устойчивых штаммов МБТ в России [6-8]. Анализ результатов проводится путем электрофореза продуктов ПЦР в горизонтальном агарозном мини-геле.
Преимущества предлагаемого способа:
– быстрота (один день от момента выделения ДНК),
– простая и однозначная интерпретация результатов,
– простое оборудование для стандартной ПЦР и агарозного гель-электрофореза,
– возможность быстрого анализа больших коллекций штаммов МБТ для оценки применимости метода на данной территории и при популяционных исследованиях.
Сущность изобретения поясняется чертежами, где:
Фиг.1. Схематическое изображение фрагмента гена katG, анализируемого в аллель-специфической ПЦР. wt (wild type) – дикий аллель katG315. Короткие стрелки показывают праймеры (katg0F, katg5R, katg4R), длинные двусторонние стрелки – индикаторные продукты ПЦР.
Фиг.2. Анализ препаратов очищенной ДНК из штаммов М. tuberculosis методом МАС-ПЦР.
Дорожки: 1, 3, 4 – штаммы с мутацией katG315 AGC ACC; 2, 5, 6 – штаммы с диким аллелем katG315; 7 – штамм с мутацией AGC ACC; 2, 5, 6 – штаммы с диким аллелем katG315; 7 – штамм с мутацией AGC ACA (штамм W). ACA (штамм W).
М – маркер молекулярных весов “100 bp DNA Ladder” (Amersham Biosciences).
Способ осуществляется следующим образом.
Выделение ДНК из культуры МБТ, выращенной на среде Левенштейна-Йенсена, проводят по van Embden et al. [12] при выделении очищенной ДНК и по Mazars et al. [13] при получении клеточных лизатов. В первом случае суспендируют 1 петлю культуры в общем объеме 400 мкл буфера ТЕ 1х и инкубируют 20 мин при 85°С. Дальнейшую обработку проводят с использованием лизоцима, протеиназы К, додецилсульфата натрия и цетилтриметиламмонийбромида. Полученный лизат обрабатывают смесью хлороформ-изоамиловый спирт (24:1), центрифугируют, осаждают изопропанолом, промывают 70% этанолом, осадок высушивают и растворяют в 30-50 мкл ТЕ х0.5. При получении грубого препарата ДНК (клеточного лизата) 1 петлю культуры суспендируют в 100 мкл буфера ТЕ 1х, кипятят 20 мин, центрифугируют 15 мин (12000 об/мин), и полученный супернатант используют для ПЦР.
Вариант одношаговой мультиплексной аллель-специфической ПЦР (МАС-ПЦР) с использованием сконструированных праймеров. Материал для реакции – чистая ДНК достаточно хорошего качества и количества. Проводят реакцию ПЦР фрагмента гена katG, включающего кодон 315, с использованием двух внешних праймеров (katg0F и katg4R) и одного внутреннего аллель-специфического katg5R (Фиг.1). Продукты ПЦР разделяют в агарозном 1.5% гель-электрофорезе. Отсутствие фрагмента длиной 292 пн (пн – пар нуклеотидов) (и амплификация фрагмента 435 пн) свидетельствует о присутствии мутации в кодоне 315 и, следовательно, о INH-резистентности штамма МБТ (Фиг.2). Метод использует три праймера. 3′-конец внутреннего обратного праймера соответствует 2-му основанию в кодоне katG315 AGC (дикого типа). (Фиг.1).
Следующие праймеры были использованы для MAC-ПЦР фрагмента katG315 (позиции в гене katG 669-1103 в штамме H37Rv [номер доступа в GenBank X68081, позиции 2647-3081]): два внешних праймера, прямой katg0F (5′-GCAGATGGGGCTGATCTACG) и обратный katg4R (5′-AACGGGTCCGGGATGGTG), и внутренний обратный праймер katg5R (5′-ATACGACCTCGATGCCGC). Очищенная ДНК (0.1-0.5 мкл) добавляется к смеси ПЦР (конечный объем 30 мкл), содержащей 1,5 mM MgCl2, 1 U rTaq ДНК полимеразы (MBI Fermentas), 200  M каждого из дНТФ, праймеры katg0F и katg5R (по 30 pmole), и katg4R (40 pmole). ПЦР проводили в термоциклере РТС-100 (MJ Research, Inc.) в следующих условиях: 96°С, 3′; 5 циклов 95°С, 45 с, 64°С, 1′, 72°С, 30 с; 5 циклов 95°С, 40 с, 62°С, 40 с, 72°С, 30 с; 20 циклов 94°С, 50 с, 60°С, 40 с, 72°С, 20 с; заключительная элонгация 72°С, 3′. Продукты ПЦР (10 M каждого из дНТФ, праймеры katg0F и katg5R (по 30 pmole), и katg4R (40 pmole). ПЦР проводили в термоциклере РТС-100 (MJ Research, Inc.) в следующих условиях: 96°С, 3′; 5 циклов 95°С, 45 с, 64°С, 1′, 72°С, 30 с; 5 циклов 95°С, 40 с, 62°С, 40 с, 72°С, 30 с; 20 циклов 94°С, 50 с, 60°С, 40 с, 72°С, 20 с; заключительная элонгация 72°С, 3′. Продукты ПЦР (10  1) разделяли электрофорезом в 1,5% агарозном геле и визуализировали на УФ-трансиллюминаторе. 1) разделяли электрофорезом в 1,5% агарозном геле и визуализировали на УФ-трансиллюминаторе.
Оценка результатов.
В отсутствие мутации в кодоне 315 праймер участвует в ПЦР и амплифицирует фрагмент 292 пн (Фиг.2В, Дор. 2, 5, 6). В случае мутации (например, AGC ACC) возникает неспаривание на 3′-конце внутреннего праймера и отсутствие амплификации фрагмента длиной 292 пн. Два внешних праймера katg0F и katg4R фланкируют весь изучаемый участок гена katG (Фиг.1). В случае дикого аллеля katG315 амплификация фрагмента длиной 435 пн не происходит из-за конкурентной амплификации фрагмента длиной 292 пн праймером katg5R. Фрагмент длиной 435 пн амплифицируется только у штаммов с мутацией в katG315 (Фиг.2В, Дор. 1, 3, 4, 7) и таким образом является индикатором INH-резистентного фенотипа. ACC) возникает неспаривание на 3′-конце внутреннего праймера и отсутствие амплификации фрагмента длиной 292 пн. Два внешних праймера katg0F и katg4R фланкируют весь изучаемый участок гена katG (Фиг.1). В случае дикого аллеля katG315 амплификация фрагмента длиной 435 пн не происходит из-за конкурентной амплификации фрагмента длиной 292 пн праймером katg5R. Фрагмент длиной 435 пн амплифицируется только у штаммов с мутацией в katG315 (Фиг.2В, Дор. 1, 3, 4, 7) и таким образом является индикатором INH-резистентного фенотипа.
Условия предлагаемого метода были отработаны на 46 штаммах с известной последовательностью katG315 [6], имевших следующее распределение аллелей: дикий тип (AGC) – 23, АСС – 22, АСА – 1.
Пример 1. Анализ 204 проб ДНК фенотипически INH-устойчивых штаммов, выделенных от эпидемиологически не связанных больных в 1997-2002 гг. (Санкт-Петербург, Ленинградская и Новгородская области). Мутации в katG315 были выявлены у 191 (93.6%) штаммов. Другие исследования, проведенные в России, показали наличие данных мутаций у 98% из 113 INH-устойчивых штаммов [7]. Таким образом, этот метод обеспечивает высокую чувствительность определения устойчивости МБТ к изониазиду в России.
Пример 2. Анализ проб из 25 клеточных лизатов. Во всех случаях результаты анализа лизатов и очищенной ДНК тех же штаммов совпадали.
Пример 3. Известный штамм W, вызвавший эпидемию мультирезистентного туберкулеза в Нью-Йорке в начале 1990-х гг. [14], устойчив к изониазиду вследствие редкой двойной мутации в katG315 AGC ACA. Применение метода МАС-ПЦР позволило успешно определить наличие этой мутации в образце ДНК штамма W, предоставленном Питером Смоллом (Стэнфордский университет, США). ACA. Применение метода МАС-ПЦР позволило успешно определить наличие этой мутации в образце ДНК штамма W, предоставленном Питером Смоллом (Стэнфордский университет, США).
Литература
2. Slayden R.A., and C.E.Barry, 3rd
9. Cockerill FR, 3rd
Формула изобретения
Способ экспрессного определения устойчивости к изониазиду у микобактерий туберкулеза путем определения специфических мутаций в кодоне 315 гена katG посредством ПЦР, отличающийся тем, что применяют мультиплексную ПЦР с использованием двух внешнимх праймеров для фрагмента 669-1103 katG и внутреннего обратного аллельспецифического праймера, 3 -конец которого соответствует 2-му основанию в кодоне katG315 AGC, и при амплификации фрагмента ДНК длиной 435 пн и отсутствии амплификации фрагмента ДНК длиной 292 пн судят о наличии штаммов с мутацией АСС и АСА в указанном кодоне, устойчивых к изониазиду. -конец которого соответствует 2-му основанию в кодоне katG315 AGC, и при амплификации фрагмента ДНК длиной 435 пн и отсутствии амплификации фрагмента ДНК длиной 292 пн судят о наличии штаммов с мутацией АСС и АСА в указанном кодоне, устойчивых к изониазиду.
РИСУНКИ
|
|