Патент на изобретение №2238979
|
||||||||||||||||||||||||||
(54) СПОСОБ ОПРЕДЕЛЕНИЯ АНТИРАДИКАЛЬНОЙ АКТИВНОСТИ ВЕЩЕСТВ IN VITRO
(57) Реферат:
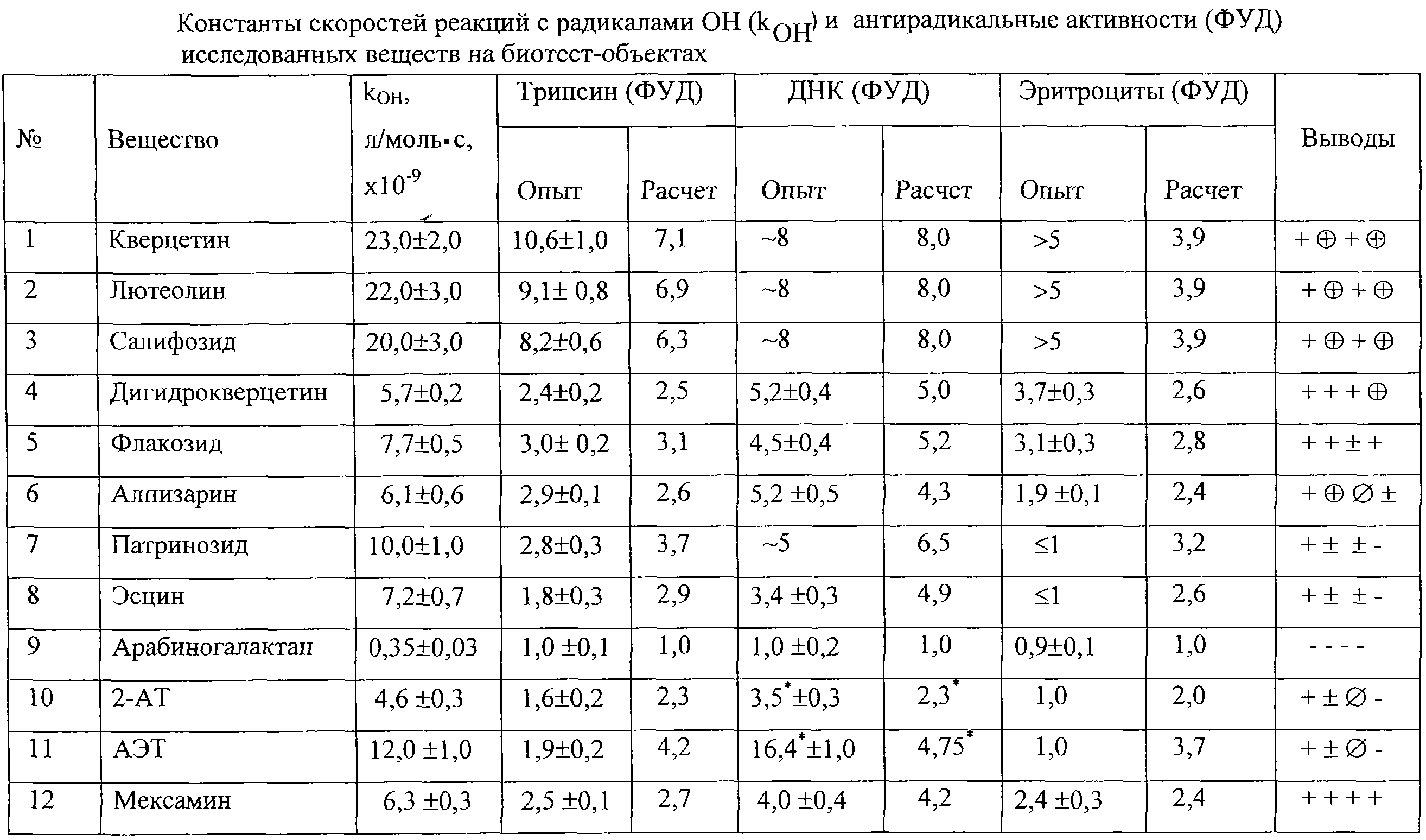
Изобретение относится к области биотехнологии и может быть использовано для определения антирадикальной активности веществ по способности взаимодействия их с радикалами ОН. Определение величины константы скорости реакции вещества с радикалами ОН (kOH) проводят в условиях Изобретение относится к медицине и может быть использовано, в частности, в фармакологии, радиобиологии, экологии для определения биологической активности веществ на антирадикальную активность по способности взаимодействия их с радикалами ОН. Тестирование биологически активных веществ по способности взаимодействовать с радикалами ОН – актуальный подход для изучения свойств, понимания механизмов фармакологического действия биологически активных веществ (БАВ) и скрининга веществ – потенциальных радиопротекторов. Радикал ОН является наиболее активным из активированных форм кислорода (АФК: О–2, 1О2, ОН, HO2• , RО Присутствие БАВ, способных к активному перехвату радикалов ОН, должно модифицировать результат повреждающего действия этих радикалов. Направленность же модифицирующего эффекта и его величина в значительной мере определяются также свойствами образующихся радикальных состояний молекулы БАВ: нейтральны ли они по отношению к основным мишеням действия радикалов ОН в организме, либо способны с ними взаимодействовать. Например, относительно действия ионизирующей радиации вещества, обладающие антирадикальной активностью к радикалам ОН и образующие при этом продукты, нейтральные к мишеням, могут рассматриваться как потенциальные радиопротекторы. Антирадикальную активность веществ оценивают на различных моделях с использованием в качестве тест-объекта подопытных животных. Так изучали влияние исследуемого вещества на интенсивность процессов перекисного окисления липидов /пат. РФ № 2066319/. Для этого использовали модель отравления крыс карбофосом. Контрольной группе крыс карбофос вводили однократно в дозе ЛД50 (260 мг/кг внутрижелудочно). Животных опытных групп лечили атропином (5 мг/кг) и дипироксином (25 мг/кг) внутрибрюшинно через 5 мин, 3 и 6 часов после отравления. Действие исследуемого препарата сравнивали с эффективностью ионола в дозе 120 мг/кг. На 14-е сутки после отравления регистрировали биохимические показатели. Объектом биохимических исследований служили миокард и полушария головного мозга крыс. В липидных экстрактах миокарда и полушарий головного мозга определяли продукты окисления липидов (ПОЛ). Экстракцию липидов проводили по методу Фолча. Пробы гомогенизировали на холоду в продутых аргоном реагентах. Липиды определяли гравиметрически, упаривая растворитель на вакуумном роторном испарителе при 50 Известен экспресс-метод определения антирадикальной активности, основанный на определении спектрофотометрически способности исследуемых веществ реагировать с дифенилпикрилгидразилом (ДФПГ) – стабильным радикалом /пат.РФ № 2141331/. ДФПГ взаимодействует с соединениями, которые обладают подвижным атомом водорода, например тиолы, фенолы, амины, амиды и др., изменяя свою окраску; он устойчив к действию кислорода воздуха. Реакции проводили в спиртовом растворе, исследуемые вещества присутствовали в эквимолярных количествах. Спиртовой раствор ДФПГ и препарата смешивали и определяли на спектрофотометре оптическую плотность при 250 нм сразу после смешивания, затем через 10, 30 и 60 мин. Антирадикальную активность рассчитывали по изменению оптической плотности раствора ДФПГ при взаимодействии его с исследуемыми препаратами. Известные способы определения антирадикальной активности не информативны относительно радикалов ОН, т.к. в используемых системах инициируются либо многие из АФК, либо органические пероксидные радикалы, либо используется вещество, существующее в радикальной форме. Наиболее близким техническим решением к заявляемому методу является способ определения антирадикальной активности веществ in vitro, заключающийся в Недостатком данного способа является невозможность оценки свойств образующихся радикальных состояний веществ или стабильных продуктов их превращений: нейтральны они к биомишеням или сами способны их повреждать. Задача, на решение которой направлено предлагаемое изобретение, состоит в создании высокоэффективного способа определения БАВ, обладающих антирадикальной активностью (к радикалам ОН) за счет расширения информативности способа и повышения достоверности выводов о свойствах исследуемого вещества. Поставленная цель достигается за счет использования способа определения антирадикальной активности веществ in vitro, заключающегося в В радиационно-химических исследованиях установлено, что модификаторы повреждающего действия ионизирующей радиации являются активными перехватчиками радикальных продуктов радиолиза воды, в частности радикалов ОН, их константы скоростей реакций с радикалами ОН имеют величины, близкие к значениям, предельным для реакций, контролируемых диффузией. Различия же в эффектах определяются свойствами продуктов реакции: протекторы дают продукты, не участвующие в дальнейших реакциях, а сенсибилизаторы образуют активный продукт, который повреждает молекулы мишени более эффективно, чем продукты радиолиза воды. Авторами данного изобретения был разработан метод комплексной оценки антирадикальных свойств БАВ, включающий непосредственное определение величины константы скорости реакции веществ с радикалами ОН и испытания на биотест-объектах, соответствующих основным мишеням действия этих радикалов в организме: белок (трипсин), ДНК и природный белково-липидный комплекс (эритроциты), с последующим сопоставлением эффективности защиты биотест-объектов от повреждения радикалами ОН, наблюдаемой в эксперименте с полученной расчетным путем, исходя из величины kOH. Использование предложенного способа позволило получить 1) количественную оценку антирадикальной активности БАВ, а именно величину константы скорости реакции БАВ с радикалами ОН, 2) данные о свойствах вторичных радикалов БАВ (реактивны они относительно биомишеней или нет), 3) возможность сопоставить антирадикальные и антиоксидантные эффекты БАВ. Биотест-объекты выбраны, исходя из требований, предъявляемых к первичному скринингу: доступность и сравнительно несложная процедура тестирования. Использованы: трипсин – протеолитический фермент, ДНК высокомолекулярная (12 Изобретение иллюстрируется следующими примерами. Используемое оборудование: 1. Источник 2. Низкоградиентный многошариковый (4- или 3-шариковый) капиллярный вискозиметр типа Оствальда с градиентами скорости, например, 0=18, 30, 50 сек-1 для 1хССЦ, или ротационные низкоградиентные вискозиметры коммерческого производства (например, вискозиметр Зимма). 3. Спектрофотометр с регистрацией поглощения в УФ – и видимой областях спектра, ультратермостат для наружного термостатирования; термостат водяной со встряхиванием пробирок; желательно автоматические пипетки для отбора проб. Используемые материалы: 1. р-Нитрозодиметиланилин – эталон сравнения с известной константой скорости реакции с радикалами ОН. 2. Белок – трипсин бычий панкреатический, лиофилизованный, свободный от солей. М.м. 23800 Да. 3. ДНК высокомолекулярная лиофилизованная тимуса теленка или селезенки крупного рогатого скота. М.м. (12-18)x106 Да, содержание белка в РНК не более 3%, Г.Э. 37-40%, содержание ГЦ-пар – 42%. 4. Эритроциты, свежевыделенные из стабилизированной крови беспородных крыс-самцов (200-250 г). Описание предлагаемого способа. 1-й этап способа – р-нитрозодиметиланилин (ПНДА), разрушение которого радикалами ОН, инициируемыми в водном растворе действием 2, 3, 4-ые этапы способа – биотест-объекты выбраны с постепенным усложнением структуры: белок (трипсин), высокомолекулярная ДНК и функционирующий белково-липидный комплекс мембраны в виде безъядерных клеток зрелых эритроцитов. На этих этапах оценивали противолучевую активность исследуемого вещества. Для этого сопоставляли разрушение биотест-объекта в водном растворе без вещества и в его присутствии: на трипсине – по тесту нарушения ферментативной активности, на ДНК тестом является появление двунитевых разрывов, определяемых вискозиметрически, на эритроцитарной системе тест повреждения – гемолиз с регистрацией снижения светорассеяния. При использовании заявляемого способа определяли противолучевую активность БАВ по фактору увеличения дозы облучения (ФУД), который применяют в радиобиологии для оценки эффективности защитного действия и рассчитывают по соотношению равноповреждающих доз при облучении в присутствии испытуемого вещества и без него. Выбранные для тестирования условия облучения (насыщенные воздухом разбавленные водные буферные растворы с рН, близкими к нейтральным) таковы, что из образующихся активных продуктов радиолиза воды (eag. ОН, Н, НO2) лишь радикалы ОН осуществляют повреждение моделей, а остальные активные частицы образуются с меньшим (в 4-6 раз) выходом и на 1-2 порядка менее активны, либо дезактивизируются кислородом воздуха. Образующиеся радикальные продукты БАВ (БАВ Значение ФУД, определенное в эксперименте, сопоставляется с величиной ФУД, полученной известным расчетным путем /Амирагова М.И., Жеребченко П.Г., Комар В.Е. и др. Пределы модифицируемости лучевого поражения. М.: Атомиздат, 1978, 216 с./. Характеристики используемых биотест-объектов и условий работы с ними: р-Нитрозодиметиленанилин – использовали как акцептор радикалов ОН для определения констант скоростей реакции веществ с радикалами ОН в условиях стационарного облучения. Для этого применяли растворы ПНДА концентрации (2-5)x10-5 М в 0,001 М фосфатном буфере с необходимым значение рН, соотношение молекулярных концентраций БАВ и ПНДА варьируется от 0,02 до 12 в зависимости от реакционной способности БАВ к радикалам ОН. Для облучения использовали дозы 50%-ной деструкции ПНДА в буфере без добавления вещества. Спектрофотометрически наблюдали за разрушением хромофора ПНДА. Определяли убыль оптической плотности ПНДА при облучении без БАВ и в его присутствии. Величина kOH больше 1 Трипсин – классическая белковая модель. Для исследования радиопротекторной активности применяли растворы трипсина 0,2 мг/мл (4,2 ДНК. Для работы готовили из препарата ДНК основной концентрированный раствор (1 мг/мл). Лиофилизованный препарат ДНК растворяли в растворителе с низкой ионной силой: натрий-цитратном буфере -0,1 Концентрацию ДНК определяли спектрофотометрически (А47мкг/мл260=1,0). Для облучения готовили раствор ДНК 200 мкг/мл в 0,1 Эритроциты. Стабилизированную (нитратную или оксалатную) кровь центрифугировали 15 мин при 4000 об/мин, осадок эритроцитов четырежды промывали буферным физиологическим раствором с рН 7,4 (0,15 М NaCl в 0,01 М фосфатном буфере). Отмытые от сыворотки эритроциты разводят таким же физраствором. Для облучения готовили суспензию эритроцитов 0,6-0,7 опт.ед. ( Условия облучения. Насыщенные воздухом растворы облучали при Т=10-15 – ПНДА – дозы 150 и 300-350 Гр в зависимости от концентрации ПНДА, мощность дозы 1,3 Гр/с, – трипсин – дозы от 50 до 600 Гр (при снятии дозовых зависимостей) и 200 Гр при однократном облучении (мощность дозы 1,3 Гр/с), – ДНК – дозы от 10 до 300 Гр и выше (мощность 0,3 Гр/с), – Эритроциты – дозы от 150 Гр до 2,4 кГр (мощность дозы 1,3 Гр). Различия в диапазонах доз связаны с различиями в радиочувствительности биотест-объектов, а мощность дозы определяется оптимальной длительностью облучения с учетом свойств тест-объектов. Обработка и анализ результатов сведены в таблицу. Заявляемый способ тестирования был опробован на БАВ растительного происхождения, некоторых S-содержащих соединениях и известном радиопротекторе – мексамине /Машковский М.Д. Лекарственные средства. Т.1, с.292, Харьков, Торсинг,1997/. Полученные результаты представлены в таблице. Результаты для всех тест-объектов вычисляли как среднее данных не менее 3-4 опытов с двумя параллельными определениями в каждом, приведены среднеквадратичные ошибки средней. При kон+БАВ& 1) ФУДэксп=ФУДрасч на всех биотест-объектах (№ 12) означает, что радикалы БАВ* и их стабильные продукты нейтральны ко всем биомишеням (обозначены в таблице “+”). 2) ФУДэксп& 3) ФУДэксп& а) для ДНК это свидетельство взаимодействия БАВ б) для других биомишеней это означает наложение дополнительных механизмов защиты (напр., адсорбционной – для белка и антиоксидантной – для эритроцитов) (обозначение в таблице Принцип отбора исследуемых веществ по результатам тестирования их антирадикальных свойств определяется поставленной задачей. В графе “Выводы” таблицы результаты тестирования обозначены значками: + для п.1, ± для п.2, Формула изобретения
Способ определения антирадикальной активности веществ in vitro, предусматривающий взаимодействие исследуемого вещества и эталона сравнения со свободными радикалами и определение величины константы скорости реакции вещества с радикалами, отличающийся тем, что в качестве эталона сравнения используют водный раствор р-нитрозодиметиланилина, а определение величины константы скорости реакции исследуемого вещества с радикалами ОН (kOH) проводят в условиях PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 10.11.2008 БИ: 31/2008
|
||||||||||||||||||||||||||

 -облучения, в качестве эталона сравнения используют водный раствор р-нитрозодиметиланилина. Отбирают вещества с kOH выше (4-5)х109 л/моль
-облучения, в качестве эталона сравнения используют водный раствор р-нитрозодиметиланилина. Отбирают вещества с kOH выше (4-5)х109 л/моль с. Затем определяют последовательно соотношения равноповреждающих доз при
с. Затем определяют последовательно соотношения равноповреждающих доз при  2, RO
2, RO С. Продукты ПОЛ – диеновые конъюгаты определяли спектрофотометрически. Липиды в концентрации 1 мг/кг растворяли в системе метанол – гептан в соотношении 3:1, спектр поглощения снимали на спектрофотометре СФ-16 в ультрафиолетовой области (максимум поглощения 232 нм). Различия результатов в сериях “опыт-контроль” считали достоверными при уровне вероятности различий 95%.
С. Продукты ПОЛ – диеновые конъюгаты определяли спектрофотометрически. Липиды в концентрации 1 мг/кг растворяли в системе метанол – гептан в соотношении 3:1, спектр поглощения снимали на спектрофотометре СФ-16 в ультрафиолетовой области (максимум поглощения 232 нм). Различия результатов в сериях “опыт-контроль” считали достоверными при уровне вероятности различий 95%. 106 Да) селезенки крупного рогатого скота или тимуса теленка, эритроциты – суспензия свежевыделенных отмытых эритроцитов крови крысы.
106 Да) селезенки крупного рогатого скота или тимуса теленка, эритроциты – суспензия свежевыделенных отмытых эритроцитов крови крысы. =670 нм). Определяли дозовые зависимости гемолиза эритроцитов в присутствии БАВ (1,5
=670 нм). Определяли дозовые зависимости гемолиза эритроцитов в присутствии БАВ (1,5 ; 1
; 1 (4-5)x109 тестирование следует проводить. У ряда веществ kOH+БАВ достигает максимально возможных величин: № 10-12
(4-5)x109 тестирование следует проводить. У ряда веществ kOH+БАВ достигает максимально возможных величин: № 10-12 1 – явная сенсибилизация (обозначение в таблице “-“).
1 – явная сенсибилизация (обозначение в таблице “-“). );
); ).
).