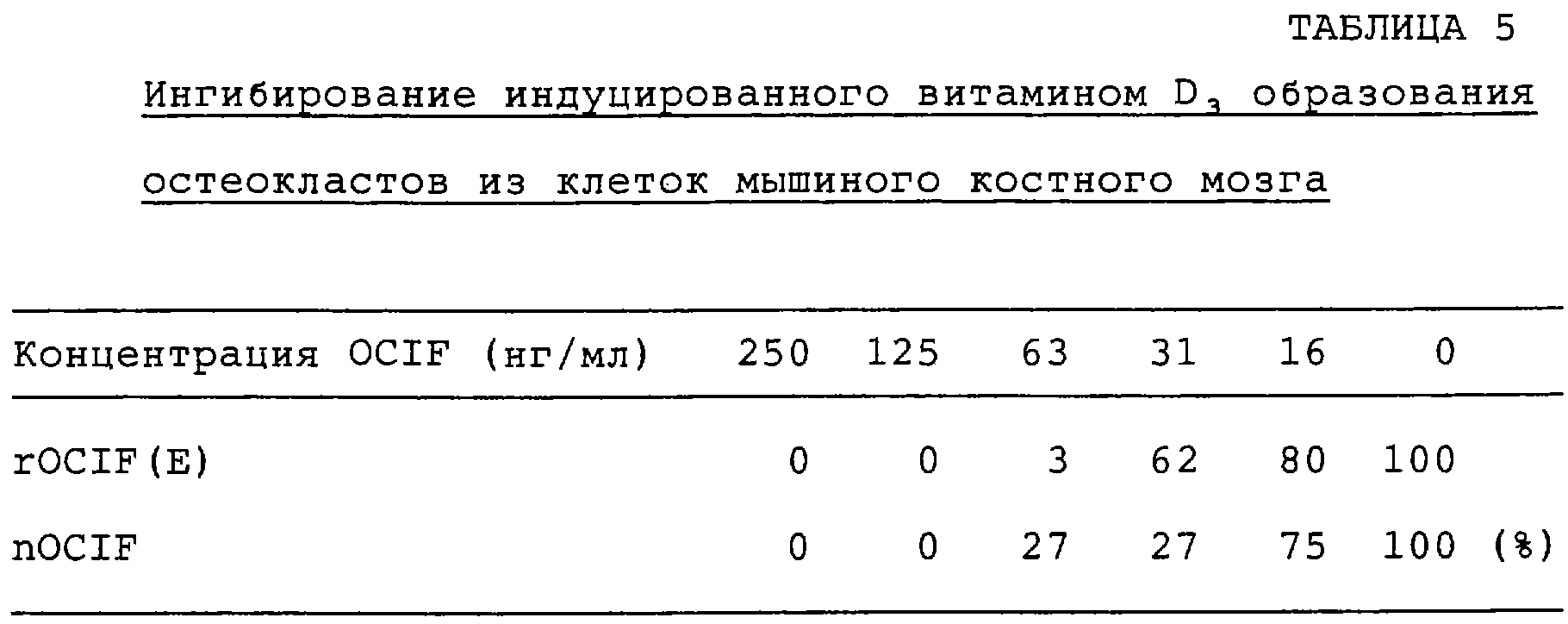
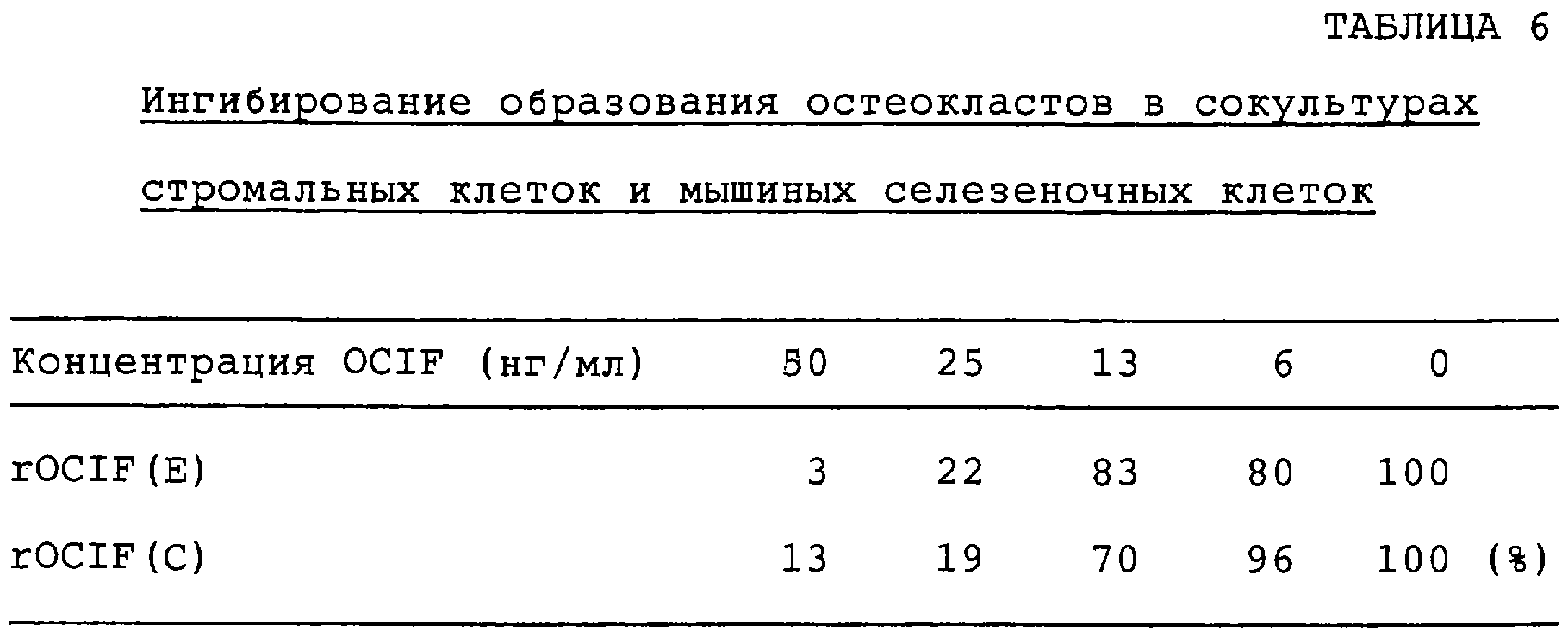
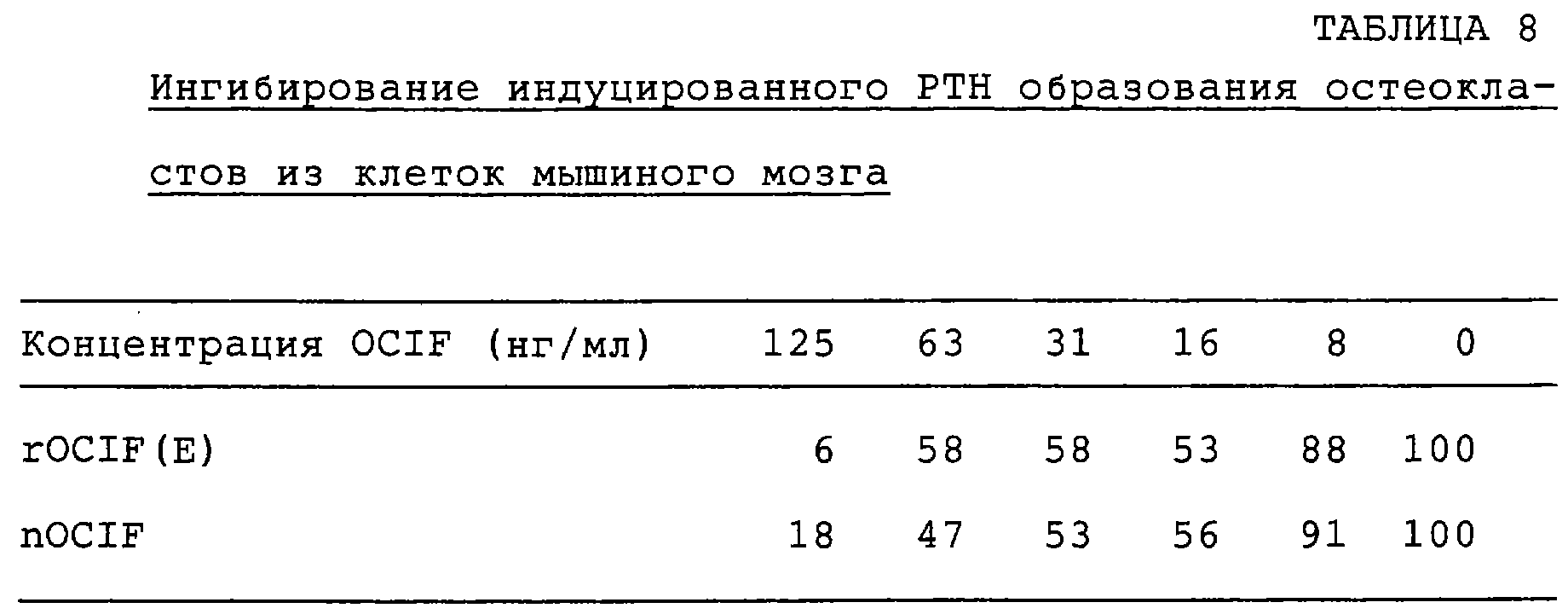
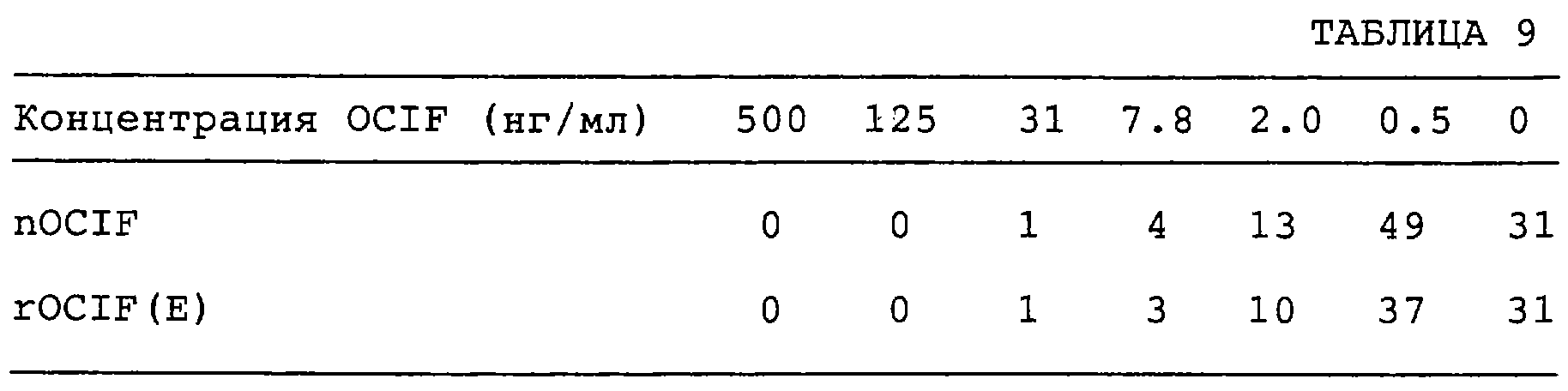
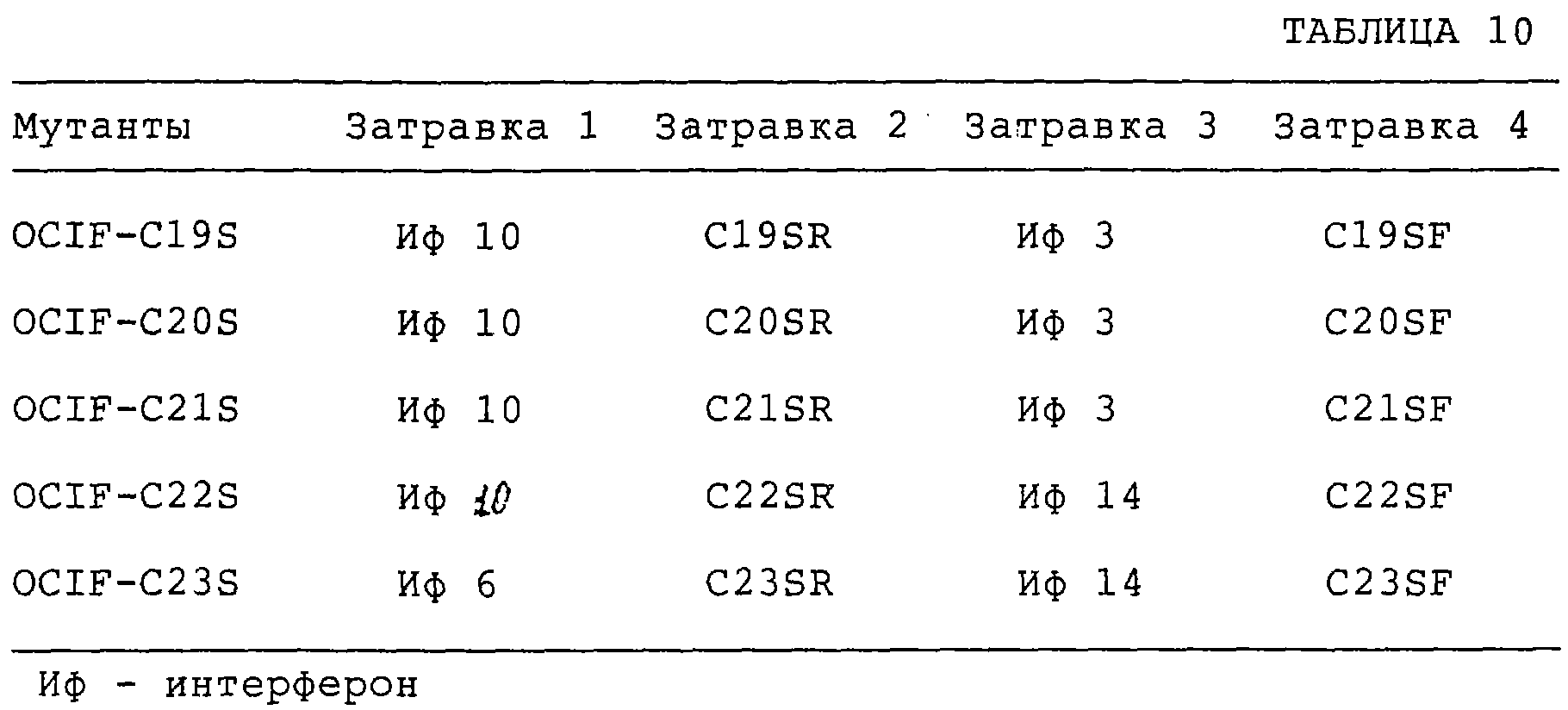
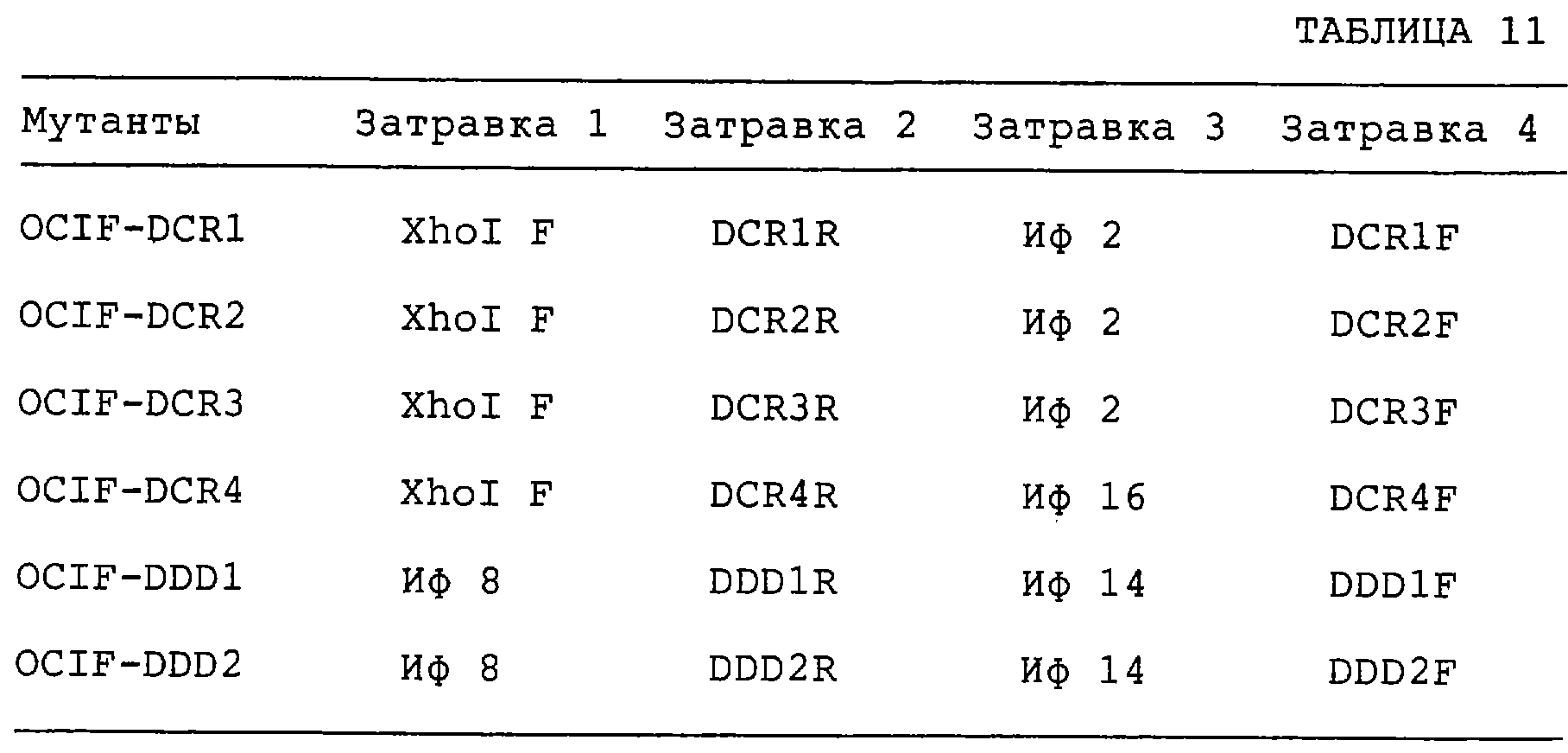
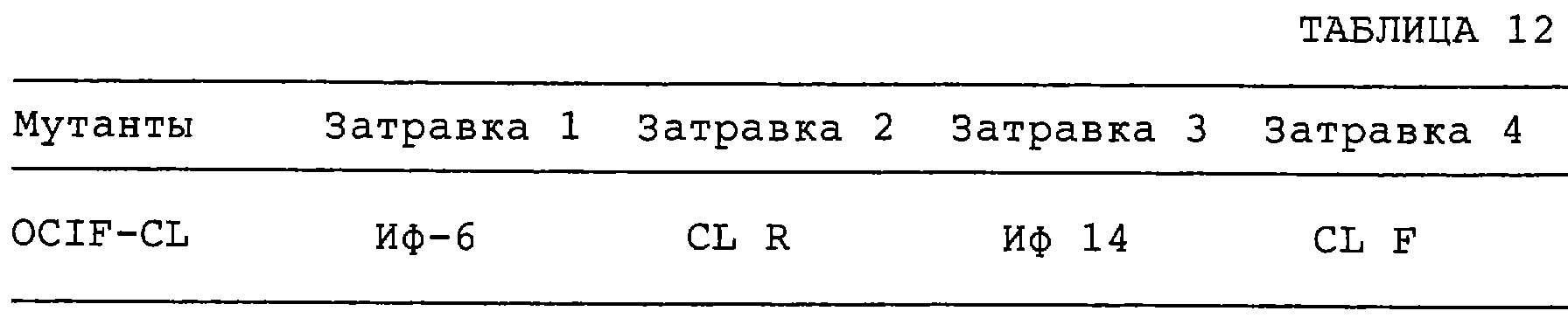
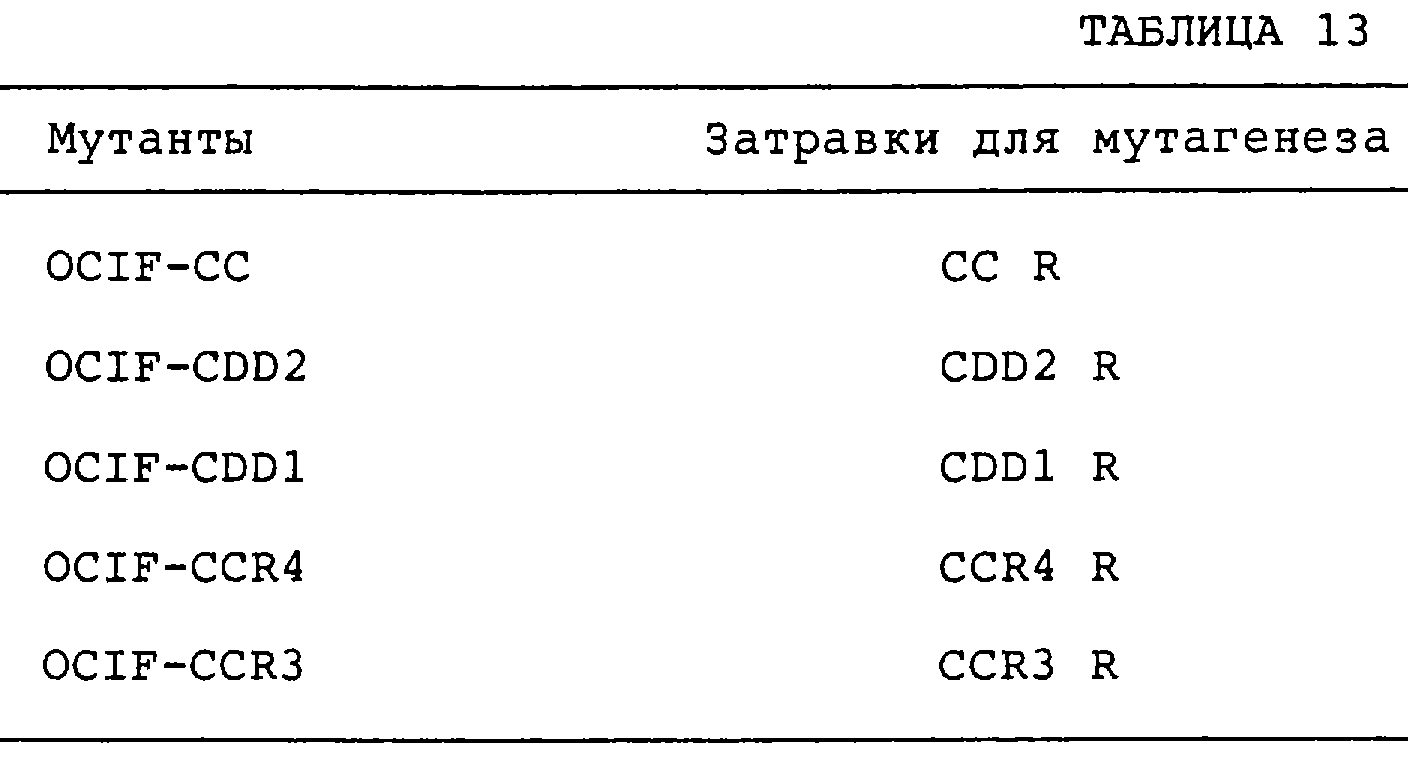
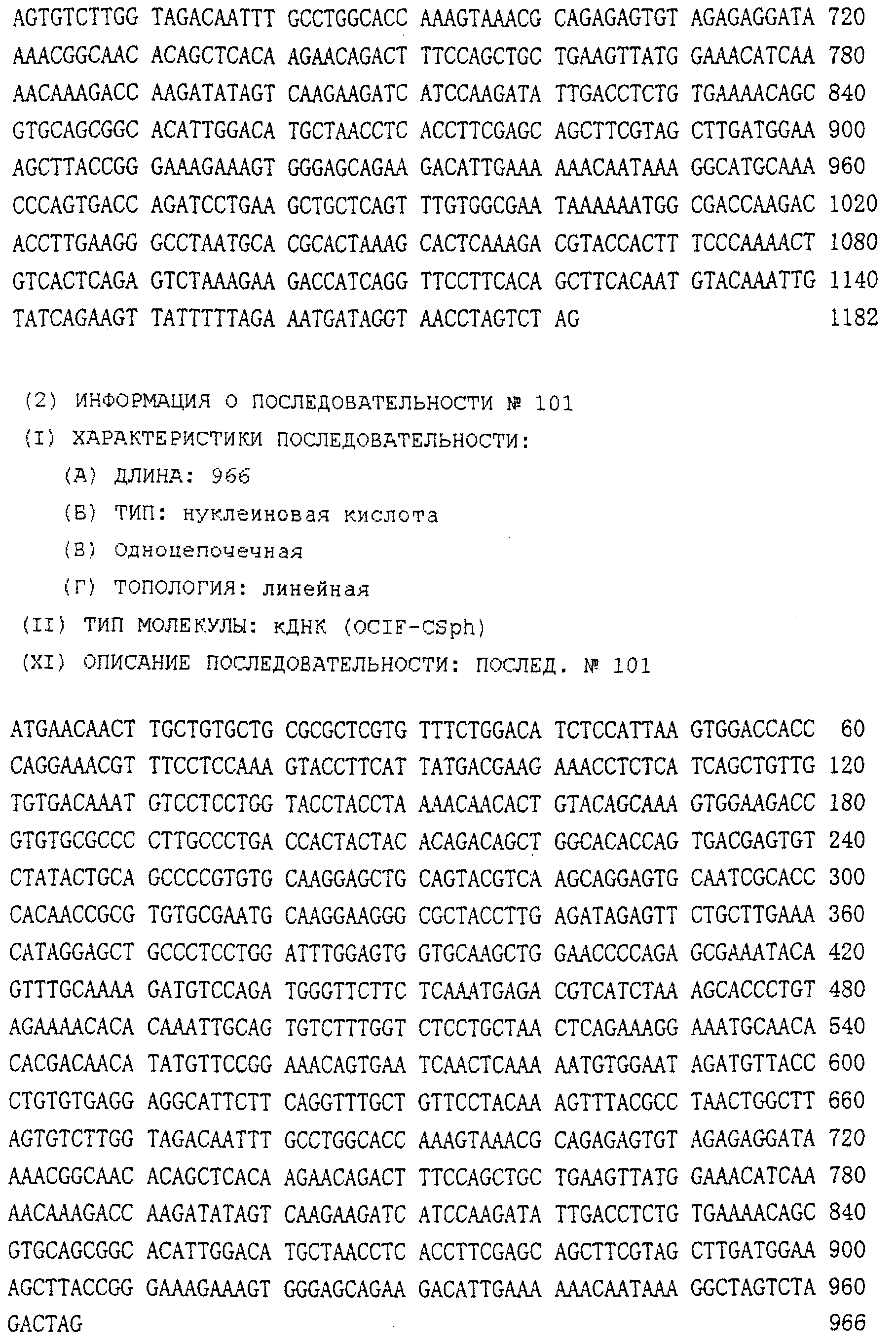
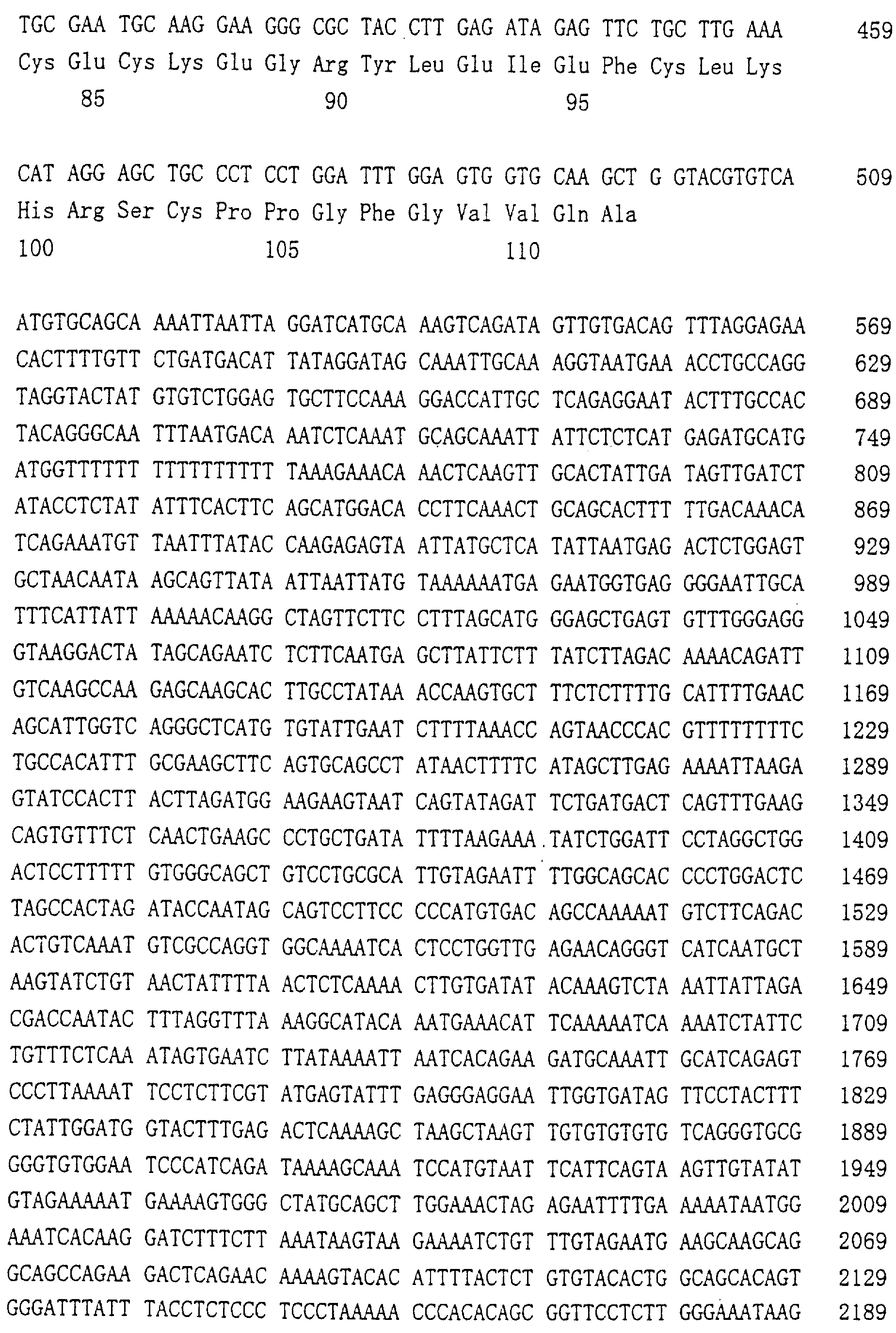
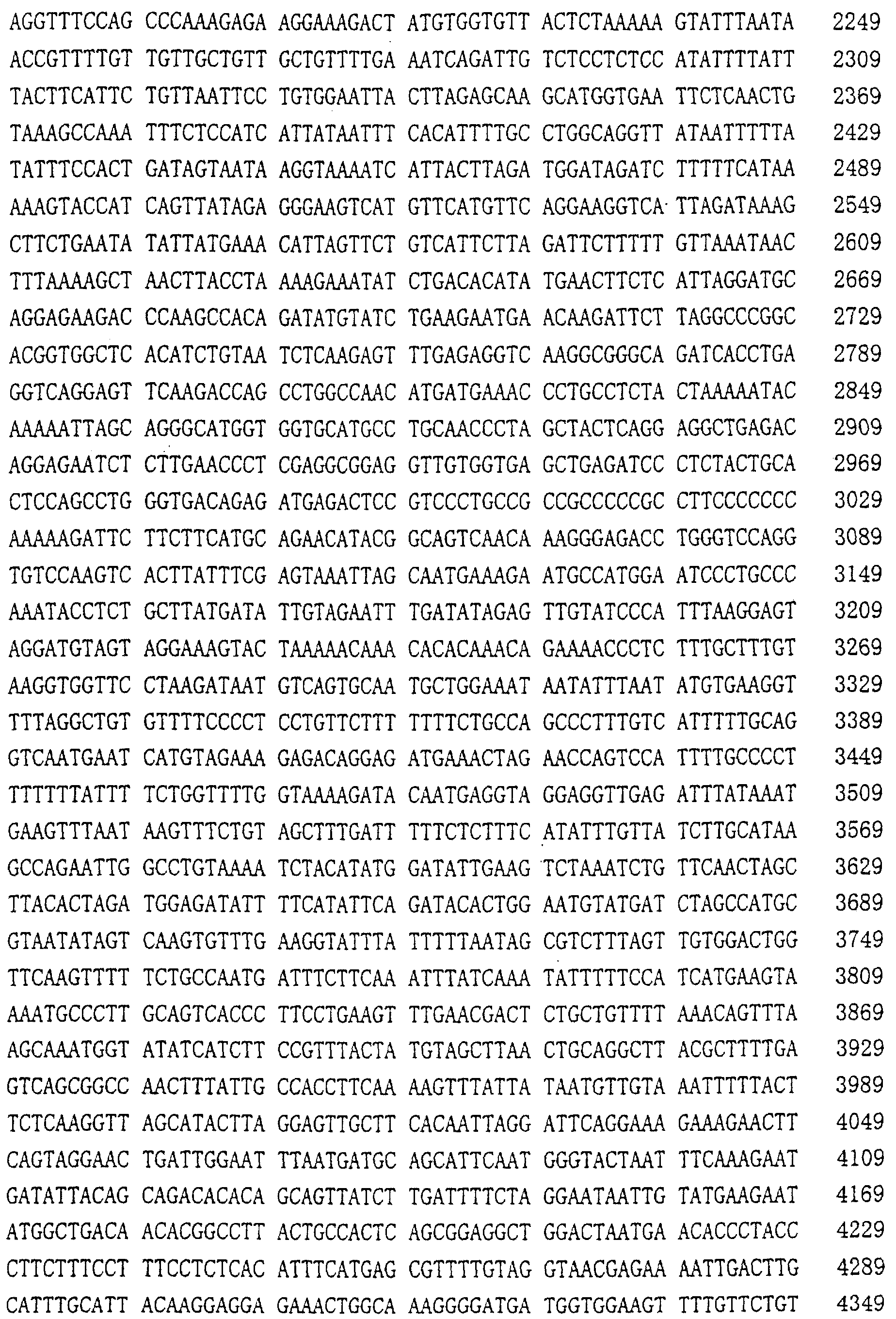
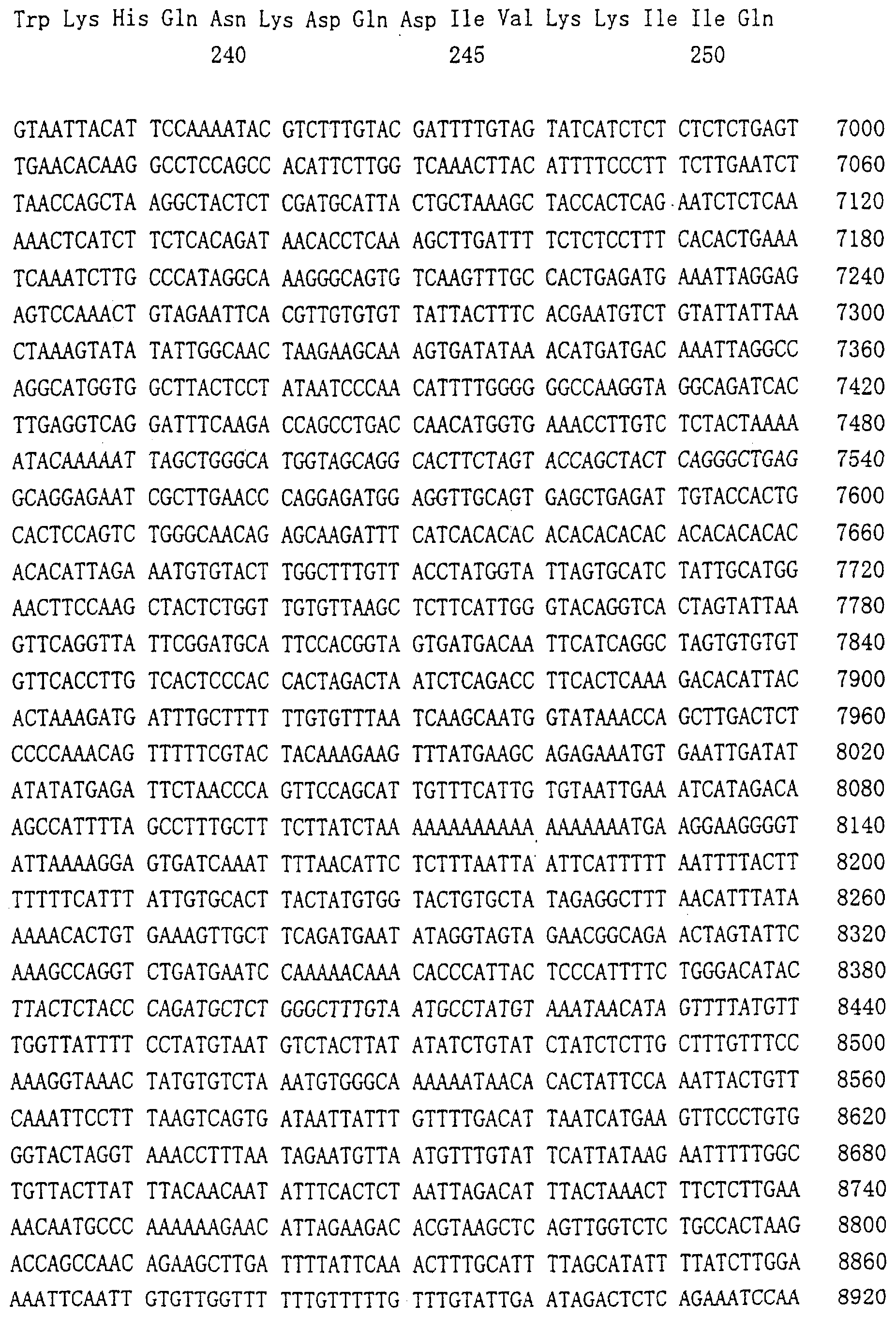
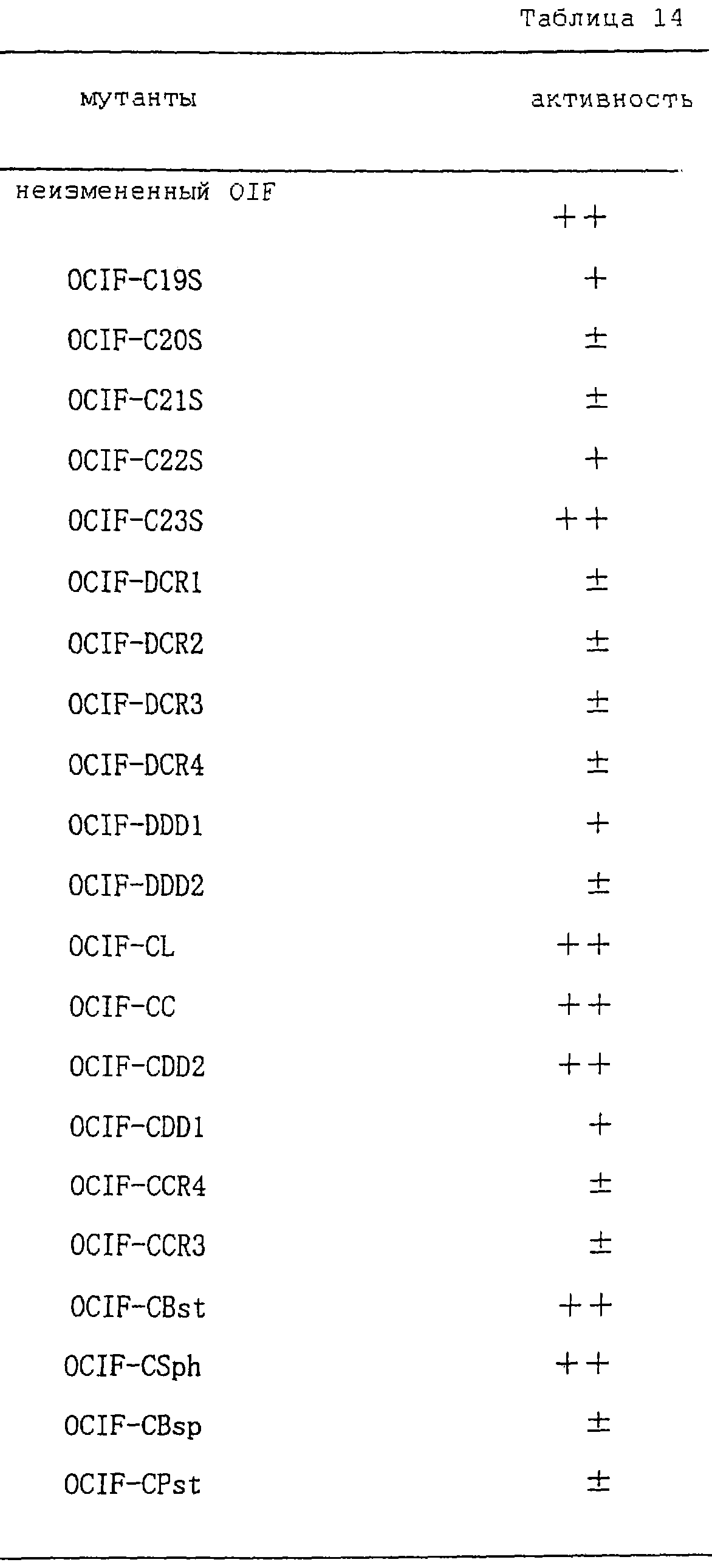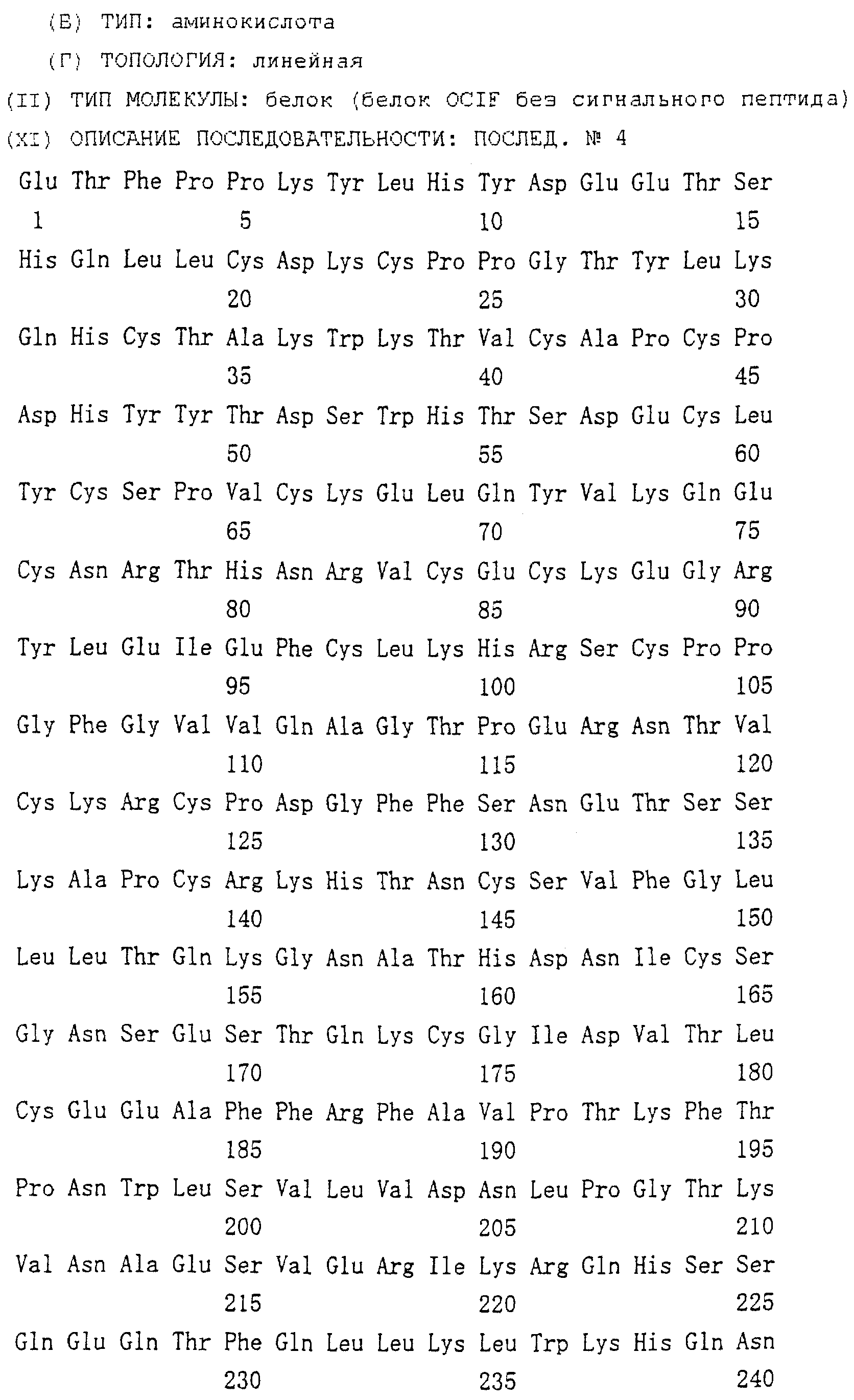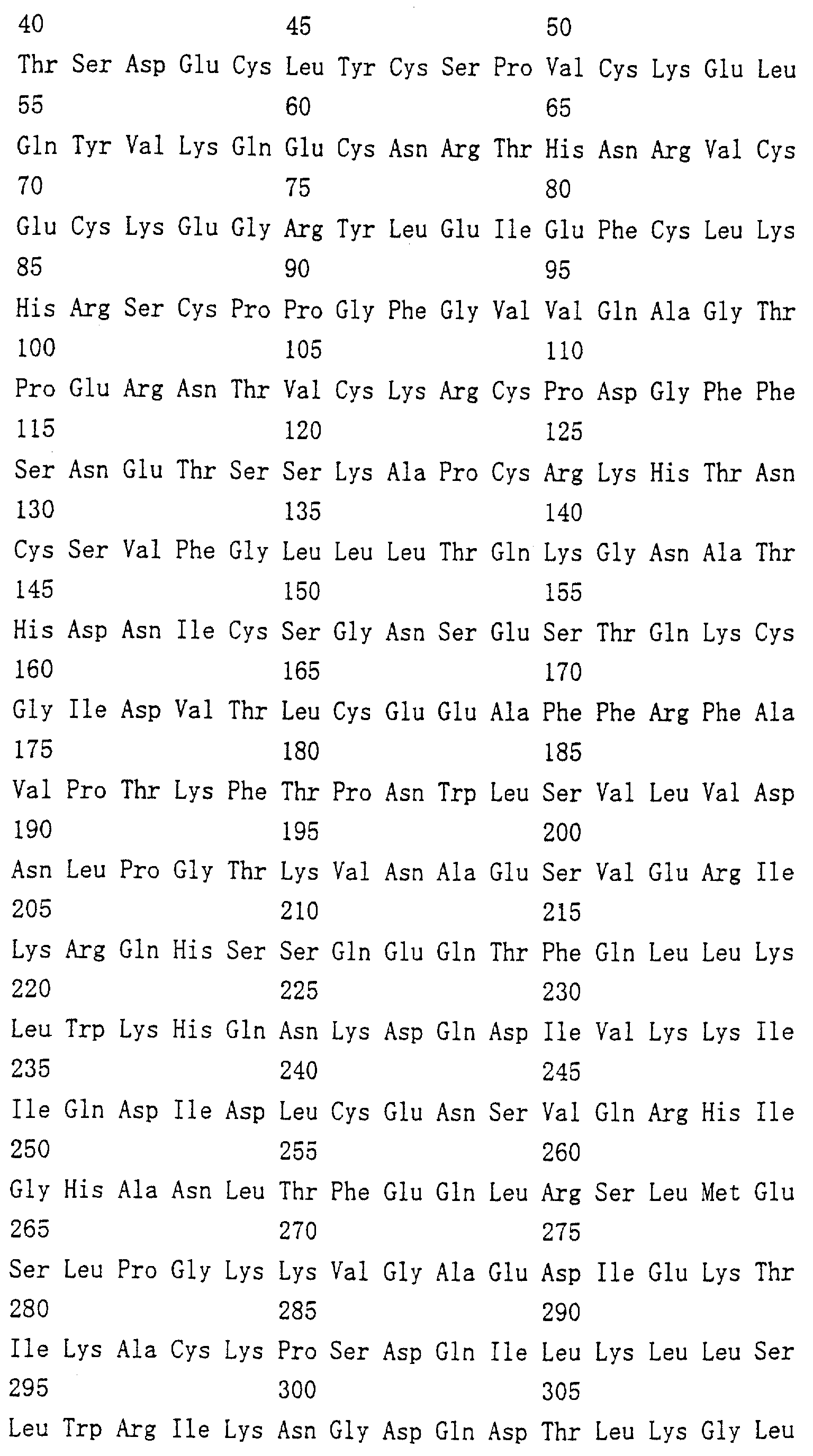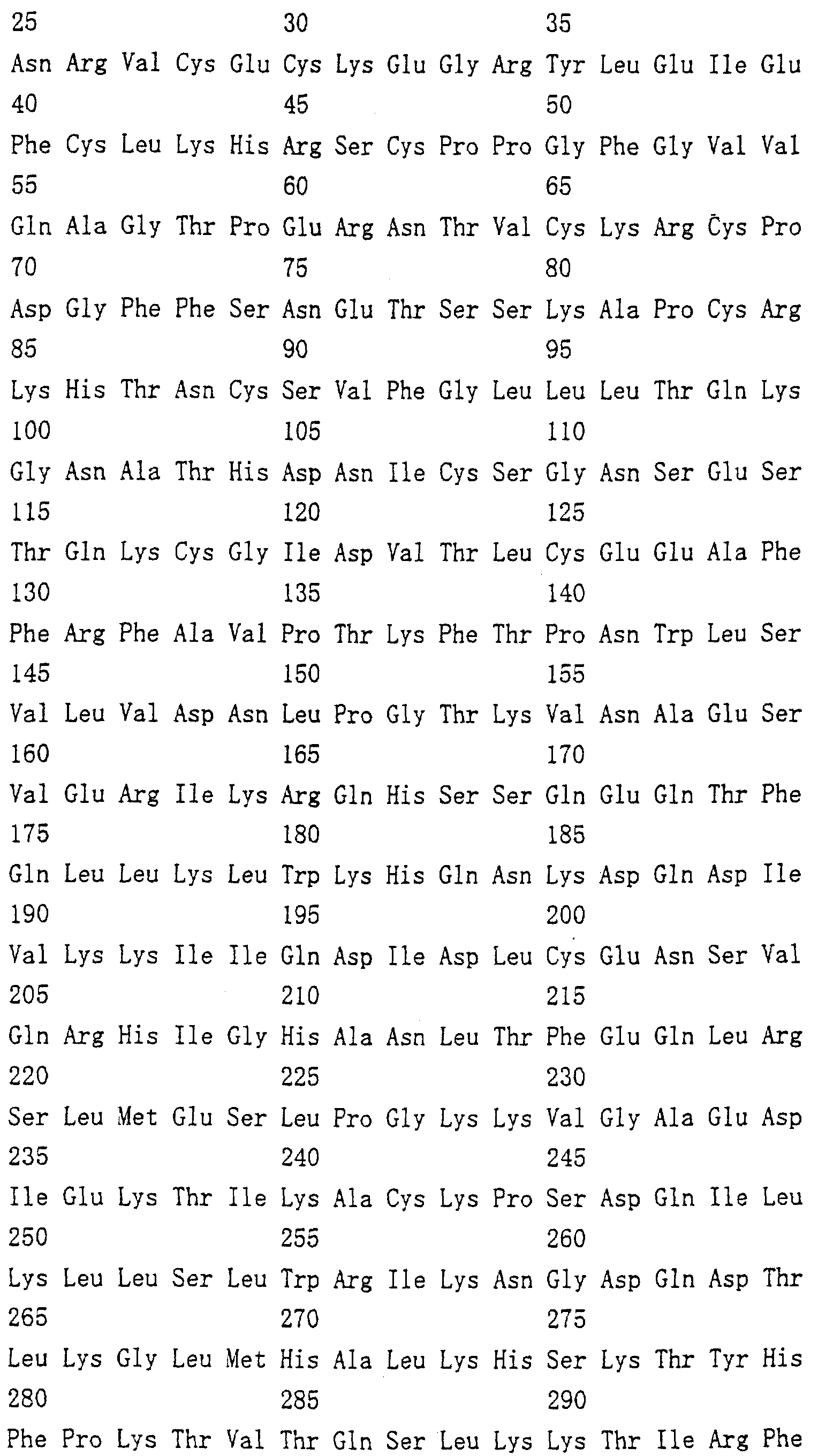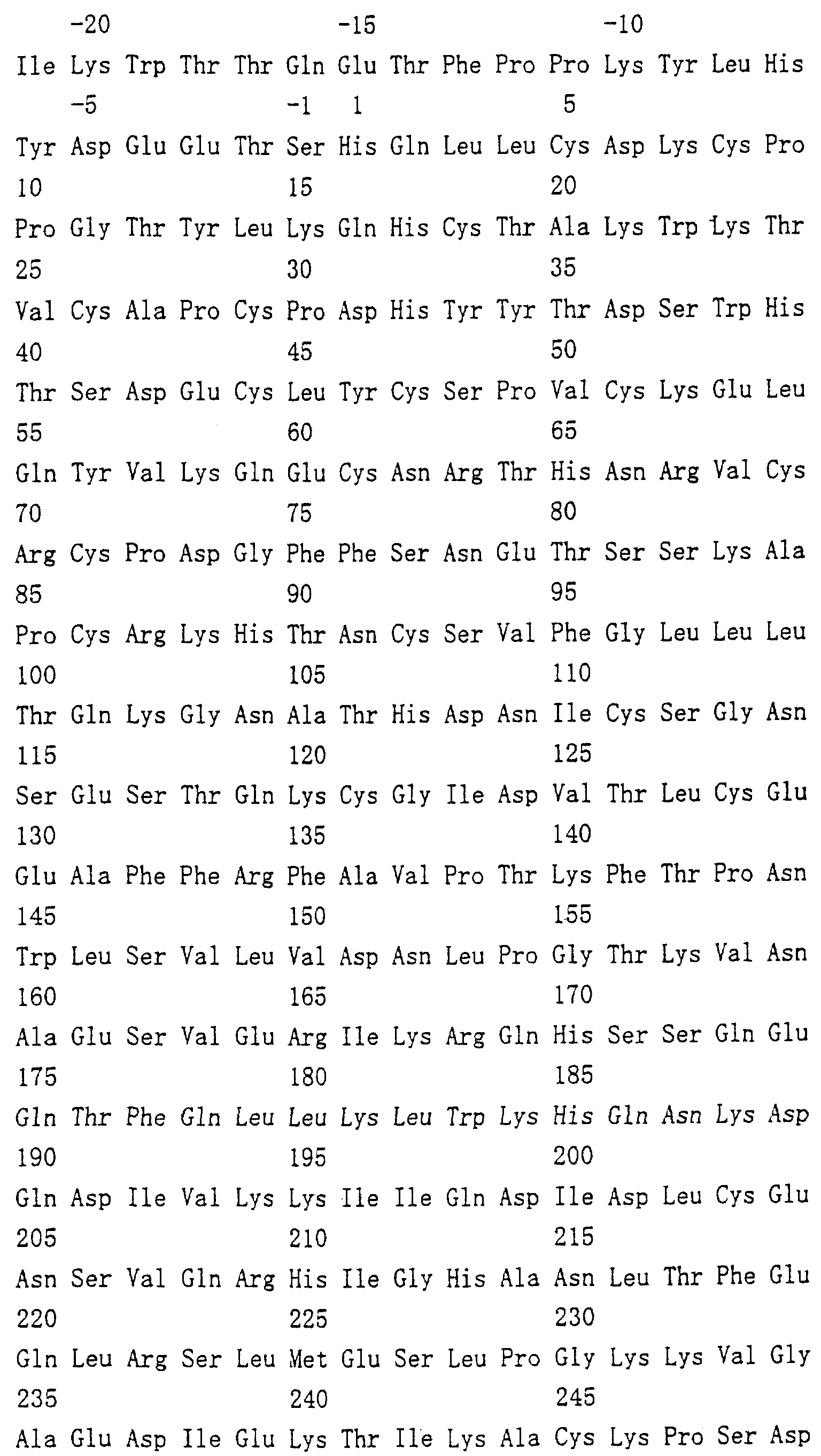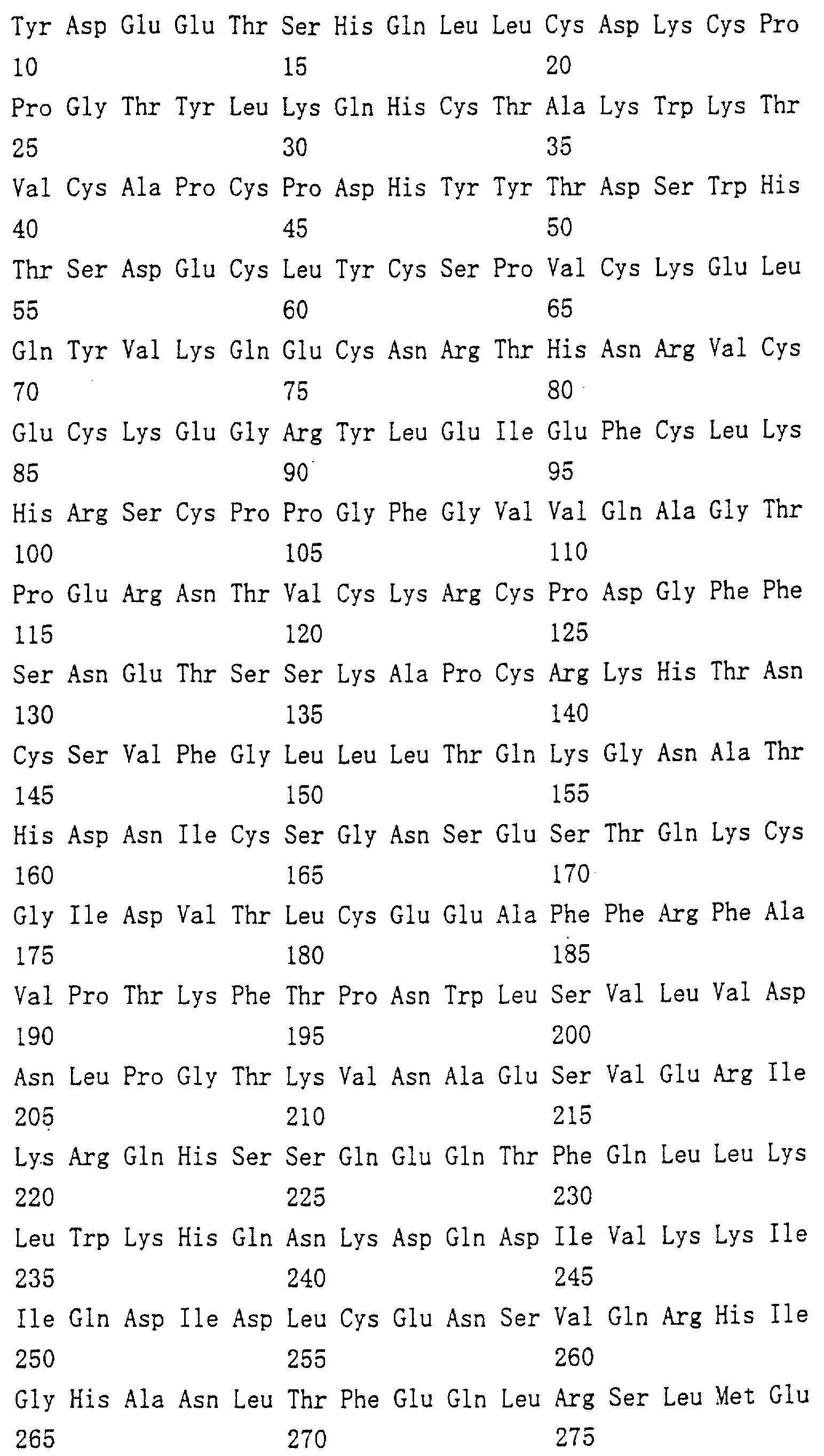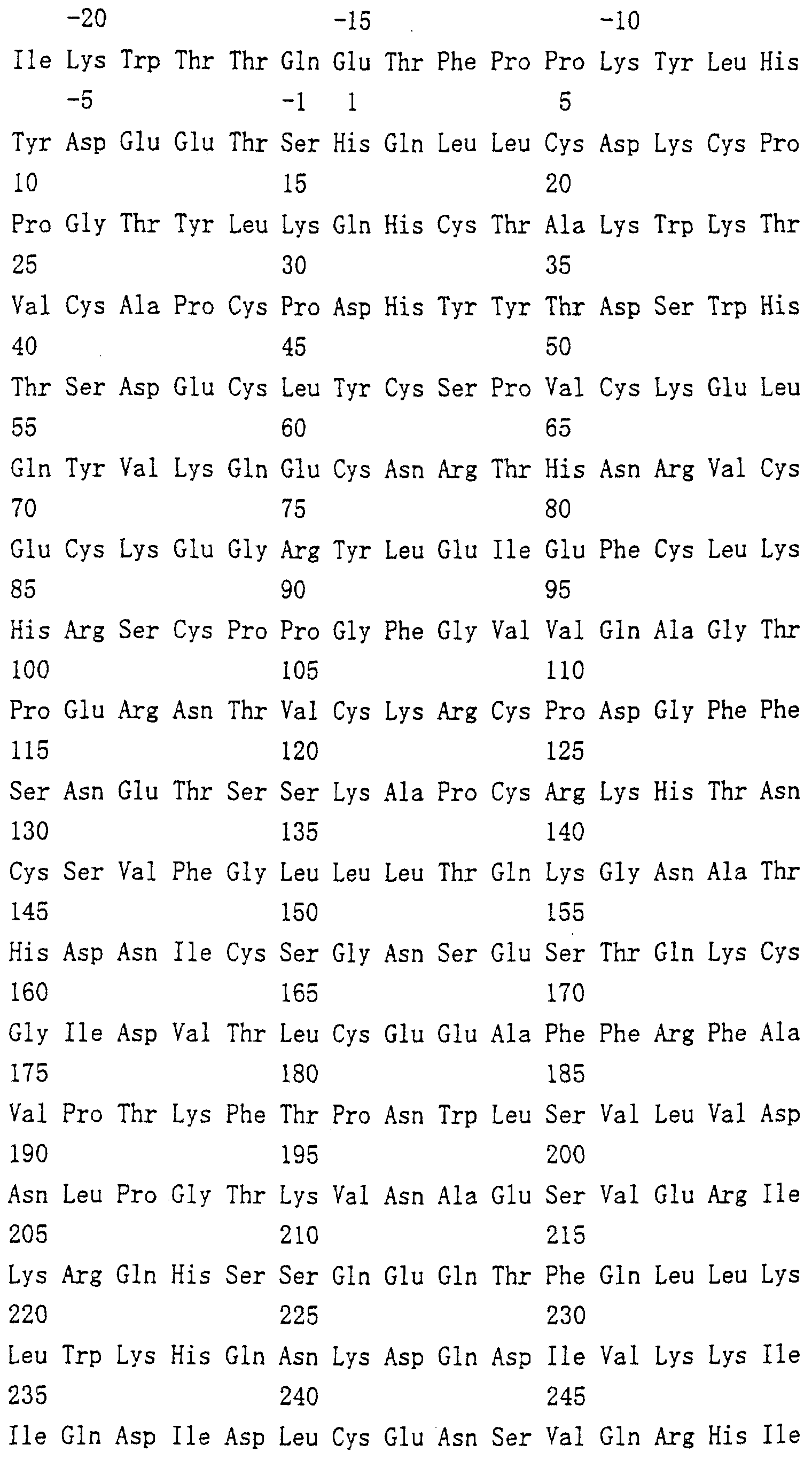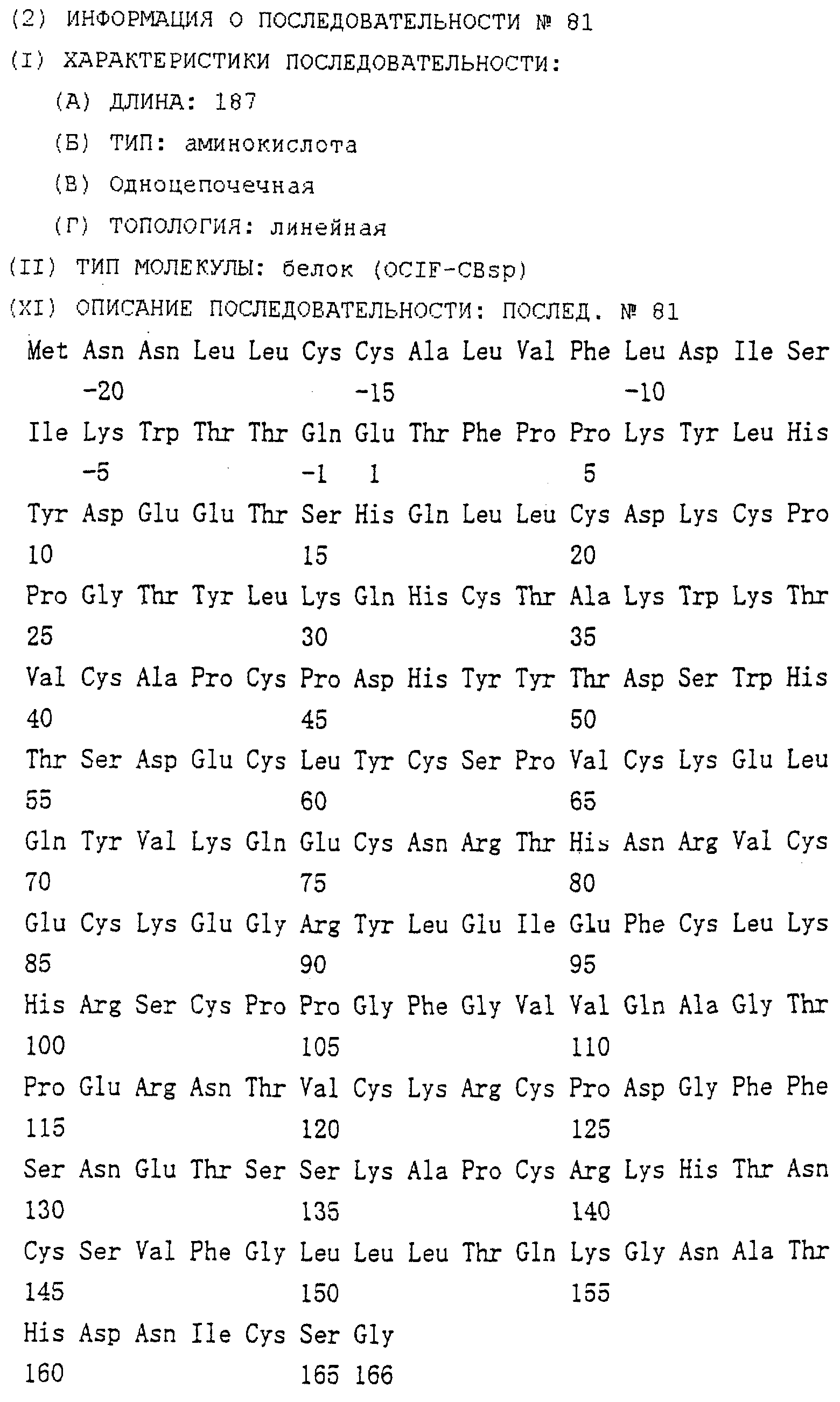Патент на изобретение №2238948
|
||||||||||||||||||||||||||
(54) БЕЛОК, СПОСОБНЫЙ ИНГИБИРОВАТЬ ОСТЕОКЛАСТОГЕНЕЗ (OCIF) (ВАРИАНТЫ), КДНК, СПОСОБ ПОЛУЧЕНИЯ БЕЛКА, СПОСОБ ЛЕЧЕНИЯ ОСТЕОПОРОЗА, СПОСОБ ЛЕЧЕНИЯ И/ИЛИ УЛУЧШЕНИЯ ВОСТАНОВЛЕНИЯ МАССЫ КОСТИ, СПОСОБ ЛЕЧЕНИЯ НАРУШЕНИЯ, СВЯЗАННОГО С КОСТНЫМ МЕТАБОЛИЗМОМ, ТРАНСФОРМИРОВАННЫЙ ШТАММ ESCHERICHIA COLI PBK/01F10 И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат:
Изобретение относится к области биотехнологии, конкретно к получению белка/фактора ингибирования остеокластогенеза (OCIF), и может быть использовано для лечения и иммунологической диагностики заболеваний, сопровождающихся резорбцией костей. Белок OCIF с молекулярной массой приблизительно 60 кД в условиях восстановления, с аминокислотными последовательностями SEQ ID NO: 1, 2 и 3, получают путем трансформации клетки-хозяина вектором, содержащим кДНК, кодирующую этот белок. Белок OCIF в составе фармацевтической композиции используют в способах лечения остеопороза, лечения/улучшения восстановления массы кости, а также в способе лечения нарушения, связанного с костным метаболизмом. Изобретение позволяет получить новый белок, который эффективно ингибирует образование остеокластов. 9 н. и 3 з.п. ф-лы, 15 ил., 16 табл.
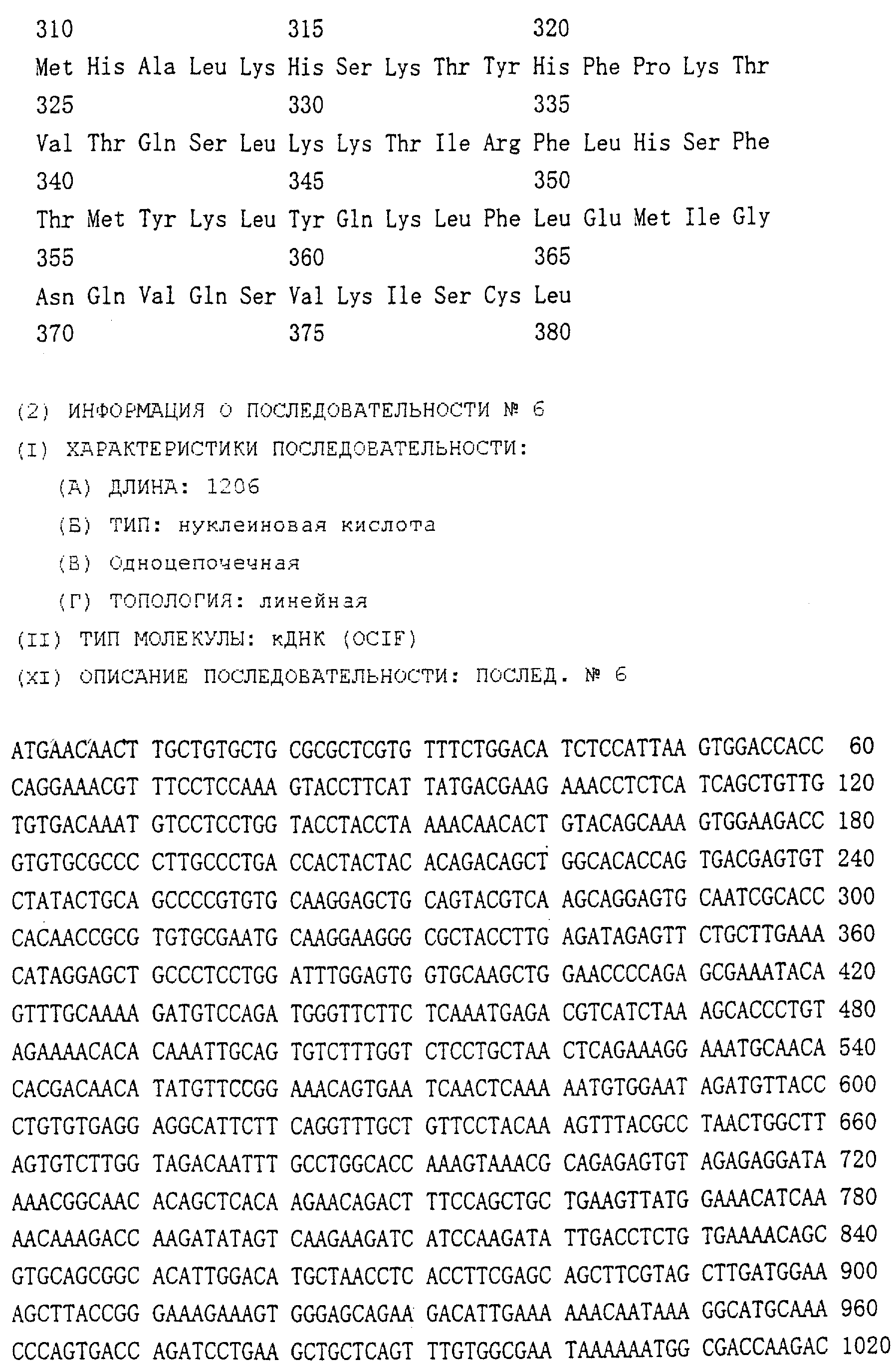
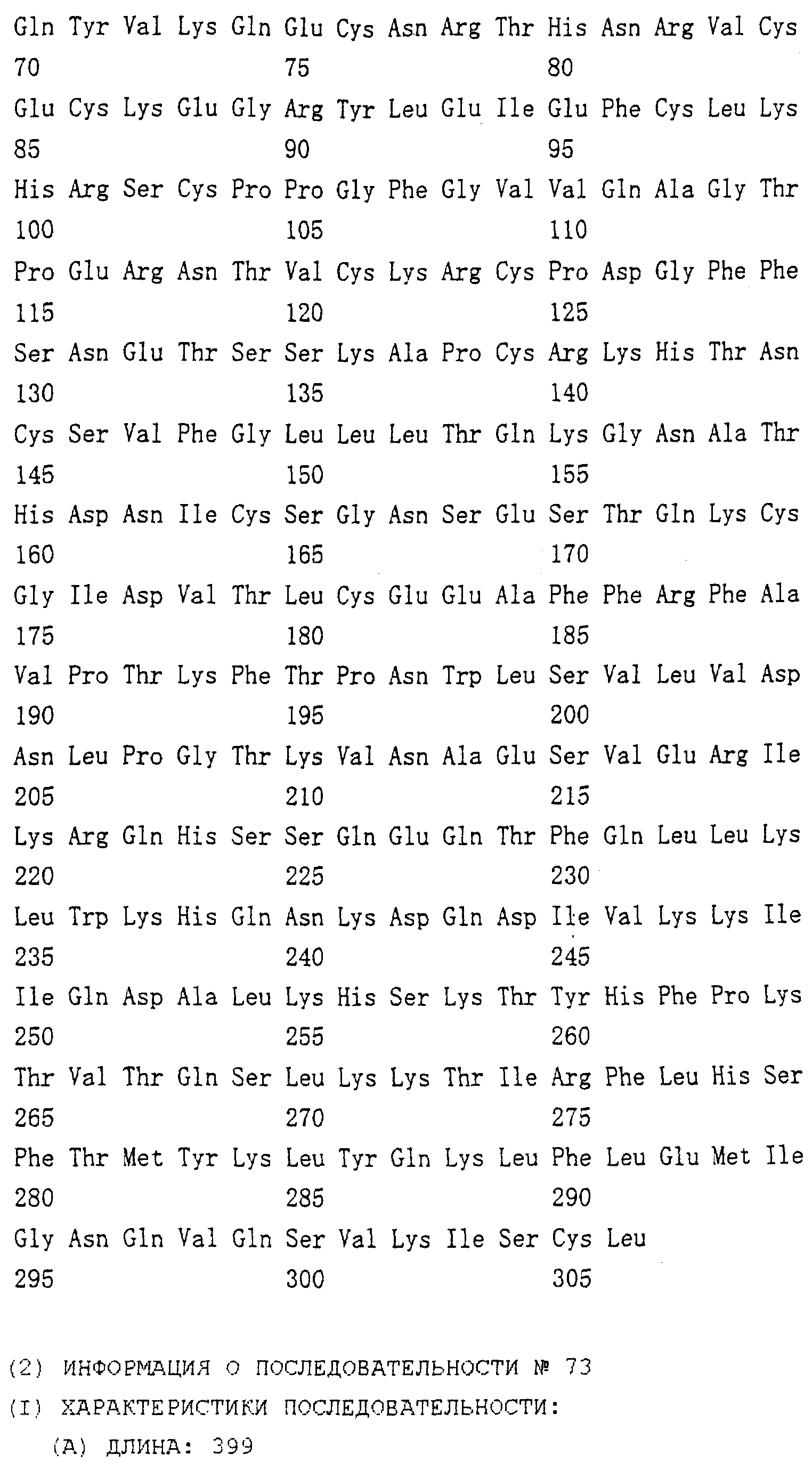
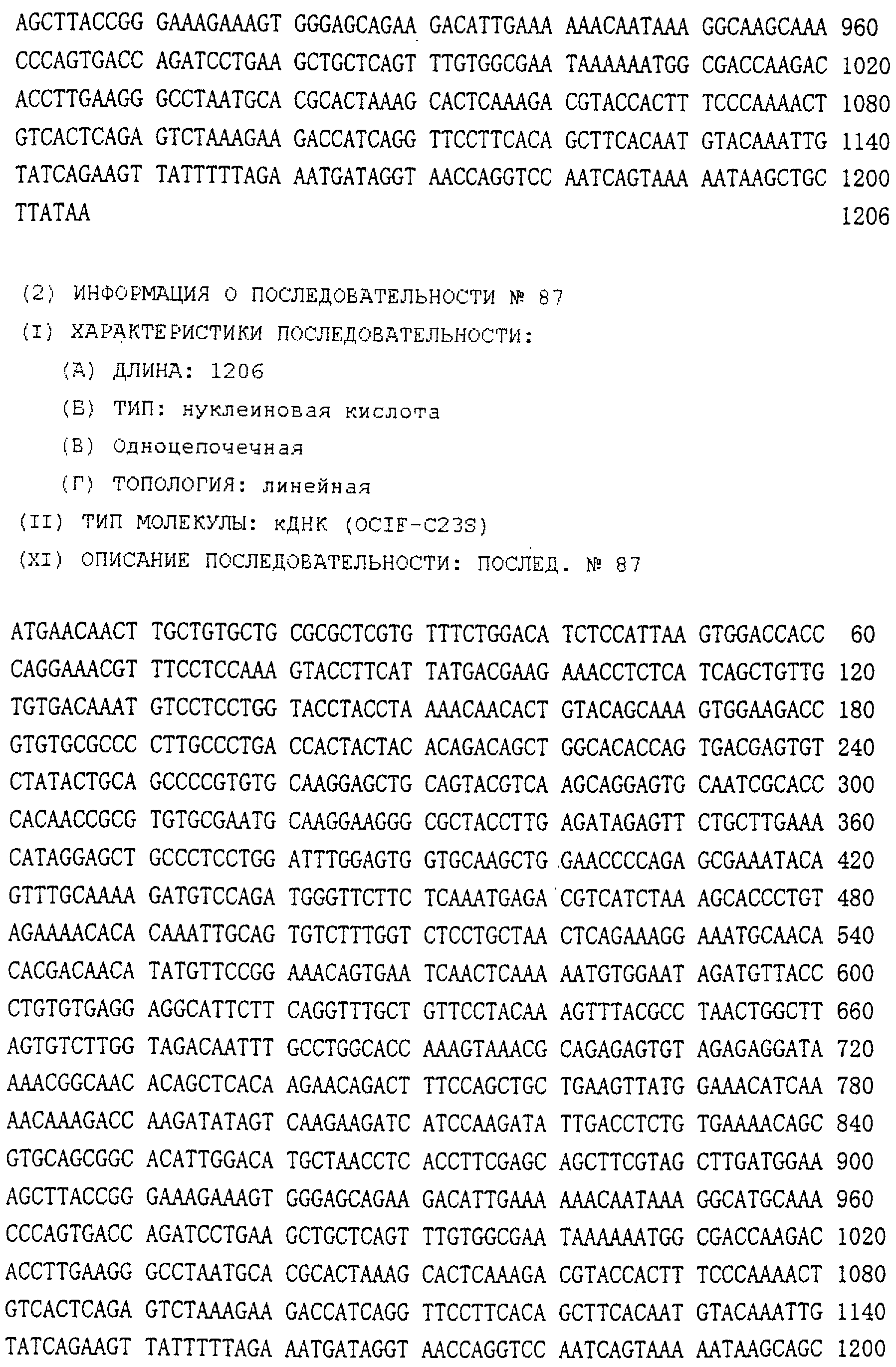
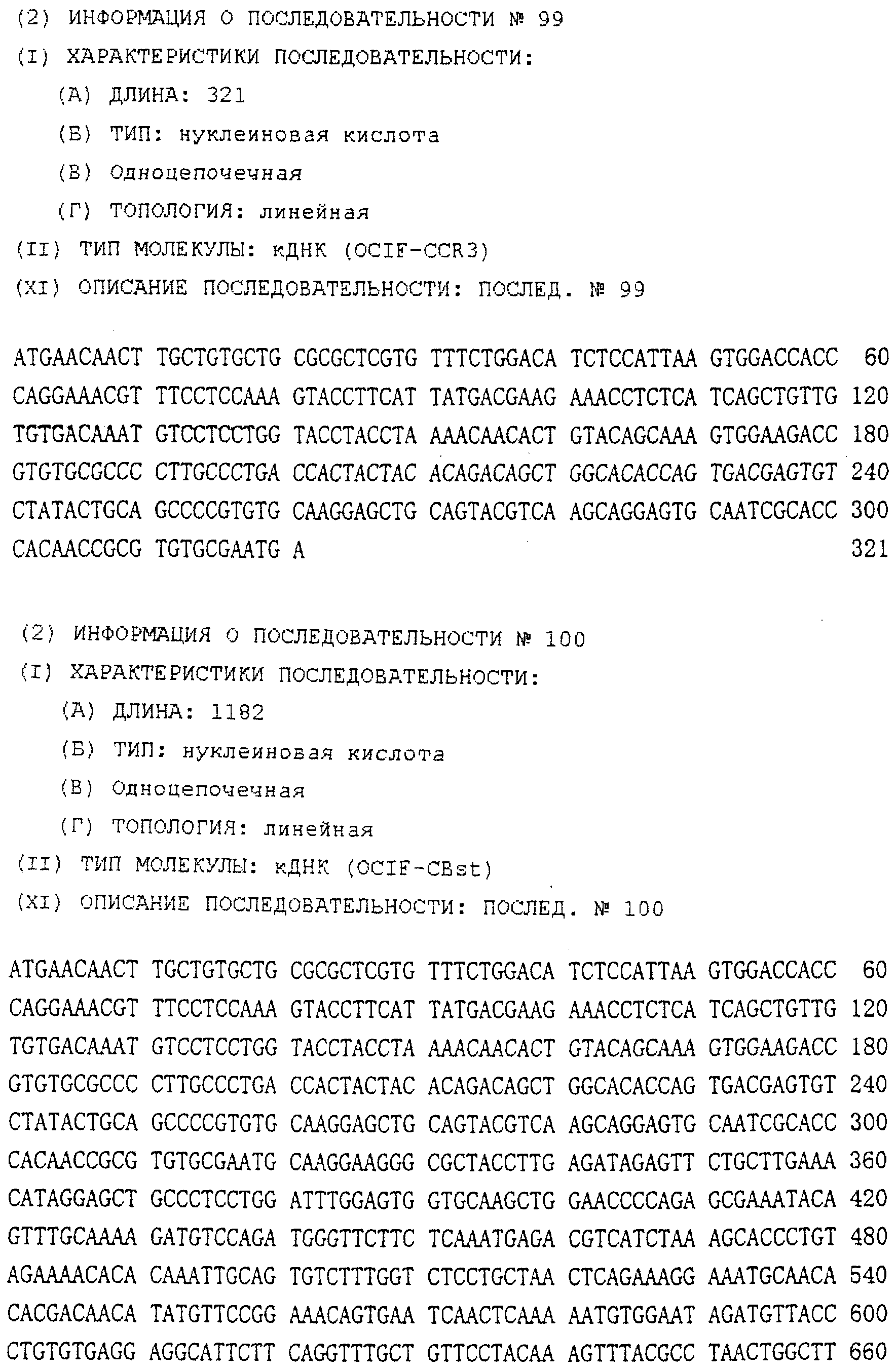
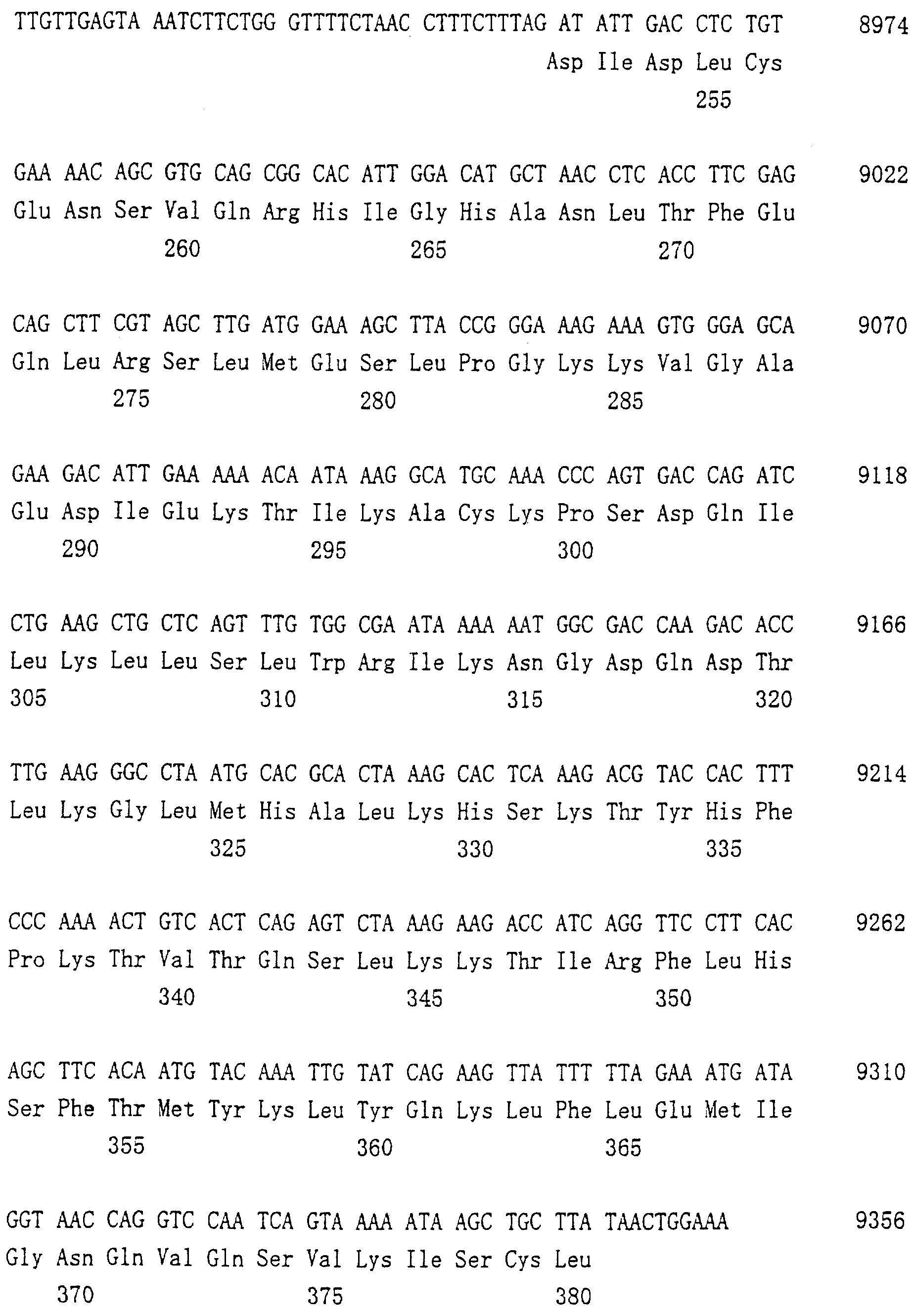
Область техники, к которой относится изобретение Настоящее изобретение относится к новому белку – фактору ингибирования остеокластогенеза (OCIF) и к способам получения такого белка. Предпосылки создания изобретения Человеческие кости постоянно преобразовываются за счет повторяющихся процессов резорбции и воссоздания. Полагают, что при этих процессах остеобласты и остеокласты являются клетками, ответственными, в основном, за костеобразование и резорбцию костей соответственно. Типичным примером заболевания, вызванного развитием аномального костного метаболизма, является остеопороз. Известно, что это заболевание провоцируется состоянием, при котором резорбция костей остеокластами превышает костеобразование остеобластами, но механизм остеопороза пока полностью невыяснен. Остеопороз вызывает боль в костях и делает кости хрупкими, что приводит к переломам. Так как остеопороз увеличивает число лежачих пациентов пожилого возраста, он становится социальной проблемой при возрастании числа пожилых людей. Поэтому ожидается, что будут разрабатываться эффективные лекарственные средства для лечения этого заболевания. Снижение костной массы, вызванное аномальным костным метаболизмом, как считается, можно предупредить посредством ингибирования резорбции костей, улучшения костеобразования или улучшения уравновешенного метаболизма. Предполагается, что костеобразование промотируется путем стимулирования роста, дифференцировки или активации остеобластов. Сообщается, что многие цитокины стимулируют рост или дифференцировку остеобластов, т.е. фактор роста фибробластов (FGF) (Rodan S.B. et al.. Endocrinology, vol.121, р.1917, 1987), инсулиноподобный фактор роста I (IGF-I) (Hock J.M. et al., Endocrinolory, vol.122, p.254, 1988), инсулиноподобный фактор роста II (IGF-II) (McCarthy Т. et al., Endocrinology, vol.124, p.301, 1989), активин A (Centrella M. et al., Mol. Cell. Biol., vol.11, p.250, 1991), васкулотропин (Varonique M. et al., Biochem. Biophys. Res. Commun., vol.199, p.380, 1994) и морфогенетический костный белок (BMP) (Yamaguchi A. et al., J. Cell Biol., vol.113, p.682, 1991, Sampath Т.К. et al., J. Biol. Chem., vol.267, p.20532, 1992, и Knutsen R. et al., Biochem. Biophys. Res. Commun., vol. 194, p.1352, 1993). С другой стороны, уделялось внимание и интенсивно изучались цитокины, которые ингибируют дифференцировку и/или созревание остеокластов. Обнаружено, что трансформирующий Предполагается, что эти цитокины являются эффективными лекарственными средствами для улучшения восстановления костной массы путем стимуляции костеобразования и/или путем ингибирования резорбции костей. Цитокины, такие как инсулиноподобный фактор роста I и костные морфогенетические белки, в настоящее время прошли клинические испытания на их действие при лечении пациентов с костными заболеваниями. Кальцитонин уже применяют в качестве лекарственного средства для лечения остеопороза и для уменьшения боли при остеопорозе. Примерами лекарственных средств, в настоящее время используемых клинически для лечения костных заболеваний и для сокращения периода лечения, являются дигидроксивитамин 3, витамин К2, кальцитонин и его производные, гормоны, такие как эстрадиол, иприфлавон, и препараты кальция. Однако эти лекарственные средства не обеспечивают удовлетворительного терапевтического действия, и, как и ожидалось, разрабатываются новые лекарственные средства. Как уже упоминалось, костный метаболизм регулируется балансом между резорбцией костей и костеобразованием. Поэтому предполагается, что в качестве лекарственных средств для лечения костных заболеваний, таких как остеопороз, будут разрабатываться цитокины, которые ингибируют дифференцировку и/или созревание остеокластов. Изложение сущности изобретения Настоящее изобретение предпринято с учетом описанных выше соображений. Целью настоящего изобретения является как новый фактор, названный фактором ингибирования остеокластогенеза (OCIF), так и эффективный способ получения указанного фактора. Авторы настоящего изобретения провели интенсивные поиски факторов ингибирования остеокластогенеза в кондиционированной человеческими эмбриональными фибробластами IMR-90 (АТСС CCL186) среде и обнаружили новый фактор ингибирования остеокластогенеза (OCIF), который ингибирует дифференцировку и/или созревание остеокластов. Авторы настоящего изобретения создали способ накопления белка до высокой концентрации путем культивирования клеток IMR-90 с использованием кусков глиноземистой керамики в качестве основы для прилипания клеток. Авторы настоящего изобретения также создали эффективный способ выделения белка OCIF из кондиционированной IMR-90 среды с использованием последовательного ряда колоночной хроматографии – ионообменной, гепарин-аффинной, аффинной к цибарону синему и обращенно-фазовой. Авторы настоящего изобретения, основываясь на аминокислотной последовательности очищенного природного OCIF, успешно клонировали кДНК, кодирующую этот белок. Авторы настоящего изобретения создали также процедуру получения этого белка, который ингибирует дифференцировку остеокластов. Настоящее изобретение относится к белку, который получают с помощью клеток фибробластов легких человека, имеет молекулярную массу при определении методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) 60 кД в условиях восстановления и 120 кД при невосстанавливающих условиях, обладает аффинностью как к катионообменным смолам, так и к гепарину, снижает свою активность ингибирования дифференцировки и созревания остеокластов при обработке в течение 10 минут при 70 Настоящее изобретение включает способ очистки белка OCIF, включающий (1) выращивание человеческих фибробластов, (2) внесение кондиционированной среды в колонку с гепарином для получения адсорбированной фракции, (3) очистку белка OCIF с использованием катионообменной колонки, (4) очистку белка OCIF с использованием гепарин-аффинной колонки, (5) очистку белка OCIF с использованием аффинной колонки с цибакроном синим, (6) выделение белка OCIF с использованием колонки для обращенно-фазовой хроматографии. Цибакрон синий, соединенный с носителем, изготовленным из синтетических гидрофильных полимеров, является примером материала, применяемого для получения колонок с цибакроном синим. Эти колонки обычно называют “синими колонками”. Настоящее изобретение включает способ накопления белка OCIF до высоких концентраций путем культивирования человеческих фибробластов с использованием кусков глиноземистой керамики в качестве основы для прилипания клеток. Кроме того, авторы настоящего изобретения определили аминокислотные последовательности пептидов, производных от OCIF, сконструировали затравки на основе этих аминокислотных последовательностей и получили фрагменты кДНК, кодирующие OCIF, из кДНК-библиотеки клеток IMR-90. Подробное описание изобретения Белок OCIF настоящего изобретения можно выделить из кондиционированной среды человеческих фибробластов с высоким выходом. Процедура выделения OCIF основана на обычных технических приемах очистки белков от биоматериалов, в соответствии с физическими и химическими свойствами белка OCIF. Например, способ концентрации включает обычные биохимические способы, такие как ультрафильтрация, лиофилизация и диализ. Метод очистки включает сочетания нескольких приемов хроматографии для очистки белков, таких как ионообменная колоночная хроматография, аффинная колоночная хроматография, колоночная гель-фильтрация, гидрофобная колоночная хроматография, колоночная хроматография с обращенной фазой и препапаративный гель-электрофорез. Человеческие фибробласты, используемые для получения белка OCIF, представляют собой предпочтительно IMR-90. Способ получения кондиционированной IMR-90 среды представляет собой предпочтительно способ, включающий прилипание человеческих эмбриональных клеток IMR-90 к кусочкам глиноземистой керамики в роллер-флаконах, применение модифицированной по способу Дульбекко среды Игла (DMEM) с добавлением 5% сыворотки новорожденного теленка для культивирования клеток и культивирование клеток в роллер-флаконах в течение 7-10 суток методом стендовой культивации. К буферу в качестве детергента на стадиях очистки белка OCIF добавляют предпочтительно ХАПС (3-[(3-холамидопропил)диметиламмоний]-1-пропансульфонат). Белок OCIF настоящего изобретения можно сначала получить в виде гепаринсвязывающей основной фракции OCIF путем внесения культуральной среды в колонку с гепарином (гепарин-сефароза CL-6B, Pharmacia), элюирования 10 мМ буфером трис-НСl, рН 7,5, содержащим 2 М NaCl, и последующего внесения фракции OCIF в Q. анионнообменную колонку (HiLoad-Q/FF, Pharmacia) и сбора неадсорбированной фракции. Белок OCIF можно очистить, подвергая полученную фракцию OCIF очистке на S. катионообменной колонке (HiLoad-S/FF, Pharmacia), колонке с гепарином (гепарин-5РW, TOSOH), колонке с цибакроном синим (Blue-5PW, TOSOH) и на колонке для обращенно-фазовой хроматографии (BU-300 C4, Perkin Elmer), и вещество определяют по описанным ранее свойствам. Настоящее изобретение относится к способу клонирования кДНК, кодирующей белок OCIF, на основании аминокислотной последовательности природного OCIF, и к способу получения рекомбинантного белка OCIF, который ингибирует дифференцировку и/или созревание остеокластов. Белок OCIF очищают по способу, описанному в настоящем изобретении, и обрабатывают эндопептидазой (например, лизилэндопептидазой). Определяют аминокислотные последовательности пептидов, полученных при гидролизе, и синтезируют смесь олигонуклеотидов, которые могут кодировать каждую внутреннюю аминокислотную последовательность. Фрагмент кДНК OCIF получают ПЦР (предпочтительно, RT-ПЦР-ПЦР с обратной транскриптазой), используя в качестве затравок описанные выше олигонуклеотидные смеси. кДНК OCIF полной длины, кодирующую белок OCIF, клонируют из кДНК-библиотеки, используя в качестве зонда полученный фрагмент ДНК OCIF. кДНК OCIF, содержащую полную кодирующую область, вставляют в экспрессионный вектор. Рекомбинантный OCIF можно получить путем экспрессии в клетках млекопитающих или в бактериях кДНК OCIF, содержащей полную кодирующую область. Настоящее изобретение относится к новым белкам OCIF2, OCIF3, OCIF4 и OCIF5, которые являются вариантами OCIF и обладают описанной выше активностью. Эти варианты OCIF получают из кДНК-библиотеки, созданной с IMR-90 поли(А)+РНК путем гибридизации с использованием в качестве зонда фрагмента кДНК OCIF. Каждую из кДНК вариантов OCIF, содержащую полную кодирующую область, вставляют в экспрессионный вектор. Каждый вариант рекомбинантного OCIF можно получить путем экспрессии каждой из кДНК вариантов OCIF, кодирующей полную кодирующую область, в обычных хозяевах. Каждый вариант рекомбинантного OCIF можно очистить по способу, описанному в настоящем изобретении. Каждый вариант рекомбинантного OCIF обладает способностью ингибировать остеокластогенез. Настоящее изобретение включает также мутанты OCIF. Существуют мутанты замещения, в которых один цистеиновый остаток, вероятно, участвующий в образовании димера, замещен на остаток серина, и различные делеционные мутанты OCIF. Замещения или делеции вводят в кДНК OCIF с использованием полимеразной цепной реакции (ПЦР) или путем переваривания рестрикционными ферментами. Каждую из этих мутированных кДНК OCIF вставляют в вектор, содержащий соответствующий промотор для генной экспрессии. Полученный в результате экспрессионный вектор для каждого из мутантов OCIF трансфектируют в эукариотные клетки, такие как клетки млекопитающего. Каждый из мутантов OCIF можно получить и очистить от кондиционированной среды трансфектированных клеток. Настоящее изобретение относится к поликлональным антителам и к способу количественного определения концентрации OCIF с использованием этих поликлональных антител. В качестве антигенов (иммуногенов) можно использовать природный OCIF, полученный из кондиционированной IMR-90 среды, рекомбинантный OCIF, продуцированный такими хозяевами, как микроорганизмы и эукариоты с использованием кДНК OCIF, синтетические пептиды на основе аминокислотной последовательности OCIF или пептиды, полученные из OCIF путем частичного переваривания. Поликлональные антитела против OCIF получают путем иммунизации соответствующих млекопитающих антигенами в сочетании с адъювантами для иммунизации, при необходимости, и очистки от сыворотки обычными способами очистки. Поликлональные антитела против OCIF, которые метят радиоизотопами или ферментами, можно использовать в системах радиоиммунного анализа (РИА) или в системах иммунного анализа (ИФА). С помощью этих систем анализа можно легко определить концентрации QCIF в биологических материалах, таких как кровь и асциты, и в среде для культивирования клеток. Антитела в настоящем изобретении можно использовать при радиоиммуноанализе (РИА) или при иммуноферментном анализе (ИФА). Используя эти системы анализа можно легко определить концентрацию OCIF в биологических материалах, таких как кровь и асциты. Настоящее изобретение относится к новым моноклональным антителам и к способу количественного определения концентрации OCIF с использованием этих моноклональных антител. Моноклональные антитела против OCIF можно получить с помощью обычного метода с использованием OCIF в качестве антигена. В качестве антигенов можно использовать нативный OCIF, полученный из культуральной среды клеток IMR-90, и рекомбинантный OCIF, продуцированный такими хозяевами, как микроорганизмы и эукариоты с использованием кДНК OCIF. С другой стороны, в качестве антигенов можно также использовать синтезированные пептиды, созданные на основе аминокислотной последовательности OCIF, и пептиды, полученные из OCIF путем частичного переваривания. Иммунизированные лимфоциты, полученные путем иммунизации млекопитающих антигеном методом иммунизации in vitro, сливают с миеломой млекопитающих, и получают гибридому. Из гибридом, полученных при слиянии клеток, отбирают гибридомные клоны, секретирующие антитело, которое узнает OCIF. Нужные антитела можно получить путем выращивания клеток отобранных гибридомных клонов. При получении гибридомы особенно полезны для иммунизации мелкие животные, такие как мыши или крысы. Для иммунизации OCIF разводят до необходимой степени физиологическим раствором (0,15 М NaCl) и вводят с адъювантом животным 2-5 раз каждые 2-20 дней внутривенно или интраперитонеально. Иммунизированное животное убивают через три дня после последней иммунизации, извлекают селезенку, и используют спленоциты как иммунизированные В-лимфоциты. Клеточные линии мышиной миеломы для слияния клеток с иммунизированными В-лимфоцитами включают, например, р3/ Слияние клеток иммунизированных В-лимфоцитов и миеломной клеточной линии осуществляют, в основном, обычными способами. Например, используют, как правило, метод Koehler G. с сотр. (Nature, 256, 495-497, 1975), а также для слияния клеток можно применить метод электрического импульса. Иммунизированные В-лимфоциты и трансформированные В-клетки смешивают в обычных соотношениях, и для слияния клеток используют, как правило, культуральную среду без сыворотки плода коровы (FBS), содержащую полиэтиленгликоль. Слитые с миеломной клеточной линией В-лимфоциты для отбора гибридомы выращивают в селекционной среде ГАТ, содержащей FBS. Для отбора гибридомы, продуцирующей антитело против OCIF, можно использовать, главным образом, ИФА, анализ бляш-кообразования, Ouchterlony или реакцию агглютинации. Среди этих методов простым и легким для осуществления с достаточной точностью является ИФА, и его-то главным образом и используют. С помощью ИФА с использованием очищенного OCIF можно легко и точно отобрать нужное антитело. Полученную таким образом гибридому можно культивировать посредством обычного метода выращивания клеток и заморозить, чтобы иметь в наличии при необходимости. Антитело можно получить путем культивирования гибридомы с использованием обычного метода выращивания клеток или путем интраперитонеальной трансплантации гибридомы животным. Антитело можно очистить обычными методами очистки, такими как осаждение солью, гель-фильтрация и аффинная хроматография. Полученное антитело специфически реагирует с OCIF и может использоваться для определения концентрации OCIF и очистки OCIF. Антитела настоящего изобретения узнают эпитопы OCIF и обладают высокой аффинностью к OCIF. Следовательно, их можно использовать для создания ИФА. С помощью (использования) этой системы анализа можно легко определить концентрацию OCIF в биологических материалах, таких как кровь и асциты. Настоящее изобретение относится к средствам, применяемым для лечения костных заболеваний, которые в качестве действующего ингредиента содержат OCIF. Крыс подвергают денервации левой передней конечности. Испытываемые соединения вводят ежесуточно после операции в течение 14 дней. После 2-недельной обработки животных умерщвляют и рассекают их передние конечности. После этого испытывают кости на механическую прочность методом изгибания в трех точках. OCIF улучшает механическую прочность кости в зависимости от дозы. Белок OCIF настоящего изобретения пригоден как фармацевтический ингредиент для лечения или снижения потерь костной массы при остеопорозе, костных заболеваниях, таких как ревматизм, остеоартрит, и аномального костного метаболизма при множественной миеломе. Белок OCIF также полезен в качестве антигена для установления иммунологического диагноза заболевания. Составлены фармацевтические препараты, содержащие белок OCIF в качестве активного ингредиента, и их можно вводить перорально или парентерально. Препараты содержат белок OCIF настоящего изобретения в качестве действующего ингредиента и безопасны при введении человеку или животным. Примерами фармацевтических препаратов являются композиции для инъекций или капельного внутривенного вливания, суппозитории, назальные препараты, подъязычные препараты и пластыри для чрескожного поглощения. Фармацевтические препараты для инъекции можно получить путем смешивания фармакологически эффективного количества белка OCIF и фармацевтически приемлемых носителей. Носителями являются наполнители и/или активаторы, т.е. аминокислоты, сахариды, производные целлюлозы и другие органические и неорганические соединения, которые, как правило, добавляются к активным ингредиентам. Когда белок OCIF смешивают с наполнителями и/или активаторами для получения инъекций, могут быть добавлены, при необходимости, регуляторы рН, буферы, стабилизаторы, солюбилизаторы и т.п. Краткое описание чертежей На фиг.1 приводится картина элюирования сырого белка OCIF (фракция проходит через Hiload-Q/FF; образец 3) из колонки с Hilaod-S/HP. На фиг.2 приводится картина элюирования сырого белка OCIF (фракция гепарин-SPW; образец 5) из колонки с синим-5PW. На фиг.3 приводится картина элюирования сырого белка OCIF (фракции 49-50, синий-SPW) из колонки для обращенно-фазовой хроматографии. На фиг.4 приводятся данные SDS-PAGE выделенных белков OCIF в условиях восстановления и в невосстанавливающих условиях. Описание полос: полосы 1, 4 – маркерные белки молекулярной массы; полосы 2, 5 – белок OCIF пика 6 на фиг.3; полосы 3, 6 – белок OCIF пика 7 на фиг.3. Фиг.5 дает картину элюирования пептидов, полученных путем переваривания пиридилэтилированного белка OCIF лизилэн-донуклеазой, на колонке для хроматографии с обращенной фазой. На фиг.6 приводятся данные SDS-PAGE изолированного природного (n) OCIF-белка и рекомбинантного (r) белка OCIF в невосстанавливающих условиях. rOCIF(E) и rOCIF(C) продуцируются в клетках 293/EBNA и в СНО-клетках соответственно. Описание полос: полоса 1 – маркерные белки молекулярной массы; полоса 2 – белок nOCIF мономерного типа; полоса 3 – белок nOCIF димерного типа; полоса 4 – белок rOCIF(E) мономерного типа; полоса 5 – белок rOCIF(E) димерного типа; полоса 6 – белок rOCIF(С) мономерного типа; полоса 7 – белок rOCIF(С) димерного типа. На фиг.7 приводятся данные SDS-PAGE изолированного природного (n) OCIF-белка и рекомбинантного (r) белка OCIF в восстанавливающих условиях. rOCIF(E) и rOCIF(С) продуцируются в клетках 293/EBNA и в СНО-клетках соответственно. Описание полос: полоса 8 – маркерные белки молекулярной массы; полоса 9 – белок nOCIF мономерного типа; полоса 10 – белок-nOCIF димерного типа; полоса 11 – белок rOCIF(E) мономерного типа; полоса 12 – белок rOCIF(E) димерного типа; полоса 13 – белок rOCIF(С) мономерного типа; полоса 14 – белок rOCIF(С) димерного типа. На фиг.8 приводятся данные SDS-PAGE изолированного природного (n) OCIF-белка и рекомбинантного (r) белка OCIF, из которых в условиях восстановления удалены N-связанные цепи сахаров. rOCIF(E) и rOCIF(С) являются белком rOCIF, продуцированным в клетках 293/EBNA и в СНО-клетках соответственно. Описание полос: полоса 15 – маркерные белки молекулярной массы; полоса 16 – белок nOCIF мономерного типа; полоса 17 – белок nOCIF димерного типа; полоса 18 – белок rOCIF(E) мономерного типа; полоса 19 – белок rOCIF (E) димерного типа; полоса 20 – белок rOCIF(С) мономерного типа; полоса 21 – белок rOCIF (С) димерного типа. На фиг.9 сравниваются аминокислотные последовательности OCIF и OCIF2. Фиг.10 показывает сравнение аминокислотных последовательностей OCIF и OCIF3. Фиг.11 показывает сравнение аминокислотных последовательностей OCIF и OCIF4. Фиг.12 показывает сравнение аминокислотных последовательностей OCIF и OCIF5. На фиг.13 приводится стандартная кривая для определения концентрации белка OCIF с помощью ИФА с использованием поликлональных антител против OCIF. На фиг.14 приводится стандартная кривая для определения концентрации белка OCIF с помощью ИФА с использованием моноклональных антител против OCIF. На фиг.15 показывается действие белка OCIF при остеопорозе. Наилучший способ осуществления изобретения Настоящее изобретение в дальнейшем будет поясняться с помощью приведенных ниже примеров, однако объем изобретения не ограничивается указанными примерами. ПРИМЕР 1 Получение кондиционированной среды человеческих фиброластов IMR-90 Человеческие эмбриональные легочные фибробластные клетки IMR-90 (ATCC-CCL186) выращивают на кусках глиноземистой керамики (80 г) (99,5% диоксида алюминия, изготовитель Toshiba Ceramic К.К.) в среде DMEM (изготовитель Gibco BRL Со.) с добавлением 5% CS (телячьей сыворотки) и 10 мМ буфера HEPES (500 мл на роллер-флакон) при 37 ПРИМЕР 2 Метод анализа на активность ингибирования развития остеокластов Активность ингибирования развития остеокластов анализируют путем измерения активности тартрат-резистентной кислой фосфатазы (TRAP) по методам М. Kumegava с сотр. (Protein. Nucleic Acid. Enzyme, vol.34, p.999, 1989) и N. Takahashi с сотр. (Endocrynology, vol.122, p.1373, 1988) с некоторыми изменениями. Коротко, клетки костного мозга, полученные от мыши в возрасте 17 дней, суспендируют в ПРИМЕР 3 Очистка OCIF I) Колоночная хроматография на гепарин-сефарозе CL-6B Кондиционированную IMR-90 среду (90 л, образец 1) фильтруют через 0,22-мкм мембранный фильтр (гидрофильный милли-диск, 2000 см2, Millipore Co.), и разделяют фильтрат на три части. Каждую часть (30 л) вносят в колонку с гепарин-сефарозой CL-6B (5 II) Колоночная хроматография на HiLoad-Q/FF Фракцию с гепарин-сефарозного адсорбента (образец 2) диализуют против 10 мМ трис-HCl, pH 7,5, с добавлением ХАПС до конечной концентрации 0,1%, инкубируют при 4 III) Колоночная хроматография на HiLoad-S/HP Неадсорбированную на HiLoad-Q фракцию (образец 3) загружают в катионообменную колонку (HiLoad-S/HP, 2,6 IV) Аффинная колоночная хроматография с гепарином 5PW Разводят 120 мл фракции с HiLoad с 21 по 30 (образец 4) 240 мл 50 мМ трис-HCl, 0,1% ХАПС, рН 7,5, и вносят в колонку для аффинной хроматографии с гепарином 5PW (0,8 V) Аффинная колоночная хроматография на синем 5PW Образец 5 (10 мл) разбавляют 190 мл 50 мМ трис-HCl, 0,1% ХАПС, рН 7,5, и вносят в колонку с синим 5PW для аффинной хроматографии (0,5 VI) Колоночная хроматография с обращенной фазой Фракцию с синего 5PW, полученную при сборе фракций 49-50, подкисляют 10 мкл 25% ТФК (трифторуксусная кислота) и вносят в колонку С4 для хроматографии с обращенной фазой (BU-300, 2,1 ПРИМЕР 4 Молекулярная масса белка OCIF Два белковых пика (6 и 7) с активностью OCIF подвергают электрофорезу в полиакриламидном геле в присутствии ДСН в условиях восстановления и в невосстанавливающих условиях. Коротко, 20 мкл фракции каждого пика концентрируют в вакууме и растворяют в 1,5 мкл 10 мМ трис-HCl, рН 8, 1 мМ ЭДТК, 2,5% ДСН, 0,01% бромофенолового синего, и инкубируют при 37°С в течение ночи в невосстанавливающих условиях или в условиях восстановления (с 5% 2-меркаптоэтанола). Затем по 1,0 мкл каждого образца анализируют методом электрофореза в полиакриламидном геле в присутствии ДСН с градиентом геля 10-15% акриламида (Pharmacia Co.) и приспособлением для электрофореза (Fast System, Pharmacia Co.). Для вычисления молекулярной массы используют следующие маркерные белки молекулярной массы: фосфорилазу b (94 кД), бычий сывороточный альбумин (67 кД), овальбумин (43 кД), карбоангидразу (30 кД), триприновый ингибитор (20,0 кД) и лактальбумин (14,4 кД). После электрофореза белковые полосы визуализируют серебряным красителем, используя набор Phast с серебряным красителем. Результаты приводятся на фиг.4. Полоса белка явно в 60 кД детектируется в белке пика 6 как в условиях восстановления, так и в невосстанавливающих условиях. В белке пика 7 полоса белка с явными 60 кД детектируется в условиях восстановления, и полоса белка с явными 120 кД детектируется в невосстанавливающих условиях. Поэтому белок пика 7 рассматривают как гомодимер белка пика 6. ПРИМЕР 5 Термоустойчивость OCIF Образцы в 20 мкл фракций 51 и 52 из синего 5PW разбавляют до 30 мкл 10 мМ забуференного фосфатом физиологического раствора, рН 7,2, и инкубируют в течение 10 мин при 70 ПРИМЕР 6 Внутренняя аминокислотная последовательность белка OCIF Каждые 2 фракции (1 мл) №№51-70 из фракции из синего 5PW подкисляют 10 мкл 25% ТФК и вносят в колонку С4 для хроматографии с обращенной фазой (BU-300, 2,1 Белок пика 6 или пика 7, очищенный С4-ВЭЖХ, концентрируют центрифугированием и пиридилэтилируют в условиях восстановления. Коротко, 50 мкл 0,5 М трис-HCl, рН 8,5, содержащего 100 мкг дитиотрейтола, 10 мМ ЭДТК, 7 М гидрохлорида гуанидина и 1% ХАПС, добавляют к каждому образцу, и смеси инкубируют в течение ночи в темноте при комнатной температуре. Каждую смесь подкисляют 25% ТФК (конечная концентрация 0,1%) и вносят в колонку С4 для хроматографии с обращенной фазой (BU-300, 2,1 Пептидные фрагменты элюируют из колонки с линейным градиентом ацетонитрила от 0 до 50% при скорости потока 0,2 мл/мин в течение 70 мин, и собирают пептид каждого пика. Каждый пептидный фрагмент (Р1-Р3) вносят в белковый секвенатор. Последовательности пептидов показаны в последовательностях под номерами 1-3 соответственно. ПРИМЕР 7 Определение нуклеотидной последовательности кДНК OCIF I) Выделение поли(А)+РНК из клеток IMR-90 Из 1 II) Получение смешанных затравок Две показанные ниже смешанные затравки синтезируют на основе аминокислотных последовательностей двух пептидов (пептид Р2 и пептид Р3, последовательности №№2 и 3 соответственно). Все олигонуклеотиды в смешанных затравках №2F могут кодировать аминокислотную последовательность в пептиде 2 с шестого остатка – глутамина (Gln) до двенадцатого остатка – лейцина (Leu). Все олигонуклеотиды в смешанных затравках №3R могут кодировать аминокислотную последовательность в пептиде 3 с шестого остатка – гистидина (His) до двенадцатого остатка – лизина (Lys). Последовательности смешанных затравок В №№2F и 3R приведены в табл.3. III) Амплификация фрагмента кДНК OCIF методом ПЦР (полимеразной цепной реакции) Первую нить кДНК генерируют с использованием набора для синтеза кДНК Superscript II (Gibco BRL) и 1 мкг поли(А)+РНК, полученной в примере 7-I, в соответствии с рекомендациями изготовителя. Фрагмент ДНК, кодирующий OCIF, получают с помощью ПЦР с использованием кДНК-матрицы и затравок, описанных в примере 7-II. ПЦР осуществляют при следующих условиях: 10Х буфера Ex Taq (Takara Shuzo) 5 мкл 2,5 мМ раствор dNTP* 4 мкл раствор кДНК 1 мкл Ex Taq (Takara Shuzo) 0,25 мкл стерильная дистиллированная вода 29,75 мкл 40 мкМ раствор затравок №2F 5 мкл 40 мкМ раствор затравок №3R 5 мкл * dNTP=дезоксинуклеозид-5’-трифосфат. Компоненты реакции смешивают в микроцентрифужной пробирке. За начальной стадией денатурации при 95 ПРИМЕР 8 Клонирование фрагмента кДНК OCIF, амплифицированного ПЦР, и определение его ДНК-последовательности Фрагмент кДНК OCIF, амплифицированный ПЦР в примере 7-III, вставляют в плазмиду pBluescript II SK–, используя набор для лигирования ДНК, вар.2 (Takara Shuzo), по способу Marchuk D. с сотр. (Nucleic Acids Res., vol.19, p.1154, 1991). E.coli, DH5 (Gibco BRL), трансформируют смесью лигирования. Выращивают трансформанты, и очищают плазмиду, содержащую кДНК OCIF (около 400 п.о.), используя обычно применяемые для этого методы. Эту плазмиду называют pBSOCIF. Последовательность кДНК OCIF в pBSOCIF определяют с использованием набора для секвенирования Taq Dye Deoxy Terminater Cycle (Perkin-Elmer). Размер кДНК OCIF составляет 397 п.о. кДНК OCIF кодирует аминокислотную последовательность, содержащую 132 остатка. Аминокислотные последовательности внутренних пептидов (пептид Р2 и пептид Р3, последовательности №№2 и 3 соответственно), которые используют для создания затравок, обнаруживают в N- или С-концевой области в аминокислотной последовательности полипептида из 132 аминокислот, предсказанного кДНК OCIF в 397 п.о. Кроме того, аминокислотная последовательность внутреннего пептида Р1 (последовательность №1) также обнаруживается в предсказанной аминокислотной последовательности полипептида. Эти данные показывают, что кДНК OCIF в 397 п.о. является частью кДНК CCIF полной длины. ПРИМЕР 9 Получение ДНК-зонда Получают кДНК OCIF в 397 п.о. при условиях, описанных в примере 7-III. кДНК OCIF подвергают препаративному электрофорезу в агарозном геле. Из геля кДНК OCIF очищают с использованием набора для экстракции из геля QIAEX (QIAGEN), метят [ ПРИМЕР 10 Получение кДНК-библиотеки Генерируют кДНК, используя набор для синтеза кДНК большой длины (Clontech), затравку олиго(dТ), [ ПРИМЕР 11 Скрининг рекомбинантного фага Рекомбинантными фагами, полученными в примере 10, инфицируют E.coli, XLl-Blue MRF’ (Stratagene), при 37 ПРИМЕР 12 Определение нуклеотидной последовательности кДНК OCIF, содержащей полную кодирующую область Нуклеотидную последовательность кДНК OCIF, полученную в примере 11, определяют с использованием набора для секвенирования Taq Dye Deoxy Terminator Cycle (Perkin-Elmer). Используют затравки Т3, Т7 (Stratagene) и синтетические затравки, созданные в соответствии с кДНК-последовательностью OCIF. Последовательности этих затравок показаны в списке последовательностей под номерами с 16 по 29. Нуклеотидная последовательность кДНК OCIF показана как последовательность №6, а аминокислотная последовательность, предсказанная кДНК-последовательностью, представлена в последовательности №5. ПРИМЕР 13 Продуцирование рекомбинантного OCIF клетками 293/EBNA I) Конструирование плазмиды для экспрессии кДНК OCIF Получают pBKOCIF, содержащую кДНК OCIF порядка 1,6 кб, как описано в примере 11, и переваривают рестрикционными ферментами BamHI и XhoI. Вырезают вставку кДНК OCIF, отделяют путем электрофореза в агарозном геле и очищают, используя набор для экстракции из геля QIAEX (QIAGEN). Очищенную вставку кДНК OCIF лигируют с использованием набора для лигирования ДНК, вар.2 (Takara Shuzo), с экспрессионным вектором рСЕР4 (Invitrogen), переваренным рестрикционными ферментами BamHI и XhoI. E.coli, DH5 II) Промежуточная экспрессия кДНК OCIF и анализ биологической активности Рекомбинантный OCIF получают с использованием экспрессионной плазмиды pCEPOCIF, полученной в примере 13-I, по способу, описанному ниже. Инокулируют 8 III) Выделение рекомбинантного OCIF из кондиционированной 293/EBNA среды В кондиционированную 293/EBNA среду (1,8 л), полученную путем культивирования клеток, описанную в примере 13-II, добавляют 0,1% ХАПС и фильтруют через мембранный фильтр 0,22 мкм (Steribecs GS, Millipore Co.). Кондиционированную среду вносят в 50 мл гепарин-сефарозную колонку CL-6B (2,6 После промывания колонки 10 мМ трис-HCl, рН 7,5, адсорбированный белок элюируют из колонки с линейным градиентом NaCl от 0 до 2 М при скорости потока 4 мл/мин в течение 100 мин, и собирают фракции (8 мл). Используя 150 мкл каждой фракции, анализируют активность OCIF по методу, описанному в примере 2. Активную фракцию OCIF (112 мл) получают при элюировании приблизительно 0,6-1,2 М NaCl. Активную фракцию (112 мл) разводят до 1000 мл 10 мМ трис-HCl, 0,1% ХАПС, рН 7,5, и вносят в гепарин-аффинную колонку (гепарин 5PW, 0,8 ПРИМЕР 14 Продуцирование рекомбинантного OCIF с использованием СНО-клеток I) Конструирование плазмиды для экспрессии OCIF Получают pBKOCIF, содержащую кДНК OCIF порядка 1,6 кб, как описано в примере 11, и переваривают рестрикционными ферментами SalI и EcoRV. Вставку кДНК OCIF порядка 1,4 кб отделяют с помощью электрофореза в агарозном геле и очищают, используя набор для экстракции в геле QIAEX (QIAGEN). Экспрессионный вектор pcDL-SR II) Получение экспрессионной плазмиды Трансформант, содержащий OCIF-экспрессионную плазмиду pSR III) Адаптация клеток CHOdhFr – к безбелковой среде Клетки CHOdhFr- (ATCC, CRL9096) выращивают в IMDM, содержащей 10% фетальной телячьей сыворотки. Клетки адаптируют к EX-CELL 301 (JRH Bioscience), а затем адаптируют к EX-CELL PF CHO (JRH Bioscience) в соответствии с указаниями изготовителя. IV) Трансфекция OCIF-экспрессионной плазмиды и мышиной DHFR-экспрессионной плазмиды в клетки CHOdhFr- Клетки CHOdhFr-, полученные в примере 14-III, трансфицируют с помощью электропорации pSR V) Продуцирование рекомбинантного OCIF Для продуцирования рекомбинантного OCIF (rOCIF) среду EX-CELL 301 (3 л) в 3/литровой вращающейся колбе инокулируют клоном (5561) при плотности клеток 1 VI) Выделение рекомбинантного белка OCIF из кондиционированной среды СНО-клеток В кондиционированную среду СНО-клеток (1,0 л), описанную в примере 14-V, добавляют 1,0 г ХАПС и фильтруют ее через мембранный (0,22 мкм) фильтр (Steribecks GS, Millipore Со.). Кондиционированную среду вносят в гепарин-сефарозную (FF) колонку (2,6 Активную фракцию (112 мл) разводят до 1200 мл 10 мМ трис-HCl, 0,1% ХАПС, рН 7,5, и вносят в аффинную колонку (синий 5PW, 0,5 При SDS-PAGE в условиях восстановления детектируют одну полосу белка rOCIF со средней молекулярной массой 60 кД во фракциях 30-38, при невосстанавливающих условиях также детектируют полосы белка rOCIF со средней массой 60 кД и 120 кД во фракциях 30-38. Выделенную фракцию rOCIF – 30-38 – определяют как очищенный рекомбинантный OCIF, полученный из СНО-клеток (rOCIF(C)). Получают 4,5 мл rOCIF(C) (113 мкг/мл), когда определение осуществляют по методу Лоури с использованием в качестве стандартного белка бычьего сывороточного альбумина. ПРИМЕР 15 Определение N-концевой аминокислотной последовательности rOCIF Адсорбируют по 3 мкг выделенных rOCIF(Е) и rOCIF(С) на поливиниледендифторидных (PVDF) мембранах с Prospin (PERKIN ELMER Co.). Мембраны промывают 20% этанолом, и анализируют N-концевые аминокислотные последовательности адсорбированных белков с помощью белкового секвенатора (PROCISE 492, PERKIN ELMER Co.). Установленная N-концевая аминокислотная последовательность показана в последовательности №7. N-Концевой аминокислотой rOCIF(Е) и rOCIF(С) является 22-я аминокислота глутамина от Met как начальной точки трансляции, как показано в последовательности №5. 21 аминокислота от Met до Gin идентифицирована как сигнальный пептид. N-Концевая аминокислотная последовательность OCIF, выделенного из кондиционированной IMR-90 среды, не детектируется. Соответственно, N-концевой глутамин OCIF может быть блокирован путем превращения глутамина в пироглутамин во время культивирования или очистки. ПРИМЕР 16 Биологическая активность рекомбинантного (r) OCIF и природного (n)OCIF I) Ингибирование индуцированного витамином D3 образования остеокластов из клеток мышиного костного мозга Образцы rOCIF(E) и nOCIF разводят Как nOCIF, так и rOCIF(E) ингибирует образование остеокластов в зависимости от дозы при концентрации 16 нг/мл или выше. II) Ингибирование индуцированного витамином D3 образования остеокластов в сокультурах стромальных клеток и мышиных селезеночных клеток Действие OCIF на образование остеокластов, индуцированного витамином D3, в сокультурах стромальных клеток и мышиных селезеночных клеток проверяют по методу N. Udagava с сотр. (Endocrinology, vol.125, p.1805-1813, 1989). Конкретно, образцы rOCIF(E), rOCIF(C) и nOCIF разводят серийно nOCIF, rOCIF(E) и rOCIF(C) ингибируют образование остеокластов в зависимости от дозы при концентрации 6-16 нг/мл или выше. III) Ингибирование индуцированного РТН образования остеокластов из клеток мышиного костного мозга Действие OCIF на образование остеокластов, индуцированное РТН, проверяют по методу N. Takahashi с сотр. (Endocrinology, vol.122, p.1373-1382, 1988). Конкретно, образцы rOCIF(E) и nOCIF (125 нг/мл) разводят серийно nOCIF и rOCIF(E) ингибируют образование остеокластов в зависимости от дозы при концентрации 16 нг/мл и выше. IV) Ингибирование образования остеокластов, индуцированного ИЛ-11 Действие OCIF на образование остеокластов, индуцированное ИЛ-11, проверяют по методу Т. Tamura с сотр. (Рrос. Natl. Acad. Sci. USA, vol.90, p.11924-11928, 1993). Конкретно, образцы rOCIF(E) и nOCIF разводят серийно Как nOCIF, так и rOCIF(E) ингибируют образование остеокластов в зависимости от дозы при концентрации 2 нг/мл и выше. Результаты, приведенные в таблицах 4-8, показывают, что OCIF ингибирует образование остеокластов во всех случаях индуцирования – витамином D3, РТН и ИЛ-11, почти при одних и тех же дозах. Соответственно, OCIF можно было бы применять для лечения различных типов костных нарушений с уменьшением костной массы, которые вызываются различными веществами, которые индуцируют костную резорбцию. ПРИМЕР 17 Выделение OCIF мономерного типа и OCIF димерного типа В каждый образец rOCIF(E) и rOCIF(С), содержащий 100 мкг белка OCIF, добавляют 1/100 объема 25% трифторуксусной кислоты и вносят в колонку для хроматографии с обращенной фазой (PROTEIN-RP, 2,0 ПРИМЕР 18 Определение молекулярной массы рекомбинантных OCIF По 1 мкг выделенных nOCIF мономерного и димерного типа очищают, используя колонку для хроматографии с обращенной фазой, как описано в примере 3-IV, и по 1 мкг rOCIF мономерного и димерного типа, описанных в примере 17, концентрируют в вакууме. Каждый образец инкубируют в буфере для SDS-PAGE, подвергают электрофорезу в полиакриламидном геле в присутствии ДСН, и белковые полосы на геле окрашивают серебряным красителем по методу, описанному в примере 4. Результаты электрофореза при невосстанавливающих условиях и в условиях восстановления показаны на фиг.6 и фиг.7. Полосу белка со средней молекулярной массой 60 кД детектируют в каждом образце OCIF мономерного типа, и полосу белка со средней молекулярной массой 120 кД детектируют в каждом образце OCIF димерного типа при невосстанавливающих условиях. В условиях восстановления полосу белка со средней молекулярной массой 60 кД детектируют в каждом образце OCIF мономерного типа. Соответственно, молекулярные массы nOCIF мономерного типа из клеток IMR-90, rOCIF из клеток 293/EBNA и rOCIF из СНО-клеток, являются почти такими же. Молекулярные массы nOCIF димерного типа из клеток IMR-90, rOCIF из клеток 293/EBNA и rOCIF из СНО-клеток также являются почти теми же. ПРИМЕР 19 Удаление N-соединенной олигосахаридной цепи и измерение молекулярной массы природного и рекомбинантного OCIF Каждый образец, содержащий 5 мкг выделенного nOCIF мономерного и димерного типа, очищенный с использованием колонки для хроматографии с обращенной фазой по примеру 3-IV, и каждый образец, содержащий 5 мкг rOCIF мономерного и димерного типа, описанный в примере 17, концентрируют в вакууме. Каждый образец растворяют в 9.5 мкл 50 мМ натрийфосфатного буфера, pH 8,6, содержащего 100 мМ 2-меркаптоэтанола, добавляют 0,5 мкл 250 Е/мл N-гликаназы (Seikagaku kogyo Co.) и инкубируют в течение суток при 37 Средняя молекулярная масса каждого дегликозилированного nOCIF из клеток IMR-90, rOCIF из СНО-клеток и rOCIF из клеток 293/EBNA составляет 40 кД в условиях восстановления. Средняя молекулярная масса необработанных nOCIF из клеток IMR-90, rOCIF из клеток 293/EBNA и rOCIF из СНО-клеток в условиях восстановления составляет 60 кД. Соответственно, результаты показывают, что белки OCIF представляют собой гликопротеины с N-присоединенными цепями сахаров. ПРИМЕР 20 Клонирование кДНК вариантов OCIF и определение их ДНК-последовательностей Плазмиду pBKOCIF, которая является вставкой кДНК OCIF в pBKCMV (Stratagene), получают из одного из очищенных позитивных фагов, как в примере 10 и 11. Кроме того, во время скрининга кДНК-библиотеки с зондом кДНК OCIF в 397 п.о. получают трансформанты, содержащие плазмиды, у которых размеры вставки отличаются от рамера pBKOCIF. Выращивают эти трансформанты, содержащие плазмиды, и плазмиды очищают стандартным способом. Последовательность вставленной ДНК в каждой плазмиде определяют с использованием набора для секвенирования Taq Dye Deoxy Terminater Cycle (Perkin Elmer). Используют затравки Т3, Т7 (Stratagene) и синтетические затравки, полученные на основе нуклеотидной последовательности кДНК OCIF. Кроме OCIF существует 4 варианта OCIF (OCIF2, 3, 4 и 5). Нуклеотидная последовательность OCIF2 приводится в последовательности №8, а аминокислотная последовательность OCIF2, предсказанная нуклеотидной последовательностью, показана в последовательности №9. Нуклеотидная последовательность OCIF3 приводится в последовательности №10, а аминокислотная последовательность OCIF3, предсказанная нуклеотидной последовательностью, показана в последовательности №11. Нуклеотидная последовательность OCIF4 приводится в последовательности №12, а аминокислотная последовательность OCIF4, предсказанная нуклеотидной последовательностью, показана в последовательности №13. Нуклеотидная последовательность OCIF5 приводится в последовательности №14, а аминокислотная последовательность OCIF5, предсказанная нуклеотидной последовательностью, показана в последовательности №15. Строение вариантов OCIF показано на чертежах 9-12 и коротко описано ниже. OCIF2 кДНК OCIF2 имеет делецию 21 п.о. от гуанина под нуклеотидным номером 265 до гуанина с номером 285 в кДНК OCIF (последовательность №6). Соответственно, OCIF2 имеет делецию 7 аминокислот от глутаминовой кислоты (Glu) под № (аминокислотным) 68 до глутамина (Gln) под №74 в OCIF (последовательность №5). OCIF3 кДНК OCIF3 имеет точковую мутацию в нуклеотиде №9 в кДНК OCIF (последовательность №6), где цитидин заменяется гуанином. Соответственно, OCIF3 имеет мутацию, и аспарагин (Asn) под №-19 в OCIF (последовательность №5) заменяется лизином (Lys). Оказывается, что мутация располагается в сигнальной последовательности и не оказывает существенного влияния на секретированный OCIF3. КДНК OCIF3 имеет делецию 117 п.о. от гуанина под №872 до цитидина под №988 в кДНК OCIF (последовательность №6). Соответственно, OCIF3 имеет делецию 39 аминокислот от треонина (Thr) под №270 до лейцина (Leu) – аминокислоты № 308 в OCIF (последовательность № 5). OCIF4 кДНК OCIF4 имеет две точковые мутации в кДНК OCIF (последовательность №6). Цитидин под №9 в кДНК OCIF заменяется гуанином, а гуанин под №22 заменяется тимидином (последовательность №6). Соответственно, OCIF4 имеет две мутации. Аспарагин (Asn) под №19 в OCIF (последовательность №5) заменяется лизином (Lys), а аланин (А1а) под №-14 заменяется серином (Ser). Оказывается, что эти мутации располагаются в сигнальной последовательности и не оказывают существенного влияния на секретированный OCIF4. кДНК OCIF4 содержит ДНК порядка 4 кб, которая является интроном 2 гена OCIF, вставленным между нуклеотидом под №400 и нуклеотидом под №401 в кДНК OCIF (последовательность №6). Открытая рамка считывания кончается в интроне 2. Соответственно, OCIF4 имеет дополнительную новую аминокислотную последовательность, содержащую 21 аминокислоту, после аланина (А1а) под №112 в OCIF (последовательность №5). OCIF5 кДНК OCIF5 имеет точковую мутацию в нуклеотиде №9 в кДНК OCIF (последовательность №6), где цитидин заменяется гуанином. Соответственно, OCIF5 имеет мутацию, и аспарагин (Asn) под Р 19 в OCIF (последовательность №5) заменяется лизином (Lys). Оказывается, что мутация располагается в сигнальной последовательности и не оказывает существенного влияния на секретированный OCIF5. кДНК OCIF5 имеет последнюю часть (около 1.8 кб) интрона 2 между нуклеотидом № 400 и нуклеотидом №401 в кДНК OCIF (последовательность №6). Открытая рамка считывания кончается в последней части интрона 2. Соответственно, OCIF5 имеет дополнительную новую аминокислотную последовательность, содержащую 12 аминокислот, после аланина (Аlа) под №112 в OCIF (последовательность №5). ПРИМЕР 21 Продуцирование вариантов OCIF I) Конструирование плазмиды для экспрессии вариантов OCIF Плазмиду, содержащую OCIF2 или OCIF3, получают так, как описано в примере 20, и называют pBKOCIF2 и pBKOCIFS соответственно. pBKOCIF2 и pBKOCIF3 переваривают рестрикционными ферментами BamHI и XhoI. Вставки кДНК OCIF2 и OCIF3 отделяют с помощью электрофореза в агарозном геле и очищают от геля с использованием набора для экстракции из геля QIAEX (OIAGEN). Очищенные вставки кДНК OCIF2 и OCIF3 лигируют по отдельности, используя набор для ДНК-лигирования, вар.2 (Takara Shu-20), с экспрессионным вектором рСЕР4 (Invitrogen), который переварен рестрикционными ферментами BamHI и XhoI. Смесью лигирования трансформируют E.coli, DH5 Плазмиду, содержащую кДНК OCIF4, получают так, как описано в примере 20, и называют pBKOCIF4. Переваривают pBKOCIF4 рестрикционными ферментами SpeI и XhoI (Takara Shuzo). Вставку кДНК OCIF4 отделяют электрофорезом в агарозном геле и очищают от геля с использованием набора для экстракции из геля QIAEX (QIAGEN). Очищенную вставку кДНК OCIF4 лигируют с использованием набора для ДНК-лигирования, вар.2 (Takara Shuzo), с экспрессионным вектором рСЕР4 (Invitrogеn), который переварен рестрикционными ферментами NheI и XhoI (Takara Shuzo). Смесью лигирования трансформируют Е. coli, DH5 Плазмиду, содержащую кДНК OCIF5, получают так, как описано в примере 20, и называют pBKOCIF5. Переваривают pBKOCIF5 рестрикционным ферментом HindIII (Takara Shuzo). Часть 5’-кодирующей области вставки кДНК OCIF5 отделяют электрофорезом в агарозном геле и очищают от геля с использованием набора для экстракции из геля QIAEX (QIAGEN). Плазмиду экспрессии OCIF pCEPOCIF, полученную в примере 13-I, переваривают рестрикционным ферментом HindIII (Tagara Shuzo). Часть 5’ кодирующей области кДНК OCIF удаляют. Остаток плазмиды, который содержит вектор рСЕР и часть 3’ кодирующей области кДНК OCIF, называют pCEPOCIF-3’. Отделяют pCEPOCIF-3’ электрофорезом в агарозном геле и очищают от геля с использованием набора для экстракции из геля QIAEX (QIAGEN). Фрагмент HindIII кДНК OCIF5 и pCEPOCIF-3’ лигируют с использованием набора для ДНК-лигирования, вар.2 (Takara Shuzo). Смесью лигирования трансформируют E.coli, DH5 Полученные трансформанты выращивают при 37 II) Промежуточная экспрессия кДНК вариантов OCIF и анализ биологической активности вариантов рекомбинантного OCIF Варианты рекомбинантного OCIF продуцируют с использованием экспрессионных плазмид pCEPOCIF2, pCEPOCIF3, pCEPOCIF4 и pCEPOCIF5, полученных, как описано в Примере 21-I, по способу, описанному в примере 13-II. Анализируют биологическую активность вариантов рекомбинантного OCIF. Результаты таковы, что эти варианты OCIF (OCIF2, OCIF3, OCIF4 и OCIF5) имеют слабую активность. ПРИМЕР 22 Получение мутантов OCIF I) Конструирование плазмидного вектора для субклонирования кДНК, кодирующих мутанты OCIF Плазмидный вектор (5 мкг), описанный в примере 11, переваривают рестрикционными ферментами BamHI и XhoI (Takara Shuzo). Переваренную ДНК подвергают препаративному электрофорезу в агарозном геле. Фрагмент ДНК размером приблизительно в 1,6 тысяч пар оснований (кб), который содержит полную кодирующую последовательность для OCIF, очищают от геля с использованием набора для экстракции из геля QIAEX (QIAGEN). Очищенную ДНК растворяют в 20 мкл стерильной дистиллированной воды. Раствор называют ДНК-раствором 1. Переваривают р Bluescript II SK + (3 мкг) (Stratagene) рестрикционными ферментами BamHI и XhoI (Takara Shuzo). Переваренную ДНК подвергают препаративному электрофорезу в агарозном геле. Фрагмент ДНК размером приблизительно в 3,0 кб очищают от геля с использованием набора для экстракции из геля QIAEX (QIAGEN). Очищенную ДНК растворяют в 20 мкл стерильной дистиллированной воды. Раствор называют ДНК-раствором 2. Смешивают 1 мкл ДНК-раствора 2, 4 мкл ДНК-раствора 1 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2 (Takara Shuzo), и инкубируют при 16 Шесть колоний, которые выращивают на пластинке, инкубируют по отдельности в течение ночи при 37 II) Получение мутантов, в которых один из Сys-остатков в OCIF заменен остатком Ser 1) Введение мутаций в кДНК OCIF Получают мутанты OCIF, в которых один из пяти Сys-остатков, присутствующих в положениях 174, 181, 256, 298 и 379 (в послед. №4) заменен на остаток Ser, и обозначают их OCIF-C19S (174 Сys заменен на Ser), OCIF-C20S (181 Сys заменен на Ser), OCIF-C21S (256 Сys заменен на Ser), OCIF-C22S (298 Сys заменен на Ser) и OCIF-C23S (379 Сys заменен на Ser) соответственно. Для получения мутантов нуклеотиды, кодирующие соответствующие Сys-остатки, заменяют нуклеотидами, кодирующими Ser. Мутагенез осуществляют путем двухстадийной полимеразной цепной реакции (ПЦР). Первая стадия ПЦР состоит из двух реакций – ПЦР 1 и ПЦР 2. ПЦР 1 10X буфера Еx Taq (Takara Shuzo) 10 мкл 2,5 М раствор dNTP 8 мкл Плазмидный вектор, описанный в примере 11 (8 нг/мл) 2 мкл Стерильная дистиллированная вода 73,5 мкл 20 мкМ раствор затравки 1 5 мкл 100 мкМ раствор затравки 2 (для мутагенеза) 1 мкл Ex Taq (Takara Shuzo) 0,5 мкл ПЦР 2 10X буфера Ex Taq (Takara Shuzo) 10 мкл 2,5 М раствор dNTP 8 мкл Плазмидный вектор, описанный в примере 11 (8 нг/мл) 2 мкл Стерильная дистиллированная вода 73,5 мкл 20 мкМ раствор затравки 3 5 мкл 100 мкМ раствор затравки 4 (для мутагенеза) 1 мкл Ex Taq (Takara Shuzo) 0,5 мкл Специфические наборы затравок используют для каждой мутации, а другие компоненты не меняются. Затравки, применяемые для реакций, приводятся в табл.10. Нуклеотидные последовательности затравок приводятся в послед. №№20, 23, 27 и 30-40. ПЦР осуществляют при следующих условиях. После стадии начальной денатурации при 97 ПЦР 3 10Х буфера Ex Taq (Takara Shuzo) 10 мкл 2,5 М раствор dNTP 8 мкл Раствор, содержащий фрагмент ДНК, полученный при ПЦР 1 5 мкл Раствор, содержащий фрагмент ДНК, полученный при ПЦР 2 5 мкл Стерильная дистиллированная вода 61,5 мкл 20 мкМ раствор затравки 1 5 мкл 20 мкМ раствор затравки 3 0,5 мкл Ex Taq (Takara Shuzo) 0,5 мкл Условия реакции точно такие же, как для ПЦР 1 или ПЦР 2. Размер продуктов ПЦР подтверждают электрофорезом в 1,0% или 1,5% агарозном геле. Фрагменты ДНК осаждают этанолом, сушат в вакууме и растворяют в 40 мкл стерильной дистиллированной воды. Растворы, содержащие фрагменты ДНК с мутациями C19S, C20S, C21S, C22S и C23S, обозначают как ДНК-раствор А, ДНК-раствор В, ДНК-раствор С, ДНК-раствор D и ДНК-раствор Е соответственно. Фрагмент ДНК, который содержится в растворе А (20 мкл), переваривают рестрикционными ферментами NdeI и SphI (Takara Shuzo). Фрагмент ДНК размером приблизительно в 400 пар оснований (п.о.) экстрагируют из препаративного агарозного геля и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 3. Переваривают 2 мкг pSK+ -OCIF рестрикционными ферментами NdeI и SphI. Фрагмент ДНК размером приблизительно в 4,2 кб очищают от препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 4. Смешивают 2 мкл ДНК-раствора 3, 3 мкл ДНК-раствора 4 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Фрагмент ДНК, который содержится в растворе В (20 мкл), переваривают рестрикционными ферментами NdeI и SphI. Фрагмент ДНК размером приблизительно в 400 м.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 5. Смешивают 2 мкл ДНК-раствора 5, 3 мкл ДНК-раствора 4 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, Вар-2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Фрагмент ДНК, который содержится в растворе С (20 мкл), переваривают рестрикционными ферментами NdeI и SphI. Фрагмент ДНК размером приблизительно в 400 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 6. Смешивают 2 мкл ДНК-раствора 6, 3 мкл ДНК-раствора 4 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Фрагмент ДНК, который содержится в растворе C (20 мкл), переваривают рестрикционными ферментами NdeI и BstPI. Фрагмент ДНК размером приблизительно в 600 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 7. Переваривают 2 мкг pSK+ -OCIF рестрикционными ферментами NdeI и BstPI. Фрагмент ДНК размером приблизительно в 4,0 кб экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 8. Смешивают 2 мкл ДНК-раствора 7, 3 мкл ДНК-раствора 8 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Фрагмент ДНК, который содержится в растворе Е (20 мкл), переваривают рестрикционными ферментами BstPI и EcoRV. Фрагмент ДНК размером приблизительно в 120 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 9. Переваривают 2 мкг pSK+ -OCIF рестрикционными ферментами BstEII и EcoRV. Фрагмент ДНК размером приблизительно в 4,5 кб экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 10. Смешивают 2 мкл ДНК-раствора 9, 3 мкл ДНК-раствора 10 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Полученную таким образом плазмиду называют pSK-OCIF-C23S. 2) Конструирование векторов для экспрессии мутантов OCIF Переваривают pSK-OCIF-C19S, pSK-OCIF-C20S, pSK-OCIF-C21S, pSK-OCIF-C22S и pSK-OCIF-C23S рестрикционными ферментами BamHI и XhoI. Фрагмент ДНК BamHI-XhoI в 1.6 кб, кодирующий каждый мутант OCIF, выделяют и растворяют в 20 мкл стерильной дистиллированной воды. Растворы ДНК, которые содержат фрагменты кДНК в 1.6 кб, полученные из pSK-OCIF-Cl9S, pSK-OCIF-C20S, pSK-OCIF-C21S, pSK-OCIF-C22S и pSK-OCIF-C23S, обозначают как ДНК-раствор C19S, ДНК-раствор C20S, ДНК-раствор C21S, ДНК-раствор C22S и ДНК-раствор C23S соответственно. Переваривают 5 мкг экспрессионного вектора рСЕР4 (Invitrogen) рестрикционными ферментами BamHI и XhoI. Фрагмент ДНК размером приблизительно в 10 кб очищают и растворяют в 40 мкл стерильной дистиллированной воды. Этот ДНК-раствор обозначают как ДНК-раствор рСЕР4. Смешивают независимо 1 мкл ДНК-раствора рСЕР4 и 6 мкл ДНК-раствора C19S, или ДНК-раствора C20S, или ДНК-раствора C21S, или ДНК-раствора C22S, или ДНК-раствора C23S с 7 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 II) Получение мутантов OCIF с доменной делецией (1) Делеционный мутагенез кДНК OCIF Получают ряд мутантов OCIF с делециями от Thr 2 до Ala 42, от Pro 43 до Cys 84, от Glu 85 до Lys 122, от Аrg 123 до Cys 164, от Asp 177 до Gln 251 и от Ile 252 до His 326 (позиции аминокислотных остатков указаны в послед. №4). Эти мутанты обозначают как OCIF-DCRl, OCIF-DCR2, OCIF-DCR3, OCIF-DCR4, OCIF-DDD1, OCIF-DDD2 соответственно. Мутагенез осуществляют двухстадийной ПЦР, как описано в примере 22-II. Наборы затравок для реакции указаны в табл. 11, а нуклеотидные последовательности затравок показаны в последовательностях №№19, 25, 40-53 и 54. Конечные продукты ПЦР осаждают этанолом, сушат в вакууме и растворяют в 40 мкл стерильной дистиллированной воды. Растворы фрагмента ДНК, кодирующего части OCIF-DCR1, OCIF-DCR2, OCIF-DCR3, OCIF-DCR4, OCIF-DDD1, OCIF-DDD2, обозначают как растворы F, G, H, I, J и К соответственно. Фрагмент ДНК, который содержится в растворе F (20 мкл), переваривают рестрикционными ферментами NdeI и XhoI. Фрагмент ДНК размером приблизительно в 500 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 11. Переваривают 2 мкг pSK+ -OCIF рестрикционными ферментами NdeI и XhoI. Фрагмент ДНК размером приблизительно в 4,0 кб экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 12. Смешивают 2 мкл ДНК-раствора 11, 3 мкл ДНК-раствора 12 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Фрагмент ДНК, который содержится в растворе G (20 мкл), переваривают рестрикционными ферментами NdeI и XhoI. Фрагмент ДНК размером приблизительно в 500 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 13. Смешивают 2 мкл ДНК-раствора 13, 3 мкл ДНК-раствора 12 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Фрагмент ДНК, который содержится в растворе Н (20 мкл), переваривают рестрикционными ферментами NdeI и XhoI. Фрагмент ДНК размером приблизительно в 500 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 14. Смешивают 2 мкл ДНК-раствора 14, 3 мкл ДНК-раствора 12 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Фрагмент ДНК, который содержится в растворе I (20 мкл), переваривают рестрикционными ферментами XhoI и SphI. Фрагмент ДНК размером приблизительно в 900 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 15. Переваривают 2 мкг pSK+ -OCIF рестрикционными ферментами XhoI и SphI. Фрагмент ДНК размером приблизительно в 3,6 кб экстаргируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 16. Смешивают 2 мкл ДНК-раствора 15, 3 мкл ДНК-раствора 16 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Фрагмент ДНК, который содержится в растворе J (20 мкл), переваривают рестрикционными ферментами BstPI и NdeI. Фрагмент ДНК размером приблизительно в 400 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 17. Смешивают 2 мкл ДНК-раствора 17, 3 мкл ДНК-раствора 8 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 Фрагмент ДНК, который содержится в растворе К (20 мкл), переваривают рестрикционными ферментами NdeI и BstPI. Фрагмент ДНК размером приблизительно в 400 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 18. Смешивают 2 мкл ДНК-раствора 18, 3 мкл ДНК-раствора 8 и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 (2) Конструирование векторов для экспрессии мутантов OCIF Переваривают pSK-OCIF-DCR1, pSK-OCIF-DCR2, pSK-OCIF-DCR3, pSK-OCIF-DCR4, pSK-OCIF-DDD1 и pSK-OCIF-DDD2 рестрикционными ферментами BamHI и Xhol. Выделяют ДНК-фрагмент BamHI-XhoI, содержащий полную кодирующую последовательность для каждого мутанта OCIF, и растворяют в 20 мкл стерильной дистиллированной воды. Эти растворы ДНК, которые содержат фрагменты BamHI-XhoI, полученные из pSK-OCIF-DCR1, pSK-OCIF-DCR2, pSK-OCIF-DCR3, pSK-OCIF-DCR4, pSK-OCIF-DDD1 и pSK-OCIF-DDD2, обозначают как ДНК-раствор DCR1, ДНК-раствор DCR2, ДНК-раствор DCR3, ДНК-раствор DCR4, ДНК-раствор DDD1 и ДНК-раствор DDD2 соответственно. Смешивают независимо 1 мкл ДНК-раствора рСЕР4 и 6 мкл ДНК-раствора DCR1, или ДНК-раствора DCR2, или ДНК-раствора DCR3, или ДНК-раствора DCR4, или ДНК-раствора DDD1, или ДНК-раствора DDD2, с 7 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакции лигирования. Компетентные клетки DH5 III) Получение OCIF с отсечением С-концевого домена (1) Мутагенез кДНК OCIF Получают ряд мутантов OCIF с делециями от аминокислотного остатка Cys 379 до Leu 380, от Ser 331 до Leu 380, от Asp 252 до Leu 380, от Asp 177 до Leu 380, от Аrg 123 до Leu 380 и от Cys 86 до Leu 380. Позиции аминокислотных остатков показаны в послед. №4. Эти мутанты обозначают как OCIF-CL, OCIF-CC, OCIF-CDD2, OCIF-CDD1, OCIF-CCR4 и OCIF-CCR3 соответственно. Мутагенез OCIF-CL осуществляют двухстадийной ПЦР, как описано в примере 22-II. Набор затравок для реакции приведен в табл.12. Нуклеотидные последовательности затравок показаны в последовательностях №№23, 40, 55 и 56. Конечные продукты ПЦР осаждают этанолом, сушат в вакууме и растворяют в 40 мкл стерильной дистиллированной воды. Этот раствор ДНК обозначают как раствор L. Фрагмент ДНК, который содержится в растворе L (20 мкл), переваривают рестрикционными ферментами BstPI и EcoRV. Фрагмент ДНК размером приблизительно в 100 п.о. экстрагируют из препаративного агарозного геля с помощью набора для экстракции из геля QIAEX и растворяют в 20 мкл стерильной дистиллированной воды. Этот ДНК-раствор называют ДНК-раствором 19. Смешивают 2 мкл ДНК-раствора 19, 3 мкл ДНК-раствора 10 (описанного в примере 22-II) и 5 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакцию лигирования. Компетентные клетки DH5 ПЦР-реакции для мутагенеза для получения OCIF-CC, OCIF-CDD2, OCIF-CDD1, OCIF-CCR4 и OCIF-CCR3 10Х буфера Ex Taq (Takara Shuzo) 10 мкл 2,5 М раствор dNTP 8 мкл Плазмидный вектор, содержащий полную кДНК OCIF, описанный в примере 11 (8 нг/мл) 2 мкл Стерильная дистиллированная вода 73,5 мкл 20 мкМ раствор затравки OCIF Xho F 5 мкл 100 мкМ раствор затравки (для мутагенеза) 1 мкл Ex Taq (Takara Shuzo) 0,5 мкл Специфические затравки используют для каждого мутагенеза, а другие компоненты не изменяются. Затравки, используемые для мутагенеза, приводятся в табл.13. Их нуклеотидные последовательности показаны в последовательностях №№57-61. Компоненты каждой ПЦР смешивают в микроцентрифужной пробирке, и осуществляют ПЦР следующим образом. Микроцентрифужные пробирки обрабатывают в течение 3 минут при 97 Размер продуктов ПЦР подтверждают в агарозном геле. Избыток затравок при ПЦР удаляют, используя микрокон Amicon (Amicon), после завершения реакции. Фрагменты ДНК осаждают этанолом, сушат в вакууме и растворяют в 40 мкл стерильной дистиллированной воды. Фрагмент ДНК в каждом растворе переваривают рестрикционными ферментами XhoI и BamHI. После реакций ДНК осаждают этанолом, сушат в вакууме и растворяют в 20 мкл стерильной дистиллированной воды. Растворы, содержащие фрагменты с делецией СС, делецией CDD2, делецией CDD1, делецией CCR4 и делецией CCR3, обозначают как ДНК-раствор СС, ДНК-раствор CDD2, ДНК-раствор CDD1, ДНК-раствор CDR4 и ДНК-раствор CDR3 соответственно. (2) Конструирование векторов для экспрессии мутантов OCIF Переваривают pSK-OCIF-CL рестрикционными ферментами BamHI и XhoI. Фрагмент ДНК BamHI-XhoI, содержащий полную кодирующую последовательность для OCIF-CL, выделяют и растворяют в 20 мкл стерильной дистиллированной воды. Этот раствор ДНК обозначают как раствор CL ДНК. Смешивают независимо 1 мкл ДНК-раствора рСЕР4 и 6 мкп ДНК-раствора CL, или ДНК-раствора СС, или CDD2, или ДНК-раствора CDD1, или ДНК-раствора CCR4 или ДНК-раствора CCR3, с 7 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакции лигирования. Компетентные клетки DH5 IV) Получение мутантов OCIF с отсечением С-конца (1) Введение С-концевого отсечения в OCIF Получают ряд мутантов с отсечением С-конца. Мутант OCIF, в котором 10 остатков от Gln 371 до Leu 380 заменены 2 остатками Leu-Val, обозначают OCIF-CBst. Мутант OCIF, в котором 83 остатка от Cys 298 до Leu 380 заменены 3 остатками Ser-Leu-Asp, обозначают OCIF-CSph. Мутант OCIF, в котором удалены 214 остатков от Asn 167 до Leu 380, обозначают OCIF-CBsp. Мутант OCIF, в котором 319 остатков от Asp 62 до Leu 380 заменены 2 остатками Leu-Val, обозначают OCIF-CPst. Позиции аминокислотных остатков показаны в послед. №4. Переваривают 2 мкг каждого из pSK+ -OCIF с одним из рестрикционных ферментов BstPI, SphI, PstI (Takara Shuzo) и EspEl (New England Biolabs), а затем экстрагируют фенолом и осаждают этанолом. Осажденную ДНК растворяют в 10 мкл стерильной дистиллированной воды. Концы ДНК в 2 мкл каждого раствора затупляют, используя набор для дефосфорилирования ДНК, в конечном объеме 5 мкл. К реакционным смесям добавляют 1 мкг (1 мкл) содержащего амбер-кодон Хbа 1-линкера (5’-СТА-GTCTAGACTAG-3’) и 6 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2. После реакций лигирования используют по 6 мкл каждой реакционной смеси для трансформации E.coli, DH5 (2) Конструирование векторов для экспрессии мутантов OCIF Переваривают pSK-OCIF-CBst, pSK-OCIF-CSph, pSK-OCIF-CBsp и pSK-OCIF-CPst рестрикционными ферментами BamHI и XhoI. Фрагмент ДНК в 1,5 кб, содержащий полную кодирующую последовательность для каждого мутанта OCIF, выделяют и растворяют в 20 мкл стерильной дистиллированной воды. Эти растворы ДНК, которые содержат фрагмент BamHI-XhoI, полученный из pSK-OCIF-CBst, pSK-OCIF-CSph, pSK-OCIF-CBsp и pSK-OCIF-CPst, обозначают соответственно как ДНК-раствор CBst, ДНК-раствор CSph, ДНК-раствор CBsp и ДНК-раствор CPst. Смешивают независимо 1 мкл ДНК-раствора рСЕР4 (описанного в примере 22-II) и 6 мкл ДНК-раствора CBst, или ДНК-раствора CSph, или ДНК-раствора CBsp, или ДНК-раствора CPst, с 7 мкл буфера для лигирования I из набора для ДНК-лигирования, вар.2, и осуществляют реакции лигирования. Компетентные клетки DH5 V) Получение векторов для экспрессии мутантов OCIF Выращивают клоны E.coli, несущие экспрессионные векторы для мутантов OCIF (всего 21 клон), и векторы очищают на колонке QIAGEN (QIAGEN). Все экспрессионные векторы осаждают этанолом и растворяют в соответствующих объемах стерильной дистиллированной воды и используют для дальнейших, описанных ниже манипуляций. VI) Промежуточная экспрессия кДНК для мутантов OCIF и биологическая активность мутантов Мутанты OCIF продуцируют с использованием экспрессионных векторов, полученных в примере 22-V. Способ, по существу, такой же, какой описан в примере 13. Вводятся только следующие модификации. Для трансфекции ДНК используют 24-луночный планшет. В каждую лунку плашнета высевают 2 VII) Вестерн-блот-анализ Для вестерн-блоттинга используют 10 мкл конечной кондиционированной среды. Смешивают 10 мкл образца с 10 мкл образца буфера для SDS-PAGE (0,5 М трис-HCl, 20% глицерина, 4% ДСН, 20 мкг/мл бромофенолового синего, рН 6,8), кипятят в течение 3 мин и подвергают электрофорезу в 10% полиакриламидном геле в присутствии ДСН в невосстанавливающих условиях. После электрофореза разделенные белки блоттируют на PVDF мембрану (ProBlottR, Perkin Elmer) с использованием полусухого электроблоттера (BIO-RAD). Мембрану инкубируют при 37 ПРИМЕР 23 Выделение человеческого геномного гена OCIF I) Скрининг человеческой геномной библиотеки Скринируют библиотеку амплифицированных генов человеческой плаценты в векторе лямбда FIX II, закупленную у STRATAGENE, на ген, кодирующий человеческий OCIF, используя в качестве зонда кДНК человеческого OCIF. По существу, скрининг осуществляют по указаниям, прилагаемым к геномной библиотеке. Основную схему, описанную в Molecular Cloning: A Laboratory Manual, также используют для работы с фагом, E.coli и ДНК. Библиотеку титруют, и 1 II) Анализ геномных клонов путем переваривания рестрикционными ферментами и саузерн-блот-гибридизации Получают ДНК из каждого фагового изолята методом планшетлизатов, как описано в Molecular Cloning; A Laboratory Manual. ДНК, полученную из каждого фага, переваривают рестрикционными ферментами, и фрагменты, полученные из перевара, разделяют в агарозных гелях. Затем фрагменты переносят на нейлоновые мембраны и подвергают саузерн-блот-гибридизации с использованием кДНК OCIF в качестве зонда. Результаты анализа показывают, что шесть фаговых изолятов являются отдельными клонами. Среди этих фрагментов, полученных при переваривании рестрикционными ферментами, те фрагменты, которые гибридизуются с зондом кДНК OCIF, субклонируют в плазмидных векторах и подвергают анализу нуклеотидной последовательности, как описано ниже. III) Субклонирование в плазмидных векторах рестрикционных фрагментов, полученных из геномных клонов, и определение нуклеотидной последовательности Переваривают ДНК Переваривают ДНК Нуклеотидную последовательность клонированной геномной ДНК определяют с использованием набора для быстрых реакций для секвенирования ABI Dyedeoxy Terminator Cycle (PERKIN ELMER) и системы ДНК-секвенирования 373А (Applied Biosystems). Плазмиды pBSGS-5,8, pBS8H0.9 и pBSG11-6, pBSG11-3,6, pBSG11-2,6 и pSG6H2.2, pBS6H1 и pBS6H1.05 получают по методике “щелочного ДСН”, как описано в Molecular Cloning: A Laboratory Manual, и используют их в качестве матриц для анализа ДНК-последовательностей. Нуклеотидная последовательность гена человеческого OCIF представлена в последовательности №104 и последовательности №105. Нуклеотидная последовательность ДНК между экзоном 1 и экзоном 2 определена неполностью. Между последовательностями №104 и №105 существует промежуток нуклеотидов приблизительно в 17 кб. ПРИМЕР 24 Количественное определение OCIF методом ИФА I) Получение антитела против OCIF Для иммунизации с целью получения антисыворотки используют самцов кролиров JW (Kitayama LABES Co., LTD) массой в 2,5-3,0 кг. Используют для иммунизации трех самцов кроликов JW (Kitayama LABES Co., LTD) массой в 2,5-3,0 кг. Для иммунизации получают эмульсию путем смешивания равных объемов rOCIF (200 мкг/мл) и полного адъюванта Фрейнда (Difco, кат.0638-60-7). Кроликов иммунизируют подкожно шесть раз с интервалом в одну неделю 1 мл эмульсии за инъекцию. Кроликам дают шесть инъекций подкожно с интервалами в семь дней. Крось отбирают через 10 дней после последней иммунизации, и получают сыворотку. Антитела очищают из сыворотки следующим образом. Разводят сыворотку ЗФР в два раза. После добавления сульфата аммония при конечной концентрации 40% (м/о) сыворотку выстаивают при 4 Меченное пероксидазой из хрена антитело получают с использованием набора активированный имидом малеиновой кислоты пероксидазы из хрена ImmunoPure (Pierce, кат. 31494). Коротко, инкубируют 1 мкг ИгG с 80 мкг N-сукцинимидил-S-ацетил-тиоацетата в течение 30 мин. После деацетилирования 5 мг гидрохлорида гидроксиламина модифицированный ИгG отделяют с помощью полиакриламидной колонки для обессоливания. Белковый пул, смешанный с 1 мг активированной имидом малеиновой кислоты пероксидазы из хрена, инкубируют при комнатной температуре в течение 1 часа. II) Количественное определение OCIF методом двойного ИФА Титрационные микропланшеты (Nunc MaxiSorp Immunoplate) сенсибилизируют кроличьим анти-OCIF ИгG посредством инкубации 0,2 мкг в 100 мкл 50 мМ натрийбикарбонатного буфера, рН 9,6, при 4 ПРИМЕР 25 Моноклональное антитело против OCIF I) Получение гибридомы, продуцирующей моноклональное антитело против OCIF Очищают OCIF до однородного состояния из культуральной среды человеческих фибробластов IMR-90 с помощью метода очистки, описанного в примере 11. Очищенный OCIF растворяют в ЗФР при концентрации 10 мкг/100 мл. Мышей BALB/c иммунизируют путем введения этого раствора интраперитонеально три раза каждые две недели. При первой и второй иммунизациях вводят эмульсию, составленную из равных объемов OCIF и полного адъюванта Фрейнда. Через три дня после последней иммунизации извлекают селезенки, выделяют лимфоциты и сливают с клетками мышиной миеломы р3 II) Продуцирование моноклональных антител против OCIF Каждый гибридомный клон, секретирующий антитело против OCIF, который получают в примере 25-I, трансплантируют интраперитонеально мышам от Pristane (Aldrich) при плотности клеток 1 III) Отбор моноклонального антитела с высокой аффинностью к OCIF Каждое антитело, полученное в примере 25-II, растворяют в ЗФР, и определяют концентрацию белка в растворе методом Лоури. Готовят раствор каждого антитела той же концентрации, и затем разводят серийно ЗФР. Моноклональные антитела, которые могут распознать OCIF даже в сильно разведенном растворе, отбирают твердофазным ELISA, описанным в примере 25-II. Таким образом можно отобрать три моноклональных антитела – A1G5, Е3Н8 и D2F4. IV) Определение класса и подкласса антител Класс и подкласс антител настоящего изобретения, полученных в примере 25-III, анализируют с использованием набора для анализа класса и подкласса иммуноглобулинов (Amersham). Процедуру осуществляют по схеме, изложенной в указаниях. Результаты приводятся в табл.15. Антитела настоящего изобретения Е3Н8, A1G5 и D2F4 принадлежат к ИгG1, ИгG2a и ИгG2b соответственно. V) Определение OCIF с помощью ELISA Три вида моноклональных антител A1G5, ЕЗН8 и D2F4, которые получены в примере 25-IV, используют в качестве твердофазных антител и меченных ферментом антител соответственно. Конструируют двойной ELISA путем сочетания каждого твердофазного антитела и меченого антитела. Меченые антитела получают с использованием набора иммунночистой активированной имидом малеиновой кислоты пероксидазы из хрена (Pierce, кат. №31494). Каждое моноклональное антитело растворяют в 0,1 М NаНСO3 при концентрации 10 мкг/мл, и 100 мкл раствора добавляют в каждую лунку в 96-луночных иммунопланшетах (Nunc, MaxiSorp, кат. №442404), и затем выстаивают при комнатной температуре в течение ночи. После этого каждую лунку на планшетах блокируют 50% Blockace (Snow Brand Milk Products Co., Ltd.) при комнатной температуре в течение 50 минут, а затем промывают три раза ЗФР, содержащим 0,1% твина 20 (буфер для промывки). Ряд концентраций OCIF получают путем разведения OCIF буфером для 1-й реакции (0,2 М трис-HCl, рН 7,4, содержащий 40% Blockace и 0,1% твина 20). Каждую лунку 96-луночных иммунопланшетов наполняют 100 мкл приготовленного раствора -OCIF каждой концентрации, оставляют стоять при 37 С использованием трех видов моноклонального антитела в настоящем изобретении каждое сочетание антител в твердой фазе и меченных POD антител ведет к точному определению OCIF. Подтверждается, что каждое моноклональное антитело в настоящем изобретении узнает различный эпитоп OCIF. Типичная стандартная кривая OCIF при использовании сочетания твердофазного антитела A1G5 и меченного POD антитела ЕЗН8 показана на фиг.14. VI) Определение OCIF в человеческой сыворотке Концентрацию OCIF в пяти образцах сыворотки здоровых людей определяют с использованием системы ИФА, описанной в примере 25-V. Иммунопланшеты сенсибилизируют A1G5, как описано в примере 25-V, и в каждую лунку на иммунопланшетах добавляют 50 мкл буфера для 1-й реакции. Затем в каждую лунку в иммунопланшетах добавляют 50 мкл каждого образца человеческой сыворотки. Иммунопланшеты инкубируют при 37 Таким же способом обрабатывают буфер для 1-й реакции, содержащий известное количество OCIF, и получают стандартную кривую содержания OCIF, показанную на фиг.2. Определяют количество OCIF в образце человеческой сыворотки с использованием указанной стандартной кривой для OCIF. Результаты приводятся в табл.16. ПРИМЕР 26 Терапевтическое действие при остеопорозе (1) Метод Самцов крыс Fischer в возрасте 6 недель подвергают денервации левой передней конечности. Этих крыс распределяют по четырем группам (10 крыс на группу) и обрабатывают следующим образом: группа А – крысы с симулированной операцией без введения; группа Б – денервированные крысы с внутривенным введением наполнителя; группа В – денервированные крысы, которым внутривенно вводят OCIF при дозе 5 мкг/кг дважды в сутки; группа Г – денервированные крысы, которым внутривенно вводят OCIF при дозе 50 мкг/кг дважды в сутки. После денервации OCIF назначают ежедневно в течение 14 дней. После 2-недельной обработки животных умерщвляют, и отсекают их передние конечности. Затем кости испытывают на механическую прочность. (2) Результаты У животных в контрольных группах наблюдают снижение прочности костей по сравнению с животными нормальных групп, в то время как у животных в группах, получавших 50 мг OCIF на кг массы тела, прочность костей возрастает. Промышленная применимость Настоящее изобретение относится как к новому белку, который ингибирует образование остеокластов, так и к эффективному способу получения указанного белка, белок настоящего изобретения обладает активностью ингибирования образования остеокластов. Белок будет полезен для лечения многих заболеваний, сопровождающихся разрежением костей, таких как остеопороз, и будет полезен в качестве антигена, который применяется для иммунологической диагностики таких заболеваний. Справка о депонированном микроорганизме Название и адрес депозитного органа Название: National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology Ministry of International Trade and Industry Адрес: 1-3, Higashi 1-chome, Tsukuba-shi, Ibaraki-ken 305, Япония Дата депонирования: 21 июня 1995 (Передан из Bikkoken №Р-14998, который депонирован 21 июня 1995. Дата передачи: 25 октября 1995) Инвентарный номер: FERM BP-5267. Формула изобретения
1. Белок, способный ингибировать остеокластогенез (OCIF), характеризуемый следующими свойствами: (а) молекулярной массой при электрофорезе в полиакриламидном геле в присутствии ДСН (SDS-PAGE), составляющей приблизительно 60 кД в условиях восстановления, приблизительно 60 кД и 120 кД в невосстанавливающих условиях; (б) высокой аффинностью к катионообменной колонке и к колонке с гепарином; (в) биологической активностью ингибирования дифференцировки и/или созревания остеокластов, причем указанная активность снижается при нагревании при 70 2. Белок по п.1, кодируемый кДНК по п.3. 3. кДНК, кодирующая белок по п.1, которая включена в рекомбинантную плазмиду, полученную из трансформированной E.coli pBK/01F10 (FERM ВР-5267). 4. Способ получения белка по п.1, включающий конструирование вектора, содержащего кДНК по п.3, трансформирование указанным вектором подходящей клетки, культивирование указанной клетки и выделение указанного белка. 5. Способ по п.4, отличающийся тем, что клетка-хозяин является производной млекопитающего. 6. Способ по п.4, отличающийся тем, что в качестве клетки-хозяина используют клетку 293/EBNA или клетку СНО. 7. Способ лечения остеопороза, включающий введение нуждающемуся в этом субъекту белка по п.1. 8. Способ лечения/улучшения восстановления массы кости, включающий введение нуждающемуся в этом субъекту белка по п.1. 9. Способ лечения нарушения, связанного с костным метаболизмом, включающий введение нуждающемуся в этом субъекту белка по п.1. 10. Рекомбинантный белок OCIF, кодируемый кДНК по п.3, полученный способом по п.4. 11. Штамм E.coli pBK/01F10 (FERM ВР-5267), трансформированный вектором, несущим кДНК, кодирующую белок по п.1, при этом вектор способен экспрессировать указанный белок. 12. Фармацевтическая композиция для лечения остеопороза или нарушения, связанного с костным метаболизмом, или для лечения/улучшения восстановления массы кости, включающая эффективное количества белка по п.1 и фармацевтически приемлемый носитель. РИСУНКИ
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Адрес для переписки:
Извещение опубликовано: 20.04.2009 БИ: 11/2009
Дата прекращения действия патента: 20.03.2009
Извещение опубликовано: 10.06.2009 БИ: 16/2009
|
||||||||||||||||||||||||||

 -фактор роста (Chenu С. et al., Proc. Natl. Acad. Sci. USA, vol.85, p.5683, 1988) и интерлейкин-4 (Kasano К. et al., Bone-Miner., vol.21, p.179, 1993) ингибируют дифференцировку остеокластов. Обнаружено, что кальцитонин (Bone-Miner., vol.17, р.347, 1992), макрофагальный колониестимулирующий фактор (Hattersley G. et al.,. J. Cell. Physiol., vol.137, p.199, 1988), интерлейкин-4 (Watanabe, К. et al., Biochem. Biophys. Res. Commun., vol.172, p.1035, 1990) и
-фактор роста (Chenu С. et al., Proc. Natl. Acad. Sci. USA, vol.85, p.5683, 1988) и интерлейкин-4 (Kasano К. et al., Bone-Miner., vol.21, p.179, 1993) ингибируют дифференцировку остеокластов. Обнаружено, что кальцитонин (Bone-Miner., vol.17, р.347, 1992), макрофагальный колониестимулирующий фактор (Hattersley G. et al.,. J. Cell. Physiol., vol.137, p.199, 1988), интерлейкин-4 (Watanabe, К. et al., Biochem. Biophys. Res. Commun., vol.172, p.1035, 1990) и  -интерферон (Cowen M. et al., J. Bone-Miner. Res., vol.1, p.469, 1986) ингибируют резорбцию костей остеокластами.
-интерферон (Cowen M. et al., J. Bone-Miner. Res., vol.1, p.469, 1986) ингибируют резорбцию костей остеокластами. С или в течение 30 минут при 56
С или в течение 30 минут при 56 63-Аg8, p3-U1, NS-1, МРС-11, SP-2/0, F0, р3
63-Аg8, p3-U1, NS-1, МРС-11, SP-2/0, F0, р3 -МЕМ (минимальная поддерживающая среда) (изготовитель GIBCO BRL Co.), содержащей 10% FBS, 2
-МЕМ (минимальная поддерживающая среда) (изготовитель GIBCO BRL Co.), содержащей 10% FBS, 2


 ZAP EXPRESS (Stratagene) в сайт EcoRI. ДНК рекомбинантного
ZAP EXPRESS (Stratagene) в сайт EcoRI. ДНК рекомбинантного