Патент на изобретение №2238758
|
||||||||||||||||||||||||||
(54) ВОДНЫЙ РАСТВОР ИНТЕРФЕРОНА-АЛЬФА-ДВА ЧЕЛОВЕКА ДЛЯ ИНЪЕКЦИЙ
(57) Реферат:
Изобретение относится к биотехнологии и предназначено для использования в фармацевтической промышленности для производства стабильного водного раствора генно-инженерного интерферона-альфа-два, не содержащего альбумин, для инъекций, необходимого для лечения различных вирусных и онкологических заболеваний. Водный раствор интерферона-альфа-два человека для инъекций содержит буфер для поддержания рН раствора 4,5-7,0, неионогенный детергент, консервант, обладающий антимикробной активностью, агент, обеспечивающий изотоничность раствора, воду для инъекций и дополнительно содержит окисленный глутатион и/или лимонную кислоту для предотвращения потери активности интерферона. Технический результат: способ обеспечивает получение раствора интерферона-альфа-два для инъекций, стабильного в стандартных условиях хранения (5 Предлагаемое техническое решение относится к биотехнологии и предназначено для использования в фармацевтической промышленности для производства стабильного водного раствора генно-инженерного интерферона-альфа-два (ИФН альфа-2), не содержащего альбумин, для инъекций, необходимого для лечения различных вирусных и онкологических заболеваний. Интерферон является высокоактивным белком, единичная терапевтическая доза интерферона составляет десятки микрограммов. Такие разбавленные белковые растворы быстро теряют свою биологическую активность, легко инактивируются различными факторами окружающей среды, такими как температура, кислород воздуха, наличие тяжелых металлов, физические воздействия. Для того чтобы обеспечить оптимальные потребительские свойства, ингредиенты раствора интерферона должны быть тщательно отобраны из множества потенциально пригодных агентов и хорошо сочетаться друг с другом. Выбор буферной системы и бактериостатика имеет большое значение для сохранения стабильности и активности белка и во многом определяет сохранность препарата. Потерю активности можно предотвратить, если добавить в водный раствор белка различные стабилизирующие агенты. В настоящее время в России производится сухая лекарственная форма рекомбинантного интерферона-альфа-два – “реаферон-ЕС”, содержащая в своем составе сывороточный альбумин человека (HSA) [1]. Однако это связано с проблемами опасности вирусного заражения и аллергенности для лиц с повышенной чувствительностью к препаратам белков крови, что в свою очередь может привести к образованию антител. Известны водные растворы интерферона, в которых не используется HSA. Например, водный раствор интерферона-альфа, содержащий в качестве буферной системы ацетат аммония со значением рН, отличающимся более чем на одну единицу от изоэлектрической точки белка, неионогенный детергент и в некоторых случаях стабилизатор, не содержащий в своем составе консервантов [2]. Однако исключение из состава препарата консерванта в условиях крупномасштабного производства требует дополнительных мер по обеспечению стерильности препарата и не может полностью гарантировать исключения опасности бактериального заражения белковых растворов. Кроме того, отсутствие в технологии получения продувки инертными газами может приводить к снижению стабильности белка при хранении вследствие его окисления кислородом воздуха. Также известен раствор интерферона-альфа для инъекций, содержащий буферную систему, поддерживающую значение рН раствора в интервале 4,5-7,1, хелатообразователь, неионогенный детергент (твин – 80 или твин – 20) в количестве, необходимом для стабилизации интерферона-альфа и предотвращения потери его активности, агент, обеспечивающий изотоничность раствора, консервант, обладающий антимикробной активностью, и воду для инъекций, при этом он содержит (0,1-100,0) В качестве буферной системы предлагаемый раствор предпочтительно содержит двузамещенный фосфат натрия и монозамещенный фосфат натрия, в качестве хелатообразователя содержит динатрий ЭДТА или лимонную кислоту, в качестве агента, обеспечивающего изотоничность – натрия хлорид, а в качестве консерванта – вещество, выбранное из группы, включающей метакрезол, фенол, метилпарабен, пропилпарабен или их смеси. В качестве интерферона предлагаемый водный раствор содержит интерферон-альфа-два [3]. Наиболее близким к предложенному техническому решению (прототип) является водный раствор интерферона, содержащий интерферон-альфа, с буферной системой – ацетат аммония или лактат натрия, рН 4,5-5,5, содержащий неионогенный детергент и бензиловый спирт в качестве консерванта [4]. В растворах интерферона-альфа-два [3, 4], содержащих от 3 Однако при хранении препарата при повышенной температуре (25, 35 Повысить термостабильность водных растворов удается при получении их препарата в условиях “практически полного отсутствия растворенного кислорода”, а также внесением в разбавленный белковый раствор дополнительных ингредиентов, предотвращающих деструктивные процессы и способствующих сохранению биологически активной нативной структуры белка. Техническим результатом предлагаемого изобретения является получение водного раствора высокоочищенного интерферона-альфа-два для инъекций, стабильного в стандартных условиях хранения и при хранении в условиях повышенной температуры. Указанный технический результат достигается тем, что в водный раствор интерферона для инъекций, содержащий буфер для поддержания рН раствора 4,5-7,0, неионогенный детергент, консервант, обладающий антимикробной активностью, агент, обеспечивающий изотоничность раствора, воду для инъекций, дополнительно содержит окисленный глутатион и/или лимонную кислоту, при следующем соотношении компонентов на 1 мл: Интерферона-альфа-два ME, (1-36) Неионогенный детергент, мг 0,01-1,0 Буфер для поддержания рН 4,5-7,0, mM 10,0-25,0 Консервант, мг 0,06-20,0 Окисленый глутатион, мг 0,01-0,1 Или лимонная кислота 0,8-2,0 Или окисленный глутатион 0,01-0,1 И лимонная кислота 0,8-2,0 Агент, обеспечивающий изотоничность раствора: В количестве, достачном для придания изотоничности раствору Вода для инъекций, мл До 1,0 Водный раствор интерферона содержит высокоочищенный рекомбинантный интерферон-альфа-два из телец включения штамма Е. coli SG 20050 рIF16 в количестве (1-36) В качестве буферной системы для поддержания рН 4,5-7,0 водный раствор интерферона содержит фосфатный буфер в концентрации 10-25 mM или буфер – натрий фосфат двузамещенный- лимонная кислота в концентрации 10-25 mM. В качестве консерванта водный раствор интерферона содержит метилпарабен в концентрации 0,6-1,8 мг/мл либо смесь метилпарабен в концентрации 0,6-1,8 мг/мл и пропилпарабен в концентрации 0,06-0,18 мг/мл, либо метакрезол в концентрации 0,5-2,0 мг/мл, либо бензиловый спирт в концентрации 8,0-20,0 мг/мл. В качестве неионогенного детергента он содержит твин-80 или твин-20 в количестве 0,01-1,0 мг/мл. В качестве агента, обеспечивающего изотоничность, предлагаемый раствор содержит натрий хлорид или глицин. Количество данного агента зависит от композиции раствора и в случае натрия хлористого находится в пределах 1-10 мг/мл. В качестве хелатообразователя содержит динатриевую соль ЭДТА в количестве 0,01-1,0 мг/мл, в случае применения фосфатной буферной системы либо лимонную кислоту в составе буфера – натрий фосфат двузамещенный – лимонная кислота в концентрации 0,8-2,0 мг/мл. В качестве стабилизирующей добавки вводят окисленный глутатион в концентрации 0,01-0,1 мг/мл, являющийся регулятором природного метаболизма клетки, и/или лимонную кислоту в концентрации 0,8-2,0 мг/мл. Добавка окисленного глутатиона – естественного метаболита клетки – способствует защите интерферона от значительной деструкции и предотвращает потери интерферона при хранении. Окисленный глутатион, подвергаясь деструкции одновременно с интерфероном, тем самым выступает в роли защитного агента. Кроме того, окисленный глутатион предотвращает восстановление цистинов, препятствует возникновению случайных дисульфидных связей, приводящих к образованию неактивных мономеров и олигомеров. Установлено также, что окисленный глутатион является стимулятором эндогенной продукции цитокинов и гемопоэтических факторов, и использование его в качестве фармацевтического препарата позволяет добиться существенного терапевтического эффекта у людей, страдающих онкологическими и инфекционными заболеваниями. Такая вспомогательная добавка, не нарушающая стабильность композиции, не только обладает свойством “защитного” агента для молекулы интерферона, но и является иммунокорректором, поэтому введение такой добавки целесообразно с позиции современной медицины [5]. В качестве стабилизирующей добавки вводят лимонную кислоту, которая является важным продуктом обмена в живых организмах, участвует в цикле трикарбоновых кислот и глиоксилатном цикле. Лимонная кислота и ее соли находят широкое применение в качестве компонентов многих лекарственных средств, в том числе инъекционных. В составе препарата лимонная кислота находит применение не только в качестве составной части изотонического буферного раствора, но и как антиоксидант и хелатообразователь. Благодаря последнему свойству могут быть исключены другие хелатообразователи, например динатриевая соль ЭДТА, поскольку применение последней требует осторожности из-за ее возможного влияния на физиологические процессы. Изобретение иллюстрируется следующими примерами конкретного исполнения. Процедура получения водного раствора интерферона-альфа-два Растворы интерферона разного состава получают в асептических условиях в ламинар-боксе. В стеклянный мерный сосуд загружают навески компонентов, за исключением твина и глутатиона. Растворяют при интенсивном перемешивании в воде для инъекций (2/3 от объема раствора). Полученный раствор продувают аргоном. После чего добавляют твин и глутатион. Раствор перемешивают и добавляют расчетный объем раствора интерферона. Вновь осторожно перемешивают и доводят объем раствора до конечного значения водой для инъекций, раствор фильтруют с использованием фильтра с размером пор 0,22 мкм и разливают в предварительно продутые аргоном стеклянные флаконы или ампулы. Пример 1 Водный раствор интерферона-альфа-два в натрий-фосфатном буфере с использованием окисленного глутатиона в концентрации 0,03 мг/мл и метилпарабена в качестве консерванта готовят аналогично процедуре получения в следующем соотношении на 1 мл: Интерферон-альфа-два, ME 4,0 Натрий фосфорнокислый двузамещенный двенадцативодный, мг 4,5 Натрий фосфорнокислый однозамещенный двуводный, мг 1,5 Динатриевая соль ЭДТА, мг 0,1 Твин – 80, мг 0,1 Метилпарабен, мг 1,2 Окисленный глутатион, мг 0,03 Натрия хлорид, мг 7,5 Вода, мл До 1,0 Пример 2 Водный раствор интерферона-альфа-два в натрий-фосфатном буфере с использованием окисленного глутатиона в концентрации 0,1 мг/мл и метилпарабена в качестве консерванта готовят аналогично процедуре получения в следующем соотношении на 1 мл: Интерферон-альфа-два, ME 6,0 Натрий фосфорнокислый двузамещенный двенадцативодный, мг 4,5 Натрий фосфорнокислый однозамещенный двуводный, мг 1,5 Динатриевая соль ЭДТА, мг 0,1 Твин-80, мг 0,1 Метилпарабен 1,5 Окисленный глутатион, мг 0,1 Натрия хлорид, мг 7,5 Вода, мл До 1,0 Пример 3 Водный раствор интерферона-альфа-два на основе буфера натрий фосфат двузамещенный-лимонная кислота с концентрацией лимонной кислоты 1,0 мг/мл и метилпарабеном в качестве консерванта готовят аналогично процедуре получения в следующем соотношении на 1 мл: Интерферон-альфа-два, ME 4,0 Натрий фосфорнокислый двузамещенный двенадцативодный, мг 8,3 Кислота лимонная одноводная, мг 1,0 Натрия хлорид, мг 6,2 Твин-80, мг 0,1 Метилпарабен, мг 1,2 Вода, мл До 1,0 Пример 4 Водный раствор интерферона-альфа-два на основе буфера – натрий фосфат двузамещенный-лимонная кислота с концентрацией лимонной кислоты 1,5 мг/мл и метилпарабеном в качестве консерванта готовят аналогично процедуре получения в следующем соотношении на 1 мл: Интерферон-альфа-два, ME 4,0 Натрий фосфорнокислый двузамещенный двенадцативодный, мг 8,5 Кислота лимонная одноводная, мг 1,5 Натрия хлорид, мг 6,1 Твин – 80, мг 0,1 Метилпарабен, мг 1,5 Вода, мл До 1,0 Пример 5 Водный раствор интерферона-ильфа-два на основе буфера – натрий фосфат двузамещенный-лимонная кислота с концентрацией лимонной кислоты 1,5 мг/мл и бензиловым спиртом в качестве консерванта готовят аналогично процедуре получения в следующем соотношении на 1 мл: Интерферон-альфа-два, ME 4,0 Натрий фосфорнокислый двузамещенный двенадцативодный, мг 8,5 Кислота лимонная одноводная, мг 1,5 Натрия хлорид, мг 6,1 Твин-80, мг 0,1 Бензиловый спирт, мг 10,0 Вода, мл До 1,0 Пример 6 Водный раствор интерферона-альфа-два на основе буфера – натрий фосфат двузамещенный-лимонная кислота с концентрацией лимонной кислоты 1,5 мг/мл, с использованием окисленного глутатиона в концентрации 0,1 мг/мл и бензилового спирта в качестве консерванта готовят аналогично процедуре получения в следующем соотношении на 1 мл: Интерферон-альфа-два, ME 4,0 Натрий фосфорнокислый двузамещенный двенадцативодный, мг 8,5 Кислота лимонная одноводная, мг 1,5 Твин-80, мг 0,1 Натрия хлорид, мг 6,1 Окисленный глутатион, мг 0,1 Бензиловый спирт, мг 10,0 Вода, мл До 1,0 Пример 7 Водный раствор интерферона-альфа-два на основе буфера – натрий фосфат двузамещенный-лимонная кислота с концентрацией лимонной кислоты 1,3 мг/мл, с использованием окисленного глутатиона в концентрации 0,03 мг/мл и метилпарабена в качестве консерванта готовят аналогично процедуре получения в следующем соотношении на 1 мл: Интерферон-альфа-два, ME 4,0 Натрий фосфорнокислый двузамещенный двенадцативодный, мг 8,5 Кислота лимонная одноводная, мг 1,3 Твин-80, мг 0,1 Натрия хлорид, мг 6,1 Окисленный глутатион, мг 0,03 Метилпарабен, мг 1,2 Вода, мл До 1,0 Пример 8 Водный раствор интерферона-альфа-два в натрий – фосфатном буфере с использованием метакрезола в качестве консерванта готовят аналогично процедуре получения в следующем соотношении на 1 мл: Интерферон-альфа-два, ME 4,0 Натрий фосфорнокислый двузамещенный двенадцативодный, мг 4,5 Натрий фосфорнокислый однозамещенный двуводный, мг 1,5 Динатриевая соль ЭДТА, мг 0,1 Твин-80, мг 0,1 Натрия хлорид, мг 7,5 Метакрезол, мг 1,5 Вода, мл До 1,0 Пример 9 Водный раствор интерферона-альфа-два в аммоний-ацетатном буфере, рН 5,0, с использованием бензилового спирта в качестве консерванта, не содержащий вспомогательные ингредиенты, готовят аналогично процедуре получения, без добавления глутатиона, в следующем соотношении на 1 мл: Интерферон-альфа-два, ME 4,0 Ацетат аммония, мг 0,77 Твин – 80, мг 0,2 Бензиловый спирт, мг 10,0 Натрия хлорид, мг 7,2 Вода для инъекций, мл До 1,0 Результаты стабильности растворов хранения при различных температурах приведены в таблице. Полученные при выполнении данного технического решения стабилизированные водные растворы интерферона-альфа-два хранились в ампулах или в стерилизованных флаконах из стекла для лекарственных средств, укупоренных резиновыми пробками и алюминиевыми колпачками. Водные растворы интерферона-альфа, содержащие добавки (примеры 1-7). стерильны, нетоксичны на культуре клеток легкого эмбриона человека Л-68 и в экспериментах на животных (белые мыши, морские свинки). Вызывают незначительное (не более 2 По результатам испытаний на культуре клеток и животных можно сделать заключение о возможности использования предлагаемых водных растворов в качестве инъекционных лекарственных препаратов для лечения вирусных и онкологических заболеваний человека. Данные по биологической активности и физико-химической стабильности интерферона-альфа-два в водных растворах после хранения при различных температурах (5, 25, 35 Для контроля in vitro биологической (антивирусной) активности водных растворов интерферона-альфа-два, полученных, как указано в примерах 1-7, используют метод подавления цитопатогенного действия вируса энцефаломиокардита мышей в культуре клеток легкого эмбриона человека Л-68, выращенной в монослое в 96-луночных микропланшетах. Содержание интерферона в растворах (в %) определяют методом высокоэффективной жидкостной хроматографии на колонке с обращенной фазой (ВЖХ), иммуноферментным анализом (ИФА) с использованием компонентов производства 000 “Протеиновый контур” (г.Санкт-Петербург) и электрофорезом в полиакриламидном геле с додецилсульфатом натрия (ПААГ-ДСН) с денситометрированием. Водный раствор интерферона, не содержащий стабилизирующих добавок, имеющих рН 6,0-7,0 и полученный по аналогии с изобретением [3] (пример 8), сохраняет приемлемую стабильность при хранении при температуре 5 Введение в качестве защитной добавки окисленного глутатиона в концентрации 0,01-0,10 мг/мл (примеры 1, 2, 6, 7) приводит к увеличению стабильности интерферона при хранении его водных растворов как при температуре 5 Повышение стабильности растворов интерферона наблюдается также при использовании в качестве дополнительного ингредиента лимонной кислоты. Введение лимонной кислоты (в концентрации: 1,0; 1,3; 1,5; мг/мл) в состав буфера для поддержания рН повышает стабильность препарата при различных температурах хранения (примеры 3, 4, 7, 5), исключает необходимость использования других хелатообразователей, позволяет использовать широкий спектр бактериостатиков – бензилового спирта, метил- и пропилпарабенов, метакрезола и т.д. Добавление лимонной кислоты препятствует окислению метакрезола, сохраняя раствор интерферона бесцветным, в то время как при хранении некоторых растворов, содержащих метакрезол и не содержащих лимонную кислоту, постепенно растворы приобретали окрашивание, особенно при повышенных температурах. На основании анализа полученных экспериментальных данных можно заключить, что в водных растворах интерферона-альфа-два, содержащих в качестве защитных добавок как окисленный глутатион, так и лимонную кислоту, в стандартных условиях хранения лекарственных препаратов (5 Таким образом, введение дополнительных ингредиентов исключает значительные потери интерферона при наиболее употребляемых в терапевтической практике дозах (3,0 Повышенная термостабильность водных растворов интерферона-альфа-два, полученных по данному техническому решению, обеспечивает получение инъекционной лекарственной формы интерферона с увеличенным сроком годности препарата. Помимо этого, введение глутатиона, известного как иммуномодулятор [5], в состав лекарственного препарата может иметь клинически значимый эффект при лечении вирусных и онкологических заболеваний. ЛИТЕРАТУРА 1. ФСП 42-0241-1184-01. Реаферон-ЕС, порошок для приготовления инъекционных растворов. 2. Патент РФ №2180233, А 61 К 38/00, Бюл. №7, опубл. 10.03.2002. 3. Патент РФ №2157236, А 61 К 38/21, Бюл. №28, опубл. 10.10.2000. 4. Патент РФ №2113845, А 61 К 9/08, Бюл. №18, опубл. 27.06.1998. 5. Патент РФ №2089179, А 61 К 9/08, Бюл. №25, опубл. 10.09.1997. Формула изобретения
1. Водный раствор интерферона для инъекций, содержащий высокоочищенный рекомбинантный интерферона-альфа-два (1-36) Интерферона-альфа-два ME, (1-36) Неионогенный детергент, мг 0,01-1,0 Буфер для поддержания рН 4,5-7,0, мM 10,0-25,0 Консервант, мг 0,06-20,0 Окисленный глутатион, мг, или 0,01-0,1 Лимонная кислота 0,8-2,0 или Окисленный глутатион и 0,01-0,1 Лимонная кислота 0,8-2,0 Агент, обеспечивающий изотоничность раствора В количестве, достаточном для придания изотоничности раствору Вода для инъекций, мл До 1,0 2. Водный раствор по п.1, отличающийся тем, что в качестве буферной системы для поддержания рН 4,5-7,0 содержит фосфатный буфер в концентрации 10-25 мM или буфер двузамещенный фосфат натрия-лимонная кислота в концентрации 10-25 мM. 3. Водный раствор по п.1, отличающийся тем, что в качестве консерванта содержит метилпарабен в концентрации 0,6-1,8 мг/мл, либо смесь метилпарабена в концентрации 0,6-1,8 мг/мл и пропилпарабена в концентрации 0,06-0,18 мг/мл, либо метакрезол в концентрации 0,5-2,0 мг/мл, либо бензиловый спирт 8,0-20,0 мг/мл. PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
(73) Патентообладатель(и):
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 21.12.2005 № РД0005092
Извещение опубликовано: 20.02.2006 БИ: 05/2006
QB4A Регистрация лицензионного договора на использование изобретения
Лицензиар(ы): Таргонский Сергей Николаевич
Лицензиат(ы): Закрытое акционерное общество “ВЕКТОР-МЕДИКА”
Договор № РД0013232 зарегистрирован 17.10.2006
Извещение опубликовано: 27.11.2006 БИ: 33/2006
* ИЛ – исключительная лицензия НИЛ – неисключительная лицензия
QZ4A – Регистрация изменений (дополнений) лицензионного договора на использование изобретения
Лицензиар(ы): Таргонский Сергей Николаевич
Лицензиат(ы): Закрытое акционерное общество “ВЕКТОР-МЕДИКА”
Характер внесенных изменений (дополнений):
Дата и номер государственной регистрации договора, в который внесены изменения:
Извещение опубликовано: 27.04.2008 БИ: 12/2008
* ИЛ – исключительная лицензия НИЛ – неисключительная лицензия
QZ4A – Регистрация изменений (дополнений) лицензионного договора на использование изобретения
Лицензиар(ы): Таргонский Сергей Николаевич
Лицензиат(ы): Закрытое акционерное общество “ВЕКТОР-МЕДИКА”
Характер внесенных изменений (дополнений):
Дата и номер государственной регистрации договора, в который внесены изменения:
Извещение опубликовано: 20.12.2009 БИ: 35/2009
* ИЛ – исключительная лицензия НИЛ – неисключительная лицензия
|
||||||||||||||||||||||||||

 С) и при хранении в условиях повышенной температуры (25, 35
С) и при хранении в условиях повышенной температуры (25, 35 106 МЕ/мл интерферона-альфа.
106 МЕ/мл интерферона-альфа.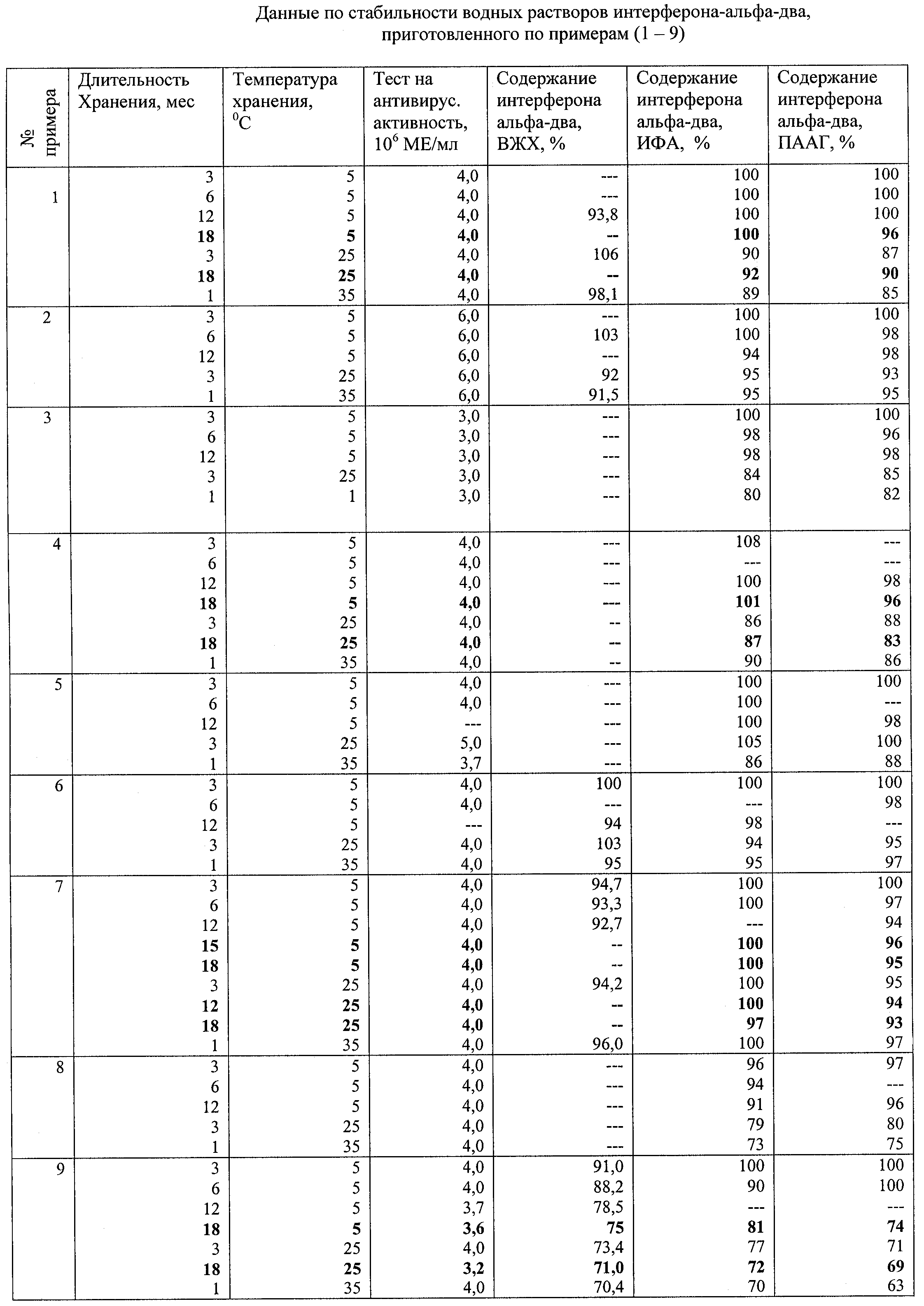
 РД0013232 продлен до 17.10.2012
РД0013232 продлен до 17.10.2012