Патент на изобретение №2238269
|
||||||||||||||||||||||||||
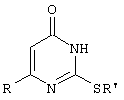
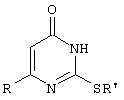
(54) СПОСОБ ПОЛУЧЕНИЯ 6-ЗАМЕЩЕННЫХ 2-(АЛКИЛСУЛЬФАНИЛ)-4(3Н)-ПИРИМИДИНОНОВ
(57) Реферат:
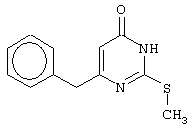
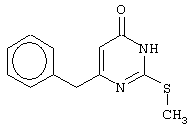
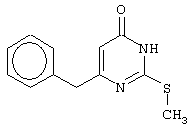
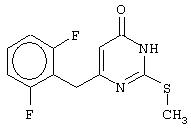
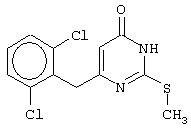
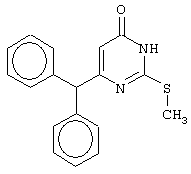
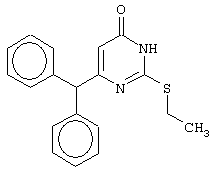
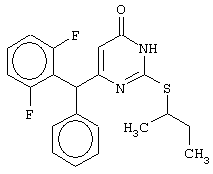
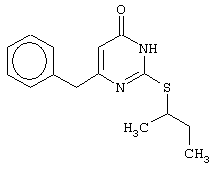
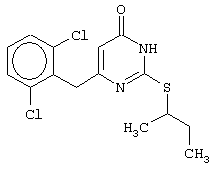
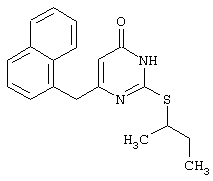
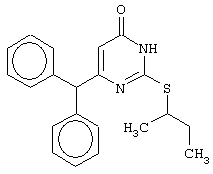
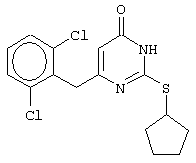
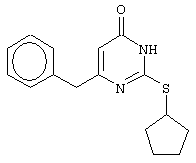
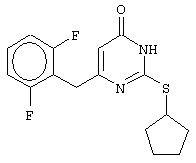
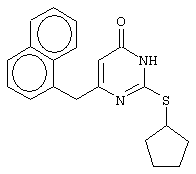
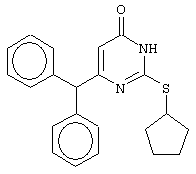
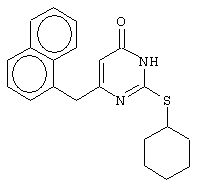
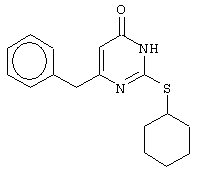
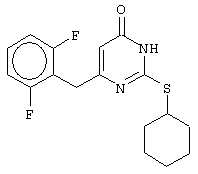
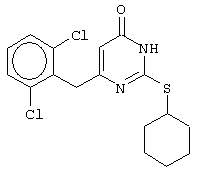
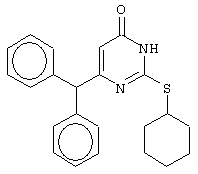
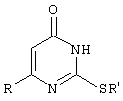
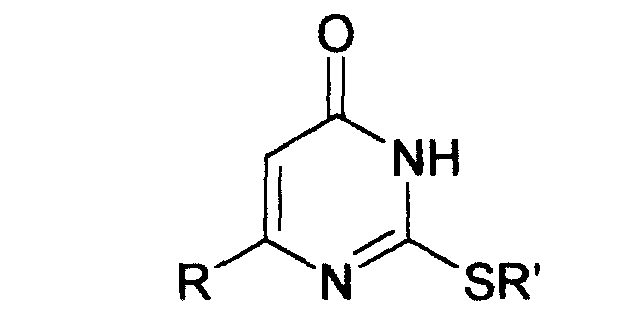
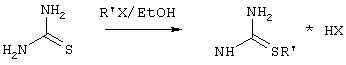
Изобретение относится к способу получения 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона общей формулы (I), которые находят применение как полупродукты для синтеза лекарственных препаратов и как самостоятельные лекарственные препараты. В соединениях формулы (I) R=С6Н5СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11, R=2,6-F2С6Н3СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11, R=2,6-Cl2С6Н3СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11, R=1-С10Н7СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11, R=Ph2CH, R’=СН3, С2Н5, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11. Способ заключается в том, что S-алкилизотиомочевины гидрогалогенид, выбранный из группы: S-метилизотиомочевины гидроиодид, S-этилизотиомочевины гидробромид, S-втор-бутилизотиомочевины гидробромид, S-цикло-пентилизотиомочевины гидробромид или S-циклогексилизотиомочевины гидробромид, полученный непосредственно внутри реактора (in situ) из тиомочевины и соответствующего галогеналкана или втор-бутанола или циклоалканола в присутствии бромистоводородной кислоты, подвергают взаимодействию в присутствии водного раствора калия карбоната с раствором в этаноле метилового эфира 4-арил-3-оксобутановой кислоты или метилового эфира 4,4-диарил-3-оксобутановой кислоты, выбранных из ряда: метиловый эфир 4-фенил-3-оксобутановой, метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой, метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой, метиловый эфир 4-(1-нафтил)-3-оксобутановой и метиловый эфир 4,4-дифенил-3-оксобутановой кислот, при мольном соотношении метиловый эфир 4-арил-3-оксобутановой кислоты или метиловый эфир 4,4-диарил-3-оксобутановой кислоты : S-алкилизотиомочевины гидрогалогенид : калия карбонат, равном 1:1-3:1-3, с последующим выделением целевого продукта. Техническим результатом является повышение выхода заявляемых соединений, упрощение процесса получения и выделения конечных продуктов. Изобретение относится к области синтеза гетероциклических соединений, конкретно к способу получения 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона формулы где R=С6Н5СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11, R=2,6-F2С6Н3СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11, R=2,6-С12С6Н3СН2, R’=СН3, СH(СН3)C2Н5, цикло-С5H9, цикло-С6H11, R=1-С10Н7СН2, R’=СН(СН3)С2Н5, цикло-С5Н9, цикло-С6Н11, R=Ph2CH, R’=СН3, С2Н5, СН(СН3)С2Н5, цикло-С5Н9, цикло-С6H11, которые находят применение как противовирусные пролекарственные препараты. Недостатком данных методов является необходимость использования пожаро- и взрывоопасных дорогостоящих реагентов, а также абсолютных растворителей. Недостатком данных методов является низкий выход продуктов алкилирования и узкий спектр производных 6-замещенного 2-(алкилсульфанил)-4(3H)-пиримидинона, которые могут быть получены этими методами. Общим недостатком методов получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов является необходимость предварительного получения соответствующих 6-замещенных производных 2-тиоурацила, которые, в свою очередь, получаются из Известен способ получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов путем конденсации гидробромида S-этилизотиомочевины и Данный способ, несмотря на свою относительную простоту и экономичность не дает удовлетворительного выхода конечных продуктов в случае Наиболее близким является способ получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов прямой конденсацией S-метилизотиомочевины гидроиодида и Этот способ не дает удовлетворительного выхода и уровня чистоты конечных продуктов и применим лишь для получения узкого спектра 6-замещенных 2-(метилсульфанил)-4(3H)-пиримидинонов. Так, по данному способу 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинон был получен с выходом 32% и температурой плавления 178-180 Недостатком данного способа является необходимость предварительного получения и выделения в чистом виде S-алкилизотиомочевины гидрогалогенидов. Задачей предлагаемого технического решения является разработка нового технологичного способа получения практически любых 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов, позволяющего проводить синтез в одну стадию в мягких условиях с использованием дешевых исходных соединений, позволяющего получать 6-замещенные 2-(алкилсульфанил)-4(3H)-пиримидиноны с высоким выходом и высокой степенью чистоты. Техническим результатом является повышение выхода заявляемых соединений, упрощение процесса получения и выделения конечных продуктов. Предлагаемый технический результат достигается в способе получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов общей формулы где R=С6Н5СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11, R=2,6-F2С6Н3СН2, R’=СН3, СH(СН3)C2H5, цикло-С5H9, цикло-С6H11, R=2,6-Сl2С6Н3СН2, R’=СН3, СH(СН3)C2H5, цикло-С5Н9, цикло-С6H11, R=1-С10Н7СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11,R=Рh2СН, R’=СН3, С2Н5, СH(СН3)С2H5, цикло-С5Н9, цикло-С6H11, с использованием реакции S-алкилизотиомочевппы гидрогалогенида, в основной среде, c последующим выделением целевого продукта, причем используют S-алкилизотиомочевины гидрогалогенид, выбранный из S-метилизотиомочевины гидроиодида, S-этилизотиомочевины гидробромида, S-втор-бутилизотиомочевины гидробромида, S-циклопентилизотиомочевины гидробромида или S-циклогексилизотиомочевины гидробромида, полученный in situ из тиомочевины и соответствующего галогеналкана или втор-бутанола или циклоалканола в присутствии бромистоводородной кислоты, подвергают взаимодействию в присутствии водного pacтвopa калия карбоната с раствором в этаноле метилового эфира 4-арил-3-оксобутановой кислоты или метилового эфира 4,4-диарил-3-оксобутановой кислоты, выбранных из ряда: метиловый эфир 4-фенил-3-оксобутановой, метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой, метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановый, метиловый эфир 4-(1-нафтил)-3-оксобутановой и метиловый эфир 4,4-дифенил-3-оксобутановой кислот, при мольном соотношении метиловый эфир 4-арил-3-оксобутановой кислоты или метиловый эфир 4,4-диарил-3-оксобутановой кислоты : S-алкилизотиомочевины гидрогалогенид : калия карбонат, равном 1:1-3:1-3. Сущностью предлагаемого способа является конденсация метиловых эфиров 4-арил-3-оксобутановой кислоты или 4,4-диарил-3-оксобутановой кислоты с генерированной in situ S-алкилизотиомочевиной с образованием целевого 6-замещенного производного 2-(aлкилсульфaнил)-4(3H)-пиpидинона: где R=С6Н5СН2, R’=СН3, СН(СН3)С2Н5, цикло-C5H9 цикло-C6H11, R=2,6-F2С6Н3СН2, R’=СН3, СH(СН3)C2Н5, цикло-С5Н9, цикло-С6Н11, R=2,6-Сl2С6Н3СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11, R=1-С10Н7СН2, R’=СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11, R=Ph2CH, R’=СН3, С2Н5, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11, Х=Br, I Производные S-алкилизотиомочевины, содержащие первичный алкильный фрагмент при атоме серы получаются по реакции соответствующего галогеналкана (иодметана или бромэтана) с тиомочевиной в 95%-ном этаноле [Беккер X. Органикум / Беккер X., Домшке Г., Фангхенель Э. и др.: Пер. с нем. – В 2 т. – М.: Мир, 1992 – Т.2 – 474 с., ил.], которые в заявляемом способе получают непосредственно внутри реактора и используются без дополнительного выделения и очистки: где R’=СН3, С2Н5; Х=Br, I где R’=СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11 В предлагаемом способе повышение выхода целевых продуктов достигается за счет проведения реакции в гомофазной среде (водно-спиртовой раствор), а также применения в качестве основания калия карбоната, а не калия гидроксида. Известно, что последний в большей степени, чем калия карбонат, способствует разложению производных S-алкилизотиомочевины до соответствующих алкилмеркаптанов и дициандиамида [Вейганд-Хильгетаг. Методы эксперимента в органической химии: Пер. с нем. – М.: Химия, 1968 – 944 с., ил.], снижая тем самым выход целевого 6-замещенного 2-(алкилсульфанил)-4(3H)-пиримидина. Необходимость применения избытка S-алкилизотиомочевины гидрогалогенида обусловлена невысокой стабильностью свободных S-алкилизотиомочевин и их склонностью к разложению. Таким образом, для достижения наиболее полной конверсии исходного метилового эфира 4-арил-3-оксобутановой кислоты или метилового эфира 4,4-диарил-3-оксобутановой кислоты в целевой 6-замещенный 2-(алкилсульфанил)-4(3H)-пиримидинон необходимо применение неэквимолярного количества S-алкилизотиомочевины гидрогалогенида. Преимуществом данного способа является возможность получения практически любых 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона, многие из которых находят применение как противовирусные лекарственные вещества, в одну стадию с хорошим выходом с использованием доступных реагентов, а также препаративная простота синтеза и легкость выделения чистых продуктов реакции. Предлагаемый способ осуществляется следующим образом. Получение 6-замещенных 2-(н-алкилсульфанил)-4(3H)-пиримидинонов. В реактор, снабженный обратным холодильником и механической мешалкой, помещают 3.81 г (50 ммоль) тиомочевины, 25 мл 95%-ного этанола и 50 ммоль н-галогеналкана. Полученная смесь кипятится при перемешивании 0.5-3 часа и оставляется на 18 часов при комнатной температуре. К реакционной смеси прибавляется раствор калия карбоната (6.91 г, 50 ммоль) в воде (25 мл) и раствор 25 ммоль метилового эфира 4-арил-3-оксобутановой кислоты или 4,4-диарил-3-оксобутановой кислоты в 15 мл 95%-ного этанола. Полученная смесь перемешивается 72-144 часа при комнатной температуре, нейтрализуется 1N раствором соляной кислоты (50 мл) и фильтруется. Осадок на фильтре промывается водой (100 мл) и сушится на воздухе до постоянной массы. После кристаллизации из бензола, 95%-ного этанола или ацетонитрила получается чистый продукт. Получение 6-замещенных 2-(втор-алкилсульфанил)-4(3H)-пиримидинонов и 6-замещенных 2-(циклоалкилсульфанил)-4(3H)-пиримидинонов. В реактор, снабженный механической мешалкой, внутренним термометром и обратным холодильником помещают 3.81 грамма (50 ммоль) тиомочевины, 50 ммоль втор-алканола или циклоалканола и 17.15 мл (25.50 грамм, 150 ммоль) 48%-ной бромистоводородной кислоты. Полученная смесь кипятится при перемешивании в течение 9 часов, а затем охлаждается до 0-5 Полученная смесь интенсивно перемешивается при комнатной температуре в течение 96-144 часа, нейтрализуется IN бромистоводородной кислотой (150 мл) и фильтруется. Осадок на фильтре промывается водой (100 мл), сушится на воздухе до постоянной массы и кристаллизуется из подходящего растворителя. При выделении продукта в виде масла реакционная масса извлекается этилацетатом (3 Изобретение иллюстрируется следующими примерами Пример 1 Синтез 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона В реактор, снабженный обратным холодильником и механической мешалкой, помещают 3.81 грамма (50 ммоль) тиомочевины, 25 мл 95%-ного этанола и 3.12 мл (7.10 г, 50 ммоль) иодметана. Полученная смесь кипятится при перемешивании 0.5 часа и оставляется на 18 часов при комнатной температуре. К реакционной смеси прибавляется раствор калия карбоната (6.91 г, 50 ммоль) в воде (25 мл) и раствор 4.81 г (25 ммоль) метилового эфира 4-фенил-3-оксобутановой кислоты в 15 мл 95%-ного этанола. Соотношение метиловый эфир 4-фенил-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:2:2. Полученная смесь перемешивается 72 часа при комнатной температуре, нейтрализуется 1N раствором соляной кислоты (50 мл) и фильтруется. Осадок на фильтре промывается водой (100 мл) и сушится на воздухе до постоянной массы. После кристаллизации из бензола получается чистый продукт с выходом 4.53 г (78% от теоретического значения). Т. пл.=183-184 Пример 2 Синтез 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 1, за исключением мольного соотношения метиловый эфир 4-фенил-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:1:1. Выход 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона – 40% от теоретического значения. Пример 3 Синтез 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 1, за исключением мольного соотношения метиловый эфир 4-фенил-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:3:3. Выход 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона – 78% от теоретического значения. Пример 4 Синтез 6-(2,6-дифторбензил)-2-(метилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 1, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-(2,6-дифторфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:2:2. После кристаллизации из ацетонитрила получается чистый продукт с выходом 82% от теоретического значения. Т. пл.=197-198 Пример 5 Синтез 6-(2,6-дихлорбензил)-2-(метилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 1, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-(2,6-дихлорфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой кислоты : S-метил-изотиомочевины гидроиодид : калия карбонат=1:2:2. После кристаллизации из ацетонитрила получается чистый продукт с выходом 74% от теоретического значения. Т.пл.=237-238.5 Пример 6 Синтез 6-бензгидрил-2-(метилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 1, за исключением использования в качестве метилового эфира 4,4-диарил-3-оксобутановой кислоты метилового эфира 4,4-дифенил-3-оксобутановой кислоты и времени конденсации, равного 96 часов. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:2:2. После кристаллизации из смеси этанола и диметилформамида получается чистый продукт с выходом 79% от теоретического значения. Т.пл.=234.5-236 Пример 7 Синтез 6-бензгидрил-2-(этилсульфанил)-4(3H)-пиримидинона В реактор, снабженный обратным холодильником и механической мешалкой, помещают 3.81 грамма (50 ммоль) тиомочевины, 25 мл 95%-ного этанола и 3.73 мл (5.45 г, 50 ммоль) бромэтана. Полученная смесь кипятится при перемешивании 3 часа и оставляется на 18 часов при комнатной температуре. К реакционной смеси прибавляется раствор калия карбоната (6.91 г, 50 ммоль) в воде (25 мл) и раствор 6.71 г (25 ммоль) метилового эфира 4,4-дифенил-3-оксобутановой кислоты в 15 мл 95%-ного этанола. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-этил-изотиомочевины гидробромид : калия карбонат=1:2:2. Полученная смесь перемешивается 144 часа при комнатной температуре, нейтрализуется 1N раствором соляной кислоты (50 мл) и фильтруется. Осадок на фильтре промывается водой (100 мл) и сушится на воздухе до постоянной массы. После кристаллизации из 95%-ного этанола получается чистый продукт с выходом 72% от теоретического значения. Т.пл.=192-194 Пример 8 Синтез 6-(2,6-дифторбензил)-2-(втор-бутилсульфанил)-4(3H)-пиримидинона В реактор, снабженный механической мешалкой, внутренним термометром и обратным холодильником помещают 3.81 грамма (50 ммоль) тиомочевины, 4.59 мл (3.71 г, 50 ммоль) втор-бутанола и 17.15 мл (25.50 грамм, 150 ммоль) 48%-ной бромистоводородной кислоты. Полученная смесь кипятится при перемешивании в течение 9 часов, а затем охлаждается до 0-5 Полученная смесь интенсивно перемешивается при комнатной температуре в течение 96 часов, нейтрализуется 1N бромистоводородной кислотой (150 мл) и извлекается этилацетатом (3 Пример 9 Синтез 6-бензил-2-(втор-бутилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 8, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-фенил-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-фенил-3-оксобутановой кислоты : S-втор-бутилизотиомочевины гидробромид : калия карбонат=1:2:2. Получен продукт с выходом 63% от теоретического значения. Т. пл.=100-102 Пример 10 Синтез 6-(2,6-дихлорбензил)-2-(втор-бутилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 8, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-(2,6-дихлорфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой кислоты : S-втор-бутилизотиомочевины гидробромид : калия карбонат=1:2:2. Получен продукт с выходом 55% от теоретического значения. Т.пл.=183-184 Пример 11 Синтез 6-(1-нафтилметил)-2-(втор-бутилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 8, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты – метилового эфира 4-(1-нафтил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(1-нафтил)-3-оксобутановой кислоты : S-втор-бутилизотиомочевины гидробромид : калия карбонат=1:2:2. Получен продукт с выходом 49% от теоретического значения. Т.пл.=161-162 Пример 12 Синтез 6-бензгидрил-2-(втор-бутилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 8, за исключением использования в качестве метилового эфира 4,4-диарил-3-оксобутановой кислоты метилового эфира 4,4-дифенил-3-оксобутановой кислоты и времени конденсации, равного 144 часа. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-втор-бутилизотиомочевины гидроиодид : калия карбонат=1:2:2. Получен продукт с выходом 42% от теоретического значения. Т.пл.=154.5-156.5 Пример 13 Синтез 6-(2,6-дихлорбензил)-2-(циклопентилсульфанил)-4(3H)-пиримидинона В реактор, снабженный механической мешалкой, внутренним термометром и обратным холодильником помещают 3.81 грамма (50 ммоль) тиомочевины, 4.54 мл (4.31 г, 50 ммоль) циклопентанола и 17.15 мл (25.50 грамм, 150 ммоль) 48%-ной бромистоводородной кислоты. Полученная смесь кипятится при перемешивании в течение 9 часов, а затем охлаждается до 0-5 Полученная смесь интенсивно перемешивается при комнатной температуре в течение 96 часов, нейтрализуется 1N бромистоводородной кислотой (150 мл) и извлекается этилацетатом (3 Пример 14 Синтез 6-бензил-2-(циклопентилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 12, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-фенил-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-фенил-3-оксобутановой кислоты : S-циклопентилизотиомочевины гидробромид : калия карбонат=1:2:2. Получен продукт с выходом 66% от теоретического значения. Т.пл.=147-148 Пример 15 Синтез 6-(2,6-дифторбензил)-2-(циклопентилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 12, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты – метилового эфира 4-(2,6-дифторфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой кислоты : S-циклопентилизотиомочевины гидроиодид : калия карбонат=1:2:2. Получен чистый продукт с выходом 66% от теоретического значения. Т.пл.=168-169 Пример 16 Синтез 6-(1-нафтилметил)-2-(циклопентилсульфанил)-4(3H)-пиримидинон Проводится аналогично синтезу 12, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты – метилового эфира 4-(1-нафтил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(1-нафтил)-3-оксобутановой кислоты : S-циклопентилизотиомочевины гидробромид : калия карбонат=1:2:2. Получен продукт с выходом 43%. Т.пл.=172-173 Пример 17 Синтез 6-бензгидрил-2-(циклопентилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 12, за исключением использования в качестве метилового эфира 4,4-диарил-3-оксобутановой кислоты – метилового эфира 4,4-дифенил-3-оксобутановой кислоты и времени проведения конденсации – 144 часа. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-циклопентилизотиомочевины гидробромид : калия карбонат=1:2:2. Получен чистый продукт с выходом 40%. Т.пл.=195-196.5 Пример 18 Синтез 6-(1-нафтилметил)-2-(циклогексилсульфанил)-4(3H)-пиримидинон В реактор, снабженный механической мешалкой, внутренним термометром и обратным холодильником помещают 3.81 грамма (50 ммоль) тиомочевины, 5.27 мл (5.01 г, 50 ммоль) циклогексанола и 17.15 мл (25.50 грамм, 150 ммоль) 48%-ной бромистоводородной кислоты. Полученная смесь кипятится при перемешивании в течение 9 часов, а затем охлаждается до 0-5 Полученная смесь интенсивно перемешивается при комнатной температуре в течение 120 часов, нейтрализуется 1N бромистоводородной кислотой (150 мл) и извлекается этилацетатом (3 Пример 19 Синтез 6-бензил-2-(циклогексилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 18, за исключением применения в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-фенил-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-фенил-3-оксобутановой кислоты : S-циклогексилизотиомочевины гидробромид : калия карбонат=1:2:2. После кристаллизации из ацетонитрила получен чистый продукт с выходом 31% от теоретического значения. Т.пл.=172-173 Пример 20 Синтез 6-(2,6-дифторбензил)-2-(циклогексилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 18, за исключением применения в качестве метилового эфира 4-арил-3-оксобутановой кислоты – метилового эфира 4-(2,6-дифторфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой кислоты: S-циклогексилизотиомочевины гидробромид: калия карбонат=1:2:2. Получен чистый продукт с выходом 27% от теоретического значения. Т.пл.=164-165 Пример 21 Синтез 6-(2,6-дихлорбензил)-2-(циклогексилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 18, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-(2,6-дихлорфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой кислоты : S-цикло-гексилизотиомочевины гидробромид : калия карбонат=1:2:2. Получен чистый продукт с выходом 25% от теоретического значения. Т.пл.=200-201 Пример 22 Синтез 6-бензгидрил-2-(циклогексилсульфанил)-4(3H)-пиримидинона Проводится аналогично синтезу 18, за исключением использования в качестве метилового эфира 4,4-диарил-3-оксобутановой кислоты метилового эфира 4,4-дифенил-3-оксобутановой кислоты и времени конденсации, равного 144 часа. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-циклогексилизотиомочевины гидробромид : калия карбонат=1:2:2. Получен чистый продукт с выходом 20% от теоретического значения. Т.пл.=186.5-188.5 Как следует из представленных примеров, предложенный нами способ получения 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона является технологичным, позволяет получать широкий спектр указанных соединений с хорошим выходом и высокой чистотой. Формула изобретения
Способ получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов общей формулы где R – С6Н5СН2, R’ – СН3,СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11; R – 2,6-F2С6Н3СН2, R’ – СН3,СH(СН3)C2Н5, цикло-С5H9, цикло-С6H11; R – 2,6-Сl2С6Н3СН2, R’ – СН3,СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11; R – 1-С10Н7СН2, R’ – СН3,СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11, R – Ph2CH,R’ – СН3,С2Н5,СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11, с использованием реакции S-алкилизотиомочевины гидрогалогенида в основной среде с последующим выделением целевого продукта, отличающийся тем, что используют S-алкилизотиомочевины гидрогалогенид, выбранный из S-метилизотиомочевины гидроиодида, S-этилизотиомочевины гидробромида, S-втор-бутилизотиомочевины гидробромида, S-циклопентилизотиомочевины гидробромида или S-циклогексилизотиомочевины гидробромида, полученный in situ из тиомочевины и соответствующего галогеналкана, или втор-бутанола, или циклоалканола в присутствии бромистоводородной кислоты, который подвергают взаимодействию в присутствии водного раствора калия карбоната с раствором в этаноле метилового эфира 4-арил-3-оксобутановой кислоты или метилового эфира 4,4-диарил-3-оксобутановой кислоты, выбранных из ряда метиловый эфир 4-фенил-3-оксобутановой, метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой, метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой, метиловый эфир 4-(1-нафтил)-3-оксобутановой и метиловый эфир 4,4-дифенил-3-оксобутановой кислот, при мольном соотношении метиловый эфир 4-арил-3-оксобутановой кислоты или метиловый эфир 4,4-диарил-3-оксобутановой кислоты: S-алкилизотиомочевины гидрогалогенид: калия карбонат равном 1:1-3:1-3. |
||||||||||||||||||||||||||

 -кетоэфиров, путем конденсации последних с тиомочевиной в среде абсолютного спирта в присутствии алкоксида натрия. Таким образом, процесс усложняется путем включения еще одной стадии синтеза, что снижает выход целевых 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона в расчете на исходный
-кетоэфиров, путем конденсации последних с тиомочевиной в среде абсолютного спирта в присутствии алкоксида натрия. Таким образом, процесс усложняется путем включения еще одной стадии синтеза, что снижает выход целевых 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона в расчете на исходный 
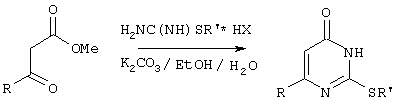
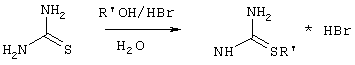
 50 мл). Органические вытяжки объединяются, промываются насыщенным водным раствором хлорида натрия (50 мл) и осушаются сульфатом магния. После удаления растворителя при пониженном давлении остаток кристаллизуется из подходящего растворителя или очищается колоночной хроматографией (элюент – этанол – хлороформ (1:99-1:95)), а затем кристаллизуется.
50 мл). Органические вытяжки объединяются, промываются насыщенным водным раствором хлорида натрия (50 мл) и осушаются сульфатом магния. После удаления растворителя при пониженном давлении остаток кристаллизуется из подходящего растворителя или очищается колоночной хроматографией (элюент – этанол – хлороформ (1:99-1:95)), а затем кристаллизуется.