Патент на изобретение №2161611
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 2-(п-АМИНОФЕНИЛ)-6-АМИНО-4H-3,1-БЕНЗОКСАЗИНОНА-4
(57) Реферат: Описан способ получения 2-(п-аминофенил)-6-амино-4Н-3,1-бензоксазинона-4 из антраниловой кислоты. Ароилирование п-нитробензоилхлоридом, образование оксазинонового цикла под действием уксусного ангидрида и нитрование азотной кислотой проводят в одну стадию с образованием 2-(п-нитрофенил)-6-нитро-4Н-3,1-бензоксазинона-4, который далее восстанавливают водородом над никелем по Ренею в целевой диамин. Полученное соединение может быть использовано в качестве мономера для получения термостойких полиамидов. Способ по изобретению позволяет интенсифицировать процесс, сократить количество технологических стадий и отходов производства, улучшить экологию процесса. Изобретение относится к новому способу получения ароматического диамина с гетероциклом между бензольными кольцами, конкретно, к способу получения 2-(п-аминофенил)-6-амино-4H-3,1-бензоксазинона-4 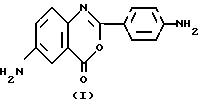 который может быть использован в качестве мономера для получения термостойких полимерных материалов, в частности полиамидов. Прототипом изобретения является описанный в литературе [Немлева С.А., Иванова В. М., Каминская Э.Г. и др. Синтез 2-(4-аминофенил)-6-амино-3,1,4-бензоксазинона/Сб. Тул. гос. пед. ин-та “Синтез, анализ и структура органических соединений”, 1976, в. 7, c. 44-48] шестистадийный способ получения 2-(п-аминофенил)-6-амино-4H-3,1-бензоксазинона-4, заключающийся в том, что антраниловую кислоту ацилируют, затем ацильное производное нитруют, ацетильную защиту снимают гидролизом, образующуюся нитроантраниловую кислоту ароилируют п-нитробензоилхлоридом, с помощью водоотнимающего средства (хлористого тионила) образуют оксазиноновый цикл и динитропродукт восстанавливают в целевой диамин структуры (I). С целью интенсификации процесса, сокращения основных технологических стадий, отходов производства, улучшения экологии процесса предлагается принципиально новое решение проблемы синтеза целевого диамина (I), основанного на двухстадийном способе получения 2-(п-аминофенил)-6-амино-4H-3,1-бензоксазинона-4 по схеме (см. в конце описания). Отличие предлагаемого способа получения целевого диамина заключается в том, что ароилирование антраниловой кислоты n-нитробензоилхлоридом, образование оксазинонового цикла под действием уксусного ангидрида и нитрование азотной кислотой проводят в одну стадию без выделения промежуточных продуктов. Образующийся на первой стадии 2-(п-нитрофенил)-6-нитро-4H-3,1-бензоксазинон-4 (II) на второй каталитически восстанавливают водородом с выделением конечного продукта (I). Предлагаемый способ имеет ряд преимуществ перед прототипом. Во-первых, малостадийность (2 стадии против 6 в прототипе) и связанный с этим меньший ассортимент сырья и его расход, упрощенность аппаратурного оформления. Здесь следует указать на то, что в предлагаемом способе отсутствуют такие агрессивные среды, как хлористый тионил, концентрированная серная кислота. Вместо 100%-ной азотной кислоты по прототипу в предлагаемом способе используется более доступная и менее агрессивная 65%-ная азотная кислота. В предлагаемом способе отсутствует требование к осушению растворителей, тогда как использование сухих петролейного эфира и особенно диоксана, способного давать пероксидные соединения, вызывают дополнительные трудности в аппаратурном оформлении процесса. Малостадийный процесс проще многостадийного за счет сокращения целого ряда как основных, так и вспомогательных технологических приемов. Во-вторых, более чистая экология предлагаемого способа по сравнению с прототипом. Это вытекает из меньших сырьевых затрат, меньшей токсичности используемых веществ, меньшего количества сточных вод и отходов производства: в прототипе 3 водные промывки, в предлагаемом способе ни одной, в прототипе, кроме того, есть еще и одна перекристаллизация из уксусной кислоты. Естественно, что энергетические затраты на регенерацию растворителей – уксусной кислоты, хлористого тионила, диоксана, петролейного эфира по прототипу выше, чем по предлагаемому способу, когда приходится регенерировать только уксусную кислоту и этиловый спирт. В-третьих, более высокий выход целевого мономера: по предлагаемому способу 74,5% против 31,2% по прототипу. Сущность предлагаемого метода получения 2-(п-аминофенил)-6- амино-4H-3,1-бензоксазинона-4 заключается в следующем. К раствору антраниловой кислоты в ледяной уксусной кислоте при нагревании и перемешивании добавляют раствор п-нитробензоилхлорида в том же растворителе. Реакционную смесь выдерживают при кипячении в течение 2 ч, затем сюда же прибавляют уксусный ангидрид, кипятят 10 мин и вносят 65%-ную азотную кислоту. Охлаждают реакционную смесь и получают динитропродукт (II), который далее восстанавливают водородом над никелем по Ренею до целевого диамина (I). Суть изобретения иллюстрируется следующими примерами. Пример 1. Синтез 2-(п-нитрофенил)-6-нитро-4H-3,1- бензоксазинона-4. К раствору 13,7 г (0,1 моль) антраниловой кислоты в 100 мл ледяной уксусной кислоты при нагревании и перемешивании добавляют раствор 20,4 г (0,11 моль) п-нитробензоилхлорида в 50 мл того же растворителя. Реакционную смесь выдерживают при кипении в течение 2 ч, затем сюда же прибавляют 300 мл уксусного ангидрида, кипятят в течение 10 мин и вносят 19,2 мл (3-кратный избыток) 65%-ной азотной кислоты. Охлаждают реакционную смесь до комнатной температуры, при этом выкристаллизовывается светло-желтый 2-(п-нитрофенил)-6-нитро-4H- 3,1-бензоксазинон-4. Отмывают водой до нейтральной среды. Выход 25 г (80,9%). Т. пл. 198oC. Найдено, %: C 53.81, 53.52, H 2.27, 2.20, N 13.37, 13.40. C14H7N3O6. Вычислено, %: C 53.67, H 2.24, N 13.42. ИК-спектр (таблетка с KBr),  , см-1: 1773 (C=О), 1521, 1349 (NO2).
Пример 2. Синтез 2-(п-аминофенил)-6-амино-4H-3,1-бензоксазинона-4. В автоклав загружают 70 г 2-(п-нитрофенил)-6-нитро-4H-3,1- бензоксазинона-4, 700 мл диметилацетамида, 7 г никеля (по Ренею). Систему после продувки инертом заполняют водородом до давления 1,5 мПа, температуру повышают до 80oC и процесс восстановления завершают за 10 мин. Горячий катализат после 30-минутной выдержки отделяют от катализатора и охлаждают. Осадок амина выделяют добавлением катализата в 2 л дистиллированной воды. Выход 90%. Т.пл. 222oC. Найдено, %: C 64.41, H 4.26, N 16,56. C14H11N3O2. Вычислено, %: C 64.40, H 4.31, N 16.60. ИК-спектр (таблетка с KBr): , см-1: 1773 (C=О), 1521, 1349 (NO2).
Пример 2. Синтез 2-(п-аминофенил)-6-амино-4H-3,1-бензоксазинона-4. В автоклав загружают 70 г 2-(п-нитрофенил)-6-нитро-4H-3,1- бензоксазинона-4, 700 мл диметилацетамида, 7 г никеля (по Ренею). Систему после продувки инертом заполняют водородом до давления 1,5 мПа, температуру повышают до 80oC и процесс восстановления завершают за 10 мин. Горячий катализат после 30-минутной выдержки отделяют от катализатора и охлаждают. Осадок амина выделяют добавлением катализата в 2 л дистиллированной воды. Выход 90%. Т.пл. 222oC. Найдено, %: C 64.41, H 4.26, N 16,56. C14H11N3O2. Вычислено, %: C 64.40, H 4.31, N 16.60. ИК-спектр (таблетка с KBr):  , см-1 1738 (C=О), 3468, 3376 (NH2).
Таким образом, предлагается новый двухстадийный способ получения 2-(п-аминофенил)-6-амино-4H-3,1-бензоксазинона-4 из антраниловой кислоты. , см-1 1738 (C=О), 3468, 3376 (NH2).
Таким образом, предлагается новый двухстадийный способ получения 2-(п-аминофенил)-6-амино-4H-3,1-бензоксазинона-4 из антраниловой кислоты.
Формула изобретения
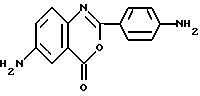 из антраниловой кислоты, отличающийся тем, что ароилирование п-нитробензоилхлоридом, образование оксазинового цикла под действием уксусного ангидрида и нитрование азотной кислотой проводят в одну стадию с образованием 2-(п-нитрофенил)-6-нитро-4H-3,1-бензоксазинона-4, который далее восстанавливают водородом над никелем по Ренею в целом диамин. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 28.07.2001
Номер и год публикации бюллетеня: 11-2003
Извещение опубликовано: 20.04.2003
|
||||||||||||||||||||||||||
