Патент на изобретение №2334748
|
||||||||||||||||||||||||||
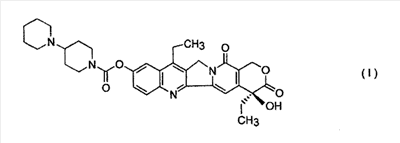
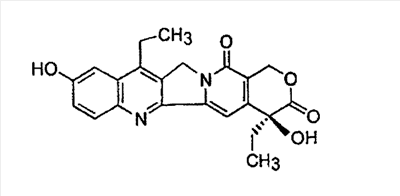
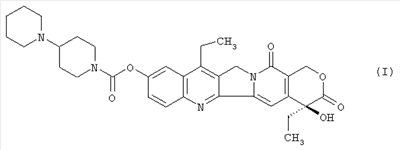
(54) СПОСОБ ПОЛУЧЕНИЯ 7-ЭТИЛ-10-[4-(1-ПИПЕРИДИНО)-1-ПИПЕРИДИНО] КАРБОНИЛОКСИКАМПТОТЕЦИНА
(57) Реферат:
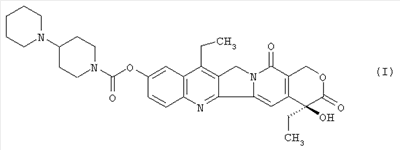
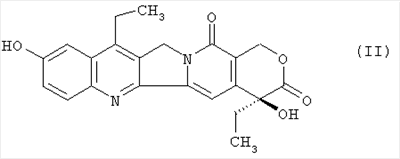
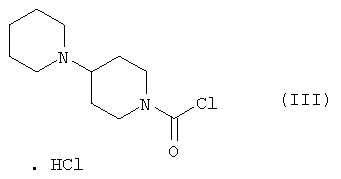
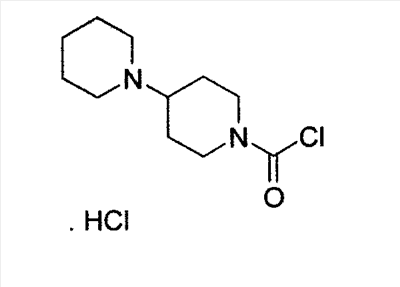
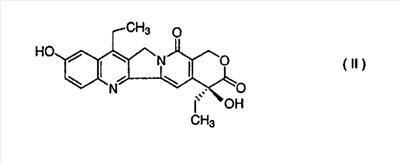
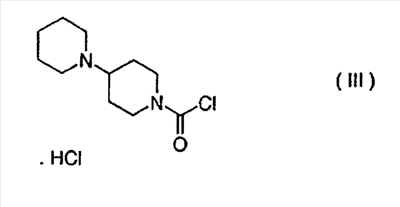
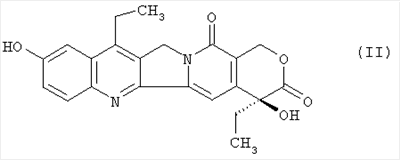
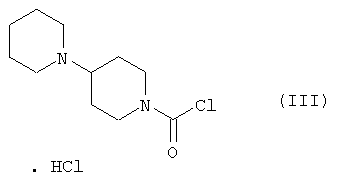
Настоящее изобретение относится к способу получения 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикамптотецина формулы I отличающемуся тем, что 7-этил-10-гидроксикамптотецин формулы II подвергают реакции конденсации с гидрохлоридом 1-хлоркарбонил-4-пиперидинопиперидина формулы III
в полярном апротонном растворителе, в частности в ацетонитриле, в присутствии 4-диметиламинопиридина. Технический результат: новый способ получения соединения формулы I с незначительными потерями целевого продукта, которое используется для лечения рака легкого и рака прямой кишки. 4 з.п. ф-лы.
Настоящее изобретение относится к способу производства 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикамптотецина формулы I 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикамптотецин, который известен также как иринотекановое основание, используемое для производства цитостатически активного тригидрата гидрохлорида иринотекана, ингибитора топоизомеразы, который используется для лечения рака легкого и рака прямой кишки. 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикамптотецин до настоящего времени получали конденсацией 7-этил-10-гидроксикамптотецина формулы с гидрохлоридом 1-хлоркарбонил-4-пиперидинопиперидина формулы в пиридине при комнатной температуре. Данный способ был описан в следующих публикациях: US № 4604463 (T.M. Kanagawa, S. Sawada, K. Nikata, E. Sugino, M. Mutai), 5.08.1986; S. Sawada, S. Okajima, R. Aiyama, K. Nikata, T. Furuta, T. Yokokura, E. Sugino, K. Yamachuchi, T. Miyasaka, Chemical and Pharmaceutical Bulletin 1991, 39(6), 1446-1454; WO 96/31513 (K.E. Henegar, J.C. Sih), 10.09.1996; US № 6235907 (K.E. Henegar, J.C. Sih), 22.05.2001; US № 6444820 (K.E. Henegar, J.C. Sih), 3.09.2002. Недостатком данного способа получения иринотеканового основания является то, что при конденсации образуются окрашенные примеси, которые необходимо удалять адсорбцией в колонке с силикагелем и последующей перекристаллизацией из этанола. Эти стадии очистки сопровождаются значительными потерями конечного продукта, и его выход составляет только примерно 64%. Кроме того, необходимы перегонка пиридина, экстракция хлороформного слоя растворами карбоната натрия и хлорида натрия и сушка хлороформного слоя над сульфатом магния. Таким образом, имелась потребность в улучшенном способе получения иринотеканового основания. И указанная задача решается способом согласно изобретению. Настоящее изобретение относится к способу получения 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикамптотецина формулы I, в котором 7-этил-10-гидроксикамптотецин формулы II подвергают конденсации с гидрохлоридом 1-хлоркарбонил-4-пиперидинопиперидина формулы III в полярном апротонном растворителе, таком как ацетонитрил, и в присутствии 4-диметиламинопиридина. Конденсацию проводят в суспензии, где полярный апротонный растворитель растворяет только 4-диметиламинопиридин, в то время как 7-этил-10-гидроксикамптотецин и гидрохлорид 1-хлоркарбонил-4-пиперидинопиперидина остаются нерастворенными в этом полярном апротонном растворителе. Количество гидрохлорида 1-хлоркарбонил-4-пиперидинопиперидина, используемое в реакции конденсации, предпочтительно составляет от 1,3 до 3 моль, более предпочтительно от 1,6 до 1,9 моль, на моль 7-этил-10-гидроксикамптотецина. Количество 4-диметиламинопиридина, используемое в конденсации, предпочтительно находится в интервале от 1,5 до 4 моль, более предпочтительно в интервале от 1,8 до 2,2, на 1 моль 7-этил-10-гидроксикамптотецина. Количество полярного апротонного растворителя, используемое в конденсации, предпочтительно составляет от 400 до 600 моль, более предпочтительно от 430 до 460 моль, на моль 7-этил-10-гидроксикамптотецина. Конденсацию проводят предпочтительно при температуре в интервале от 70 до 80°С, более предпочтительно при температуре от 73 до 77°С. После завершения конденсации присутствующие побочные продукты, включающие, например, 4-диметиламинопиридин, 4-пиперидинопиперидин и мочевину, удаляют промывкой полученного иринотеканового основания полярным апротонным растворителем, предпочтительно ацетонитрилом. Выход конденсации составляет, по меньшей мере, 94%, и полученный продукт содержит, по меньшей мере, 98% целевого иринотеканового основания, как было определено высокоэффективной жидкостной хроматографией. Основное преимущество способа согласно настоящему изобретению состоит в том, что обработка реакционной смеси после конденсации проводится с незначительными потерями целевого продукта, и конденсация не сопровождается получением окрашенных примесей. Примеры Пример 1 В химический стакан, помещенный в баню с ультразвуком, загружают 10 г (0,0247 моль) 7-этил-10-гидроксикамптотецина и 99 мл ацетонитрила. Полученную суспензию перемешивают в бане с ультразвуком до гомогенности. Затем суспензию количественно переносят в трехгорлую колбу Келлера с механической мешалкой, термометром и обратным холодильником. После этого в освобожденный таким образом стакан загружают 6,2 г (0,0502 моль) кристаллического 4-диметиламинопиридина и 40 мл ацетонитрила. Смесь перемешивают до растворения кристаллического компонента смеси. Полученный раствор затем количественно добавляют к суспензии 7-этил-10-гидроксикамптотецина. В пустой стакан загружают 13,6 г (0,0434 моль) гидрохлорида 1-хлоркарбонил-4-пиперидинопиперидина и 79 мл ацетонитрила и полученную суспензию перемешивают на ультразвуковой бане до получения гомогенной смеси. Полученную суспензию количественно переносят в трехгорлую колбу Келлера, уже содержащую 7-этил-1-гидроксикамптотецин и 4-диметиламинопиридин в ацетонитриле, и к смеси добавляют 382 мл ацетонитрила. Полученную реакционную суспензию в колбе Келлера перемешивают при 75°С в течение 5 часов. Через 2 часа суспензия светло-желтого цвета становится более густой и приобретает окраску кофе с молоком, указывая, таким образом, на правильный ход реакции. Спустя 5 часов суспензию охлаждают до 18-20°С, фильтруют и осадок на фильтре промывают 300 мл ацетонитрила. После удаления ацетонитрила фильтрацией с отсосом полученный 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикамптотецин сушат при 60-65°С до постоянной массы в сушильном шкафу. В результате получают 14,1 г (выход 94,3%) продукта, который согласно высокоэффективной жидкостной хроматографии содержит 98,9% 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикамптотецина.
Формула изобретения
1. Способ получения 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикамптотецина формулы I отличающийся тем, что 7-этил-10-гидроксикамптотецин формулы II подвергают реакции конденсации с гидрохлоридом 1-хлоркарбонил-4-пиперидинопиперидина формулы III
в полярном апротонном растворителе, в частности в ацетонитриле, в присутствии 4-диметиламинопиридина. 2. Способ по п.1, отличающийся тем, что гидрохлорид 1-хлоркарбонил-4-пиперидинопиперидина используют в количестве от 1,3 до 3 моль, предпочтительно в количестве от 1,6 до 1,9 моль, на 1 моль 7-этил-10-гидроксикамптотецина. 3. Способ по п.1, отличающийся тем, что 4-диметиламинопиридин используют в количестве от 1,5 до 4 моль, предпочтительно в количестве от 1,8 до 2,2 моль, на 1 моль 7-этил-10-гидроксикамптотецина. 4. Способ по п.1, отличающийся тем, что полярный апротонный растворитель используют в количестве от 400 до 600 моль, предпочтительно в количестве от 430 до 460 моль, на 1 моль 7-этил-10-гидроксикамптотецина. 5. Способ по п.1, отличающийся тем, что реакцию конденсации проводят при температуре от 70 до 80°С, предпочтительно при температуре от 73 до 77°С.
|
||||||||||||||||||||||||||