|
|
(21), (22) Заявка: 2005140649/13, 27.12.2005
(24) Дата начала отсчета срока действия патента:
27.12.2005
(43) Дата публикации заявки: 10.07.2007
(46) Опубликовано: 20.09.2008
(56) Список документов, цитированных в отчете о
поиске:
WO 03044192 А1, 30.05.2003. RU 2003109477, 20.10.2004. RU 2202607 С2, 20.04.2003.
Адрес для переписки:
117545, Москва, 1-й Дорожный пр-д, 1, ЗАО АГРИ, пат.пов. В.М.Белкову, рег.№ 913
|
(72) Автор(ы):
Токмакова Ирина Львовна (RU),
Горшкова Наталья Васильевна (RU),
Абалакина Елена Георгиевна (RU),
Йомантас Юргис Антанас Владович (RU)
(73) Патентообладатель(и):
Закрытое акционерное общество “Научно-исследовательский институт Аджиномото-Генетика” (ЗАО АГРИ) (RU)
|
(54) СПОСОБ ПРОДУКЦИИ АРОМАТИЧЕСКИХ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Methylophilus
(57) Реферат:
Изобретение относится к биотехнологии и представляет собой способ получения ароматических L-аминокислот с использованием бактерии рода Methylophilus, которая модифицирована таким образом, что в указанной бактерии усилена экспрессия генов, участвующих в транспорте ароматических L-аминокислот, а именно генов yddG, yddL, yddK и yddJ. Изобретение позволяет получать ароматические L-аминокислоты с высокой степенью эффективности. 2 н. и 8 з.п. ф-лы, 2 ил., 3 табл.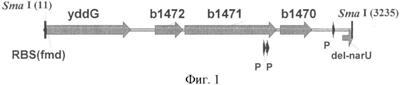
Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности, к способу получения ароматической L-аминокислоты, особенно L-фенилаланина, с использованием бактерии, принадлежащей к роду Methylophilus, при этом бактерия модифицирована таким образом, что экспрессия генов, кодирующих белки, участвующие в транспорте ароматических L-аминокислот из клетки, в указанной бактерии усилена.
Описание предшествующего уровня техники
L-Аминокислоты, такие как L-лизин, L-глутаминовая кислота, L-треонин, L-лейцин, L-изолейцин, L-валин и L-фенилаланин получают в промышленности путем ферментации с использованием микроорганизмов, которые принадлежат к роду Brevibacterium, Corynebacterium, Bacillus, Escherichia, Streptomyces, Pseudomonas, Arthrobacter, Serratia, Penicillium, Candida и подобным им. Для улучшения продуктивности используются штаммы, выделенные из природы, или их искусственные мутанты. Описаны различные способы улучшения способности продуцировать L-глутаминовую кислоту путем усиления активности ферментов биосинтеза L-глутаминовой кислоты с помощью техники рекомбинантной ДНК.
Продукция L-аминокислот значительно увеличивается при выведении упомянутых ранее микроорганизмов и при улучшении способов получения. Однако, для того, чтобы удовлетворить возрастающую потребность в будущем, все еще остается желательным разработка более эффективных способов получения L-аминокислот по более низкой цене.
Известные способы получения аминокислот путем ферментации метанола, который является сырьем, доступным в больших количествах по низкой цене, обычно включают использование микроорганизмов, которые принадлежат к роду Achromobacter или Pseudomonas (патентная заявка Японии №45-25273/1970), Protaminobacter (выложенная патентная заявка Японии №49-125590/1974), Protaminobacter или Methanomonas (выложенная патентная заявка Японии №50-25790/1975), Microcyclus (выложенная патентная заявка Японии №52-18886/1977), Methylobacillus (выложенная патентная заявка Японии №4-91793/1992), Bacillus (выложенная патентная заявка Японии №3-505284/1991) и так далее.
Способ получения L-фенилаланина путем культивирования бактерии, принадлежащей к роду Methylophilus, которая обладает способностью продуцировать L-фенилаланин и является устойчивой к аналогу фенилаланина, такому как DL-p-флуорофенилаланин, m-флуорофенилаланин и коричная кислота, был раскрыт в европейском патенте (ЕР 1134283 В1).
Также, способ получения L-аминокислоты, включая L-фенилаланин, путем культивирования микроорганизма, обладающего способностью продуцировать L-аминокислоту в среду, посредством чего L-аминокислота накапливается в среде, и отбора L-аминокислоты из среды, посредством чего указанный микроорганизм является метанол-утилизирующей бактерией, имеющей путь Энтнер-Дудорофф, в котором активность ферментов 6-фосфоглюконатдегидрогеназы и/или 2-кето-3-дезокси-6-фосфоглюконатальдолазы усилена, был раскрыт в патентной заявке США 2004014243 А1.
Способ получения L-аминокислоты, включая L-фенилаланин, путем выращивания микроорганизма, модифицированного таким образом, что экспрессия гена ybjE усилена, в жидкой среде, содержащей метанол в качестве главного источника углерода, также был раскрыт в заявке РСТ WO 05073390 A2.
Процесс получения L-аминокислоты, например, L-фенилаланина или L-триптофана, путем выращивания бактерии Escherichia в среде, где выработка L-аминокислоты увеличена путем усиления активности белка, кодируемого только геном yddG, был раскрыт в заявке РСТ WO 03044192 А1.
Однако в настоящее время отсутствуют сообщения об усилении экспрессии генов yddG, yddL, yddK, и yddJ в целях получения L-аминокислот, таких как L-фенилаланин, с использованием метанол-утилизирующей бактерии, принадлежащей к роду Methylophilus.
Описание изобретения
Целями настоящего изобретения являются повышение продуктивности штаммов-продуцентов ароматической L-аминокислоты и предоставление способа получения ароматической L-аминокислоты с использованием этих штаммов.
Вышеупомянутые цели были достигнуты путем установления того факта, что усиление экспрессии генов yddG, yddL, yddK и yddJ из бактерии Е. coli, в бактерии, принадлежащей к роду Methylophilus, в частности Methylophilus methylotrophus, может привести к повышению продукции ароматических L-аминокислот, таких как L-фенилаланин, L-триптофан и L-тирозин, предпочтительно L-фенилаланина.
Настоящее изобретение предоставляет бактерию, принадлежащую к роду Methylophilus, обладающую способностью к повышенной продукции ароматических L-аминокислот, таких как L-фенилаланин, L-триптофан и L-тирозин, предпочтительно L-фенилаланин.
Целью настоящего изобретения является предоставление бактерии, принадлежащей к роду Methylophilus, обладающей способностью к продукции ароматической L-аминокислоты, при этом указанная бактерия модифицирована таким образом, что экспрессия генов, кодирующих белки, участвующие в транспорте ароматических L-аминокислот из клетки, усилена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанные гены выделены из бактерии, принадлежащей к роду Escherichia.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанные гены включают гены yddG, yddL, yddK и yddJ.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная экспрессия усиливается путем модификации последовательности, контролирующей экспрессию указанных генов.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная экспрессия усиливается путем увеличения количества копий указанных генов.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная ароматическая L-аминокислота выбрана из группы, состоящей из L-фенилаланина, L-тирозина и L-триптофана.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанной L-аминокислотой является L-фенилаланин.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная бактерия принадлежит к виду Methylophilus methylotrophus.
Также целью настоящего изобретения является предоставление способа получения ароматической L-аминокислоты, который включает в себя:
– выращивание описанной выше бактерии в питательной среде, содержащей метанол в качестве главного источника углерода, с целью продукции и накопления ароматической L-аминокислоты в питательной среде и
– выделение указанной L-аминокислоты из культуральной жидкости.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанная ароматическая L-аминокислота выбрана из группы, состоящей из L-фенилаланина, L-тирозина и L-триптофана.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанная ароматическая L-аминокислота является L-фенилаланином.
Более детально настоящее изобретение описано ниже.
Подробное описание наилучшего способа осуществления изобретения
1. Бактерия согласно настоящему изобретению
Бактерия согласно настоящему изобретению – это бактерия, принадлежащая к роду Methylophilus, обладающая способностью к продукции ароматической L-аминокислоты, при этом бактерия модифицирована таким образом, что экспрессия генов, кодирующих белки, участвующие в транспорте ароматических L-аминокислот из клетки, в указанной бактерии усилена.
Согласно настоящему изобретению термин «бактерия, обладающая способностью к продукции ароматической L-аминокислоты» означает бактерию, обладающую способностью к продукции и выделению L-аминокислоты в питательную среду, когда бактерия согласно настоящему изобретению выращивается в указанной питательной среде. Термин «бактерия, обладающая способностью к продукции ароматической L-аминокислоты» также означает бактерию, способную продуцировать и вызывать накопление любой L-аминокислоты в культуральной среде в больших количествах, по сравнению с диким типом или родительским штаммом М. methylotrophus, таким как М. methylotrophus AS1, и, предпочтительно означает, что указанный микроорганизм способен накапливать в среде целевую L-аминокислоту в количестве не менее, чем 0.5 г/л, более предпочтительно, не менее, чем 1.0 г/л. Термин «ароматическая L-аминокислота» включает в себя L-фенилаланин, L-триптофан и L-тирозин. L-фенилаланин, в частности, является предпочтительным.
Гены, кодирующие белки, участвующие в транспорте ароматических L-аминокислот из клетки, включают гены, кодирующие белки, способные выводить ароматические L-аминокислоты из бактериальных клеток. Возросшая активность таких белков придает бактерии устойчивость к ароматическим L-аминокислотам и приводит к усиленному накоплению ароматических L-аминокислот в среде, когда такая бактерия выращивается в питательной среде.
Термин «бактерия, принадлежащая к роду Escherichia» означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, но не ограничивается только ею, может быть упомянута бактерия Escherichia coli (E. coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Фраза «бактерия модифицирована таким образом, что экспрессия генов усилена» означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит повышенное количество белков, кодируемых указанными генами, по сравнению с немодифицированной бактерией.
Фраза «усиленная экспрессия генов» означает, что уровень экспрессии генов выше, чем у немодифицированного штамма, например штамма дикого типа. Примеры таких модификаций включают увеличение числа копий гена(ов) в расчете на клетку и/или повышение уровня экспрессии гена(ов) путем модификации прилегающих к гену областей, которые включают последовательности, контролирующие экспрессию гена, такие как промотор(ы), энхансер(ы), аттенуатор(ы), сайт(ы) связывания рибосомы, и т.д.
Фраза «гены, кодирующие белки, участвующие в транспорте ароматических L-аминокислот из клетки» означает, что в процессе культивирования микроорганизма, который был модифицирован таким образом, что экспрессия генов усиливается, количество секретированных микроорганизмом в культуральную среду L-аминокислот больше, чем количество L-аминокислот, секретированных немодифицированным штаммом, таким как родительский штамм или соответствующий штамм дикого типа. Усиление способности к транспорту L-аминокислот из клетки контролируется путем установления возрастания концентрации L-аминокислот в культуральной среде. Кроме того, усиление способности к транспорту L-аминокислот из клетки контролируется путем установления снижения внутриклеточной концентрации L-аминокислот при введении гена в микроорганизм. Количество L-аминокислот, секретируемых микроорганизмом, согласно настоящему изобретению, предпочтительно увеличивается на 10% или более, более предпочтительно – на 30% или более, особенно предпочтительно – на 50% и более, по сравнению с количеством L-аминокислот, выделяемым из немодифицированного штамма. Кроме того, усиление способности к транспорту L-аминокислот из клетки также проявляется в показателях снижения концентрации L-аминокислот в клетке при условии введения генов в микроорганизм. В качестве примера, концентрация L-аминокислоты в клетке может быть измерена следующим образом: соответствующее количество силиконового масла со специфической плотностью 1.07 добавляется в среду, содержащую клетки микроорганизма, и клетки отбираются из среды путем центрифугирования, предпочтительно в режиме 12000 об/мин в течение 2 минут. Затем клетки обрабатываются 22%-ной перхлорной кислотой (Ishizaki, A. et al., Biotech. Techniq., 9, 6, 409 (1995)). Использование приготовленных таким образом клеток позволяет измерить внутриклеточную концентрацию L-аминокислот, Кроме того, «способность к транспорту L-аминокислот из клетки» может быть изучена опосредованно, путем измерения поглощения радиоактивно меченной L-аминокислоты клеткой с использованием инвертированных мембранных везикул (Pittman, M.S. et al., J. Biol. Chem., 277, 51, 49841-49849 (2002)). В качестве примера, инвертированные мембранные везикулы приготавливаются из клеток, в которые введены гены. Затем, АТФ или другие субстраты, которые обеспечивают передачу энергии, добавляются к везикулам и измеряется поглощение клеткой радиоактивно меченных L-аминокислот, Альтернативно, «способность к экспорту L-аминокислот» может быть проверена путем измерения скорости обмена между немеченной аминокислотой и меченной аминокислотой в активных клетках.
Примеры генов бактерий рода Escherichia, участвующих в транспорте ароматических L-аминокислот из клетки, включают гены yddG, yddL, yddK и yddJ из E. coli.
Ген yddG кодирует, как предполагается, трансмембранный белок YddG (синоним – В1473). Ген yddG (номера нуклеотидов с 1544312 по 1545193 в нуклеотидной последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990; SEQ ID NO: 1) расположен между генами yddL и fdnG на хромосоме E. coli K-12. Нуклеотидная последовательность гена yddG и соответствующая ей аминокислотная последовательность белка YddG, кодируемого геном yddG, приведены в Списке последовательностей под номерами SEQ ID NO: 1 и SEQ ID NO: 2, соответственно.
Ген yddL кодирует, как предполагается, поверхностный по отношению к мембране белок пор YddL (синоним – В1472). Tea yddL (номера нуклеотидов с 1543762 по 1544052 в нуклеотидной последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990; SEQ ID NO: 3) расположен между генами yddG и yddK на хромосоме Е. coli К-12. Нуклеотидная последовательность гена yddL и соответствующая ей аминокислотная последовательность белка YddL, кодируемого геном yddL, приведены в Списке последовательностей под номерами SEQ ID NO: 3 и SEQ ID NO: 4, соответственно.
Ген yddK кодирует, как предполагается, гликопротеин YddK (синоним – В1471). Ген yddK (номера нуклеотидов с 1542782 по 1543738 в нуклеотидной последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990; SEQ ID NO: 5) расположен между генами yddJ и yddL на хромосоме Е.coli К-12. Нуклеотидная последовательность гена yddK и соответствующая ей аминокислотная последовательность белка YddK, кодируемого геном yddK, приведены в Списке последовательностей под номерами SEQ ID NO: 5 и SEQ ID NO: 6, соответственно.
Ген yddJ кодирует белок YddJ (синоним – В1470), функция которого неизвестна. Ген yddJ (номера нуклеотидов с 1542408 по 1542743 в нуклеотидной последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 49175990; SEQ ID NO: 7) расположен между генами narU и yddK на хромосоме Е. coli К-12. Нуклеотидная последовательность гена yddJ и соответствующая ей аминокислотная последовательность белка YddJ, кодируемого геном fucU, приведены в Списке последовательностей под номерами SEQ ID NO: 7 и SEQ ID NO: 8, соответственно.
Поскольку у представителей различных родов и штаммов семейства Enterobacteriaceae возможны некоторые вариации в нуклеотидных последовательностях, вышеописанные гены, экспрессия которых усилена, не ограничиваются нуклеотидными последовательностями, приведенными в Списке последовательностей под номерами SEQ ID Nos: 1, 3, 5 и 7, но также могут включать в себя нуклеотидные последовательности, обладающие сходством с последовательностями под номерами SEQ ID Nos: 1, 3, 5 и 7. Таким образом, варианты белка, кодируемые вышеописанными генами, могут обладать сходством не менее 80%, предпочтительно, не менее 90% и, наиболее предпочтительно, не менее 95%, по отношению к полным аминокислотным последовательностям, приведенным в Списке последовательностей под номерами SEQ ID NO.2,4, 6 и 8, при условии, что способность данных белков вызывать транспорт ароматических L-аминокислот из клетки сохраняется.
Кроме того, вышеописанные гены могут быть представлены вариантами, которые гибридизуются в жестких условиях с нуклеотидными последовательностями, приведенными в Списке последовательностей под номерами SEQ ID Nos: 1, 3, 5 и 7, или с зондами, синтезированными на основе указанных нуклеотидных последовательностей, при условии, что указанные варианты кодируют функциональные белки. «Жесткие условия» включают такие условия, при которых специфические гибриды образуются, а неспецифические гибриды – не образуются. Практическим примером жестких условий является однократная отмывка при 60°С, предпочтительно двух- или трехкратная, с помощью раствора, содержащего 1×SSC и 0.1% SDS, предпочтительно 0.1×SSC и 0.1% SDS. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно она составляет от 100 п.н. до 1 т.п.н.
Усиление экспрессии генов может быть достигнуто путем увеличения количества копий генов и/или путем внедрения вектора, несущего ген. Вектором для бактерии рода Methylophilus может служить, к примеру, плазмида, которая автономно реплицируется в клетках бактерии рода Methylophilus. Отдельные примеры векторов для бактерии рода Methylophilus включают плазмиду RSF1010 и ее производные, такие как pAYC32 (Chistorerdov, A.Y., Tsygankov, Y.D. Plasmid, 16, 161-167 (1986)), pMFY42 (Gene, 44, 53 (1990)), pRP301, and pTB70 (Nature, 287, 396, (1980)).
Усиление экспрессии генов может быть произведено путем внедрения множественных копий гена в хромосому бактерии при помощи, например, метода гомологичной рекомбинации, Mu-интеграции, и им подобных методов. Число копий экспрессируемых генов может быть определено, к примеру, с помощью расщепления хромосомной ДНК рестриктазами и последующего гибридизационного анализа по Саузерну (Southern blotting) с использованием зондов, полученных на основе нуклеотидных последовательностей данных генов, флуоресцентной гибридизации in situ (FISH) и подобных им методов.
Усиление экспрессии генов указанного оперона может быть также произведено путем размещения гена(ов) под контроль сильного промотора, способного функционировать в бактерии, принадлежащей к роду Methylophilus. Например, промоторы lac, trp и trc, а также промоторы PR или PL фага лямбда, известны в качестве сильных промоторов. Использование сильного промотора может сочетаться с увеличением числа копий гена.
С другой стороны, действие промотора может быть усилено, к примеру, путем введения мутации в промотор для увеличения уровня транскрипции гена, расположенного после промотора. Кроме того, известно, что замена нескольких нуклеотидов в районе спейсера между сайтом связывания рибосомы (RBS) и стартовым кодоном, особенно в последовательности, расположенной сразу перед стартовым кодоном, может сильно повлиять на способность мРНК к трансляции. Например, была обнаружена 20-ти кратная разница в уровнях экспрессии, зависящая от природы трех нуклеотидов, предшествующих стартовому кодону (Gold et al., Annu. Rev. Microbiol., 35, 365-403, 1981; Hui et al., EMBO J., 3, 623-629, 1984). Ранее было показано, что мутация rhtA23 является заменой нуклеотидных остатков А на G в позиции 1 относительно стартового кодона ATG (ABSTRACTS of 17th International Congress of Biochemistry and Molecular Biology in conjugation with 1997 Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract No.457). Поэтому можно предположить, что мутация rhtA23 усиливает экспрессию гена rhtA и, как следствие, повышает устойчивость к треонину, гомосерину и некоторым другим субстанциям, экспортируемым из клетки.
Уровень экспрессии гена можно оценить путем измерения количества мРНК, транскрибируемой с целевого гена, с использованием различных известных методик, включая гибридизацию по Нозерну (Northern blotting), количественный метод ОТ-ПЦР (RT-PCR) и подобные им. Количество белка, кодируемого данным геном, может быть измерено с помощью известных методов, включающих метод SDS-PAGE с последующим иммуноблоттингом (Western blotting) и подобные ему.
Методами получения плазмидной ДНК, разрезания и лигирования ДНК, трансформации, выбора олигонуклеотидов в качестве праймеров и подобными им могут являться обычные методы, хорошо известные специалисту в данной области. Эти методы описаны, например, в книге Sambrook, J., Fritsch, E.F., and Maniatis, Т., “Molecular Cloning A Laboratory Manual, Second Edition”, Cold Spring Harbor Laboratory Press (1989).
Бактерия-продуцент L-аминокислоты
Бактерия, согласно настоящему изобретению, может быть получена путем усиления экспрессии генов, кодирующих белки, участвующие в транспорте ароматических L-аминокислот из клетки, в бактерии, которая, в действительности, обладает способностью продуцировать ароматические L-аминокислоты.С другой стороны, бактерия, согласно настоящему изобретению, может быть получена путем придания способности продуцировать ароматические L-аминокислоты бактерии, уже обладающей повышенной экспрессией генов, кодирующих белки, участвующие в транспорте ароматических L-аминокислот из клетки.
Способность к продукции ароматических аминокислот может быть природной способностью дикого штамма бактерии или способностью, которую приобретает бактерия в результате выведения.
В дальнейшем будут объяснены методы придания родительскому штамму отмеченной ранее способности продуцировать ароматические аминокислоты.
Для того чтобы придать бактерии, принадлежащей к роду Escherichia или Coryneform, способность продуцировать ароматические аминокислоты, могут быть использованы обычные методы выведения бактерий-продуцентов ароматических аминокислот. Например, могут быть использованы методы получения ауксотрофного мутантного штамма, аналог-устойчивого штамма или метаболическая регуляция мутантного штамма, обладающего способностью продуцировать L-аминокислоту, и методы создания рекомбинантного штамма, обладающего повышенной активностью ферментов, участвующих в биосинтезе L-аминокислот (“Amino Acid Fermentation”, the Japan Scientific Societies Press [Gakkai Shuppan Center], 1st Edition, published on May 30, 1986, pp.77-100). В результате использования этих методов для выведения бактерии-продуцента L-аминокислоты, бактерии могут быть приданы одно или более свойств, включая ауксотрофность, устойчивость к структурным аналогам сырьевого соединения и мутация, регулирующая метаболизм.
При создании рекомбинантного штамма может быть усилена активность одного или нескольких ферментов, участвующих в биосинтезе L-аминокислот. Кроме того, методы придания ауксотрофности, устойчивости к структурным аналогам сырьевого соединения и мутации, регулирующие метаболизм, могут сочетаться с методами усиления активности ферментов, участвующих в биосинтезе L-аминокислот.
Ауксотрофный мутантный штамм, штамм, устойчивый к аналогу L-аминокислоты или штамм с мутацией, регулирующей метаболизм, обладающий способностью к продукции L-аминокислот, может быть получен в результате обработки родительского или дикого штамма обычным мутагенным воздействием, таким как рентгеновские Х-лучи или облучение ультрафиолетовыми лучами, обработки мутагенным агентом, таким как N-метил-N’-нитро-N-нитрозогуанидин (NTG). Далее, ауксотрофный штамм, штамм, устойчивый к структурным аналогам сырьевого соединения, или штамм с мутацией, регулирующей метаболизм, который обладает способностью продуцировать L-аминокислоту, может быть отобран из мутировавших штаммов.
Бактерии, обладающие способностью продуцировать ароматические аминокислоты, могут быть получены путем усиления активности 3-дезокси-D-арабиногептулозонат-7-фосфатсинтазы (кодируемой геном aroG), 3-дегидрохиннатсинтазы (кодируемой геном aroB), шикиматкиназы (кодируемой геном aroL), хоризматмутазы (кодируемой геном aroA), хоризматсинтазы (кодируемой геном aroC) (заявка РСТ WO 02/38777).
2. Способ согласно настоящему изобретению
Способом согласно настоящему изобретению является способ получения L-аминокислоты, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-аминокислоты в питательной среде и выделения L-аминокислоты из культуральной жидкости.
Согласно настоящему изобретению выращивание, выделение и очистка L-аминокислоты из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием бактерии.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной средой, при условии, что указанная среда содержит источник углерода и источник азота и минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. Источник углерода для бактерии, принадлежащей к роду Methylophilus, включает компоненты С1, такие как метанол. Если метанол используется как основной источник углерода, то ароматические L-аминокислоты, такие как L-фенилаланин, могут быть получены по низкой цене. При использовании метанола в качестве главного источника углерода, его добавляют к культуральной среде в количествах от 0.001 до 30%. В качестве источника азота могут использоваться различные соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, натуральный источник азота, такой как пептон, гидролизат соевых бобов и ферментолизат микроорганизмов. В качестве минералов могут использоваться монофосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, экстракт дрожжей и подобные им соединения.
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно, выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем L-аминокислота может быть выделена и очищена методами ионообменной хроматографии, концентрирования и/или кристаллизации.
Краткое описание чертежей
На Фиг.1 изображена структура ПЦР-амплифицированного фрагмента ДНК, содержащего RBSfmd и гены yddG, yddL, yddK, yddJ из E. coli, которые кодируют полный набор белков для транспорта фенилаланина из клетки.
На Фиг.2 изображена структура делеционных производных, несущих ген yddG.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1. Клонирование, анализ и использование генов транспорта L-фенилаланина из клетки E. coli для штамма М. methylotrophus.
В заявке РСТ WO 03044192 A1 было описано, что усиление активности белка, кодируемого геном yddG из E. coli, приводит к повышению продукции L-аминокислоты, например, L-фенилаланина или L-триптофана бактерией E. coli, когда эта бактерия выращивалась в культуральной среде.
Поэтому было высказано предположение, что ген yddG кодирует белок транспорта L-фенилаланина из клетки.
Бактерия М. methylotrophus является удобной моделью для анализа генов транспорта L-фенилаланина из клетки, так как она не растет на среде, содержащей L-фенилаланин в высокой концентрации (2.0-5.0 г/л). При этом, активный транспорт L-фенилаланина из клетки придает бактерии М. methylotrophus устойчивость к фенилаланину.
Сначала с помощью ПЦР амплифицировали отдельный ген yddG из E. coli. Его амплифицировали с новым сайтом связывания рибосомы, AGGAGA, гена формамидазы (fmd) из бактерии М. methylotrophus (Mills, J. et al., Eur. J. Biochem., 251, p.45-53 (1998)) с применением двух синтетических праймеров PI (SEQ ID NO: 9) и Р2 (SEQ ID NO: 10). Праймер Р1 содержит сайт рестрикции SmaI и RBS из гена формамидазы бактерии М. methylotrophus. Праймер Р2 содержит сайт рестрикции KpnI. В качестве матрицы использовалась хромосомная ДНК штамма Е. coli MG1655.
Полученный амплифицированный фрагмент ДНК обрабатывали SmaI и KpnI рестриктазами и лигировали под контролем промотора Рtac в вектор pTACTER2, который предварительно обрабатывали теми же рестриктазами. Полученную таким образом плазмиду обозначили как pTYD6 (pTACTER2-PtacEco-RBSfmd-yddGEco).
Вектор pTACTER2 получали из вектора pAYCTER3 путем введения промотора Ptac. Для этой цели коммерчески доступный промотор Ptac (Pharmacia, Швеция) обрабатывали рестриктазами HindIII и BamHI и лигировали в вектор pAYCTER3, который предварительно обработали теми же рестриктазами.
Вектор pAYCTER3 является производным вектора pAYC32, среднекопийного и очень стабильного вектора, сконструированного на основе плазмиды RSF1010 (Christoserdov A.Y., Tsygankov Y.D, Broad-host range vectors derived from a RSF 1010 Tnl plasmid, Plasmid, 1986, v.16, pp.161-167). Вектор pAYCTER3 получили путем введения полилинкера из плазмиды pUC19 и сильного терминатора rrnB в плазмиду pAYC32 вместо ее природного терминатора. Детальная конструкция вектора pAYCTER3 описана в заявке РСТ WO 03044192 A1.
Далее, полученную таким образом плазмиду мобилизовали из штамма Е.coli S17-1 (McPheat, W.L., FEMS Microbiology Letters, 41, 185-188 (1987)) в штамм М. methylotrophus AS1. Штамм Methylophilus methylotrophus AS1 может быть получен из Национальной коллекции промышленных и морских бактерий (Address NCIMB Lts., Torry Research Station, 135, Abbey Road, Aberdeen AB98DG, United Kingdom).
Оба штамма, штамм AS1 и сконструированный штамм AS1/pTYD6, проверяли ферментацией в пробирках со средой 121, содержащей 2% метанола (условия ферментации и способ измерения концентрации L-фенилаланина: см. Пример 2 ниже). Результаты ферментации представлены в Таблице 1. Как следует из таблицы 1, природный штамм М. methylotrophus AS 1 не вырабатывает фенилаланин при условии, если только единичный ген yddG из Е. coli амплифицирован на плазмиде.
Было сделано предположение, что единичный ген yddG из Е. coli кодирует только внутренний белок мембраны, которого недостаточно для функционирования в качестве переносчика через внутреннюю и внешнюю мембраны в штамме М. methylotrophus. Таким образом, для формирования многокомпонентной системы транспорта фенилаланина из клетки бактерии М. methylotrophus необходимо найти и клонировать другие гены из Е. coli, помимо гена yddG.
Гены, расположенные вокруг гена yddG в геноме Е. coli, были проанализированы и было установлено, что несколько генов, расположенных после гена yddG, кодируют белки, гомологичные белкам внешней оболочки (поринам) из других бактерий. Эту группу генов Е. coli, состоящую из генов yddG, yddL, yddK and yddJ (Фиг.1), амплифицировали с помощью ПЦР, клонировали в pTACTER2 под контролем промотора Ptac и RBS гена формамидазы (fmd) и перенесли в штамм М. methylotrophus AS1.
Для этой цели группу генов yddG, yddL, yddK and yddJ амплифицировали с помощью ПЦР с применением праймеров PI (SEQ ID NO: 9) и Р3 (SEQ ID NO: 11). Праймер Р3 содержит сайт рестрикции SmaI.
Полученный таким образом амплифицированный фрагмент ДНК обрабатывали рестриктазой SmaI и лигировали под контролем промотора Ptac и RBS гена fmd в вектор pTACTER2, который предварительно обрабатывали той же рестриктазой. Полученную плазмиду обозначили pTBG4 (pAYCTER3-Ptac Eco-RBSMme-yddGEco-yddLEco-yddGEco-yddJEco). Далее полученную плазмиду pTBG4 мобилизовали из штамма Е. coli S17-1 (McPheat, W.L., FEMS Microbiology Letters, 41,185-188 (1987)) в штамм М. methylotrophus AS1.
Природный штамм М. methylotrophus AS 1 является чувствительным к высоким концентрациям фенилаланина и не растет в среде, содержащей 1 г/л или более L-фенилаланина. L-фенилаланин ингибирует единственную DAHP синтазу. Это свойство помогает выявить гены Е. coli, которые кодируют полный комплект белков, составляющих систему транспорта фенилаланина из клетки и функционирующую в штамме М. methylotrophus. Система активного транспорта L-фенилаланина из клетки Е. coli экспортирует L-фенилаланин из М. methylotrophus, снижает внутреннюю концентрацию L-фенилаланина и позволяет бактерии расти на среде, содержащей L-фенилаланин в высокой концентрации.
Несколько штаммов протестировали на устойчивость к L-фенилаланину. К ним относятся штаммы М. methylotrophus AS1/pTBG4 (pAYCTER3-Ptac Eco-RBSMme-yddGEco-yddLEco-yddKEco-yddJEco) (клоны No.7, No.8, No.9); AS1/pTYD6 (pAYCTER3-Ptac Eco-RBSMme-yddGEco); AS1/pAYCTER3. Эксперимент по проверке чувствительности/устойчивости к фенилаланину проводили по стандартной схеме. Штаммы выращивали в течение ночи в жидкой среде, далее разводили до концентрации клеток 105 клеток/мл и сеяли на чашки с агаром в среде 121, содержащей 1% метанола, 100 мг/л ампицилина и различные концентрации L-фенилаланина (г/л). Рост колоний анализировали через 72 часа. Результаты эксперимента представлены в Таблице 2.
Было установлено, что только штамм М. methylotrophus AS1/pTBG4, несущий четыре клонированных гена yddG-yddL-yddK-yddJ из E. coli, способен расти в среде, содержащей высокую концентрацию фенилаланина, такую как 5 г/л, 2.5 г/л или 1.2 г/л.
Штамм М. methylotrophus AS1/pTYD6, несущий единичный ген yddG, не рос в среде, содержащей высокую концентрацию фенилаланина (1.2, 2.5, 5 г/л), так же, как контрольный штамм AS1/pAYCTER3.
Кроме того, клон 8 штамма М. methylotrophus AS1/pTBG4 рос медленно в среде без L-фенилаланина. Это может означать, что система активного транспорта фенилаланина из клетки у E. coli (yddG-yddL-yddK-yddJ) действительно функцианирует в штамме М. methylotrophus AS1 и генерирует слабую ауксотрофность при условии роста в среде без L-фенилаланина.
Продукцию L-фенилаланина штаммом AS1 и тремя клонами штамма AS1/pTBG4 проверяли путем ферментации в пробирках в среде 121 с 2% метанола (условия ферментации и метод измерения концентрации L-фенилаланина приведены ниже в Справочном примере). Результаты ферментации представлены в Таблице 2. Из Таблицы 2 следует, что дикий штамм М. methylotrophus AS1, несущий плазмиду с активной системой транспорта фенилаланина из клетки, секретирует в среду около 0.06-0.11 г/л L-фенилаланина.
Для подтверждения того факта, что все четыре гена E. coli необходимы для нормального функционирования системы транспорта фенилаланина из клетки М. methylotrophus, с помощью доступных рестриктаз сконструировали две делетированные плазмиды, производные от плазмиды pTBG4, несущие два и три гена транспорта фенилаланина из клетки (Фиг.2), и проверили устойчивость штаммов AS1, несущих такие производные палзмиды, к L-фенилаланину и продукцию L-фенилаланина такими штаммами.
Производная плазмиды pTBG4, делетированная по сайтам HpaI-Smal, плазмида рВНА2 (pAYCTER3-Ptac-RBSfmd-yddGEco-yddLEco), содержит только два гена E. coli и не придает устойчивость к L-фенилаланину. Штамм AS1, несущий эту производную плазмиду, не растет на среде, содержащей 3 г/л L-фенилаланина и не секретирует L-фенилаланин в среду. Это означает, что система транспорта L-фенилаланина из клетки не полная.
Производная плазмиды pTBG4, делетированная по сайтам HindIII, плазмида pBHIN3 (pAYCTER3-Ptac-RBSfmd-yddGEco-yddLEco-yddKEco), содержит три гена E. coli. Штамм AS 1, несущий эту производную плазмиду, также не растет в среде, содержащей 3 г/л L-фенилаланина, и не секретирует L-фенилаланин в среду. Этот результат означает, что все четыре гена Е.coli, а именно гены yddG, yddL, yddK и yddJ, необходимы штаммам М. methylotrophus для секреции L-фенилаланина.
Пример 2. Процедура ферментации штаммов М. methylotrophus и измерение концентрации L-фенилаланина.
1. Состав среды и процедура культивирования в пробирке и во флаконе
Выращивание штаммов М. methylotrophus проводилось при температуре 30°С в 5 мл среды 121 (Fe2, Fe3), содержащей 2% метанола и 3% карбоната кальция в пробирках (18 мм в диаметре) в течение 48-72 часов при встряхивании на шейкере в режиме 240 об/мин. Состав среды 121 (Fe2, Fe3) из расчета на 1 литр:
| К2HPO43H2O |
1.57 г |
| КН2PO4 |
0.62 г |
| (NH4)2SO4 |
3 Г |
| NaCl |
0.1 г |
| MgSO47H2O |
0.2 г |
| CaCl2 |
0.025 г |
| EDTA-Na2 |
5 мг |
| FeSO47H2O |
3 мг |
| FeCl36Н2О |
10 мг |
| MnSO45Н2О |
0.01 мг |
| ZnSO47H2O |
0.07 мг |
| Na2MoO42H2O |
0.01 мг |
| Н3ВО3 |
0.01 мг |
| CoCl26H2O |
0.005 мг |
| CuSO45H2O |
0.005 мг |
| Метанол |
20 мл (стерилизованный фильтрованием) |
| СаСО3 |
30 г |
рН 7.0. Первоначальный объем среды в пробирках для ферментации: 5 мл.
Посевная культура выращивалась в 5 мл такой же жидкой среды без СаСО3 в пробирках в течение 24 часов со встряхиванием в режиме 240 об/мин при температуре 30°С. Размер инокулята составлял 10%. Температура поддерживалась около 30°С. Перемешивание на мешалке – 240 об/мин.
2. Измерение концентрации L-фенилаланина.
Концентрацию L-фенилаланина измеряли флуорометрическим методом, описанным в, к примеру, McCaman, M.W. and Robins, E. (J. Lab. Clin. Med., 59, No.5, 885-890 (1962)). Фенилаланин вступает в реакцию с нингидрином в присутствии ионов меди с образованием сильно флуоресцирующего комплекса. Флуоресценция значительно усиливается в присутствии дипептида L-Leu-L-Ala в реакционной смеси. Интенсивность флуоресценции, измеренная на флуориметре, пропорциональна концентрации фенилаланина.
Хотя указанное изобретение описано в деталях со ссылкой на Наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.
| Таблица 1 |
| Штамм |
Клонированный ген |
Phe, г/л |
| AS1 |
– |
0.02 |
| ASl/pTYD6 |
Ptac Eco-RBSMme-yddGEco |
0.02 |
| Таблица 2 |
| Штамм и клонированные гены |
Рост в присутствии L-фенилаланина, г/л |
| 0 |
0.3 |
0.6 |
1.2 |
2.5 |
5 |
10 |
| AS1/pAYCTER3 |
+ |
+ |
+ |
– |
– |
– |
– |
| AS1/pTYD6(yddG) |
+ |
+ |
+ |
– |
– |
– |
– |
| AS1/pTBG4 No.7 |
+ |
+ |
+ |
+ |
++ |
++ |
– |
| (yddG+b1472+b1471+b1470) |
|
|
|
|
|
|
|
| AS1/pTBG4 No.8 |
+/- |
+/- |
+ |
+ |
++ |
++ |
– |
| (yddG+b1472+b1471+b1470) |
|
|
|
|
|
|
|
| AS1/pTBG4 No.9 |
+ |
+ |
+ |
+ |
+ |
+ |
– |
| (yddG+b1472+b1471+b1470) |
|
|
|
|
|
|
|
| +/- соответствует слабому росту миниколоний; + соответствует нормальному росту; ++ соответствует хорошему росту |
| Таблица 3 |
| Штамм |
Клонированные гены |
Phe, г/л |
| AS1 |
– |
0.03 |
| AS1/pAYCTER3 |
– |
0.05 |
| AS1/pTBG4 No.7 |
Ptac-RBSfmd-yddG+yddL+yddK+yddJ |
0.06 |
| AS1/pTBG4 No.9 |
Ptac-RBSfmd-yddG+yddL+yddK+yddJ |
0.09 |
| AS1/pTBG4 No.8 (leaky) |
Ptac-RBSfmd-yddG+yddL+yddK+yddJ |
0.11 |
Формула изобретения
1. Бактерия, принадлежащая к роду Methylophilus, обладающая способностью к продукции ароматических L-аминокислот, модифицированная таким образом, что в указанной бактерии усилена экспрессия генов yddG, yddL, yddK и yddJ, кодирующих белки, участвующие в транспорте ароматических L-аминокислот из клетки.
2. Бактерия по п.1, отличающаяся тем, что указанные гены получены из бактерии, принадлежащей к роду Escherichia.
3. Бактерия по п.1, отличающаяся тем, что указанная экспрессия усилена путем
модификации последовательности, контролирующей экспрессию указанных генов.
4. Бактерия по п.1, отличающаяся тем, что указанная экспрессия усилена путем увеличения числа копий указанных генов.
5. Бактерия по п.1, отличающаяся тем, что указанная ароматическая L-аминокислота выбрана из группы, состоящей из L-фенилаланина, L-тирозина и L-триптофана.
6. Бактерия по п.5, отличающаяся тем, что указанной ароматической L-аминокислотой является L-фенилаланин.
7. Бактерия по п.1, отличающаяся тем, что указанная бактерия принадлежит к виду Methylophilus methylotrophus.
8. Способ получения ароматической L-аминокислоты, включающий: выращивание бактерии по любому из пп.1-7 в питательной среде, содержащей метанол в качестве основного источника углерода, вызывающее продукцию и накопление указанной ароматической L-аминокислоты в культуральной жидкости; и выделение указанной L-аминокислоты из культуральной жидкости.
9. Способ по п.8, отличающийся тем, что указанная ароматическая L-аминокислота выбрана из группы, состоящей из L-фенилаланина, L-тирозина и L-триптофана.
10. Способ по п.9, отличающийся тем, что указанная ароматическая L-аминокислота является L-фенилаланином.
РИСУНКИ
|
|