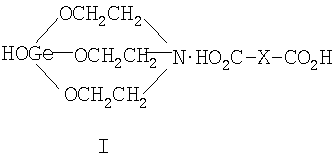Патент на изобретение №2333912
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СОЛИ 1-ГИДРОКСИГЕРМАТРАНА С ОКСИ-, КЕТО- И ДИКАРБОНОВЫМИ КИСЛОТАМИ
(57) Реферат:
Данное изобретение относится к элементоорганической химии и химической технологии. Описаны новые соли 1-гидроксигерматрана с окси-, кето- и дикарбоновыми кислотами, а именно 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилаты. Созданы новые вещества повышенной чистоты, получено расширение знаний о структуре соединений 1-гидроксигерматрана с окси-, кето- и дикарбоновыми кислотами, что расширяет класс соединений 1-гидроксигерматрана. Новые соли биоактивны, с широким спектром действия, могут найти применение в качестве новых средств в фармакотерапии, в медицине, медицинской, фармацевтической и пищевой промышленности, в том числе детском питании, для очистки воды, в косметологии, парфюмерии, стоматологии. 5 н.п.ф-лы, 3 табл.
Область техники Данное изобретение относится к элементоорганической химии, химической технологии, конкретно, к новым солям 1-гидроксигерматрана с окси-, кето- и дикарбоновыми кислотами, а именно 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилатам формулы (I):
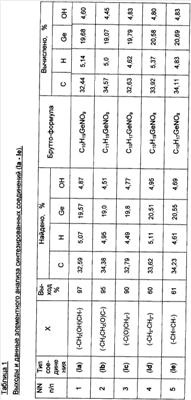
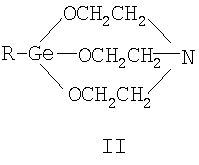
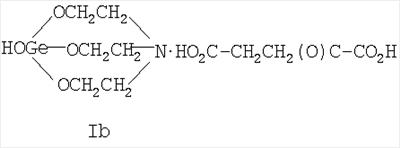
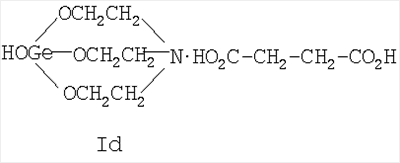
где Х=(-CH2(OH)CH-) (Ia), (-СН2СН2(O)С-) (Ib), (-С(О)СН2-) (Ic), (-CH2-CH2-) (Id), (-СН=СН-) (Ie). Предшествующий уровень техники Известны [Патент RU 2104032 [ООО «СНЕЖНЫЙ БАРС», ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А.] 17.08.1998, C07F 7/30, А61К 31/28 и Патент RU 2104033 [ООО «СНЕЖНЫЙ БАРС», ЩЕРБИНИН В.В, ЧЕРНЫШЕВ Е.А.] 17.08.1998, C07F 7/30, А61К 31/28] германийорганические соединения – производные 1-гидроксигерматрана, содержащие в качестве заместителя у атома Ge известный лекарственный препарат – например, ацикловир, или ацетилсалициловую кислоту, или парацетамол, или анальгин, или индометацин, или фталазол, или ампициллин, или адреналин, в соответствии с формулой (II):
где R – ОН, или органический радикал, или элементорганический радикал, в том числе лекарственный препарат или в соответствии с формулой (III), записанной в общем виде
где R1÷R12 – H, или органический радикал, X – О или S. Производные 1-гидроксигерматрана (II, R – ОН, или органический радикал, или элементорганический радикал), содержащие в качестве заместителя кислоты – ацетилсалициловую кислоту, ампициллин в [Патент RU 2104032 [ООО «СНЕЖНЫЙ БАРС», ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А.] 17.08.1998, C07F 7/30, А61К 31/28] названы германиловыми эфирами (см. таблицу 9 [Патент RU 2104032 [ООО «СНЕЖНЫЙ БАРС», ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А.] 17.08.1998, C07F 7/30, А61К 31/28]), а в [Патент RU 2104033 [ООО «СНЕЖНЫЙ БАРС», ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А.] 17.08.1998, C07F 7/30, А61К 31/28] – герматраниловыми эфирами ацетилсалициловой и пенициллановой кислот. Известны германийорганические соединения с органической кислотой (см. [Патент RU 2233286 [СОЛОВЬЕВ Е.В, ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А., КОТРЕЛЕВ М.В.] 17.08.1998, C07F 7/30, А61К 31/28]), в котором рассматриваются комплексы германийорганического соединения с лекарственными препаратами или биологически активными веществами общей формулы Lk(ГОС)m(Раств.)n (IV), где L – лекарственный препарат или биологически активное вещество (в том числе, ацетилсалициловая кислота, никотиновая кислота, аминокислоты и т.д.), k В источнике [Патент RU 2233286 [СОЛОВЬЕВ Е.В., ЩЕРБИНИН В.В, ЧЕРНЫШЕВ Е.А., КОТРЕЛЕВ М.В.] 17.08.1998, C07F 7/30, А61К 31/28] на с.5 упоминается о возможности донорно-акцепторного взаимодействия атома азота в молекуле ГОС с карбоксильной (тиокарбоксильной) группой лекарственного препарата или биологически активного вещества, но при этом соединение L в формулах (IV) координирует с атомом Ge. В данном источнике [Патент RU 2233286 [СОЛОВЬЕВ Е.В., ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А., КОТРЕЛЕВ М.В.] 17.08.1998, C07F 7/30, А61К 31/28] рассматриваются только комплексы германийорганических соединений с органическими кислотами. В известных рассмотренных источниках, наиболее близких к предлагаемому изобретению, часть которых приведена здесь, не имеется каких-либо сведений об образовании солей герматранов, в частности с лекарственными препаратами или биологически активными веществами, в том числе с окси-, кето- и дикарбоновыми кислотами. Способов получения комплексов или других соединений ГОС (III) с лекарственными средствами, органическими и неорганическими соединениями в патентах [Патент RU 2104032 [ООО «СНЕЖНЫЙ БАРС», ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А.] 17.08.1998, C07F 7/30, А61К 31/28] и [Патент RU 2104033 [ООО «СНЕЖНЫЙ БАРС», ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А.] 17.08.1998, C07F 7/30, А61К 31/28] не описано. Известный способ получения комплекса формулы (IV) с ацетилсалициловой кислотой ([Патент RU 2233286 [СОЛОВЬЕВ Е.В., ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А., КОТРЕЛЕВ М.В.] 17.08.1998, C07F 7/30, А61К 31/28], с.14) осуществляется путем смешивания 0,1 М раствора ацетилсалициловой кислоты в этаноле (100 мл этанола) и 0,1 М раствора 1-этил-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3.01.5]-ундекан-3,7,10-триона (75 мл этанола) на магнитной мешалке в течение 14 часов при комнатной температуре и выделением из раствора на роторном испарителе. Выход 89%, температура плавления Тпл. равна 230-231°С. По данным авторов [Патент RU 2233286 [СОЛОВЬЕВ Е.В., ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А., КОТРЕЛЕВ М.В.] 17.08.1998, C07F 7/30, А61К 31/28], результаты рентгеноструктурного анализа подтверждают наличие координационного взаимодействия между атомами германия и кислорода активной функциональной группы, длина связи составляет 1,8 А0. Тип взаимодействия ГОС (II, R – этил) и активной функциональной группы ацетилсалициловой кислоты, по мнению авторов, имеет вид комплекса с 6-ти валентным атомом Ge:
Среди описанных примеров в [Патент RU 2233286 [СОЛОВЬЕВ Е.В., ЩЕРБИНИН В.В., ЧЕРНЫШЕВ Е.А., КОТРЕЛЕВ М.В.] 17.08.1998, C07F 7/30, А61К 31/28] (см. три примера на с.14) получения комплексов отсутствует пример получения германийорганического соединения с окси-, кето- и дикарбоновыми кислотами. Нами также не найдены какие-либо упоминания о германийорганических соединениях с окси-, кето- и дикарбоновыми кислотами ни в каких известных нам источниках. Раскрытие изобретения Техническим результатом предложенного изобретения является создание новых веществ повышенной чистоты, расширение знаний о структуре соединений 1-гидроксигерматранов, а именно соединений 1-гидроксигерматрана с окси-, кето- и дикарбоновыми кислотами (с яблочной кислотой, с Поставленный технический результат достигается тем, что предложены германийорганические соединения, представляющие собой 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилаты следующей общей формулы (I)
где Х=(-СН2(ОН)СН-) (Ia), (-CH2CH2(O)C-) (Ib), (-C(O)CH2-) (Ic), (-CH2-СН2-) (Id), (-СН=СН-) (Ie), и для каждой окси-, кето- и дикарбоновой кислоты предложенное германийорганическое соединение, соответственно, называется: – 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий малат или, иначе, соль 1-гидроксигерматрана с яблочной кислотой, при этом формула (I) имеет вид [далее «формула (Ia)»]: – – 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3,3.3]ундеканий – 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий оксалоацетат или, иначе, соль 1-гидроксигерматрана с щавелевоуксусной кислотой, при этом формула (I) имеет вид [далее «формула (Ic)»]: – – 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий сукцинат при Х=(-СН2-СН2-), иначе, соль 1-гидроксигерматрана с янтарной кислотой, при этом формула (I) имеет вид [далее «формула (Id)»]: – – 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий фумарат или, иначе, соль 1-гидроксигерматрана с фумаровой кислотой, при этом формула (I) приобретает вид [далее «формула (Ie)»]: –
Отличием предложенных соединений формулы (I) является то, что предложены новые, ранее неизвестные соединения 1-гидроксигерматранов, объединенные единым замыслом. Предложенные соединения 1-гидроксигерматрана (I) являются солями 1-гидроксигерматрана с окси-, кето- и дикарбоновыми кислотами, (далее «соли 1-гидроксигерматрана (I)», а при рассмотрении солей с каждой кислотой в отдельности – «соль 1-гидроксигерматрана с (соответствующей) кислотой (Ia-Ie) соответственно»). Не описаны в литературе ни их структура, ни их свойства. Также не были ранее известны какие-либо упоминания об использовании подобных соединений (I). Совершенно неочевидным оказался факт образования «внешней ионной пары» с некоторой координацией между атомом азота и атомом углерода карбонильной группы. Образование солей 1-гидроксигерматрана (I), очевидно, происходит за счет разрыва внутримолекулярного донорно-акцепторного взаимодействия Ge Предложенные соли 1-гидроксигерматрана (I) были получены путем взаимодействия 1-гидроксигерматрана (II, R=OH) с соответствующей окси-, кето-, дикарбоновой кислотой в водном растворе, чем обеспечена дешевизна и простота получения предложенных солей при выходах 60-97% и высокой чистоте получаемого продукта. Нами выявлена неочевидная возможность получения солей 1-гидроксигерматрана с окси-, или кето-, или дикарбоновыми кислотами по третичному атому азота. Основные известные особенности герматранов, связанные с существованием внутримолекулярного донорно-акцепторного взаимодействия азот – германий (Ge Поэтому совершенно неожиданным оказался факт образования предложенных солей 1-гидроксигерматрана с окси-, или кето-, или дикарбоновыми кислотами в водной среде, очевидно, за счет разрыва внутримолекулярного донорно-акцепторного взаимодействия Ge Убедительным доказательством образования предложенных солей 1-гидроксигерматрана (I) по атому азота также служат обнаруженные сильные смещения химических сдвигов протонов ( Сказанное выше подтверждает наличие критериев изобретения – «новизны» и «изобретательского уровня». Технологическая реализация изобретения не представляет трудностей, весьма проста и технологична, основана на известных технологических химических процессах получения химических соединений, что отвечает выполнению критерия «промышленная применимость». Варианты осуществления изобретения В дальнейшем изобретение поясняется конкретными вариантами осуществления способа получения солей 1-гидроксигерматрана с окси-, или кето-, или дикарбоновыми кислотами [1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилатов формулы (I)]. Далее приводится ряд примеров из всей совокупности проведенных экспериментов. Пример 1. Получение соли 1-гидроксигерматрана с яблочной (оксикарбоновой) кислотой формулы (I, Х=-CH2(OH)CH-) (Ia). В трехгорлую круглодонную колбу, емкостью 500 мл, снабженную термометром, мешалкой и обратным холодильником, помещают при перемешивании 50,8 г (0,2 моль) 1-гидроксигерматрана (II, R-ОН), 34,9 г (0,26 моль) яблочной кислоты и 350 мл дистиллированной воды. Реакционную смесь перемешивают при 80°С в течение 20 минут. Далее прозрачный водный раствор помещают в одногорлую круглодонную колбу емкостью 1 л и отгоняют на роторном испарителе (60°С, 10-15 мм рт.ст.) 270-280 мл воды. Далее маточный раствор охлаждают до комнатной температуры и вводят 160 мл спирта. Полученный раствор перемешивают на роторном испарителе при комнатной температуре в течение 30 минут и далее отгоняют азеотроп (вода-спирт) при 50°С (±0,05°С) и остаточным давлением 15-20 мм рт.ст. После образования белого сухого продукта остаточное давление понижают до 2-5 мм рт.ст. и вакуумируют дополнительно 3-4 часа. Получают 75,3 г соли 1-гидроксигерматрана с яблочной кислотой формулы (I, X=-СН2(ОН)СН-) (Ia). Выход – 97,0%. После этого продукт измельчают и упаковывают в герметичную тару. Данные элементного анализа полученного соединения (Ia) представлены в таблице 1. Спектр протонного магнитного резонанса ПМР (20% раствор в D2O, стандарт СН3CN), полученный на приборе Bruker AM-360, имеет 2 характерных для герматрановой структуры триплета ( Пример 2. Получение соли 1-гидроксигерматрана с Получение проводят согласно процедуре, описанной в примере 1, только загружают 29,2 г (0,2 моль) Данные элементного анализа упомянутой соли (Ib) представлены в таблице 1, а данные спектра протонного магнитного резонанса ПМР – в таблице 2. Пример 3. Получение соли 1-гидроксигерматрана с щавелевоуксусной (кетокарбоновой) кислотой формулы (I, Х=-С(O)СН2-) (Ic). Получение проводят согласно процедуре, описанной в примере 1, только загружают 26,4 г (0,2 моль) щавелевоуксусной кислоты, реакционную смесь перемешивают при комнатной температуре (20°С) в течение 24 часов. После сушки получают 69,5 г соли 1-гидроксигерматрана с щавелевоуксусной кислотой формулы (I, Х=-СН=СН-) (Ic). Выход – 90,0% Данные элементного анализа упомянутой соли (Ic) представлены в таблице 1, а данные спектра протонного магнитного резонанса ПМР – в таблице 2. Пример 4. Получение соли 1-гидроксигерматрана с янтарной (дикарбоновой) кислотой формулы (I, Х=-CH2-CH2-) (Id). Получение проводят согласно процедуре, описанной в примере 1, только загружают 23,6 г (0,2 моль) янтарной кислоты, реакционную смесь перемешивают при 80°С в течение 30 минут. После сушки получают 44,6 г соли 1-гидроксигерматрана с янтарной кислотой формулы (I, Х=-СН2-СН2-) (Id). Выход – 60,0%. Данные элементного анализа упомянутой соли (Id) представлены в таблице 1, а данные спектра протонного магнитного резонанса ПМР – в таблице 2. Пример 5. Получение соли 1-гидроксигерматрана с фумаровой (дикарбоновой) кислотой формулы (I, Х=-СН=CH-) (Ie). Получение проводят согласно процедуре, описанной в примере 1, только загружают 23,2 г (0,2 моль) фумаровой кислоты, реакционную смесь перемешивают при температуре 50°С в течение 60 минут. После сушки получают 45,1 г соли 1-гидроксигерматрана с фумаровой кислотой формулы (I, Х=-СН=СН-) (Ie). Выход – 61,0%. Данные элементного анализа упомянутой соли (Ie) представлены в таблице 1, а данные спектра протонного магнитного резонанса ПМР – в таблице 2. Полученные в примерах 1-5 соли 1-гидроксигерматрана (I) формул (Ia) – (Ia) представляют собой белые порошки, растворимые в воде. Они не плавятся, а при нагревании разлагаются. Неспособность предложенных солей 1-гидроксигерматрана (I) формул (Ia) – (Ia) давать стабильную жидкую фазу при нагревании и нерастворимость их в таких растворителях как хлороформ, бензол, толуол, эфир, диоксан, конечно, не характерны для простых ковалентно построенных соединений. Все это, а также повышенная чувствительность к влаге, указывает на наличие сильных электростатических сил, удерживающих молекулы в специфических положениях кристаллов и придающих соединениям (I) солеобразные свойства – «внешней ионной пары» с некоторой координацией между атомом азота и атомом углерода карбонильной группы. Данные предложенные соединения 1-гидроксигерматрана (I) получены с высокой чистотой и с выходом (60-97%). Нами впервые предложены новые неизвестные ранее соли 1-гидроксигерматрана с окси-, кето-, дикарбоновыми кислотами (I). Получено расширение сведений о свойствах трициклических соединений, содержащих атомы германия и азота – герматранов. Следовательно, получено расширение знаний о структуре 1-гидроксигерматранов с органическими кислотами, расширение ряда классов соединений 1-гидроксигерматранов, расширение класса солей. Способ получения весьма прост, технологичен и не дорог, отсутствуют препятствия для его использования в химической промышленности. Кроме того, нами проведены исследования по определению показателей их биологической активности и токсичности заявленных соединений (Ia-Ie) для определения возможности их реализации. 1. Определение противовирусной активности соединений (Ia-Ie) Для исследования по определению показателей биологической активности соединений (Ia-Ie) были взяты: – вирус гриппа А, референс-штамм, рекомендованный экспертами ВОЗ для производства диагностических и вакцинных препаратов – А/Новая Каледония/20/99 (H1N1), чувствительный к ремантадину и арбидолу, а также – эпидемический вариант вируса гриппа В – В/Хабаровск/57/05, подобный эталону В/Шанхай/362/01, в отношении которого ранее была установлена активность противовирусного препарата арбидол. Определение противовирусных активностей соединений 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилатов формул (Ia-Ie) было проведено по снижению экспрессии вирусных антигенов, выявляемой методом иммунноферментного анализа (ИФА) в культуре клеток MDCK при заражении клеточной культуры вирусами гриппа А и В в присутствии различных концентраций исследуемых заявленных соединений. На монослой клеток культуры тканей наносили соединения (Ia-Ie) за два часа до инфицирования. Каждое разведение вируса исследовали в 3-х повторах, для которых вычисляли среднее значение оптической плотности при длине волны 492 нм (ОП-492). Результаты изучения активности соединений (Ia-Ie) представлены в Таблице 3 – «Снижение репродукции вирусов гриппа А и В в культуре клеток MDCK при добавлении соединений (Ia-Ie) по сравнению с контролем, (%)» Полученные результаты выявили активность соединений (Ia-Ie) в отношении вирусов гриппа. Причем наибольшее снижение активности вируса гриппа А (40,0-55,0%) было отмечено для всех соединений (Ia-Ie) при концентрации 250 мкг/мл и дальнейшее ее увеличение до 1000 мкг/мл не привело к усилению ингибирующей активности. В то же время для вируса гриппа В отмечена более низкая активность соединений (Ia-Ie), которая при концентрации 200 мкг/мл для соединения (Ie) составила 23,0% и при 500 мкг/мл – 34,0%. Изучено комбинированное действие соединения (Ie) и ремантадина. В Таблице 3 представлены результаты – выявлено усиление эффекта снижения репродукции вируса гриппа A (H1N1), по сравнению с таковыми, полученными в отношении каждого из них при низких концентрациях (см. Таблицу 3). Комбинация соединения (Ie) с концентрацией 100 мкг/мл и ремантадина, взятом в концентрации (0,05 мкг.мл), ингибировали репродукцию вируса гриппа А на 100%. 2. Острая токсичность Определение острой токсичности проводили на нелинейных белых мышах-самцах массой 18-20 г при однократном внутрижелудочном (в/ж) введении в дозах 1000, 2000, 3000, 4000 и 5000 мг/кг 20% водного раствора по 0,1, 0,2, 0,3, 0,4 и 0,5 мл на 20 г массы мыши соответственно. Проводили введение каждого из соединений 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилатов формул (Ia-Ie), в отдельности. В течение 14 дней после введения каждого из соединений (Ia-Ie) не обнаружено признаков интоксикации, отставания прироста массы тела и гибели животных. В интервале исследованных доз не наблюдалось какого-либо нарушения движений животных, рефлексов и поведения. Анатомические исследования не обнаружили изменений в легких, почках, селезенке и других органах. Для мышей величина LD50 для исследованных соединений (Ia-Ie) составила более 5000 мг/кг, что позволяет отнести их к IV классу опасности в соответствии с классификацией опасности веществ по степени воздействия на организм по ГОСТу 12.1.007-76. или к V классу токсичности (практически нетоксичным веществам) по Hodge, Sterner (1943). Приведенные примеры позволяют определить предложенные соединения – 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилаты формул (Ia-Ie) – как биологически активные вещества. Нами получены новые биологически активные вещества, являющиеся новыми неизвестными ранее солями 1-гидроксигерматрана с окси-, кето-, дикарбоновыми кислотами (I). Получено расширение ряда биологически активных герматранов с органическими кислотами. Промышленная применимость Полученные новые соединения – соли 1-гидроксигерматрана с окси-, кето-, дикарбоновыми кислотами используются в промышленности, в частности в химической промышленности, а также, как показали исследования, упомянутые предложенные соли являются биологически активными веществами, могут найти применение в качестве новых средств в фармакотерапии, в медицине, медицинской, фармацевтической и пищевой промышленности, в том числе детском питании, для очистки воды, в косметологии, парфюмерии, стоматологии.
Формула изобретения
1. Германийорганическое соединение, представляющее собой 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилат следующей общей формулы (I):
называемый 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий малат при Х=(-СН2(ОН)СН-) (1а), иначе, соль 1-гидроксигерматрана с яблочной кислотой формулы (1а). 2. Германийорганическое соединение, представляющее собой 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилат следующей общей формулы (I):
называемый 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий 3. Германийорганическое соединение, представляющее собой 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилат следующей общей формулы (I):
называемый 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий оксалоацетат при Х=(-С(O)СН2) (1с), иначе, соль 1-гидроксигерматрана с щавелевоуксусной кислотой формулы (1с). 4. Германийорганическое соединение, представляющее собой 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилат следующей общей формулы (I):
называемый 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий сукцинат при X=(-CH2-CH2-) (1d), иначе, соль 1-гидроксигерматрана с янтарной кислотой формулы (1d). 5. Германийорганическое соединение, представляющее собой 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий карбоксилат следующей общей формулы (I):
называемый 1-гидрокси-1-герма-2,8,9-триокса-5-азатрицикло[3.3.3]ундеканий фумарат при Х=(-СН=СН-) (1е), иначе, соль 1-гидроксигерматрана с фумаровой кислотой формулы (1е).
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 27.12.2008
Извещение опубликовано: 10.02.2010 БИ: 04/2010
NF4A – Восстановление действия патента СССР или патента Российской Федерации на изобретение
Дата, с которой действие патента восстановлено: 10.02.2010
Извещение опубликовано: 10.02.2010 БИ: 04/2010
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

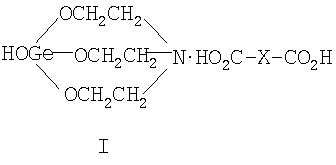
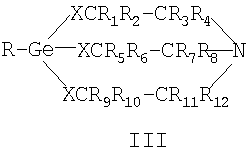
 1, m
1, m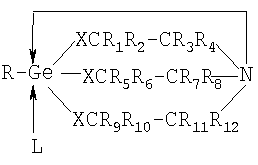
 -кетоглутаровой кислотой, с щавелевоуксусной кислотой, с янтарной кислотой, с фумаровой кислотой), расширение ряда классов соединений 1-гидроксигерматранов, расширение класса солей.
-кетоглутаровой кислотой, с щавелевоуксусной кислотой, с янтарной кислотой, с фумаровой кислотой), расширение ряда классов соединений 1-гидроксигерматранов, расширение класса солей.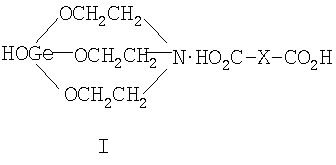
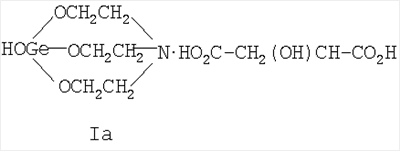
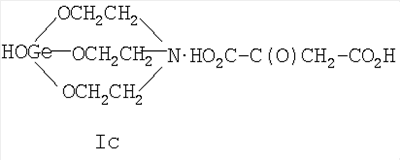
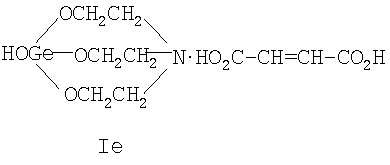
 N в исходном 1-гидроксигерматране (II, R=OH), образования свободной пары электронов у атома азота, взаимодействующей с карбонильной группой (С=О).
N в исходном 1-гидроксигерматране (II, R=OH), образования свободной пары электронов у атома азота, взаимодействующей с карбонильной группой (С=О). , м.д.) атранового остова (скелета) у атома азота (CH2N)=0,41-0,42 м.д. в сторону слабого поля у предложенных солей 1-гидроксигерматрана (I) по сравнению с исходными 1-гидроксигерматранами (II, R=OH) в полярном растворителе D2O.
, м.д.) атранового остова (скелета) у атома азота (CH2N)=0,41-0,42 м.д. в сторону слабого поля у предложенных солей 1-гидроксигерматрана (I) по сравнению с исходными 1-гидроксигерматранами (II, R=OH) в полярном растворителе D2O.