Патент на изобретение №2333222
|
||||||||||||||||||||||||||
(54) ЭПИМЕРИЗОВАННЫЕ ПРОИЗВОДНЫЕ ПОЛИСАХАРИДА К5 С ВЫСОКОЙ СТЕПЕНЬЮ СУЛЬФАТИРОВАНИЯ
(57) Реферат:
Описан способ гиперсульфатирования эпи-К5-N-сульфата для получения эпи-К5-амин-O-гиперсульфата с очень высокой степенью сульфатирования, который при последующем N-сульфатировании дает новые производные эпи-К5-N,O-гиперсульфата со степенью сульфатирования 4-4,6, практически лишенные активности на параметры свертывания крови и полезные для получения фармацевтических композиций, обладающих антидерматитной и противовирусной активностью. Также описаны новые низкомолекулярные эпи-К5-N-сульфаты, применимые в качестве промежуточных продуктов при получении соответствующих производных НМ эпи-К5-N,O-гиперсульфатов. 5 н. и 50 з.п. ф-лы.
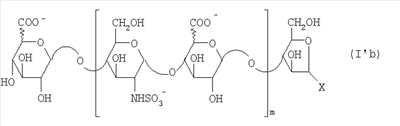
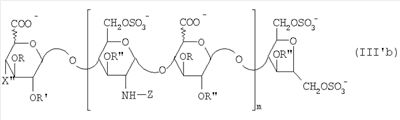
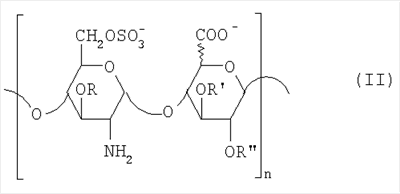
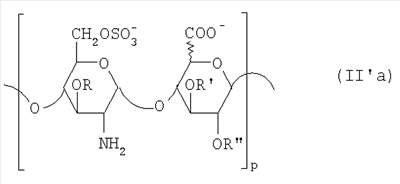
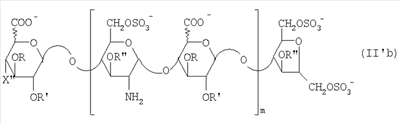
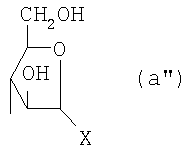
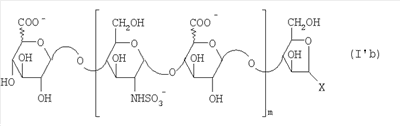
Область техники, к которой относится изобретение Настоящее изобретение касается новых производных полисахарида К5 с высокой степенью сульфатирования, способа их получения, новых сильно O-сульфатированных промежуточных продуктов, полезных при их синтезе, и фармацевтических композиций, содержащих данные производные полисахарида К5 в качестве активных ингредиентов, практически лишенных активности на свертываемость крови. В частности, изобретение касается способа получения эпи-К5-N,O-гиперсульфатов, исходя из полисахарида К5, предварительно N-деацетилированного, N-сульфатированного и С5-эпимеризованного, по меньшей мере, на 20%, путем O-гиперсульфатирования в подходящих условиях и последующего N-сульфатирования, а также касается данных эпи-К5-N,O-гиперсульфатов, обладающих антиангиогенной и антивирусной активностью, и новых низкомолекулярных промежуточных продуктов для эпи-К5-N-сульфатов. Уровень техники Гликозаминогликаны, такие как гепарин, гепарансульфат, дерматансульфат, хондроитинсульфат и гиалуроновая кислота, – это биополимеры, которые в промышленности экстрагируют из различных органов животных. В частности, гепарин, который в основном получают экстрагированием из слизистой оболочки кишечника свиней или легких крупного рогатого скота, является полидисперсным полимером с молекулярным весом приблизительно в пределах от 3000 до 30000 Д, состоящим из смешанных цепей, в основном состоящих из уроновой кислоты (глюкуроновой или идуроновой кислоты) и аминосахара (глюкозамина), соединенных между собой связями Свойства и естественный биосинтез гепарина у млекопитающих описаны в Lindahl et al., 1986 in Lane D. and Lindahl U. (Editors) “Heparin. Chemical and Biological Properties, Clinical Applications”, Edward Arnold, London, Pages 159-190; Lindahl U., Feingold D.S. and Roden L., 1986 TIBS, 11, 221-225; Conrad H.E. “Heparin Binding Proteins”, Chapter 2: Structure of Heparinoids. Academic Press, 1998. Биосинтез гепарина происходит, начинаясь с его предшественника N-ацетилгепарозана, состоящего из смешанных цепей, состоящих из повторяющихся звеньев дисахарида глюкуронил- В природе образование активного пентасахарида осуществляется посредством реакции эпимеризации карбоксила некоторой части глюкуроновых звеньев в идуроновые звенья под действием глюкуронил-С5-эпимеразы (С5-эпимеризация) и соответствующего сульфатирования, которое также ведет к введению сульфатной группы в гидроксил в положении 3 глюкозамина. В частности, в природе образование активного пентасахарида осуществляется таким образом, что С5-эпимеризация происходит отдельными “кластерами”, то есть на части цепей, и в большой степени, при этом образуется продукт, содержащий больше идуроновых звеньев, чем глюкуроновых. В самом деле, коммерческий гепарин содержит примерно 70% идуроновых звеньев и 30% глюкуроновых звеньев. Наряду с основным антикоагуляционным и антитромботическим действием гепарин также оказывает антилипемическое, антипролиферативное, антивирусное, противораковое и противометастазное действие, но его применение в качестве лекарственного препарата сдерживается из-за побочных эффектов, обусловленных его антикоагуляционным действием, которые может вызывать кровотечения. Как известно, капсулярный полисахарид К5, выделенный из Escherichia coli и описанный Vann W.F. et al., European Journal of Biochemistry, 1981, 116, 359-364 [“Vann 1981”], состоит из смешанных цепей, состоящих из повторяющихся звеньев дисахарида глюкуронил- как у N-ацетилгепарозана – предшественника гепарина. Капсулярный полисахарид К5, именуемый в дальнейшем как “полисахарид К5” или просто “К5”, подвергали химической модификации Lormeau et al., как описано в US 5550116, и Casu et al., как описано в Carbohydrate Research, 1994, 263, 271-284. O-сульфаты К5, обладающие противораковым, противометастазным, антивирусным действием, в особенности против ВИЧ, описаны в ЕР 333243 и WO 98/34958. К5 также подвергали химическим и энзиматическим модификациям для того, чтобы получить продукты, имеющие такой же тип биологической активности на свертываемость крови in vitro, как у гепарина, экстрагированного из органов животных (экстрактивного гепарина). Получение продуктов, обладающих таким же типом активности на свертываемость крови, как экстрактивный гепарин, осуществляется способом, имитирующим процесс, происходящий в природе и предусматривающий всю ключевую стадию С5-эпимеризации с помощью D-глюкуронил-C5-эпимеразы. В способах, описанных в IT 1230785, WO 92/17507, WO 96/14425 и WO 97/43317, в качестве исходного материала используется К5. Полученный при ферментации К5 подвергают N-деацетилированию, а затем N-сульфатированию, и образовавшийся при этом К5-N-сульфат подвергают С5-эпимеризации в растворе с помощью С5-эпимеразы, полученной хроматографией раствора микросомальных ферментов из клеток мастоцитомы мышей (IT 1230785) или бычьей печени (WO 92/17507, WO 96/14425 и WO 97/43317). D-глюкуронил-С5-эпимераза из бычьей печени была очищена Campbell P. et al., J. Biol. Chem., 1994, 269/43, 26953-26958 (“Campbell 1994”), которые также получили ее аминокислотный состав и описали ее применение в растворе для превращения K5-N-сульфата в соответствующий продукт, эпимеризованный на 30%, засвидетельствовав образование идуроновой кислоты методом HPLC с последующей полной деполимеризацией с помощью азотистой кислоты на дисахариды. В WO 98/48006 описана последовательность ДНК, кодирующей D-глюкуронил-С5-эпимеразу, и была получена рекомбинантная D-глюкуронил-С5-эпимераза с помощью рекомбинантного экспрессирующего вектора, содержащего эту ДНК, а затем очищена Campbell et al., как показано в Jin-Ping L. et al., J. Biol. Chem., 2001, 276, 20069-20077 (“Jin-Ping 2001”). Полная последовательность С5-эпимеразы описана в Crawford B.E. et al., J. Biol. Chem., 2001, 276(24), 21538-21543 (Crawford 2001). В WO 01/72848 описан способ получения N-деацетилированных N-сульфатированных производных полисахарида К5, эпимеризованных до идуроновой кислоты, по меньшей мере, на 40% в пересчете на сумму уроновых кислот, с молекулярным весом от 2000 до 30000, содержащих от 25% до 50% высокоаффинных цепей для ATIII и обладающих антикоагуляционной и антитромботической активностью, выраженной в виде отношения HCII/антиХа, от 1,5 до 4. В этом документе описано гиперсульфатирование К5-N-сульфата, эпимеризованного на 40-60%, и показано, что полученный продукт, для которого приведен спектр 13С-ЯМР, содержит 2-3,5 сульфатных группы на 1 звено дисахарида. При повторении вышеуказанного гиперсульфатирования в описанных условиях и изучении 13С-ЯМР было установлено, что полученный продукт на самом деле представляет собой свободный амин, содержащий 80-95% 6-O-сульфата и 30% 3-O-сульфата на аминосахаре, но степень сульфатирования составляет 3,2. Также оказалось, что в условиях гиперсульфатирования, описанных в WO 01/72848, достигается степень сульфатирования не более 3,2. В US 2002/0062019 описан способ получения эпи-К5-N,O-сульфатов, проявляющих активность в регуляции свертывания крови, у которых степень сульфатирования составляет от 2,3 до 2,9, с молекулярным весом от 2000 до 30000, либо от 4000 до 8000, либо от 18000 до 30000. Этот способ включает стадии: (p-а) N-деацетилирования полисахарида К5 и N-сульфатирования образовавшегося К5-амина, (p-b) эпимеризации К5-N-сульфата, (p-с) O-гиперсульфатирования эпи-К5-N-сульфата, (p-d) частичного O-десульфатирования, (p-е) избирательного 6-O-сульфатирования, (p-f) N-сульфатирования полученного при этом продукта, причем любой продукт, полученный по окончании одной из стадий от (p-b) до (p-f), может быть подвергнут деполимеризации. В этом документе описан эпи-К5-N,O-сульфат с молекулярным весом 7400, получаемый при проведении стадий от (p-а) до (p-f) с последующей азотистой деполимеризацией под конец стадии (p-f), у которого степень сульфатирования составляет от 2,3 до 2,9. В том же документе описана и отдельная часть К5 с молекулярным весом примерно 5000, которая также может быть подвергнута стадиям от (p-а) до (p-f). Для того, чтобы стандартизировать терминологию и сделать текст более понятным, в настоящем описании будут применяться условные термины и выражения, в единственном или множественном числе. В частности: – “К5” или “полисахарид К5” означает капсулярный полисахарид из Escherichia coli, полученный путем ферментации, то есть это смешанная цепь, состоящая из звеньев дисахарида (А), необязательно содержащих двойную связь на невосстанавливающем конце, как показано выше, и в любом случае он получен и очищен методами, описанными в литературе, в частности методом Vann 1981, методом Manzoni M. et al., Journal of Bioactive Compatible Polymers, 1996, 11, 301-311 (“Manzoni 1996”) или методом, описанным в WO 01/72848 WO 02/068447; специалисту в этой области должно быть ясно, что все, что показано в дальнейшем, применимо к любому N-ацетилгепарозану; – “С5-эпимераза” означает В-глюкуронил-С5-эпимеразу, экстрактивную или рекомбинантную, но в любом случае она получена, выделена и очищена, в частности, как описано в Campbell 1994; WO 98/48006; Jin-Ping L. et al., J. Biol. Chem. 2001, 276, 20069-20077 (“Jin-Ping 2001”) или Crawford 2001; – “К5-амин” означает К5, деацетилированный, по меньшей мере, на 95%, у которого N-ацетильные группы не обнаруживаются на обычном приборе для ЯМР; – “К5-N-сульфат” означает К5, деацетилированный, по меньшей мере, на 95% и N-сульфатированный обычно на 100%, так как N-ацетильные группы не обнаруживаются на обычном приборе для ЯМР, как описано далее; – “эпи-К5” означает К5 и его производные, у которых 20-60% глюкуроновых звеньев подверглись С5-эпимеризации в идуроновые звенья; – “эпи-К5-N-сульфат” означает К5-N-сульфат, у которого 20-60% глюкуроновых звеньев подверглись С5-эпимеризации в идуроновые звенья; – “эпи-К5-амин-O-гиперсульфат” означает эпи-К5-амин-O-сульфат, у которого степень сульфатирования составляет, по меньшей мере, 3,4; – “эпи-К5-N,O-гиперсульфат” означает эпи-К5-амин-O-сульфат, подвергшийся полному N-сульфатированию до степени сульфатирования, по меньшей мере, 4. Кроме того: – условные термины и выражения, определенные выше, относятся к К5, выделенному после ферментации, обычно с молекулярным весом приблизительно в пределах от 1500 до 50000 и средним молекулярным весом 10000-25000, предпочтительно 15000-25000; – условные термины и выражения, определенные выше, если им предшествует сокращение “НМ” (низкомолекулярный), например НМ К5-N-сульфат, НМ эпи-К5-N-сульфат, означают низкомолекулярные продукты, полученные при фракционировании или при деполимеризации К5-N-сульфата и состоящие или происходящие из K5-N-сульфатов со средним молекулярным весом приблизительно от 1500 до 12000 в пересчете на 100% N-сульфатированный продукт; – условные термины и выражения, определенные выше, если при них стоит слово “производное”, в целом означают как производные нативного К5, так и низкомолекулярного К5; – выражение “приблизительно” в отношении молекулярного веса означает молекулярный вес, измеренный методом вискозиметрии, ± теоретический вес дисахаридного звена, включая вес натрия, который принимается равным 461 в случае производных эпи-К5-N-сульфатов и 806 в случае производных эпи-К5-N,O-гиперсульфатов со степенью сульфатирования 4,26; – выражение “преобладающая разновидность” означает соединение, которое в смеси, состоящей из НМ эпи-К5-N-сульфата, НМ эпи-К5-амин-O-гиперсульфата или НМ эпи-К5-N,O-гиперсульфата, представлено в наибольшей степени, что определяется пиком на графике молекулярного веса при измерении методом HPLC; – если не оговорено иначе, “степень сульфатирования” означает соотношение SO3 –/COO–, также выражаемое числом сульфатных групп на 1 звено дисахарида, при измерении кондуктометрическим методом, описанным в Casu В. et al.. Carbohydrate Research, 1975, 39, 168-176 (Casu 1975), который также применялся в WO 01/72848; – “условия O-гиперсульфатирования” означают предельное O-сульфатирование, которое проводится, к примеру, согласно методу С, описанному в В. Casu et al., Carbohydrate Research, 1994, 263, 271-284 (Casu 1994); – термин “алкил” означает линейный или разветвленный алкил, тогда как “тетрабутиламмоний” означает группу тетра-п-бутиламмония. Сущность изобретения Было показано, что в отличие от того, что происходит при применении способов, описанных в IT 1230785, WO 92/17507, WO 96/14425, WO 97/43317, WO 01/72848 и US 2002/0062019, исходя из эпи-К5-N-сульфата можно получить эпи-К5-амин-O-гиперсульфат с большей степенью сульфатирования, чем у любого другого эпи-К5-амин-O-сульфата, описанного в литературе, например, в WO 01/72848, путем получения соли третичного или четвертичного органического основания данного эпи-К5-N-сульфата с обязательным оставлением реакционной смеси на 30-60 минут при поддержании рН около 7 с помощью того же органического основания, а затем обработки полученной соли O-сульфатирующим реагентом в условиях O-гиперсульфатирования. Подвергая полученные при этом эпи-К5-амин-O-гиперсульфаты N-сульфатированию, получают новые эпи-К5-N,O-гиперсульфаты, которые в отличие от продуктов, описанных в IT 1230785, WO 92/17507, WO 96/14425, WO 97/43317, WO 01/72848 и US 2002/0062019, лишены активности на свертываемость крови и полезны для получения лекарств, в частности фармацевтических композиций, обладающих антиангиогенной и антивирусной активностью, либо косметических композиций. При деполимеризации данных эпи-К5-N,O-гиперсульфатов с помощью азотистой кислоты получают новые НМ эпи-К5-N,O-гиперсульфаты, лишенные активности на свертываемость крови и обладающие антиангиогенной и антивирусной активностью. При получении N,O-сульфата из N-деацетилированных производных полисахарида К5, эпимеризованных, по меньшей мере, на 40% до идуроновой кислоты в пересчете на сумму уроновых кислот и имеющих низкий молекулярный вес, методом, описанным в WO 01/72848, было установлено, что деполимеризация высокомолекулярного продукта, полученного по окончании заключительной стадии процесса N-сульфатирования, может давать различные результаты, так как она обычно приводит к получению некоторых деполимеризованных продуктов, обладающих значительно меньшей активностью, чем те высокомолекулярные продукты, из которых они образуются, на все параметры свертывания крови. Предполагается, что это происходит потому, что на деградацию с применением азотистой кислоты влияет присутствие сульфатных групп. В частности, сульфаты в положении 3 глюкозамина ведут к образованию гетерогенных продуктов, как описано в Nagasawa et al., Thrombosis Research, 1992, 65, 463-467 (Nagasawa 1992). Тогда же было обнаружено, что при азотистой деполимеризации эпи-K5-N-сульфата, в котором содержание идуроновой кислоты в пересчете на сумму уроновых кислот составляет 20-60%, предпочтительно 40-60%, более предпочтительно около 60%, образуются НМ эпи-К5-N-сульфаты, являющиеся новыми эффективными промежуточными продуктами для получения НМ эпи-К5-N,O-гиперсульфатов, обладающих высокой активностью на различные биологические параметры, в частности обладающие или не обладающие активностью на параметры свертывания крови. Оказалось, что при деполимеризации эпи-К5-N-сульфата можно получить новые НМ эпи-К5-N-сульфаты со средним молекулярным весом приблизительно от 2000 до 4000, в частности, определенные НМ эпи-К5-N-сульфаты, состоящие из смесей, в которых преобладающим соединением является декасахарид или додекасахарид либо тетрадекасахарид. К тому же эти НМ эпи-К5-N-сульфаты, которые невозможно получить иным способом, обладают интересными биологическими свойствами и являются важными промежуточными продуктами для получения НМ эпи-К5-N,O-гиперсульфатов, обладающих антивирусной и/или антиангиогенной активностью и неожиданно лишенных активности на свертываемость крови. Подвергая НМ эпи-К5-N-сульфат вышеуказанному методу получения соли с помощью третичного или четвертичного органического основания с обязательным оставлением реакционной смеси на 30-60 минут при поддержании рН около 7 с помощью того же органического основания, а затем обработки полученной соли O-сульфатирующим реагентом в условиях O-гиперсульфатирования, получают новые НМ эпи-К5-амин-O-гиперсульфаты. Подвергая НМ эпи-К5-амин-O-гиперсульфат N-сульфатированию, получают новые N-сульфатированные и O-гиперсульфатированные производные (НМ эпи-К5-N,O-гиперсульфаты), неожиданно лишенные активности на свертываемость крови и обладающие антивирусной и/или антиангиогенной активностью, полезные для получения фармацевтических или косметических композиций. Эти НМ эпи-К5-N-сульфаты получают из К5-N-сульфата посредством реакции эпимеризации с помощью выделенной и очищенной рекомбинантной С5-эпимеразы, иммобилизованной на твердом носителе, при температуре около 30°С и рН около 7 в течение 12-24 часов в присутствии двухвалентного катиона, выбранного из числа кальция, магния, бария и марганца, и последующей реакции азотистой деполимеризации полученного при этом продукта, либо в обратной последовательности. Неожиданно наблюдения за ходом реакции эпимеризации в вышеуказанных условиях позволяют предположить, что в отличие от того, что происходит в природе при биосинтезе гепарина, протекает не “кластерная”, а обычная С5-эпимеризация субстрата через каждые 2 звена глюкуроновой кислоты, которая ведет к образованию производных эпи-К5-N-сульфатов, отличающихся наличием повторяющегося тетрасахаридного звена, состоящего из двух звеньев глюкозамина, разделенных сначала глюкуроновым звеном, а затем идуроновым звеном, либо наоборот. Подробное описание изобретения Итак, в соответствии с одним из аспектов настоящее изобретение предусматривает способ получения производных эпи-К5-N,O-гиперсульфатов, характеризующихся тем, что: (a) производное эпи-К5-N-сульфата, в кислотной форме, обрабатывают третичным или четвертичным органическим основанием, оставляя реакционную смесь на 30-60 минут, и поддерживают значение рН раствора около 7 добавлением того же третичного или четвертичного органического основания, и выделяют соль данного органического основания; (b) данную соль органического основания и данного производного эпи-К5-N-сульфата обрабатывают O-сульфатирующим реагентом в условиях O-гиперсульфатирования; (c) полученное при этом производное эпи-К5-амин-O-гиперсульфата обрабатывают N-сульфатирующим реагентом и выделяют производное эпи-К5-N,O-гиперсульфата. В общем случае производное эпи-К5-N,O-гиперсульфата выделяют в виде натриевой соли и необязательно данную натриевую соль превращают в другую химически или фармацевтически приемлемую соль. В этом контексте термин “химически приемлемый” относится к катиону, применяемому при химическом синтезе, типа натрия, аммония, иона (C1-C4)-тетраалкиламмония, или при очистке продукта, тогда как “фармацевтически приемлемый” не требует объяснений. Предпочтительны катионы щелочных металлов, щелочноземельных металлов, аммония, (С1-С4)-тетраалкиламмония, алюминия и цинка. Наиболее предпочтительны катионы натрия, кальция и тетрабутиламмония. В соответствии с предпочтительным выполнением способа стадия (а) проводится путем пропускания раствора натриевой соли производного эпи-К5-N-сульфата, то есть полисахарида К5, предварительно N-деацетилированного, N-сульфатированного, обычно на 100%, С5-эпимеризованного на 20-60% и необязательно деполимеризованного азотистой кислотой, со средним молекулярным весом приблизительно от 1000 до 25000, предпочтительно от 1500 до 25000, через колонку с кислым анионообменником, к примеру, типа IR-120 Н+ сбора элюата вместе с промывочным раствором и нейтрализации элюата третичным или четвертичным органическим основанием, предпочтительно водным раствором гидроокиси тетрабутиламмония. Раствор оставляют на 1 час, поддерживая рН около 7 добавлением того же самого основания, и полученную при этом соль выделяют путем лиофилизации. На стадии (b) O-гиперсульфатирование проводится при помощи избытка O-сульфатирующего реагента и обработки при температуре от 20 до 70°С в течение времени вплоть до 24 часов в апротонном полярном растворителе. Предпочтительно выделенную на стадии (а) соль третичного или четвертичного органического основания и производного эпи-К5-N-сульфата, то есть полисахарида К5, предварительно N-деацетилированного, N-сульфатированного, предпочтительно на 100%, С5-эпимеризованного на 20-60% и необязательно деполимеризованного азотистой кислотой, со средним молекулярным весом приблизительно от 1000 до 25000, предпочтительно от 1500 до 25000, растворяют в диметилформамиде и обрабатывают O-сульфатирующим реагентом в количестве 2-10 моль на каждый свободный гидроксил при температуре 40-60°С в течение 10-20 часов. В качестве O-сульфатирующего реагента предпочтительно используют соединение пиридин·SO3 в количестве 2,5-5 моль, предпочтительно 2,5-4 моль на 1 свободный гидроксил на 1 дисахарид и реакцию проводят предпочтительно при 50-60°С, более предпочтительно при 55°С в течение ночи. Полученный по окончании реакции продукт выделяют путем добавления 0,1-1 объема воды и нейтрализации, предпочтительно с помощью гидроокиси натрия, осаждения насыщенным раствором хлористого натрия в ацетоне, фильтрования и необязательно ультрафильтрации. Полученный при этом продукт обычно представляет собой натриевую соль производного эпи-К5-амин-O-гиперсульфата с содержанием идуроновой кислоты в 20-60% от суммы уроновых кислот, со средним молекулярным весом приблизительно от 3500 до 40000, предпочтительно от 4500 до 40000, со степенью сульфатирования не менее 3,4, предпочтительно, по меньшей мере, 3,5, более предпочтительно от 3,55 до 4, наиболее предпочтительно от 3,55 до 3,8. Полученная при этом соль может быть превращена в другую соль. Например, может быть проведен обмен ионов на ион кальция с помощью мембран для ультрафильтрации. На стадии (с) производное эпи-К5-амин-O-гиперсульфата с очень высокой степенью сульфатирования подвергают N-сульфатированию, используя известные в литературе методы N-сульфатирования. На практике N-сульфатирование проводится путем обработки водного раствора, содержащего производное эпи-К5-амин-O-гиперсульфата, полученное на стадии (b), карбонатом натрия и N-сульфатирующим реагентом, например соединением (C1-C4)-триалкиламин·SO3 или пиридин·SO3, выдерживания смеси при 30-50°С в течение 8-24 часов и выделения нужного производного эпи-К5-N,O-гиперсульфата, к примеру, путем диафильтрации. Необязательно стадию N-сульфатирования повторяют до получения степени замещения более чем на 95%, предпочтительно до полного завершения. Новые производные эпи-К5-N,O-гиперсульфаты, полученные при этом, обычно находятся в виде натриевой соли. Натриевая соль может быть превращена в другую химически или фармацевтически приемлемую соль. Особенно предпочтительны соли щелочных металлов, щелочноземельных металлов, аммония, (С1-С4)-тетраалкиламмония, алюминия и цинка. Наиболее предпочтительны соли натрия, кальция и тетрабутиламмония. Исходные эпи-К5-N-сульфаты, направляемые на стадию (а) способа настоящего изобретения, происходят из полисахарида К5, предварительно N-деацетилированного, N-сульфатированного практически на 100%, С5-эпимеризованного на 20-60%, предпочтительно на 40-60%, и необязательно деполимеризованного азотистой кислотой, со средним молекулярным весом приблизительно от 1000 до 25000, предпочтительно от 1500 до 25000. Предпочтительно исходный материал представляет собой эпи-К5-N-сульфат со средним молекулярным весом от 10000 до 25000 или НМ эпи-К5-N-сульфат со средним молекулярным весом приблизительно от 1000 до 12000, более предпочтительно от 1000 до 10000, наиболее предпочтительно от 1500 до 8000. Эпи-К5-N-сульфаты, полученные путем С5-эпимеризации К5-N-сульфатов, хорошо известны в литературе и широко описаны, к примеру, в WO 92/17507, WO 01/72848, WO 98/14425, WO 97/43317 или US 2002/0062019. Их получение путем С5-эпимеризации глюкуронового звена К5-N-сульфата с помощью D-глюкуронил-С5-эпимеразы описано в документах, приведенных выше. НМ эпи-К5-N-сульфат с содержанием идуроновой кислоты приблизительно 20%, полученный путем N-деацетилирования, N-сульфатирования и С5-эпимеризации фрагмента К5 со средним молекулярным весом 5000, описан в WO 92/17507. Однако такой НМ К5-N-сульфат содержит значительное количество ацетильных групп. Эпи-К5-N-сульфат с содержанием идуроновой кислоты в 40-60%, особенно предпочтительный в качестве исходного материала, получают путем эпимеризации K5-N-сульфата, практически лишенного ацетильных групп, который, в свою очередь, получают из особенно чистого К5, в частности не содержащего липофильных веществ, описанного в WO 02/068477. В соответствии с предпочтительным выполнением способа при эпимеризации используется К5-N-сульфат, полученный из К5, лишенный липофильных веществ, как тот, что описан в WO 02/068477, а С5-эпимеризация проводится с помощью D-глюкуронил-С5-эпимеразы, выделенной, очищенной и иммобилизованной на твердом носителе, при рН около 7, при температуре примерно 30°С и в течение 12-24 часов, в присутствии, по меньшей мере, одного двухвалентного иона, выбранного из числа кальция, магния, бария и марганца. НМ эпи-К5-N-сульфаты с более высоким содержанием идуроновой кислоты, в частности 40-60%, предпочтительно 50-55%, – это новые, особенно предпочтительные продукты в качестве исходных материалов для получения НМ производных эпи-К5-N,O-гиперсульфатов. Вышеуказанные НМ эпи-К5-N-сульфаты получают способом, который характеризуется тем, что К5-N-сульфат подвергается, в любом порядке, (i) С5-эпимеризации с помощью O-глюкуронил-С5-эпимеразы, выделенной, очищенной и находящейся в растворе или иммобилизованной на твердом носителе, при рН около 7, при температуре примерно 30°С и в течение 12-24 часов, в присутствии, по меньшей мере, одного двухвалентного иона, выбранного из числа кальция, магния, бария и марганца; и (ii) азотистой деполимеризации, за которой необязательно следует восстановление, обычно с помощью борогидрида натрия. Выражение “в любом порядке” означает, что способ может выполняться равно как в направлении (i)-(ii), то есть в порядке, приведенном выше, так и в обратном порядке, то есть в направлении (ii)-(i), подвергая К5-N-сульфат сначала реакции азотистой деполимеризации, а затем необязательно восстановлению борогидридом натрия и после этого С5-эпимеризации в изложенных выше условиях. Предпочтительный порядок – в направлении (i) В соответствии с предпочтительным аспектом изобретения, С5-эпимераза подвергается иммобилизации на инертном твердом носителе. С5-эпимераза, предпочтительно рекомбинантная, выделенная и очищенная, к примеру, согласно Campbell 1994, WO 98/48006, Jin-Ping 2001 или Crawford 2001, подвергается иммобилизации на инертном носителе в присутствии субстрата, то есть в присутствии исходного производного К5-N-сульфата или в присутствии НМ K5-N-сульфата, предпочтительно со средним молекулярным весом более 4000, более предпочтительно не менее 6000. Иммобилизация проводится в соответствии со стандартными методами, например, как описано в WO 01/72848. Реакция С5-эпимеризации проводится путем пропускания 20-1000 мл 25 мМ раствора Hepes, рН около 7, содержащего 0,001-10 г субстрата (К5-N-сульфата или НМ К5-N-сульфата, предпочтительно с молекулярным весом более 4000, более предпочтительно, по меньшей мере, 6000) и катион, выбранный из числа кальция, магния, бария и марганца в концентрации от 10 до 60 мМ, через колонку, содержащую от 1,2×107 до 3×1011 cpm иммобилизованного фермента, при рН около 7 и температуре примерно 30°С, при скорости пропускания в 30-220 мл/час в течение 12-24 часов, предпочтительно 15-24 часов. Предпочтительно данный раствор пропускают со скоростью 200 мл/час в течение ночи (15-20 часов). Полученный продукт очищают и отделяют в соответствии с известными методами, например, ультрафильтрации и осаждения этанолом. Полученный при этом продукт состоит либо из эпи-К5-N-сульфата (в этом случае его растворяют в воде и подвергают деполимеризации), либо из НМ эпи-К5-N-сульфата (в таком случае он является конечным продуктом). Степень эпимеризации, что на практике означает количество идуроновых звеньев относительно глюкуроновых, рассчитывают с помощью 1Н-ЯМР методом, описанным в WO 96/4425. Реакция азотистой деполимеризации проводится в соответствии с известными методами деполимеризации гепарина, например в соответствии с методами, описанными в ЕР 37319, WO 82/03627, или в соответствии с методом деполимеризации К5-N-сульфата, описанным в ЕР 544592, но исходя из К5-N-сульфата или эпи-К5-N-сульфата, содержащего от 0 до 10%, предпочтительно не более 5% ацетильных групп. Предпочтительно деполимеризации проводится с помощью нитрита натрия и соляной кислоты на эпи-К5-N-сульфате, практически лишенном ацетильных групп, с последующим восстановлением in situ борогидридом натрия. На практике холодный водный раствор эпи-К5-N-сульфата доводят до кислого значения рН (приблизительно 2) соляной кислотой и обрабатывают на холоду нитритом натрия при постоянной температуре (примерно 4°С) и рН (приблизительно 2), а по окончании деполимеризации (примерно 15-30 минут) раствор нейтрализуют гидроокисью натрия и обрабатывают, опять при температуре примерно 4°С, водным раствором борогидрида натрия. По окончании восстановления (приблизительно 4 часа) излишек борогидрида натрия устраняют соляной кислотой, раствор нейтрализуют гидроокисью натрия и выделяют деполимеризованный (и восстановленный) продукт в соответствии с известными методами, например, путем прямого осаждением этанолом или ацетоном. Продукт, полученный по окончании деполимеризации, может представлять собой либо HM эпи-К5-N-сульфат (в этом случае он является конечным продуктом), либо НМ K5-N-сульфат (в таком случае он непосредственно подвергается С5-эпимеризации, как описано выше, после выделения либо в растворе без предварительного выделения), в частности, если его молекулярный вес составляет более 4000, предпочтительно, по меньшей мере, 6000, или же его утилизируют для получения НМ К5-N,O-гиперсульфата, обладающего антиангиогенной и антивирусной активностью. При надлежащем контроле за реакцией деполимеризации, в частности, используя различные количества нитрита натрия/соляной кислоты, получают НМ К5-N-сульфаты или НМ эпи-К5-N-сульфаты со средним молекулярным весом на всем интервале примерно от 1500 до 12000, предпочтительно от 1500 до 10000, более предпочтительно от 1500 до 7500, который рассчитывают из спектра 13С-ЯМР путем интегрирования сигнала, относящегося к атому С2 2,5-ангидроманнитола, и сигнала от аномерного углерода глюкозамина на полисахаридной цепочке. В соответствии с общим выполнением способа, к примеру, исходя из 1 г эпи-К5-N-сульфата, исходный продукт растворяют в 100-200 мл деионизованной воды и ставят в термостат на 4°С. Затем добавляют такое количество нитрита натрия, чтобы получить нужный молекулярный вес, к примеру, от 2000 до 4000. Таким образом, исходя из эпи-К5-N-сульфата со средним молекулярным весом 20000 при измерении методом HPLC на колонке BioRad BioSil 250 с использованием стандарта гепарина с известным молекулярным весом, нужно будет добавить от 330 до 480 мг нитрита натрия в виде 0,2% водного раствора. Раствор, содержащий эпи-К5-N-сульфат и нитрит натрия, при 4°С доводят до рН 2 добавлением 0,1 N HCl, охлажденного до 4°С. Раствор оставляют на 20-40 минут для протекания реакции с медленным перемешиванием, а затем нейтрализуют с помощью 0,1 N NaOH. Полученный продукт доводят до комнатной температуры и обрабатывают восстановительным реагентом, например борогидридом натрия (250-500 мг растворяют в 50-100 мл воды) и оставляют для протекания реакции на 4-8 часов. Избыток борогидрида натрия удаляют доведением рН до 5-5,5 с помощью 0,1 N HCl и оставляют еще на 2-4 часа. Наконец, раствор нейтрализуют с помощью 0,1 N NaOH и выделяют продукт путем осаждения ацетоном или этанолом после концентрации продукта испарением при пониженном давлении. Аналогичным образом можно определить количество нитрита натрия, которое, исходя из 1 г К5-N-сульфата или эпи-К5-N-сульфата, позволяет получить НМ K5-N-сульфат или НМ эпи-К5-N-сульфат со средним молекулярным весом от 4000 до 12000, предпочтительно от 4000 до 7500, более предпочтительно от 6000 до 7500. Полученный при этом НМ эпи-К5-N-сульфат с содержанием идуроновой кислоты от 20 до 60%, предпочтительно от 40 до 60%, более предпочтительно от 50 до 55%, и практически лишенный -NH2 и N-ацетильных групп, со средним молекулярным весом примерно от 1500 до 12000, предпочтительно от 1500 до 10000, более предпочтительно от 1500 до 7500, а также его химически и фармацевтически приемлемые соли представляют собой новые продукты, применимые в качестве представляющих особый интерес исходных материалов для получения НМ эпи-К5-N,O-гиперсульфатов, но и сами по себе они полезны в качестве активных ингредиентов фармацевтических или косметических композиций и составляют дополнительный аспект настоящего изобретения. Предпочтительно исходными материалами при получении производных эпи-К5-N,О-гиперсульфатов настоящего изобретения являются производные эпи-К5-N-сульфаты, состоящие из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, n – целое число от 2 до 100, предпочтительно от 3 до 100, а соответствующий катион является химически или фармацевтически приемлемым. Более предпочтительно данные исходные производные эпи-К5-N-сульфаты состоят из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I, в которой уроновые звенья на 40-60% состоят из идуроновой кислоты, n – целое число от 2 до 100, предпочтительно от 3 до 100, а соответствующий катион является химически или фармацевтически приемлемым. Наиболее предпочтительно исходные материалы представляют собой НМ эпи-К5-N-сульфаты, представленные выше, состоящие из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I, в которой уроновые звенья на 20-60%, предпочтительно на 40-60%, более предпочтительно на 50-55% состоят из идуроновой кислоты, n – целое число от 2 до 20, предпочтительно от 3 до 15, а соответствующий катион является химически приемлемым. На практике данные предпочтительные НМ эпи-К5-N-сульфаты состоят из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I’: в которой уроновые звенья на 20-60%, предпочтительно на 40-60%, более предпочтительно на 50-55% состоят из идуроновой кислоты, q – целое число от 2 до 20, предпочтительно от 3 до 15, а соответствующий катион является химически или фармацевтически приемлемым. В этом контексте термин “химически” относится к катиону, применяемому при химическом синтезе, типа ионов натрия, аммония, (С1-С4)-тетраалкиламмония, или при очистке продукта. Предпочтительны катионы щелочных металлов, щелочноземельных металлов, аммония, (С1-С4)-тетраалкиламмония, алюминия и цинка. Наиболее предпочтительны катионы натрия, кальция и тетрабутиламмония. Особый интерес представляют НМ эпи-К5-N-сульфаты, состоящие из смешанных цепей, из которых, по меньшей мере, 90% соответствуют вышеприведенной формуле I’, которые получены путем азотистой деполимеризации соответствующих эпи-К5-N-сульфатов, приведенных выше, и последующего необязательного восстановления, к примеру, борогидридом натрия. Из их числа предпочтительны НМ эпи-К5-N-сульфаты, состоящие из смешанных цепей, среди которых преобладают цепи согласно формуле I’а: в которой уроновые звенья на 60-40% состоят из глюкуроновой кислоты и на 40-60% – из идуроновой кислоты, р – целое число от 4 до 8. Средний молекулярный вес этих продуктов составляет приблизительно от 2000 до 4000, а соответствующий катион является химически или, фармацевтически приемлемым. Получение этих эпи-К5-М-сульфатов, начиная со стадии азотистой деполимеризации, включает присутствие на восстанавливающем конце у большинства цепей из данной смеси звена 2,5-ангидроманнозы или в случае восстановления, к примеру, борогидридом натрия, звена 2,5-ангидроманнитола структуры (а):
в которой Х означает формил или гидроксиметил. Следовательно, восстанавливающий конец у большинства (60-70%) цепей на самом деле представлен структурой (b): в которой Х определен выше. Присутствие структуры (а) не оказывает влияния на химические характеристики эпи-К5-N-сульфатов и их производных, так как сульфатирование может привести только к введению одной или двух сульфатных групп, однако это не изменит значительно степень сульфатирования O-сульфатированных производных. Тем не менее, предпочтительно, чтобы за азотистой деполимеризацией последовало восстановление, к примеру, борогидридом натрия, так как в соответствии со способом настоящего изобретения НМ эпи-К5-N-сульфаты подвергаются реакциям сульфатирования и ацилирования, о влиянии которых на формильную группу, когда Х представлен формилом, радикала 2,5-ангидроманнозы структуры (а) неизвестно. Кроме того, присутствие структуры (а) не влияет на биологическую активность продуктов, как показано в Østergaard Р.В. et al., Thrombosis Research, 1987, 45, 739-749 (Østergaard 1987) в отношении гепаринов низкого молекулярного веса. Особенно предпочтительные НМ эпи-К5-N-сульфаты по настоящему изобретению состоят из смешанных цепей, среди которых преобладают соединения формулы I’b: в которой Х означает формил или предпочтительно гидроксиметил, m равно 4, 5 или 6, соответствующий катион является химически или фармацевтически приемлемым, а глюкуроновые и идуроновые звенья чередуются, начиная с глюкуронового или идуронового звена, причем соотношение между глюкуроновыми и идуроновыми звеньями составляет от 45/55 до 55/45, то есть приблизительно 50/50. Следовательно, применение С5-эпимеразы, предпочтительно рекомбинантной, предпочтительно иммобилизованной на твердом носителе в условиях, изложенных выше, способствует не “кластерной” эпимеризации производных К5-N-сульфатов в производные эпи-К5-N-сульфаты, как это происходит в природе, а эпимеризации обычного типа. Итак, в соответствии со следующим аспектом настоящее изобретение предусматривает использование выделенной и очищенной С5-эпимеразы для превращения производных К5-N-сульфатов в соответствующие производные эпи-К5-N-сульфаты, отличающиеся наличием повторяющегося тетрасахаридного звена, состоящего из двух звеньев глюкозамина, разделенных сначала глюкуроновым звеном, а затем идуроновым звеном, либо разделенных сначала идуроновым звеном, а затем глюкуроновым звеном. Данная эпимеризация происходит оптимальным образом, если она проводится с производным К5-N-сульфатом со средним молекулярным весом более 4000, предпочтительно от 6000 до 7500. В соответствии с настоящим изобретением исходные производные эпи-К5-N-сульфаты, предпочтительно N-сульфатированные на 100% (в особенности производные эпи-К5-N-сульфаты, состоящие из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I или I’, либо среди которых преобладают цепи по формуле I’а или I’b, где Х означает гидроксиметил), направляются на вышеуказанные стадии (а) и (b), по завершении которых происходит выделение соответствующих новых производных эпи-К5-амин-O-гиперсульфатов, у которых аминогруппа не замещена и которые обычно имеют вид натриевой соли, которая может быть превращена в другую химически или фармацевтически приемлемую соль. Особенно предпочтительны соли щелочных металлов, щелочноземельных металлов, аммония, (С1-С4)-тетраалкиламмония, алюминия и цинка, а из них предпочтительны соли натрия, кальция и тетрабутиламмония. Таким образом, в соответствии со следующим аспектом настоящее изобретение касается новых производных эпи-К5-амин-O-гиперсульфатов и их химически или фармацевтически приемлемых солей, получаемых способом, который характеризуется тем, что: (a) производное эпи-К5-N-сульфата, в кислотной форме, обрабатывают третичным или четвертичным органическим основанием, оставляя реакционную смесь на 30-60 минут и поддерживая значение рН раствора около 7 добавлением данного третичного или четвертичного органического основания, и выделяют его соль, образованную с данным органическим основанием; (b) данную соль органического основания и данного производного эпи-К5-N-сульфата обрабатывают O-сульфатирующим реагентом в условиях O-гиперсульфатирования и выделяют производное эпи-К5-амин-O-гиперсульфата. Используя в качестве исходного материала для стадии (а) производные эпи-К5-N-сульфаты, состоящие из смешанных цепей, из которых, по меньшей мере, 90% соответствуют вышеприведенной формуле I, в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, n – целое число от 3 до 100, а соответствующий катион является химически или фармацевтически приемлемым, по окончании стадии (b) получают производное эпи-К5-амин-O-гиперсульфата, состоящее из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле II: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, n – целое число от 2 до 100, предпочтительно от 3 до 100, R, R’ и R” представляют собой водород или SO3 –, причем степень сульфатирования составляет, по меньшей мере, 3,4, предпочтительно, по меньшей мере, 3,5, более предпочтительно от 3,55 до 4, наиболее предпочтительно от 3,55 до 3,8, а соответствующий катион является химически или фармацевтически приемлемым. Эти производные эпи-К5-амин-O-гиперсульфаты с очень высокой степенью сульфатирования представляет собой новые продукты, применимые в качестве промежуточных продуктов для получения их N-сульфатированных или Н-(С2-С4)-ацилированных производных, практически лишенных активности на параметры свертываемости крови, но обладающих другими интересными фармакологическими свойствами. Предпочтительно производные эпи-К5-амин-O-гиперсульфаты с очень высокой степенью сульфатирования состоят из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле II, в которой уроновые звенья на 40-60% состоят из идуроновой кислоты, n – целое число от 2 до 100, предпочтительно от 3 до 100, и имеют средний молекулярный вес приблизительно от 2000 до 40000, предпочтительно от 4500 до 40000, R, по меньшей мере, на 40%, предпочтительно на 50-80%, представлен SO3 –, R’ и R” оба представлены SO3 – либо один из них представлен водородом, а другой – на 5-10% представлен SO3 – в моносульфате глюкуроновой кислоты и на 10-15% представлен SO3 – в моносульфате идуроновой кислоты, причем степень сульфатирования составляет более 3,4, предпочтительно, по меньшей мере, 3,5, более предпочтительно от 3,55 до 4, наиболее предпочтительно, от 3,55 до 3,8, а соответствующий катион является химически или фармацевтически приемлемым. Предпочтительные производные эпи-К5-амин-O-гиперсульфаты с очень высокой степенью сульфатирования – это НМ эпи-К5-амин-O-гиперсульфаты, состоящие из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле II, в которой уроновые звенья на 40-60%, предпочтительно на 50-55% состоят из идуроновой кислоты, R, по меньшей мере, на 40%, предпочтительно на 50-80%, более предпочтительно на 65% представлен SO3 –, R’ и R” оба представлены SO3 – либо один из них представлен водородом, а другой – на 5-10% представлен SO3 – в глюкуроновой кислоте и на 10-15% представлен SO3 – в идуроновой кислоте, n – целое число от 2 до 20, предпочтительно от 3 до 15, и имеют средний молекулярный вес приблизительно от 4000 до 8000, а соответствующий катион является химически или фармацевтически приемлемым. На практике данные предпочтительные НМ эпи-К5-амин-O-гиперсульфаты состоят из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле II’: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, q – целое число от 2 до 20, предпочтительно от 3 до 15, R, R’ и R” представлены водородом или SO3 –, причем степень сульфатирования составляет, по меньшей мере, 3,4, предпочтительно, по меньшей мере, 3,5, более предпочтительно от 3,55 до 4, наиболее предпочтительно от 3,55 до 3,8, а соответствующий катион является химически или фармацевтически приемлемым ионом. Из этих НМ эпи-К5-амин-O-гиперсульфатов предпочтительны те, которые состоят из смешанных цепей, среди которых преобладают цепи, соответствующие формуле II’a: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, р – целое число от 4 до 8, R, R’ и R” уже определены выше, причем степень сульфатирования составляет, по меньшей мере, 3,4, предпочтительно, по меньшей мере, 3,5, более предпочтительно от 3,55 до 4, наиболее предпочтительно от 3,55 до 3,8, а соответствующий катион является химически или фармацевтически приемлемым. Получение новых НМ эпи-К5-амин-O-гиперсульфатов из НМ эпи-К5-сульфатов, получаемых путем азотистой деполимеризации и последующего восстановления, к примеру, борогидридом натрия, включает присутствие на восстанавливающем конце у большинства цепей из данной смеси сульфатированного звена 2,5-ангидроманнитола структуры (а’):
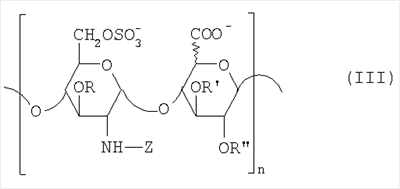
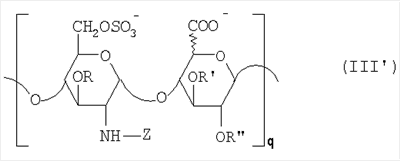
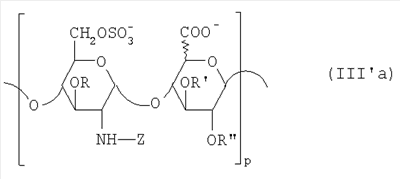
в которой R” означает водород или SO3 –. Таким образом, восстанавливающий конец у большинства цепей из данной смеси представлен структурой (b’): в которой уроновое звено может быть глюкуроновым или идуроновым. Из вышеописанных новых НМ эпи-К5-амин-O-гиперсульфатов предпочтительны те, которые состоят из смешанных цепей, среди которых преобладают соединения согласно формуле II’b: в которой уроновые звенья на 40-60% состоят из идуроновой кислоты, m равно 4, 5 или 6, R, R’ и R” представлены водородом или SO3 –, X” означает ОН или OSO3 –, причем степень сульфатирования составляет, по меньшей мере, 3,4, предпочтительно, по меньшей мере, 3,5, более предпочтительно от 3,55 до 4, наиболее предпочтительно от 3,55 до 3,8, идуроновые звенья чередуются, начиная с глюкуронового или идуронового звена, а соответствующий катион является химически или фармацевтически приемлемым. Все эти производные эпи-К5-амин-O-гиперсульфаты с очень высокой степенью сульфатирования представляют собой новые продукты, которые являются полезными промежуточными продуктами для получения новых N-замещенных производных эпи-К5-амин-O-гиперсульфатов, поэтому они составляют дополнительный аспект настоящего изобретения. В частности, в соответствии со следующим аспектом настоящее изобретение касается применения вышеописанных производных эпи-К5-амин-O-гиперсульфатов с очень высокой степенью сульфатирования для получения новых N-замещенных производных эпи-К5-амин-O-гиперсульфатов, в частности N-сульфатированных или N-ацилированных. По завершении стадии (с) способа настоящего изобретения, состоящей из N-сульфатирования производных эпи-К5-амин-O-гиперсульфатов, полученных на стадии (b) (в особенности производных эпи-К5-амин-O-гиперсульфатов, состоящих из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле II или II’, либо среди которых преобладают цепи по формуле II’а или II’b), получаются производные эпи-К5-N,О-гиперсульфаты, у которых идуроновая кислота составляет 20-60% от суммы уроновых кислот, а степень сульфатирования – по меньшей мере, 4, предпочтительно от 4 до 4,6. Итак, в соответствии со следующим аспектом настоящее изобретение предусматривает новые N-деацетилированные производные полисахарида К5, O-сульфатированные и N-сульфатированные, С5-эпимеризованные до идуроновой кислоты, по меньшей мере, на 20% от суммы уроновых звеньев, со средним молекулярным весом приблизительно от 2000 до 45000, со степенью сульфатирования, по меньшей мере, 4, причем данные производные практически не обладают активностью на параметры свертывания крови. Аналогично тому, что было сказано выше, данные новые производные в целом обозначают общим термином “производные эпи-К5-N,O-гиперсульфаты”, независимо от их молекулярного веса. В частности, их средний молекулярный вес составляет приблизительно от 2000 до 45000, так как данные производные происходят либо из эпи-К5-К-сульфата, полученного путем N-деацетилирования и N-сульфатирования К5 при ферментации, либо путем его азотистой деполимеризации. Путем контроля за азотистой деполимеризацией можно получить низкомолекулярные производные практически на всем указанном интервале. Однако для применения производных по настоящему изобретению в качестве фармацевтических или косметических продуктов предпочтительно получение низкомолекулярных производных со средним молекулярным весом приблизительно от 2000 до 16000, предпочтительно от 3500 до 13000 с распределением молекулярных весов между 1000 и 15000, более предпочтительно от 4500 до 9000 с распределением молекулярных весов между 2000 и 10000, либо высокомолекулярных производных, происходящих из нефракционированного К5, со средним молекулярным весом приблизительно от 20000 до 45000, с распределением молекулярных весов между 2000 и 70000. У производных эпи-К5-N,O-гиперсульфатов по настоящему изобретению степень сульфатирования очень высока, предпочтительно от 4 до 4,6, при этом атом азота у глюкозамина сульфатирован практически на 100%. Кроме того, производные эпи-К5-N,O-гиперсульфаты 6-O-сульфатированы на 100% и 3-O-сульфатированы на 50-80% по глюкозаминовым звеньям, 3-O-моносульфатированы на 5-10% по глюкуроновым звеньям, О-моносульфатированы на 10-15% по идуроновым звеньям и 2,3-ди-О-сульфатированы по остальным идуроновым звеньям, учитывая, что степень сульфатирования составляет, по меньшей мере, 4. Предпочтительные производные эпи-К5-N,O-гиперсульфаты по настоящему изобретению получают через производные эпи-К5-амин-O-гиперсульфаты, которые, в свою очередь, получают из производных эпи-К5-N-сульфатов, состоящих из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I, в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, n – целое число от 2 до 100, предпочтительно от 3 до 100, а соответствующий катион является химически или фармацевтически приемлемым. В данном случае новые производные эпи-К5-N,O-гиперсульфаты состоят из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, n – целое число от 2 до 100, предпочтительно от 3 до 100, R, R’ и R” представлены водородом или SO3 –, Z означает SO3 –, причем степень сульфатирования составляет, по меньшей мере, 4, предпочтительно от 4 до 4,6, а соответствующий катион является химически или фармацевтически приемлемым. Предпочтительны катионы щелочных металлов, щелочноземельных металлов, аммония, (С1-С4)-тетраалкиламмония, алюминия и цинка, а из них наиболее предпочтительны соли натрия, кальция и тетрабутиламмония. Из вышеуказанных новых производных эпи-К5-N,O-гиперсульфатов те, которые состоят из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III, в которой R представлен SO3 – у 50-80% цепей, предпочтительно примерно у 65% цепей, а степень сульфатирования составляет, по меньшей мере, 4, предпочтительно от 4 до 4,6, более предпочтительно от 4 до 4,3. Предпочтительно производные эпи-К5-N,O-гиперсульфаты с очень высокой степенью сульфатирования состоят из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III, в которой Z означает SO3 –, уроновые звенья на 40-60% состоят из идуроновой кислоты, n – целое число от 2 до 100, предпочтительно от 3 до 100, и имеют средний молекулярный вес приблизительно от 2000 до 45000, предпочтительно от 4500 до 45000, R, по меньшей мере, на 40%, предпочтительно на 50-80%, представлен SO3 –, R’ и R” оба представлены SO3 – либо один из них представлен водородом, а другой – на 5-10% представлен SO3 – в моносульфате глюкуроновой кислоты и на 10-15% представлен SO3 – в моносульфате идуроновой кислоты, причем степень сульфатирования составляет, по меньшей мере, 4, предпочтительно от 4 до 4,6, а соответствующий катион является химически или фармацевтически приемлемым. Предпочтительными N-замещенными эпи-5-амино-О-гиперсульфатированными производными НМ-эпи-5-амино-О-гиперсульфатированными производными являются смеси цепей, в которых, по меньшей мере, 90% цепей имеют формулу III, в которой 40-60% уроновых единиц содержат предпочтительно 50-55% идуроновой кислоты, R является, по меньшей мере, на 40%, предпочтительно на 50-80%, особенно предпочтительно на 65% SO3 –, R’ и R” оба являются SO3 – или один из них является водородом и другой является 5-10% SO3 – в глюкуроновой кислоте и 10-15% SO3 – в идуроновой кислоте, Z является 100% SO3 – или (С2-С4)ациллом, n является целым числом от 2 до 20, предпочтительно от 3 до 15, с молекулярным весом от примерно 4000 до примерно 8500 и соответствующим катионом, приемлемым химически или фармацевтически. На практике данные предпочтительные производные эпи-К5-N,O-сульфаты с очень высокой степенью сульфатирования состоят из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III’: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, q – целое число от 2 до 20, предпочтительно от 3 до 15, R, R’ и R” представлены водородом или SO3 –, Z означает SO3 –, причем степень сульфатирования составляет, по меньшей мере, 4, предпочтительно от 4 до 4,6, а соответствующий катион является химически или фармацевтически приемлемым ионом. Особый интерес представляют смешанные цепи согласно формуле III’, в которой уроновые звенья на 40-60%, предпочтительно на 50-55% состоят из идуроновой кислоты, R, по меньшей мере, на 40%, предпочтительно на 50-80%, более предпочтительно на 65% представлен SO3 –, R’ и R” оба представлены SO3 – либо один из них представлен водородом, а другой – на 5-10% представлен SO3 – в глюкуроновой кислоте и на 10-15% представлен SO3 – в идуроновой кислоте, n – целое число от 2 до 20, предпочтительно от 3 до 15, и имеют средний молекулярный вес приблизительно от 2000 до 16000, предпочтительно от 3500 до 13000, более предпочтительно от 4500 до 9000, а соответствующий катион является химически или фармацевтически приемлемым. Из этих НМ эпи-К5-N,O-гиперсульфатов предпочтительны те, которые состоят из смешанных цепей, среди которых преобладают цепи, соответствующие формуле III’а: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, р – целое число от 4 до 8, Z означает SO3 –, R, R’ и R” представлены водородом или SO3 –, причем степень сульфатирования составляет, по меньшей мере, 4, предпочтительно от 4 до 4,6, а соответствующий катион является химически или фармацевтически приемлемым. Получение новых НМ эпи-К5-N,O-гиперсульфатов из НМ эпи-К5-сульфатов, получаемых путем азотистой деполимеризации и последующего восстановления, к примеру, борогидридом натрия, включает присутствие, на восстанавливающем конце у большинства цепей из данной смеси, сульфатированного звена 2,5-ангидроманнитола структуры (а’), приведенной выше, в которой R” означает водород или SO3 –. Таким образом, восстанавливающий конец у большинства цепей из данной смеси представлен структурой (b”): в которой Z означает SO3 –, а уроновое звено может быть глюкуроновым или идуроновым. Из вышеописанных новых НМ эпи-К5-N,O-гиперсульфатов предпочтительны те, которые являются смесями, среди которых преобладают виды, являющиеся соединениями формулы III’b: в которой R, R’ и R” представлены водородом или SO3 –, Z означает SO3 –, а X” – ОН или OSO3 –, m равно 4, 5 или 6, причем степень сульфатирования составляет, по меньшей мере, 4, предпочтительно от 4 до 4,6, уроновые звенья чередуются, начиная с глюкуронового или идуронового звена, а соответствующий катион является химически или фармацевтически приемлемым. Предпочтительны катионы щелочных металлов, щелочноземельных металлов, аммония, (С1-С4)-тетраалкиламмония, алюминия и цинка, а из них наиболее предпочтительны ионы натрия, кальция и тетрабутиламмония. Если в способе настоящего изобретения в качестве исходного производного эпи-К5 используется эпи-К5, то есть полисахарид К5, предварительно N-деацетилированный, N-сульфатированный обычно на 100%, С5-эпимеризованный на 20-60% и не деполимеризованный, то по завершении стадии (с) выделяется эпи-К5-N,O-гиперсульфат, который может быть подвергнут азотистой деполимеризации и последующему восстановлению, к примеру, борогидридом натрия, с получением соответствующего НМ эпи-К5-N,O-гиперсульфата, имеющего ту же степень сульфатирования. В частности, получаются НМ эпи-К5-N,O-гиперсульфаты, состоящие из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III’ или III’а, в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, q, R, R’, R” и Z уже определены выше, причем степень сульфатирования составляет, по меньшей мере, 4, предпочтительно от 4 до 4,6, а соответствующий катион является химически или фармацевтически приемлемым. В таком случае получение этих НМ эпи-К5-N,O-гиперсульфатов посредством реакции азотистой деполимеризации и возможного последующего восстановления, к примеру, борогидридом натрия включает присутствие на восстанавливающем конце у большинства цепей из данной смеси звена 2,5-ангидроманнитола структуры (а”):
в которой Х означает формил или гидроксиметил, а R” означает водород или SO3 –. Новые производные эпи-К5-N,O-гиперсульфаты, особенно в виде солей, представляют собой сильно анионные продукты, способные захватывать свободные радикалы, и они могут применяться в косметической промышленности в качестве адъювантов против выпадения волос или для получения кремов “против старения” и в фармацевтической промышленности в качестве препаратов для лечения дерматита. Кроме того, производные эпи-К5-N,O-гиперсульфаты настоящего изобретения, в особенности НМ эпи-К5-N,O-гиперсульфаты, обладают антиангиогенной и антивирусной активностью и поэтому могут служить активными ингредиентами для получения лекарств. Итак, в соответствии с одним из дополнительных аспектов настоящее изобретение предусматривает фармацевтические композиции, включающие в качестве одного из активных ингредиентов фармакологически активное количество производного эпи-К5-N,О-гиперсульфата, описанного выше, или одной из его фармацевтически приемлемых солей, вместе с фармацевтическим наполнителем. В фармацевтических композициях настоящего изобретения для перорального, подкожного, внутривенного, трансдермального или наружного применения активные ингредиенты предпочтительно вводятся в виде дозовых единиц, вместе с классическими фармацевтическими наполнителями или носителями. Дозировка может сильно варьировать в зависимости от возраста, веса и состояния здоровья пациента. Она включает введение дозы от 1 до 1000 мг, предпочтительно от 10 до 750 мг, более предпочтительно от 250 до 500 мг, от одного до трех раз в день внутривенным, подкожным, пероральным, трансдермальным или наружным способом. Фармацевтические композиции настоящего изобретения составляются вместе с классическими наполнителями, подходящими для различных способов применения. Особенно предпочтительны составы в виде кремов, мазей, жидких мазей, гелей, пеноматериалов, бальзамов, вагинальных колец, свечей, растворов или суспензий, пригодных для местного нанесения. Предпочтительно композиции по настоящему изобретению включают в качестве одного из активных ингредиентов производное эпи-К5-N,O-гиперсульфата, получаемого, исходя из производного эпи-К5 в соответствии со стадиями (а), (b) и (с) вышеописанного способа, либо исходя из недеполимеризованного эпи-К5 в соответствии со стадиями (а), (b) и (с) вышеописанного способа с возможной последующей азотистой деполимеризацией после стадии (с), или одну из его фармацевтически приемлемых солей, вместе с фармацевтическим наполнителем. Предпочтительно данное производное эпи-К5-N,O-гиперсульфата состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III или III’, либо среди которых преобладают соединения по формуле III’a или III’b. Предпочтительным активным ингредиентом является НМ эпи-К5-N,O-гиперсульфат со степенью сульфатирования, по меньшей мере, 4, предпочтительно от 4 до 4,6, предпочтительно со средним молекулярным весом приблизительно от 3500 до 11000, более предпочтительно от 3500 до 5200, и практически лишенный N-ацетильных групп. Наконец, в соответствии со следующим аспектом, настоящее изобретение предусматривает косметическую композицию, включающую эффективное количество производного эпи-К5-N,O-гиперсульфата или его фармацевтически приемлемой соли, вместе с косметическим наполнителем. Соль, выбранная из группы, состоящей из солей натрия, калия, кальция, магния, алюминия и цинка производных эпи-К5-N,O-гиперсульфатов, в особенности состоящих из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III или III’, либо среди которых преобладают соединения по формуле III’a или III’b, является эффективным активным ингредиентом фармацевтической или косметической композиции по настоящему изобретению. Нижеследующие примеры раскрывают изобретение, но не ограничивают его. Препаративный пример I Получение полисахарида К5 из Escherichia coli Сначала проводится ферментация в конической колбе с использованием следующей среды, г/л:
рН=7,3 Среду подвергают стерилизации при 120°С в течение 20 минут. Глюкозу готовят отдельно в виде раствора, который стерилизуют при 120°С в течение 30 минут и добавляют в среду асептически. В коническую колбу инокулируют суспензию клеток Е.coli Bi 8337/41 (O10:К5:Н4), происходящую из косяка с триптическим соевым агаром, и инкубируют при 37°С в течение 24 часов с умеренным встряхиванием (160 об/мин, размах 6 см). Рост бактерий измеряют путем подсчета клеток под микроскопом. На следующей стадии в ферментер Chemap-Braun на 14 л, содержащий такую же среду, инокулируют 0,1% культуры из конической колбы и проводят ферментацию с пропусканием воздуха (1 объем воздуха на 1 объем жидкости за 1 минуту) с перемешиванием при 400 об/мин при температуре 37°С в течение 18 часов. Во время ферментации проводятся измерения рН, кислорода, глюкозы, продукции полисахарида К5 и роста бактерий. По окончании ферментации температуру доводят до 80°С на 10 минут. Клетки отделяют от среды центрифугированием при 10000 об/мин и супернатант подвергают ультрафильтрации в модуле SS 316 (MST), снабженном мембраной PES с номинальным отсеканием от 800 до 10000 Д, уменьшая объем до 1/5. Затем полисахарид К5 осаждают добавлением 4 объемов ацетона при 4°С и оставляют на всю ночь при 4°С. После этого его выделяют центрифугированием при 10000 об/мин в течение 20 мин или фильтрованием. Из полученного вещества удаляют белки с помощью протеазы типа II из Aspergillus orizae в буфере из 0,1 М NaCl и 0,15 М ЭДТА, рН 8, содержащем SDS (0,5% додецилсульфата натрия) (10 мг/л фильтрата) при 37°С в течение 90 мин. Полученный раствор подвергают ультрафильтрации в модуле SS 316, снабженном мембраной PES с номинальным отсеканием до 10000 Д, с двумя экстракциями 1 М NaCl, и промывают водой до исчезновения оптического поглощения в ультрафильтрате. Затем полисахарид К5 осаждают ацетоном с выходом 850 мг на 1 л ферментера. Чистоту полученного полисахарида измеряют путем определения уроновых кислот (карбазоловый метод), 1Н- и 13С-ЯМР, УФ и содержания белка. Чистота составляет более 80%. Полученный полисахарид состоит из двух молекул различного молекулярного веса в 30000 и 5000 Д соответственно, как следует из определения методом HPLC на колонке Pharmacia 75 HR, и одной молекулы со временем удержания примерно 9 минут при использовании двух последовательных колонок Bio-Sil SEC 250 (BioRad) и Na2SO4 в качестве подвижной фазы при комнатной температуре со скоростью 0,5 мл/мин. Определение проводится по стандартной кривой, полученной с использованием молекул гепарина известного молекулярного веса. Спектр 1Н-ЯМР полученного при этом очищенного К5 проявляет различные сигналы, свойственные метальным группам липофильных веществ. Препаративный пример II Очистка К5 В 100 мл насыщенного водного раствора хлористого натрия при 4°С растворяют 1 г К5, полученного в Препаративном примере I, и в полученный раствор добавляют 3 объема холодного изопропанола. Концентрацию соли в растворе доводят до 3 М добавлением расчетного объема насыщенного раствора хлористого натрия и полученный раствор оставляют в холодном месте (около 4°С) на всю ночь. Образовавшийся осадок отделяют центрифугированием при 10000 об/мин в течение 20 мин и проверяют чистоту продукта путем диализа в течение ночи и изучения спектра 1Н-ЯМР, в котором не должно быть сигналов в области менее 1,5 ppm. Необязательно повторяют операцию растворения в воде, насыщенной NaCl, и осаждения изопропанолом. Осадок растворяют в воде и подвергают ультрафильтрации через мембрану Miniplate фирмы Millipore с отсеканием в 10000 Д до исчезновения солей. При этом получают К5 с чистотой не менее 99%, у которого в спектре 1Н-ЯМР не обнаруживается сигналов липофильных примесей в области менее 1,5 ppm. Препаративный пример III Получение KS-N-сульфата (i) N-Деацетилирование 10 г очищенного полисахарида К5, полученного, как описано в Препаративном примере II, растворяют в 1000 мл 2N NaOH и полученный раствор оставляют при 60°С на 24 часа. Раствор доводят до комнатной температуры, а затем до нейтрального значения рН (рН 7) с помощью 6N соляной кислоты. (ii) N-Сульфатирование В раствор, содержащий деацетилированный К5, находящийся при 40°С, вносят 16 г карбоната натрия и через 4 часа – 16 г пиридин-SO3 –. По окончании реакции, через 24 часа, раствор доводят до комнатной температуры, а затем до рН 6,5-7 с помощью 5% раствора соляной кислоты. Продукт очищают от солей диафильтрацией через спиральную мембрану с отсеканием в 1000 Д (препаративный картридж фирмы Millipore). Процесс прекращают по достижении электропроводимости раствора менее 1000 мкСм, предпочтительно менее 100 мкСм. Объем диализата уменьшают до достижения концентрации полисахарида в 10°/о, используя ту же систему диализа. Концентрированный раствор высушивают путем лиофилизации. При анализе спектра 13С-ЯМР остатки N-ацетила или -NH2 не обнаруживаются. Препаративный пример IV Низкомолекулярный KS-N-сульфат Продукт, полученный, как описано в Примере 1, стадии (i) и (ii) патента WO 02/068477, подвергают деполимеризации методом расщепления азотистой кислотой и последующего восстановления образовавшегося альдегида. Для этого растворяют 1 г К5-N-сульфата в 200 мл дистиллированной воды и добавляют 480 мг нитрита натрия, растворенного в 240 мл дистиллированной воды. Затем раствор доводят до 4°С и до рН 2 с помощью 0,1 N HCl и оставляют на 30 мин. По окончании реакции раствор доводят до рН 7 с помощью 0,1 М NaOH, а затем до комнатной температуры. Затем в раствор добавляют 450 мг NaBH4 и оставляют реагировать в течение 4 часов. Избыток NaBH4 удаляют с помощью HCl, доводя рН до 5-6. После нейтрализации с помощью 0,1 М NaOH продукт выделяют путем осаждения 3 объемами ацетона при 4°С с фильтрованием на воронке и сушат при 40°С в вакуумной сушке. Получают 900 мг НМ К5-N-сульфата со средним молекулярным весом примерно 2000, состоящего из смешанных цепей, среди которых преобладают соединения формулы I’b, в которой m равно 4, а уроновые звенья представлены глюкуроновой кислотой. Пример 1 НМ эпи-К5-N-сульфат. Последовательность (i) (i) Эпимеризация до эпи-К5-N-сульфата 10 г К5-N-сульфата, полученного, как описано в Примере 1, стадии (i) и (ii) патента WO 02/068477, у которого в спектре 1Н-ЯМР не обнаруживаются сигналы, соответствующие остаткам N-ацетила или -NH2, растворяют в 600 мл 25 мМ буфера Hepes, рН 7, содержащего CaCl2 в концентрации 50 мМ, и полученный раствор пропускают через колонку объемом 50 мл, заполненную Сефарозой 4В, содержащей 5 г рекомбинантной С5-эпимеразы (WO 96/14425), иммобилизованной, как описано в Примере 1 WO 01/72848. Реакцию проводят при 30°С при рН 7 при скорости пропускания 200 мл/ч в течение 24 часов. Полученный продукт очищают путем ультрафильтрации и осаждения этанолом. При этом получают эпи-К5-N-сульфат с содержанием идуроновой кислоты в 54%. (ii) Деполимеризация эпи-К5-N-сульфата 1 г полученного продукта растворяют в 25 мл дистиллированной воды и в этот раствор вносят 230 мг нитрита натрия, растворенного в 115 мл дистиллированной воды. Затем раствор доводят до 4°С и до рН 2 с помощью 0,1 N HCl и оставляют на 30 мин. По окончании реакции раствор доводят до комнатной температуры и до рН 7 с помощью 0,1 М NaOH. Затем в раствор добавляют 450 мг NaBH4 и оставляют реагировать в течение 4 часов. Продукт выделяют путем осаждения 3 объемами ацетона при 4°С с фильтрованием на воронке и сушат при 40°С в вакуумной сушке. Получают 900 мг НМ эпи-К5-N-сульфата с содержанием идуроновой кислоты в 54% и распределением молекулярных весов от 1000 до 4000 при измерении методом HPLC. Пример 2 НМ эпи-К5-N-сульфат. Последовательность (ii) (ii) Деполимеризация KS-N-сульфата 2 г К5-N-сульфата, полученного, как описано в Примере 1, стадии (i) и (ii) патента WO 02/068477, подвергают деполимеризации, как описано в Препаративном примере I, используя 100 мг нитрита натрия и 300 мг борогидрида натрия. Получают 1,8 г НМ K5-N-сульфата со средним молекулярным весом 5000. (i) Эпимеризация НМ KS-N-сульфата 1 г НМ К5-N-сульфата, полученного на предыдущей стадии (ii), обрабатывают, как описано на стадии (i) Примера 1. Получают эпимеризованный продукт с соотношением идуроновая/глюкуроновая кислота 44/56 по сравнению с соотношением 0/100 у исходного продукта, с распределением молекулярных весов от 2000 до 10000 и средним молекулярным весом 5000 Д. Выход, рассчитанный по измерению содержания уроновых кислот по сравнению со стандартом в соответствии с карбазоловым методом (Bitter and Muir, Anal. Biochem. 1971, 39, 88-92), составляет 90%. Пример 3 НМ эпи-К5-N-сульфат. Последовательность (i) (i) Эпимеризация KS-N-сульфата Порцию в 2 г К5-N-сульфата, полученного, как описано в Примере 1, стадии (i) и (ii) патента WO 02/068477, растворяют в 120 мл 25 мМ буфера Hepes, рН 7, содержащего 50 мМ CaCl2. Полученный раствор пропускают через колонку объемом 50 мл, заполненную носителем, содержащим иммобилизованный фермент, полученный, как описано в WO 96/14425. Эту операцию проводят при 30°С при скорости пропускания 200 мл/ч в течение 24 часов. Полученный продукт очищают путем ультрафильтрации через мембрану с отсеканием в 1000 Д и пропускания через колонку с ионообменником IR 120 Н+, нейтрализируя элюат с помощью 1N NaOH. Образец выделяют путем осаждения этанолом или ацетоном. Получают эпимеризованный продукт с соотношением идуроновая/глюкуроновая кислота 55/45 по сравнению с соотношением 0/100 у исходного продукта. Степень эпимеризации рассчитывают по 1Н-ЯМР в соответствии с методом, описанным в WO 96/14425. Выход, рассчитанный по измерению содержания уроновых кислот по сравнению со стандартом в соответствии с карбазоловым методом (Bitter and Muir, Anal. Biochem. 1971, 39, 88-92), составляет 90%. (ii) Деполимеризация эпи-К5-N-сульфата 1 г продукта, полученного на стадии (а), подвергают деполимеризации методом расщепления азотистой кислотой и последующего восстановления образовавшегося альдегида. Для этого продукт растворяют в 25 мл дистиллированной воды и вносят туда 230 мг нитрита натрия, растворенного в 115 мл дистиллированной воды. Затем раствор доводят до 4°С и до рН 2 с помощью 0,1 N НС1 и оставляют на 30 мин. По окончании реакции раствор доводят до комнатной температуры и до рН 7 с помощью 0,1 М NaOH. Затем в раствор добавляют 450 мг NaBH4 и оставляют реагировать в течение 4 часов. Продукт выделяют путем осаждения 3 объемами ацетона при 4°С с фильтрованием на воронке и сушат при 40°С в вакуумной сушке. Получают 900 мг НМ эпи-К5-N-сульфата с распределением молекулярных весов при измерении методом HPLC в пределах от 1000 до 4000, с содержанием глюкуроновой кислоты в 45% и содержанием идуроновой кислоты в 55%. Пример 4 Эпи-К5-N,O-гиперсульфат (а) Тетрабутиламмониевая соль эпи-К5-N-сульфата В 40 мл воды растворяют 400 мг эпи-К5-N-сульфата, полученного по окончании стадии (i) Примера 1, раствор ставят в термостат на 4°С, а затем пропускают через ионообменник IR 120+, предварительно уравновешенный с водой при 4°С. Полученный элюат, состоящий из 100 мл раствора со значением рН 1,94, нейтрализуют 15% раствором гидроокиси тетрабутиламмония и оставляют при комнатной температуре на 1 час, поддерживая рН около 7 добавлением 15% гидроокиси тетрабутиламмония, после чего лиофилизируют. При этом получают 805 мг тетрабутиламмониевой соли эпи-К5-N-сульфата. (b) Эпи-К5-амин-O-гиперсульфат Раствор, содержащий 805 мг полученной выше соли в 30 мл диметилформамида, доводят до 55°С и обрабатывают 30 мл диметилформамида, содержащего 2,26 г соединения пиридин·SO3. Реакцию при 55°С продолжают в течение ночи, а затем в эту смесь добавляют 60 мл воды. После нейтрализации с помощью 1N NaOH продукт осаждают 3 объемами ацетона, насыщенного NaCl, и оставляют при 4°С на всю ночь. Осадок извлекают фильтрованием на guch G4, а затем подвергают ультрафильтрации с помощью системы TFF фирмы Millipore с отсеканием в 1000 Д и сушат при пониженном давлении. Получают 550 мг эпи-К5-амин-O-гиперсульфата с содержанием идуроновой кислоты 54%, глюкозамин-6-О-сульфата 100%, глюкозамин-3-О-сульфата 60%, моносульфата глюкуроновой кислоты 10%, моносульфата идуроновой кислоты 15%, причем остальные идуроновые звенья дисульфатированы, а степень сульфатирования составляет 3,55 при измерении кондуктометрическим методом согласно Casu et al., 1975. (c) N-сульфатирование эпи-К5-амин-O-гиперсульфата 250 мг эпи-К5-амин-O-гиперсульфата, полученного на стадии (b), растворяли в 15 мл воды и добавляли 400 мг карбоната натрия, а затем в полученную смесь вносили 400 мг пиридин·SO3 в твердом виде мелкими порциями в течение 4 часов. Реакционную смесь держали при 55°С в течение ночи, а затем останавливали реакцию доведением до рН 7 с помощью 0,1 N HCl. После ультрафильтрации через мембрану с отсеканием до 1000 Д добавляли 3 объема ацетона, насыщенного хлористым натрием, и извлекали осадок центрифугированием при 5000 об/мин в течение 5 мин. При этом получили 244 мг эпи-К5-N,O-гиперсульфата, у которого степень сульфатирования составила 4,25 при измерении кондуктометрическим методом согласно Casu et al., 1975. Из анализа спектра 1Н-ЯМР следует, что полученный эпи-К5-N,O-гиперсульфат имеет содержание идуроновой кислоты 54%, 6-O-сульфата 100%, N-сульфата 100%, глюкозамин-3-О-сульфата 60%, моносульфата глюкуроновой кислоты 10%, моносульфата идуроновой кислоты 15%, причем остальные идуроновые звенья дисульфатированы. Из спектра 1Н-ЯМР была рассчитана степень сульфатирования в 4,35, которая, учитывая пределы ошибки методов, соответствует степени сульфатирования эпи-К5-амин-O-гиперсульфата, полученного по завершении стадии (b) и N-сульфатированного на 100%. Поэтому предполагается, что при превышении определенного процента сульфатных групп сильно анионная природа продукта может приводить к занижению степени сульфатирования при определении кондуктометрическим методом.
Формула изобретения
1. Способ получения производного N-деацетилированного,N,O-гиперсульфатированного, на 20-60%С5-эпимеризованного К5 полисахарида(эпи-К5-N,O-гиперсульфат-производное) со степенью сульфатирования равной 4-4,6, характеризующийся тем, что: (a) N-деацетилированный, N-гиперсульфатированный, на 20-60% С5-эпимеризованный К5 полисахарид (эпи-К5-N,O-гиперсульфат-производное) со средним молекулярным весом приблизительно от 1500 до 25000, в кислотной форме, обрабатывают третичным или четвертичным органическим основанием, оставляют реакционную смесь на 30-60 мин при рН около 7, и выделяют его соль, образованную с данным органическим основанием; (b) данную соль органического основания и данного эпи-К5-N-сульфат-производного обрабатывают O-сульфатирующим реагентом в условиях O-гиперсульфатирования; (c) полученный таким образом N-деацетилированный,N,O-гиперсульфатированный, на 20-60% С5-эпимеризованный К5 полисахарид (эпи-К5-N,O-гиперсульфат-производное) со степенью сульфатирования равной 3,55-3,8, N-сульфатируют обычными методами и выделяют полученное эпи-К5-амин-O-гиперсульфат-производное. 2. Способ по п.1, характеризующийся тем, что эпи-К5-N,O-гиперсульфат-производное выделяют в виде натриевой соли и необязательно превращают в другую химически или фармацевтически приемлемую соль. 3. Способ по п.1, характеризующийся тем, что на стадии (а) в качестве органического основания используется гидроокись тетрабутиламмония. 4. Способ по п.1, характеризующийся тем, что на стадии (b) O-гиперсульфатирование проводят в диметилформамиде, используя 2-4 моли O-сульфатирующего реагента на 1 доступную группу ОН на 1 дисахарид при температуре 40-60°С в течение 15-20 ч. 5. Способ по п.1, характеризующийся тем, что в качестве исходного материала используется эпи-К5-N-сульфат-производное 100% N-сульфатированное и на 40-60% С5-эпимеризовано. 6. Способ по п.5, характеризующийся тем, что данное исходное эпи-К5-N-сульфат-производное имеет среднюю молекулярную массу от 10000 до 25000. 7. Способ по п.1, характеризующийся тем, что исходное эпи-К5-N-сульфат-производное имеет среднюю молекулярную массу приблизительно от 1500 до 8000. 8. Способ по п.1, характеризующийся тем, что в качестве исходного материала используется эпи-К5-N-сульфат-производное, состоящий из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, n – целое число от 2 до 100, а соответствующий катион является химически или фармацевтически приемлемым. 9. Способ по п.8, характеризующийся тем, что данный исходный материал состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I, в которой уроновые звенья на 40-60% состоят из идуроновой кислоты. 10. Способ по п.8, характеризующийся тем, что в формуле I n означает целое число от 3 до 100. 11. Способ по п.8, характеризующийся тем, что данный исходный материал состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I’: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, q – целое число от 2 до 20, а соответствующий катион является химически или фармацевтически приемлемым. 12. Способ по п.9, характеризующийся тем, в формуле I, в которой n означает целое число от 3 до 15. 13. Способ по п.5, характеризующийся тем, что данный исходный материал состоит из смешанных цепей, среди которых преобладают цепи согласно формуле I’а: в которой уроновые звенья на 60-40% состоят из глюкуроновой кислоты и на 40-60% – из идуроновой кислоты, p – целое число от 4 до 8, а соответствующий катион является химически или фармацевтически приемлемым. 14. Способ по п.13, характеризующийся тем, что средний молекулярный вес данного исходного материала составляет приблизительно от 2000 до 4000. 15. Способ по п.14, характеризующийся тем, что данный исходный материал состоит из смешанных цепей, среди которых преобладают цепи согласно формуле I в которой Х означает гидроксиметил, m равно 4, 5 или 6, а глюкуроновые и идуроновые звенья чередуются, начиная с глюкуронового или идуронового звена. 16. Способ по любому из пп.1-15, характеризующийся тем, что данный исходный материал получен путем N-деацетилирования и N-сульфатирования К5, практически лишенного липофильных веществ. 17. Эпи-К5-N,O-гиперсульфат-производное, получаемое в соответствии со способом по пп.1-16. 18. Эпи-К5-N,O-гиперсульфат-производное по п.17, имеющее содержание идуроновой кислоты 20-60%, средний молекулярный вес приблизительно от 2000 до 45000 и степень сульфатирования, по меньшей мере, 4-4,6, либо одна из его химически или фармацевтически приемлемых солей, причем данное производное практически не обладает активностью на параметры свертывания крови. 19. Эпи-К5-N,O-гиперсульфат-производное по п.18, у которого средний молекулярный вес составляет приблизительно от 15000 до 45000. 20. Эпи-К5-N,O-гиперсульфат-производное по п.18, у которого средний молекулярный вес составляет приблизительно от 4500 до 8500. 21. Эпи-К5-N,O-гиперсульфат-производное по п.18, характеризующееся тем, что оно на 100% 6-O-сульфатирован и на 50-80% 3-O-сульфатирован по глюкозаминовым звеньям, на 5-10% O-моносульфатирован по глюкуроновым звеньям, на 10-15% 3-O-моносульфатирован по идуроновым звеньям и 2,3-дисульфатирован по остальным уроновым звеньям. 22. Эпи-К5-N,O-гиперсульфат-производное по п.18, характеризующееся тем, что оно состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, R, R’ и R” представлены водородом или SO3 –, причем R представлен SO3 –, по меньшей мере, у 40% данных смешанных цепей, Z означает SO3 –, n – целое число от 2 до 100, причем степень сульфатирования составляет, по меньшей мере, 4, а соответствующий катион является химически или фармацевтически приемлемым. 23. Эпи-К5-N,O-гиперсульфат-производное по п.18, характеризующееся тем, что оно состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III, в которой уроновые звенья на 40-60% представлены идуроновой кислотой. 24. Эпи-К5-N,O-гиперсульфат-производное по п.22, характеризующееся тем, что оно состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III, в которой n – целое число от 3 до 100. 25. Эпи-К5-N,O-гиперсульфат-производное по п.18, характеризующееся тем, что оно является низкомолекулярным (НМ) эпи-К5-N,O-гиперсульфатом, состоящим из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III’: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, q – целое число от 2 до 20, R, R’ и R” представлены водородом или SO3 –, Z означает SO3 –, а соответствующий катион является химически или фармацевтически приемлемым. 26. НМ эпи-К5-N,O-гиперсульфат по п.25, характеризующийся тем, что он состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III’, в которой q – целое число от 3 до 15. 27. НМ эпи-К5-N,O-гиперсульфат по п.25, характеризующийся тем, что он состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III’, в которой уроновые звенья на 40-60% состоят из идуроновой кислоты. 28. НМ эпи-К5-N,O-гиперсульфат по п.25, характеризующийся тем, что содержание идуроновой кислоты в нем составляет 50-55%. 29. НМ эпи-К5-N,O-гиперсульфат по п.26, характеризующийся тем, что он состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III’, в которой R, по меньшей мере, на 40% представлен SO3 –, R’ и R” оба представлены SO3 – либо один из них представлен водородом, а другой – на 5-10% представлен SO3 – в глюкуроновой кислоте и на 10-15% представлен SO3 – в идуроновой кислоте. 30. НМ эпи-К5-N,O-гиперсульфат по п.26, характеризующийся тем, что его средний молекулярный вес приблизительно составляет от 4000 до 8500. 31. НМ эпи-К5-N,O-гиперсульфат по п.26, характеризующийся тем, что он состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле III’, в которой R на 50-80% представлен SO3 –. 32. НМ эпи-К5-N,O-гиперсульфат по п.26, характеризующийся тем, что он состоит из смешанных цепей, среди которых преобладают цепи согласно формуле III’a: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, p – целое число от 4 до 8, Z означает SO3 –, R, R’ и R” представлены водородом или SO3 –, а соответствующий катион является химически или фармацевтически приемлемым. 33. НМ эпи-К5-N,O-гиперсульфат по п.32, характеризующийся тем, что он состоит из смешанных цепей, среди которых преобладают цепи согласно формуле III’b: в которой R, R’ и R” представлены водородом или SO3 –, Z означает SO3 –, а X” – ОН или OSO3 –, m равно 4, 5 или 6, идуроновые звенья чередуются, начиная с глюкуронового или идуронового звена, а соответствующий катион является химически или фармацевтически приемлемым. 34. Эпи-К5-N,O-гиперсульфата-производное по любому из пп.18-33, характеризующееся тем, что данная химически или фармацевтически приемлемая соль или катион является солью или катионом щелочного металла, щелочноземельного металла, аммония, (C1-C4)-тетраалкиламмония, алюминия или цинка. 35. Эпи-К5-N,O-гиперсульфат-производное по любому из пп.18-33, характеризующееся тем, что данная химически или фармацевтически приемлемая соль или катион является солью или катионом натрия, кальция или тетрабутиламмония. 36. Эпи-К5-амин-O-гиперсульфат-производное, имеющее степень сульфатирования 3,55-3,8 одна из его химически или фармацевтически приемлемых солей, получаемых в соответствии со стадиями (а) и (b) по п.1, выделенная в виде натриевой соли и, необязательно, превращенная в другую химически или фармацевтически приемлемую соль. 37. Эпи-К5-амин-O-гиперсульфат-производное по п.36, у которого содержание идуроновой кислоты составляет 20-60% от суммы уроновых кислот, со средним молекулярным весом приблизительно от 2000 до 40000. 38. Эпи-К5-амин-O-гиперсульфат-производное по п.36, характеризующееся тем, что оно состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле II: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, n – целое число от 2 до 100, R, R’ и R” представлены водородом или SO3 –, а соответствующий катион является химически или фармацевтически приемлемым. 39. Эпи-К5-амин-O-гиперсульфат-производное по п.38, характеризующееся тем, что в формуле II n означает целое число от 3 до 100. 40. Эпи-К5-амин-O-гиперсульфат-производное по п.38, характеризующееся тем, что оно состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле II, в которой уроновые звенья на 40-60% состоят из идуроновой кислоты, причем средний молекулярный вес составляет приблизительно от 2000 до 40000, R, по меньшей мере, на 40% представлен SO3 –, R’ и R” оба представлены SO3 – либо один из них представлен водородом, а другой – на 5-10% представлен SO3 – в моносульфате глюкуроновой кислоте и на 10-15% представлен SO3 – в моносульфате идуроновой кислоте. 41. Эпи-К5-амин-O-гиперсульфат-производное по п.38, характеризующееся тем, что оно является НМ эпи-К5-амин-O-гиперсульфатом, состоящим из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле II, в которой уроновые звенья на 40-60% состоят из идуроновой кислоты, R, по меньшей мере, на 40% представлен SO3 –, R’ и R” оба представлены SO3 – либо один из них представлен водородом, а другой – на 5-10% представлен SO3 – в глюкуроновой кислоте и на 10-15% представлен SO3 – в идуроновой кислоте, n – целое число от 3 до 15, имеет средний молекулярный вес приблизительно от 4000 до 8000, а соответствующий катион является химически или фармацевтически приемлемым. 42. Эпи-К5-амин-O-гиперсульфат-производное по п.36, характеризующееся тем, что оно является НМ эпи-К5-амин-O-гиперсульфатом, состоящим из смешанных цепей, среди которых преобладают цепи согласно формуле II’a: в которой уроновые звенья на 20-60% состоят из идуроновой кислоты, p – целое число от 4 до 8, R, R’ и R” представлены водородом или SO3 –. 43. НМ эпи-К5-амин-O-гиперсульфат по п.42, характеризующийся тем, что он состоит из смешанных цепей, среди которых преобладают соединения согласно формуле II’b: в которой уроновые звенья на 40-60% состоят из идуроновой кислоты, m равно 4, 5 или 6, R, R’ и R” представлены водородом или SO3 –, X” означает ОН или OSO3, а идуроновые звенья чередуются, начиная с глюкуронового или идуронового звена. 44. НМ эпи-К5-N-сульфат, практически лишенный -NH2 и N-ацетильных групп, с содержанием идуроновой кислоты от 20 до 60% и средним молекулярным весом приблизительно от 1500 до 12000, либо одна из его химически или фармацевтически приемлемых солей. 45. НМ эпи-К5-N-сульфат по п.44, характеризующийся тем, что содержание идуроновой кислоты составляет от 40 до 60%, а средний молекулярный вес – приблизительно от 1500 до 10000. 46. НМ эпи-К5-N-сульфат по п.45, характеризующийся тем, что средний молекулярный вес составляет, приблизительно, от 1500 до 7500. 47. НМ эпи-К5-Н-сульфат по п.46, полученный способом, отличающийся тем, что К5-N-сульфат подвергается, в любом порядке, (i) С5-эпимеризации с помощью O-глюкуронил-С5-эпимеразы, выделенной, очищенной и находящейся в растворе или иммобилизованной на твердом носителе, при рН около 7, при температуре примерно 30°С и в течение 12-24 ч, в присутствии, по меньшей мере, одного двухвалентного иона, выбранного из числа кальция, магния, бария и марганца; и (ii) азотистой деполимеризации, за которой необязательно следует восстановление. 48. НМ эпи-К5-N-сульфат по п.47, характеризующийся тем, что он состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I’: в которой q – целое число от 2 до 20, а соответствующий катион является химически или фармацевтически приемлемым. 49. НМ эпи-К5-Н-сульфат по п.48, характеризующийся тем, что в нем присутствует звено со структурой (а”)
на восстановленном конце большинства смешанных цепей, где Х представляет собой формил или гидроксиметил. 50. НМ эпи-К5-N-сульфат по п.48, характеризующийся тем, что он состоит из смешанных цепей, из которых, по меньшей мере, 90% соответствуют формуле I 51. НМ эпи-К5-N-сульфат по п.48, характеризующийся тем, что он состоит из смешанных цепей, среди которых преобладают цепи согласно формуле I’а: в которой p – целое число от 4 до 8, а соответствующий катион является химически или фармацевтически приемлемым. 52. НМ эпи-К5-N-сульфат по п.51, характеризующийся тем, что он состоит из смешанных цепей, среди которых преобладают цепи согласно формуле I’b: в которой Х означает гидроксиметил, m равно 4, 5 или 6, соответствующий катион является химически или фармацевтически приемлемым ионом, а глюкуроновые и идуроновые звенья чередуются, начиная с глюкуронового или идуронового звена. 53. НМ эпи-К5-N-сульфат по любому из пп.44-52, характеризующийся тем, что соль или катион выбирают из числа щелочных металлов, щелочноземельных металлов, аммония, (С1-С4)-тетраалкиламмония, алюминия и цинка. 54. НМ эпи-К5-N-сульфат по любому из пп.45-52, характеризующийся тем, что соль или катион выбирают из числа натрия, кальция и тетрабутиламмония. 55. Фармацевтическая композиция, обладающая антидерматитной и противовирусной активностью, включающая в качестве одного из активных ингредиентов фармакологически активное количество эпи-К5-N,O-гиперсульфат-производное по любому из пп.20-40 в смеси с фармацевтическим наполнителем. Приоритет по пунктам: 18.06.2002 по пп.1-7, 10, 12, 16-20, 21, 24, 29, 30, 31, 34-37, 39-41, 46-49, 50, 53-55; 27.08.2002 по пп.13-15, 51, 52; 17.06.2003 по пп.8, 9, 11, 22, 23, 25-28, 32, 33, 38, 42-45.
|
||||||||||||||||||||||||||

 -1
-1 4- или
4- или  -1
-1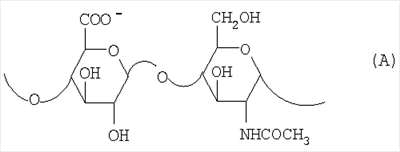
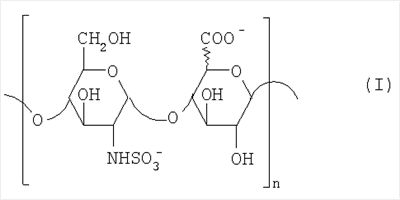
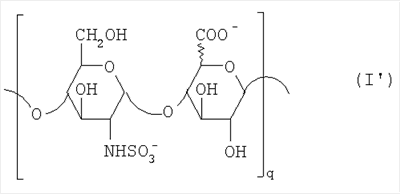
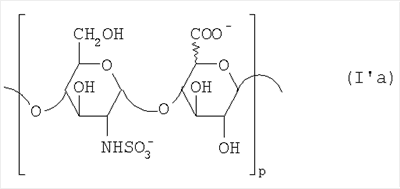
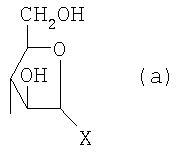
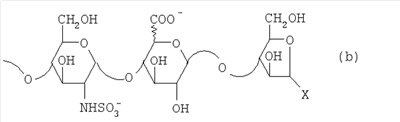
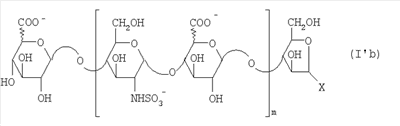
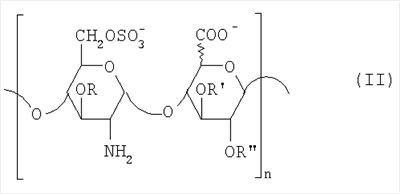
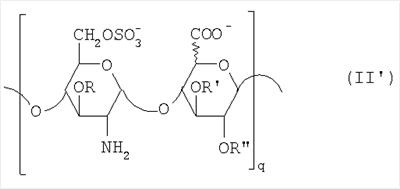
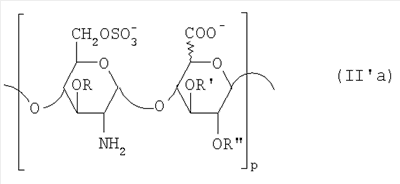
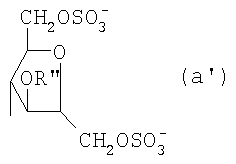
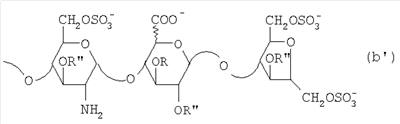
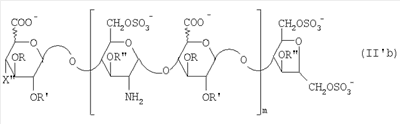
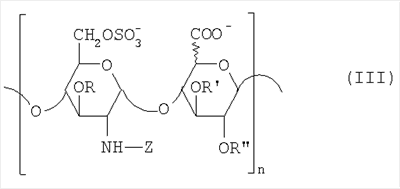
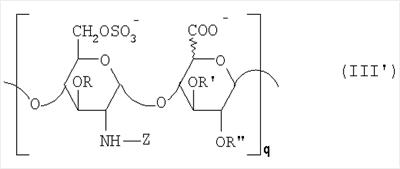
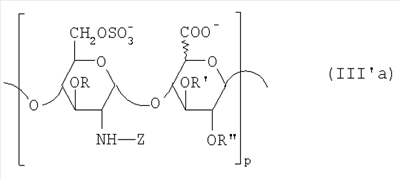
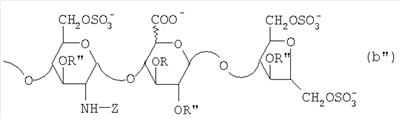
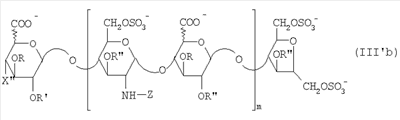
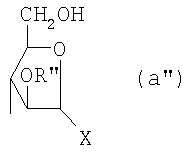
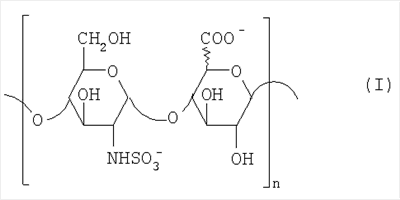
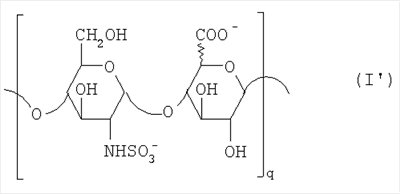
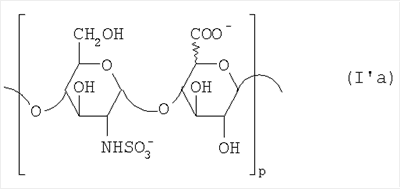
 b:
b: