Патент на изобретение №2333219
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ИНГИБИТОРЫ ПРЕДСТАВЛЕНИЯ АНТИГЕНОВ МОЛЕКУЛАМИ МНС II КЛАССА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
(57) Реферат:
Настоящее изобретение относится к биологически активным соединениям, обладающим ингибирующей активностью в отношении связывания антигена с молекулами МНС II класса, в частности с HLA-DR2-молекулой МНС II класса. Также предложены фармацевтические композиции, содержащие такие соединения, и их применение для получения лекарственного средства для лечения или предупреждения заболеваний, связанных с Т-клеточной пролиферацией, таких как аутоиммунные заболевания и нарушения ингибирования связывания с HLA-БR2-молекулой МНС II класса. 11 н. и 6 з.п. ф-лы, 4 табл.
Настоящая заявка на патент притязает на приоритет предварительной заявки на патент США № 60/447949, поданной 14 февраля 2003 г., содержание которой включено в настоящее описание во всей своей полноте в качестве ссылки. 1. ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ Настоящее изобретение относится к новым соединениям, фармацевтическим композициям, содержащим такие соединения, и способам их применения. 2. УРОВЕНЬ ТЕХНИКИ 2.1 Аутоиммунные заболевания Иммунные ответы хозяина обычно классифицируют как две различимые группы, клеточные и гуморальные. Клеточный иммунитет является опосредованным Т-лимфоцитами, или Т-клетками, и защищает от клеток, инфицированных вирусом, грибов, паразитов и чужеродных тканей. Гуморальный иммунитет, который опосредован В-лимфоцитами, или В-клетками, путем продуцирования антител, наиболее эффективен при бактериальных инфекциях и внеклеточных фазах вирусных инфекций. D. Voet & J. Voet, Biochemistry 1208 (2-е издание, Wiley 1995). Каскады реакций клеточного иммунитета приводят к разрушению антигенов посредством 1) поглощения антигенов клетками-макрофагами или клетками, представляющими антиген; 2) процессинга или фрагментации антигена внутри макрофага; 3) формирования комплекса фрагментированного антигена с белками клеточной поверхности, известными как белки главного комплекса гистосовместимости (“МНС”), и 4) связывания комплекса белок МНС/антиген Т-клетками, которые индуцированы для размножения, таким образом препятствуя эффективному иммунному ответу против специфического антигена. При аутоиммунных заболеваниях такой каскад реакций клеточного иммунитета распознает «свое» в качестве антигенов, что фактически приводит к разрушению белков, клеток и тканей хозяина. Процесс, при помощи которого клеточная иммунная система распознает и инициирует ответ на антигены, как чужеродные, так и свои, в последние годы находится в фокусе многих исследований. Белки МНС классифицируются как две группы, называемые белками МНС I класса и II класса, которые являются сходными структурно и функционально. D. Voet & J. Voet, Id. Макрофаги, представляющие белки МНС I класса или белки МНС II класса, которые формируют комплекс с антигеном на своей поверхности, связываются цитотоксическими Т-клетками или клетками Т-хелперами соответственно. В результате такого связывания для пролиферации и запуска иммунного ответа против антигена индуцируются Т-клетки. Роль белков МНС заключается в представлении антигена на поверхности клетки таким образом, чтобы они могли распознаваться Т-клетками. У человека белки МНС I класса кодируются тремя отдельными генетическими локусами, HLA-A, HLA-B и HLA-C. Также существует три гетеродимерных человеческих белка МНС II класса, чьи альфа- и бета-цепи кодируются генами, обозначаемыми HLA-DP, HLA-DQ и HLA-DR. Гены как I класса, так и II класса являются высокополиморфными, что увеличивает разнообразие между индивидуумами в популяции. Поскольку в активации Т-клеток ключевую роль играет комплекс антиген/МНС, целью данного исследования явилось ингибирование связывания антигена с молекулами МНС в аутоиммунных заболеваниях. При аутоиммунных заболеваниях неуместный запуск Т-кеточного ответа комплексами «молекула МНС-аутоантиген» приводит к разрушению нормальных тканей. Индивиды наследуют гены МНС гаплотипов HLA-DR, -DP и -DQ, которые ассоциированы со специфическими аутоантигенами и аутоиммунными заболеваниями, такими как рассеянный склероз и ревматоидный артрит. В каждом из таких случаев пациенты с диагностированным аутоиммунным заболеванием несли ген, связанный с МНС. При ревматоидном артрите свыше 80% пациентов имеют гены либо HLA-DR1, либо DR4; при рассеянном склерозе приблизительно 70% имеют HLA-DR2. Разработка ингибиторов клеточного иммунного ответа была основной целью исследования, задачи которого – предотвратить пролиферацию Т-клеток при аутоиммунном заболевании. Yusuf-Makagiansar и др. (2002) Med. Res. Rev. 22(2):146-167, Adorini и др., (1998) Nature, 334, 623-625. Например, в клинических испытаниях II фазы, основанных на этих принципах, Astra-Zeneca имеет частично стабилизированный большой пептидный аналог (ZD 2315), который связывается с DR1/4. Показано, что в мышиных моделях соединение активно in vitro. Cytel, Inc. разработал частично стабилизированный пептид (a(Cha)AAAKTAAAAa-NH2), который связывает молекулы DR, но не вызывает супрессию Т-клеточной пролиферации в ответ на белковые антигены, а также не проявляет активности на животных моделях аутоиммунного заболевания (Lamont и др. (1990), J. Immunol. 144, 2493-2498; Ishioka и др., (1994) J. Immunol. 152, 4310-4319). Предполагается, что недостаток клеточной активности связан с пептидами, поскольку они (а) подвержены быстрому изменению внутри загружаемого эндосомального компартмента, в присутствии HLA-DM, и (b) подвержены расщеплению протеолитическими ферментами класса катепсинов, которые находятся в эндосоме и осуществляют процессинг белковых антигенов. Было определено взаимодействие между пептидами и молекулами МНС в сериях кристаллических структур с высоким разрешением. Stern и др., (1994) Nature 368:215-221; Smith и др., (1998) J. Exp.Med. 188:1511-1520. Общие свойства включают в себя распространенную поли(пролин)II-спиральную конформацию пептидного остова, наличие карманов (которые связывают так называемые якорные остатки) вдоль цепи и сети водородных связей между пептидным остовом и боковыми цепями молекул МНС, которые тянутся вдоль сайта связывания. В другой работе требования для связывания пептидов определяли путем исследования структурной активности (Hammer J. и др., (1993) Cell 74:197-203) библиотеками пептидов при помощи фагового дисплея. 2.2 Рассеянный склероз Рассеянный склероз представляет собой хроническое аутоиммунное заболевание демиелинизации центральной нервной системы, от которого страдает свыше 2 миллионов пациентов во всем мире, и примерно 350 000 пациентов в США, в среднем еженедельно такой диагноз устанавливают у 200 новых пациентов. За исключением травмы рассеянный склероз является основной причиной неврологического нарушения функций у взрослых от молодого до среднего возраста. Заболевание обычно является прогрессирующим, инвалидизирующим и поражает сложную систему организма. Следовательно, остается необходимость в эффективной терапии рассеянного склероза вдобавок к другим аутоиммунным заболеваниям. При рассеянном склерозе антигенные пептиды, происходящие из нервных миелиновых оболочек, связываются с HLA-DR2-молекулой MHC II класса. Специфический аллель, HLA-DR2 MHC II класса (DRA*0101/DRB1*1501), тесно ассоциирован с рассеянным склерозом. У людей, происходящих из северной Европы, приблизительно 70% пациентов с рассеянным склерозом несут ген HLA-DR2. Giordano, M. и др., (2002) Am. J. Pharmacogenomics 2:37-58. Следовательно, в качестве эффективной терапии для лечения или предотвращения рассеянного склероза производится поиск соединений, способных ингибировать связывание антигена посредством HLA-DR2 MHC II класса. Дополнительное исследование сфокусировано на структурных требованиях для связывания соединения с DR2-молекулами путем исследования пептидов, которые содержат основной белок миелина (“MBP”). Wucherpfennig и др., (1994) J.Exp.Med. 179:279-290. Было обнаружено, что иммунодоминантный пептид МВР (84-102) связывается с высоким сродством с молекулами DRB1*1501 и DRB5*0101 DR2-гаплотипа, связанного с заболеванием. Другие сегменты пептида, которые включены в этот пептид, также являются критичными для связывания с этими молекулами. Было показано, что гидрофобные остатки (Val189 и Phe92) в сегменте МВР (88-95) были критичными для связывания пептида с DRB1*1501-молекулами, и такие гидрофобные и заряженные остатки (Phe92, Lys93) в последовательности МВР (89-101/102) способствовали связыванию с DRB5*0101. Эти остатки необходимы для профилактики или лекарственных препаратов, которые могут быть использованы для лечения или предупреждения аутоиммунных заболеваний, более конкретно рассеянного склероза. Настоящее изобретение связано с этими и другими потребностями в фармацевтической области. 3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ В одном из вариантов осуществления настоящее изобретение относится к новым соединениям, которые пригодны в качестве лекарственных средств, более конкретно для лечения или предупреждения аутоиммунных заболеваний или нарушений. В одном из вариантов осуществления соединения согласно изобретению пригодны для ингибирования связывания антигена с молекулами МНС II класса как in vitro, так и in vivo, более конкретно с молекулами HLA-DR1 МНС II класса, HLA-DR2 МНС II класса или HLA-DR4 МНС II класса. В другом варианте осуществления настоящее изобретение относится к соединениям, пригодным для ингибирования представления антигена молекулами МНС II класса, более конкретно молекулой HLA-DR1 МНС II класса, HLA-DR2 МНС II класса или HLA-DR4 МНС II класса. В другом варианте осуществления настоящее изобретение относится к соединениям, пригодным для ингибирования Т-клеточной пролиферации у животных, более конкретно у млекопитающих, включая человека. В другом варианте осуществления настоящее изобретение относится к способу лечения или предупреждения заболеваний, реагирующих на ингибирование связывания антигена с молекулами МНС II класса, более конкретно с молекулой HLA-DR1 МНС II класса, HLA-DR2 МНС II класса или HLA-DR4 МНС II класса, включающему в себя введение эффективного количества соединения согласно изобретению нуждающемуся в этом пациенту. В предпочтительном варианте осуществления HLA-DR-молекула МНС II класса представляет собой HLA-DR2-молекулу МНС II класса. Настоящее изобретение также относится к способу ингибирования связывания антигена с молекулами МНС II класса, включающему в себя взаимодействие клетки с эффективным количеством соединения согласно изобретению. В другом варианте осуществления настоящее изобретение относится к способу лечения или предупреждения заболеваний, реагирующих на представление антигена молекулой МНС II класса, более конкретно молекулой HLA-DR1 МНС II класса, HLA-DR2 МНС II класса или HLA-DR4 МНС II класса, включающему в себя введение эффективного количества соединения согласно изобретению нуждающемуся в этом пациенту. В предпочтительном варианте осуществления HLA-DR молекула МНС II класса представляет собой HLA-DR2 молекулу МНС II класса. Настоящее изобретение также относится к способу ингибирования представления антигена молекулой МНС II класса, включающему в себя взаимодействие клетки с эффективным количеством соединения согласно изобретению. В другом варианте осуществления настоящее изобретение относится к способу лечения или предупреждения заболевания, реагирующего на ингибирование Т-клеточной пролиферации, включающему в себя введение эффективного количества соединения согласно изобретению нуждающемуся в этом пациенту. Настоящее изобретение также относится к способу ингибирования Т-клеточной пролиферации, включающему в себя взаимодействие клетки с эффективным количеством соединения согласно изобретению. В другом варианте осуществления настоящее изобретение относится к способу лечения или предупреждения аутоиммунного заболевания или нарушения, включающему в себя введение эффективного количества соединения согласно изобретению нуждающемуся в этом пациенту. 4. ОСУЩЕСТВЛЕНИЕ СОГЛАСНО ИЗОБРЕТЕНИЮ 4.1 Определения В настоящем описании термин “пациент” означает животное (например, корову, лошадь, овцу, свинью, цыпленка, индейку, куропатку, кошку, собаку, мышь, крысу, кролика, морскую свинку), более предпочтительно млекопитающее, такое как не-примат и примат (например, обезьяну или человека), наиболее предпочтительно человека. В одном из вариантов осуществления первичное обследование используется для определения того, имеет ли пациент или является ли он восприимчивым к приобретению иммунного, аутоиммунного или воспалительного заболевания или нарушения вследствие наличия гена или генов МНС II класса, связанных с заболеванием. В настоящем описании термин “замещенный” означает группу, замещенную от одного до четырех или более заместителями, такими как алкил, галоген, трифторметил, трифторметокси, гидрокси, алкокси, циклоалкокси, гетероциклоокси, оксо, алканоил, арил, арилокси, аралкил, алканоилокси, амино, алкиламино, алкиламиноалкил, алкиламидо, ариламино, аралкиламино, циклоалкиламино, гетероциклоамино, моно и дизамещенный амино, в котором два заместителя на аминогруппе выбирают из алкила, арила, аралкила, алканоиламино, ароиламино, аралканоиламино, замещенного алканоиламино, замещенного ариламино, замещенного аралканоиламино, гидрокси, гидроксиалкила, алкоксиалкила, тиола, алкилтио, арилтио, аралкилтио, циклоалкилтио, гетероциклотио, алкилтионо, арилтионо, аралкилтионо, алкилсульфонила, арилсульфонила, аралкилсульфонила, сульфонамидо (например, SO2NH2), замещенного сульфонамидо, нитро, циано, карбокси, карбамила (например, CONH2), замещенного карбамила (например, CONH алкил, CONH арил, CONH аралкил или примеры, в которых имеются два заместителя на азоте, выбранные из алкила, арила или аралкила), алкоксикарбонила, арила, замещенного арила, гуанидино и гетероциклов, таких как индолил, имидозолил, фурил, тиенил, тиазолил, пирролидил, пиридил, пиримидил и т.п. Причем, как указано выше, сами заместители дополнительно замещены такими дополнительными заместителями, которые выбраны из группы, содержащей галоген, алкил, алкокси, арил и аралкил. В настоящем описании термин “алкил” означает замещенную линейную цепь или разветвленный нециклический углеводород, имеющий от 1 до 20 атомов углерода, предпочтительно 1-10 атомов углерода, и наиболее предпочтительно 1-4 атомов углерода. Характерные замещенные алкилы с линейной цепью включают в себя -метил, -этил, -н-пропил, -н-бутил, -н-пентил, -н-гексил, -нептил, -н-октил, -н-нонил и -н-децил; в то время как замещенные разветвленные алкилы включают в себя -изопропил, -втор-бутил, -изобутил, -трет-бутил, -изопентил, 2-метилбутил, 3-метилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилбутил, 2,3-диметилпентил, 2,4-диметилпентил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилпентил, 2,2-диметилгексил, 3,3-диметилпентил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилпентил, 3-этилпентил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, 2-метил-4-этилпентил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2-метил-4-этилгексил, 2,2-диэтилпентил, 3,3-диэтилгексил, 2,2-диэтилгексил, 3,3-диэтилгексил и т.п. Группа алкила может быть незамещенной или замещенной. Незамещенные алкильные группы включают в себя группы алкенила и группы алкинила, которые будут рассмотрены ниже. В настоящем описании термин “алкенил” означает линейную цепь или разветвленный нециклический углеводород, имеющий от 2 до 20 атомов углерода, более предпочтительно 2-10 атомов углерода, наиболее предпочтительно 2-6 атомов углерода и включающий в себя по меньшей мере одну двойную связь углерод-углерод. Характерные линейная цепь и разветвленные (C2-C10)алкенилы включают в себя -винил, -аллил, -1-бутенил, -2-бутенил, изобутиленил, -1-пентенил, -2-пентенил, -3-метил-1-бутенил, -2-метил-2-бутенил, -2,3-диметил-2-бутенил, -1-гексенил, -2-гексенил, -3-гексенил, -1-гептенил, -2-гептенил, -3-гептенил, -1-октенил, -2-октенил, -3-октенил, -1-ноненил, -2-поненил, -3-ноненил, -1-деценил, -2-деценил, -3-деценил и т.п. Двойная связь алкенильной группы может быть не связана или связана с другой незамещенной группой. Алкенильная группа может быть незамещенной или замещенной. В настоящем описании термин “алкинил” означает линейную цепь или разветвленный нециклический углеводород, имеющий от 2 до 20 атомов углерода, более предпочтительно 2-10 атомов углерода, наиболее предпочтительно 2-6 атома углерода, и включающий в себя, по меньшей мере, одну тройную связь углерод-углерод. Характерные линейная цепь и разветвленные -(C2-C10)алкинилы включают в себя -ацетиленил, -пропинил, -1-бутинил, -2-бутинил, -1-пентинил, -2-пентинил, -3-метил-1-бутинил, -4-пентинил, -1-гексинил, -2-гексинил, -5-гексинил, -1-гептинил, -2-гептинил, -6-гептинил, -1-октинил, -2-октинил, -7-октинил, -1-нонинил, -2-нонинил, -8-нонинил, -1-децинил, -2-децинил, -9-децинил и т.п. Тройная связь алкинильной группы может быть не соединена или соединена с другой незамещенной группой. Алкинильная группа может быть незамещенной или замещенной. В настоящем описании термин “ацил” означает группу алканоила или ароила, включающую в себя ацетил, безоил, пивалоил, циннамоил и т.п. В настоящем описании термин “галоген” или “гало” означает фтор, хлор, бром или йод. В настоящем описании термин “сульфонамидо” означает арил-SONH- или алкил-SONH, где арил и алкил представлены, как определено выше, включая бензенсульфонамидо, метансульфонамидо и т.п. В настоящем описании термин “алкилсульфонил” означает -SO2-алкил, где алкил представлен, как определено выше, включая -SO2-CH3, -SO2-CH2CH3, -SO2-(CH2)2CH3, -SO2-(CH2)3CH3, -SO2-(CH2)4CH3, -SO2-(CH2)5CH3 и т.п., а также включая алкилсульфоновую кислоту, включающую в себя -CH2-SO3H, (CH2)2-SO3H и т.п. В настоящем описании термин “карбоксил” и “карбокси” означает -COO–. В настоящем описании термин “алкокси” означает -O-(алкил), где алкил представлен, как определено выше, включая -OCH3, -OCH2CH3, -O(CH2)2CH3, -O(CH2)3CH3, -O(CH2)4CH3, -O(CH2)5CH3 и т.п. В настоящем описании термин “алкоксикарбонил” означает -C(=O)O-(алкил), где алкил представлен, как определено выше, включая -C(=O)O-CH3, -C(=O)O-CH2CH3, -С(=О)О-(СН2)2СН3, -C(=O)O-(CH2)3CH3, -C(=O)O-(CH2)4CH3, -C(=O)O-(CH2)5CH3 и т.п. В предпочтительном варианте осуществления эфиры представляют собой биогидролизируемые (например, эфир гидролизуется до карбоновой кислоты in vitro или in vivo). В настоящем описании термин “алкоксиалкил” означает -(алкил)-O-(алкил), где каждый “алкил” независимо является группой алкила, как определено выше, включая -CH2OCH3, -С2ОСН2СНз, -(СН2)2ОСН2СН3, -(СН2)2О(СН2)2СН3 и т.п. В настоящем описании термин “арил” означает ароматическое карбоциклическое кольцо, содержащее от 5 до 14 атомов в кольце. Все атомы в кольце карбоциклической арильной группы являются атомами углерода. Структуры арильного кольца включают в себя соединения, имеющие одно или несколько кольцевых структур, таких как моно-, би- или трициклические соединения, а также бензоконденсированные карбоциклические фрагменты, такие как 5,6,7,8-тетрагидронафтил и т.п. Предпочтительно арильная группа представляет собой моноциклическое кольцо, бициклическое кольцо или трициклическое кольцо. Характерные арильные группы включают в себя без ограничений фенил, толил, антраценил, флуоренил, инденил, азуленил, фенантренил и нафтил. Карбоциклическая арильная группа может быть незамещенной или замещенной. В настоящем описании термин “гетероатом” означает атом, отличный от углерода, и в конкретном варианте осуществления N, О или S. В настоящем описании термин “группа гетероатомов” означает группу, содержащую один или несколько гетероатомов, С и H, включая карбоксамидо, аминдино, имино, гуанидино, уреидо, карбамоил и т.п. В настоящем описании термин “гетероарил” означает ароматическое кольцо, содержащее от 5 до 14 кольцевых атомов, и кольцевые атомы содержат по меньшей мере один гетероатом, предпочтительно от 1 до 3 гетероатомов, независимо выбранных из азота, кислорода или серы. Структуры гетероарильного кольца включают в себя соединения, имеющие одну или несколько кольцевых структур, таких как моно-, би- или трициклические соединения, а также конденсированные гетероциклические фрагменты. Характерные гетероарилы представляют собой триазолил, тетразолил, оксадиазолил, пиридил, фурил, бензофуранил, тиофенил, бензотиофенил, хинолинил, пирролил, индолил, оксазолил, бензоксазолил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изоксазолил, пиразолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, циннолинил, фталазинил, хиназолинил, бензохиназолинил, акридинил, пиримидил, оксетанил, азепинил, пиперазинил, морфолинил, диоксанил, тиетанил, и оксазолил. Гетероарильная группа может быть замещенной или незамещенной. В настоящем описании термин “карбоциклический” означает карбоциклическое кольцо, содержащее от 5 до 14 кольцевых атомов. Все кольцевые атомы карбоциклической группы представляют собой атомы углерода. Структуры карбоциклического кольца включают в себя соединения, имеющие одну или несколько кольцевых структур, таких как моно-, би- или трициклические соединения, а также конденсированные карбоциклические и арильные фрагменты, такие как нафтален, антрацен, индан, инден, фенален, фенантрен, бензоциклобутан, бензоциклогептан, тетрагидронафтален и т.п. Предпочтительно карбоциклическая группа представляет собой моноциклическое кольцо, бициклическое кольцо или трициклическое кольцо. Характерные карбоциклические группы включают в себя без ограничений циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п. Карбоциклическая арильная группа может быть замещенной или незамещенной. В настоящем описании термин “гетероциклический” означает кольцо, содержащее от 5 до 14 кольцевых атомов, и кольцевые атомы содержат по меньшей мере один гетероатом, предпочтительно от 1 до 3 гетероатомов в кольце, независимо выбранных из азота, кислорода, или серы. Структуры гетероциклического кольца включают в себя соединения, имеющие одну или несколько структур, таких как моно-, би- и трициклических соединений, а также конденсированные гетероциклические фрагменты. Характерные гетероциклы включают в себя морфолинил, пирролидинонил, пирролидинил, пиперидинил, гидантоинил, валеролактамил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил, имидазолидинил, изоксазолидинил, изотиазолидинил, оксазинанил, пиперазинил, тиазинанил, хинолинил, хроменил, оксатиоланил и т.п. Гетероциклическая группа может быть замещенной или незамещенной. В настоящем описании термин “бициклический” означает систему двух колец, содержащую 9-14 атомов углерода, в которой один или несколько, предпочтительно 1-4 или 1-2, атомов углерода могут быть замещены гетероатомом, таким как O, N или S. Бициклическая кольцевая система может быть замещенной, незамещенной, ароматической или неароматической. Характерные бициклические кольца включают в себя без ограничений индол, изохинолин, хинолин, тетрагидроизохинолин и бензофуран. В настоящем описании термин “трициклический” означает систему трех колец, содержащую от 13-17 атомов углерода, в которой один или несколько, предпочтительно 1-6 или 1-3, атомов углерода могут быть замещены гетероатомом, таким как O, N или S. Трициклическая кольцевая система может быть замещенной, незамещенной, ароматической или неароматической. Характерные трициклические кольца включают в себя без ограничений карбазол, фенотиазин, дибензофуран и флуорен. В настоящем описании термин “арилокси” означает -O-арильную группу, в которой арил представлен, как определено выше. Арилокси группа может быть незамещенной или замещенной. В настоящем описании термин “арилалкил” означает -(алкил)-(арил), где алкил и арил представлены, как определено выше, включая -(CH2)фенил, -(CH2)2фенил, -(СН2)3фенил, -CH(фенил)2, -CH(фенил)3, -(CH2)толил, -(CH2)антраценил, -(CH2)флуоренил, -(CH2)инденил, -(CH2)азуленил, -(CH2)пиридинил, -(CH2)нафтил и т.п. В настоящем описании термин “гетероарилалкил” означает -(алкил)-(гетероарил), где алкил и гетероарил представлены, как определено выше, включая -CH2-триазолил, -CH2-тетразолил, -CH2-оксадиазолил, -CH2-пиридил, -CH2-фурил, -(CH2)2-фурил, -CH2-бензофуранил, -CH2-тиофенил, -CH2-бензотиофенил, -CH2-хинолинил, -CH2-пирролил, -CH2-индолил, -CH2-оксазолил, -CH2-бензоксазолил, -CH2-имидазолил, -(CH2)2-имидазолил, -СН2-бензоимидазолил, -CH2-тиазолил, -CH2-бензотиазолил, -CH2-изоксазолил, -CH2-пиразолил, -CH2-изотиазолил, -CH2-пиридазинил, -CH2-пиримидинил, -CH2-пиразинил, -CH2-триазинил, -CH2-циннолинил, -CH2-фталазинил, -CH2-хиназолинил, -CH2-пиримидил, -CH2-оксетанил, -CH2-азепинил, -CH2-пиперазинил, -CH2-морфолинил, -CH2-диоксанил -CH2-тиетанил, -CH2-оксазолил, -(CH2)2-триазолил и т.п. В настоящем описании термин “гетероалкил” означает алкильную группу, как определено выше, где одна или несколько -CH2– групп замещены гетероатомом, независимо выбранным из азота, кислорода или серы, включающую в себя группы эфира, тиоэфира и алкиламино, такие как -CH2-O-CH3, -CH2-S-CH3, -CH2-NH-CH3, -CH2-O-CH2-CH3, -CH2-S-CH2-CH3, -CH2-NH-CH2-CH3, -CH2-O-(CH2)2-CH3, -CH2-S-(CH2)2-CH3, -CH2-NH-(CH2)2-CH3, -CH2-O-(CH2)3-CH3, -CH2-S-(CH2)3-CH3, -CH2-NH-(CH2)3-CH3, включая гуанидино, амидино и т.п. В настоящем описании термин “гидроксиалкил” означает алкил, где алкил представлен, как определено выше, имеющий один или несколько атомов водорода, замещенных гидрокси, включая -CH2OH, -CH2CH2OH, -(CH2)2CH2OH, -(CH2)3CH2OH, -(CH2)4CH2OH, -(CH2)5CH2OH, -CH(OH)-CH3, -CH2CH(OH)CH3 и т.п. В настоящем описании термин “гидрокси” означает -OH. В настоящем описании термин “оксоарилалкил” означает -O-(алкил)-(арил), где алкил и арил представлены, как определено выше, включая -O-(CH2)2фенил, -O-(CH2)3фенил -O-CH(фенил)2, -O-CH(фенил)3, -О-(CH2)толил, -O-(CH2)антраценил, -О-(CH2)флуоренил -O-(CH2)инденил, -O-(CH2)азуленил, -O-(CH2)пиридинил, -O-(CH2)нафтил и т.п. В настоящем описании термин “циклоалкилокси” означает -O-(циклоалкил), где циклоалкил определен выше. В настоящем описании термин “циклоалкилалкилокси” означает -O-(алкил)-(циклоалкил), где циклоалкил и алкил представлены, как определено выше, включая -O-циклопропил, -O-циклобутил, -O-циклопентил, -O-циклогексил, -O-циклогептил и т.п. В настоящем описании термин “аминоалкокси” означает -O-(алкил)-NH2, где алкил представлен, как определено выше, включая -O-CH2-NH2, -O-(CH2)2-NH2, -O-(CH2)3-NH2, -O-(CH2)4-NH2, -О-(CH2)5-NH2 и т.п. В настоящем описании термин “алкиламино” означает -NH-(алкил) или -N-(алкил)(алкил), где алкил представлен, как определено выше, включая -NH-CH3, -NH-CH2CH3, -NH-(CH2)2CH3, -NH-(CH2)3CH3, -NH-(CH2)4CH3, -NH-(CH2)5CH3, -N-(CH3)2, -N-(CH2CH3)2, -N-((CH2)2CH3)2, -N-(CH3)(CH2CH3) и т.п. В настоящем описании термин “алкиламидо” означает -(алкил)-NH-C(O)(алкил), где каждый “алкил” независимо представляет собой алкильную группу, определяемую выше, включая -СН2-NH-С(О)СН3, -С2-NH-C(O)CH2CH3, -CH2-NH-C(O)(CH2)2CH3, -CH2-NH-C(O)(CH2)3CH3, -CH2-NH-C(O)(CH2)4CH3, -CH2-NH-C(O)(CH2)5CH3, -(CH2)2-NH-C(O)CH3, -(CH2)2-NH-C(O)CH2CH3, -(CH2)2-NH-C(O)(CH2)2CH3 и т.п. или -(алкил)-C(O)-NH-(алкил), где каждый “алкил” независимо представляет собой алкильную группу, определяемую выше, включая -CH2-C(O)-NH-CH3, -CH2-C(O)-NH-CH2CH3, -CH2-C(O)-NH-(CH2)2CH3, -CH2-C(O)-NH-(CH2)3CH3, -CH2-C(O)-NH-(CH2)4CH3, -CH2-C(O)-NH-(CH2)5CH3, -(CH2)2-C(O)-NH-CH3, -(CH2)2-С(О)-NH-СН2СН3, -(СН2)2-C(O)-NH-(CH2)2CH3 и т.п. В настоящем описании термин “диалкиламиноалкил” означает -(алкил)-N(алкил)(алкил), где каждый “алкил” независимо представляет собой алкильную группу, определенную выше, включая -CH2-N(CH3)2, -CH2-N(CH2CH3)2, -CH2-N((CH2)2CH3)2, -СН2-N(СН3)(СН2СН3), -(CH2)2-N(CH3)2 и т.п. В настоящем описании термин “ариламино” означает -NH(арил), где арил представлен, как определено выше, включая -NH(фенил), -NH(толил), -NH(антраценил), -NH(флуоренил), -NH(инденил), -NH(азуленил), -NH(пиридинил), -NH(нафтил) и т.п. В настоящем описании термин “арилалкиламино” означает NH-(алкил)-(арил), где алкил и арил представлены, как определено выше, включая -NH-CH2-(фенил), -NH-CH2-(толил), -NH-CH2-(антраценил), -NH-CH2-(флуоренил), -NH-CH2-(инденил), -NH-CH2-(азуленил), -NH-CH2-(пиридинил), -NH-CH2-(нафтил), -NH-(CH2)2-(фенил) и т.п. В настоящем описании термин “циклоалкиламино” означает -NH-(циклоалкил), где циклоалкил представлен, как определено выше, включая -NH-циклопропил, -NH-циклобутил, -NH-циклопентил, -NH-циклогексил, -NH-циклогептил и т.п. В настоящем описании термин “аминоалкил” означает -(алкил)-NH2, где каждый “алкил” независимо представляет собой алкильную группу, определяемую выше, включая -CH2-NH2, -(CH2)2-NH2, -(СН2)3-NH2, -(CH2)4-NH2, -(CH2)5-NH2 и т.п. В настоящем описании термин “алкиламиноалкил” означает -(алкил)-NH(алкил) или -(алкил)-N(алкил)(алкил), где каждый “алкил” независимо является алкильной группой, определенной выше, включая -CH2-NH-CH3, -CH2-NHCH2CH3, -CH2-NH(CH2)2CH3, -CH2-NH(CH2)3CH3, -CH2-NH(CH2)4CH3, -CH2-NH(CH2)5CH3, -(CH2)2-NH-CH3, -CH2-N(CH3)2, -CH2-N(CH2CH3)2, -CH2-N((CH2)2CH3)2, -CH2-N(CH3)(CH2CH3), -(CH2)2-N(CH3)2 и т.п. В настоящем описании термин “алкоксиаминоалкил” означает -O-алкил-NH(алкил) или -O-алкил-N(алкил)(алкил), где алкил и аминоалкил представлены, как определено выше, включая -OCH2CH2N(CH3)2 и т.п. В настоящем описании термин “фрагмент сахаров” означает моносахариды (например, глюкозу, арабинозу, фукозу, галактозу, маннозу, ксилозу, фруктозу, ликсозу, аллозу, аринозу, рибозу, талозу, гулозу, идозу, альтрозу, сорбит, маннит или глюкозоамин), дисахариды и олигосахариды (например, мальтозу, изомальтозу, туранозу, гентиобиозу, мелибиозу, плантеобиозу, примерерозу, вицианозу, нигерозу, ламинарибиозу, рутинозу, целлобиозу, ксилобиозу, мальтотриозу, гентианозу, мелезитозу, плантеозу, кетозу, трегалозу, сукрозу, лактозу, рафинозу или ксилотриозу), полисахариды (например, амилозу, фикол, декстрин, крахмал, декстран, полидекстрозу, пуллулан, циклодекстрин, глюкоманногликан, глюкоманнан, гуаровую камедь, гуммиарабик или глюкозоаминогликан), сложные углеводороды (например, гликопептид, гликопротеин, гликолипид или протеогликан) и т.п. В настоящем описании термин “ПЭГ” означает группу полиэтиленгликоля, такую как H(OCH2CH2)nOH, где n равно 1-30, 1-25, 1-20, 1-15, 1-10, 1-5 или 1-2. В настоящем описании “терапевтически эффективное количество” относится к такому количеству соединения согласно изобретению или другого активного ингредиента, которого достаточно для обеспечения терапевтического действия при лечении или терапии заболевания (например, генетического заболевания, заболевания центральной нервной системы (“ЦНС”), воспалительного заболевания, нейродегенеративного заболевания или аутоиммунного заболевания) или для ослабления или минимизации симптомов, связанных с заболеванием. Кроме того, терапевтически эффективное количество в отношении соединения согласно изобретению означает такое количество терапевтического агента как такового или в сочетании с другими видами лечения, которое обеспечивает улучшение эффекта лечения или контроля при данном заболевании. Используемый применительно к количеству соединения согласно изобретению, данный термин может включать в себя количество, которое в целом улучшает терапию, уменьшает или устраняет симптомы или причины заболевания или повышает терапевтическую эффективность или синергизм в сочетании с другим терапевтическим агентом. Как используется в настоящем описании, “профилактически эффективное количество” относится к такому количеству соединения согласно изобретению или другого активного ингредиента, которого достаточно для предупреждения рецидивов или распространения заболевания (например, генетического заболевания, заболевания ЦНС, воспалительного заболевания, нейродегенеративного заболевания или аутоиммунного заболевания). Профилактически эффективное количество может относиться к количеству, достаточному для предупреждения первичного заболевания или рецидива или распространения заболевания, или возникновения заболевания у пациента, включая без ограничений, пациента, предрасположенного к заболеванию. Профилактически эффективное количество также может относиться к количеству, которое обеспечивает профилактическую пользу при предупреждении заболевания. Кроме того, профилактически эффективное количество в отношении соединения согласно изобретению означает такое его количество индивидуально или в сочетании с другими агентами, которое обеспечивает профилактическую пользу при предупреждении заболевания. Используемый применительно к количеству соединения согласно изобретению, термин может включать в себя количество, которое в целом улучшает профилактические мероприятия или усиливает профилактическое воздействие или синергизм с другим профилактическим агентом. Как используется в настоящем описании, “терапевтический протокол” относится к режиму хронометрирования и дозирования одного или нескольких терапевтических агентов. Как используется в настоящем описании, “профилактический протокол” относится к режиму хронометрирования и дозирования одного или нескольких профилактических агентов. Как используется в настоящем описании, “протокол” включает в себя схему применения и режимы дозирования. Как используется в настоящем описании, “в комбинации” относится к использованию больше чем одного профилактического и/или терапевтического агента пациентом таким образом, что пациент получает пользу от обоих лекарственных веществ. Лекарственные вещества могут приниматься одновременно или по отдельности. В одном из вариантов осуществления соединение согласно изобретению и другой профилактический или терапевтический агент оказывают свое биологическое воздействие на пациента в течение одного и того же периода времени. Как используется в настоящем описании, термины “предупредить”, “предупреждение” и “профилактика” относятся к профилактике появления, рецидива или распространения заболевания (например, генетического заболевания, заболевания ЦНС, воспалительного заболевания, нейродегенеративного заболевания или аутоиммунного заболевания) у пациента. В одном из вариантов осуществления пациент проявляет признаки аутоиммунного заболевания, более конкретно рассеянного склероза, или имеет первое патологическое поражение и прием соединения согласно изобретению предупреждает ухудшение симптомов или структур дополнительных поражений. Как используется в настоящем описании, термины “лечить”, “лечение” и “терапия” относятся к устранению или облегчению заболевания (например, генетического заболевания, заболевания ЦНС, воспалительного заболевания, нейродегенеративного заболевания или аутоиммунного заболевания) или симптомов, связанных с заболеванием, или к лечению заболевания, которое в результате не приводит к излечению заболевания или не облегчает заболевание, но предупреждает его развитие. В некоторых вариантах осуществления такие термины относятся к минимизации распространения или ухудшения заболевания в результате применения одного из соединений согласно изобретению пациентом с таким заболеванием. В одном из вариантов осуществления пациенту вводят одно или несколько соединений согласно изобретению для лечения заболевания, с тем чтобы предупредить прогрессирование или ухудшение заболевания. Как используется в настоящем описании, термин “фармацевтически приемлемые соли” относится к солям, полученным из фармакологически приемлемых нетоксичных кислот или оснований, включая неорганические кислоты и основания и органические кислоты и основания. Подходящие фармацевтически приемлемые соли присоединения основания для соединения согласно изобретению включают в себя соли металлов, образованные из алюминия, кальция, лития, магния, калия, натрия и цинка или органических солей образованных из лизина, N,N’-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина (N-метилглюкамина) и прокаина. Подходящие нетоксичные кислоты включают в себя без ограничений неорганические и органические кислоты, такие как уксусная, альгиновая, аминобензойная, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуранкарбоновая, галактуроновая, глюконовая, глюкуроновая, глутаминовая, гликолевая, бромистоводородная, хлористоводородная, изэтиновая, молочная, малеиновая, оксиянтарная, миндальная, метансульфоновая, муциновая, азотная, памовая, пантотеиновой, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, янтарная, сульфаниловая, серная, виннокаменная кислота и п-толуолсульфоновая кислота. Специфические нетоксичные кислоты включают в себя хлористоводородную, бромистоводородную, фосфорную, серную и метансульфоновую кислоты. Примеры таких специфических солей включают в себя соли гидрохлориды и мезилаты. Как используется в настоящем описании, термин “пролекарство” означает производное соединения, которое может гидролизоваться, окисляться или реагировать иным образом в биологических условиях (in vitro или in vivo) для обеспечения активного соединения, более конкретно соединения согласно изобретению. Примеры пролекарств включают в себя без ограничений производные и метаболиты соединения согласно изобретению, которые включают в себя биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды, биогидролизуемые липиды и биогидролизуемые фосфатные аналоги. Предпочтительно пролекарства соединений с карбоксильными функциональными группами представляют собой сложные эфиры низших алкилов карбоновой кислоты. Карбоксилатные сложные эфиры обычно образуют этерифицированием любого из фрагментов карбоновой кислоты, присутствующей в молекуле. Пролекарства обычно могут быть получены хорошо известными способами, такими как способы, описанные в Burger’s Medicinal Chemistry and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley) и Design and Application of Prodrugs (H. Bundgaard ed., 1985, Harwood Academic Publishers Gmfh). В настоящем описании термины “биогидролизуемый амид”, “биогидролизуемый сложный эфир”, “биогидролизуемый карбамат”, “биогидролизуемый карбонат”, “биогидролизуемый уреид”, “биогидролизуемый фосфат” означают амид, сложный эфир, карбамат, карбонат, уреид или фосфат соответственно соединение, которое либо: 1) не мешает биологической активности соединения, но может придать такие преимущественные свойства соединению in vivo, как усвоение, длительность действия или проявление действия; либо 2) является биологически не активным, но преобразуется in vivo в биологически активное соединение. Примеры биогидролизуемых сложных эфиров включают в себя без ограничений сложные эфиры низших алкилов, алкоксиацилокси сложные эфиры, алкилациламиноалкил сложные эфиры и сложные эфиры холина. Примеры биогидролизуемых амидов включают в себя без ограничений амиды низших алкилов, амиды Как используется в настоящем описании, термин “оптически чистый” или “стереоизомерно чистый” означает композицию, которая содержит один стереоизомер соединения и по существу является свободной от других стереоизомеров такого соединения. Например, стереоизомерно чистая композиция соединения, имеющая один хиральный центр, по существу может быть свободной от противоположных энантиомеров данного соединения. Стереоизомерно чистая композиция соединения, имеющая два хиральных центра, по существу может быть свободной от других диастереомеров данного соединения. Обычно стереоизомерно чистое соединение содержит больше чем примерно 80% по весу одного стереоизомера соединения и меньше чем примерно 20% по весу других стереоизомеров соединения, более предпочтительно больше чем примерно 90% по весу одного стереоизомера соединения и меньше чем примерно 10% по весу других стереоизомеров соединения, еще более предпочтительно больше чем примерно 95% по весу одного стереоизомера соединения и меньше чем примерно 5% по весу других стереоизомеров соединения, и наиболее предпочтительно больше чем примерно 97% по весу одного стереоизомера соединения и меньше чем примерно 3% по весу других стереоизомеров соединения. В настоящем описании термин “энантиомерно чистый” означает стереоизомерно чистую композицию соединения, имеющую один или несколько хиральных центров. В настоящем описании термин “соединение согласно изобретению” означает соединение, описанное в настоящем изобретении, которое способно ингибировать связывание антигена с молекулой HLA-DR 1, 2 или 4 MHC II класса или ингибировать T-клеточную пролиферацию in vitro или in vivo. Такая ингибиторная активность может быть определена при помощи анализа или животной модели, хорошо известной в данной области, включая таковые, определяемые далее в разделе 5. Соединение согласно изобретению может быть в виде его фармацевтически приемлемого пролекарства, соли, сольвата или гидрата. Соединения согласно изобретению также могут быть “защищенными”, где защита представляет собой группу, такую как ацильная группа, сульфонильная группа, группа, содержащая ПЭГ-группу, фрагмент сахара или алкильную группу, замещенную одной или несколькими гидрокси-группами. Примеры защитных групп включают в себя, без ограничения, -NHCH3, -NHAc, -CO2R, -CO2Ac и -CO2NR2 (где каждое наличие R является независимым от H или алкила). Дополнительные примеры защитных групп включают в себя группы, раскрытые в патенте США № 6020315, выданном 1 февраля 2000 г., включенном в настоящее описание во всей своей полноте в качестве ссылки. В предпочтительном варианте осуществления соединение согласно изобретению представляет собой соединение структуры I-IV. В настоящем описании термины “встречающиеся в природе аминокислоты” или “природные аминокислоты” относится к любой из 20 встречающихся в природе L-аминокислот, как определено ниже в таблице 1, и также включают в себя смеси, которые содержат примерно 0,1%, примерно 0,5%, примерно 1%, примерно 5%, примерно 10%, примерно 25%, примерно 50%, примерно 75%, примерно 90%, примерно 95%, примерно 99%, примерно 99,5% или примерно 99,9% по весу соответствующей D-аминокислоты. Аминокислоты могут быть использованы для получения соединения согласно изобретению или представлять собой его часть. Связь между каждой аминокислотой соединений согласно изобретению может быть амидной, по существу амидом или изостером амида.
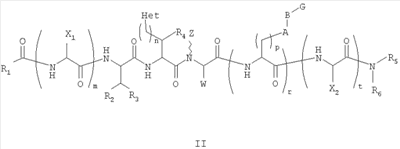
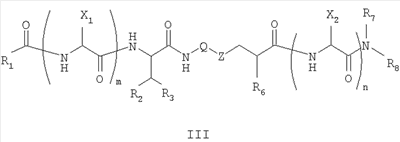
Как используется в настоящем описании, термины “аминокислота неприродного происхождения”, или “неприродная аминокислота”, относится к любой природной аминокислоте, которая модифицирована, или любой структуре, имеющей амино- и карбоксильную группу (например, орнитин), включая пептидомиметики, включающие в себя более одной аминокислоты, или непептидомиметики пептидов, имеющие замены остова для пептидного остова, представленные ниже Р1 Р2, Р3, Р4, Р5, Р6, Р7, P8, P9, P10. Дополнительные миметические группы, которые могут быть включены в соединение согласно изобретению, включают в себя группы, раскрытые в Gillespie и др. (1997) Biopolym. Pep. Science 43:191. Неприродные аминокислоты также включают в себя D-изомеры аминокислот, приведенных в таблице 1. Настоящее изобретение дополнительно охватывает соединения, которые могут быть составлены как из D-, так и из L-изомеров неприродных аминокислот, а также из других изомерных форм неприродных аминокислот (например, геометрические изомеры, позиционные изомеры и стереоизомеры). Неклассические аминокислоты или химические аналоги аминокислот также используются для получения или являются частью соединений согласно изобретению. Неклассические аминокислоты обычно включают в себя без ограничений D-изомеры (R-кнфигурация) обычных аминокислот, 4.2 Соединения согласно изобретению Настоящее изобретение предоставляет соединения формул I-IV (“соединение(соединения) согласно изобретению”), фармацевтические композиции, содержащие соединения согласно изобретению и способы их применения. Не ограничивая себя какой-либо теорией, авторы полагают, что соединения согласно изобретению являются модуляторами представления антигена HLA-DR молекулами MHC II класса. В одном из вариантов осуществления соединения согласно изобретению представляют собой соединения формулы I: К1-Р1-Р2-Р3-Р4-Р5-Р6-Р7-Р8-Р9-Р10-К2 или их фармацевтически приемлемые соли, где K1 представляет собой необязательный заместитель, который, если присутствует, представляет собой алкил-C(O)-, гидроксиалкил-C(O)-, аралкил-C(O)-, гетероарилалкил-C(O), алкокси-C(O)-, алкоксикарбонилалкил-C(O)-, амино-C(O)-, моноалкиламино-C(O)-, диалкиламино-C(O)-, аминоалкил-C(O)-, моноалкиламиноалкил-C(O)-, диалкиламиноалкил-C(O)-, NH2(CH2)4C(O)-, NH2(CH2)3C(O)-, гидроксиалкил, сульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, арилсульфонил или фрагмент сахара; P1-P10 представляют собой необязательные заместители, которые, если присутствуют, представляют собой каждый независимо аминоацильные группы природных аминокислот или неприродных аминокислот, включая аминокислоты, приведенные ниже в таблице 2 (где n представляет собой целое число, изменяющееся в пределах от 1 до 4), причем присутствуют по меньшей мере три из P1-P10, и по меньшей мере один из P1-P10, или по меньшей мере два из P1-P10, или по меньшей мере три из P1-P10, или по меньшей мере четыре из P1-P10, или по меньшей мере пять из P1-P10, или по меньшей мере шесть из P1-P10, или по меньшей мере семь из P1-P10, или по меньшей мере восемь из P1-P10, или по меньшей мере девять из P1-P10, или по меньшей мере все из P1-P10 являются неприродными аминокислотами или пептидомиметиками; K2 представляет собой необязательный заместитель, который, если присутствует, представляет собой -OH (образуя аминокислотную группу с P10), амино (образуя аминокислотный амид с Р10), или аминогруппу, замещенную линейным или разветвленным алкилом, гидроксиалкилом, гетероалкилом, арилалкилом, гетероарилалкилом, алкокси, алкоксикарбонилом, алкоксиалкилом, оксоарилалкилом, аминоалкилом, алкиламиноалкилом, диалкиламиноалкилом и т.п. В одном из вариантов осуществления соединения формулы I имеют 2-10 или 3-10 P групп. В другом варианте осуществления соединения формулы I имеют 2-8 или 3-8 P групп. В другом варианте осуществления соединения формулы I имеют 2-6 или 3-6 P групп. В другом варианте осуществления соединения формулы I имеют 2-4 или 3-4 P групп. В другом варианте осуществления соединения формулы I имеют 4-8 P групп. В другом варианте осуществления соединения формулы I имеют 4-6 P групп. В одном варианте осуществления все соединения формулы I содержат L-остатки. В одном варианте осуществления соединения формулы I содержат один или более, два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более или девять или более остатков в D-конфигурации. В другом варианте осуществления все соединения формулы I содержат D-остатки. В одном варианте осуществления P8-P10 включают в себя любую из групп, приведенных ниже в таблице 2. Иллюстративные не ограничивающие примеры P1-P10 включают в себя непрерывную последовательность остатков, выбранных из остатков, описанных в таблице 2 (где n представляет собой целое число, изменяющееся в пределах от 1 до 4), ниже. Где приведенные выше аббревиатуры соответствуют следующим структурам: К тому же каждая из нижеследующих формул включена в качестве иллюстративного примера соединений согласно изобретению: Без ограничения рамками какой-либо теории в одном из вариантов осуществления минимальная активная формула содержит К1, К2 и три Р-группы (например, К1-Р(1-10)-Р(1-10)-Р(1-10)-К2). В другом варианте осуществления К1 и К2 являются необязательными в активной формуле. В другом варианте осуществления соединения согласно изобретению являются соединениями формулы II: или их фармацевтически приемлемые соли, где R1 представляет собой линейный или разветвленный алкил, ПЭГ, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино, гуанидино, гидроксиалкил или фрагмент сахара; X1 представляет собой линейный или разветвленный алкил, гидроксиалкил, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино или гуанидино; X2 представляет собой линейный или разветвленный алкил, гидроксиалкил, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино или гуанидино; R2 и R3 независимо представляют собой водород, линейный или разветвленный алкил, алкокси, алкоксиалкил; или R2 и R3, взятые вместе, образуют замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо; или R2 и R3, взятые вместе, образуют замещенное или незамещенное бициклическое кольцо; R4 представляет собой водород, линейный или разветвленный алкил, алкокси, алкоксикарбонил, гидроксиалкил или гидрокси; Het представляет собой гетероатом, содержащий группу, такую как -NH, -SH, -OH, гетероалкил, алкиламино, амноалкил, алкиламиноалкил, алкиламидо, диалкиламиноалкил, аминоалкокси или замещенное или незамещенное гетероциклическое кольцо; R5 и R6 независимо представляют собой водород, линейный или разветвленный алкил, ПЭГ, гидроксиалкил, гетероалкил, CH3C(O)-, NH2(CH2)4C(O)-, NH2(CH2)3C(O)-, или фрагмент сахара; или R5 и R6, взятые вместе, образуют замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо; или, если r равно 0, и t равно 0, R6 может быть (CH2)P-A-B-G; Z представляет собой водород, линейный или разветвленный алкил, гетероалкил; или Z взятое вместе с W, может образовать замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое ароматическое кольцо, замещенное или незамещенное 5-7-членное ароматическое кольцо; или Z, взятое вместе с W, может образовать замещенное или незамещенное бициклическое кольцо; W представляет собой линейный или разветвленный алкил, замещенный или незамещенный арил или замещенный или незамещенный арилалкил; A представляет собой замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо, замещенное или незамещенное 9-14-членное бициклическое кольцо; или замещенное или незамещенное 13-17-членное трициклическое кольцо; B представляет собой необязательный заместитель, который, если присутствует, представляет собой -CHY-, -YCH-, -Y(CH)q-, -(CH)qY-; YG- или GY-; G представляет собой необязательный заместитель, который, если присутствует, представляет собой линейный или разветвленный алкил, замещенный или незамещенный гетероалкил, замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо; Y представляет собой O, S или NR2R3; m равно целому числу между 0-3; n равно целому числу между 0-4, так что -CH2– отсутствует, присутствует или составляет цепь до четырех метильных групп; r равно целому числу между 0-3; t равно целому числу между 0-3; p равно целому числу между 0-4, так что -CH2– отсутствует, присутствует или составляет цепь до четырех метильных групп; и q равно целому числу между 1-3, где соединения формулы II не включают в себя все природные L-аминокислотные пептиды. В одном из вариантов осуществления все соединения формулы II содержат L-остатки. В одном из вариантов осуществления соединения формулы II содержат один или более, два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, девять или более остатков в D-конфигурации. В другом варианте осуществления все соединения формулы II содержат D-остатки. В предпочтительном варианте осуществления соединения согласно изобретению представляют собой соединения формулы III: или их фармацевтически приемлемые соли, где R1 представляет собой линейный или разветвленный алкил, ПЭГ, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино, гуанидино, гидроксиалкил или фрагмент сахара; X1 представляет собой линейный или разветвленный алкил, гидроксиалкил, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино или гуанидино; X2 представляет собой линейный или разветвленный алкил, гидроксиалкил, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино или гуанидин, или (СН2)р-А-В-G, как определено ранее в формуле II; R2 и R3 независимо представляют собой водород, линейный или разветвленный алкил, алкокси, алкоксиалкил; или R2 и R3, взятые вместе, образуют замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо; или R2 и R3, взятые вместе, образуют замещенное или незамещенное 9-14-членное бициклическое кольцо; Q представляет собой -CH2, -CHR4, -NH или -NR4; R4 представляет собой водород, линейный или разветвленный алкил, алкокси, гидроксиалкил или гидрокси; Z представляет собой -CH2, -C(О) или -CHOH, где Q представляет собой -CH2 или -CHR4, и Z представляет собой -CH2 или -C(O), если Q представляет собой -NH или -NR4; R6 представляет собой линейный или разветвленный алкил, арилалкил, гетероарилалкил, алкокси, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо; R7 представляет собой водород, линейный или разветвленный алкил, ПЭГ, гидроксиалкил, гетероалкил, CH3C(O)-, NH2(CH2)4C(O)-, NH2(CH2)3C(O)-, фрагмент сахара, замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо; R8 представляет собой водород, линейный или разветвленный алкил, ПЭГ, гидроксиалкил, гетероалкил, CH3C(O)-, NH2(CH2)4C(O)-, NH2(CH2)3C(O)-, фрагмент сахара, замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо, или, если n равно 0, R8 может быть (CH2)P-A-B-G; A представляет собой замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо, замещенное или незамещенное 9-14-членное бициклическое кольцо; или замещенное или незамещенное 13-17-членное трициклическое кольцо; B представляет собой необязательный заместитель, который, если присутствует, представляет собой -CHY-, -YCH-, -Y(CH)q-, -(CH)qY-; YG- или GY-; G представляет собой необязательный заместитель, который, если присутствует, представляет собой линейный или разветвленный алкил, замещенный или незамещенный гетероалкил, замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо; Y представляет собой O, S или NR2R3; m равно целому числу от 0-3; n равно целому числу от 0-4; p равно целому числу между 0-4; и q равно целому числу между 1-3, где соединения формулы III не включают в себя все природные L-аминокислотные пептиды. В одном из вариантов осуществления все соединения формулы III содержат L-остатки. В одном из вариантов осуществления соединения формулы III содержат один или более, два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, девять или более остатков в D конфигурации. В другом варианте осуществления все соединения формулы III содержат D-остатки. В другом предпочтительном варианте осуществления соединения согласно изобретению представляют собой соединения формулы IV: или их фармацевтически приемлемые соли, где: R1 представляет собой линейный или разветвленный алкил, ПЭГ, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино, гуанидино, гидроксиалкил или фрагмент сахара; X1 представляет собой линейный или разветвленный алкил, гидроксиалкил, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино или гуанидино; X2 представляет собой линейный или разветвленный алкил, гидроксиалкил, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино или гуанидино; R2 и R3 независимо представляют собой водород, линейный или разветвленный алкил, алкокси, алкоксиалкил; или R2 и R3, взятые вместе, образуют замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероароматическое кольцо, замещенное или незамещенное 5-7-членное арильное кольцо; или R2 и R3, взятые вместе, образуют замещенное или незамещенное 9-14-членное бициклическое кольцо; Q представляет собой -CH2, -CHR4, -NH или -NR4; R4 представляет собой водород, линейный или разветвленный алкил, алкокси, гидроксиалкил или гидрокси; Z представляет собой -CH2, -C(O) или -CHOH, если Q представляет собой -CH2 или -CHR4, и Z представляет собой -CH2 или -C(O), если Q представляет собой -NH или -NR4; R6 представляет собой линейный или разветвленный алкил, гидроксиалкил, гетероалкил, арилалкил, гетероарилалкил, алкокси, алкоксикарбонил, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, амидино или гуанидино; R7 представляет собой линейный или разветвленный алкил, арилалкил, гетероарилалкил, алкокси, алкоксиалкил, оксоарилалкил, аминоалкил, алкиламиноалкил, диалкиламиноалкил, замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо, или (CH2)P-A-B-G, как определено выше в формуле II; R8 представляет собой водород, линейный или разветвленный алкил, ПЭГ, гидроксиалкил, гетероалкил, CH3C(O)-, NH2(CH2)4C(O)-, NH2(CH2)3C(O)-, фрагмент сахара, замещенное или незамещенное 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, замещенное или незамещенное 5-7-членное гетероарильное кольцо, замещенное или незамещенное 5-7-членное арильное кольцо; m равно целому числу между 0-3; n равно целому числу между 0-3; t равно целому числу между 1-4; и p равно целому числу между 0-4. В одном из вариантов осуществления все соединения формулы IV содержат L-остатки. В одном из вариантов осуществления соединения формулы IV содержат один или более, два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, девять или более остатков в D-конфигурации. В другом варианте осуществления соединения формулы IV все содержат D-остатки. В одном из вариантов осуществления соединения формулы I представляют собой соединения, приведенные далее в таблице 3, ниже, или их фармацевтически приемлемые соли, которые предоставлены в данном описании для иллюстрации, а не для ограничения.
Соединения в таблице 3 могут быть проанализированы как С-терминальные амиды с использованием протокола анализа, приведенного далее в разделе 5.4. Предпочтительные соединения согласно изобретению представляют собой соединения со значением IC50, меньшим чем примерно 25 мкМ, меньшим чем примерно 10 мкМ, меньшим чем примерно 2,5 мкМ, меньшим чем примерно 1 мкМ, меньшим чем примерно 500 нМ, меньшим чем примерно 250 нМ, меньшим чем примерно 100 нМ, меньшим чем примерно 50 нМ, меньшим чем примерно 25 нМ, меньшим чем примерно 10 нМ, меньшим чем примерно 5 нМ или меньшим чем примерно 1 нМ, с использованием протокола, приведенного далее в разделе 5.4. В одном из вариантов осуществления все соединения таблицы 3 содержат L-остатки. В одном из вариантов осуществления соединения таблицы 3 содержат один или более, два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, девять или более остатков в D-конфигурации. В другом варианте осуществления все соединения таблицы 3 содержат D-остатки. Также в объем согласно изобретению включены “блокированные” формы соединений согласно изобретению, т.е. формы, в которых N- и/или C-концы заблокированы фрагментом, способным реагировать с N-терминальным -NH2 или C-терминальным -C(O)OH. В одном из вариантов осуществления N-терминальные группы блокирования включают в себя RC(O)-, где R представляет собой -H, (C1-6) алкил, (C1-6) алкенил, (C1-6) алкинил, (C5-20) арил, (C6-26) алкарил, 5-20-членный гетероарил или 6-26-членный алкилгетероарил. В конкретном варианте осуществления N-терминальные группы блокирования включают ацетил, формил и дансил. В одном из вариантов осуществления C-терминальные группы блокирования включают в себя -C(O)NRR и -C(O)OR, где каждое R независимо определено, как указано выше. В конкретном варианте осуществления C-терминальные группы блокирования включают в себя группы, где каждое R независимо представляет собой метил. Предпочтительные соединения согласно изобретению представляют собой соединения формул I-IV, которые устойчивы к разрушению катепсином, более конкретно катепсином B, D или L. В предпочтительном варианте осуществления соединения формул I-IV имеют период полураспада, больший чем примерно 1 час, в растворе, содержащем катепсин B, предпочтительно больший, чем примерно 2 часа, более предпочтительно больший, чем примерно 3 часа и наиболее предпочтительно больший, чем примерно 4 часа. В другом варианте осуществления соединения согласно изобретению, такие как соединения формул I-IV, устойчивы к разрушению пептидазами in vitro. В другом варианте осуществления соединения согласно изобретению, такие как соединения формул I-IV, устойчивы к разрушению в клеточной среде. В другом варианте осуществления соединения согласно изобретению, такие как соединения формул I-IV, устойчивы к разрушению пептидазами in vivo. В другом предпочтительном варианте осуществления соединения согласно изобретению, включающие без ограничений соединения формул I-IV, специфически связываются с HLA-DR2-молекулой MHC II класса, к которой они имеют большее сродство, или предпочтительно связываются с HLA-DR2-молекулой MHC II класса. В другом варианте осуществления соединения согласно изобретению, включающие без ограничений соединения формул I-IV, специфически связываются с HLA-DR2-молекулой MHC II класса, но не связываются с HLA-DR1-молекулой MHC II класса или HLA-DR4-молекулой MHC II класса. В конкретном варианте осуществления соединения согласно изобретению, включающие без ограничений соединения формул I-IV, имеют значения IC50 для молекулы DR2, которые равны примерно 0,5, примерно 0,1, примерно 0,01, примерно 0,001 или примерно 0,0001 от их значения IC50 для молекулы DR1 или DR4. В другом варианте осуществления соединения согласно изобретению, включающие без ограничений соединения формул I-IV, предпочтительно связываются с DRBl*1501 по DRB5*0101. В конкретном варианте осуществления соединения согласно изобретению, включающие без ограничений соединения формул I-IV, имеют значения IC50 для DRB1*15Q1, которые равны примерно 0,5, примерно 0,1, примерно 0,01, примерно 0,001 или примерно 0,0001 от их значения IC50 для DRB5*0101. Без ограничения какой-либо теорией в одном из вариантов осуществления соединения согласно изобретению, включающие без ограничений соединения формул I-IV, полностью ингибируют связывание MBP с HLA-DR2-молекулой MHC II класса. Очевидно, что если стереохимия структуры или части структуры не указана, например, толстой или пунктирной линиями, то структура или часть структуры должна быть интерпретирована как охватывающая все ее стреоизомеры. 4.3 Биологические исследования Не ограничивая себя какой-либо теорией, авторы предполагают, что принципы представления антигенов требуют связывания антигена молекулами MHC II класса. В примере рассеянного склероза HLA-DR2-молекулы MHC II класса представляют собой аутоантигены, производные миелина, которые инициируют T-клеточную активность и разрушение мертвых миелиновых оболочек нерва. Следовательно, сродство к связыванию соединений согласно изобретению с HLA-DR-молекулами MHC II класса является одним из индикаторов их пригодности в качестве лекарственных средств для терапии аутоиммунного заболевания. Более конкретно ингибирование или связывание HLA-DR2 MHC II класса является индикатором пригодности в качестве лекарственных средств для рассеянного склероза. Исследования, используемые для демонстрации пригодности соединений согласно изобретению, включают в себя такие исследования связывания HLA-молекул, известные в данной области, как Texier, C. и др. (2000) J. Immunol. 164:3177-3184; Jones, A. и др. (1999) Bioorg. Med. Chem. Lett. 9:2115-2118; Jones, A. et al. (1999) Btoorg. Med, Chem. Lett. 9:2109-2114; Wucherpfennig et al. (1994) J. Exp. Med. 179:279-290; и Bolin, D.R. и др. (2000) J. Med. Chem. 43:2135-2148, каждое из которых включено в настоящее описание во всей своей полноте в качестве ссылки. Исследования, используемые для демонстрации активности соединений согласно изобретению ингибирования пролиферации T-клеток, включают в себя исследования, приведенные далее в разделе 5.2, а также такие исследования, которые известны в данной области, такие как Sarabu, R. (2002) Drug. Des. Disc. 18:3-7; Bolin, D., (2000) J Med. Chem. 43:2135-2148; Chirathaworn, C. (2002) J. Immunol. 168(11):5530-5531; Falcioni, F., и др. (1999) Nature Biotechnology 17:562-567, каждое из которых включено в настоящее описание во всей своей полноте в качестве ссылки. Животные модели, используемые для демонстрации терапевтической пользы соединений согласно изобретению, включают в себя модели, известные в данной области, такие как Vallabhapurapu, S. (2001) Eur. J. Immunol. 37:2612-2622 и патент США №5833987, каждое из которых включено в настоящее описание во всей своей полноте в качестве ссылки. Исследования, используемые для демонстрации стабильности соединений согласно изобретению к разрушению катепсином, включают в себя исследования, известные в данной области, такие как Li, M. (1993) Bioconjug. Chem. 4:275-83 и Nakagomi, K. (2002) Biol. Pharm. Bull. 25:564-8. 4.4 Синтез и получение Соединения согласно изобретению обычно могут быть получены методами твердофазного синтеза, такими как методы, описанные у Barany, G. и Merrifield, R. B. The Peptides, Gross E., Meienhofer, J. Eds., Academic Press: New York, 1980, vol. 2, pp. 1-284; Solid phase synthesis: A practical guide, S. A. Kates, F. Albericio, Eds. Marcel Delkker: New York, 2000; Myers A.G. и др. (1997) J.Amer.Chem.Soc. 119:656; Myers A.G. и др. (1999) J.Org.Chem. 64:3322D; A. Wellings, E. Atherton, (1997) Methods Enzymol. 289:44; Fields, G.B. и др., (1990) Int. J. Peptide Protein Res.35:161; H. Rink, (1987) Tetrahedron Lett.28: 3787; R. C. Sheppard, B. J. Williams, (1982) Int. J. Rept. Protein Res.20:451; J. Coste, и др., (1991) Tetrahedron Lett. 32:1967; L. A. Carpino, A. Elfaham, C. A. Minor, F. Albericio, (1994) J. Chem, Soc. Chem. Comm., 201; M. Felix, и др., (1998) J. Peptide Res. 52:155; патент США № 5770732, выданный 23 июня, 1998 г.; патент США № 5514814, выданный 7 мая, 1996 г.; и патент США № 5489692, выданный 6 февраля, 1996 г., которые включены в настоящее описание во всей своей полноте в качестве ссылки. Некоторые обычные способы проиллюстрированы в схемах 1-4. Исходные вещества, используемые для получения соединений согласно изобретению, и его промежуточные формы являются коммерчески доступными или могут быть созданы из коммерчески доступных веществ с использованием известных способов синтеза и реагентов. Обычно аминокислоты (природные, неприродные или пептидомиметики) являются защищенными в виде производных N-Fmoc с группами защиты, меченными кислотой, так и подходящими заместителями боковых цепей. Для синтеза С-терминальных амидов используется смола Fmoc-Rink или Knorr linker-BHA. Для синтеза С-терминальных кислот используется TGT-спиртовая смола. Группы Fmoc удаляют при помощи 20-40% пиперидина ДМФ. Конденсация подходящей аминокислоты N-Fmoc происходит при помощи HBTU/N-метилморфолина в ДМФ (получают активный эфир HOBT аминокислоты и добавляют в смолу). Связывание с N-алкилом или иминокислотами выполняют при помощи эфира BOP-C1 или PyBrOP в NMP. После снятия защиты группы Fmoc, используя 20-40% пиперидин в ДМФ, связывание следующей аминокислоты N-Fmoc или связывание группы производят таким же способом. Такой цикл повторяют до тех пор, пока на смоле не будет синтезирована требуемая последовательность. Последнее снятие защиты N-терминальной Fmoc-группы, если она присутствует, сопровождается обработкой кислым ангидридом, активированной карбоновой кислотой или сульфоновой кислотой в ДМФ в течение 1 часа. Если требуются C-терминальные амиды, смолу промывают ДМФ, этанолом, метиленхлоридом и сушат в вакууме. Линейные соединения отщепляют от смолы и обработкой 80% раствора ТФУ в дихлорметане с добавлением воды (5%) и изопропилсилана (5%) удаляют защитные группы с любой стороны цепи. Фильтраты концентрируют в вакууме и разбавляют диэтиловым эфиром до получения сырых соединений в виде белых твердых веществ. Сырые продукты очищают ВЭЖХ с обращенной фазой (C18 силикагель; элюция в градиенте ацетонирил/вода/ТФУ) и лиофилизируют, получая конечные соединения. Если последовательность включает в себя основной заместитель, такой как аминогруппа лизина, продукт может быть образован в виде соли ТФУ. Если это необходимо, соль ТФУ может быть заменена на другую фармацевтически приемлемую соль путем нейтрализации и обработки фармацевтически приемлемой кислотой с образованием новой соли. Конечные продукты могут быть охарактеризованы с использованием метода аналитической ВЭЖХ, FAB-MS, ES-MS и/или аминокислотного анализа. Чистота ВЭЖХ, как определено из всех УФ активных пиков, обычно выше 97%. Неприродные, не-альфа-аминокислоты, и пептидомиметики встраивают в последовательности при помощи такой же технологии, и, если требуется, присоединение сопровождается определением любого не прореагировавшего свободного аминоконца с использованием стандартного теста Кайзера. В таких случаях присоединение повторяют до тех пор, пока не получат отрицательный тест Кайзера. Если требуются C-терминальные группы, отличные от амидов, синтез осуществляют на TGT-спиртовой смоле, как описано выше, кроме того, что соединение с защищенной стороны цепи отщепляют от смолы при помощи 2% ТФУ для освобождения карбоновой кислоты защищенной группы, которая на этапе отщепления может быть амидированной или преобразованной в эфир или производное сахара и по существу лишена защиты, как описано выше. Соединения формул I-IV могут быть синтезированы при помощи синтеза, изображенного ниже на схемах. Схемы 1a и 1b: Получение хиральной Схема 1а Схема 1b Схема 2: Получение структурной единицы карбазолаланина N-Boc-3-метилкарбазол К раствору 3-метилкарбазол (500 мг, 2,76 мМ) в толуоле (7,5 мл) добавляли гидроксид натрия (5 г, 125 мМ) в виде водного раствора (15 мл), за которым следовал три-н-бутилбензил аммония хлорид (25 мг). Двухфазный раствор перемешивали при 0°C и в одну из частей добавляли ди-трет-бутилкарбонат (1,25 г, 5,7 мМ). Смесь перемешивали в течение примерно 1 ч примерно при 0°C, отделяли слой толуола и промывали водой (2×10 мл); сушили (MgSO4) и концентрировали под вакуумом для получения неочищенного продукта (725 мг, выход – 96%). ES-MS (M+H)+ 282,0 (выч.282,1). N-Boc-3-бромметилкарбазол К перемешанному раствору N-Boc-3-метилкарбазола (85 мг, 0,3 мМ) и N-бромсукцинимида (54 мг, 0,3 мМ) в треххлористом углероде (10 мл) добавляли бензоилпероксид (10 мг) и реакцию кипятили с обратным холодильником в течение 12 часов. Охлажденную реакционную смесь фильтровали через целит, растворитель удаляли при пониженном давлении и неочищенный продукт очищали с использованием колоночной хроматографии на силикагеле с гексан/этилацетатом в качестве элюента (86 мг, выход – 80%). ES-MS (M-Br)+ 280,9 (выч.280,15). Диэтиловый эфир 2-ацетиламино-2-(9-трет-бутоксикарбонил-9Н-карбазол-3-илметил)малоновой кислоты К перемешанной суспензии гидрида натрия (100 мг 60% дисперсии в масле, 2,5 мМ) в ТФУ (10 мл) при 0°С в атмосфере аргона добавляли по каплям раствор ацетамидодиэтилмалоната (241 мг, 1,1 мМ) в ТФУ (1 мл). Перемешанную реакционную смесь оставляли нагреваться при комнатной температуре в течение примерно 30 минут, охлаждали до 0°С и добавляли раствор N-Boc-3-бромметилкарбазола (400 мг, 1,1 мМ) в ТФУ (2 мл). Перемешанную реакционную смесь нагревали примерно при 60°С в течение 6 ч. Охлажденную реакционную смесь гасили рассолом (10 мл), экстрагировали этилацетатом (3×20 мл). Объединенные органические экстракты промывали водой (10 мл), сушили (MgSO4) и растворитель удаляли под вакуумом. Неочищенный продукт очищали с использованием колоночной хроматографии на силикагеле с 1:1 гексан/этилацетатом в качестве элюента с получением продукта (150 мг, выход – 27%). ES-MS (M+Н)+ 497,3 (выч.497,2). 2-Амино-3-(9Н-карбазол-3-ил)пропионовая кислота Диэтиловый эфир 2-ацетиламино-2-(9-трет-бутоксикарбонил-9Н-карбазол-3-илметил)малоновой кислоты (200 мг, 0,4 мМ) объединяли с бромоводородом (4 мл 24% водного раствора) и кипятили с обратным холодильником примерно в течение 12 ч. Охлажденную реакционную смесь выпаривали при пониженном давлении и сушили под вакуумом с получением аминокислоты в виде соли бромоводорода. ES-MS (M+Н)+ 255,0 (выч.254,1). rac-3-(9Н-Карбазол-3-ил)-2-(9Н-флюорен-9-илметоксикарбониламино)пропионовая кислота Сырую соль HBr 2-амино-3-(9Н-карбазол-3-ил)пропионовой кислоты (50 мг, 0,15 мМ) объединяли с водным раствором гидрокарбоната (2 мл насыщенного раствора) и диоксана (2 мл) и перемешивали при 0°C. Добавляли 9-фторметилхлорформат (100 мг, 0,39 мМ) и перемешивали реакционную смесь при комнатной температуре в течение 8 ч. Реакционную смесь разбавляли водой (25 мл) и экстрагировали диэтиловым эфиром (2×25 мл). Водный слой подкисляли соляной кислотой до pH 3 и экстрагировали этилацетатом (3×25 мл). Объединенные экстракты этилацетата концентрировали при пониженном давлении и сушили под вакуумом. Неочищенный продукт очищали, используя колоночную хроматографию на силикагеле с 10% метанолом в дихлорметане в качества элюента с получением rac-3-(9Н-карбазол-3-ил)-2-(9Н-флюорен-9-илметоксикарбониламино)пропионовой кислоты (ES-MS (M+H)+ 477,2 (вычисл. 477,17)), которую сразу использовали в синтезе пептидных аналогов при помощи протокола твердофазного пептидного синтеза. Схема 3: Введение неприродных аминокислот Схема 4: Получение диацилгидразид-связанных пептидных аналогов N’-Boc-(N-ацетилциклопентилглицинил)гидразид (S)-N-Ацетилциклопентилглицин (450 мг, 2,4 мМ) объединяли с 1-гидроксибензотриазолгидратом (371 мг, 2,4 мМ), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлоридом (465 мг, 2,4 мМ) и N-Boc-гидразином (327 мг, 2,4 мМ) в безводной ТФУ (10 мл)/дихлорметан (10 мл) и перемешивали при комнатной температуре в атмосфере аргона в течение примерно 18 ч. Реакционную смесь концентрировали при пониженном давлении, разбавляли дихлорметаном (50 мл) и промывали водным раствором бикарбоната натрия (25 мл насыщенного раствора); рассолом (25 мл) и сушили (Na2SO4). Раствор фильтровали через пробку силикагеля и силикагель промывали этилацетатом (150 мл). Объединенные экстракты растворителя концентрировали при пониженном давлении, остаток перекристаллизовывали из этилацетата (338 мг, выход – 47%). N-Ацетилциклопентилглицинилгидразид К суспензии N’-Boc-(N-ацетилциклопентилглицинил)гидразида (445 мг, 1,5 мМ) в дихлорметане (25 мл) добавляли раствор ТФУ (10 мл) в дихлорметане (10 мл) и реакционную смесь перемешивали в течение примерно 3 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении, разбавляли дихлорметаном (20 мл) и концентрировали. Это повторяли два раза для удаления всей ТФУ и остаток сушили под вакуумом. Остаток растирали в порошок с сухим диэтиловым эфиром, собирали получающееся в результате твердое вещество и сушили под вакуумом (374 мг, выход – 80%). Метиловый эфир 3-[N’-(ацетиламиноциклопентилацетил)гидразинкарбонил]-2-бензилпропионовой кислоты Метиловый эфир (R)-2-бензилянтарной кислоты (326 мг, 1,4 мМ) объединили с HBTU (584 мг, 1,54 мМ), N-метилморфолином (170 мкл, 1,54 мМ) в безводной ДМФ (5 мл) при перемешивании в атмосфере аргона. После примерно 40 мин добавляли (R)-N-ацетилциклопентилглицингидразид (437 мг, 1,4 мМ) и N-метилморфолин (340 мкл, 3,1 мМ) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали под вакуумом и остаток разделяли между водой (25 мл) и этилацетатом (80 мл). Органическую фазу отделяли и водный слой экстрагировали этилацетатом (2×25 мл). Объединенные экстракты этилацетата промывали холодным водным раствором лимонной кислоты (20 мл 5% раствора), холодным водным раствором бикарбоната натрия (20 мл насыщенного раствора) и сушили (Na2SO4). Растворитель удаляли при пониженном давлении для получения неочищенного диацилгидразида (426 мг, выход – 76%), который использовали на следующем этапе без дополнительной очистки. 3-[N’-(ацетиламиноциклопентилацетил)гидразинкарбонил]-2-бензилпропионовая кислота К перемешанному раствору метилового эфира 3-[N’-(ацетиламиноциклопентилацетил)гидразинкарбонил]-2-бензилпропионовой кислоты (510 мг, 1,26 мМ) в метаноле (30 мл) добавляли раствор гидроксида лития (252 мг, 6 мМ) в воде (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, концентрировали под вакуумом и оставшуюся взвесь разбавляли водой (2 мл) и подкисляли до pH 3 6M соляной кислотой. Для растворения всего твердого остатка добавляли достаточное количество ацетонитрила и раствор лиофилизировали для получения белого твердого вещества. Продукт изолировали ВЭЖХ на обращенных фазах на С18 силикагеле с градиентной элюцией ацетонитрил/вода/ТФУ (0,075%), 132,5 мг, 27%. Схема 5: Ключевые промежуточные продукты моно- и ди-пирролинона Схема 6: Получение дипирролинонов Схема 7: Получение дипирролинонов 4.5 Способы применения Первый вариант осуществления согласно изобретению относится к способу ингибирования связывания антигена молекулой MHC II класса in vitro или in vivo, в частности молекулой HLA-DR1 MHC II класса, HLA-DR2 MHC II класса или MHC HLA-DR4 II класса, включающему взаимодействие клетки, например клетки млекопитающего, с эффективным количеством соединения согласно изобретению. В предпочтительном варианте осуществления HLA-DR-молекула MHC II класса представляет собой HLA-DR2-молекулу MHC II класса. В одном из вариантов осуществления соединение согласно изобретению ингибирует по принципу конкурентности связывание антигена, связанного с аутоиммунным заболеванием, HLA-DR-молекулой MHC II класса, включая MBP, антиген, имеющий отношение к связыванию с HLA-DR2 при рассеянном склерозе. Другой вариант осуществления согласно изобретению относится к способу ингибирования представления антигена HLA-DR-молекулой MHC II класса in vitro или in vivo, в частности молекулой HLA-DR1 MHC II класса, HLA-DR2 MHC II класса или HLA-DR4 MHC II класса, включающему в себя взаимодействие клетки, например клетки млекопитающего, с эффективным количеством соединения согласно изобретению. В предпочтительном варианте осуществления HLA-DR-молекула MHC II класса представляет собой HLA-DR2-молекулу MHC II класса. Другой вариант осуществления согласно изобретению относится к способу ингибирования T-клеточной пролиферации in vitro или in vivo, включающему в себя взаимодействие клетки, например клетки млекопитающего, с эффективным количеством соединения согласно изобретению. Другой вариант осуществления согласно изобретению относится к способу лечения или предупреждения излечимого заболевания или предупреждаемого ингибирования T-клеточной пролиферации in vivo, включающему в себя взаимодействие клетки, например клетки млекопитающего, с эффективным количеством соединения согласно изобретению. Настоящее изобретение дополнительно относится к включению соединения согласно изобретению в фармацевтические композиции и единичные лекарственные формы, используемые при лечении и предупреждении множества заболеваний и нарушений. Специфические заболевания и нарушения включают в себя заболевания и нарушения, реагирующие на ингибирование связывания антигена с HLA-DR-молекулой MHC II класса, заболевания и нарушения, реагирующие на ингибирование представления антигена HLA-DR-молекулой MHC II класса, и заболевания и нарушения, реагирующие на ингибирование T-клеточной пролиферации. В предпочтительном варианте осуществления HLA-DR-молекула MHC II класса представляет собой HLA-DR2-молекулу MHC II класса. В предпочтительном варианте осуществления настоящее изобретение относится к способу лечения и предупреждения заболевания, реагирующего на ингибирование связывания антигена с HLA-DR-молекулой MHC II класса, в частности молекулой HLA-DR1 MHC II класса, HLA-DR2 MHC II класса или HLA-DR4 MHC II класса, включающему в себя введение эффективного количества соединения согласно изобретению нуждающемуся в этом пациенту. В предпочтительном варианте осуществления HLA-DR-молекула MHC II класса представляет собой HLA-DR2-молекулу MHC II класса. В другом варианте осуществления настоящее изобретение относится к способу лечения и предупреждения заболевания, реагирующего на ингибирование представления антигена HLA-DR-молекулой MHC II класса, в частности молекулой HLA-DR1 MHC II класса, HLA-DR2 MHC II класса или HLA-DR4 MHC II класса, включающему в себя введение эффективного количества соединения согласно изобретению нуждающемуся в этом пациенту. В предпочтительном варианте осуществления HLA-DR-молекула MHC II класса представляет собой HLA-DR2-молекулу MHC II класса. В другом варианте осуществления настоящее изобретение относится к способу лечения и предупреждения заболевания, реагирующего на ингибирование T-клеточной пролиферации, включающему в себя введение эффективного количества соединения согласно изобретению нуждающемуся в этом пациенту. Конкретные заболевания, для лечения и предупреждения которых пригодны соединения согласно изобретению, включают в себя без ограничений генетическое заболевание, заболевание центральной нервной системы (“ЦНС”), воспалительное заболевание, нейродегенеративное заболевание или аутоиммунное заболевание. В одном из вариантов согласно изобретению заболевание представляет собой рассеянный склероз, который является как генетическим, так и аутоиммунным заболеванием. В другом варианте осуществления генетическое заболевание представляет собой диабет. В другом варианте осуществления диабет представляет собой диабет типа I, сахарный диабет или ювенильный диабет. Аутоиммунные заболевания включают в себя заболевания, которые воздействуют только на один орган или тип ткани или могут воздействовать на множество органов или тканей. Органы и ткани, обычно подверженные аутоиммунному заболеванию, включают в себя красные кровяные клетки, кровеносные сосуды, соединительные ткани, железы внутренней секреции (например, щитовидную или поджелудочную железу), мышцы, суставы и кожу. Примеры аутоиммунных заболеваний включают в себя без ограничений энцефаломиелит, оофорит, реакцию “трансплантат против хозяина”, гнездную алопецию, анкилозирующий спондилоартрит, антифосфолипидный синдром, аутоиммунную Аддисонову болезнь, аутоиммунное заболевание надпочечников, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунные оофорит и орхит, аутоиммунную тромбопению, болезнь Бехчета, буллезный пемфигоид, кардиомиопатию, целиакию, целиакию-дерматит, синдром хронической усталости и иммунной дисфункции (CFIDS), хроническую воспалительную демиелинизирующую полиневропатию, синдром Черджа-Строса, рубцовый пемфигоид, синдром CREST, синдром холодовой агглютинации, болезнь Крона, дискоидную волчанку, эссенциальную смешанную криоглобулинемию, фибромиалгию-фибромиозит, гломерулонефрит, болезнь Грейвса, синдром Guillain-Barre, тиреоидит Хашимото, идиопатический фиброз легких, идиопатическую тромбоцитопеническую пурпуру (ITP), IgA-невропатию, ювенильный артрит, красный плоский лишай, красную волчанку, болезнь Меньера, смешанное заболевание соединительной ткани, рассеянный склероз, имунно-опосредованный сахарный диабет типа I, тяжелую миастению, обыкновенную пузырчатку, пернициозную анемию, полиартрит, полихондрит, плюригландулярный синдром, ревматическую полимиалгию, полимиозит и дерматомиозит, первичную агаммаглобулинемию, первичный билиарный цирроз печени, псориаз, псориатический артрит, феномен Рейно, болезнь Рейтера, ревматоидный артрит, саркоидоз, склеродермию, синдром Шегрена, синдром ригидного человека, системную красную волчанку, красную волчанку, артериит Такаясу, височный артериит/краниальный артериит, язвенный колит, увеит, васкулит, например герпетиформный дерматический васкулит, витилиго и гранулематоз Вегенера. Таким образом, настоящее изобретение включает в себя применение соединений согласно изобретению для лечения заболеваний, указанных выше. В одном из вариантов осуществления пациент проходит или прошел генетическую проверку на определение аллеля MHC II класса, который имеется у пациента. В конкретном варианте осуществления было определено, что пациент имеет HLA-DR2-аллель MHC II класса. В другом варианте осуществления пациенту поставили диагноз рассеянный склероз или симптомы рассеянного склероза. В другом варианте осуществления пациент проходит или прошел проверку на определение наличия типа клеток, в которых нормальные клеточные белки распознаются как чужие, включающую в себя этапы скрининга пациента или клеток, извлеченных из пациента, при помощи подходящего анализа T-клеточной пролиферации. Конкретные способы согласно изобретению дополнительно содержат введение дополнительного терапевтического агента (т.е. терапевтического агента, отличного от соединения согласно изобретению). В некоторых вариантах осуществления согласно изобретению соединение согласно изобретению может быть применено в комбинации по меньшей мере с одним другим терапевтическим агентом. Более конкретно настоящее изобретение предоставляет комбинацию методов лечения для предупреждения, лечения или улучшения одного или нескольких симптомов, связанных с аутоиммунным заболеванием пациента, причем указанное сочетание методов лечения включает в себя введение указанного соединения согласно изобретению и по меньшей мере одного другого профилактического или терапевтического агента, который имеет другой механизм действия, чем соединение согласно изобретению. Терапевтические агенты включают в себя без ограничения иммуномодулирующие вещества, модуляторы T-клеточных рецепторов, Примеры иммуномодулирующих веществ включают в себя без ограничений метотрексат, лефлюномид, циклофосфамид, циклоспорин A и макролидные антибиотики (например, FK506 (такролимус)), метилпреднизолон (MP), кортикостероиды, стероиды, микофенолат мофетил, рапамицин (сиролимус), мизорибин, дезоксиспергуалин, бреквинар, малононитриламиды (например, лефлунамид), копаксон® (глатирамер ацетат). Модуляторы T-клеточных рецепторов и модуляторы рецепторов цитокинов. Примеры модуляторов T-клеточных рецепторов включают в себя без ограничений антитела против T-клеточных рецепторов (например, анти-CD4 моноклональные антитела, анти-CD3 моноклональные антитела, анти-CD8 моноклональные антитела, моноклональные антитела к анти-CD40 лиганду, анти-CD2 моноклональные антитела) и CTLA4-иммуноглобулин. Примеры Соединения согласно изобретению и другие терапевтические агенты могут действовать аддитивно или более предпочтительно синергично. В предпочтительном варианте осуществления композицию, содержащую соединение согласно изобретению, вводят одновременно с введением другого терапевтического агента, который может быть частью той же самой композиции или находиться в композиции, отличной от той, в которой содержится соединение согласно изобретению. Профилактические или терапевтические комбинированной терапии согласно изобретению могут вводиться пациенту совместно или последовательно. Профилактические или терапевтические агенты комбинированной терапии согласно изобретению также могут вводиться циклами. Цикличная терапия включает в себя введение первого профилактического или терапевтического агента в течение некоторого периода времени с последующим введением второго профилактического или терапевтического агента в течение некоторого периода времени и повторение такого последовательного введения, например, цикл для уменьшения развития устойчивости к одному из агентов, для устранения или уменьшения побочных эффектов одного из агентов, и/или для улучшения эффективности лечения. Величина профилактической или терапевтической дозы конкретного активного ингредиента согласно изобретению при остром или хроническом течении заболевания или состояния могут изменяться, однако, в зависимости от природы и тяжести заболевания или состояния и способа введения активного ингредиента. Доза и, возможно, частота доз также могут изменяться в зависимости от возраста, веса тела и реакции отдельного пациента. Подходящие режимы дозирования могут быть легко выбраны специалистами в данной области согласно рассмотренным факторам. Обычно рекомендуемый диапазон суточной дозы для условий, изложенных в данном описании, лежит в пределах от примерно 0,1 мг до примерно 3000 мг в сутки, даваемый в виде одноразовой суточной дозы или в виде отдельных доз в течение суток. Более конкретно суточную дозу вводят в виде единичной дозы или в виде равных отдельных доз. В частности, диапазон суточной дозы должен составлять от примерно 1 мг до примерно 2500 мг в сутки, более точно между примерно 10 мг и примерно 2000 мг в сутки, более точно между примерно 50 мг и примерно 1500 мг в сутки, или как это необходимо для достижения в участке воздействия эффективных концентраций, достаточных, чтобы блокировать наличие антигена. Такая доза зависит от способа введения, биодоступности, метаболической стабильности, связывания с белком и других факторов, известных в данной области техники. Соединения также могут быть введены в виде лекарственной формы пролонгированного действия, которая высвобождает эффективное количество активного ингредиента в течение от нескольких дней до нескольких недель или месяцев; обычно после внутримышечного или подкожного введения. При лечении пациента лечение следует начинать с меньших доз, от примерно 1 мг в сутки до примерено 25 мг в сутки, и увеличивать при необходимости от примерно 200 мг в сутки до примерно 1000 мг в сутки или от примерно 1500 мг в сутки до примерно 3000 мг в сутки в виде либо единичной дозы, либо отдельных доз в зависимости от общей реакции пациента. В некоторых случаях может потребоваться применение доз активного ингредиента за пределами диапазонов, изложенных в настоящем описании, как очевидно специалистам в данной области техники. Более того, очевидно, что клиницисту или лечащему врачу хорошо известно, как и когда прервать, адаптировать или завершить лечение согласно реакции отдельного пациента. 4.6 Фармацевтические композиции Фармацевтические композиции и единичные дозированные формы, содержащие соединение согласно изобретению или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, также охвачены настоящим изобретением и способами применения, изложенными в настоящем описании. Отдельные дозированные формы согласно изобретению могут быть пригодными для перорального, мукозального (включая сублингвальный, буккальный, ректальный, назальный или вагинальный), парентерального (включая подкожный, внутримышечный, болюсное вливание, внутриартериальный или внутривенный), чрескожного или топического введения. Фармацевтические композиции и дозированные формы согласно изобретению содержат соединение согласно изобретению или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат. Фармацевтические композиции и дозированные формы согласно изобретению также обычно содержат один или несколько фармацевтически приемлемых наполнителей. Конкретная фармацевтическая композиция, охваченная настоящим изобретением, содержит соединение согласно изобретению или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, и по меньшей мере один дополнительный терапевтический агент. Примеры дополнительных терапевтических агентов включают в себя без ограничений супрессоры иммунного ответа, противораковые препараты и противовоспалительные методы лечения. Единичные формы дозирования согласно изобретению пригодны для перорального, мукозального (например, назального, в виде ингаляции, сублингвального, вагинального, буккального или ректального), парентерального (например, подкожного, внутривенного, болюсного вливания, инфузии, внутримышечного, или внутриартериального), чрескожного введения пациенту. Примеры дозированных форм включают в себя без ограничений таблетки; таблетки в форме капсулы; капсулы, такие как мягкие эластичные желатиновые капсулы; крахмальные капсулы; лепешки; пастилки; дисперсии; суппозитории; мази; припарки (примочки); пасты; порошки; повязки; крема; гипс; микстуры; пластыри; аэрозоли (например, назальные спреи или ингаляторы); гели; жидкие дозированные формы, пригодные для перорального или мукозального введения пациенту, включающие в себя (например, жидкие суспензии на водной или неводной основе, эмульсии масло-в-воде или жидкие эмульсии вода-в-масле) растворы и эликсиры; жидкие дозированные формы, пригодные для парентерального введения пациенту; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), которые могут быть преобразованы для предоставления жидких дозированных форм, пригодных для парентерального введения пациенту. Композиция, вид и тип дозированных форм согласно изобретению обычно изменяются в зависимости от их применения. Например, дозированная форма, применяемая при интенсивной терапии воспаления или родственного заболевания, может содержать большие количества одного или нескольких активных ингредиентов, чем это содержит дозированная форма, применяемая при хроническом лечении того же самого заболевания. Аналогично парентеральная дозированная форма может содержать меньшие количества одного или нескольких активных ингредиентов, чем это содержит оральная дозированная форма, применяемая при лечении того же самого заболевания или нарушения. Эти и другие способы, при которых специфические дозированные формы, охваченные настоящим изобретением, могут отличаться друг от друга, очевидны специалистам в данной области техники. См., например, Remington’s Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990). Обычные фармацевтические композиции и дозированные формы содержат один или несколько носителей, наполнителей или разбавителей. Подходящие наполнители хорошо известны специалистам в области фармацевтики, и в настоящем описании предоставлены неограничивающие примеры подходящих наполнителей. Является ли конкретный наполнитель подходящим для включения в фармацевтическую композицию или дозированную форму, зависит от различных факторов, хорошо известных в данной области техники, включая без ограничений способ приема дозированной формы пациентом. Например, пероральные дозированные формы, такие как таблетки, могут содержать наполнители, непригодные для применения в парентеральных дозированных формах. Соответствие конкретного наполнителя также может зависеть от специфических активных ингредиентов в дозированной форме. Настоящее изобретение дополнительно охватывает безводные фармацевтические композиции и дозированные формы, содержащие активные ингредиенты, поскольку вода может способствовать разрушению некоторых соединений. Например, добавление воды (например, 5%) широко применяется в фармацевтической области как средство, имитирующее продолжительное хранение для определения характеристик, таких как срок хранения или стабильность лекарственного препарата со временем. См., например, Jens T. Carstensen, Drug Stability: Principles & Practice, 2d. Ed., Marcel Dekker, NY, NY, 1995, pp. 379-80. В действительности вода и тепло ускоряют разложение некоторых соединений. Таким образом, влияние воды на лекарственный препарат может иметь большее значение, поскольку влажность и/или сырость обычно встречаются во время производства, обработки, упаковки, хранения, перевозки и применения лекарственных препаратов. Безводные фармацевтические композиции и дозированные формы согласно изобретению могут быть изготовлены с использованием безводных ингредиентов или ингредиентов с пониженным содержанием влаги и в условиях с пониженной влажностью и сыростью. Фармацевтические композиции и дозированные формы, которые содержат лактозу и по меньшей мере один активный ингредиент, который содержит первичный или вторичный амин, являются предпочтительно безводными, если ожидается реальный контакт с влажностью и/или сыростью во время производства, упаковки, и/или хранения. Безводные фармацевтические композиции следует изготавливать и хранить таким образом, чтобы сохранилась их безводная природа. Следовательно, безводные композиции предпочтительно упаковывают, используя материалы, известные как предотвращающие взаимодействие с водой, таким образом, чтобы они могли быть включены в подходящие наборы лекарственных форм. Примеры подходящих упаковок включают в себя без ограничений герметично запечатанную фольгу, пластик, контейнеры единичных доз (например, ампулы), блистерные упаковки и стриповые упаковки. В одном из вариантов осуществления соединение согласно изобретению вводят в фармацевтической лекарственной форме, содержащей карбонат. Настоящее изобретение дополнительно включает в себя фармацевтические композиции и дозированные формы, которые содержат одно или несколько соединений, уменьшающих скорость, с которой будет распадаться активный ингредиент. Такие соединения, которые названы в настоящем описании “стабилизаторами”, включают в себя без ограничений антиоксиданты, такие как аскорбиновая кислота, pH буферный раствор или солевые буферы. Подобно количеству и типам наполнителей количество и специфические типы активных ингредиентов в дозированной форме могут отличаться в зависимости от факторов, таких как, без ограничений, способ, которым она должна быть введена пациентам. Однако обычные дозированные формы согласно изобретению содержат соединение согласно изобретению или его фармацевтически приемлемое пролекарство, соль, сольват или гидрат, находящиеся в пределах от примерно 0,1 мг до примерно 3000 мг в сутки, даваемое в виде единичной суточной дозы по утрам, но предпочтительно в виде отдельных доз в течение суток, принимаемых во время приема пищи. Более предпочтительно суточную дозу вводят два раза в сутки равными отдельными дозами. В частности, диапазон суточной дозы должен составлять от примерно 1 мг до примерно 2500 мг в сутки, более конкретно между примерно 10 мг и примерно 2000 мг в сутки, более конкретно между примерно 25 мг и примерно 1500 мг в сутки, более конкретно между примерно 50 мг и примерно 1000 мг в сутки, более конкретно между примерно 100 мг и примерно 750 мг в сутки, более конкретно между примерно 200 мг и примерно 500 мг в сутки, более конкретно между примерно 250 мг и примерно 300 мг в сутки. При лечении пациента лечение следует начинать с меньших доз, возможно, от примерно 1 мг до примерно 25 мг и увеличивать при необходимости от примерно 200 мг до примерно 1000 мг в сутки в виде либо единичной дозы, либо отдельных доз в зависимости от общей реакции пациента. В одном из вариантов осуществления соединения согласно изобретению вводят в фармацевтической композиции, содержащей липосомы. Липосомы могут быть полимеризованными или неполимеризованными, и соединения согласно изобретению необязательно могут быть включены в липосомы. Подходящие липофильные растворители или наполнители включают в себя жирные масла, такие как кунжутное масло, или синтетические эфиры жирных кислот, такие как этилолеат или триглицериды. 4.6.1. Парентеральные дозированные формы Парентеральные дозированные формы могут быть введены пациенту различными путями, включая без ограничений подкожный, внутривенный (включая болюсное вливание), внутримышечный и внутриартериальный. Поскольку их введение обычно минует природную защиту пациентов от загрязнений, парентеральные дозированные формы предпочтительно являются стерильными или допускающими стерилизацию до введения пациенту. Примеры парентеральных дозированных форм включают в себя без ограничений растворы, готовые для инъекции, сухие формы, готовые для растворения или суспендирования в фармацевтически приемлемом наполнителе для инъекции и эмульсии. Подходящие наполнители, которые могут применяться для предоставления парентеральных дозированных форм согласно изобретению, хорошо известны специалистам в данной области техники. Примеры включают в себя без ограничений: воду для инъекции USP; водные наполнители, такие как, без ограничений, инъекция хлорида натрия, инъекция Рингера, декстрозная инъекция, инъекция декстрозы и хлорида натрия и лактированная инъекция Рингера; водорастворимые наполнители, такие как, без ограничений, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и водонерастворимые наполнители, такие как, без ограничений, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат. В парентеральные дозированные формы согласно изобретению также могут быть включены соединения, которые увеличивают растворимость одного или нескольких активных ингредиентов, изложенных в настоящем описании, такие как органические растворители, включая пропиленгликоль, полиэтиленгликоль, этанол, глицерин, рицинолеат полиэтиленгликоля (Cremophor) или полиоксиэтилен сорбитановые эфиры жирных кислот (Твин). Парентеральные растворы соединений согласно изобретению также могут содержать человеческие сывороточные белки, которые служат в качестве ингибиторов кристаллизации, такие как белки, описанные в патенте США № 4842856, включенном в настоящее описание во всей своей полноте в качестве ссылки. Парентеральные растворы соединений согласно изобретению дополнительно могут содержать полоксамеры или полисорбаты. Парентеральные дозированные формы также могут быть введены в формах пролонгированного действия или медленного высвобождения, содержащих соединение согласно изобретению на основе полимера полиолов и гидроксикарбоновых кислот, таких как те, которые раскрыты в международной заявке на патент WO 78/00011, включенной в настоящее описание во всей своей полноте в качестве ссылки. Формы пролонгированного действия также могут содержать сложные эфиры полиолов, содержащие остатки полимерных дикарбоновых кислот (например, винной кислоты), такие как эфиры, описанные в патентах США № 5922682 и 5922338, каждый из которых включен в настоящее описание во всей своей полноте в качестве ссылки. Дополнительные пролонгированные формы включают в себя матрикс, содержащий эфир поливинилового спирта (м.в. примерно 14000), полиэтиленгликоль (м.в. примерно от 6000 до 20000) или полимерные остатки эфиров оксикарбоновых кислот (например, молочной кислоты м.в. от примерно 26000 до 114000), или гликолевую кислоту (м.в. примерно 10000), такие как раскрытые в европейской заявке на патент №92918, включенной в настоящее описание во всей своей полноте в качестве ссылки. Лекарственные формы задержанного освобождения для парентеральных дозированных форм также включают в себя гранулы, не содержащие связывающего вещества, как описано в патенте США № 4902516, и формы, раскрытые для применения с витамином D в патенте США № 5795882, каждый из которых включен в настоящее описание во всей своей полноте в качестве ссылки. Дополнительные парентеральные дозированные формы включают в себя восковые микросферы, такие как микросферы, раскрытые в патенте США № 6340671, липофильные лекарственные вещества, такие как вещества, раскрытые в патенте США № 6335346, неводные композиции, такие как композиции, раскрытые в патенте США № 5965603, полимеры карбогидратов, такие как полимеры, раскрытые в патенте США № 5456922, и эмульсии, такие как эмульсии, раскрытые в патенте США № 4563354 и 5244925, каждый из которых включен в настоящее описание во всей своей полноте в качестве ссылки. Парентеральные дозированные формы могут вводиться через имплантируемые устройства, осмотические насосы или системы катетеров, которые способны поставлять композицию с выбранными скоростями (См. патенты США № 6471688; 6436091; 6413239; 6464688; 5672167; и 4968507 каждый из которых включен в настоящее описание во всей своей полноте в качестве ссылки). 4.6.2. Пероральные дозированные формы Фармацевтические композиции согласно изобретению, которые являются подходящими для перорального введения, могут быть представлены в виде отдельных дозированных форм, таких как, без ограничений, таблетки (например, жевательные таблетки), таблетки в форме капсулы, капсулы и жидкости (например, ароматизированные сиропы). Такие дозированные формы содержат заданные количества активных ингредиентов и могут быть изготовлены фармацевтическим способом, хорошо известным специалистам в данной области техники. В целом см. Remington’s Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990) или Remington: The Science and Practice of Pharmacy, 20th ed., Lippincott, Williams and Wilkins, (2000). Обычные пероральные дозированные формы согласно изобретению изготавливают путем объединения активного ингредиента(ингредиентов) в однородные смеси с, по меньшей мере, одним наполнителем согласно обычным фармацевтическим методам смешивания. Наполнители могут принимать широкое разнообразие форм в зависимости от формы получения, требуемой для введения. Например, наполнители, пригодные для перорального применения в пероральной жидкой или аэрозольной дозированной форме, включают в себя без ограничений воду, гликоли, масла, спирты, ароматизаторы, консерванты и красящие вещества. Примеры наполнителей, пригодных для перорального применения в твердых пероральных дозированных формах (например, порошки, таблетки, капсулы и таблетки в форме капсулы), включают в себя без ограничений крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие вещества, лубриканты, связывающие вещества и дезинтеграторы. Из-за удобства приема таблетки и капсулы представляют наиболее предпочтительные пероральные единичные дозированные формы, если применяются твердые наполнители. Если это необходимо, таблетки могут быть покрыты при помощи стандартных или нестандартных методов. Такие дозированные формы могут быть изготовлены любым фармацевтическим способом. Обычно фармацевтические композиции и дозированные формы изготавливают при помощи равномерного и тщательного смешивания активного ингредиента с жидкими носителями, мелкоизмельченными твердыми носителями или с тем и другим, и затем, если это необходимо, продукт формуют в требуемую форму. Например, таблетка может быть изготовлена прессованием или формованием. Прессованные таблетки могут быть изготовлены прессованием активных ингредиентов в легкосыпучей форме, такой как порошок или гранулы, необязательно смешанных с наполнителем, на соответствующем станке. Формованные таблетки могут быть изготовлены формованием смеси порошкообразного соединения с инертным жидким разбавителем на соответствующем станке. Примеры наполнителей, которые могут быть использованы в пероральных дозированных формах согласно изобретению, включают в себя без ограничений связывающие вещества, начинки, дезинтеграторы и лубриканты. Связывающие вещества, подходящие для применения в фармацевтических композициях и дозированных формах, включают в себя без ограничений кукурузный крахмал, картофельный крахмал иди другие крахмалы, желатин, природные и синтетические смолы, такие как акации, альгинат натрия, альгиновую кислоту и другие альгинаты, порошкообразный трагакант, гуаровую камедь, целлюлозу и ее производные (например, этилцеллюлозы, ацетатцеллюлозы, кальция карбоксиметилцеллюлозы, натрия карбоксиметилцеллюлозы), поливинилпирролидон, метилцеллюлозу, прежелатинизированный крахмал, гидроксипропилметилцеллюлозу, (например, №№ 2208, 2906, 2910), микрокристаллическую целлюлозу их смеси. Примеры начинок для применения в фармацевтических композициях и дозированных формах, раскрытых в настоящем описании, включают в себя, но без ограничений тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстрины, каолин, маннит, кремниевую кислоту, сорбит, крахмал, прежелатинизированный крахмал и их смеси. Связывающие вещества или начинки фармацевтических композиций согласно изобретению в форме обычно составляют от примерно 50 до примерно 99 весовых процентов фармацевтической композиции или дозированной формы. Подходящие формы микрокристаллической целлюлозы включают в себя без ограничений твердые вещества, как AVICEL-PH-101, AVICEL-PH-103 AVICEL RC-581, AVICEL-PH-105 (доступный от FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA) и их смеси. Специфическое связывающее вещество представляет собой смесь микрокристаллической целлюлозы и натрия карбоксиметилцеллюлозу в твердой форме, как AVICEL RC-581. Подходящие безводные наполнители или наполнители с повышенной влажностью или добавки включают в себя AVICEL-PH-103 В композициях согласно изобретению используются дезинтеграторы для предоставления таблеток, которые распадаются под воздействием водной среды. Таблетки, которые содержат слишком много дезинтегратора, могут распадаться при хранении, хотя таблетки, которые содержат слишком мало дезинтегратора, не могут распадаться с требуемой скоростью или в требуемых условиях. Таким образом, для формирования твердых пероральных дозированных форм согласно изобретению должно применяться достаточное количество дезинтегратора, которое не является слишком маленьким или слишком большим, отрицательно изменяющим высвобождение активных ингредиентов. Количество используемого дезинтегратора изменяется в зависимости от типа лекарственной формы и является очевидным для специалистов в данной области техники. Обычно фармацевтические композиции содержат от примерно 0,5 до примерно 15 весовых процентов дезинтегратора, в частности от примерно 1 до примерно 5 весовых процентов дезинтегратора. Дезинтеграторы, которые могут быть использованы в фармацевтических композициях и дозированных формах согласно изобретению, включают в себя без ограничений агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, натрия кроскамелозу, кросповидон, полакрилин калия, натрия крахмал гликолат, картофельный крахмал или крахмал из кассавы, прежелатинированный крахмал, другие крахмалы, клеи, другие альгины, другую целлюлозу, смолы и их смеси. Лубриканты, которые могут применяться в фармацевтических композициях и дозированных формах согласно изобретению, включают в себя без ограничений стеарат кальция, стеарат магния, минеральное масло, маловязкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурил сульфат натрия, тальк, гидрогенированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллауреат, агар и их смеси. Дополнительные лубриканты включают в себя, например, силикагель силоид (AEROSIL 200, производство W.R. Grace Co. of Baltimore, MD), коагулированный аэрозоль синтетического кремния (производство Degussa Co. of Plano, TX), CAB-O-SIL (пирогенный диоксид кремния, продаваемый Cabot Co. of Boston, MA) и их смеси. В случае применения лубриканты обычно применяются в количестве меньшем, чем примерно 1 весовой процент от фармацевтических композиций или дозированных форм, в которые они включены. 4.6.3. Задержанное высвобождение дозированных форм Активные ингредиенты согласно изобретению могут быть введены при помощи средств контролируемого высвобождения или при помощи средств подачи, которые хорошо известны специалистам в данной области техники. Примеры включают в себя без ограничений примеры, раскрытые в патентах США №№ 3845770; 3916899; 3536809; 3598123; и 4008719 5674533 5059595 5591767 5120548 5073543 5639476 5354556 и 5733566, каждый из которых включен в настоящее описание во всей своей полноте в качестве ссылки. Такие дозированные формы могут быть применены для предоставления медленного или контролируемого высвобождения одного или нескольких активных ингредиентов, использующих, например, гидропропилметилцеллюлозу, карбоксиметилцеллюлозу или другие полимерные основы, гели, проницаемые мембраны, осмотические системы, многослойные покрытия, микрочастицы, липосомы, микросферы или их комбинации для обеспечения требуемого профиля высвобождения в изменяющихся пропорциях. В предпочтительном варианте осуществления лекарственные формы с контролируемым высвобождением являются биоразрушаемыми. Подходящие лекарственные формы с контролируемым высвобождением, известные специалистам в данной области техники, включая лекарственные формы, рассмотренные в настоящем описании, могут быть легко выбраны для применения с активными ингредиентами согласно изобретению. Таким образом, настоящее изобретение охватывает единичные дозированные формы, пригодные для перорального введения, такие как, без ограничений, таблетки, капсулы, гелькапсулы и таблетки в форме капсулы, которые адаптированы для контролируемого высвобождения. Соединение согласно изобретению также может быть введено в пролонгированной лекарственной форме или включено в комплекс и не обязательно может быть введено под кожу. Все фармацевтические формы контролируемого высвобождения предназначены для улучшения лекарственной терапии, которая достигается при помощи их неконтролируемого аналога. В идеале применение формы, необязательно предназначенной для контролируемого высвобождения при лечении, характеризуется минимумом лекарственного вещества, применяемого для лечения или управления состоянием за минимальный промежуток времени. Преимущества лекарственных форм с контролируемым высвобождением включают в себя более продолжительную активность лекарственного препарата, уменьшенную частоту дозирования и улучшение возможности соблюдения больным режима и схемы лечения. Дополнительно лекарственные формы с контролируемым высвобождением могут применяться для воздействия на время проявлении действия или другие характеристики, такие как уровни лекарственного вещества в крови, и, таким образом, могут воздействовать на возникновение побочных (например, нежелательных) эффектов. Большинство лекарственных форм с контролируемым высвобождением разработано для начального высвобождения такого количества лекарственного вещества (активного ингредиента), которое без промедления генерирует требуемый терапевтический эффект и постепенное и продолжительное высвобождение другого количества лекарственного вещества для поддержания этого уровня терапевтического или профилактического эффекта в течение продолжительного периода времени. Для поддержания такого постоянного уровня лекарственного вещества в теле лекарственное вещество должно высвобождаться из дозированной формы со скоростью, которая может возместить количество лекарственного вещества, подвергшегося метаболизму и выведенному из тела. Контролируемое высвобождение активного ингредиента может стимулироваться различными условиями, включая без ограничений рН, температурой, ферментами, водой или другими физиологическими условиями или соединениями. 4.6.4 Чрескожные, топические и мукозальные дозированные формы Чрескожные, топические и мукозальные дозированные формы согласно изобретению включают в себя без ограничений офтальмологические растворы, спреи, аэрозоли, крема, примочки, мази, гели, растворы, эмульсии, суспензии или другие формы, хорошо известные в данной области техники. См., например, Remington’s Pharmaceutical Sciences, 18th eds.. Mack Publishing, Easton PA (1990); и Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea & Febiger, Philadelphia (1985). Дозированные формы, пригодные для лечения слизистой оболочки ротовой полости, могут быть составлены в виде жидкостей для полоскания рта или в виде гелей для ротовой полости. Кроме того, чрескожные дозированные формы включают в себя пластыри “резервуарного типа” или “матриксного типа”, которые могут прикладываться к коже, и их можно носить в течение определенного периода времени, чтобы обеспечить проникновение требуемого количества активных ингредиентов. Пригодные наполнители (например, носители и разбавители) и другие материалы, которые могут применяться для предоставления чрескожных, топических и мукозальных дозированных форм, охваченных настоящим изобретением, хорошо известны специалистам в области фармацевтики и зависят от конкретной ткани, к которой может быть приложена данная фармакологическая композиция или дозированная форма. Принимая во внимание данный факт, обычно наполнители включают в себя без ограничений воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпалмитат, минеральное масло и их смеси для получения примочек, настоек, кремов, эмульсий, гелей или мазей, которые являются нетоксичными и фармацевтически приемлемыми. Если это необходимо, в фармацевтические композиции и дозированные формы также могут быть добавлены увлажняющие средства или смачивающие средства. Примеры таких дополнительных ингредиентов хорошо известны специалистам в данной области техники. См., например, Remington’s Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990). В зависимости от конкретной ткани, предназначенной для лечения, дополнительные компоненты могут применяться до, совместно или последовательно при лечении активными ингредиентами согласно изобретению. Например, для облегчения введения активного ингредиента в ткань могут применяться вещества, усиливающие проникновение. Подходящие вещества, усиливающие проникновение, включают в себя без ограничений: ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; сульфоксиды алкилов, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; разновидности коллидона (повидон, поливидон); мочевину; и различные водорастворимые или нерастворимые эфиры сахаров, такие как твин 80 (полисорбат 80) и спан 60 (сорбитана моностеарат). Для улучшения подачи одного или нескольких активных ингредиентов также может подбираться pH фармакологической композиции, или дозированной формы, или ткани, к которой прикладывается фармакологическая композиция. Аналогично, для улучшения подачи могут подбираться полярность носителя-растворителя, его ионная сила или тоничность. Соединения, например стеараты, также могут быть добавлены в фармацевтические композиции или дозированные формы для эффективного изменения гидрофильности или липофильности одного или нескольких активных ингредиентов для улучшения подачи. В этом отношении стеараты могут служить в качестве липидного носителя для лекарственной формы, в качестве эмульгирующего вещества или поверхностно-активного вещества и в качестве вещества, увеличивающего подачу и увеличивающего проникновение. Для дополнительной адаптации свойств конечного соединения могут применяться различные соли, гидраты или сольваты активных ингредиентов. 5. ПРИМЕРЫ 5.1. Синтез соединения 92 (Ac(Cpg)NHNH[COCH2CH(Ph)CO]FKNI) NH2-Phe-Lys(N’-Boc)-Asn(Trt)-Ileu-NH2 получали при помощи протоколов синтеза Fmoc на амидной смоле Sieber и отщепляли 1% ТФУ в дихлорметане (в таких условиях защита цепи со стороны Boc и тритила оставалась неактивной). Защищенный пептид очищали градиентной элюцией на колонке с силикагелем C18 ВЭЖХ с обращенной фазой – ацетонитрил/вода/ТФУ (0,075%). Фракции, содержащие чистый пептид, концентрировали при пониженном давлении и лиофилизировали для получения пептида (соли ТФУ основных групп) в виде тонкодисперсного порошка. К перемешанному раствору 3-[N’-(ацетиламиноциклопентилацетил)гидразинокарбонил]-2-бензилпропионовой кислоты (49 мг, 0,13 мМ) в безводной ТФУ (1,5 мл) и ДМФ (1 мл) при 0°C добавляли N-метилморфолин (17 мкл, 0,15 мМ), за которым следовал изобутил хлорформат (19 мкл, 0,14 мМ). Реакционную смесь перемешивали при 0°C в течение 30 мин, и в одну часть добавляли раствор NH2-Phe-Lys(N’-Boc)-Asn(Trt)-Ileu-NH2 (101 мг, 0,12 мМ) в безводной ТФУ (1 мл) и ДМФ (1 мл). Реакционную смесь оставляли для достижения комнатной температуры и перемешивали в течение 12 ч. Реакционную смесь концентрировали при пониженном давлении и остаток объединяли с ТФУ/дихлорметан/три-изопропилсилан/вода (5 мл смеси 5:4:0,5:0,5) при комнатной температуре в течение 20 мин для осуществления снятия общей защиты неочищенного продукта. Растворитель удаляли при пониженном давлении, разбавляли дихлорметаном (50 мл) и концентрировали. Это повторяли два раза для удаления всей ТФУ и остаток сушили под вакуумом. Остаток растирали в порошок с безводным диэтиловым эфиром и полученное твердое вещество собирали и сушили под вакуумом, получали 126 мг желтого неочищенного вещества. Пептиды очищали градиентной элюцией на колонке с силикагелем C18 ВЭЖХ с обращенной фазой – ацетонитрил/вода/ТФУ (0,075%). Фракции, содержащие чистый пептид, концентрировали при пониженном давлении и лиофилизировали для получения продукта (соли ТФУ основных групп) в виде мелкодисперсного порошка. ES-MS (M+H)+ 891,8 (вычисл. 891,50). 5.2 Синтез соединения 93 (Ac(Chg)K(Tic)(4′-карбазолил Ala)) Аналог пептида синтезировали на амидной смоле Knorr (0,1 мМ), используя 5 эквивалентов N-Fmoc аминокислоты с HBTU (5 эквивалентов) в 0,4 M N-метилморфолин в ДМФ в качестве активатора. Реакции присоединения проводили в течение 1 ч при комнатной температуре и повторяли с 5 эквивалентами HBTU/N-Fmoc аминокислотой, как это необходимо (двойное присоединение). Удаление Fmoc проводили обработкой 20% пиперидина в ДМФ (2×20 мин циклов), получая три N-аминоконца, для следующего присоединения аминокислоты. Конечное ацилирование N-конца пептидной последовательности выполняли после удаления Fmoc обработкой соответствующим кислым ангидридом (в примере 23 ангидридом уксусной кислоты) в 0,4 M растворе N-метилморфолина в ДМФ (20 мин). При завершении синтеза смолу последовательно промывали ДМФ; этанолом и хлорметаном и сушили под вакуумом. Аналог пептида отщепляли от смолы обработкой смесью ТФУ (8,8 мл): три-изопропилсилан (0,5 мл): дихлорметан (0,5 мл): вода (0,5 мл) в течение 45 минут. Смесь фильтровали, смолу промывали ТФУ (10 мл) и объединенный фильтрат упаривали при пониженном давлении. Измельчением в порошок с безводным диэтиловым эфиром получили неочищенный пептид в виде твердого вещества. Пептиды очищали до гомогенности градиентной элюцией на колонке с силикагелем C18 ВЭЖХ с обращенной фазой – ацетонитрил/вода/ТФУ (0,075%). Фракции, содержащие чистый пептид, концентрировали при пониженном давлении и лиофилизировали для получения пептида (соли ТФУ основных групп) в виде мелкодисперсных порошков. ES-MS (M+H)+ 849,8 (вычисл. 849,47). 5.3 Синтез соединения 105 (Ac(Cpg)NHNH[COCH2CH(Ph)CO](4′-индолил Ala)) (NH2-(4′-индолилаланин{N’-Boc})-Lys(N’-Boc)-NH2 получали при помощи протоколов Fmoc синтеза на амидной смоле Sieber и отщепляли 1% ТФУ в дихлорметане (в таких условиях защита цепи со стороны Boc оставалась неактивной). Защищенный пептид очищали градиентной элюцией на колонке с силикагелем C18 ВЭЖХ с обращенной фазой – ацетонитрил/вода/ТФУ (0,075%). Фракции, содержащие чистый пептид, концентрировали при пониженном давлении и лиофилизировали для получения пептида (соли ТФУ основных групп) в виде мелкодисперсного порошка. В перемешанный раствор 3-[N’-(ацетиламиноциклопентилацетил)гидразинокарбонил]-2-бензилпропионовой кислоты (35 мг, 0,09 мМ) в безводном ТГФ (0,5 мл) и ДМФ (0,5 мл) при 0°C добавляли N-метилморфолин (12 мкл, 0,11 мМ), а затем – изобутил хлорформат (13 мкл, 0,1 мМ). Реакционную смесь перемешивали при 0°C в течение 30 мин, и в одну часть добавляли раствор NH2-(4′-индолилаланин{N’-Boc})-Lys(N’-Boc)-NH2 (44,2 мг, 0.1 мМ) в безводном ТГФ (0,5 мл) и ДМФ (0,5 мл). Реакционную смесь оставляли для достижения комнатной температуры и перемешивали в течение 12 ч. Реакционную смесь концентрировали при пониженном давлении и остаток объединяли с ТФУ/дихлорметан/три-изопропилсилан/вода (2 мл смеси 5:4:0,5:0,5) при комнатной температуре в течение 20 мин для осуществления снятия общей защиты неочищенного продукта. Растворитель удаляли при пониженном давлении, разбавляли дихлорметаном (20 мл) и концентрировали. Это повторяли более двух раз для удаления всей ТФУ и остаток сушили под вакуумом. Остаток растирали в порошок с безводным диэтиловым эфиром и полученное твердое вещество собирали и сушили под вакуумом, получая 34 мг неочищенного вещества. Пептиды очищали градиентной элюцией на колонке с силикагелем C18 ВЭЖХ с обращенной фазой – ацетонитрил/вода/ТФУ (0,075%). Фракции, содержащие чистый пептид, концентрировали при пониженном давлении и лиофилизировали с получением продукта (соли ТФУ основных групп) в виде мелкодисперсного порошка. ES-MS (M+H)+ 704,0 (вычисл. 703,39). 5.4. Анализ связывания HLA II EBV гомозиготные клеточные линии использовали в качестве источника HLA молекул II класса. HLA-DR-молекулы очищали путем аффинной хроматографии, используя мономорфное mAb L243 (американская коллекция типовых культур, Manassas, VA) связанное с гелем белок A-Сефароза CL 4B (Amersham Pharmacia Biotech). На колонки с Сефарозой 4B и белок A-Сефарозой 4B наносили супернатанты лизированных клеток после центрифугирования (100000 g в течение 1 ч). HLA DR-молекулы элюировали 1,1 мМ н-додецил HLA-DR-молекулы разбавляли 10 мМ фосфатом, 150 мМ NaCl, 1 мМ н-додецил Некоторые соединения согласно изобретению проанализировали, используя вышеуказанный протокол, для демонстрации их селективности в отношении конкретных молекул DR, как приведено ниже в таблице 4.
5.5. Анализ ингибирования Т-клеточной пролиферации Соединения согласно изобретению могут быть протестированы на предмет ингибирования T-клеточного ответа. Специалистам в данной области знакомы многие способы, используемые для измерения T-клеточной пролиферации. См. Bolin, D., (2000) J. Med. Chem. 43:2135-2148; Chirathaworn, C. (2002) J. Immunol. 168(11):5530-5537; Falcioni, F., et. al (1999) Nature Biotechnology 17:562-567. Обработанные митомицином C (150 г/мл, 37°C, 60 мин) антигенпредставляющие клетки (APC) заранее инкубировали со стимулирующей концентрацией соединения согласно изобретению в 96-луночных U-донных планшетах (4×104 LBL или 105 DR-тансгенных клеток селезенки/лунку) при 37°C в течение 2 ч. Затем добавляли T-клетки (2×104/лунку) и клетки культивировали в течение 3 дней. Пролиферативный T-клеточный ответ измеряли путем включения [3H]тимидина с использованием счетчика в жидком сцинтиляторе. Для скрининга соединения вывели HEL-специфические поликлональные T-клеточные линии и OVA-специфические T-клеточные гибридомы из химерных трансгенных мышей HLA-DR4-IE, а спленоциты тех же самых трансгенных мышей служили в качестве APC. Bolin, D. Id. Т-клеточную ингибиторную активность можно измерить относительно показателя IC50 для контрольных пептидов или соединений с известной ингибиторной активностью. В качестве альтернативы могут быть использованы стандартные контрольные соединения, известные в данной области, например форбол (10 нМ) в комбинации с иономицином (0,5 мкМ). 5.6. Анализ стабильности катепсина Пептид, связанный с основным белком миелина (AcVRFFKNI-NHo), инкубировали с забуференным раствором, содержащим катепсин B, D, или L, примерно при 37°C при pH 6. Продукты разрушения разделяли, используя ВЭЖХ с обращенной фазой (градиентная элюция ацетонитрил/вода/ТФУ). Величину исходного пика выражали как функцию от времени инкубации с ферментом и строили график относительно высоты внутреннего стандартного пика. Массу выбранных пиков определяли для идентификации участков расщепления. Поскольку настоящее изобретение описано на примере конкретных неограничивающих вариантов изобретения, специалистам в данной области очевидно, что допустимы различные изменения и модификации в прделах сущности и объема согласно изобретению, как определяется формулой изобретения. Также предполагается, что такие модификации охватываются объемом прилагаемой формулы изобретения.
Формула изобретения
1. Соединение формулы II или его фармацевтически приемлемая соль, где R1 представляет собой линейный или разветвленный C1-6алкил; X1 представляет собой линейный или разветвленный С1-6алкил, гидроксиС1-6алкил, C1-6гетероалкил, С5-14арилС1-6алкил, С5-14гетероарилС1-6алкил, C1-6алкокси, С1-6алкоксикарбонил, С1-6алкоксиС1-6алкил, оксоС5-14арилС1-6алкил, аминоС1-6алкил, С1-6алкиламиноС1-6алкил, диалкиламиноС1-6алкил; Х2 представляет собой линейный или разветвленный С1-6алкил, гидроксиС1-6алкил, C1-6гетероалкил, С5-14арилС1-6алкил, С5-14гетероарилС1-6алкил, С1-6алкокси, С1-6алкоксикарбонил, С1-6алкоксиС1-6алкил, оксоС5-14арилС1-6алкил, аминоС1-6алкил, С1-6алкиламиноС1-6алкил, диалкиламиноС1-6алкил; R2 и R3 независимо представляют собой водород, линейный или разветвленный, С1-6алкил С1-6алкокси, С1-6алкоксиС1-6алкил; или R2 и R3, взятые вместе, образуют 5-7-членное карбоциклическое кольцо, 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное гетероарильное кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, замещенное или незамещенное 5-7-членное арильное кольцо; или R2 и R3, взятые вместе, образуют 9-14-членное бициклическое кольцо; R4 представляет собой водород, линейный или разветвленный С1-6алкил, C1-6алкокси, C1-6алкоксикарбонил, гидроксиС1-6алкил или гидрокси; Het представляет собой гетероатом, содержащий группу, такую как -NH, -SH, -ОН, C1-6гетероалкил, С1-6алкиламино, аминоС1-6алкил, С1-6алкиламиноС1-6алкил, С1-6алкиламидо, диалкиламиноС1-6алкил, аминоС1-6алкокси или 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы; R5 и R6 независимо представляют собой водород; или, если г равно 0 и t равно 0, R6 может представлять собой (CH2)Р-A-B-G; Z представляет собой водород, линейный или разветвленный С1-6алкил, С1-6гетероалкил; или Z, взятое вместе с W, может образовывать 5-7-членное карбоциклическое кольцо, замещенное или незамещенное 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное гетероциклическое ароматическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, замещенное или незамещенное 5-7-членное ароматическое кольцо; или Z, взятое вместе с W, может образовывать 9-14-членное бициклическое кольцо; W представляет собой линейный или разветвленный С1-6алкил, С5-7арил или замещенный или незамещенный С5-7арилС1-6алкил; А представляет собой 5-7-членное карбоциклическое кольцо, 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное гетероарильное кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное арильное кольцо, 9-14-членное бициклическое кольцо; или 13-17-членное трициклическое кольцо; В представляет собой необязательный заместитель, который, если присутствует, представляет собой -CHY-, -YCH-, -Y(CH)q-, -(CH)qY-; YG- или GY-; G представляет собой необязательный заместитель, который, если присутствует, представляет собой линейный или разветвленный С1-6алкил, С1-6гетероалкил, 5-7-членное карбоциклическое кольцо, 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное гетероарильное кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное арильное кольцо; Y представляет собой О, S или NR2R3; m является целым числом от 0 до 3; n является целым числом от 0 до 4, так что -СН2– отсутствует, присутствует или составляет цепь до четырех метильных групп; r является целым числом от 0 до 3; t является целым числом от 0 до 3; p является целым числом от 0 до 4, так что -СН2– отсутствует, присутствует или составляет цепь до четырех метильных групп; и q является целым числом от 1 до 3, где соединения формулы II не включают в себя полностью природный L – аминокислотный пептид. 2. Соединение формулы III: или его фармацевтически приемлемая соль, где R1 представляет собой линейный или разветвленный C1-6алкил; X1 представляет собой линейный или разветвленный С1-6алкил, гидроксиС1-6алкил, С1-6гетероалкил, С5-14арилС1-6алкил, С5-14гетероарилС1-6алкил, С1-6алкоксил С1-6алкоксикарбонил, С1-6алкоксиС1-6алкил, оксоС5-14арилС1-6алкил аминоС1-6алкил, С1-6алкиламиноС1-6алкил, диалкиламиноС1-6алкил; Х2 представляет собой линейный или разветвленный С1-6алкил, гидроксиС1-6алкил, С1-6гетероалкил, С5-14арилС1-6алкил, С5-14гетероарилС1-6алкил, С1-6алкокси, С1-6алкоксикарбонил, С1-6алкокси C1-6алкил, оксоС5-14арилС1-6алкил, аминоС1-6алкил, С1-6алкиламиноС1-6алкил, диалкиламиноС1-6алкил, или (СН2)Р-A-B-G; R2 и R3 независимо представляют собой водород, линейный или разветвленный C1-6алкил, С1-6алкокси, С1-6алкоксиС1-6алкил; или R2 и R3, взятые вместе, образуют 5-7-членное карбоциклическое кольцо, 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное гетероарильное кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, замещенное или незамещенное 5-7-членное арильное кольцо; или R2 и R3, взятые вместе, образуют замещенное или незамещенное 9-14-членное бициклическое кольцо; Q представляет собой -СН2, -CHR4, -NH или -NR4; R4 представляет собой водород, линейный или разветвленный С1-6алкил, C1-6алкокси, гидроксиС1-6алкил или гидрокси; Z представляет собой -СН2, -С(О) или -СНОН, где Q представляет собой -СН2 или -CHR4, и Z представляет собой -СН2 или -С(O), если Q представляет собой -NH или -NR4; R6 представляет собой линейный или разветвленный С1-6алкил, С5-14арилC1-6алкил, С5-7гетероарилС1-6алкил, С1-6алкокси, С1-6алкокси С1-6алкил, оксоарилС1-6алкил, аминоС1-6алкил, С1-6алкиламиноС1-6алкил, диалкиламиноС1-6алкил, 5-7-членное карбоциклическое кольцо, 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное гетероарильное кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное арильное кольцо; R7 представляет собой водород; R8 представляет собой водород, или, если n равно 0, R8 может представлять собой (CH2)P-A-B-G; А представляет собой 5-7-членное карбоциклическое кольцо, 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное гетероарильное кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, замещенное или незамещенное 5-7-членное арильное кольцо, 9-14-членное бициклическое кольцо; или 13-17-членное трициклическое кольцо; В представляет собой необязательный заместитель, который, если присутствует, представляет собой -CHY-, -YCH-, -Y(CH)q-, -(CH)qY-; YG- или GY-; G представляет собой необязательный заместитель, который, если присутствует, представляет собой линейный или разветвленный С1-6алкил, C1-6гетероалкил, 5-7-членное карбоциклическое кольцо, 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное гетероарильное кольцо, содержащее по меньшей мере один гетероатом, выбранный из азота, кислорода или серы, 5-7-членное арильное кольцо; Y представляет собой О, S или NR2R3; m является целым числом от 0 до 3; n является целым числом от 0 до 3; р является целым числом от 0 до 4; и q является целым числом от 1 до 3, где соединения формулы III не включают в себя полностью природный L – аминокислотный пептид. 3. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой следующее ENPVVHFFKNI AcIHFFKNI AcVRFFKNI AcVHPFKNI AcVHFFPNI AcVHFFKTI AcVRFANI AcVRPFS AcVRLFANI AcVVHFFKNI AcVTFFKNI AcVH(N-Me-Ala)FKNI AcVHA(N-Me-Ala)-F-(N-Me-Ala)N AcVHFVKNI AcVRF(2-Nal)KNI AcVRF(l-Nal)KNI AcVHFFA(N-Me-Ala)NI AcVRLFKN AcVRF(4′-Пиридил-Ala)KNI AcVRAFAN AcVRA(O-Бензил-Ser)KNI Ac(Tic)FKNI AcVR(Tic)FKNI Ac(Cpg)RFFKNI AcVHSFSN AcVRF(3′-Циано-Phe)KNI AcVR(Tiq)FKNI Ac(Tiq)FKNI AcVVRFFK AcVRFF(homo-Pro)NI Ac(Tic)FKNI Ac(Cpg)R(Tic)FKNI AcVR(homo-Pro)FKNI AcVRFFK AcVKFFKNI AcV(Orn)FFKNI Ac V(N’-Alloc-Dab)FFKNI Ac(Cha)RFFKNI Ac(2′-Фуранил-Ala)RFFKNI Ac(2′-Тиенил-Ala)RFFKNI AcVR(2’2′-Фуранил-Ala)FKNI Ас(2′-Тиенил-Ala)FKNI AcVRAFKNI Бензоил-VRFFK Изобутаноил-VRFFK Бутаноил-VRFFK Изовалероил-VRFFK Ac(Cpg)R(Tic)F(homo-Pro) AcVVRFF 3-(Имадазоил-4-ил)пропионил-VRFFK Ac(Chg)RFFKNI AcVRFF(Dap)NI Ac(Dab)FFKNI AcVVAGFKNI AcVAGFKNI AcV(Dap)FFKNI AcVRFF AcVRF(3′-фенокси-Phe)KNI AcVVKF(3′-Метиламино-Phe)K AcFRFFKNI AcVRFFK(beta-Ala)I AcV(3′-амино-1′-карбоксиметилпиридин-2′-он)FKNI Ac(Idg)RFFKNI AcAVRFFK AcAVHFFKNI AcV(2′-Фуранил-Ala)FFKNI AcV(2′-Тиенил-Ala)FFKNI AcVVKF(3′-Циано-Phe)K Ac(Phg)RFFKNI AcIR(Tic)F(homo-Pro) AcLRFFKNI AcVR(Phg)FKNI AcVVRF(3′-фенокси-Phe)K AcVRF(Phg)KNI AcVRFFK(beta-Ala) AcVVRFFK(beta-Ala) Ac(Chg)VRFFK Ac(Chg)RF(4′-Индолил-Ala)KNI AcVRF(3′-Карбазолил-Ala)KNI Ac(Cpg)-NHNH(COCH2CH(Ph)CO)KNI AcVRF(3′-амино-Phe)KNI AcWRFFKNI AcV( AcV(Chg)RFFK AcV(nor-Arg)FFKNI AcVRF(3-Ацетиламино-Phe)KNI Ac(Chg)R(Tic)F(4′-гидрокси-Pro) Ac(Chg)R(Tic) AcVKFFENI AcVRIFKNI Ac(Cpg)-NHNH(COCH2CH(Ph)CO)FKNI Ac(Chg)R(Tic)-(3′-Карбазолил-Ala) Ac(Chg)R(Tic)F(homo-Pro) Ac(Idg)R(Tic)FK AcV(Idg)R(Tic)FK AcV(Chg)R(Tic)F AcV(Chg)RFFK Ac(Chg)R(Tic)-(3′-Карбазолил-Ala)G AcV(Chg)R(Tic)-(3′-Карбазолил-Ala)G AcVVRF(3′-Ацетиламинометил-Phe) AcVVRF(3′-Метилсульфониламинометил-Phe) (2,6-Диметилбензоил)-VRFFK AcV(homo-Arg)FFKNI Ac(Cpg)-NHNH(COCH2CH(Ph)CO)-(4′-Индолил-Ala)K. 4. Соединение по п.2, в котором все природные и неприродные аминокислоты представляют собой L-аминокислоты. 5. Соединение по п.2, в котором одна или несколько природных аминокислот или неприродных аминокислот имеют R-конфигурацию. 6. Соединение по п.2, в котором одна или несколько природных аминокислот или неприродных аминокислот имеют S-конфигурацию. 7. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении связывания антигена с молекулами МНС II класса, включающая в себя терапевтически эффективное количество соединения по пп.1, 2 или 3 и фармацевтически приемлемый носитель. 8. Применение соединения по пп.1, 2 или 3 или его фармацевтически приемлемой соли для производства лекарственного средства для лечения или предупреждения заболевания, реагирующего на ингибирование связывания антигена с молекулой МНС II класса. 9. Применение соединения по пп.1, 2 или 3 или его фармацевтически приемлемой соли для производства лекарственного средства для лечения или предупреждения заболевания, реагирующего на ингибирование представления антигена молекулой МНС II класса. 10. Применение соединения по пп.1, 2 или 3 или его фармацевтически приемлемой соли для производства лекарственного средства для лечения или предупреждения заболевания, реагирующего на ингибирование Т-клеточной пролиферации. 11. Применение по п.8, в котором молекула МНС II класса представляет собой HLA-DR2. 12. Применение по п.9, в котором молекула МНС II класса представляет собой HLA-DR2. 13. Применение соединения по пп.1, 2 или 3 или его фармацевтически приемлемой соли для производства лекарственного средства для лечения или предупреждения аутоиммунного заболевания. 14. Применение по п.13, в котором аутоиммунное заболевание представляет собой рассеянный склероз. 15. Способ ингибирования связывания с HLA-DR2-молекулой МНС II класса, включающий в себя взаимодействие клетки с эффективным количеством соединения по пп.1, 2 или 3. 16. Способ ингибирования представления антигена HLA-DR2-молекулой MHC II класса, включающий в себя взаимодействие клетки с эффективным количеством соединения по пп.1, 2 или 3. 17. Способ ингибирования Т-клеточной пролиферации, включающий в себя взаимодействие клетки с эффективным количеством соединения по пп.1, 2 или 3.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -амино кислоты, алкоксиациламиды и алкиламиноалкилкарбониламиды. Примеры биогидролизуемых карбаматов включают в себя без ограничений низшие алкиламины, замещенные этилендиамины, аминокислоты, гидроксиалкиламины, гетероциклические и гетероароматические амины и амины полиэфиров.
-амино кислоты, алкоксиациламиды и алкиламиноалкилкарбониламиды. Примеры биогидролизуемых карбаматов включают в себя без ограничений низшие алкиламины, замещенные этилендиамины, аминокислоты, гидроксиалкиламины, гетероциклические и гетероароматические амины и амины полиэфиров. -O-аланин, фтор-аминокислоты, сконструированные аминокислоты, такие как
-O-аланин, фтор-аминокислоты, сконструированные аминокислоты, такие как 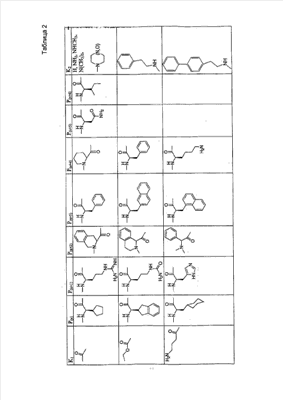
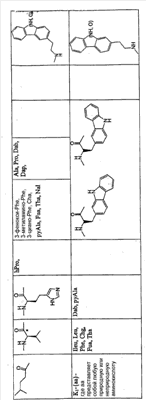
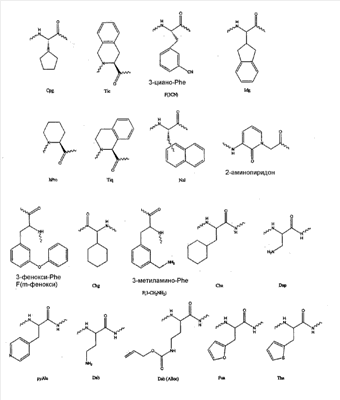
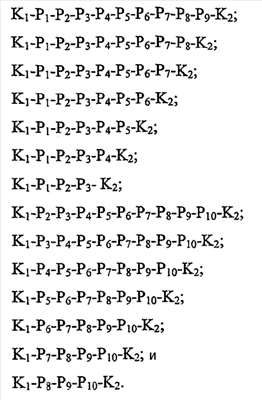
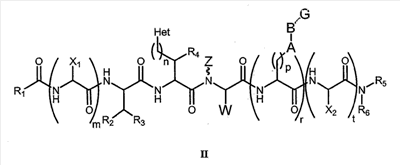
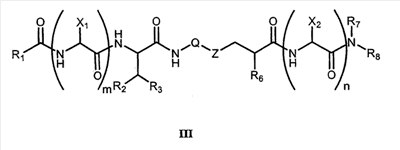
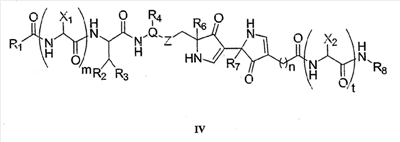
 ,
,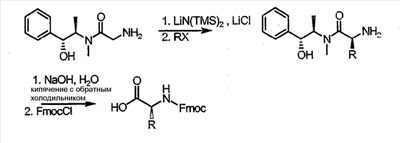
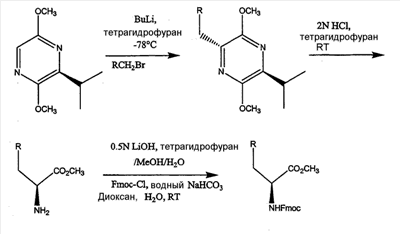
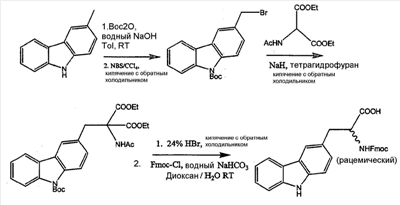
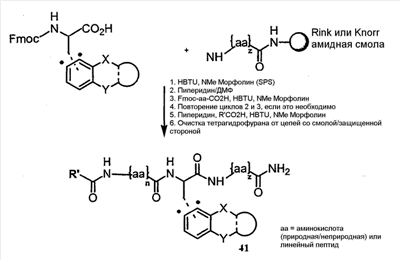
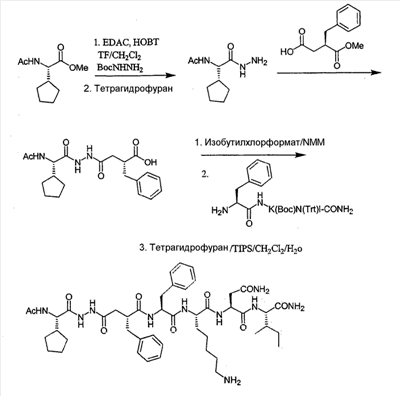
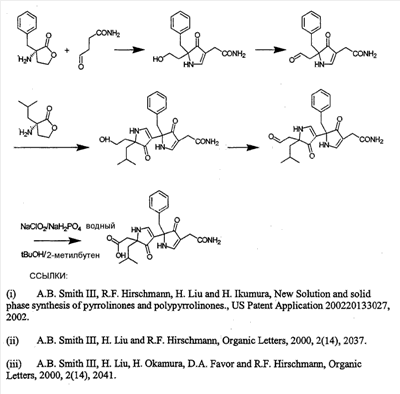
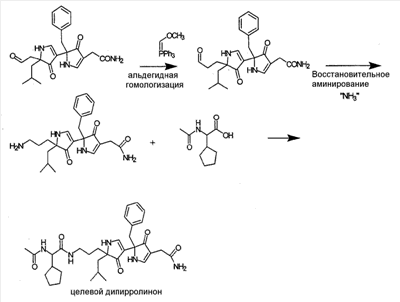
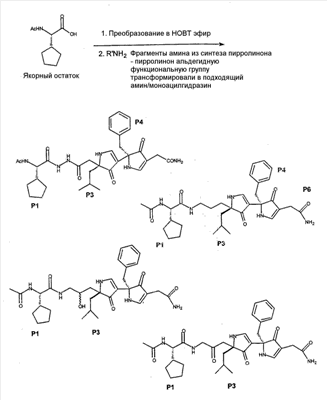
 и Starch 1500 LM.
и Starch 1500 LM.