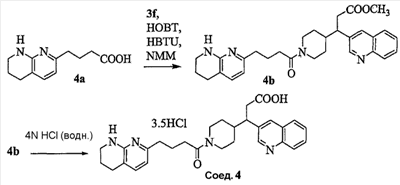
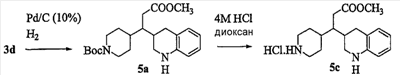
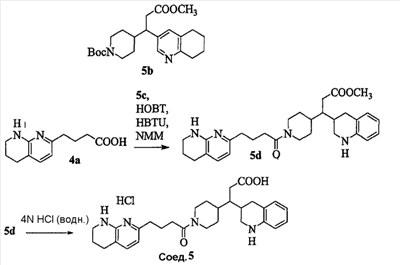
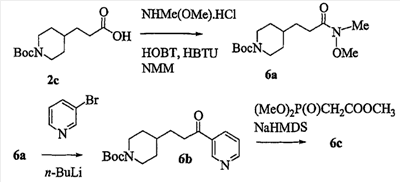
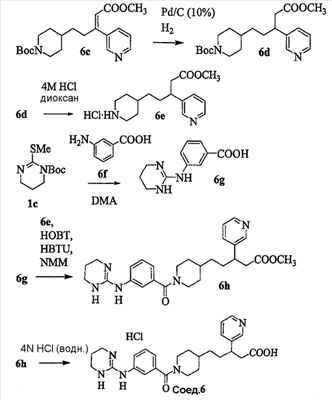
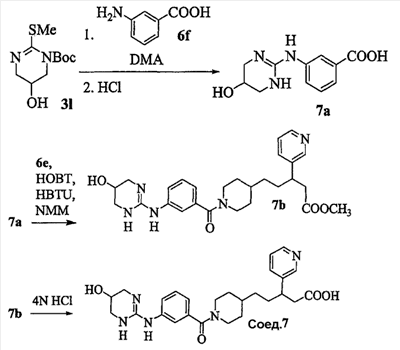
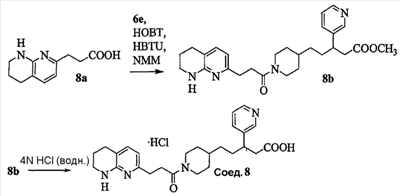
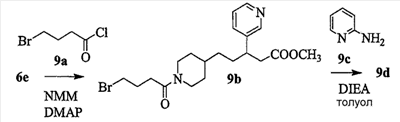
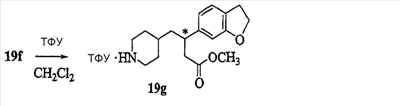
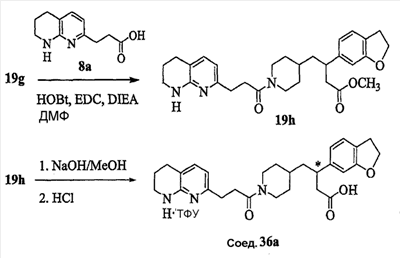
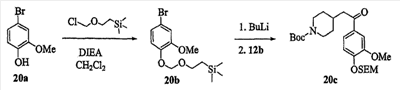
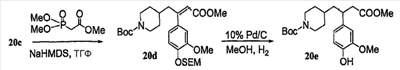
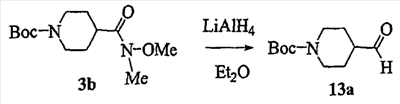Патент на изобретение №2333210
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СОЕДИНЕНИЯ ПИПЕРИДИНИЛА, СЕЛЕКТИВНО СВЯЗЫВАЮЩИЕ ИНТЕГРИНЫ
(57) Реферат:
Изобретение относится к новым соединениям пиперидинила формулы (I) и (II), которые селективно связываются с рецепторами интегрина, фармацевтическим композициям и применению соединений для приготовления лекарственного средства, обладающего антагонистической активностью в отношении рецепторов интегрина, где W, R2, Z и q описаны в заявке. 8 н. и 25 з.п. ф-лы, 1 табл.
(56) (продолжение): CLASS=”b560m”Fisher et al “Fused Bicyclic Gly-Asp
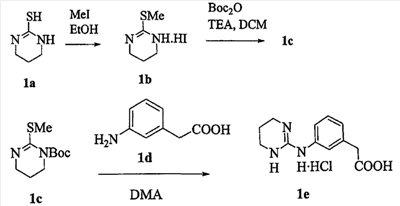
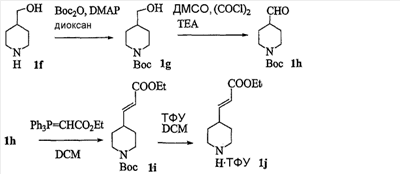
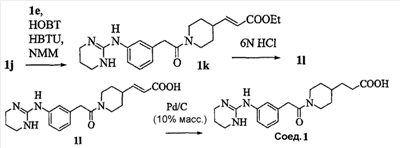
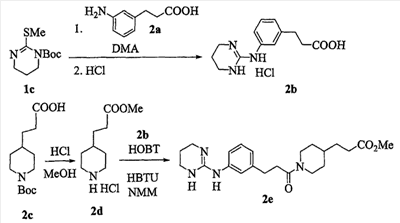
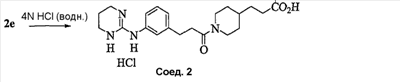
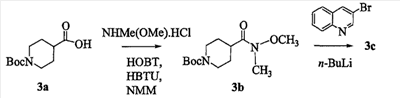
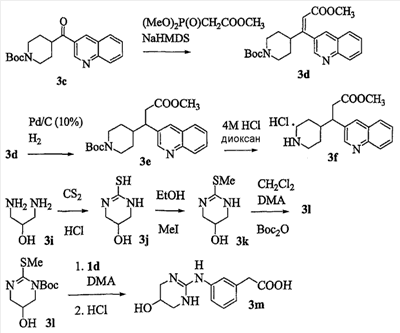
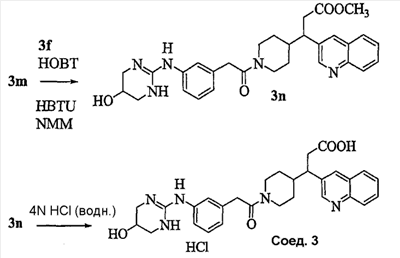
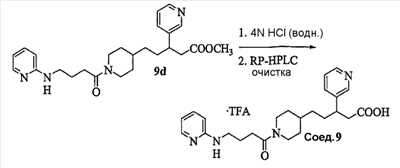
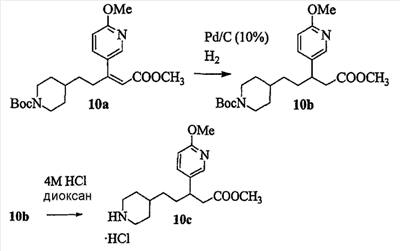
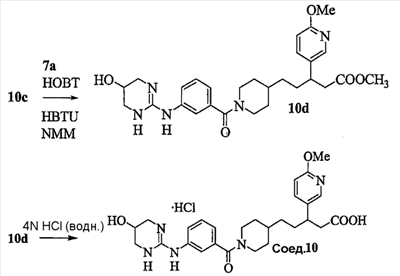
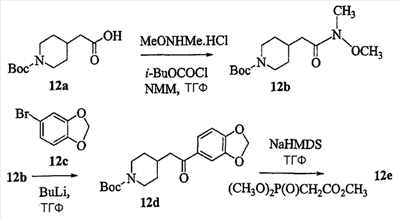
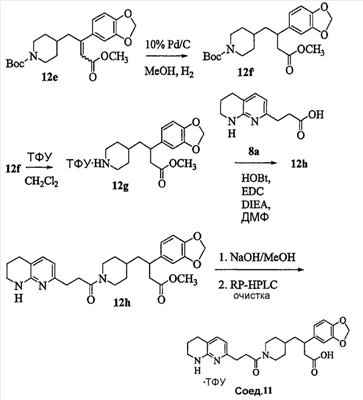
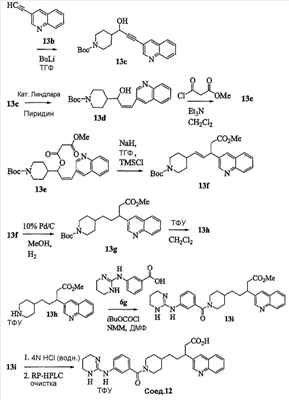
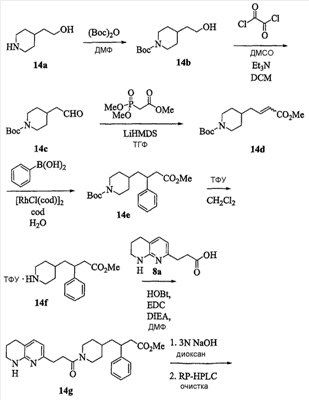
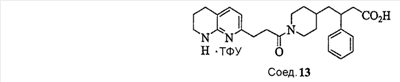
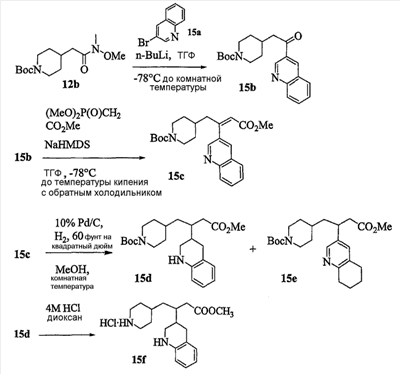
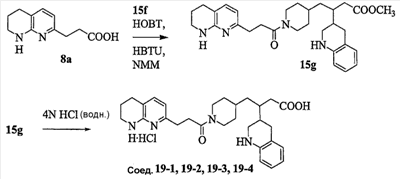
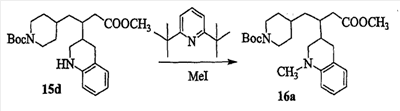
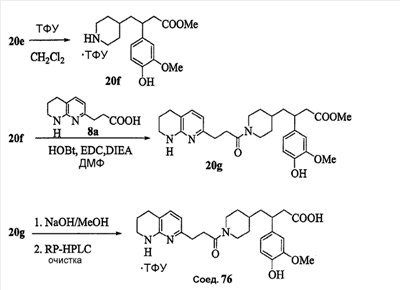
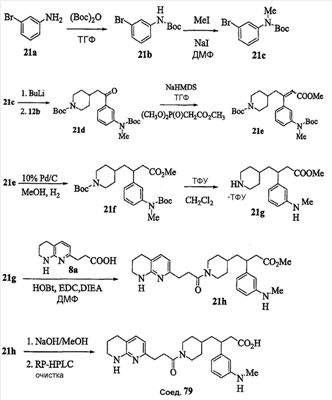
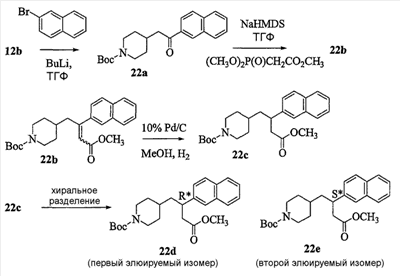
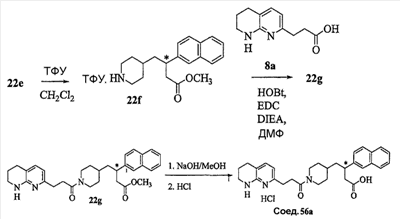
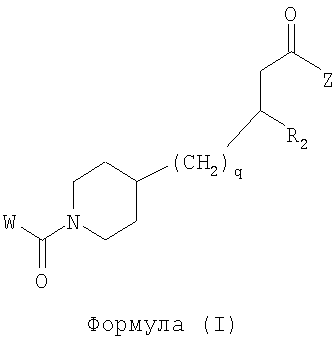
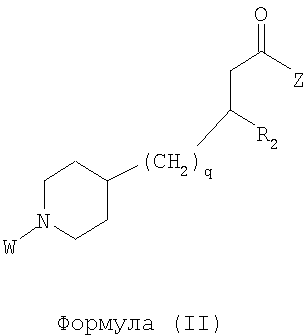
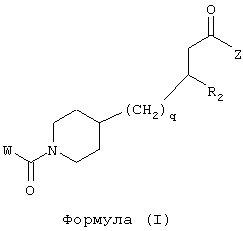
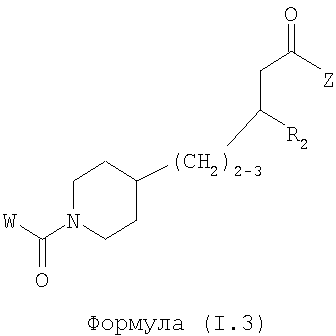
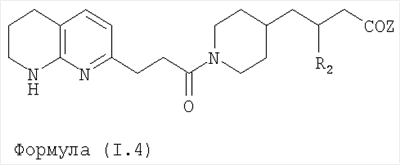
Область изобретения Данная заявка является развитием предварительной заявки, имеющей серийный номер 60/404,239, поданной 16 августа 2003, которая включена здесь в виде ссылки. Данное изобретение относится к новым соединениям и способам их применения для лечения заболеваний, опосредованных интегрином. Более конкретно, данное изобретение относится к соединениям пиперидинила, которые селективно связываются с рецепторами интегрина, и к способам лечения заболеваний, опосредованных интегрином. Предпосылки изобретения Интегрины представляют собой семейство трансмембранных рецепторов, каждый из которых состоит из пары гетеродимерных, нековалентно-связанных гликопротеинов, обозначаемых как Настоящее изобретение относится к новому классу соединений пиперидинила, которые селективно связываются с Краткое описание изобретения Настоящее изобретение относится к соединениям пиперидинила формулы (I): Формула (I) и формулы (II) Формула (II) где W выбран из группы, состоящей из -C0-6алкил(R1), -C1-6алкил(R1a), -C0-6алкиларил(R1,R8), -C0-6алкилгетероциклил(R1,R8), -C0-6алкокси(R1), -C0-6алкоксиарил(R1,R8) и -C0-6алкоксигетероциклил(R1,R8), R1 выбран из группы, состоящей из водорода, -N(R4)2, -N(R4)(R5), -N(R4)(R6), -гетероциклил(R8) и -гетероарил(R8); R1a выбран из группы, состоящей из -C(R4)(=N-R4), -C(=N-R4)-N(R4)2, -C(=N-R4)-N(R4)(R6), -C(=N-R4)-N(R4)-C(=O)-R4, -C(=N-R4)-N(R4)-C(=O)-N(R4)2, -C(=N-R4)-N(R4)-CO2-R4, -C(=N-R4)-N(R4)-SO2-C1-8алкил(R7) и -C(=N-R4)-N(R4)-SO2-N(R4)2; R4 выбран из группы, состоящей из водорода и -C1-8алкил(R7); R5 выбран из группы, состоящей из -C(=O)-R4, -C(=O)-N(R4)2, -C(=O)-циклоалкил(R8), -C(=O)-гетероциклил(R8), -C(=O)-арил(R8), -C(=O)-гетероарил(R8), -C(=O)-N(R4)-циклоалкил(R8), -C(=O)-N(R4)-арил(R8), -CO2-R4, -CO2-циклоалкил(R8), -CO2-арил(R8), -C(R4)(=N-R4), -C(=N-R4)-N(R4)2, -C(=N-R4)-N(R4)(R6), -C(=N-R4)-N(R4)-C(=O)-R4, -C(=N-R4)-N(R4)-C(=O)-N(R4)2, -C(=N-R4)-N(R4)-CO2-R4, -C(=N-R4)-N(R4)-SO2-C1-8алкил(R7), -C(=N-R4)-N(R4)-SO2-N(R4)2, -N(R4)-C(R4)=(=N-R4), -N(R4)-C(=N-R4)-N(R4)2, -N(R4)-C(=N-R4)-N(R4)(R6), -N(R4)-C(=N-R4)-N(R4)-C(=O)-R4, -N(R4)-C(=N-R4)-N(R4)-C(=O)-N(R4)2, -N(R4)-C(=N-R4)-N(R4)-CO2-R4, -N(R4)-C(=N-R4)-N(R4)-SO2-C1-8алкил(R7), -N(R4)-C(=N-R4)-N(R4)-SO2-N(R4)2, -SO2-C1-8алкил(R7), -SO2-N(R4)2, -SO2-циклоалкил(R8) и -SO2-арил(R8); R6 выбран из группы, состоящей из -циклоалкил(R8), -гетероциклил(R8), -арил(R8) и -гетероарил(R8); R7 представляет собой один или два заместителя, независимо выбранных из группы, состоящей из водорода, -C1-8алкокси(R9), NH2, -NH-C1-8алкил(R9), -N(C1-8алкил(R9))2, -C(=O)H, -C(=O)-C1-8алкил(R9), -C(=O)-NH2, -C(=O)-NH-C1-8алкил(R9), -C(=O)-N(C1-8алкил(R9))2, -C(=O)-NH-арил(R10), -C(=O)-циклоалкил(R10), -С(=O)-гетероциклил(R10), -C(=O)-арил(R10), -C(=O)-гетероарил(R10), -CO2H, -CO2-C1-8алкил(R9), -CO2-арил(R10), -C(=NH)-NH2, -SH-S-C1-8алкил(R9), -S-C1-8алкил-S-C1-8алкил(R9), -S-C1-8алкил-C1-8алкокси(R9), -S-C1-8алкил-NH-C1-8алкил(R9), -SO2-C1-8алкил(R9), -SO2-NH2, -SO2-NH-C1-8алкил(R9), -SO2-N(C1-8алкил(R9))2, -SO2-арил(R10), циано, (галоген)1-3, гидрокси, нитро, оксо, -циклоалкил(R10), -гетероциклил(R10), -арил(R10) и -гетероарил(R10); R8 представляет собой от одного до четырех заместителей, независимо выбранных из группы, состоящей из водорода, -C1-8алкил(R9), -C(=O)H, -C(=O)-C1-8алкил(R9), -C(=O)-NH2, -C(=O)-NH-C1-8алкил(R9), -C(=O)-N(C1-8алкил(R9))2, -C(=O)-NH-арил(R10), -C(=O)-циклоалкил(R10), -C(=O)-гетероциклил(R10), -C(=O)-арил(R10), -C(=O)-гетероарил(R10), -CO2H, -CO2-C1-8алкил(R9), -CO2-арил(R10), -C(=NH)-NH2, -SO2-C1-8алкил(R9), -SO2-NH2, -SO2-NH-C1-8алкил(R9), -SO2-N(C1-8алкил(R9))2, -SO2-арил(R10), -циклоалкил (R10) и -арил(R10), если присоединен к атому азота; и где R8 представляет собой от одного до четырех заместителей, независимо выбранных из группы состоящей из водорода, -C1-8алкил(R9), -C1-8алкокси(R9), -O-циклоалкил(R10), -O-арил(R10), -C(=O)H, -C(=O)-C1-8алкил(R9), -C(=O)-NH2, -C(=O)-NH-C1-8алкил(R9), -C(=O)-N(C1-8алкил(R9))2, -C(=O)-NH-арил(R10), -C(=O)-циклоалкил(R10), -C(=O)-гетероциклил(R10), -C(=O)-арил(R10), -C(=O)-гетероарил(R10), -CO2H, -CO2-C1-8алкил(R9), -CO2-арил(R10), -C(=NH)-NH2, -SO2-C1-8алкил(R9), -SO2-NH2, -SO2-NH-C1-8алкил(R9), -SO2-N(C1-8алкил(R9))2, -SO2-арил(R10), -SH, -S-C1-8алкил(R9), -S-C1-8алкил-S-C1-8алкил(R9), -S-C1-8алкил-C1-8алкокси(R9), -S-C1-8алкил-NH-C1-8алкил(R9), -NH2, -NH-C1-8алкил(R9), -N(C1-8алкил(R9))2, циано, галоген, гидрокси, нитро, оксо, -циклоалкил(R10), -гетероциклил(R10), -арил(R10) и -гетероарил(R10), если присоединен к атому углерода; R9 выбран из группы, состоящей из водорода, -C1-8алкокси, -NH2, -NH-C1-8алкил, -N(C1-8алкил)2, -C(=O)H, -C(=O)-NH2, -C(=O)-NH-C1-8алкил, -C(=O)-N(C1-8алкил)2, -CO2H, -CO2-C1-8алкил, -SO2-C1-8алкил, -SO2-NH2, -SO2-NH-C1-8алкил, -SO2-N(C1-8алкил)2, циано, (галоген)1-3, гидрокси, нитро и оксо; R10 представляет собой от одного до четырех заместителей, независимо выбранных из группы, состоящей из водорода, -C1-8алкила, -C(=O)H, -C(=O)-C1-8алкила, -C(=O)-NH2, -C(=O)-NH-C1-8алкила, -C(=O)-N(C1-8алкил)2, -CO2H, -CO2-C1-4алкила, -SO2-C1-8алкила, -SO2-NH2, -SO2-NH-C1-8алкила и -SO2-N(C1-8алкил)2, если присоединен к атому азота; и где R10 представляет собой от одного до четырех заместителей, независимо выбранных из группы состоящей из водорода, -C1-8алкила, -C1-8алкокси, -C(=O)H, -C(=O)-C1-8алкила, -C(=O)-NH2, -C(=O)-NH-C1-8алкила, -C(=O)-N(C1-8алкил)2, -CO2H, -CO2-C1-4алкила, -SO2-C1-8алкила, -SO2-NH2, -SO2-NH-C1-8алкила, -SO2-N(C1-8алкил)2, -NH2, -NH-C1-8алкила, -N(C1-8алкил)2, циано, галогена, гидрокси, нитро и оксо, если присоединен к атому углерода; R2 выбран из группы, состоящей из водорода, -C1-8алкил(R7), -C2-8алкенил(R7), -C2-8алкинил(R7), -циклоалкил(R8), гетероциклил(R8), -арил(R8) и -гетероарил(R8); q равно 0, 1, 2 или 3; Z выбран из группы, состоящей из гидрокси, -NH2, -NH-C1-8алкила, -N(C1-8алкил)2, -O-C1-8алкила, -O-C1-8алкил-OH, -O-C1-8алкилC1-8алкокси, -O-C1-8алкилкарбонилC1-8алкила, -O-C1-8алкил-CO2H, -O-C1-8алкил-C(O)OC1-8алкила, -O-C1-8алкил-O-C(O)C1-8алкила, -O-C1-8алкил-NH2, -O-C1-8алкил-NH-C1-8алкила, -O-C1-8алкил- N(C1-8алкил)2, -O-C1-8алкиламида, -O-C1-8алкил-C(O)-NH-C1-8алкила, -O-C1-8алкил-C(O)-N(C1-8алкил)2 и -NHC(O)C1-8алкила, и к их фармацевтически приемлемым солям, рацемическим смесям и энантиомерам. Настоящее изобретение также относится к способам получения настоящих соединений пиперидинила и их фармацевтических композиций и лекарственных средств. Настоящее изобретение, кроме того, относится к способу лечения или облегчения заболевания, опосредованного рецептором интегрина. Подробное описание изобретения Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где W предпочтительно выбран из группы, состоящей из -C0-4алкил(R1), -C1-4алкил(R1a), -C0-4алкиларил(R1,R8), -C0-4алкилгетероциклил(R1,R8), -C0-4алкокси(R1), -C0-4алкиларил(R1,R8) и -C0-4алкилгетероциклил(R1,R8). Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где W предпочтительно представляет собой -C0-4алкил(R1) или -C0-4алкиларил(R1,R8). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где W предпочтительно представляет собой -C0-4алкил(R1) или -C0-4алкилфенил(R1,R8). Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R1 представляет собой -N(R4)(R6), -гетероциклил(R8) или -гетероарил(R8). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R1 представляет собой -N(R4)(R6), -дигидро-1H-пирроло[2,3-b]пиридинил(R8), -тетрагидропиримидинил(R8), -тетрагидро-1,8-нафтиридинил(R8), -тетрагидро-1H-азепино[2,3-b]пиридинил (R8) или -пиридинил (R8). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R1 представляет собой -N(R4)(R6), -тетрагидропиримидинил(R8) или -тетрагидро-1,8-нафтиридинил (R8). Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R1a представляет собой -C(R4)(=N-R4), -C(=N-R4)-N(R4)2, -C(=N-R4)-N(R4)(R6), -C(=N-R4)-N(R4)-C(=O)-R4, -C(=N-R4)-N(R4)-C(=O)-N(R4)2, -C(=N-R4)-N(R4)-CO2-R4, -C(=N-R4)-N(R4)-SO2-C1-4алкил(R7) или -C(=N-R4)-N(R4)-SO2-N(R4)2. Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R4 представляет собой водород или -C1-4алкил(R7). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R4 представляет собой водород. Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R5 представляет собой -C(=O)-R4, -C(=O)-N(R4)2, -C(=O)-циклоалкил(R8), -C(=O)-гетероциклил(R8), -C(=O)-арил(R8), -C(=O)-гетероарил(R8), -C(=O)-N(R4)-циклоалкил(R8), -C(=O)-N(R4)-арил(R8), -CO2-R4, -CO2-циклоалкил(R8), -CO2-арил(R8), -C(R4)(=N-R4), -C(=N-R4)-N(R4)2, -C(=N-R4)-N(R4)(R6), -C(=N-R4)-N(R4)-C(=O)-R4, -C(=N-R4)-N(R4)-C(=O)-N(R4)2, -C(=N-R4)-N(R4)-CO2-R4, -C(=N-R4)-N(R4)-SO2-C1-4алкил(R7), -C(=N-R)-N(R4)-SO2-N(R4)2, -N(R4)-C(R4)(=N-R4), -N(R4)-C(=N-R4)-N(R4)2, -N(R4)-C(=N-R4)-N(R4)(R6), -N(R4)-C(=N-R4)-N(R4)-C(=O)-R4, -N(R4)-C(=N-R4)-N(R4)-C(=O)-N(R4)2, -N(R4)-C(=N-R4)-N(R4)-CO2-R4, -N(R4)-C(=N-R4)-N(R4)-SO2-C1-4алкил(R7), -N(R4)-C(=N-R4)-N(R4)-SO2-N(R4)2, -SO2-C1-4алкил(R7), -SO2-N(R4)2, -SO2-циклоалкил(R8) или -SO2-арил(R8). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R5 представляет собой -C(=O)-R4, -C(=O)-N(R4)2, -CO2-R4, -C(R4)(=N-R4), -C(=N-R4)-N(R4)2, -C(=N-R4)-N(R4)(R6), -N(R4)-C(R4)(=N-R4), -N(R4)-C(=N-R4)-N(R4)2, -N(R4)-C(=N-R4)-N(R4)(R6), -SO2-C1-4алкил(R7) или -SO2-(R4)2. Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R6 представляет собой -гетероциклил(R8) или -гетероарил(R8). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R6 представляет собой -дигидроимидазолил(R8), -тетрагидропиридинил(R8), -тетрагидропиримидинил(R8) или -пиридинил(R8). Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R7 представляет собой один или два заместителя, независимо выбранных из водорода, -C1-4алкокси(R9), -NH2, -NH-C1-4алкил(R9), -N(C1-4алкил(R9))2, -C(=O)H, -C(=O)-C1-4алкил(R9), -C(=O)-NH2, -C(=O)-NH-C1-4алкил(R9), -C(=O)-N(C1-4алкил(R9))2, -C(=O)-NH-арил(R10), -C(=O)-циклоалкил(R10), -C(=O)-гетероциклил(R10), -C(=O)-арил(R10), -C(=O)-гетероарил(R10), -CO2H, -CO2-C1-4алкил(R9), -CO2-арил(R10), -C(=NH)-NH2, -SH, -S-C1-4алкил(R9), -S-C1-4алкил-S-C1-4алкил(R9), -S-C1-4алкил-C1-4алкокси(R9), -S-C1-4алкил-NH-C1-4алкил(R9), -SO2-C1-4алкил(R9), -SO2-NH2, -SO2-NH-C1-4алкил(R9), -SO2-N(C1-4алкил(R9))2, -SO2-арил(R10), циано, (галоген)1-3, гидрокси, нитро, оксо, -циклоалкил(R10), -гетероциклил(R10), -арил(R10) или -гетероарил(R10). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R7 представляет собой один или два заместителя, независимо выбранных из водорода, -C1-4алкокси(R9), -NH2, -NH-C1-4алкил(R9), -N(C1-4алкил(R9))2, (галоген)1-3, гидрокси или оксо. Еще один дополнительный аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R7 представляет собой водород. Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкил(R9), -C(=O)H, -C(=O)-C1-4алкил(R9), -C(=O)-NH2, -C(=O)-NH-C1-4алкил(R9), -C(=O)-N(C1-4алкил(R9))2, -C(=O)-NH-арил(R10), -C(=O)-циклоалкил(R10), -C(=O)-гетероциклил(R10), -C(=O)-арил(R10), -C(=O)-гетероарил(R10), -CO2H, -CO2-C1-4алкил(R9), -CO2-арил(R10), -C(=NH)NH2, -SO2-C1-4алкил(R9), -SO2-NH2, -SO2-NH-C1-4алкил(R9), -SO2-N(C1-4алкил(R9))2, -SO2-арил(R10), -циклоалкил(R10) или -арил(R10), если присоединен к атому азота; и где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкил(R9), -C1-4алкокси(R9), -O-циклоалкил(R10), -O-арил(R10), -C(=O)H, C(=O)-C1-4алкил(R9), -C(=O)-NH2, -C(=O)-NH-C1-4алкил(R9), -C(=O)-N(C1-4алкил-R11)2, -C(=O)-NH-арил(R10), -C(=O)-циклоалкил(R10), -C(=O)-гетероциклил(R10), -C(=O)-арил(R10), -C(=O)-гетероарил(R10), -CO2H, -CO2-C1-4алкил(R9), -CO2-арил(R10), -C(=NH)-NH2, -SO2-C1-4алкил(R9), -SO2-NH2, -SO2-NH-C1-4алкил(R9), -SO2-N(C1-4алкил(R9))2, -SO2-арил(R10), -SH, -S-C1-4алкил(R9), -S-C1-4алкил-S-C1-4алкил(R9), -S-C1-4алкил-C1-4алкокси(R9), -S-C1-4алкил-NH-C1-4алкил(R9), -NH2, -NH-C1-4алкил(R9), -N(C1-4алкил(R9))2, циано, галогена, гидрокси, нитро, оксо, -циклоалкил(R10), -гетероциклил(R10), -арил(R10) или -гетероарил(R10), если присоединен к атому углерода. Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкил(R9), -C(=O)H, -C(=O)-NH2, -C(=O)-NH-C1-4алкил(R9), -C-(=O)-N(C1-4алкил(R9))2, -CO2H, -CO2-C1-4алкил(R9) или -SO2-NH2, если присоединен к атому азота; и где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкил(R9), -C1-4алкокси(R9), -O-арил(R10), -C(=O)H, -C(=O)-NH2, -C(=O)-NH-C1-4алкил(R9), -C(=O)-N(C1-4алкил(R9))2, -CO2H, -CO2-C1-4алкил(R9), -SO2-NH2, -NH2, -NH-C1-4алкил(R9), -N(C1-4алкил(R9))2, циано, галогена, гидрокси, нитро или оксо, если присоединен к атому углерода. Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода или -C1-4алкил(R9), если присоединен к атому азота; и где R9 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкил(R9), -C1-4алкокси(R9), -O-арил(R10), -NH2, -NH-C1-4алкил(R9), -N(C1-4алкил(R9))2, галоген, гидрокси или оксо, если присоединен к атому углерода. Еще один дополнительный аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода или -C1-4алкил(R9), если присоединен к атому азота; и где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкил(R9), -C1-4алкокси(R9)-O-арил(R10) или гидрокси, если присоединен к атому углерода. Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R9 представляет собой водород, -C1-4алкокси, -NH2, -NH-C1-4алкил, -N(C1-4алкил)2, -C(=O)H, -C(=O)-NH2, -C(=O)-NH-C1-4алкил, -C(=O)-N(C1-4алкил)2, -CO2H, -CO2-C1-4алкил, -SO2-C1-4алкил, -SO2-NH2, -SO2-NH-C1-4алкил, -SO2-N(C1-4алкил)2, циано, (галоген)1-3, гидрокси, нитро или оксо. Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R9 представляет собой водород, -C1-4алкокси, -NH2, -NH-C1-4алкил, -N(C1-4алкил)2, -C(=O)H, -CO2H, -C(=O)-C1-4алкокси, (галоген)1-3, гидрокси или оксо. Еще один дополнительный аспект настоящего изобретения включает в себя соединения формулы (I), где R9 представляет собой водород, -C1-4алкокси, -NH2, -NH-C1-4алкил, -N(C1-4алкил)2, (галоген)1-3 или гидрокси. Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R10 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкила, -C(=O)H, -C(=O)-C1-4алкила, -C(=O)-NH2, -C(=O)-NH-C1-4алкила, -C(=O)-N(C1-4алкил)2, -CO2H, -CO2-C1-4алкила, -SO2-C1-4алкила, -SO2-NH2, SO2-NH-C1-4алкила или -SO2-N(C1-4алкил)2, если присоединен к атому азота; и где R10 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкила, -C1-4алкокси, -С(=O)H, -C(=O)-C1-4алкила, -C(=O)-NH2, -C(=O)-NH-C1-4алкила, -C(=O)-N(C1-4алкил)2, -CO2H, -CO2-C1-4алкила, -SO2-C1-4алкила, -SO2-NH2, -SO2-NH-C1-4алкила, -SO2-N(C1-4алкил)2, -NH2, -NH-С1-4алкила, -N(C1-4алкил)2, циано, галогена, гидрокси, нитро или оксо, если присоединен к атому углерода. Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где (R10)1-4 представляет собой водород, -C1-4алкил, -C1-4алкокси, -C(=O)H, -C(=O)-C1-4алкил, -CO2H, -CO2-C1-4алкил, -NH2, -NH-C1-4алкил, -N(C1-4алкил)2, галоген, гидрокси, нитро или оксо, если присоединен к атому углерода. Еще один дополнительный аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R10 представляет собой водород. Аспекты настоящего изобретения включают в себя соединения формулы (I) и формулы (II), где R2 представляет собой водород, -C1-4алкил(R7), -C2-4алкенил(R7), -C2-4алкинил(R7), -циклоалкил(R8), -гетероциклил(R8), -арил(R8) или -гетероарил(R8). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R2 представляет собой водород, -циклоалкил(R8), -гетероциклил(R8), -арил(R8) или -гетероарил(R8). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R2 представляет собой водород, -циклоалкил(R8), -гетероциклил(R8), -фенил(R8), -нафталенил(R8) или -гетероарил(R8). Еще один аспект настоящего изобретения включает в себя соединения формулы (I) и формулы (II), где R2 представляет собой водород, -тетрагидропиримидинил(R8), -1,3-бензодиоксолил(R8), -дигидробензофуранил(R8), -тетрагидрохинолинил (R8), -фенил(R8), -нафталенил(R8), -пиридинил(R8), -пиримидинил(R8) или -хинолинил(R8). Аспекты настоящего изобретения включают в себя композицию, содержащую соединение формулы (I) и формулы (II), где q равно 1, 2 или 3. Аспекты настоящего изобретения включают в себя композицию, содержащую соединение формулы (1) и формулы (II), где Z выбран из группы, состоящей из гидрокси, -NH2, -NH-C1-8алкила, -N(C1-8алкил)2, -O-C1-8алкила, -O-C1-8алкил-OH, -O-C1-8алкилC1-4алкокси, -O-C1-8алкилкарбонилC1-4алкила, -O-C1-8алкил-CO2H, -O-C1-8алкил-C(O)O-C1-6алкила, -O-C1-8алкил-O-C(O)C1-8алкила, -O-C1-8алкил-NH2, -O-C1-8алкил-NH-C1-8алкила, -O-C1-8алкил-N(C1-8алкил)2, -O-C1-8алкиламида-O-C1-8алкил-C(O)-NH-C1-8алкила, -O-C1-8алкил-C(O)-N(C1-8алкил)2 и -NHC(O)C1-8алкила. Аспекты настоящего изобретения включают в себя композицию, содержащую соединение формулы (I) Формула (I) где соединение выбрано из группы, состоящей из:
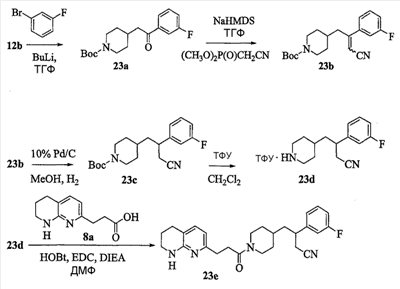
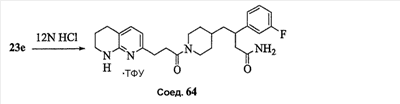
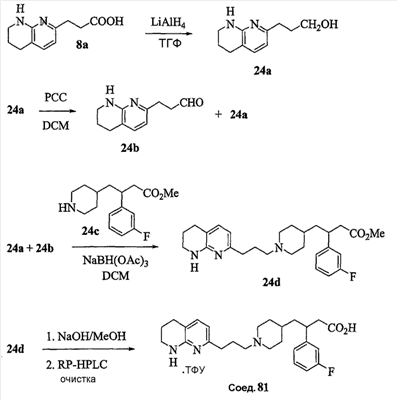
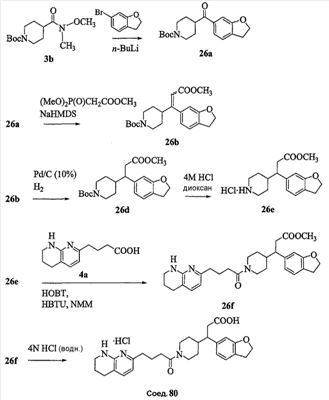
Аспекты настоящего изобретения включают в себя композицию, включающую соединение формулы (II) Формула (II) где W, R1, R2, q и Z такие, как было определено до этого, и предпочтительно представляют собой
Аспекты настоящего изобретения включают в себя композицию, содержащую соединение формулы (I), где соединение выбрано из группы, состоящей из соединения формулы (I), где W представляет собой -CH2-Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидропиримидин-2-ил; R2 представляет собой H, q равно 0 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидропиримидин-2-ил; R2 представляет собой H, q равно 0 и Z представляет собой OH; соединения формулы (I), где W представляет собой -CH2-Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-OH-пиримидин-2-ил; R2 представляет собой -3-хинолинил, q равно 0 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 0, и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 0 и Z представляет собой OH; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидропиримидин-2-ил; R2 представляет собой -3-пиридинил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-OH-пиримидин-2-ил; R2 представляет собой -3-пиридинил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-OH-пиримидин-2-ил; R2 представляет собой -(6-MeO)пиридин-3-ил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидропиримидин-2-ил; R2 представляет собой -3-хинолинил, q равно 2 и Z представляет собой OH; соединения формулы (1), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0 и Z представляет собой OH; соединения формулы (I), где W представляет собой -CH2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0 и Z представляет собой OH; соединения формулы (I) где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-MeO) пиридин-3-ил, q равно 0 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,4,5,6-тетрагидро-2-Me-пиримидин-5-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-MeO)пиридин-3-ил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -(6-MeO)пиридин-3-ил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-OH-2-пиримидинил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-MeO)пиридин-3-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(4-F)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(4-F)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-Me)пиримидин-5-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,3-дигидробензофуран-6-ил, q равно 1 и Z представляет собой OH; соединения формулы (1), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3,5-F2)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3,5-F2)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-CF3)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(4-OCF3)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2, представляет собой -(3-F-4-Ph)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F-4-OMe)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(4-OPh)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -4-изохинолинил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -5-дигидробензофуранил, q равно 1 и Z представляет собой OH; соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,4-(OMe)2-пиримид-5-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-OMe)пиримидин-5-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-OH-пиримидин-2-ил; R2 представляет собой -3-хинолинил, q равно 2 и Z представляет собой OH; соединения формулы (1), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-3,4,5,6-тетрагидропиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-3,4,5,6-тетрагидропиримидин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-3,4,5,6-тетрагидропиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2 и Z представляет собой OH; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-OH-пиримидин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2 и Z представляет собой OH; соединение формулы (I), где W представляет собой -CH2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2 и Z представляет собой OH и соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2-нафталенил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя композицию, содержащую соединение формулы (I), где соединение выбрано из группы, состоящей из: соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 0 и Z представляет собой OH; соединения формулы (1), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1, 3-бензодиоксол-5-ил, q равно 0 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-MeO)пиридин-3-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F)Ph, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-Me)пиримидин-5-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,3-дигидробензофуран-6-ил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -4-изохинолинил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 1 и Z представляет собой OH; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,4-(OMe)2-пиримид-5-ил, q равно 1 и Z представляет собой OH; и соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-OMe)пиримидин-5-ил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 0 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-MeO)пиридин-3-ил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F)Ph, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-Me)пиримидин-5-ил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,3-дигидробензофуран-6-ил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -4-изохинолинил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,4-(OMe)2-пиримид-5-ил, q равно 1 и Z представляет собой OH. Еще один аспект настоящего изобретения включает в себя соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-OMe)пиримидин-5-ил, q равно 1 и Z представляет собой OH. Аспекты настоящего изобретения включают в себя соединение формулы (I): Формула (I) где W, R1, R2, R6, R8, R9, q и Z такие, как определено до этого; и, предпочтительно, где W представляет собой -C0-4алкил(R1) или -C0-4алкилфенил(R1,R8); R1 представляет собой -NH(R6); R2 представляет собой водород, -тетрагидропиримидинил(R8), -1,3-бензодиоксолил(R8), -дигидробензофуранил(R8), -тетрагидрохинолинил(R8), -фенил(R8), -нафталенил(R9), -пиридинил(R8), -пиримидинил(R8) или -хинолинил(R8); R6 представляет собой -дигидроимидазолил(R8), -тетрагидропиридинил(R8), -тетрагидропиримидинил(R8) или -пиридинил(R8); R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода или -C1-4алкил(R9), если присоединен к атому азота; и где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкил(R9), -C1-4алкокси(R9), -O-арил(R10) или гидрокси, если присоединен к атому углерода; R9 представляет собой водород, -C1-4алкокси, -NH2, -NH-C1-4алкил, -N(C1-4алкил)2, (галоген)1-3 или гидрокси; и q равно 1,2 или 3; Z выбран из группы, состоящей из гидрокси, -NH2, -NH-C1-8алкила, -N(C1-8алкил)2, -O-C1-8алкила, -O-C1-8алкил-OH, -O-C1-8алкилC1-8алкокси, -O-C1-8алкилкарбонилC1-8алкила, -O-C1-8алкил-CO2H, -O-C1-8алкил-C(O)O-C1-8алкила, -O-C1-8алкил-O-C(O)C1-8алкила, -O-C1-8алкил-NH2, -O-C1-8алкил-NH-C1-8алкила, -O-C1-8алкил-N(C1-8алкил)2, -O-C1-8алкиламида, -O-C1-8алкил-C(O)-NH-C1-8алкила, -O-С1-8алкил-C(O)-N(C1-8алкил)2 и -NHC(O)C1-8алкила; и его фармацевтически приемлемые соли, рацемические смеси и энантиомеры. Аспекты настоящего изобретения включают в себя соединение формулы (I), где соединение представляет собой соединение формулы (I.2): Формула (I.2) где W, R1, R6, R8, R9, q и Z такие, как определено до этого; и, предпочтительно, где W представляет собой -C0-4алкил(R1) или -C0-4алкил-фенил(R1,R8); R1 представляет собой -NH(R6), -дигидро-1H-пирроло[2,3-b]пиридинил(R8), -тетрагидропиримидинил(R8), -тетрагидро-1,8-нафтиридинил(R8), -тетрагидро-1H-азепино[2,3-b]пиридинил(R8) или -пиридинил (R8); R6 представляет собой -дигидроимидазолил(R8), -тетрагидропиридинил(R8), -тетрагидропиримидинил(R8) или -пиридинил(R8); R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода или -C1-4алкил(R9), если присоединен к атому азота; и где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкил(R9), -C1-4алкокси(R9), -O-арил(R10) или гидрокси, если присоединен к атому углерода; R9 представляет собой водород, -C1-4алкокси, -NH2, -NH-C1-4алкил, -N(C1-4алкил)2, (галоген)1-3 или гидрокси; и q равно 1, 2 или 3; Z выбран из группы, состоящей из гидрокси, -NH2, -NH-C1-8алкила, -N(C1-8алкил)2, -O-C1-8алкила, -O-C1-8алкил-OH, -O-C1-8алкилC1-8алкокси, -O-C1-8алкилкарбонилC1-8алкил, -O-C1-8алкил-CO2H, -O-C1-8алкил-C(O)O-C1-8алкил, -O-C1-8алкил-O-C(O)C1-8алкил, -O-C1-8алкил-NH2, -O-C1-8алкил-NH-C1-8алкил, -O-C1-8алкил-N(C1-8алкил)2, -O-C1-8алкиламид, -O-C1-8алкил-C(O)-NH-C1-8алкил, -O-C1-8алкил-C(O)-N(C1-8алкил)2 и -NHC(O)C1-8алкил; и его фармацевтически приемлемые соли, рацемические смеси и энантиомеры. Еще один аспект настоящего изобретения включает в себя соединения формулы (I.2), где R1 представляет собой -NH(R6), -тетрагидропиримидинил(R8) или -тетрагидро-1,8-нафтиридинил(R8) и все другие варианты, определенные до этого. Аспекты настоящего изобретения включают в себя соединение формулы (I), где соединение представляет собой соединение формулы (I.3): Формула (I.3) где W, R1, R2, R6, R8, R9 и Z такие, как определено до этого; и, предпочтительно, где W представляет собой -C0-4алкил(R1) или -C0-4алкилфенил(R1,R8); R1 представляет собой -NH(R6), -дигидро-1H-пирроло[2,3-b]пиридинил(R8), -тетрагидропиримидинил(R8), -тетрагидро-1,8-нафтиридинил(R8), -тетрагидро-1H-азепино[2,3-b]пиридинил(R8) или -пиридинил(R8); R2 представляет собой водород, -тетрагидропиримидинил(R8), -1,3-бензодиоксолил(R8), -дигидробензофуранил(R8), -тетрагидрохинолинил(R8), -фенил(R8), -нафталенил(R8), -пиридинил(R8), -пиримидинил(R8) или -хинолинил(R8); R6 представляет собой -дигидроимидазолил(R8), -тетрагидропиридинил(R8), -тетрагидропиримидинил(R8) или -пиридинил(R8); R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода или -C1-4алкил(R9), если присоединен к атому азота; и где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -C1-4алкил(R9), -C1-4алкокси(R9), -O-арил(R10) или гидрокси, если присоединен к атому углерода; и R9 представляет собой водород, -C1-4алкокси, -NH2, -NH-C1-4алкил, -N(C1-4алкил)2, (галоген)1-3 или гидрокси; Z выбран из группы, состоящей из гидрокси, -NH2, -NH-C1-8алкила, -N(C1-8алкил)2, -O-C1-8алкила, -O-C1-8алкил-OH, -O-C1-8алкилC1-8алкокси, -O-C1-8алкилкарбонилC1-8алкила, -O-C1-8алкил-CO2H, -O-C1-8алкил-C(O)O-C1-8алкила, -O-C1-8алкил-O-C(O)C1-8алкила, -O-C1-8алкил-NH2, -O-C1-8алкил-NH-C1-8алкила, -O-C1-8алкил-N(C1-8алкил)2, -O-C1-8алкиламида, -O-C1-8алкил-C(O)O-NH-C1-8алкил, -O-C1-8алкил-C(O)-N(C1-8алкил)2 и -NHC(O)C1-8алкила; и его фармацевтически приемлемые соли, рацемические смеси и энантиомеры. Еще один аспект настоящего изобретения включает в себя соединения формулы (I.3), где R1 представляет собой -NH(R6), -тетрагидропиримидинил(R8) или -тетрагидро-1,8-нафтиридинил(R8) и все другие варианты, как определено до этого. Аспекты настоящего изобретения включают в себя соединение формулы (I), где соединение представляет собой соединение формулы (I.4): Формула (I.4) где R2 и Z такие, как определено до этого; и, кроме того, R2 выбран из группы, состоящей из -2-бензофуранила, -3-бензофуранила, -4-бензофуранила, -5-бензофуранила, -6-бензофуранила, -7-бензофуранила, -бензо[b]тиен-2-ила, -бензо[b]тиен-3-ила, -бензо[b]тиен-4-ила, -бензо[b]тиен-5-ила, -бензо[b]тиен-6-ила, -бензо[b]тиен-7-ила, -1Н-индол-2-ила, -1H-индол-3-ила, -1H-индол-4-ила, -1H-индол-5-ила, -1H-индол-6-ила, -1H-индол-7-ила, -2-бензоксазолила, -4-бензоксазолила, -5-бензоксазолила, -6-бензоксазолила, -7-бензоксазолила, -2-бензотиазолила, -3-бензотиазолила, -4-бензотиазолила, -5-бензотиазолила, -6-бензотиазолила, -7-бензотиазолила, -1H-бензимидазолил-2-ила, -1H-бензимидазолил-4-ила, -1H-бензимидазолил-5-ила, -1H-бензимидазолил-6-ила, -1H-бензимидазолил-7-ила, -2-хинолинила, -3-хинолинила, -4-хинолинила, -5-хинолинила, -6-хинолинила, -7-хинолинила, -8-хинолинила, -2H-1-бензопиран-2-ила, -2H-1-бензопиран-3-ила, -2H-1-бензопиран-4-ила, -2H-1-бензопиран-5-ила, -2H-1-бензопиран-6-ила, -2H-1-бензопиран-7-ила, -2H-1-бензопиран-8-ил,-4H-1-бензопиран-2-ила, -4H-1-бензопиран-3-ила, -4H-1-бензопиран-4-ила, -4H-1-бензопиран-5-ила, -4H-1-бензопиран-6-ила, -4H-1-бензопиран-7-ила, -4H-1-бензопиран-8-ила, -1H-2-бензопиран-1-ила, -1H-2-бензопиран-3-ила, -1H-2-бензопиран-3-ила, -1H-2-бензопиран-5-ила, -1H-2-бензопиран-6-ила, -1H-2-бензопиран-7-ила, -1H-2-бензопиран-8-ила, -1,2,3,4-тетрагидро-1-нафталенила, -1,2,3,4-тетрагидро-2-нафталенила, -1,2,3,4-тетрагидро-5-нафталенила, -1,2,3,4-тетрагидро-6-нафталенила, -2,3-дигидро-2-бензофуранила, -2,3-дигидро-3-бензофуранила, -2,3-дигидро-4-бензофуранила, -2,3-дигидро-5-бензофуранила, -2,3-дигидро-6-бензофуранила, -2,3-дигидро-7-бензофуранила, -2,3-дигидробензо[b]тиен-2-ила, -2,3-дигидробензо[b]тиен-3-ила, -2,3-дигидробензо[b]тиен-4-ила, -2,3-дигидробензо[b]тиен-5-ила, -2,3-дигидробензо[b]тиен-6-ила, -2,3-дигидробензо[b]тиен-7-ила, -2,3-дигидро-1H-индол-2-ила, -2,3-дигидро-1H-индол-3-ила, -2,3-дигидро-1H-индол-4-ила, -2,3-дигидро-1H-индол-5-ила, -2,3-дигидро-1H-индол-6-ила, -2,3-дигидро-1H-индол-7-ила, -2,3-дигидро-2-бензоксазолила, -2,3-дигидро-4-бензоксазолила, -2,3-дигидро-5-бензоксазолила, -2,3-дигидро-6-бензоксазолила, -2,3-дигидро-7-бензоксазолила, -2,3-дигидро-1H-бензимидазол-2-ила, -2,3-дигидро-1H-бензимидазол-4-ила, -2,3-дигидро-1H-бензимидазол-5-ила, -2,3-дигидро-1H-бензимидазол-6-ила, -2,3-дигидро-1H-бензимидазол-7-ила, -3,4-дигидро-1(2H)-хинолинила, -1,2,3,4-тетрагидро-2-хинолинила, -1,2,3,4-тетрагидро-3-хинолинила, -1,2,3,4-тетрагидро-4-хинолинила, -1,2,3,4-тетрагидро-5-хинолинила, -1,2,3,4-тетрагидро-6-хинолинила, -1,2,3,4-тетрагидро-7-хинолинила, -1,2,3,4-тетрагидро-8-хинолинила, -3,4-дигидро-2H-1-бензопиран-2-ила, -3,4-дигидро-2H-1-бензопиран-3-ила, -3,4-дигидро-2H-1-бензопиран-4-ила, -3,4-дигидро-2H-1-бензопиран-5-ила, -3,4-дигидро-2H-1-бензопиран-6-ила, -3,4-дигидро-2H-1-бензопиран-7-ила, -3,4-дигидро-2H-1-бензопиран-8-ила, -3,4-дигидро-4H-1-бензопиран-2-ила, -3,4-дигидро-4H-1-бензопиран-3-ила, -3,4-дигидро-4H-1-бензопиран-4-ила, -3,4-дигидро-4H-1-бензопиран-5-ила, -3,4-дигидро-4H-1-бензопиран-6-ила, -3,4-дигидро-4H-1-бензопиран-7-ила, -3,4-дигидро-4H-1-бензопиран-8-ила, -3,4-дигидро-1H-2-бензопиран-2-ила, -3,4-дигидро-1H-2-бензопиран-3-ила, -3,4-дигидро-1H-2-бензопиран-4-ила, -3,4-дигидро-1H-2-бензопиран-5-ила, -3,4-дигидро-1H-2-бензопиран-6-ила, -3,4-дигидро-1H-2-бензопиран-7-ила и -3,4-дигидро-1H-2-бензопиран-8-ила, необязательно замещенные, если есть доступные валентности, до 7 заместителями, независимо выбранными из метила, если присоединен к атому азота; и, независимо выбраны из метила, метокси или фтора, если присоединен к атому углерода; Z выбран из группы, состоящей из гидрокси, -NH2, -NH-C1-8алкила, -N(C1-8алкил)2, -O-C1-8алкила, -O-C1-8алкил-OH, -O-C1-8алкилC1-8алкокси, -O-C1-8алкилкарбонилC1-8алкила, -O-C1-8алкил-CO2H, -O-C1-8алкил-C(O)O-C1-8алкила, -O-C1-8алкил-O-C(O)C1-8алкила, -O-C1-8алкил-NH2, -O-C1-8алкил-NH-C1-8алкила, -O-C1-8алкил-N(C1-8алкил)2, -O-C1-8алкиламида, -O-C1-8алкил-C(O)-NH-C1-8алкила, -O-C1-8алкил-C(O)-N(C1-8алкил)2 и -NHC(O)C1-8алкила; его фармацевтически приемлемые соли, рацемические смеси и энантиомеры. Соединения по настоящему изобретению также могут быть представлены в виде фармацевтически приемлемых солей. Для применения в медицине соли композиций по данному изобретению относятся к нетоксическим «фармацевтически приемлемым солям» (Ref. International J.Pharm., 1986, 33, 201-217; J. Pharm.Sci., 1977 (Jan), 66, 1, 1). Для получения соединения по данному изобретению или его фармацевтически приемлемых солей, тем не менее, могут использоваться другие соли. Характерные примеры органических или неорганических кислот включают в себя, но ими не ограничиваются, хлористоводородную, бромистоводородную, йодистоводородную, перхлорную, серную, азотную, фосфорную, уксусную, пропионовую, гликолевую, молочную, янтарную, малеиновую, фумаровую, яблочную, винную, лимонную, бензойную, миндальную, метансульфоновую, гидроксиэтансульфоновую, бензолсульфоновую, щавелевую, памовую, 2-нафталенсульфоновую, п-толуолсульфоновую, циклогексансульфаминовую, салициловую, сахариновую или трифторуксусную кислоту. Характерные примеры органического или неорганического основания включают в себя, но ими не ограничиваются, основные или катионные соли, такие как бензатин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин, прокаин, алюминий, кальций, литий, магний, калий, натрий и цинк. В объем настоящего изобретения входят пролекарства соединений по данному изобретению. Обычно такие пролекарства могут быть функциональными производными соединений, которые легко преобразуются in vivo в требуемое соединение. Таким образом, в способах лечения по настоящему изобретению под термином «введение» понимают лечение описанных здесь различных заболеваний с помощью конкретно описанного соединения или с помощью соединения, которое может быть специально не описано, но которое после введения субъекту in vivo преобразуется в описанное соединение. Стандартные процедуры селекции и получения подходящих производных пролекарств описаны, например, в «Design of Prodrugs», ed. H. Bundgaard, Elsevier, 1985. Поскольку соединения по данному изобретению содержат, по крайней мере, один хиральный центр, то они могут существовать в виде энантиомеров. Так как соединения имеют два или более хиральных центра, то они могут дополнительно существовать в виде диастереомеров. Так как в процессах получения соединений по данному изобретению образуются смеси стереоизомеров, эти изомеры могут быть разделены обычными способами, такими как препаративная хроматография. Соединения могут быть получены в рацемическом виде или в виде отдельных энантиомеров или диастереомеров путем либо стереоспецифического синтеза, либо растворения. Соединения могут быть разделены на энантиомеры или диастереомеры обычными способами. Понятно, что все их стереоизомеры, рацемические смеси, диастереомеры и энантиомеры входят в рамки настоящего изобретения. В процессе любого способа получения соединений по настоящему изобретения может быть необходимо и/или желательно защитить чувствительные или реакционноспособные группы на любой интересующей молекуле. Это может быть достигнуто с помощью любых обычных защитных групп, таких как защитные группы, описанные в Protective Groups in Organic Chemistry, ed. J. F. W. McOmie, Plenum Press, 1973; и T. W. Greene & P. G. M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991. Защитные группы могут быть удалены на подходящей более поздней стадии, используя способы, известные в данной области. Более того, некоторые кристаллические формы соединений могут существовать в виде полиморфов и по существу входят в объем настоящего изобретения. Кроме того, некоторые соединения могут образовывать сольваты с водой (то есть гидраты) или обычными органическими растворителями и такие сольваты также входят в рамки данного изобретения. Как используется здесь, нижеследующие выделенные термины имеют следующие обозначения. Термин «Cа-b» (где a и b являются целыми числами, относящимися к обозначенному числу атомов углерода) относится к алкильному, алкенильному, алкинильному, алкокси или циклоалкильному радикалу или к алкильной части радикала, в котором у алкила указан нижний индекс, указывающий на содержание от а до b атомов углерода включительно. Например, C1-3 обозначает радикал, содержащий 1, 2 или 3 атома углерода. Термин «алкил» относится к необязательно замещенным насыщенным или частично ненасыщенным, разветвленным, с прямой цепью или циклическим моновалентным углеводородным радикалам, полученным путем удаления одного атома водорода от единичного атома углерода алкановой молекулы с образованием, таким образом, места присоединения. Термин «алкенил» относится к необязательно замещенному частично ненасыщенному разветвленному или с прямой цепью моновалентному углеводородному радикалу, содержащему, по крайней мере, одну двойную связь углерод-углерод, и полученную путем удаления одного атома водорода от единичного атома углерода молекулы алкена с образованием, таким образом, места присоединения. Радикал возле двойной(ых) связи(ей) может быть либо в цис-, либо в транс-конформации. Термин «алкинил» относится к необязательно замещенному частично ненасыщенному разветвленному или с прямой цепью моновалентному радикалу, содержащему, по крайней мере, одну тройную связь углерод-углерод и полученную путем удаления атома водорода от единичного атома углерода алкиновой молекулы с образованием, таким образом, места присоединения. Термин «алкокси» относится к необязательно замещенному насыщенному или частично ненасыщенному, разветвленному, с прямой цепью моновалентному углеводородному радикалу, полученному путем удалении атома водорода от единичного атома кислорода молекулы алкана, алкена или алкина с образованием, таким образом, места присоединения. Алкильный, алкенильный, алкинильный или алкоксирадикал необязательно замещены на самом радикале или на концевом атоме углерода (цепи) таким количеством заместителей, которое удовлетворяет доступным для насыщения валентностям. Термин «C1-8алкил(Rx)» (где x является целым числом, относящимся к обозначенной замещающей группе) относится к Rx замещающей группе, которая может замещена на алкильной цепи, на концевом атоме углерода и может быть также замещена на алкенильном, алкинильном или алкокси-радикале обозначенным количеством заместителей, которое удовлетворяет доступным для насыщения валентностям. Термин «-C0-8алкил(Rx)» относится к Rx замещающей группе, которая также может быть непосредственно замещена на месте присоединения без алкильной связывающей группы (где C0 является структурным нулем для Rx заместителя с прямой связью к месту присоединения). Термин «циклоалкил» относится к насыщенному или частично ненасыщенному циклическому моновалентному углеводородному радикалу, согласующемуся с определениями алкила, алканила, алкенила и алкинила. В частности, к определению циклоалкил относятся конденсированные полициклические кольцевые системы, в которых одно или несколько колец являются ароматическими и одно или несколько колец являются ненасыщенными или частично насыщенными (понятно, что радикал может также находиться на ароматическом кольце). Например, циклоалкильные группы являются насыщенными или частично ненасыщенными или моноциклическими алкильными радикалами, содержащими от 3-8 атомов углерода (полученный из молекул, таких как циклопропан, циклобутан, циклопентан, циклогексан или циклопентан); насыщенными или частично ненасыщенными конденсированными или бензоконденсированными циклическими алкильными радикалами, содержащими от 9 до 12 атомов углерода; или насыщенными или частично ненасыщенными конденсированными или бензоконденсированными трициклическими или полициклическими алкильными радикалами, содержащими от 13 до 20 атомов углерода. Термин «гетероциклил» относится к насыщенному или частично ненасыщенному циклическому алкильному радикалу, в котором один или несколько атомов углерода независимо замещены одинаковым или различным гетероатомом. В частности, к определению гетероциклил относятся конденсированные полициклические кольцевые системы, в котором одно или несколько колец являются ароматическими и одно или несколько колец являются насыщенными или частично ненасыщенными (понятно, что радикал также может находится на ароматическом кольце). Типичные гетероатомы, замещающие атом(ы), углерода включают в себя, но ими не ограничиваются, N, O, S и тому подобное. Например, гетероциклильная группа является насыщенным или частично ненасыщенным пятичленным моноциклическим алкильным кольцом, в котором, по крайней мере, один член замещен на атом N, O или S, и который, необязательно, содержит один дополнительный атом O, замещающий дополнительный член алкильного кольца, или один дополнительный атом N, замещающий член алкильного кольца; насыщенным или частично ненасыщенным шести-членным моноциклическим алкильным кольцом, в котором один, два или три члена алкильного кольца замещены на атом N и, необязательно, один член алкильного кольца замещен на атом O или S, или два члена алкильного кольца замещены на атомы O или S; насыщенным или частично ненасыщенным 5-6-членным гетероциклическим кольцом, как определено ранее, конденсированным с гетероарилом, как определено ранее; насыщенным, частично ненасыщенным или бензоконденсированным девяти- или десятичленным бициклическим алкилом, где, по крайней мере, один член кольца замещен на атом N, O или S, и в котором необязательно один или два дополнительных члена бициклического алкила замещены на атомы N, O или S; или насыщенным, частично ненасыщенным или бензоконденсированным 11-20-членным полициклическим алкилом, в котором, по крайней мере, один член замещен на атом N, O или S, и в котором, необязательно, один, два или три дополнительных члена полициклического алкила замещены на атомы N. Примеры насыщенных или частично ненасыщенных гетероциклильных радикалов включают в себя, но ими не ограничиваются, 2-пирролинил, 3-пирролинил, пирролидинил, 1,3-диоксаланил, 2-имидазолинил, имидазолидинил, дигидроимидазолил, 2-пиразолинил, пиразолидинил, пиперидинил, морфолинил, тетрагидропиримидинил, пиперазинил, дигидро-1H-пирроло[2,3-b]пиридинил, тетрагидро-1,8-нафтиридинил, тетрагидро-1H-азепино[2,3-b]пиридинил, 1,3-бензодиоксол-5-ил, 1,2,3,4-тетрагидро-3-хинолинил или дигидробензофуранил. Термин «арил» относится к моновалентному ароматическому углеводородному радикалу, полученному путем удаления одного атома водорода от единичного атома углерода ароматической кольцевой системы, с получением, таким образом, места присоединения радикала. Например, арильная группа получена из ненасыщенной ароматической моноциклической кольцевой системы, содержащей 5 или 6 атомов углерода (например, фенил, полученный из бензола); ненасыщенной ароматической бициклической кольцевой системы, содержащей 9 или 10 атомов углерода (например, нафтил, полученный из нафталина); или ненасыщенной ароматической трициклической кольцевой системы, содержащей 13 или 14 атомов углерода (например, антраценил, полученный из антрацена). Термин «ароматическая кольцевая система» относится к ненасыщенной циклической или полициклической кольцевой системе, содержащей «ароматическую» конъюгированную Термин «гетероарил» относится к моновалентному гетероароматическому радикалу, полученному путем удаления одного атома водорода из единичного атома гетероароматической кольцевой системы, с получением, таким образом, места присоединения радикала. Термин «гетероароматическая кольцевая система» относится к ароматической кольцевой системе, в которой один или несколько атомов углерода независимо замещен гетероатомом. Типичные гетероатомы, замещающие атомы углерода, включают в себя, но ими не ограничиваются, N, O, S и тому подобное. В частности, к определению гетероароматическая кольцевая система относятся конденсированные кольцевые системы, в которых один или несколько колец являются насыщенными или частично ненасыщенными. Например, гетероарильная группа получена из гетероароматической моноциклической кольцевой системы, содержащей пять членов, из которых, по крайней мере, один член представляет собой атом N, O или S, и которая необязательно содержит один, два или три дополнительных атома N; гетероароматической моноциклической кольцевой системы, содержащей шесть членов, из которых один, два или три члена являются атомом N; гетероароматической конденсированной бициклической кольцевой системы, содержащей девять членов, из которых, по крайней мере, один член является атомом N, O или S, и которая необязательно содержит один, два или три дополнительных атома N; гетероароматической конденсированной бициклической кольцевой системы, содержащей десять членов, из которых один, два или три члена являются атомами N; гетероароматической конденсированной трициклической кольцевой системы, содержащей 13 или 14 членов, из которых, по крайней мере, один член является атомом N, O или S, и которая необязательно содержит один, два или три дополнительных атома N; или гетероароматической конденсированной полициклической кольцевой системы, содержащей от 15 до 20 членов, из которых, по крайней мере, один член представляет собой атом N, O или S, и которая необязательно содержат один, два или три дополнительных атома N. Типичные гетероарилы включают в себя, но ими не ограничиваются, циннолинил, фуранил, имидазолил, индазолил, индолил, индолинил, индолизинил, изобензофуранил, изохинолинил, изотиазолил, изоксазолил, нафтиридинил, оксазолил, фенантридинил, фенантролинил, пуринил, пиранил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетразол, тиадиазол, тиазол, тиофен, триазол и тому подобное. Термин «независимо» обозначает, что если группа замещена более чем одним заместителем, то заместители могут быть одинаковыми или различными. Термин «зависимо» обозначает, что заместители заданы в указанном сочетании структурных вариантов. По стандартным номенклатурным правилам, используемым в этом описании, сначала описывается концевая часть обозначенной боковой цепи, а затем расположенная рядом функциональная группа относительно места присоединения. Таким образом, например, заместитель «фенилC1-6алкиламидоC1-6алкил» относится к группе формулы: Место присоединения заместителя также может быть обозначено пунктирной линией для обозначения мест(а) присоединения с последующей расположенной рядом функциональной группой и заканчивающейся концевой функциональной группой, такой как, например, _-(C1-6)алкил-карбонил-NH-(C1-6)алкил-фенил. Подразумевается, что определение любого заместителя или переменных в определенном положении молекулы не зависит от их определений в другом месте этой молекулы. Понятно, что заместители и характер замещения соединений по данному изобретению могут быть выбраны специалистом в данной области с получением соединений, которые являются химически стабильными и которые могут быть легко синтезированы методами, хорошо известными в данной области, а также способами, приведенными здесь. Интегрины представляют собой широко экспрессируемое семейство кальций- или магний-зависимых Например, субсемейство Антагонисты интегрина были типично сконструированы в соответствии с биоактивной аргинин-глицин-аспартатной (RGD) структурой пептидов, полученной из первичного лиганда витронектина. Мотив RGD является основной последовательностью клеточного присоединения большого количества белков экстрацеллюлярного матрикса, крови и клеточной поверхности, так, например, половина приблизительно 20 известных интегринов связывает RGD-содержащие адгезивные лиганды. Для того чтобы найти пептиды RGD, обладающие селективностью к интегринам, были изучены пептиды как с ограниченными конфирмациями, так и с различными вариантами фланкирующих остатков. В частности, были описаны структурные требования для взаимодействия последовательности RGD с GPIIb/IIIa и ингибиторная функция ряда непептидных миметиков на агрегацию тромбоцитов и взаимодействия с экстрацеллюлярным матриксом (D. Varon, et al., Thromb. Haemostasis, 1993, 70 (6), 1030-1036). Итеративный синтез циклических и алициклических пептидов и компьютерное моделирование дало эффективные селективные средства в качестве основания для конструирования непептидного антагониста интегрина Полагают, что антагонисты интегрина являются эффективными для ингибирования резорбции кости (S. B. Rodan and G. A. Rodan, Integrin Function In Osteoclasts, Journal of Endocrinology, 1997, 154: S47-S56). У позвоночных резорбция кости вызвана активностью клеток, называемых остеокласты, больших многоядерных клеток до приблизительно 400 мм в диаметре, которые резорбируют минерализованную ткань, главным образом карбонат кальция и фосфат кальция. Остеокласты являются активными подвижными клетками, которые мигрируют по поверхности кости и могут связываться с костью, секретируют необходимые кислоты и протеазы, таким образом, вызывая фактическую резорбцию минерализованной ткани из кости. Более конкретно, остеокласты, вероятно, находятся, по крайней мере, в двух физиологических состояниях, а именно в секреторном состоянии и мигрирующем или подвижном состоянии. В секреторном состоянии остеокласты являются плоскими, присоединяются к костному матриксу через узкую зону присоединения (уплотняющаяся зона), становятся высокополяризованными, образуют ребристую границу и секретируют лизосомальные ферменты и протоны для резорбции кости. Адгезия остеокластов на поверхность кости является важнейшей начальной стадией костной резорбции. В мигрирующем или подвижном состоянии остеокласты мигрируют через костный матрикс и не принимают участия в резорбции до тех пор, пока они снова не присоединяться к кости. Интегрины вовлечены в присоединение, активацию и мигрирование остеокластов. Наибольшее количество интегриновых рецепторов на остеокластах (например, на остеокластах крыс, цыплят, мышей и людей) составляют интегриновые рецепторы В настоящее время основными заболеваниями костей, которые вызывают озабоченность населения, являются остеопороз, гиперкальцемия злокачественных новообразований, остеопения в результате метастазов в кости, периодонтальное заболевание, гиперпаратироидизм, околосуставные поражения при ревматоидном артрите, болезнь Педжета, остеопения, вызванная уменьшением подвижности, и остеопороз, вызванный глюкокортикоидами. Все эти состояния характеризуются потерей костной массы, что приводит к дисбалансу резорбции кости, то есть нарушению и образованию кости, которая продолжается на протяжении всей жизни со скоростью в среднем приблизительно 14% в год. Однако скорость метаболизма кости различается в зависимости от местоположения; например, она выше в трабекулярной кости позвоночника и альвеолярной кости челюстей по сравнению с кортикальными слоями длинных трубчатых костей. Возможность потери костной массы непосредственно связана с метаболизмом и может составлять свыше 5% в год в позвоночнике непосредственно после менопаузы, состояния, которое приводит к повышению риска перелома. В настоящее время в Соединенных Штатах у людей с обнаруживаемыми переломами позвоночника приблизительно в 20 миллионах случаев причиной является остеопороз. Кроме того, ежегодно 250000 случаев перелома бедра связывают с остеопорозом. Эта клиническая обстановка соответствует 12% коэффициенту смертности на протяжении первых двух лет, тогда как 30% пациентам после перелома требуется медицинская помощью на дому. Лечение средствами, которые ингибируют резорбцию кости, могло быть полезным для людей, страдающих одним из перечисленных выше состояний. Кроме того, было обнаружено, что лиганды Помимо того, полагают, что рост опухолей зависит от достаточного кровоснабжения, которое, в свою очередь, зависит от роста сосудов в опухоли; таким образом, ингибирование ангиогенеза может вызвать регрессию опухоли на моделях животных (Harrison’s Principles of Internal Medicine, 1991, 12-ое издание). Следовательно, антагонисты Ингибирование рецептора интегрина Ингибирование рецепторов интегрина Антагонист интегрина Один из аспектов настоящего изобретения относится к композиции или лекарственному средству, содержащему фармацевтически приемлемый носитель и любое соединение по настоящему изобретению. Иллюстративным примером настоящего изобретения является композиция или лекарственный препарат, полученный путем смешивания данного соединения и фармацевтически приемлемого носителя. Еще одним иллюстративным примером настоящего изобретения является способ получения композиции или лекарственного препарата, содержащего смесь любого соединения, описанного здесь, и фармацевтически приемлемый носитель. Дополнительным иллюстративным примером по настоящему изобретению являются композиции или лекарственные препараты, содержащие одно или несколько соединений по настоящему изобретению в объединении с фармацевтически приемлемым носителем. Как используется здесь, термин «композиция» включает в себя продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, полученный, непосредственно или косвенно, в результате объединения определенных ингредиентов в определенных количествах для лечения или улучшения заболевания, опосредованного интегрином Соединения по настоящему изобретению представляют собой ингибиторы интегрина Один из аспектов по настоящему изобретению относится к способу лечения или облегчения заболевания, опосредованного интегрином Термин «терапевтически эффективное количество» или «эффективное количество», как используется здесь, обозначает, то количество активного соединения или фармацевтического средства, определенное исследователем, ветеринаром, врачом или другим практикующим врачом, которое вызывает биологическую или лекарственную реакцию в системе тканей, животного или человека, включающую в себя уменьшение симптомов заболевания или расстройства, на которое направлено лечение. Один из аспектов настоящего изобретения относится к профилактическому способу для предотвращения заболевания, опосредованного интегрином Еще один аспект настоящего изобретения относится к препарату лекарственного средства, который содержит терапевтически эффективное количество соединения формулы (I) для использования в профилактике, лечения или облегчения заболевания, опосредованного интегрином Под термином «введение» в соответствии со способами настоящего изобретения следует понимать, что само по себе соединение по настоящему изобретению или его композицию для лечебного действия можно вводить отдельно в разное время в течение курса лечения или параллельно, как разделенную форму или целую комбинацию. Профилактическое введение может осуществляться до появления симптомов, характерных для заболевания или расстройства, опосредованного интегрином Термин «пациент», как используется здесь, относится к животным, предпочтительно к млекопитающим, наиболее предпочтительно человеку, который является объектом лечения, наблюдения или эксперимента и у которого существует риск (или который подвержен) развития заболевания или расстройства, или у которого существует заболевание или расстройство, связанное с экспрессией интегрина Термин «заболевание, опосредованное Термин «неконтролируемая» относится к нарушению процесса контролируемой клеточной пролиферации, как, например, в опухолевых клетках. Термин «нарушенный контроль» относится к несоответствующему клеточному росту, как, например, в результате патогенеза. Термин «подтип» относится к конкретному рецептору интегрина Термин «расстройства или заболевания, связанные с неконтролируемой клеточной пролиферацией или с клеточной пролиферацией с нарушенным контролем» относится к расстройствам, когда клеточная пролиферация одного или нескольких субпопуляций клеток в многоклеточном организме наносит вред (такой как дискомфорт или уменьшение продолжительности жизни) организму. Такие расстройства могут существовать у различных типов животных и человека и они включают в себя, но ими не ограничиваются, злокачественные новообразования, патологии, связанные со злокачественными опухолями, атеросклероз, васкулопатии, вызванные трансплантацией, образование неоинтимы, папилома, фиброз легких, пневмосклероз, гломерулонефрит, гломерулосклероз, врозжденная поликистозная дисплазия почек, фиброз почек, диабетическая ретинопатия, дистрофия желтого пятна, псориаз, остеопороз, резорбция кости, воспалительный артрит, ревматоидный артрит, рестеноз или образование спаек. Термин «злокачественное новообразование» относится, но ими не ограничивается, к глиоме, злокачественным новообразованиям легких, злокачественным новообразованиям молочной железы, злокачественным новообразованиям прямой кишки, злокачественным новообразованиям предстательной железы, злокачественным новообразованиям желудка, злокачественным новообразованиям пищевода, лейкемии, меланоме, базально-клеточному раку и лимфоме. Термин «патологии, связанные со злокачественным новообразованием» относится, но ими не ограничивается, к неконтролируемой клеточной пролиферации или к клеточной пролиферации с нарушенным контролем, росту опухоли, васкуляризации опухоли, ангиопатии и ангиогенезу. Термин «ангиогенез» относится, но не ограничивается, к неконтролируемой пролиферации или к пролиферации с нарушенным контролем новой сосудистой ткани, включая, но ими не ограничиваясь, клетки эндотелия, гладкомышечные клетки сосудов, перициты и фибробласты. Термин «остеопороз» относится, но не ограничивается, к образованию или активности остеокластов, что приводит к резорбции кости. Термин «рестеноз» относится, но им не ограничивается, к стент-стенозу и рестенозу сосудистого трансплантата. Термин «экспрессия интегрина 1) клеток, которые обычно не экспрессируют интегрин 2) неопластических клеток; 3) в ответ на стимуляцию фактором роста, гипоксией, неоплазией или патологическим процессом; 4) в результате мутаций, которые приводят к нерегулируемой экспрессии интегрина Экспрессия интегрина Еще один аспект настоящего изобретения относится к способу лечения или улучшения заболевания, опосредованного селективным интегрином Еще один аспект настоящего изобретения относится к способу лечения или улучшения заболевания, опосредованного селективным интегрином Еще один аспект настоящего изобретения относится к способу лечения или облегчения заболевания, одновременно опосредованного интегрином Одним из аспектов настоящего изобретения относится к способу ингибирования неопластической активности, опосредованной интегрином Термин «неопластическая активность» относится к неконтролируемой клеточной пролиферации или к клеточной пролиферации с нарушенным контролем и процессу ангиогенеза или образования новой сосудистой системы, питающей опухоль, в эндотелиальном микроокружении вокруг опухоли. Термин «опухоль» относится к опухолевым клеткам, которые представляют собой клетки с неконтролируемой пролиферацией или пролиферацией с нарушенным контролем в результате генетической нестабильности или мутации, и к эндотелию, где эндотелиальные клетки обладают неконтролируемой пролиферацией или пролиферацией с нарушенным контролем в результате патогенного состояния. В рамках настоящего изобретения не требуется, чтобы опухоль экспрессировала интегрин Термин «ингибирование неопластической активности, опосредованной интегрином Один из аспектов настоящего изобретения относится к способу лечения или улучшения заболевания, опосредованного патологической клеточной экспрессией интегрина Термин «заболевание, опосредованное патологической клеточной экспрессией интегрина Один из аспектов настоящего изобретения относится к способу поддержания опухолевой регрессии у пациента, при необходимости поддержания такой регрессии, который заключается во введении пациенту эффективного количества соединения формулы (I) или его композиции; где соединение или его композиция связана с терапевтическим средством и доставляет его в опухоль или в микроокружение вокруг опухоли; и где терапевтическое средство вызывает апоптоз или уменьшает неконтролируемую клеточную пролиферацию или клеточную пролиферацию с нарушенным контролем. Термин «связана с терапевтическим средством» и «доставляет его» относится к соединению формулы (I) или его композиции, связанному с терапевтическим средством способами связывания, известными специалистами в данной области; где соединение или его композиция действуют как целевое средство, вызывающее антагонизм рецепторов интегрина Термин «терапевтическое средство» включает, но не ограничивается, технеций99, относящийся к радиофармацевтическим препаратам, известным специалистам в данной области. Один из аспектов настоящего изобретения относится к способу применения соединения формулы (I) или его композиции эффективно вводя в один или несколько антипролиферативных методов лечения, включая химиотерапию, лучевую терапию, генную терапию или иммунотерапию, для профилактики, лечения или улучшения заболевания, опосредованного интегрином Комбинированная терапия может включать: 1) одновременное введение соединения формулы (I) или его композиции и химиотерапевтического средства для профилактики, лечения или облегчения заболевания, опосредованного интегрином 2) последовательное введение соединения формулы (I) или его композиции и химиотерапевтического средства для профилактики, лечения или облегчения заболевания, опосредованного интегрином 3) введение композиции, содержащей соединение формулы (I) и химиотерапевтический агент, для профилактики, лечения или облегчения заболевания, опосредованного интегрином 4) одновременное введение отдельной композиции, содержащей соединение формулы (I), и отдельной композиции, содержащей химиотерапевтический агент, для профилактики, лечения или облегчения заболевания, опосредованного интегрином Например, соединения по изобретению могут быть эффективны при комбинированных методах лечения с, по крайней мере, одним дополнительным химиотерапевтическим средством для лечения большого числа различных видов злокачественных новообразований и, по-видимому, эффективны для облегчения применения пониженной дозы химиотерапевтического средства, которое рекомендовано для конкретного вида злокачественного новообразования или нарушения клеточной пролиферации. Следовательно, можно предположить, что соединения по изобретению могут быть эффективны в схеме лечения до введения конкретного химиотерапевтического средства, рекомендованного для лечения конкретного вида злокачественного новообразования, во время введения химиотерапевтического средства или после лечения конкретным химиотерапевтическим средством. Термин «химиотерапевтическое средство» включает в себя, но ими не ограничивается, антиангиогенные средства, противоопухолевые средства, цитотоксические средства, ингибиторы клеточной пролиферации и тому подобное. Термин «лечение или улучшение» включает в себя, но ими не ограничивается, облегчение уничтожения, ингибирование прогрессии или стимулирование задержки роста злокачественной опухоли. Например, ингибиторное соединение по настоящему изобретению, действуя как антиангиогенное средство, может вводиться в режиме дозирования с, по крайней мере, одним дополнительным цитотоксическим соединением, таким как ДНК-алкилирующее средство. Предпочтительные противоопухолевые средства выбраны из группы, состоящей из кладрибина (2-хлор-2′-дезокси-(бета)-D-аденозин), хлорамбуцила (4-(бис(2-хлорэтил)амино)бензолмасляная кислота), DTIC-Dome (5-(3,3-диметил-1-триазено)-имидазол-4-карбоксамид); химиотерапевтических средств на основе платины и химиотерапевтических средств, не содержащих платину. Противоопухолевые средства, содержащие платину, включают, но ими не ограничиваются, цисплатин (CDDP) (цис-дихлордиаминплатина). Противоопухолевые средства, не содержащие платину, включают в себя, но ими не ограничиваются, адриамицин (доксорубицин), аминоптерин, беомицин, камптотецин, карминомицин, комбретастатин(ы), циклофосфамид, цитозин арабинозид, дактиномицин, дауномицин, эпирубицин, этопозид (VP-16), 5-фторурацил (5FU), герцептин актиномицин-D, метотрексат, митомицин C, тамоксифен, таксол, таксотер, тиотепа, винбластин, винкристин, винорелбин и их производные и пролекарства. Каждое противоопухолевое средство вводится в терапевтически эффективном количестве, которое может изменяться в зависимости от используемого средства, типа злокачественного новообразования, но которое направлено лечение или улучшение, и других состояний в соответствии со способами, хорошо известными в данной области. Как понятно специалисту в данной области, подходящие дозы химиотерапевтических средств будут, как правило, приблизительно такими же, как уже применяются в клинических способах лечения, где химиотерапевтические средства вводят самостоятельно или в сочетании с другими химиотерапевтическими средствами. Исключительно в качестве примера, для лечения рака широко применяются средства, такие как цисплатин и другие ДНК-алкилирующие средства. Эффективная доза цисплатина, используемая в клинической практике, составляет приблизительно 20 мг/м2 в течение 5 дней каждый три недели, всего три курса. Цисплатин не всасывается при пероральном приеме и должен, следовательно, доставляться посредством внутривенной, подкожной, внутриопухолевой или внутрибрюшинной инъекции. Дополнительные эффективные средства включают в себя соединения, которые препятствуют репликации ДНК, митозу и расхождению хромосом. Такие химиотерапевтические средства включают в себя адриамицин (доксорубицин), этопозид, верапамил или подофиллотоксин и тому подобное, и широко применяются в способах лечения опухолей. Эти соединения вводят посредством болюсных внутривенных инъекций с диапазоном доз от около 25 до около 75 мг/м2 в течение 21 дневных интервалов (для адриамицина) или от около 35 до около 50 мг/м2 (для этопозида) или перорально с удвоенной внутривенной дозой. Для нацеливания на опухоль предпочтительно используются средства, которые нарушают синтез и правильность полинуклеотидных предшественников, такие как 5-фторурацил (5-FU). 5-FU, хотя и является достаточно токсичным, обычно используется посредством внутривенного введения в диапазоне доз от около 3 до около 15 мг/кг/день. Еще один аспект настоящего изобретения относится к способу введения соединения по настоящему изобретению в сочетании с лучевой терапией. Как используется здесь, «лучевая терапия» относится к терапии, которая заключается в облучении пациента, при необходимости такого облучения. Такой способ лечения известен специалисту в данной области. Подходящая схема лучевой терапии будет сходна со схемами, уже применяемыми в клинической практике, когда лучевая терапия используется либо самостоятельно, либо в сочетании с другими химиотерапевтическими средствами. Один из аспектов настоящего изобретения относится к способу введения соединения по настоящему изобретению в сочетании с генной терапией или использования соединения по настоящему изобретению в способах генной терапии. Термин «генная терапия» относится к терапии, направленной на ангиогенные эндотелиальные клетки или опухолевую ткань во время развития опухоли. Стратегии генной терапии включают в себя восстановление дефектных генов, ингибирующих злокачественное новообразование, клеточную трансдукцию или трансфекцию антисмысловой ДНК (соответствующую генам, кодирующим факторы роста и их рецепторы) и применение «генов-самоубийц». Термин «способы генной терапии» относится к применению направленного вектора, содержащего сочетание катионных наночастиц, присоединенных к лиганду, нацеленного на Еще один аспект настоящего изобретения относится к способу лечения или улучшения опухоли, опосредованной интегрином Термин «доставленный или введенный как затравка непосредственно в опухоль» включает в себя применение соединения формулы (I) или его композиции в способах генной терапии, при которых соединение или его композиция действует как целевой агент, который нацеливает конъюгат на его независимое место действия (то есть эндотелиальные клетки сосудов опухоли или опухолевые клетки). Из-за специфического взаимодействия ингибитора интегрина Еще один аспект настоящего изобретения относится к способу введения соединения по настоящему изобретению в сочетании с иммунотерапией. Как используется здесь, «иммунотерапия» относится к терапии, направленной на конкретный белок, вовлеченный в развитие опухоли, с помощью антител, специфических к этому белку. Например, в лечении злокачественных новообразований используются моноклональные антитела против эндотелиального фактора роста сосудов. Один из аспектов настоящего изобретения относится к способу иммуносцинциографии опухолей у больного, при необходимости такой иммуносцинциографии, который включает в себя эффективное одновременное введение пациенту эффективного количества соединения формулы (I) или его композиций; где соединение или его композиция конъюгированы с неинвазивным радиоактивным препаратом для визуализации опухоли и доставляют его в опухоль или микроокружение опухоли. Термины «конъюгирован с неинвазивным радиоактивным препаратом для визуализации опухоли» и «доставляет его» относится к соединению формулы (I) или его композиции, связанной с радиоактивным препаратом способами конъюгации, известными специалисту в данной области; где соединение или его композиция действуют как целевой агент, вызывая антагонизм рецепторов интегрина Коронарная ангиопластика является наиболее эффективным методом, использующимся для снижения тяжести коронарной окклюзии; однако, ее долговременный успех ограничивается высоким показателем рестеноза. В значительной степени рестеноз связан с активацией гладкомышечных клеток сосудов, миграцией и пролиферацией (Ross, R., Nature, 1993, 362, 801-809). Еще один аспект настоящего изобретения относится к способу, использующему ингибиторное соединение интегрина Один из аспектов настоящего изобретения относится к композиции, содержащей соединение формулы (I), или его фармацевтически приемлемую соль, в ассоциации с фармацевтически приемлемым носителем. Композиции, рассматриваемые в данном изобретении, могут быть получены обычными фармацевтическими методами. В композиции по изобретению также может использоваться (но не обязательно) фармацевтически приемлемый носитель. Термин «фармацевтически приемлемый» относится к молекулярным элементам и композициям, которые не оказывают нежелательную, аллергическую или другую неблагоприятную реакцию при введении животному или человеку в зависимости от ситуации. Применение в ветеринарии в равной мере находится в области изобретения, и «фармацевтически приемлемые» лекарственные составы включают в себя составы как для медицинского, так и/или для ветеринарного применения. Композиция может находиться в большом количестве разнообразных форм препарата, в зависимости от введения, включая, но ими не ограничиваясь, внутривенное (как болюс, так и инфузия), пероральное, назальное, чрескожное, местное введение без или вместе с окклюзией, и внутрибрюшинную, подкожную, внутримышечную, внутриопухолевую или парентеральную инъекцию, все используемые формы хорошо известны специалисту в области фармацевтики. Композиция может образовывать лекарственную форму, такую как таблетка, пилюля, капсула, порошок, гранула, стерильный парентеральный раствор или суспензия, аэрозоль или жидкий спрей с дозированием, капля, ампула, устройство для автоматического введения или суппозиторий; для перорального, парентерального, интраназального, подъязычного или ректального введения или для ингаляции или вдувания. Композиции, подходящие для перорального введения, включают в себя твердые формы, такие как пилюли, таблетки, таблетки в форме капсулы, капсулы (каждая включает лекарственные составы с немедленным высвобождением, высвобождением, распределенным по времени, и отсроченным высвобождением), гранулы и порошки; и жидкие формы, такие как растворы, сиропы, эликсиры, эмульсии и суспензии. Формы, используемые для парентерального введения, включают стерильные растворы, эмульсии и суспензии. Альтернативно, композиция может находиться в форме, подходящей для введения один раз в неделю или один раз в месяц; например, нерастворимая соль активного соединения, такая как деканоат, может быть адаптирована для создания депо препарата при внутримышечной инъекции. При получении композиций в форме для перорального введения могут быть использованы один или несколько обычных фармацевтических носителей, включая необходимые и инертные фармацевтические эксципиенты, такие как вода, гликоли, масла, спирты, вкусовые добавки, консерванты, красящее вещество, сироп и тому подобное; в случае жидких препаратов для перорального введения могут использоваться носители, такие как крахмалы, сахара, разбавители, гранулирующие агенты, смазочные вещества, связующие вещества, разрыхляющие агенты и тому подобное. Лекарственные формы в этом изобретении (таблетка, капсула, порошок, инъекция, суппозиторий, измеренная жидкая доза и тому подобное), содержащие фармацевтические композиции, будут содержать количество активного ингредиента, необходимое для доставки терапевтически эффективного количества, как описано выше. Композиция может содержать от около 0,001 мг до около 5000 мг активного соединения или его пролекарства и может образовывать любую форму, подходящую для способа введения, выбранного для нужд пациента. Один из аспектов настоящего изобретения относится к терапевтически эффективному количеству в диапазоне от около 0,001 мг до 1000 мг/кг массы тела в день. Еще один аспект настоящего изобретения относится к диапазону от около 0,001 до около 500 мг/кг массы тела в день. Дополнительный аспект настоящего изобретения относится к диапазону от около 0,001 до около 300 мг/кг массы тела в день. Композиции могут вводиться в зависимости от режима дозирования от около 1 до около 5 раз в день и, еще более предпочтительно, 1, 2 или 3 раза в день. Для перорального введения композиции предпочтительно готовят в форме таблеток, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250 и 500 миллиграмм активного ингредиента для симптоматической коррекции дозы для пациента, которому проводят лечения. Оптимальные дозы введения могут быть легко определены специалистами в данной области и будут изменяться в зависимости от факторов, связанных с конкретным пациентом, которому проводят лечения (возраст, масса, режим питания и время введения), тяжести состояния, на которое направлено лечение, применяемого соединения, способа введения и эффективности препарата. Может использоваться ежедневное применение или пост-циклическое введение дозы. Для получения твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем, например традиционными ингредиентами для изготовления таблеток, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальций фосфат или камедь, и другими фармацевтическими разбавителями, например вода, с получением твердой лекарственной композиции, содержащей гомогенную смесь соединения по настоящему изобретению или его фармацевтически приемлемой соли. Когда лекарственные композиции называют гомогенными, то под этим понимают, что активный ингредиент равномерно диспергирован в композиции, так что композиция может быть легко разделена на равные эффективные дозированные формы, такие как таблетки, пилюли и капсулы. Эти твердые предварительные лекарственные составы затем разделяют на лекарственные формы описанного выше типа, содержащие от около 0,001 до около 5000 мг активного ингредиента по настоящему изобретению. Таблетки или пилюли композиции могут быть покрыты или смешаны иным образом с получением лекарственной формы, оказывающей благоприятный пролонгированный эффект. Например, таблетка или пилюля может содержать инертный компонент и наружный лекарственный компонент, последний находится в виде оболочки относительно первого. Два компонента могут быть разделены энтеросолюбильным слоем, который препятствует дезинтеграции в желудке и позволяет внутреннему компоненту пройти неповрежденным в двенадцатиперстную кишку или для задержки высвобождения. В таких энтеросолюбильных слоях или покрытиях могут использоваться различные вещества, такие вещества включают большое количество полимерных кислот с такими веществами как шеллак, ацетиловый спирт и ацетат целлюлозы. Для перорального введения в форме таблетки или капсулы активный компонент препарата может быть необязательно комбинирован с пероральным, нетоксическим фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и тому подобное. Более того, если желательно или необходимо, в смесь могут быть введены подходящие связывающие агенты; смачивающие вещества, разрыхляющие агенты и красящие агенты. Подходящие связывающие агенты включают, но ими не ограничиваются, крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, сахаристое вещество из кукурузы, природные и синтетические смолы, такие как гуммиарабик, трагакант или олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и тому подобное. Разрыхляющие агенты включают в себя, но ими не ограничиваются, крахмал, метилцеллюлозу, агар, бентонит, ксантановую смолу и тому подобное. Жидкие формы, в которые может быть введено соединение формулы (I) для перорального применения или введения инъекцией, включают водные растворы, подходящие сиропы со вкусовыми наполнителями, водные или масляные суспензии и эмульсии со вкусовыми наполнителями со съедобными маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и сходные фармацевтические носители. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают в себя синтетические и природные смолы, такие как трагакант, гуммиарабик, альгинат, декстран, натрия карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин. Жидкие формы с подходящими суспендирующими или разрыхляющими агентами со вкусовыми наполнителями также могут включать синтетические и природные смолы, например трагакант, гуммиарабик, метилцеллюлоза и тому подобное. Для парентерального введения желательны стерильные суспензии и растворы. При внутривенном введении желательны изотонические препараты, которые обычно содержат подходящие консерванты. В данной области также хорошо известно, что соединения могут альтернативно парентерально вводиться с помощью инъекции лекарственного состава, состоящей из активного ингредиента, растворенного в инертном жидком носителе. Лекарственный состав для инъекции может включать активный ингредиент в смеси с соответствующим жидким носителем. Подходящие жидкие носители включают в себя растительные масла, такие как ореховое масло, хлопковое масло, кунжутное масло и тому подобное, а также органические растворители, такие как солкетал, глицерин и тому подобное. В качестве альтернативы также могут использоваться водные парентеральные лекарственные составы. Например, подходящие водные растворители включают в себя воду, раствор Рингера и изотонический водный солевой раствор. Кроме того, в качестве растворителя или суспендирующего агента в водных составах могут использоваться стерильные нелетучие масла. Составы получают путем растворения или суспендирования активного ингредиента в жидком носителе, так чтобы конечное содержание в лекарственном составе составляло от 0,005 до 10% по массе активного ингредиента. Могут соответственно использоваться другие добавки, включая консервант, анизотоничный агент, солюбилизатор, стабилизатор и агент, уменьшающий боль. Преимущественно соединения формулы (I) могут вводиться однократной дозой один раз в день, или суммарная дневная доза может вводиться разделенными дозами два, три или четыре раза в день. Кроме того, соединения по настоящему изобретению могут вводиться в интраназальной форме с помощью местного нанесения подходящих интраназальных носителей или с помощью чрескожных путей, используя формы чрескожных пластырей, хорошо известные специалисту в данной области. При введении в форме чрескожной системы доставки введение дозы будет, конечно, длительным, а не периодическим на протяжении режима дозирования. Из-за простоты введения таблетки и капсулы представляют более выгодную пероральную лекарственную форму, в которой используются твердые фармацевтические носители. Если желательно, таблетки могут быть покрыты оболочкой из сахара или энтеросолюбильной оболочкой с помощью обычных методов. Для парентеральных введений носитель будет обычно включать стерильную воду, хотя он может включать другие ингредиенты, например, предназначенные, например, для улучшения растворимости или для консервации. Суспензии для инъекции также могут быть получены, и в этом случае могут использоваться соответствующие жидкие носители, суспендирующие агенты и тому подобное. Композиции по настоящему изобретению также включают в себя композиции для замедленного высвобождения соединения по изобретению. Такая композиция включает в себя носитель замедленного высвобождения (обычно полимерный носитель) и соединение по изобретению. В препаратах для замедленного высвобождения носитель замедленного высвобождения, обычно полимерный носитель, и соединение по изобретению сначала растворяют или диспергируют в органическом растворителе. Полученный органический раствор затем добавляют в водный раствор с получением эмульсии типа «масло в воде». Предпочтительно водный раствор включает в себя поверхностно-активный(ые) агент(ы). Затем органический растворитель упаривают из эмульсии типа «масло в воде» с получением коллоидной суспензии частиц, содержащей носитель замедленного высвобождения и соединение по изобретению. Биодеградируемые носители замедленного высвобождения также хорошо известны специалистам в данной области. Они представляют собой вещества, которые могут образовывать частицы, захватывающие в себя активный(ые) соединение(я) и медленно деградирующие/растворяющиеся в подходящих внешних условиях (например, водных, кислотных, щелочных и так далее), и, таким образом, деградируют/растворяются в жидкости организма и высвобождают активное(ые) соединение(я). Частицы предпочтительно представляют собой наночастицы (то есть в диапазоне от около 1 до 500 нм в диаметре, предпочтительно от около 50-200 нм в диаметре и наиболее предпочтительно около 100 нм в диаметре). Настоящее изобретение также относится к способам получения фармацевтических композиций по изобретению. Соединение формулы (I), как активный ингредиент, тщательно смешивают с фармацевтическим носителем в соответствии с обычными фармацевтическими методами смешивания, где носитель может иметь большое количество различных форм в зависимости от формы желаемого препарата для введения. При получении композиций пероральных лекарственных форм может использоваться любая обычная фармацевтическая среда. В случае твердых пероральных лекарственных форм подходящие носители и добавки включают в себя крахмалы, сахара, разбавители, гранулирующие агенты, смачивающие вещества, связывающие вещества, разрыхляющие вещества и тому подобное. В случае жидких пероральных препаратов подходящие носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, красящие вещества и тому подобное. Кроме того, жидкие формы активного лекарственного компонента могут быть объединены с подходящими суспендирующими или диспергирующими агентами со вкусовыми добавками, такими как синтетические и природные смолы, включая, например, трагакант, гуммиарабик, метилцеллюлозу и тому подобное. Другие диспергирующие агенты, которые могут использоваться, включают в себя глицерин и тому подобное. Агент на основе антитела, обеспечивающий направленную доставку препарата, включает в себя антитела или их антиген-связывающие фрагменты, которые связываются к целевым или доступным компонентом опухолевой клетки, опухолевой сосудистой системы или стромы опухоли. «Целевой или доступный компонент» опухолевой клетки, опухолевой сосудистой системы или стромы опухоли предпочтительно представляет экспрессируемый на поверхности доступный на поверхности или расположенный на поверхности компонент. Агент на основе антитела, обеспечивающий направленную доставку препарата, также включает антитела или их антиген-связывающие фрагменты, которые связывают внутриклеточный компонент, который высвобождается из некротизированной опухолевой клетки. Предпочтительно такими антителами являются моноколональные антитела или их антиген-связывающие фрагменты, которые связывают нерастворимый(ые) внутриклеточный(ые) антиген(ы), представленные в клетках с индуцированной проницаемостью или в разрушенных клетках по существу всех опухолевых или нормальных клетках, но которые не присутствуют или не доступны во внешней среде нормальных живых клеток млекопитающих. Как используется здесь, термин «антитело» обозначает в широком смысле иммунологический связывающий агент, такой как IgG, IgM, IgA, IgE, F(ab’)2, унивалентный фрагмент, такой как Fab’, Fab, Dab, а также сконструированные антитела, такие как рекомбинантные антитела, гуманизированные антитела, биспецифические антитела и тому подобное. Антитело может быть как поликлональным, так и моноколональным, хотя предпочтительным является моноклональное антитело. В данной области известно большое разнообразие антител, которые обладают иммунологической специфичностью в отношении поверхности клетки практически любого типа солидной опухоли (смотри Summary Table on monoclonal antibodies for solid tumors в патенте США № 5855866, Thorpe, et al). Специалистам в данной области хорошо известны способы получения и выделения антител, которые могут использоваться в качестве агентов, нацеленных на опухоли (патент США №5855866, Thorpe; и патент США № 6342219 (Thorpe)). Агенты, на основании других веществ, исключая антитела, обеспечивающие направленную доставку препарата, включают в себя факторы роста, которые специфически связываются с опухолевой сосудистой системой и другими целевыми компонентами, такими как аннексины и подобные лиганды. Кроме того, в качестве агентов, обеспечивающих направленную доставку препарата в опухоли, могут использоваться различные другие органические молекулы, примерами являются гиалуронан олигосахариды со специфически распознающим гиалуронан-связывающим белком, белок клеточной поверхности, экспрессирующийся во время роста опухоли и миграции эндотелиальных клеток и во время образования капилляроподобных сосудов (патент США № 5902795 (Toole, et al.)), и полианионные соединения, в частности полисульфатированные или полисульфонированные соединения, такие как N- и О-сульфат полианионные полисахариды, полистирол сульфонат и другие полианионные соединения (как описано в патенте США № 5762918 (Thorpe)) которые селективно связываются с эндотелиальными клетками сосудов. Способы конъюгирования терапевтической части с антителами хорошо известны (Amon, et al., Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy, Monoclonal Antibodies and Cancer Therapy, Reisfeld, et al. (eds,), стр. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom, et al., Antibodies For Drug Delivery, Controlled Drug Delivery (2nd Ed.), Robinson, et al. (eds.), стр. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review, Monoclonal Antibodies ’84: Biological, and Clinical Applications, Pinchera, et al. (eds. ), стр. 475-506 (1985)). Аналогичные методы могут быть использованы для присоединения соединений по изобретению к агентам, на основании других веществ, исключая антитела, обеспечивающим направленную доставку препарата. Специалистам в данной области известны или они могут выбрать способы в данной области для получения конъюгатов с другими веществами, исключая антитела, для направленной доставки препарата, такими как олигопептиды, полисахариды или другие полианионные соединения. Хотя для связывания соединения по изобретения с образованием агента, обеспечивающего направленную доставку, могут использоваться любые достаточно стабильные в крови связывающие группы, предпочтительными являются связывающие группы с биологически разрывающимися связями и/или селективно расщепляющимися разделительными или связывающими группами. «Биологически разрывающиеся связи» или «селективно расщепляющиеся разделительные или связывающие группы» относятся к таким связывающим группам, которые обладают достаточной стабильностью в циркуляции и разрываются, расщепляются или гидролизуются только или предпочтительно при определенных условиях (то есть при определенных внешних условиях или при взаимодействии с определенным агентом). Такие связи включат в себя, например, дисульфидную и трисульфидную связи и кислотонеустойчивые связи (как описано в патенте США № 5474765 и № 5762918) и ферменточувствительные связи, включая пептидные связи, сложные эфиры, амиды, фосфодиэфиры и гликозиды (как описано в патенте № 5474765 и 5762918). Такие особенности конструирования с селективным высвобождением способствуют замедленному высвобождению соединений из конъюгатов на предназначенном целевом сайте. Терапевтически эффективное количество соединения по изобретению конъюгированы с агентом, обеспечивающим направленную доставку препарата, зависит от конкретного больного, типа заболевания, болезненного состояния, способа введения и других клинических параметров. Эффективное количество можно легко определить, используя данные модели на животных. Экспериментальных животных с солидными опухолями часто используют для оптимизации подходящих терапевтически эффективных количество до осуществления в клинической практике. Хорошо известно, что такие модели очень надежны в прогнозировании эффекта противоопухолевых подходов. Например, мыши с солидными опухолями широко используются в предклиническом испытании для определения рабочей области терапевтических средств, которые оказывают благоприятные противоопухолевые эффекты с минимальной токсичностью. Настоящее изобретение, кроме того, относится к композиции, которая содержит эффективное количество соединения по изобретению, конъюгированное с агентом, обеспечивающим направленную доставку, и фармацевтически приемлемый носитель. Если в качестве агентов, обеспечивающих направленную доставку, используются белки, такие как антитела или факторы роста, или полисахариды, то их предпочтительно вводят в форме композиций для инъекций. Раствор антител для инъекций может вводиться в вену, артерию или в цереброспинальную жидкость курсом от около 2 минут до около 45 минут, предпочтительно от около 10 до около 20 минут. В определенных случаях чрескожное и внутриполостное введение являются более эффективными для опухолей, ограниченных областями, близкими к определенным областям кожи и/или определенным полостям организма. Кроме того, интратекальные введения могут использоваться в случае опухолей, расположенных в мозге. Еще один аспект настоящего изобретения относится к способу лечения заболеваний, связанных с экспрессией интегрина Термин «в просвете медицинского приспособления» относится к любому устройству доставки, такому как катетеры для внутрисосудистой доставки лекарственных средств, круглые стержни, фармакологические стенты и внутриполостные покрытия. Область настоящего изобретения включает в себя устройства доставки, включающие артериальный или венозный стент, содержащий покрытие или оболочку, которая элюирует или высвобождает терапевтически эффективное количество настоящего соединения. Термин «контролируемая доставка» относится к высвобождению активного ингредиента сайт-направленным или зависимым от времени способом. Альтернативно, система доставки в случае такого устройства может включать в локальный катетер для инфузии, который доставляет соединение с различной контролируемой скоростью. Термин «стент» относится к любому устройству, которое способно доставляться с помощью катетера. Стент обычно используется для предотвращения закупорки сосуда в результате физических аномалий, таких как нежелательный внутренний рост ткани сосуда в результате хирургической травмы. Стент часто имеет цилиндрическую структуру по типу расширяющейся решетки, предназначенную для введения внутрь просвета канала для уменьшения обструкции. Стент имеет поверхность, контактирующую со стенкой полости, и поверхность, открытую в полость. Поверхность, контактирующая со стенкой полости, является наружной поверхностью трубки, а поверхность, открытая в полость, является внутренней поверхностью трубки. Материал стента может быть полимерным, металлическим материалом или полимерно-металлическим сочетанием и может быть необязательно биодеградируемым. Обычно стент вводят в просвет в нерасширенной форме, а затем он расширяется автоматически или с помощью второго устройства in situ. Существует обычный способ расширения благодаря применению баллона для ангиопластики, оборудованного катетером, который надувается в стенозированном сосуде или канале организма для того, чтобы рассечь и нарушить обструкцию, связанную с компонентами стенки сосуда, и для получения расширенной полости. Могут также использоваться стенты с автоматическим расширением, как описано в находящейся на рассмотрении патентной заявке США № 2002/0016625 Al (Falotico, et al.). Комбинирование стента с лекарственными препаратами, агентами или соединениями, которые предотвращают воспаление и пролиферацию, может обеспечить наиболее эффективное лечение постангиопластического рестеноза. Соединения по настоящему изобретению могут быть введены или присоединены к стенту большим количеством способов. Раствор соединения по настоящему изобретению и биологически совместимое вещество или полимер могут вводиться в или на стент большим количеством способов. Например, раствор настоящего соединения может быть распылен на стент или стент может быть помещен в раствор и, в каждом случае, оставлен сушиться. В другом способе покрытия раствор настоящего соединения электрически заряжают до одной полярности, а стент заряжают до противоположной полярности. В этом способе раствор и стент будут притягивать друг друга. В еще одном способе покрывают стент раствором настоящего соединения, используя суперкритическую температуру и повышенное давление. Покрытие стента, используя суперкритические условия, позволяет снизить потери и добиться лучшего контроля над толщиной слоя покрытия. Обычно соединение присоединяется только к наружной поверхности стента (поверхность, которая образует контакт с тканью), но некоторые соединения могут образовывать оболочку всего стента. Продукт объединения, содержащий терапевтически эффективное количество настоящего соединения, нанесенного на стент и на или в слой или слои полимерного покрытия, где полимерное покрытие контролирует скорость высвобождения препарата, может использоваться, если эффективность препарата оказывает вредное воздействие. Следовательно, соединение может высвобождаться из стента в течение, по крайней мере, около 6 месяцев; в другом аспекте в течение, по крайней мере, от около 3 дней до около 6 месяцев; и в еще одном аспекте в течение от около 7 до около 30 дней. В качестве слоя или слоев полимерного покрытия, связанного с соединением по настоящему изобретению, может использоваться любое число неразмываемых, биологически совместимых полимерных веществ. В одном иллюстративном примере соединение непосредственно введено в полимерный матрикс, такой как полимер полипиррол, и затем нанесено на наружную поверхность стента. По существу соединение вымывается из матрикса путем диффузии через полимерные молекулы. Стенты и способы для нанесения лекарственных препаратов на стенты подробно описаны в публикации PCT WO 96/32907. В еще одном аспекте стент сначала покрывали основным слоем, содержащим раствор соединения, этилен-со-винилацетат и полибутилметакрилат. Стент затем дополнительно покрывали наружным слоем, содержащим полибутилметакрилат. Наружный слой действовал как диффузионный барьер для предотвращения слишком быстрого вымывания соединения и поступления в окружающие ткани. Толщина наружного слоя или верхнего покрытия определяла скорость, с которой соединение вымывалось из матрикса. Стенты и способы покрытия подробно описаны в находящейся на рассмотрении патентной публикации США № 2002/0016625 A1. Необходимо отметить, что для различных стентов могут использоваться различные полимеры. Например, выше описанный этилен-со-винилацетатный и полибутилметакрилатный матрикс хорош для стентов из нержавеющей стали. Другие полимеры могут использоваться более эффективно со стентами, полученными из других материалов, включая материалы, которые обладают суперпластичными свойствами, такие как сплавы никеля и титана или сохраняющие форму полимерные материалы, которые «запоминают» и возвращаются к своей начальной форме при активации при температуре организма. Способы введения стента в полость организма хорошо известны. В одном из аспектов изобретения стент, покрытый соединением, вводят с помощью катетера. Специалисту в данной области будет понятно, что способы могут незначительно изменяться в зависимости от расположения имплантанта стента. При коронарной имплантации стента баллонный катетер, несущий стент, вводят в коронарную артерию и стент устанавливают в желательном участке. Баллон раздувают, расширяя стент. При расширении стента он контактирует со стенками полости. После установки стента баллон сдувают и удаляют. Стент остается на месте, а поверхность, контактирующая с полостью и несущая соединение, непосредственно контактирует с поверхностью стенки полости. Имплантация стента при необходимости может сопровождаться антикоагуляционной терапией. Оптимальные условия для доставки соединений для применения в стенте по данному изобретению могут изменяться в зависимости от используемой локальной системы доставки, а также свойств и концентрации используемого соединения. Условия, которые могут быть оптимизированы, включают в себя, например, концентрацию соединений, доставляемый объем, путь доставки, глубину проникновения в стенку сосуда, проксимальное давление заполнения, количество и размер перфорации и подбор баллонного катетера, доставляющего препарат. Условия могут быть оптимизированы для ингибирования пролиферации гладкомышечных клеток на месте повреждения, так, чтобы не возникала значительная артериальная блокада вследствие рестеноза, что измеряется, например, по пролиферативной активности гладкомышечных клеток или по изменению сопротивления сосудов или диаметра просвета. Оптимальные условия могут быть определены на основании данных экспериментов на моделях животных, используя обычные методы расчета. Соединения по настоящему изобретению также могут вводится в форме липосомальных систем доставки, таких как маленькие моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные везикулы. Системы доставки, содержащие липосомы, хорошо известны в данной области, и их получают из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. В настоящем описании, особенно в схемах, используются нижеследующие аббревиатуры:
Общие способы синтеза Характерные соединения по настоящему изобретению могут быть синтезированы в соответствии с общими способами синтеза, описанными ниже, и проиллюстрированы более конкретно на нижеследующих схемах. Хотя схемы являются иллюстративными для получения промежуточных и целевых соединений по настоящему изобретению, изобретение не следует рассматривать как ограниченное химическими реакциями и указанными условиями. Дополнительные характерные примеры и их стереоизомеры, рацемические смеси, диастереоизомеры и энантиомеры могут быть получены, используя промежуточные соединения, полученные в соответствии с этими схемами и другими веществами, соединениями и реагентами, известными специалисту в данной области. Все такие соединения, их стереоизомеры, рацемические смеси, диастереоизомеры и энантиомеры входят в состав настоящего изобретения. Получение различных исходных продуктов, использованных в схемах, хорошо известно специалисту в данной области. Схема A На схеме A описан способ получения целевого соединения формулы (I) (где R1 и W такие, как определено выше в рамках данного изобретения). Удаление Boc-защитной группы из Ra, замещающего (где Ra представляет собой C1-4алкил) соединение А1, осуществляли в кислых условиях (используя кислоту, такую как кислая смесь ТФУ и DCM, или неорганическую кислоту в соответствующем растворителе, таком как диоксан), что приводило к получению пиперидина, соединение A2. Взаимодействие пиперидина, соединение A2, с карбоновой кислотой, соединение A3, в стандартных условиях взаимодействия (используя смесь связующих агентов, таких как HOBt/EDC, HOBT/HBTU или изобутил хлорформиат, в присутствии подходящего основания, такого как NMM или DIEA), давало сложный эфир, соединение A4. Гидролиз сложного эфира, соединение A4, в кислых или щелочных условиях давал заданное соединение формулы (I). Отдельные изомеры формулы (I) могут быть получены с помощью хирального разделения промежуточных веществ A1-A4 и преобразования хиральных промежуточных веществ в соединения формулы (I). Схема A Схема B На схеме В описан альтернативный способ получения целевого соединения формулы (I) (где R1 представляет собой -NH(R6) и W представляет собой -(CH2)0-4алкил-). Конденсация соединения А2 с соединением B1 (где R1 представляет собой H), обладающим подходящей удаляемой группой, такой как галоген, или мезилат, или тозилат, при стандартных условиях связывания (используя смесь связующих агентов, таких как HOBt/EDC, HOBT/HBTU или изобутилхлорформиат, в присутствии подходящего основания, такого как NMM или DIEA) дала соединение B2. Взаимодействие соединения B2 с подходящим амином, соединение B3, в присутствии соответствующего основания, такого как LiHMDS, NaHMDS или LDA, давало соединение B4. Обработка соединения B4 водным раствором соляной кислоты приводила к гидролизу сложного эфира с получением целевого соединения формулы (1). Схема B Схема С На схеме С описан альтернативный способ, в соответствии с которым может быть получено соединение A1. Карбоновую кислоту, соединение C1, преобразовывали в амид, соединение C2, используя N-метил-O-метилгидроксиламин в присутствии подходящего активирующего агента, такого как HOBt, HBTU, HATU, изобутилхлорформиат или тому подобное. Взаимодействие амида, соединение C2, с получением in situ ариллитиевых производных, реагентом Гриньяра или тому подобное приводило к образованию кетона, соединения C3. Кетон, соединение C3, преобразовывали в смесь цис- и транс-изомеров Схема C Схема D На схеме D описан альтернативный способ синтеза соединения A1, где (CH2)q представляет собой (CH2)2-3. Взаимодействие амида, соединение C2, с подходящим восстанавливающим агентом, таким как алюмогидрид лития или тому подобное, приводило к образованию альдегида, соединение D1. Конденсация полученного in situ ацетилида, соединение D2, с альдегидом, соединение D1, при пониженной температуре приводила к образованию пропаргилового спирта, соединение D3. Алкин, соединение D3, селективно восстанавливали до цис-олефина, соединение D4, в условиях гидролиза, используя катализатор Линдлара (Lindlar) в пиридине. Конденсация аллилового спирта, соединение D4, с 3-хлор-3-оксопропионатом, замещенным Ra, соединение D5, в присутствии основания, такого как TEA, DIEA или тому подобное, приводило к образованию смешенного сложного эфира, соединение D6. Обработка соединения D6 хлортриметилсиланом в присутствии подходящего основания, такого как гидрид натрия, гидрид калия, LDA или тому подобное, давала выход промежуточному продукту силилкетенацеталю, который преобразовывался при нагревании в подходящем растворителе, таком как ТГФ или Et2О, до смешанного сложного эфира, соединение D7. Декарбоксилирование сложного эфира, соединения D7, с образованием соединения D8 осуществляли при нагревании соединения D7 под вакуумом. Восстановление двойной связи в соединении D8 осуществляли в стандартных условиях гидролиза с повышенным давлением водорода (от около 10 до 50 фунт на квадратный дюйм) в присутствии подходящего катализатора, такого как 5 или 10% палладий на угле, что приводило к образованию заданного соединения, соединение A1, в котором (CH2)q представляет собой (CH2)2-3. Схема D Схема E На схеме E описан альтернативный способ синтеза заданного соединения формулы (I.2) (где R2 в случае соединения формулы (I) представляет собой водород, R1 и W такие, как определено ранее). Конденсация альдегида, соединение E1, используя подходящий карбалкоксиметилен трифенилфосфоран (реакция Виттига (Wittig)) или триалкил фосфонацетат (реакция Хорнера-Эммонса (Horner-Emmons)), приводила к образованию Схема E Схема F На схеме F описан альтернативный способ, с помощью которого может быть получено заданное соединение A1. Рацемическая E/Z-смесь Схема F Схема G На схеме G описан альтернативный способ синтеза заданного соединения формулы (I.3) (где (CH2)q в случае соединения формулы (I) представляет собой -(CH2)2-3-, R1 такой, как определено ранее, и W представляет собой -(CH2)0-4алкил-). Boc-защитную группу на соединении D8 удаляли в кислых условиях (используя кислоту, такую как смесь 1:1 ТФУ в DCM, 4н HCl в диоксане или тому подобное) с получением замещенного пиперидина, соединение G1. Взаимодействие пиперидина, соединение G1, с карбоновой кислотой, соединение A3, в стандартных условиях связывания (используя смесь связующих веществ, таких как HOBt/EDC, HOBT/HBTU или изобутилхлорформиат в присутствии подходящего основания, такого как NMM или DIEA) приводило к образованию сложного эфира, соединение G2. Сложный эфир, соединение G2, преобразовывали до соединения G3 в условиях водного раствора сильной кислоты или основания (в присутствии сильной кислоты или основания, такого как концентрированная HCl или NaOH). Двойную связь в соединении G3 восстанавливали, используя стандартные условия гидролиза, с повышенным давлением водорода (от около 10 до около 50 фунт на квадратный дюйм) в присутствии подходящего катализатора, такого как 5 или 10% палладий на угле, что приводило к образованию заданного соединения формулы (I.3). Схема G Схема H На схеме H описан способ синтеза заданного соединения формулы (I.3a) (где R1 в случае соединения формулы (I.3) представляет собой -NH(R5), W представляет собой -(CH2)0-4алкил-, и R5 гетероарильный заместитель восстановлен до частично ненасыщенного гетероциклильного заместителя) путем восстановления двойной связи в соединении G3a (где R1 в соединении G3 представляет собой -NH(R5)), используя стандартные условия гидролиза с повышенным давлением водорода (от около 10 до около 50 фунт на квадратный дюйм) в присутствии подходящего катализатора, такого как 5 или 10% палладий на угле, с последующим стандартным восстановлением R5 с получением заданного соединения формулы (I.3a). Схема H Схема I На схеме I показан альтернативный способ синтеза заданного соединения B4a (где (CH2)q в случае соединения B4 не ограничено -(CH2)2-3-, R6 такой, как определено ранее, R1 представляет собой H и W представляет собой -(CH2)0-4алкил-). Конденсация соединения A2 в стандартных условиях связывания (используя смесь связующих веществ, таких как HOBt/EDC, HOBT/HBTU или изобутилхлорформиат, в присутствии подходящего основания, такого как NMM или DIEA) с защищенной аминокислотой, соединение I1, что приводило к образованию заданного соединения B4a. Схема I Схема J На схеме J описан способ синтеза заданного соединения A1a (где R2 в соединении A1 представляет собой гетероарильный заместитель, который восстановлен до частично или полностью ненасыщенного гетероциклильного заместителя). Двойная связь в соединении C5a (где R2 в соединении C5 представляет ненасыщенный гетероарильный заместитель) восстанавливали в стандартных условиях гидролиза с повышенным давлением водорода (от около 10 до около 50 фунт на квадратный дюйм) в присутствии подходящего катализатора, такого как 5 или 10% палладий на угле, с последующим стандартным восстановлением R2 с получением заданного соединения A1a. На этой стадии соединение A1a может быть разделено на его отдельные оптические изомеры с помощью хиральной хроматографии. Кроме того, соединение A1a может быть алкилировано на R2 гетероатоме, используя подходящий алкилирующий агент, такой как йодметан, и подходящее основание, такое как 2,6-ди-трет-бутилпиридин, с получением A1b. Схема J Схема K На схеме K показан способ получения заданного соединения формулы I4. Обработка соединения формулы I подходящим спиртом в присутствии связующего вещества, такого как 1,3-дициклогексилкарбодиимид, и активирующего вещества, такого как диметиламинопиридин или тому подобное, приводило к образованию заданного соединения формулы (I4). Альтернативно, соединения формулы I могут быть обработаны алкилгалогенидом в присутствии подходящего основания, такого как NMM или DIEA, с выходом соединения формулы I4. Схема K Схема L На схеме L показан способ синтеза заданного соединения формулы A1b (где R2 в соединении A1b представляет собой гидроксиарильный, аминоарильный или тиофенильный заместитель, у которого была удалена защита). Двойную связь в соединении C5b (где R2 в соединении C5 представляет собой О-защищенный гидроксиарил, N-защищенный анилино или S-защищенный тиоарильный заместитель) восстанавливали в стандартных условия гидролиза с повышенным давлением водорода (от около 10 до около 50 фунт на квадратный дюйм) в присутствии подходящего катализатора, такого как 5% или 10% палладий на угле, с последующим удалением защитной группы с получением гидроксиарила или анилино, соединение A1b. Альтернативно, защитная группа может быть удалена с помощью основного или кислотного гидролиза в последующей стадии. Схема L Схема M На схеме M описан способ получения заданного соединения формулы (I5) (где R1 и W такие, как описано ранее). Кетон, соединение C3, преобразовывали до смеси цис- и транс-изомеров Схема N На схеме N описан способ синтеза заданного соединения формулы (II) (где W определен как C1-4алкил(R1)). Карбоновую кислоту, соединение A3, преобразовывали в спирт, соединение N1, используя подходящий восстановительный агент, такой как алюмогидрид лития или тому подобное. Спирт, соединение N1, преобразовывали в альдегид, соединение N2, используя подходящий окисляющее вещество, такое как пиридин хлорхромат или тому подобное. Взаимодействие альдегида соединение N2 с пиперидином, соединение A2, в стандартных условиях восстановительного аминирования, используя восстановительный агент, такой как триацетоксиборгидрид натрия или тому подобное, с получением сложного эфира, соединение N3. Гидролиз сложного эфира соединения N3 в кислых или основных условиях давал заданное соединение формула (II). Схема N Конкретные способы синтеза Конкретные соединения, которые являются характерными для изобретения, получали в соответствии со следующими далее примерами и последовательностями реакции; примеры и схемы, изображающие последовательности реакций, даны в качестве иллюстрации, для упрощения понимания изобретения, и их не следует рассматривать как ограничивающие тем или иным образом изобретение, изложенное в формуле изобретения, которая приведены далее. Данные соединения также могут использоваться как промежуточные соединения в последующих примерах для получения дополнительных соединений по настоящему изобретению. Ни в какой из реакций не предпринимались попытки оптимизировать продукты выхода. Специалисту в данной области должно быть известно, каким образом повысить выход с помощью обычных вариаций времени реакции, температуры, растворителей и/или реагентов. Реагенты были приобретены из коммерческих источников. Микроанализ осуществляли в Robertson Microlit Laboratories, Inc., Madison, New Jersey, и выражали в процентах массы каждого элемента на общую молекулярную массу. Спектр ядерно-магнитного резонанса (ЯМР) для атомов водорода измеряли с указанным растворителем (TMS) в качестве внутреннего стандарта на спектрометре Bruker Avance (300 МГц). Значения выражали в миллионных долях относительно от ТМС. Масс-спектр (MS) определяли на спектрометре Micromass Platform LC как (ESI) m/z (M+H+), используя способы электрораспыления. Стереоизометрические соединения могут быть описаны как рацемические смеси или как их отдельные диастереомеры и энантиомеры, используя рентгеноструктрурную кристаллографию и другие способы, известные специалистам в данной области. Если не указано иного, в примерах использовали вещества, полученные из легко доступных коммерческих фирм-поставщиков, или были синтезированы стандартными способами, хорошо известными специалисту в области химического синтеза. Группы заместителей, которые были различны в различных примерах, представляют собой водород, если не указано иного. Пример 1 1-[[3-[(1,4,5,6-Тетрагидро-2-пиримидинил)амино]фенил]ацетил]-4-пиперидинпропиновая кислота (Соединение 1) К раствору 3,4,5,6-тетрагидро-2-пиримидинтиола, соединение 1a (6,00 г, 51,6 ммоль), в абсолютном этаноле (45 мл) добавляли метил йодид (3,21 мл, 51,6 ммоль). Смесь кипятили с обратным холодильником в течение 3 часов, концентрировали и сушили в вакууме с выходом соединения 1b в виде бесцветного масла. MS (ES+) m/z 172 (M+41). 1H ЯМР (DMSO-d6, 300 МГц) К раствору соединения 1b (13,4 г, 51,9 ммоль) и TEA (7,23 мл, 51,9 ммоль) в DCM (70 мл) добавляли Boc2O (11,33 г, 51,91 ммоль) при 0°C и смесь перемешивали при комнатной температуре в течение 2 дней. Органический слой промывали водой (2×75 мл), сушили (Na2SO4) и концентрировали с получением соединения 1c. MS (ES+) m/z 231 (M+H+). Раствор соединения 1c (0,91 г, 3,95 ммоль) и 3-аминофенилуксусной кислоты, соединение 1d (0,59 г, 3,95 ммоль), в DMA (5 мл) нагревали до 80-85°C в течение 4 дней. Смесь охлаждали до комнатной температуры и разбавляли MeCN. Твердый продукт фильтровали и промывали MeCN и Et2O, затем сушили в вакууме. Добавляли воду и pH доводили до pH 1-2, по каплям добавляя концентрированную HCl. Полученный раствор лиофилизировали с получением соединения 1e в виде светло-желтого твердого продукта. MS (ES+) m/z 234 (M+H+). К раствору 4-пиперидинметанола, соединение 1f (10 г, 87 ммоль), DMAP (каталитическое количество), диоксана (90 мл) и воды (45 мл) добавляли Boc2О (19 г, 87 ммоль) и TEA (13 мл, 96 ммоль) при 5°C. Реакционную смесь перемешивали в течение ночи при комнатной температуре и разбавляли DCM (100 мл). Органический слой промывали насыщенным NH4Cl, сушили (Na2SO4) и концентрировали с получением соединения 1g. MS (ES+) m/z 216 (M+H+). К раствору оксалил хлорида (2,63 мл, 30,19 ммоль) в DCM (110 мл) добавляли DMSO (4,28 мл, 60,38 ммоль) в течение 15 минут при -78°C. После перемешивания при -78°C в течение 30 минут по каплям добавляли раствор соединения 1g (5,0 г, 23,2 ммоль) в DCM (10 мл). Полученную смесь перемешивали при -78°C в течение 2 часов. По каплям добавляли TEA (19,42 мл, 139,3 ммоль) и смесь нагревали до комнатной температуры и гасили водой. Органический слой разделяли, последовательно промывали насыщенным NH4Cl (75 мл), водой (75 мл), насыщенным NaHCO3 (75 мл) и насыщенным солевым раствором (75 мл), затем сушили (Na2SO4) и концентрировали с получением соединение 1h. MS (ES+) m/z 214(M+H+). 1H ЯМР (DMSO-d6, 300 МГц) Раствор соединения 1h (2,29 г, 10,7 ммоль) в DCM (15 мл) по каплям добавляли к раствору карбэтоксиметилена трифенилфосфорана (4,11 г, 10,7 ммоль) в DCM (20 мл) при 0°C. Полученную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Смесь концентрировали и остаток очищали флэш-хроматографией (силикагель, 15-30% этилацет/гексан) с получением соединения 1i. MS (ES+) m/z 284 (M+H+). 1H ЯМР (DMSO-d6, 300 МГц) Смесь соединения 1i (1,6 г, 5,6 ммоль), ТФУ (10 мл) и анизола (1 капля) в DCM (10 мл) перемешивали при комнатной температуре в течение 1,5 часа. Смесь концентрировали и сушили в вакууме с получением соединения 1j в виде соли ТФУ. MS (ES+) m/z 184 (M+H+). К раствору соединения 1j (0,308 г, 1,04 ммоль) в MeCN (20 мл) и ДМФ (2 мл) последовательно добавляли NMM (0,22 мл, 2,07 ммоль), соединение 1e (0,29 г, 1,04 ммоль), NMM (0,114 мл, 1,04 ммоль), HOBT (0,07 г, 0,51 ммоль) и HBTU (0,46 г, 1,24 ммоль). Смесь перемешивали при 0°C в течение 1 часа, затем при комнатной температуре в течение ночи, гасили насыщенным NH4Cl, концентрировали и экстрагировали EtOAc. Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Сырой продукт очищали флэш-хроматографией (силикагель, от 10% EtOH/1,5%NH4OH/DCM до 16% EtOH/1,5% NH4OH/DCM) с получением соединения 1k в виде бесцветного твердого продукта. MS (ES+) m/z 399 (M+H+). Соединение 1k (0,27 г) разбавляли в ледяном 6 н. HCl (20 мл) при 0°C и перемешивали при комнатной температуре в течение 2 дней. Смесь концентрировали и MeCN (3×20 мл) использовали как азеотроп. Полученный твердый продукт растирали в порошок с Et2O и DCM и очищали с помощью ОФ-ВЭЖХ (10-90% MeCN/вода, 0,1% ТФУ) с получением соединения 1l в виде соли ТФУ. MS (ES+) m/z 371(M+H+). 1H ЯМР (DMSO-d6, 300 МГц) Вычислено: C 49,96; H 5,14; N 10,08; F 16,09; H2О 1,24. Найдено: C 49,62; H 5,00; N 9,97; F 15,98; H2О 1,25. К раствору соединения 1l (0,05 г) в теплом EtOH (10 мл) добавляли 10% палладий на угле (85 мг) в атмосфере аргона, и смесь гидрировали (40 фунт на квадратный дюйм) в аппарате Парра. Смесь фильтровали через целит и концентрировали при пониженном давлении с выходом соединения 1 в виде липкого твердого продукта. MS (ES+) m/z 373 (M+H+). Пример 2 1-[1-Оксо-3-[3-[(1,4,5,6-тетрагидро-2-пиримидинил)амино]фенил]пропил]-4-пиперидинпропановая кислота (соединение 2) К раствору 3-(3-аминофенил)пропионовой кислоты, соединение 2a (0,60 г, 3,65 ммоль) в DMA (5 мл) добавляли соединение 1c (0,84 г, 3,65 ммоль). Реакционную смесь перемешивали при 80-85°C в течение 3 дней, охлаждали до комнатной температуры, разбавляли MeCN (30 мл) и фильтровали. К фильтрату добавляли воду и pH устанавливали равным 1-2, по каплям добавляя концентрированную HCl. Полученный раствор лиофилизировали с выходом соединения 2b. MS (ES+) m/z 248 (M+H+). К раствору 4 н. HCl в диоксане (8 мл) по каплям добавляли раствор соединения 2c (1,0 г, 3,9 ммоль) в MeOH (20 мл) при 0°C. Полученную смесь перемешивали в течение ночи при комнатной температуре и концентрировали, используя MeCN (3×20 мл) как азеотроп. Твердый продукт растирали в порошок с Et2О и гексаном, растворяли в воде и лиофилизировали с получением соединения 2d в виде бесцветного твердого продукта. MS (ES+) m/z 172 (M+H+). К раствору соединения 2d (0,20 г, 0,70 ммоль) в MeCN (25 мл) и ДМФ (2 мл) добавляли NMM (0,23 мл, 2,11 ммоль). Затем добавляли соединение 2b (0,15 г, 0,70 ммоль), NMM (0,15 мл, 1,40 ммоль), HOBT (0,05 г, 0,35 ммоль) и HBTU (0,32 г, 0,84 ммоль) и смесь перемешивали в течение 1 часа при 0°C, а затем в течение ночи при комнатной температуре. Добавляли насыщенный NH4Cl и реакционную смесь концентрировали и экстрагировали EtOAc (25 мл). Органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме. Сырую смесь очищали с помощью ОФ-ВЭЖХ (10-90% MeCN/вода, 0,1% ТФУ) с получением соединения 2e. MS (ES+) m/z 401 (M+H+). Соединение 2e (0,21 г) разбавляли в 4 н. HCl (20 мл) при 0°C и смесь перемешивали в течение ночи при комнатной температуре. Смесь концентрировали, используя MeCN (3 x 25 мл) как азеотроп, и растирали в порошок с Et2O с выходом соединения 2 в виде соли HCl. MS (ES+) m/z 387(M+H+). 1H ЯМР (DMSO-d6, 300 МГц) Вычислено: C 53,14; H 7,26; N 11,82; H2O 4,37. Найдено: C 53,19; H 7,14; N 11,91; H2O 4,62. Пример 3
К раствору соединения 3a (5,00 г, 21,80 ммоль) в MeCN (75 мл) добавляли N,O-диметилгидроксиламин гидрохлорид (98%, 2,55 г, 26,17 ммоль), NMM (14,39 мл, 130,8 ммоль), HOBT (1,47 г, 10,90 ммоль) и HBTU (9,83 г, 26,16 ммоль). Смесь перемешивали в течение 1 часа при 0°C и в течение ночи при комнатной температуре, гасили насыщенным NH4Cl, концентрировали и экстрагировали EtOAc (3×75 мл). Органический слой сушили (Na2SO4) и концентрировали в вакууме. Сырой продукт очищали флэш-хроматографией на колонке (силикагель, 30-60% этилацетат/гексан с несколькими каплями TEA) с получением соединения 3b в виде жидкости. MS (ES+) m/z 273 (M+H+). К перемешиваемому раствору 3-бромхинолина (3,81 г, 18,35 ммоль) в безводном Et2О (65 мл) по каплям добавляли n-BuLi (2,5 M гексан, 7,34 мл, 18,35 ммоль) при -78°C в течение 30 минут. Смесь перемешивали при -78°C в течение 30 минут и по каплям добавляли раствор соединения 3b (1,0 г, 3,67 ммоль) в Et2O (20 мл) в течение 10 минут. Полученную смесь перемешивали в течение 30 минут при -78°C и оставляли нагреваться до комнатной температуры. После перемешивания в течение 2 часов при комнатной температуре смесь гасили насыщенным раствором NH4Cl и разбавляли EtOAc. Органический слой промывали насыщенным солевым раствором, сушили(Na2SO4) и концентрировали в вакууме. Остаток очищали с помощью хроматографии (силикагель, 15-25% этилацетат/гексан) с получением соединения 3c в виде жидкости. MS (ES+) m/z 341 (M+H+). Раствор NaHMDS (1M, 3,17 мл, 3,17 ммоль) в ТГФ добавляли в течение 15 минут к перемешиваемому раствору триметилфосфоацетата (0,51 мл, 3,17 ммоль) в ТГФ (15 мл) при 0°C в атмосфере аргона. После перемешивания полученной смеси в течение 20 минут, раствор соединения 3c (0,27 г, 0,79 ммоль) в ТГФ (3 мл) добавляли в течение 15 минут. Смесь перемешивали при 0°C в течение 30 минут, кипятили с обратным холодильником в течение 2,5 часа, охлаждали до комнатной температуры, разбавляли Et2O (30 мл) и промывали насыщенным раствором NaHCO3 (2×25 мл) и насыщенным солевым раствором (2×25 мл). Водный слой экстрагировали Et2O и объединенные органические слои сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали флэш-хроматографией на колонке (силикагель, 10-30% этилацетат/гексан) с получением соединения 3d в виде смеси E- и Z-изомеров. MS (ES+) m/z 397 (M+H+). Смесь E- и Z-изомеров соединения 3d (0,25 г, 0,63 ммоль) и 10% Pd/C (0,12 г) в MeOH (15 мл) встряхивали в течение ночи при повышенном давлении водорода (5 фунт на квадратный дюйм) в аппарате Парра. Смесь фильтровали через целит и концентрировали в вакууме. Сырой продукт очищали с помощь флэш-хроматографии (70% этилацетат в гексане) с выходом соединения 3e в виде масла. MS (ES+) m/z 399 (M+H+). 1H ЯМР (DMSO-d6, 300 МГц) Соединение 3e (0,11 г) разбавляли в диоксане (3 мл), добавляли одну каплю анизола и по каплям добавляли 4 н. HCl в диоксане (3 мл). Смесь перемешивали при комнатной температуре в течение 2 часов и концентрировали, используя MeCN как азеотроп. Полученный твердый продукт растирали в порошок с Et2O и гексаном и сушили с получением соединения 3f в виде липкого твердого продукта. MS (ES+)m/z 299 (M+H)+. 1H ЯМР (DMSO-d6, 300 МГц) Вычислено: C 48,36; H 4,53; N 5,04; F 22,54. Найдено: C 48,24; H 4,42; N 4,99; F 22,56. 1,3-Диамино-2-гидроксипропан, соединение 3i (10,0 г, 111 ммоль), разбавляли в этаноле (30 мл) и деионизированной воде (30 мл). По каплям через дополнительную воронку добавляли дисульфид углерода (6,67 мл, 110,95 ммоль) в течение 35 минут, поддерживая температуру при 25-33°C с получением молочно-белой смеси. Полученную смесь кипятили с обратным холодильником в течение 2 часов с получением желтого раствора. После охлаждения смеси в ледяной воде по каплям добавляли концентрированную HCl (7 мл), поддерживая температуру смеси при 25-26°C. Температуру смеси затем повышали до 79°C. После перемешивания в течение 21 часов смесь охлаждали до 2°C и фильтровали посредством вакуумной фильтрации. Белый твердый продукт собирали, промывали три раза смесью 1:1 холодного этанола и воды и сушили в вакууме при 40°C с получением соединения 3j. MS (ES+) m/z 174 (M+MeCN). 1H ЯМР (ДМСО-d6, 300 МГц) К перемешиваемому раствору соединения 3j (6,1 г, 46 ммоль) в абсолютном этаноле (35 мл) добавляли метил йодид (2,9 мл, 46 ммоль), и смесь кипятили с обратным холодильником в течение 1 часа и охлаждали до комнатной температуры. После концентрирования остаток растирали в порошок с Et2O и сушили в вакууме с получением соединения 3k в виде белого твердого продукта. MS (ES+) m/z 188 (M+MeCN). 1H ЯМР (ДМСО-d6, 300 МГц) К раствору соединения 3k (13,06 г, 49,61 ммоль) в DCM (50 мл) и DMA (5 мл) добавляли TEA (6,91 мл, 49,61 ммоль). Смесь охлаждали на ледяной бане и добавляли Boc2О (10,82 г, 49,61 ммоль) при 4°C. Смесь нагревали при 41-43°C в течение 18 часов с получением светло-желтого раствора. Полученный раствор промывали водой (3×75 мл), сушили (Na2SO4) и концентрировали в вакууме с выходом соединения 3l в виде твердого продукта. MS (ES+) m/z 247 (M+H+). 1H ЯМР (ДМСО-d6, 300 МГц) 3-Аминофенилуксусную кислоту, соединение 1d (2,60 г, 17,25 ммоль), добавляли к раствору соединения 3l (5,1 г, 21 ммоль) в DMA (5 мл). Смесь нагревали при 100°C в течение 2 дней, охлаждали до комнатной температуры и разбавляли MeCN (75 мл). Полученный осадок фильтровали и промывали MeCN и Et2О, обрабатывали водой и подкисляли концентрированной HCl. После лиофилизации получали соединение 3m в виде белого твердого продукта. MS (ES+) m/z 250 (M+H+). 1H ЯМР (ДМСО-d6, 300 МГц) Используя способ, описанный в примере 2, касающийся преобразования соединения 2d в соединение 2e, преобразовывали соединение 3m с получением соединения 3n в виде твердого продукта. MS (ES+) m/z 530 (M+H+). 1H ЯМР (ДМСО-d6, 300 МГц) Используя способ, описанный в примере 2, касающийся преобразования соединения 2е в соединение 2, преобразовывали соединение 3n с получением соединения 3 в виде твердого продукта. MS (ES+) m/z 516(M+H+). 1H ЯМР (ДМСО-d6, 300 МГц) Пример 4
Соединение 4a получали, как описано в WO 99/31061. Используя способ, описанный в примере 2, касающийся преобразования соединения 2d в соединение 2e, соединение 4a преобразовывали и очищали с помощью ОФ-ВЭЖХ (10-70% ацетонитрил/вода, 0,1% ТФУ) с получением соединения 4b. MS (ES+) m/z 501 (M+H+). 1H ЯМР (ДМСО-d6, 300 МГц) Используя способ, описанный в примере 2, касающийся преобразования соединения 2е в соединение 2, преобразовывали соединение 4b с получением соединения 4 в виде липкого твердого продукта. MS (ES+) m/z 487 (M+H+). 1H ЯМР (ДМСО-d6, 300 МГц) Для C29H34N4O3-3,5 HCl-H2O: Вычислено: C 55,09; H 6,30; N 8,86; H2O 3,24. Найдено: C 54,83; H 6,53; N 9,08; H2O 3,24. Используя метод примера 4 и подходящие реагенты и исходные продукты, известные специалистам в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
и их фармацевтически приемлемые соли. Пример 5 1,2,3,4-Тетрагидро- Соединение 3d (0,49 г) объединяли с 10% Pd/C (0,6 г) в метаноле (40 мл) и воде (1,5 мл) и гидрировали при 50 фунт на квадратный дюйм H2 в течение 3 дней. После фильтрации катализатора упаренное вещество очищали с помощью флэш-хроматографии (градиент 20-30% этилацетат в гептане с несколькими каплями триэтиламина) с получением соединения 5a (0,23 г, 47%) и 5b (0,16 г, 32%). Соединение 5a: MS (ES+) m/z 403(M+H+). 1H ЯМР (CDCl3, 300 МГц) Используя способ, описанный в примере 3, касающийся преобразования соединения 3e в соединение 3f, соединение 5a преобразовывали с получением соединения 5c в виде твердого продукта. MS (ES+) m/z 303(M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя способ, описанный в примере 2, касающийся преобразования соединения 2d в соединение 2e, соединение 4a подвергали взаимодействию с соединением 5c и очищали с помощью ОФ-ВЭЖХ (10-70% ацетонитрил/вода, 0,1% ТФУ) с получением соединения 5d. MS (ES+) m/z 505 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя способ, описанный в примере 2, касающийся преобразования соединения 2e в соединение 2, соединение 5d преобразовывали с получением соединения 5 в виде соли HCl. MS (ES+) m/z 491 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя метод примера 5 и подходящие реагенты и исходные продукты, известные специалистам в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
и их фармацевтически приемлемые соли. Пример 6
Используя способ, описанный в примере 3, касающийся преобразования соединения 3a в соединение 3b, N-Boc-пиперидин-4-пропионовую кислоту, соединение 2c, преобразовывали в соединение 6a (бесцветную жидкость; очищали с помощью флэш-хроматографии на силикагеле, элюируя 30-50% этилацетатом/гексаном с несколькими каплями TEA). MS (ES+) m/z 301 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя способ, описанный в примере 3, касающийся преобразования соединения 3b в соединение 3c, соединение 6a преобразовывали в соединение 6b (очищали с помощью флэш-хроматографии на силикагеле, элюируя 30-50% этилацетатом/гексаном с несколькими каплями TEA). MS (ES+) m/z 319 (M+H+). Используя способ, описанный в примере 3, касающийся преобразования соединения 3с в соединение 3d, соединение 6b преобразовывали в соединение 6c (очищали с помощью флэш-хроматографии на силикагеле, элюируя 30-50% этилацетатом/гексаном с несколькими каплями TEA). MS (ES+) m/z 375 (M+H+). Используя способ, описанный в примере 3, касающийся преобразования соединения 3d в соединение 3e, соединение 6c преобразовывали в соединение 6d (очищали с помощью флэш-хроматографии на силикагеле, элюируя 15-35% этилацетатом/гексаном с несколькими каплями TEA). MS (ES+) m/z 377 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя способ, описанный в примере 3, касающийся преобразования соединения 3e в соединение 3f, соединение 6d преобразовывали в соединение 6e (белый твердый продукт). MS (ES+) m/z 277 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя способ, описанный в примере 1, касающийся преобразования соединения 1с в соединение 1e, соединение 1c подвергали взаимодействию с 3-аминобензойной кислотой, соединение 6f, с получением соединения 6g в виде белого аморфного твердого продукта. MS (ES+) m/z 220 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя способ, описанный в примере 1, касающийся преобразования соединения 1j в соединение 1k, соединение 6g подвергали взаимодействию с соединением 6e с получением соединения 6h (очищали посредством ОФ-ВЭЖХ: 5-50% ацетонитрил/вода, 0,1% ТФУ). MS (ES+) m/z 478 (M+H+). Используя способ, описанный в примере 2, касающийся преобразования соединения 2e в соединение 2, соединение 6h преобразовывали в соединение 6 (очищали посредством ОФ-ВЭХЖ: 5-50% ацетонитрил/вода, 0,1% ТФУ). MS (ES+) m/z 464 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Пример 7
Используя способ, описанный в примере 3, касающийся преобразования соединения 3l в соединение 3m, соединение 3l подвергали взаимодействию с 3-аминобензойной кислотой, соединение 6f, с получением соединения 7a в виде белого аморфного твердого продукта. MS (ES+) m/z 235 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя способ, описанный в примере 3, касающийся преобразования соединения 3m в соединение 3n, соединение 7a подвергали взаимодействию с соединением 6e с получением соединения 7b (белый твердый продукт; очищали с помощью ОФ-ВЭЖХ: 2-30% ацетонитрил/вода, 0,1% ТФУ). MS (ES+) m/z 494 (M+H+). Используя способ, описанный в примере 3, касающийся преобразования соединения 3n в соединение 3, соединение 7b преобразовывали с получением соединения 7 в виде белого твердого продукта. MS (ES+) m/z 480 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Пример 8
Кислоту, соединение 8a, получали из соответствующего этилового эфира, как описано в W099/31061, синтез которого описан в WO 00/72801. Используя способ, описанный в примере 5, касающийся преобразования соединения 4a в соединение 5c, соединение 8a подвергали взаимодействию с соединением 6e с выходом соединения 8b (очищали с помощью ОФ-ВЭЖХ: 10-90% ацетонитрил/вода, 0,1% ТФУ). MS (ES+) m/z 465 (M+H+). Используя способ, описанный в примере 5, касающийся преобразования соединения 5c в соединение 5, соединение 8b преобразовывали с получением соединения 8 в виде соли HCl. MS (ES+) m/z 451 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя метод примера 8 и подходящие реагенты и исходные продукты, известные специалистам в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
и их фармацевтически приемлемые соли. Пример 9
Смесь соединения 6e (0,14 г, 0,44 ммоль) в DCM (10 мл) и NMM (0,09 мл, 0,89 ммоль) перемешивали в течение 0,5 часов при комнатной температуре, затем охлаждали на ледяной бане. Добавляли 4-бромбутирилхлорид, соединение 9a (0,06 мл, 0,58 ммоль), и NMM (0,09 мл, 0,89 ммоль) и реакционную смесь перемешивали в течение 6 часов при 0°C и в течение ночи при комнатной температуре. Реакционную смесь промывали насыщенным раствором NH4Cl (5 мл), водой (5 мл) и 1 н. HCl (3 x 10 мл). Органический слой сушили (Na2SO4) и концентрировали в вакууме с выходом соединения 9b в виде вязкого масла. MS (ES+) m/z 345 (M-Br). К перемешиваемому раствору соединения 9b (0,60 г, 1,41 ммоль) и 2-аминопиридину, соединение 9c (0,39 г, 4,23 ммоль), в толуоле (10 мл) добавляли DIEA (0,73 мл, 4,23 ммоль). Смесь кипятили с обратным холодильником в течение ночи и концентрировали в вакууме. Остаток очищали с помощью ОФ-ВЭЖХ (2-30% ацетонитрил/вода, 0,1% ТФУ) с получением соединения 9d в виде масла. MS (ES+) m/z 439 (M+H+). Используя способ, описанный в примере 6, касающийся преобразования соединения 6h в соединение 6, соединение 9d преобразовывали в соединение 9 (очищали с помощью ОФ-ВЭЖХ: 2-30% ацетонитрил/вода, 0,1% ТФУ). MS (ES+) m/z 425 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Используя способ, описанный в примере 9, и подходящие реагенты и исходные продукты, известные специалисту в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
и их фармацевтически приемлемые соли. Пример 10 6-Метокси- Используя способ, описанный в примере 6, касающийся преобразования соединения 6c в соединение 6d, соединение 10a преобразовывали в соединение 10b (бесцветная жидкость; очищали с помощью флэш-хроматографии на силикагеле, 10-15% этилацетат/гексан с несколькими каплями TEA). MS (ES+) m/z 407 (M+H+) в виде рацемической смеси, которую энантиомерно разделяли, используя хиральную колонку OJ, элюируя гексаном/этанолом (75:25). 1H ЯМР (DMCO-d6, 300 МГц) Используя способ, описанный в примере 6, касающийся преобразования соединения 6d в соединение 6e, соединение 10b преобразовывали с получением соединения 10c в виде соли HCl. MS (ES+) m/z 307 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Для C17H26N2О3-1,63 CF3COOH-0,2H2O: Вычислено: C 49,08; H 5,70; N 5,65; H2O 0,73. Найдено: C 49,10; H 5,66; N 5,65; H2O 0,93. Используя способ, описанный в примере 7, касающийся преобразования соединения 7a в соединение 7b, соединение 7a подвергали взаимодействию с соединением 10c с получением соединения 10d. Используя способ, описанный в примере 3, касающийся преобразования соединения 3n в соединение 3, соединение 10d преобразовывали с получением соединения 10 в виде соли HCl (очистка ОФ-ВЭЖХ: 5-50% ацетонитрил/вода, 0,1% ТФУ). MS (ES+) m/z 510 (M+H+). 1H ЯМР (DMCO-d6, 300 МГц) Пример 11 Используя способ, описанный в примерах 6 и 8 получения соединения 8, получали энантиомеры соединения 21 из энантиомеров 10b. Два очищенных хиральных промежуточных соединения 10b-1 (изомер 1: более быстрое элюирование) и 10b-2 (изомер 2: более медленное элюирование) получали с помощью хиральной ВЭЖХ хроматографии (стационарная фаза: 500 г Chiralcel OJ; элюент: гексан/этанол 75/25; длина волны: 220 нм). Соединения 10b-1 и 10b-2, каждое по отдельности, преобразовывали в 21a и 21b соответственно с помощью тех же способов, применявшихся для преобразования 6d в 8 в примерах 6 и 8. Используя способ, описанный в примере 11, и подходящие растворители, колонку, реагенты и исходные продукты, известные специалисту в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
Пример 12
К раствору соединения 12a (5 г, 20,55 ммоль) и NMM (4,96 мл, 45,11 ммоль) в безводном ТГФ (50 мл) при -20°C в атмосфере азота через шприц добавляли изобутилхлорформиат (2,67 мл, 20,58 ммоль). Смесь перемешивали в течение 30 минут и одной порцией добавляли N,O-диметилгидроксиламин (2 г, 20,5 ммоль). Смесь медленно нагревали до комнатной температуры и перемешивали в течение 2 дней. После охлаждения в вакууме остаток разделяли между EtOAc и 1 н. HCl. Органическую фазу разделяли, промывали H2О и насыщенным NaHCO3, сушили (Na2SO4) и концентрировали в вакууме с получением соединения 12b в виде масла. Соединение 12b использовали в следующей реакции без дополнительной очистки. К раствору 4-бром-1,2-(метилендиокси)бензола, соединение 12c (1,26 мл, 10,48 ммоль), в ТГФ (40 мл) при -78°C по каплям добавляли бутиллитий (2,5M в гексане, 4,19 мл, 10,48 ммоль). Смесь перемешивали при -78°C в течение 30 минут и по каплям добавляли раствор соединения 12b (2 г, 6,98 ммоль) в ТГФ (10 мл). После перемешивания смеси при -78°C в течение 30 минут охлаждающую баню убирали. Смесь перемешивали еще 2 часа при комнатной температуре и гасили насыщенным раствором NH4Cl. Органическую фазу отделяли, промывали насыщенным солевым раствором, сушили (Na2SO4) и концентрировали. Остаток очищали с помощью ОФ-ВЭЖХ с выходом соединения 12d в виде масла. К раствору триметил фосфонацетата (0,33 мл, 2,07 ммоль) в ТГФ (10 мл) при 0°C по каплям добавляли гексаметилдисилазид натрия (1,0M в ТГФ, 2,07 мл, 2,07 ммоль). Смесь перемешивали при 0°C в течение 30 минут и по каплям добавляли раствор соединения 12d (0,18 г, 0,52 ммоль) в ТГФ (5 мл). Смесь кипятили с обратным холодильником в течение 16 часов, затем перемешивали при комнатной температуре в течение еще 24 часов, охлаждали, разбавляли Et2O (30 мл) и промывали насыщенным NaHCO3 и насыщенным солевым раствором. Органический слой сушили (Na2SO4) и концентрировали. Остаток очищали с помощью ОФ-ВЭЖХ с получением соединения 12e. Раствор соединения 12e (0,5 г, 1,24 ммоль) в MeOH (20 мл) гидрировали при 40 фунт на квадратный дюйм H2 в присутствии 10% палладия на угле (0,2 г) в течение 16 часов. Катализатор удаляли фильтрацией через целит. Фильтрат концентрировали в вакууме с выходом соединения 12f в виде масла. Соединение 12f использовали в следующей реакции без дополнительной очистки. К раствору соединения 12f (0,37 г, 0,91 ммоль) в DCM (20 мл) добавляли ТФУ (5 мл). Смесь перемешивали при комнатной температуре в течение 30 минут, концентрировали в вакууме и остаток очищали посредством ОФ-ВЭЖХ с получением соединения 12g в виде масла. К раствору соединения 8a (0,28 г, 1,15 ммоль) в ДМФ (40 мл), 1-HOBt (0,135 г, 1,0 ммоль), EDC (0,192 г, 1,0 ммоль) и DIEA (0,35 мл, 2 ммоль) добавляли в атмосфере аргона при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 45 минут. В смесь, содержащую соединение 8a, добавляли раствор соединения 12g (0,28 г, 0,067 ммоль) и DIEA (0,35 мл, 2 ммоль) в ДМФ (10 мл). Полученную смесь перемешивали в течение ночи при комнатной температуре. Добавляли воду (2 мл), а затем DCM (20 мл). Органический слой отделяли, сушили (Na2SO4) и концентрировали. Полученное сырое соединение 12h использовали как есть в следующей реакции. Сырое соединение 12h разбавляли в MeOH (20 мл) и добавляли 3 н. водный NaOH (6 мл). Смесь перемешивали при комнатной температуре в течение 5 часов и нейтрализовали с помощью 2 н. HCl. После упаривания растворителя остаток очищали посредством ОФ-ВЭЖХ с выходом соединения 11. MS (ES+) m/z 480 (M+H+). 1H-ЯМР соединения 11: 1H ЯМР (CDCl3, 300 МГц) Используя способ, описанный в примере 12, и подходящие реагенты и исходные продукты, известные специалисту в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
Пример 13
Суспензия алюмогидрида лития (3,11 г, 0,082 моль) в Et2О (250 мл) охлаждали при -55°C в атмосфере аргона. По каплям добавляли раствор соединения 3b (18,5 г, 0,068 моль) в Et2О (75 мл) в течение 15 минут с тем, чтобы температура не превышала -50°C. Охлаждающую баню удаляли и смесь нагревали до 5°C, охлаждали снова до -35°C и добавляли целит (50 г). Смесь медленно гасили раствором бисульфата (15,30 г в 43 мл H2О), поддерживая температуру при -30°C. Полученную смесь нагревали до 0°C, фильтровали через целит и твердый продукт на фильтрате промывали EtOAc (750 мл) и H2O (500 мл). Органический слой отделяли, промывали 0,5 н. NHCl (100 мл), насыщенным NaHCO3 (100 мл) и насыщенным солевым раствором (100 мл). Водный слой экстрагировали EtOAc (500 мл) и объединенные органические слои сушили, фильтровали и упаривали. Полученный осадок очищали дистилляцией по Kugelrohr (120-140°C при 1,5-2 мм рт.ст.) с выходом соединения 13a в виде бесцветного масла. Смесь 3-бромхинолина (10,40 г, 0,05 моль), триметилсилилацетилена (8,48 мл, 0,06 моль), йодид меди (0,5 г) и транс-дихлорбис(трифенилфосфин)палладия (1 г) и TEA (15 мл) нагревали при 70°C в запаянной пробирке в течение 1 часа. Добавляли H2О (150 мл), затем Et2O (300 мл). Органический слой отделяли, и водный слой экстрагировали Et2О (200 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали. Остаток очищали флэш-хроматографией на колонке (элюент: 100% DCM) с получением 3-(триметилсилилэтинил)хинолин в виде коричневого масла. 3-(Триметилсилилэтинил)хинолин разбавляли в безводном MeOH (100 мл) и добавляли K2CO3 (0,69 г, 5 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа и добавляли DCM (250 мл). Смесь фильтровали через целит. Фильтрат упаривали и остаток очищали флэш-хроматографией на колонке с получением соединения 13b в виде не совсем белого твердого продукта. К раствору соединения 13b (3,62 г, 23,6 ммоль) в ТГФ (150 мл) добавляли по каплям бутиллитий (2,5M в гексане, 9,44 мл, 23,6 ммоль) в атмосфере аргона, так чтобы температура не превышала -60°C, затем смесь охлаждали до -70°C. Смесь перемешивали при -70°C в течение 15 минут и по каплям добавляли раствор соединения 13a в ТГФ (40 мл), поддерживая температуру от -60 до -70°C. После перемешивания при -70°C в течение 30 минут смесь нагревали до 0°C в течение 20 минут и добавяли H2O (1 мл). Полученную смесь сушили над K2CO3, фильтровали и упаривали. Остаток очищали флэш-хроматографией на колонке (градиент элюирования: DCM/MeOH: от 100:0 до 95:5) с выходом соединения 13c в виде масла. Смесь соединения 13c (6,05 г) в пиридине (100 мл) гидратировали в присутствии катализатора Линдлара (Lindlar) (1 г) при 1 фунт на квадратный дюйм водорода в течение 7 часа. Катализатор удаляли путем фильтрации через целит и растворитель упаривали. Остаток очищали флэш-хроматографией на колонке (градиент элюирования:гексан/EtOAc: 9:1 до 1:1) с выходом соединения 13d в виде твердого продукта. Раствор метила 3-хлор-3-оксопропионата (1,24 мл, 11,53 ммоль) в DCM (20 мл) по каплям добавляли в течение 30 минут к раствору соединения 13d (4,25 г, 11,53 ммоль) и TEA (1,81 мл, 13 ммоль) в DCM (80 мл) при 0°C в атмосфере аргона. Смесь перемешивали в течение ночи при комнатной температуре. Добавляли водный раствор NH4Cl (50 мл) и DCM (150 мл). Органический слой разделяли и промывали насыщенным NaHCO3 (100 мл) и насыщенным солевым раствором (100 мл), сушили (Na2SO4), фильтровали и упаривали. Остаток очищали флэш-хроматографией на колонке (градиент элюирования: гексан/EtOAc: от 4:1 до 1:1) с выходом соединения 13e в виде масла. Раствор соединения 13e (4,45 г, 9,5 ммоль) в ТГФ (20 мл) по каплям добавляли в колбу, содержащую гидрид натрия (60% в минеральном масле, 0,57 г, 14,25 ммоль, три раза промывали гексаном (3 x 25 мл) при 60°C в атмосфере аргона. Смесь нагревали до 60°C в течение 15 минут. Через шприц добавляли хлортриметилсилан (2,41 г, 19 ммоль) и смесь нагревали в течение 4 часов при 60°C. Добавляли H2О (0,5 мл) и смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь упаривали, добавляли DCM (250 мл) и смесь сушили (Na2SO4). После фильтрации и упаривания остаток нагревали при 130°C в течение 2 часов под вакуумом. Очистка флэш-хроматографией на колонке (элюент: 1% MeOH в DCM) давала соединение 13f в виде желтого масла. Раствор соединения 13f (0,375 г, 0,88 ммоль) в MeOH (50 мл) гидратировали в присутствии 10% палладия на угле (120 мг) при 1 фунт на квадратный дюйм водорода в течение 2 часа. Катализатор удаляли фильтрацией через целит и растворитель упаривали с получением сырого соединения 13g, который использовали как есть в следующей реакции. К раствору соединения 13g (0,35 г, 0,82 ммоль) в DCM (10 мл) добавляли ТФУ (10 мл). Смесь перемешивали при комнатной температуре в течение 1 часа и концентрировали под вакуумом с получением сырого соединения 13h, которое использовали как есть в следующей реакции. К раствору соединения 6g (230 мг, 0,90 ммоль) и NMM (0,385 мл, 3,5 ммоль) в ДМФ (8 мл) добавляли изобутил хлорформиат (0,118 мл, 0,90 ммоль) в атмосфере аргона при 0°C. Смесь перемешивали при 0°C в течение 5 минут и по каплям добавляли раствор соединения 13h (0,455 г, 0,82 ммоль) в ДМФ (7мл). После завершения добавления охлаждающую баню убирали. Смесь перемешивали при комнатной температуре в течение ночи. Добавляли H2О (0,5 мл) и смесь концентрировали под вакуумом при 80°C. Остаток очищали ОФ-ВЭЖХ с выходом соединения 13i в виде белого порошка. К раствору соединения 13i (0,15 г, 0,2 ммоль) в 1,4-диоксане (10 мл) добавляли 1 н. водный NaOH (10 мл). Реакционную смесь перемешивали в течение 20 часов при комнатной температуре и нейтрализовали 1 н. HCl (10 мл). Очистка ОФ-ВЭЖХ давала соединение 12 в виде белого порошка после лиофилизации. MS (ES+) m/z 514 (M+H+). 1H-ЯМР соединения 12: 1H ЯМР (ДМСО-d6, 300 МГц) Используя способ, описанный в примере 13, и подходящие реагенты и исходные продукты, известные специалисту в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
Пример 14 1-[1-Оксо-3-(5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил)пропил]- К раствору 4-(2-гидроксиэтил)пиперидина, соединение 14a (24,42 г, 189 ммоль), в ДМФ (200 мл) одной порцией добавляли ди-трет-бутилдикарбонат (41,25 г, 189 ммоль) при 0°C. Через 1 час убирали охлаждающую баню и реакционную смесь оставляли перемешиваться в течение 20 часов при комнатной температуре. Реакционную смесь обрабатывали Et2O (200 мл) и H2О (500 мл). Органический слой отделяли, промывали насыщенным NH4Cl (200 мл) и насыщенным солевым раствором (200 мл) и сушили (MgSO4). После фильтрации и упаривания получали соединение 14b в виде прозрачного масла и использовали как есть без дополнительной очистки. Раствор DMSO (14 г, 179 ммоль) в DCM (80 мл) по каплям добавляли в течение 1,5 часа в 2M раствор оксалил хлорида (62,8 мл, 125,6 ммоль) в сухом DCM (200 мл) при -78°C так, чтобы температура не превышала -60°C. По каплям добавляли раствор соединения 14a в DCM (30 мл) при -78°C в течение 50 минут. После перемешивания в течение 30 минут при -78°C охлаждающую баню убирали и температуру реакционной смеси оставляли повышаться до -30°C в течение 30 минут. Добавляли TEA (25,41 г, 251 ммоль) и реакционную смесь оставляли перемешиваться в течение 1 часа при комнатной температуре. Твердый образовавшийся осадок удаляли фильтрацией и фильтрат промывали 0,3 н. HCl (2 x 100 мл) и насыщенным солевым раствором (200 мл). Органическую фазу сушили (Na2SO4), упаривали и остаток очищали флэш-хроматографией на колонке (градиент элюирования: гексан/EtOAc от 100/0 до 70/30) с выходом соединения 14c. К раствору триметил фосфонацетата (13,29 г, 73 ммоль) в ТГФ (200 мл) через шприц добавляли 1M раствор LiHMDS (73 мл, 73 ммоль) при -78°C в атмосфере аргона. Реакционную смесь затем перемешивали в течение 20 минут при -78°C, и добавляли раствор соединения 14c (8,3 г, 36,5 ммоль) в ТГФ (50 мл) в течение 30 минут. После перемешивания в течение 15 минут при -78°C охлаждающую баню убирали и реакционную смесь кипятили с обратным холодильником в течение 2. Реакционную смесь оставляли охлаждаться до комнатной температуры и добавляли насыщенный раствор NH4Cl (40 мл). Добавляли Et2О (200 мл), органический слой отделяли и промывали насыщенным солевым раствором (140 мл) и сушили (Na2SO4). После фильтрации и упаривания остаток очищали флэш-хроматографией на колонке (градиент элюирования: гексан/EtOAc: от 100/0 до 85/15) с получением смеси E- и Z-изомеров соединения 14d. Соединение 14d, фенил борной кислоты (1,55 г, 12,32 ммоль), [RhCl(Cod)]2 (0,1 г, 0,227 ммоль) и Cod (0,557 г, 5,15 ммоль) объединяли в H2О (15мл) и нагревали до 100°C в течение 3 часов в атмосфере азота. Снова добавляли фенилборную кислоту (1,0 г, 8,2 ммоль) и реакционную смесь нагревали до 100°C в течение еще 6 часов. Реакционную смесь оставляли охлаждаться до комнатной температуры, добавляли Et2О (100 мл) и органический слой отделяли. Водный слой промывали Et2О (2 x 100 мл) и объединенные органические слои сушили (Na2SO4), фильтровали и упаривали. Остаток очищали с помощью флэш-хроматографии на колонке с получением соединения 14e. К раствору соединения 14e (1,48 г, 4,09 ммоль) в DCM (14 мл) добавляли ТФУ (6 мл). Смесь перемешивали при комнатной температуре в течение 20 минут, концентрировали под вакуумом и очищали с помощью ОФ-ВЭЖХ с выходом соединение 14f в виде соли трифторуксусной кислоты. К раствору соединения 8a (0,64 г, 2,64 ммоль) в ДМФ (30 мл) добавляли HOBt (0,333 г, 2,46 ммоль), EDC (0,47 г, 2,46 ммоль) и NMM (0,68 г, 5,28 ммоль) в атмосфере аргона. Смесь перемешивали при комнатной температуре в течение 1 часа, затем добавляли раствор соединения 14f (0,66 г, 1,76 ммоль) и NMM (0,68 г, 5,28 ммоль) в ДМФ (10 мл). Полученную смесь перемешивали в течение ночи при комнатной температуре. Добавляли воду (2 мл), а затем DCM (20 мл). Органический слой отделяли, сушили (Na2SO4) и концентрировали. Полученное сырое соединение 14g использовали как есть в следующей реакции. К раствору соединения 14g в диоксане (2 мл) и H2О (1 мл) добавляли NaOH (0,78 г, 19,5 ммоль). Смесь перемешивали при комнатной температуре в течение 5 часов и нейтрализовали 2 н. HCl. После упаривания растворителя остаток очищали ОФ-ВЭЖХ с получением соединения 13 после лиофилизации. Используя способ, описанный в примере 14, и подходящие реагенты и исходные продукты, известные специалисту в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
и их фармацевтически приемлемые соли. Пример 15 Изомеры 1, 2, 3 и 4 1,2,3,4-тетрагидро- К перемешиваемому раствору амида Вейнреба (Weinreb) 12b (3,00 г, 10,48 ммоль) и 3-бромхинолина, соединение 15a (10,9 г, 52,38 ммоль), в ТГФ (120 мл) по каплям добавляли n-BuLi (2,5 M раствор в гексане; 21,0 мл, 52,38 ммоль) в течение 20 минут при -78°C. Во время добавления реакционную смесь поддерживали ниже -74°C. После добавления смесь перемешивали в течение 30 минут при -78°C и затем охлаждающую баню убирали. Реакционную смесь оставляли нагреваться до комнатной температуры в течение 1 часа. Реакционную смесь гасили добавлением насыщенного NH4Cl в воде (50 мл) и экстрагировали EtOAc (100 мл). Органический слой промывали насыщенным солевым раствором (10 мл) и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (30% EtOAc/гексан) с получением кетона, соединение 15b, в виде желтой пены. MS (ES+) m/z 355,4 (M+H+). 1H ЯМР (CDCl3, 300 МГц) К раствору ТГФ (166 мл) триметил фосфонацетата (11,65 мл, 80,58 ммоль) по каплям добавляли NaHMDS (1,0 M в ТГФ; 67,2 мл, 67,15 ммоль) в течение 10 минут при -78°C. Полученную частично отвердевающую смесь перемешивали при -50°C в течение 20 минут. К полученной жирной отвердевающей смеси добавляли раствор ТГФ (119 мл) кетона, соединение 15b (4,76 г, 13,43 ммоль), при -50°C в течение 5 минут. После добавления охлаждающую баню меняли на водяную баню и перемешивали в течение 15 минут. Реакционную смесь затем кипятили с обратным холодильником в течение 2,5 часов. Реакцию контролировали с помощью ВЭЖХ. После охлаждения до комнатной температуры смесь разбавляли EtOAc (400 мл) и промывали насыщенным NaHCO3 (50 мл x 2) и насыщенным солевым раствором (50 мл). Органический слой сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (100 г, 6,5 x 5 см, 20% до 30% EtOAc/гексан) с получением олефина, соединение 15c, в виде желто-красного сиропа, смеси E-, Z-изомеров. MS (ES+) m/z 411,3 (M+H+). Раствор MeOH (150 мл) олефина, соединение 15c (2,76 г, 6,72 ммоль), добавляли к 10% Pd/C (5,52 г как есть, 50% влажность). Раствор дегазировали в вакууме/N2 и затем создавали повышенное давление до 60 фунт на квадратный дюйм H2. Реакцию перемешивали при комнатной температуре в течение 22 часов. Реакционную смесь фильтровали и фильтраты концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на колонке (70 г, 3 x 25 см колонка, элюировали 30% EtOAc/гексан) с получением гидрохинолина, соединение 15d, в виде светло-желтого клея) и соединения 15e в виде побочного продукта. Альтернативно, в качестве растворителя может быть использован толуол. Раствор соединения 15c (17,14 г, ммоль) объединяли с 10% Pd/C (8,6 г) в толуоле (210 мл) с TEA (2,1 мл). Реакционную смесь трясли в аппарате Пара (Parr) при 50°C и 50 фунт на квадратный дюйм в течение около 28 часов. Реакцию останавливали, когда замедлялось поглощение водорода. После хроматографии соединение 15d выделяли. MS (ES+) m/z 417,1 (M+H+)+. 1H ЯМР (CDCl3, 300 МГц) Отдельные энантиомеры соединения 19 получали путем разделения изомеров 15d и получали из них конечные продукты, соединения 19-1, 19-2, 19-3 и 19-4, теми же способами, какими преобразовали соединение 15a в соединение 5 в примере 5, но используя тетрагидронафтиридин, соединение 8a, вместо 4a. Четыре изомера соединения 15d разделяли последовательной хиральной хроматографией. Препаративную ВЭЖХ с инициацией УФ осуществляли, используя колонку Prochrom LC50 типа Dynamic Axial Compression, которую наполняли 500 граммами стационарной фазы. Применяли смесительный насос с низким давлением с четырехкомпонентным градиентом Prep LC 4000 (Waters), УФ-детектор K-2500 (KNAUER), автоматическую пипетку 233 XL (Gilson), шприцевой насос 402 (Gilson), коллектор фракций 202 (Gilson), клапан коллектора фракций rh. 7030L (Gilson) и контрольное программное обеспечение Unipoint (Gilson). Изомеры (пронумерованы по порядку элюирования: изомер 1 элюировался первый) 15d-1 и 15d-2 отделяли от изомеров 15d-3 и 15d-4, используя Chiralpak® OD: целлюлоза трис-(3,5-диметилфенилкарбамат) наслаивали на 20 мкм силикагеля, 5 см ID; 41 см длины; используя метанол в качестве элюента: 100 об.% при 80 мл/минут; длина волны 220 нМ. Это приводит к 15d-1 и 15d-2 в виде смеси и 15d-3 и 15d-4 в виде смеси. Изомеры (пронумерованы по порядку элюирования: изомер 1 элюировался первый) 15d-1 и 15d-2 отделяли от изомеров 15d-3 и 15d-4, используя Chiralpak® AD: амилозу трис-(3,5-диметилфенилкарбамат) наслаивали на 20 мкм силикагеля, 5 см ID; 41 см длины; используя метанол в качестве элюента: 100 об.% при 80 мл/минут; длина волны 220 нМ. Это дало два чистых изомера 15d-1 и 15d-2 в виде смеси, которые индивидуально преобразовывали в 19-1 и 19-2 соответственно способами, описанными в примере 5, с помощью подходящих реагентов и исходных продуктов. Изомеры 15d-3 и 15d-4 отделяли на хиральной колонке: Chiralpak® AD, амилозу трис-(3,5-диметилфенилкарбамат) наслаивали на 20 мкм силикагеля, 500 г; 5 см ID; 41 см длина и в качестве элюента использовали этанол: 100 об.% при 80 мл/минут; длина волны 220 нМ. Это дало два чистых изомера 15d-3 и 15d-4, которые индивидуально преобразовывали в 19-3 и 19-4 соответственно способами, описанными в примере 5, с помощью подходящих реагентов и исходных продуктов. Соединения 19-1, 19-2, 19-3, 19-4: 1H ЯМР (ДМСО-d6, 300 МГц)
Используя способ, описанный в примере 19, и подходящие растворители и исходные продукты, известные специалисту в данной области, могут быть получены другие конкретные изомеры соединений по настоящему изобретению, включая, но не ограничиваясь:
и их фармацевтически приемлемые соли.
Пример 16 N-Метил-1,2,3,4-тетрагидро- Соединение 67 получали теми же способами, которые использовали для преобразования соединения 15d в соединение 19, как описано в примере 15, за исключением того, что промежуточное соединение 15d алкилировали до стадии удаления Boc-защитной группы. Алкилированный продукт, соединение 16a, преобразовывали в соединение 67 тем же способом, как соединение 15d преобразовывали в соединение 19. Соединение 15d (280 мг, 0,67 ммоль) разбавляли в безводном ДМФ (10 мл) и обрабатывали 2,6-ди-трет-бутилпиридином (0,181 мл, 0,81 ммоль) и йодметаном (0,050 мл, 0,81 ммоль) и оставляли при комнатной температуре в течение 20 часов. Сырую реакционную смесь упаривали и затем очищали с помощью флэш-хроматографии (20% EtOAc в гексане, несколько капель триэтиламина) с выходом 16a (90 мг, 31%) в виде прозрачного твердого продукта. MS (ES+) m/z 431 (M+H+). 1H ЯМР (ДМСО-d6, 300 МГц)
Пример 17 Трет-бутиловый эфир 4-[1-(3-5,6,7,8-тетрагидро-[1,8]нафтиридин-2-ил-пропионил)пиперидин-4-ил]масляной кислоты (соединение 70) Используя способ, описанный в примере 3, касающийся преобразования соединения 3d в соединение 3e, соединение 14d преобразовывали в соединение 17a. MS (ES+) m/z 286 (M+H+). Используя способ, описанный в примере 3, касающийся преобразования соединения 3e в соединение 3f, соединение 17a преобразовывали в соединение 17b. MS (ES+) m/z 186 (M+H+). Используя способ, описанный в примере 14, касающийся преобразования соединения 14f в соединение 14g, соединение 17b подвергали взаимодействию с соединением 8a с выходом соединения 17c. MS (ES+) m/z 374,2 (M+H+). К раствору соединения 17c (1,8 г, 4,82 ммоль) в MeOH (9 мл) добавляли 3 н. NaOH (3,21 мл, 9,63 ммоль). Полученную смесь перемешивали в течение 4,5 часов при комнатной температуре. Добавляли 2 н. HCl (4,82 мл, 9,64 ммоль) и смесь концентрировали при пониженном давлении. К остатку добавляли DCM и твердый продукт удаляли путем фильтрации. Фильтрат упаривали с выходом соединения 17d. MS (ES+) m/z 360,3 (M+H+). К раствору соединения 17d (0,3 г, 0,83 ммоль) в DCM (2 мл) добавляли трет-бутанол (0,476 мл, 4,98 ммоль), 1,3-дициклогексилкарбодиимид (1M в DCM; 1 мл, 1 ммоль) и DMAP (1M в DCM; 0,11 мл, 0,11 ммоль). Полученную смесь перемешивали в течение ночи при комнатной температуре. Смесь фильтровали и концентрировали при пониженном давлении и остаток очищали ОФ-ВЭЖХ (10-90% MeCN/вода, 0,1% ТФУ) с выходом соединения 70. MS (ES+) m/z 388,4 (M+H+). 1H ЯМР (CDCl3, 300 МГц) Используя способ, описанный в примере 17, и подходящие реагенты и исходные продукты, известные специалисту в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
Пример 18 2,2-Диметилпропионилоксиметиловый эфир 4-[1-(3-5,6,7,8-тетрагидро-[1,8]нафтиридин-2-ил-пропионил)пиперидин-4-ил]масляной кислоты (соединение 74) К раствору соединения 17c (1,8 г, 4,82 ммоль) в MeOH (10 мл) добавляли 3 н. NaOH (3,21 мл, 9,63 ммоль). Полученную смесь перемешивали в течение 4 часов при комнатной температуре и концентрировали при пониженном давлении с выходом 18a. MS (ES+) m/z 360,3 (M+H+). К суспензии соединения 18a (0,5 г, 1,3 ммоль) в ацетоне (10 мл) добавляли хлорметил пивалат (0,21 мл, 1,46 ммоль) и 25% водный NaI (0,13 мл) и полученную смесь нагревали при кипячении с обратным холодильником в течение 5 часов. Растворитель удаляли при пониженном давлении и остаток очищали ОФ-ВЭЖХ (10-90% MeCN/вода, 0,1% ТФУ) с выходом соединения 74. MS (ES+) m/z 474,3 (M+H+). 1H ЯМР (CDCl3, 300 МГц) Пример 19 3-(2,3-Дигидробензофуран-6-ил)-4-[1-(3-5,6,7,8-тетрагидро-[1,8]нафтиридин-2-ил-пропионил)пиперидин-4-ил]масляная кислота (соединение 36a) Используя способ, описанный в примере 12, касающийся преобразования соединения 12b в соединение 12d, соединение 12b преобразовывали в соединение 19b путем взаимодействия с n-BuLi и 6-бром-2,3-дигидробензофураном 19a (соединение 19a получали в третьей стадии из 1,4-дибром-2-фторбензола, как описано в Organic Letters (2001), 3 (21), 3357-3360). MS (ES+) m/z 368,4 (M+Na+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12d в соединение 12e, соединение 19b преобразовывали в соединение 19c. MS (ES+) m/z 424,4 (M+Na+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12e в соединение 12f, соединение 19c преобразовывали в соединение 19d. MS (ES+) m/z 426,5 (M+Na+). Рацемическое соединение 19d разделяли на два энантиомерно чистых соединения 19e и 19f на хиральной колонке, используя метанол в качестве элюента (стационарная фаза: Chiralpak AD 20 мкм (Daicel); элюент: метанол; диаметр колонки: 50 мм; детектор: 0,5 мм Knauer superpreparative cell; длина волны: 225 нм). Соединение 19f (второй элюируемый изомер): [ Используя способ, описанный в примере 12, касающийся преобразования соединения 12f в соединение 12g, соединение 19f преобразовывали в соединение 19g. MS (ES+) m/z 304,4 (M+H+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12g в соединение 12h, соединение 19g преобразовывали в соединение 19h. MS (ES+) m/z 492 (M+H+). Сырое соединение 19h разбавляли в MeOH (20 мл) и добавляли 3 н. водный NaOH (6 мл). Смесь перемешивали при комнатной температуре в течение 5 часов и нейтрализовали 2 н. HCl. После упаривания растворителя, остаток очищали с помощью ОФ-ВЭЖХ с выходом соединения 36a. MS (ES+) m/z 478,8 (M+H+). 1H ЯМР (CDCl3, 300 МГц) Для C28H35N3О4-1,05 HCl-0,6 H2О: Вычислено: C 63,86; H 7,13; N 7,98; Cl 7,07; H2O 2,06. Найдено: C 63,67; H 7,32; N 8,12; Cl 6,94; H2О 1,91. [ Энантиомер 36b получали из быстродвижущего энантиомера 19е, используя способы, описанные для преобразования 19f в соединение 36a. Пример 20 3-(4-Гидрокси-3-метоксифенил)-4-[1-(3-5,6,7,8-тетрагидро-[1,8]нафтиридин-2-ил-пропионил)пиперидин-4-ил]масляная кислота (соединение 76) К раствору бром-метоксифенола, соединение 20a (10 г, 49,2 ммоль), и N,N-диэтил-N-диизопропиламина (0,7 г, 54,2 ммоль) в сухом DCM (100 мл) добавляли 2-(триметилсилил)этоксиметил хлорид (9,03г, 54,2 ммоль). Полученную смесь перемешивали в течение 2 часов при комнатной температуре и добавляли воду и насыщенный солевой раствор. Органический слой отделяли и сушили над Na2SO4. Растворитель удаляли при пониженном давлении и остаток очищали с помощью флэш-хроматографии на колонке (силикагель; элюент:гексан: EtOAc; 9:1) с выходом соединения 20b. MS (ES+) m/z 396/398 (M+H+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12b в соединение 12d, соединение 12b преобразовывали в соединение 20c. MS (ES+) m/z 502,2 (M+Na+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12d в соединение 12e, соединение 20c преобразовывали в соединение 20d. MS (ES+) m/z 558,2 (M+Na+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12e в соединение 12f, соединение 20d преобразовывали в соединение 20e. MS (ES+) m/z 408,3 (M+H+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12f в соединение 12g, соединение 20e преобразовывали в соединение 20f. MS (ES+) m/z 308,1 (M+H+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12g в соединение 12h, соединение 20f преобразовывали в соединение 20g. MS (ES+) m/z 496,8 (M+H+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12h в соединение 11, соединение 20g преобразовывали в соединение 76. MS (ES+) m/z 482,4 (M+H+). 1H ЯМР (ДМСО-d6, 300 МГц) Производные, в которых гидроксильный заместитель соединения 76 был алкилирован или ацилирован, могут быть получены, используя общие способы, исходные продукты и реагенты, известные специалисту в данной области. Пример 21 3-(3-Метиламинофенил)-4-[1-(3-5,6,7,8-тетрагидро-[1,8]нафтиридин-2-ил-пропионил)пиперидин-4-ил]масляная кислота (соединение 79) Раствор 3-броманилина, соединение 21a (2 мл, 18,4 ммоль), ди-трет-бутил дикарбоната (4,05 г, 18,6 ммоль) в ТГФ (20 мл) кипятили с обратным холодильником в течение 30 часов в атмосфере N2. Смесь упаривали при пониженном давлении и остаток разбавляли в EtOAc. Раствор промывали насыщенным раствором NaHCO3 и насыщенным солевым раствором. Органический слой сушили над MgSO4, фильтровали и упаривали с выходом соединения 21b. MS (ES+) m/z 256,8/258,8 (M-CH3). Гидрид натрия (60% в масле; 0,78 г, 19,5 ммоль) добавляли небольшими порциями к раствору соединения 21b (4,18 г, 15,4 ммоль) и метил йодида (1,21 мл, 19,5 ммоль) в ДМФ (50 мл) при 0°C. Полученную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 часа. Смесь выливали в ледяную воду и экстрагировали EtOAc. Органический слой отделяли, сушили над MgSO4, фильтровали и упаривали при пониженном давлении с выходом соединения 21c. MS (ES+) m/z 270,9/272,9 (M-CH3). Используя способ, описанный в примере 12, касающийся преобразования соединения 12b в соединение 12d, соединение 21c преобразовывали в соединение 21d. MS (ES+) m/z 455,0 (M+Na+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12d в соединение 12e, соединение 21d преобразовывали в соединение 21e. MS (ES+) m/z 510,9 (M+Na+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12e в соединение 12f, соединение 21e преобразовывали в соединение 21f. MS (ES+) m/z 512,8 (M+Na+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12f в соединение 12g, соединение 21f преобразовывали в соединение 21g. MS (ES+) m/z 291,0 (M+H+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12g в соединение 12h, соединение 21g преобразовывали в соединение 21h. MS (ES+) m/z 479,0 (M+H+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12h в соединение 11, соединение 21h преобразовывали в соединение 79. MS (ES+) m/z 465,0 (M+H+). 1H ЯМР (ДМСО-d6, 300 МГц) Используя способ, описанный в примере 21, и подходящие реагенты и исходные продукты, известные специалисту в данной области, могут быть получены другие соединения по настоящему изобретению, включая, но не ограничиваясь:
Пример 22 3-Нафтален-2-ил-4-[1-(3-5,6,7,8-тетрагидро-[1,8]нафтиридин-2-ил-пропионил)пиперидин-4-ил]масляная кислота (соединение 56a) Используя способ, описанный в примере 19, касающийся преобразования соединения 12b в соединение 19b, соединение 12b преобразовывали в соединение 22a при взаимодействии с 2-бромнафталеном. MS (ES+) m/z 376 (M+Na). Используя способ, описанный в примере 19, касающийся преобразования соединения 19b в соединение 19c, соединение 22a преобразовывали в соединение 22b. MS (ES+) m/z 432,1 (M+Na+). Используя способ, описанный в примере 19, касающийся преобразования соединения 19c в соединение 19d, соединение 22b преобразовывали в соединение 22c. MS (ES+) m/z 434,1 (M+Na+). Рацемическое соединение 22c разделяли на два энантиомерно чистых соединения 22d и 22e на хиральной колонке, используя этанол в качестве элюента (стационарная фаза: Chiralpak AD 20 мкм (Daicel); диаметр колонки: 50 мм; детектор: 0,5 мм Knauer superpreparative cell; длина волны: 225 нм). 22d (первый элюируемый изомер): [ Используя способ, описанный в примере 19, касающийся преобразования соединения 19f в соединение 19g, соединение 22e преобразовывали в соединение 22f. MS (ES+) m/z 312,0 (M+H+). Используя способ, описанный в примере 19, касающийся преобразования соединения 19g в соединение 19h, соединение 22f подвергали взаимодействию с соединением 8a с выходом соединения 22g. MS (ES+) m/z 500,0 (M+H+). Используя способ, описанный в примере 19, касающийся преобразования соединения 19h в соединение 36a, соединение 22g преобразовывали в соединение 56a. MS (ES+) m/z 486,0 (M+H+). 1H ЯМР (CDCl3, 300 МГц) Для C30H35N3О3-1,1 HCl-0,75 H2О: Вычислено: C 66,83; H 7,03; N 7,80; Cl 7,24; H2O 2,51. Найдено: C 66,53; H 7,26; N 8,15; Cl 7,27; H2О 2,39. [ Энантиомер 56b получали из быстродвижущегося энантиомера 22d, используя способы, описанные для преобразования 22e в соединение 56a. Пример 23 3-(3-Фторфенил)-4-[1-(3-5,6,7,8-тетрагидро-[1,8]нафтиридин-2-ил-пропионил)пиперидин-4-ил]бутирамид (соединение 64) Используя способ, описанный в примере 12, касающийся преобразования соединения 12b в соединение 12d, соединение 12b преобразовывали в соединение 23a путем взаимодействия с 1-бром-3-фторбензолом. MS (ES+) m/z 344(M+Na+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12d в соединение 12e, соединение 23a преобразовывали в соединение 23b путем взаимодействия с диэтилцианометилфосфонатом. MS (ES+) m/z 367,4 (M+Na+). Раствор соединения 23b (2,06 г, 5,98 ммоль) в EtOH (50 мл) гидратировали при 5 фунт на квадратный дюйм в присутствии 10% палладия на угле (200 мг) в течение 40 часов. Катализатор удаляли фильтрацией через целит. Фильтрат концентрировали в вакууме с выходом соединения 23c. MS (ES+) m/z 369,5 (M+Na+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12f в соединение 12g, соединение 23c преобразовывали в соединение 23d. MS (ES+) m/z 247 (M+H+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12g в соединение 12h, соединение 23d подвергали взаимодействию с соединением 8a с выходом соединения 23e. MS (ES+) m/z 435 (M+H+). Смесь соединения 23e (150 мг, 0,345 ммоль) и 12 н. HCl (10 мл) нагревали до 40°C в течение 3 часов. Смесь упаривали досуха и дополнительно сушили лиофилизацией с выходом соединения 64. MS (ES+) m/z 453,5 (M+Na+). 1H ЯМР (ДМСО-d6, 300 МГц) Пример 24 3-(3-Фторфенил)-4-[1-(3-5,6,7,8-тетрагидро[1,8]нафтиридин-2-ил-пропил]пиперидин-4-ил]масляная кислота (соединение 81) К суспензии соединения 8a (2,0 г, 8,2 ммоль) в сухом ТГФ (60 мл) медленно добавляли алюмогидрид лития (1,0 M в ТГФ; 16,5 мл, 16,5 ммоль) при 0°C. Охлаждающую баню убирали и смесь перемешивали в течение 24 часов при комнатной температуре. Смесь гасили водой и добавляли целит. Смесь экстрагировали Et2O и EtOAc. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением соединения 24a. MS (ES+) m/z 193,2 (M+H+). Соединение 24a (0,5 г, 2,6 ммоль) добавляли к суспензии хлорхромата пиридина (0,67 г, 3,12 ммоль) в DCM (5 мл). Смесь перемешивали в течение ночи при комнатной температуре. Добавляли диэтиловый эфир и смесь фильтровали. Фильтрат сушили над Na2SO4. После удаления осушителя путем фильтрации растворитель удаляли при пониженном давлении с получением смеси 24a и 24b, которую использовали как есть в следующей реакции. Соединение 24b: MS (ES+) m/z 191,1 (M+H+). К смеси 24a и 24b (0,01 г, 0,05 ммоль) и пиперидина, соединение 24c (0,015 г, 0,05 ммоль; получали, используя способ, описанный в примере 12, касающийся преобразования соединения 12a в соединение 12g, и где бром-3-фторбензол заменяли на 4-бром-1,2-(метилендиокси)бензол (соединение 12c) и проводили взаимодействие с получением 3-фторфенила, соединения аналогичного соединению 12f) в DCM (0,2 мл) добавляли триацетоксиборгидрид натрия (25,6 мг, 0,074 ммоль) и смесь перемешивали в течение 4 часов при комнатной температуре. Добавляли диэтиловый эфир и органический слой отделяли и сушили над Na2SO4. Осушитель удаляли фильтрацией и растворитель удаляли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии (градиент элюирования: DCM: MeOH:NH4OH; от 1,00:0:0 до 90:9:1) с выходом соединения 24d. MS (ES+) m/z 454,4 (M+H+). Используя способ, описанный в примере 12, касающийся преобразования соединения 12h в соединение 11, соединение 24d преобразовывали в соединение 81. MS (ES+) m/z 440,5 (M+H+). Пример 25
Соединение 30 синтезировали следующим способом, описанным в примере 12, где бром-3-фторбензол заменяли на 4-бром-1,2-(метилендиокси)бензол (соединение 12c) и проводили взаимодействие с получением 3-фторфенила, соединения, аналогичного соединению 12f. Дополнительное соединение 30 разделяли на два изомера (соединение 30a и соединение 30b) по существу следуя способу, описанному в примере 19, где стационарная фаза Chiralcel OD; элюент: гексан/EtOH: 95/5; длина волны: 220 нм. Интересующим изомером был второй элюируемый изомер. Разделенные изомеры преобразовывали в соединения 30a и 30b, завершая синтез из соединения 12f, как описано в примере 12, с выходом соединения 30a и 30b. Перспективный пример 26 3-(2,3-Дигидробензофуран-6-ил)-4-[1-(3-5,6,7,8-тетрагидро-[1,8]нафтиридин-2-илбутил)пиперидин-4-ил]пропановая кислота (соединение 80) Используя способ, описанный в примере 3, касающийся преобразования соединения 3b в соединение 3c, соединение 3b может быть преобразовано с получением соединения 26a, при взаимодействии с 6-бром-2,3-дигидробензофураном. Используя способ, описанный в примере 3, касающийся преобразования соединения 3c в соединение 3d, соединение 26a может быть преобразовано с получением соединения 26b. Используя способ, описанный в примере 3, касающийся преобразования соединения 3d в соединение 3e, соединение 26b может быть преобразовано с получением соединения 26c. Используя способ, описанный в примере 3, касающийся преобразования соединения 3e в соединение 3f, соединение 26c может быть преобразовано с получением соединения 26d. Используя способ, описанный в примере 3, касающийся преобразования соединения 3f в соединение 3g, соединение 26d может быть преобразовано с получением соединения 26e. Используя способ, описанный в примере 4, касающийся преобразования соединения 4a в соединение 4b, соединение 26e может быть преобразовано с получением соединения 26f. Используя способ, описанный в примере 4, касающийся преобразования соединения 4b в соединение 4, соединение 26f может быть преобразовано с получением соединения 80. Примеры биологических экспериментов Как показано в биологических экспериментах, описанных здесь ниже, как показано в таблице I, соединения по настоящему изобретению являются антагонистами рецепторов интегрина Пример 1 Анализ связывания Методы осуществления анализа связывания витронектина/ Пример 2 Анализ связывания GP IIb/IIIa на основании твердофазного анализа in vitro 96-луночную плашку Immulon-2 для микротитрования (Dynatech-Immulon) покрывали 50 мкл/лунку очищенным GP IIb/IIIa с аффинностью к RGD (эффективный уровень 0,5-10 мкг/мл) в 10 мМ HEPES, 150 мМ NaCl, 1 мМ MgCl2 при pH 7,4. Плашку покрывали и инкубировали в течение ночи при 4°С. Раствор GP IIb/IIIa удаляли и добавляли 150 мкл 5% BSA и инкубировали при комнатной температуре в течение 1-3 часа. Плашку энергично промывали модифицированным буфером Tyrodes. В лунки, содержащие исследуемые соединения (25 мкл/лунку), добавляли биотинилированный фибриноген (25 мкл/лунку) до 2x конечной концентрации. Плашку покрывали и инкубировали при комнатной температуре в течение 2-4 часов. За двадцать минут до окончания инкубирования добавляли одну каплю реагента A (VectaStain ABC Horseradish Peroxidase kit, Vector Laboratories, Inc.) и одну каплю реагента В смеси с 5 мл модифицированного буфера Tyrodes и оставляли. Раствор лиганда удаляли и плашку промывали (5 x 200 мкл/лунку) модифицированным буфером Tyrodes. Добавляли реагент Vecta Stain HRP-биотин-авидин (50 мкл/лунку, полученный выше) и инкубировали при комнатной температуре в течение 15 минут. Раствор Vecta Stain удаляли и лунки промывали (5 x 200 мкл/лунку) модифицированным буфером Tyrodes. Добавляли буфер для проявления (10 мл 50 мМ цитрат/фосфатный буфер @ pH 5,3, 6 мг o-фенилендиамин, 6 мкл 30% H2О2; 50 мкл/лунку) и инкубировали при комнатной температуре в течение 3-5 минут и затем добавляли 2 н. H2SO4 (50 мкл/лунку). Оптическую плотность считывали при 490 нМ. В таблице 1 показаны результаты анализа связывания GP IIb/IIIa на основании твердофазного анализа in vitro для характерных соединений по настоящему изобретению. Пример 3 Анализ связывания Метод проведения анализа связывания витронектина/
Хотя представленное описание отражает основные принципы настоящего изобретения, с примерами, представленными только с целью иллюстрации, следует учесть, что на практике изобретение охватывает все возможные его вариации, приложения и/или модификации, входящие в объем следующей формулы изобретения и ее эквивалентов.
Формула изобретения
1. Соединение формулы (I) или формулы (II):
где W выбран из группы, состоящей из -С1-6алкил(R1), -С0-6алкиларил(R1,R8), R1 выбран из группы, состоящей из -N(R4)(R6), -гетероциклил(R8), где гетероциклил представляет собой насыщенный или частично ненасыщенный 5-6-членный моно- или 9-10-членный бициклический алкильный радикал, в котором один или несколько атомов углерода независимо замещены на атом N, О, S и -гетероарил(R8), который представляет собой 5-6- членную моно- или 9-10-членную бициклическую кольцевую ароматическую систему, содержащей по крайней мере один гетероатом, выбранный из N, О, S; R4 представляет собой водород, R6 выбран из группы, состоящей из -гетероциклил(R8), где гетероциклил представляет собой насыщенный или частично ненасыщенный 5-6-членный моно- или 9-10- членный бициклический алкильный радикал, в котором один или несколько атомов углерода независимо замещены на атом N, О, S и -гетероарил(R8), который представляет собой 5-6-членную моно- или 9-10-членную бициклическую кольцевую ароматическую систему, содержащую по крайней мере один гетероатом, выбранный из N, О, S; R8 представляет собой от одного до четырех заместителей, независимо выбранных из группы состоящей из водорода, -С1-8алкил(R9), если присоединен к атому азота; и где R8 представляет собой от одного до четырех заместителей, независимо выбранных из группы водорода, -С1-8алкил(R9), -C1-8алкокси(R9), -С6-12арил(R10), -O-C6-12арил(R10), -S-C1-8алкил(R9), -NH-C1-8алкил(R9), -N(С1-8алкил(R9))2 или гидрокси, галоген, если присоединен к атому углерода; R9 представляет собой водород или (галоген)1-3; R10 представляет собой водород или (галоген)1-3; R2 выбран из группы состоящей из водорода, – C6-12арил(R8), гетероциклил(R8), который представляет собой насыщенный или частично ненасыщенный 5-6-членный моно- или 9-10-членный бициклический алкильный радикал, в котором один или несколько атомов углерода независимо замещены на атом N, О, S, и -гетероарил(R8), который представляет собой 5-6-членную моно- или 9-10-членную бициклическую кольцевую ароматическую систему, содержащую по крайней мере один гетероатом, выбранный из N, О, S; q равно 0, 1, 2 или 3; Z выбран из группы состоящей из гидрокси, -NH2, -O-С1-8алкила, -О-С1-8алкил-O-С(O)С1-8алкила, и их фармацевтически приемлемые соли. 2. Соединение по п.1, где W представляет собой -С1-4-алкил(R1) и -C1-4алкилфенил(R1,R8). 3. Соединение по п.1, где R1 выбран из группы, состоящей из -N(R4)(R6), -дигидро-1H-пирроло[2,3-b]пиридинил(R8), -тетрагидропиримидинил(R8), -тетрагидро-1,8-нафтиридинил(R8), -тетрагидро-1H-азепино[2,3-b]пиридинил(R8) и -пиридинил(R8). 4. Соединение по п.1, где R1 выбран из группы, состоящей из -N(R4)(R6), -тетрагидропиримидинил(R8) и -тетрагидро-1,8-нафтиридинил(R8). 5. Соединение по п.1, где R6 выбран из группы, состоящей из -дигидроимидазолил(R8), -тетрагидропиридинил(R8), -тетрагидропиримидинил(R8) и -пиридинил(R8). 6. Соединение по п.1, где R8 представляет собой от одного до четырех заместителей, независимо выбранных из группы, состоящей из водорода и -С1-4алкил(R9), при присоединении к атому азота; и где R8 представляет собой от одного до четырех заместителей, независимо выбранных из группы, состоящей из водорода, -С1-4алкил(R9), -C1-4алкокси(R9), -O-арил(R10) и гидрокси, при присоединении к атому углерода. 7. Соединение по п.1, где R10 представляет собой водород. 8. Соединение по п.1, где R2 выбран из группы, состоящей из водорода, -гетероциклил(R8), -фенил(R8), -нафталенил(R8) и -гетероарил(R8). 9. Соединение по п.1, где R2 выбран из группы, состоящей из водорода, -тетрагидропиримидинил(R8), -1,3-бензодиоксолил(R8), -дигидробензофуранил(R8), -тетрагидрохинолинил(R8), -фенил(R8), -нафталенинл(R8), -пиридинил(R8), -пиримидинил(R8) и -хинолинил(R8). 10. Соединение по п.1, где q равно 1, 2 или 3. 11. Соединение формулы (I):
где W, R1, R2, q и Z выбраны из:
и его фармацевтически приемлемые соли. 12. Соединение по п.1, выбранное из группы, состоящей из: соединения формулы (I), где W представляет собой -CH2-Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-пиримидин-2-ил; R2 представляет собой Н, q равно 0, и Z представляет собой ОН; соединения формулы (1), где W представляет собой -(CH2)2-Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидропиримидин-2-ил; R2 представляет собой Н, q равно 0, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -CH2-Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-ОН-пиримидин-2-ил; R2 представляет собой -3-хинолинил, q равно 0, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(СН2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 0, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 0, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидропиримидин-2-ил; R2 представляет собой -3-пиридинил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-ОН-пиримидин-2-ил; R2 представляет собой -3-пиридинил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-ОН-пиримидин-2-ил; R2 представляет собой -(6-МеО)пиридин-3-ил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидропиримидин-2-ил; R2 представляет собой -3-хинолинил, q равно 2, и Z представляет собой ОН; соединения формулы (1), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -CH2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0, и Z представляет собой ОН; соединения формулы (I) где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-МеО) пиридин-3-ил, q равно 0 и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,4,5,6-тетрагидро-2-Ме-пиримидин-5-ил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-МеО)пиридин-3-ил, q равно 2 и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -NH-пиридин-2-ил; R2 представляет собой -(6-МеО)пиридин-3-ил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-ОН-2-пиримидинил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-МеО)пиридин-3-ил, q равно 1 и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(4-F)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(СН2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(4-F)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-Ме)пиримидин-5-ил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,3-дигидробензофуран-6-ил, q равно 1, и Z представляет собой ОН; соединения формулы (1), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3,5-F2)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3,5-F2)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-CF3)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(4-OCF3)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2, представляет собой -(3-F-4-Ph)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F-4-OMe)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(4-OPh)Ph, q равно 1 и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -4-изохинолинил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -5-дигидробензофуранил, q равно 1, и Z представляет собой ОН; соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,4-(ОМе)2-пиримид-5-ил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R2 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-ОМе)пиримидин-5-ил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-ОН-пиримидин-2-ил; R2 представляет собой -3-хинолинил, q равно 2, и Z представляет собой ОН; соединения формулы (1), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-3,4,5,6-тетрагидропиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-3,4,5,6-тетрагидропиримидин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-3,4,5,6-тетрагидропиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -Ph(3-R1); R1 представляет собой -NH-1,4,5,6-тетрагидро-5-ОН-пиримидин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2, и Z представляет собой ОН; соединение формулы (I), где W представляет собой -CH2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 2, и Z представляет собой ОН; и соединение формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2-нафталенил, q равно 1, и Z представляет собой ОН. 13. Соединение по п.12, выбранное из группы, состоящей из: соединения формулы (I), где W представляет собой -(СН2)3R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 0, и Z представляет собой ОН; соединения формулы (1), где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-МеО)пиридин-3-ил, q равно 1 и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F)Ph, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-Ме)пиримидин-5-ил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,3-дигидробензофуран-6-ил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -4-изохинолинил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 1, и Z представляет собой ОН; соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,4-(ОМе)2-пиримид-5-ил, q равно 1, и Z представляет собой ОН; и соединения формулы (I), где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-ОМе)пиримидин-5-ил, q равно 1, и Z представляет собой ОН. 14. Соединение по п.1, где W представляет собой -(СН2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 0, и Z представляет собой ОН. 15. Соединение по п.1, где W представляет собой -(CH2)3-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,3-бензодиоксол-5-ил, q равно 0, и Z равно ОН. 16. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -1,2,3,4-тетрагидро-3-хинолинил, q равно 1, и Z представляет собой ОН. 17. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(6-МеО)пиридин-3-ил, q равно 1, и Z представляет собой ОН. 18. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(3-F)Ph, q равно 1, и Z представляет собой ОН. 19. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-хинолинил, q равно 1, и Z представляет собой ОН. 20. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-Ме)пиримидин-5-ил, q равно 1, и Z представляет собой ОН. 21. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,3-дигидробензофуран-6-ил, q равно 1, и Z равно ОН. 22. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -4-изохинолинил, q равно 1, и Z представляет собой ОН. 23. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -3-пиридинил, q равно 1, и Z представляет собой ОН. 24. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,4-(ОМе)2-пиримид-5-ил, q равно 1, и Z представляет собой ОН. 25. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -(2-ОМе)пиримидин-5-ил, q равно 1, и Z представляет собой ОН. 26. Соединение по п.1, где W представляет собой -(CH2)2-R1; R1 представляет собой -5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил; R2 представляет собой -2,3-дигидробензофуран-6-ил, q равно 0, и Z представляет собой ОН. 27. Соединение формулы (I):
где W выбран из группы, состоящей из -С1-4алкил(R1) или -С0-4алкилфенил(R1,R8); R1 представляет собой -NH(R6); R2 выбран из группы, состоящей из водорода, -тетрагидропиримидинил(R8), -1,3-бензодиоксолил(R8), -дигидробензофуранил(R8), -тетрагидрохинолинил(R8), -фенил(R8), -нафталенил(R9), -пиридинил(R8), -пиримидинил(R8) или -хинолинил (R8); R6 выбран из группы, состоящей из -тетрагидропиридинил(R8), -тетрагидропиримидинил(R8) или -пиридинил(R8); R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода или -С1-4алкил(R9), если присоединен к атому азота; и, где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -С1-4алкил(R9), -С1-4алкокси(R9), -O-C6-12арил(R10) или гидрокси, если присоединен к атому углерода; R9 представляет собой водород; R10 представляет собой водород; и q равно 1, 2 или 3; Z выбран из группы состоящей из гидрокси, NH2, -О-С1-8алкила, -О-С1-8алкил-O-С(O)С1-8алкила, и его фармацевтически приемлемые соли. 28. Соединение формулы (1.2):
где W выбран из группы, состоящей из -С1-4алкил(R1) или -С0-4алкил-фенил(R1,R8); R1 выбран из группы, состоящей из -NH(R6), -тетрагидропиримидинил(R8), -тетрагидро-1,8-нафтиридинил(R8), или -пиридинил (R8); R6 выбран из группы, состоящей из -тетрагидропиридинил(R8), -тетрагидропиримидинил(R8) или -пиридинил(R8); R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода и -С1-4алкил(R9), если присоединен к атому азота; и, где R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода, -С1-4алкил(R9), -С1-4алкокси(R9), -O-С6-12арил(R10) и гидрокси, если присоединен к атому углерода; R9 представляет собой водород; R10 представляет собой водород; и q равно 1, 2 или 3; Z выбран из группы состоящей из гидрокси, -NH2, -О-С18алкила, -О-С1-8алкил-O-С(O)С1-8алкила, и его фармацевтически приемлемые соли. 29. Соединение по п.1, где R1 выбран из группы, состоящей из -NH(R6), -тетрагидропиримидинил(R8) и -тетрагидро-1,8-нафтиридинил(R8), W представляет собой -(CH2)2-R1; R2 представляет собой -(2-ОМе)пиримидин-5-ил, q равно 1, и Z представляет собой ОН. 30. Соединение формулы (1.3):
где W выбран из группы, состоящей из -С1-4алкил(R1) или -С0-4алкилфенил(R1,R8); R1 выбран из группы, состоящей из -NH(R6), -тетрагидропиримидинил(R8), -тетрагидро-1,8-нафтиридинил(R8), – или -пиридинил(R8); R2 выбран из группы, состоящей из водорода, -тетрагидропиримидинил(R8), -1,3-бензодиоксолил(R8), -дигидробензофуранил(R8), -тетрагидрохинолинил(R8), -фенил(R8), -нафталенил(R8), -пиридинил(R8), -пиримидинил(R8) и -хинолинил(R8); R6 представляет собой -тетрагидропиридинил(R8), -тетрагидропиримидинил(R8) или -пиридинил(R8); R8 представляет собой от одного до четырех заместителей, независимо выбранных из водорода и -С1-4алкил(R9), если присоединен к атому азота; и, где R8 представляет собой от одного до четырех заместителей, независимо выбранных из группы, состоящей из водорода, -С1-4алкил(R9), -C1-4алкокси(R9), -O-C6-12арил(R10) и гидрокси, если присоединен к атому углерода; и R9 представляет собой водород; R10 представляет собой водород; и Z выбран из группы состоящей из гидрокси, -NH2, -О-С1-8алкила, -О-С1-8алкил-O-С(O)С1-8алкила, и его фармацевтически приемлемые соли. 31. Соединение формулы (1.4): где R2 выбран из группы, состоящей из -1,3-бензодиоксол-5-ила, фенила, пиридин-3-ила, пиримидин-5-ила, изохинолин-4-ила, нафтален-2-ила, 5,6,7,8-тетрагидро-3-хинолинила, тетрагидрофуран-3-ила, тиофен-2-ила, -2,3-дигидро-бензо[1,4]диоксин-6-ила, -3-хинолинила, -2,3-дигидро-3-бензофуранила, -2,3-дигидро-5-бензофуранила, -1,2,3,4-тетрагидро-3-хинолинила необязательно замещенные, если есть доступные валентности, до 7 заместителями, независимо выбранными из метила, метокси или фтора, если присоединен к атому углерода; Z выбран из группы, состоящей из гидрокси, -NH2 и его фармацевтически приемлемые соли. 32. Фармацевтическая композиция, обладающая антагонистической активностью в отношении рецепторов интегрина 33. Применение соединения по п.1 для приготовления лекарственного средства, обладающего антагонистической активностью в отношении рецепторов интегрина
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 16.08.2009
Извещение опубликовано: 27.07.2010 БИ: 21/2010
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

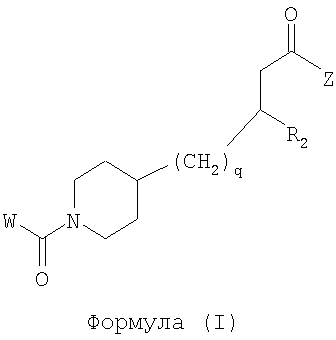
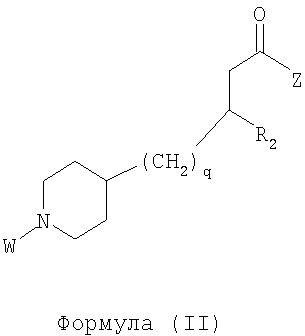
 -turn mimics with potent affinity for GPIIb-IIIa. Exploration of the Arginine Isostere.”, Bioorganic & Medicinal Chemistry Letters 2000, 10, 385-389. Valerie A.Alabaster et al “2,4-Diamino-6,7-dymethoxyquinazolines. 2.2-(4-Carbamoylpiperidino) derivatives as
-turn mimics with potent affinity for GPIIb-IIIa. Exploration of the Arginine Isostere.”, Bioorganic & Medicinal Chemistry Letters 2000, 10, 385-389. Valerie A.Alabaster et al “2,4-Diamino-6,7-dymethoxyquinazolines. 2.2-(4-Carbamoylpiperidino) derivatives as  1-adrenoceptor antagonists and antihypertensive agents.”, J. Med. Chem., 1987, 30, 999-1003. Yuji Ishihara et al “Regioselective Friedel-Crafts acylation of 2,3,4,5-tetrahydro-1H-2-benzazepine and related nitrogen heterocycles.” J. Chem. Soc. Perkin Trans. 1994, 20, 2993-2999.
1-adrenoceptor antagonists and antihypertensive agents.”, J. Med. Chem., 1987, 30, 999-1003. Yuji Ishihara et al “Regioselective Friedel-Crafts acylation of 2,3,4,5-tetrahydro-1H-2-benzazepine and related nitrogen heterocycles.” J. Chem. Soc. Perkin Trans. 1994, 20, 2993-2999.
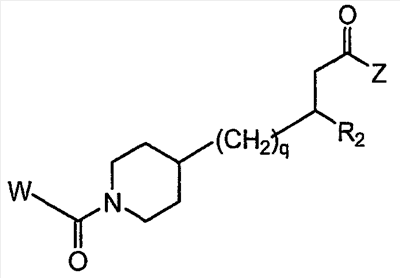
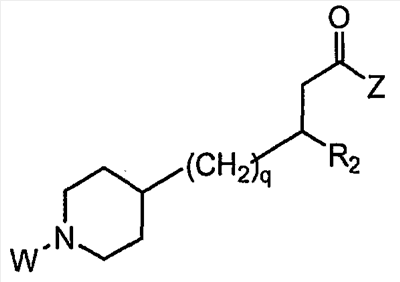
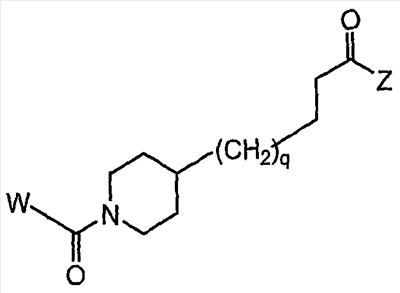
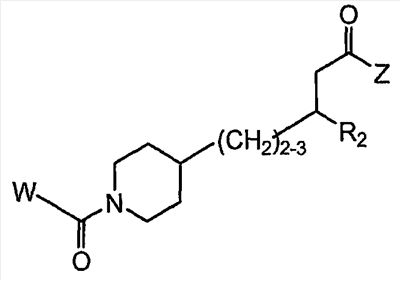
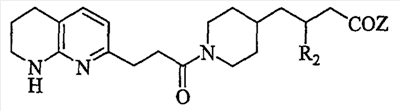
 электронную систему. В частности, к определению арил относятся конденсированные кольцевые системы, в которых один или несколько колец являются насыщенными или частично ненасыщенными. Типичные арильные группы включают, но ими не ограничиваются, антраценил, нафталенил, азуленил, бензенил и тому подобное.
электронную систему. В частности, к определению арил относятся конденсированные кольцевые системы, в которых один или несколько колец являются насыщенными или частично ненасыщенными. Типичные арильные группы включают, но ими не ограничиваются, антраценил, нафталенил, азуленил, бензенил и тому подобное.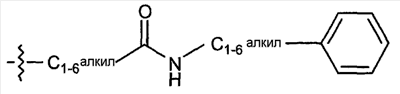
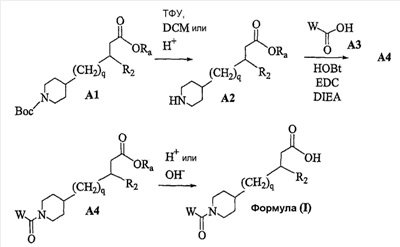
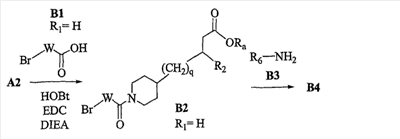
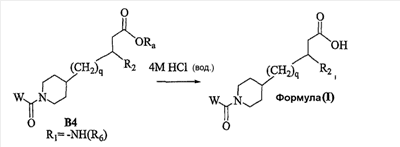

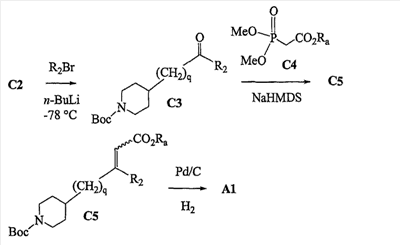
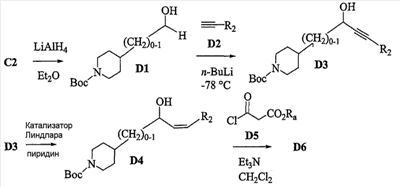
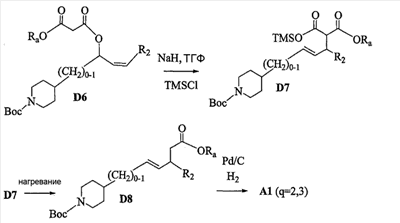
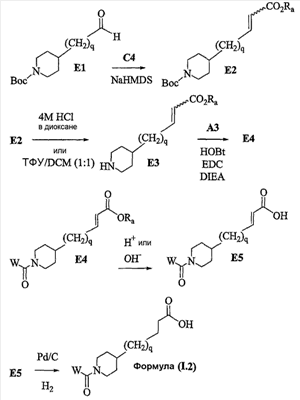
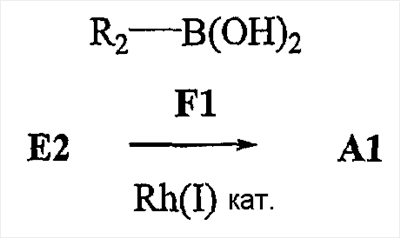
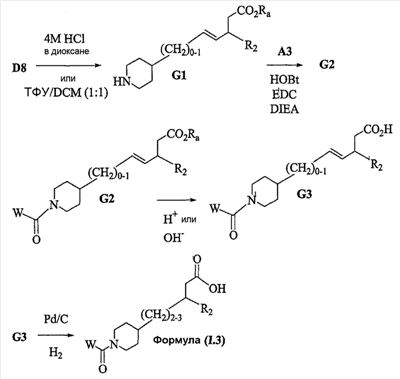
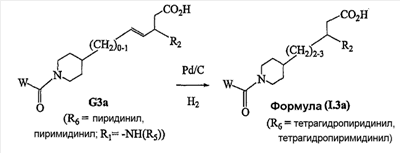
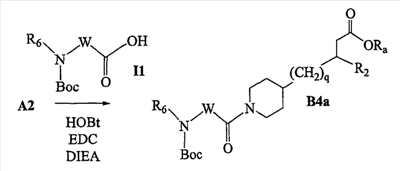
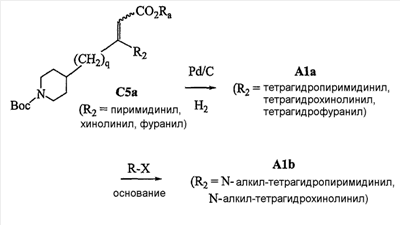
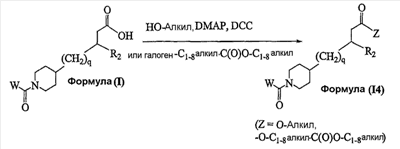

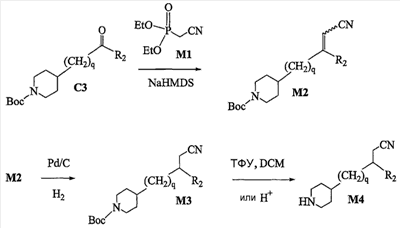
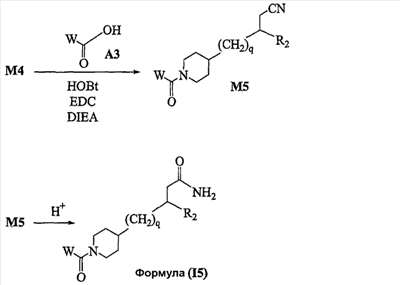
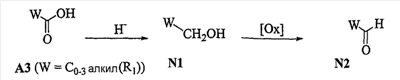
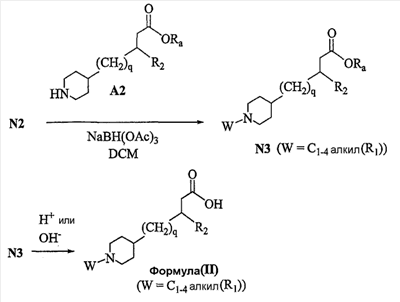
 1,89 (м, 2H), 2,61 (с, 3H), 3,61 (м, 4H), 9,56 (с, 1H).
1,89 (м, 2H), 2,61 (с, 3H), 3,61 (м, 4H), 9,56 (с, 1H).