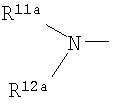Патент на изобретение №2333198
|
||||||||||||||||||||||||||||||||||||||
(54) ПРОИЗВОДНЫЕ БЕНЗАМИДА ИЛИ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ УКАЗАННОГО ПРОИЗВОДНОГО, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ
(57) Реферат:
Изобретение относится к новым соединениям формулы (I) и их фармацевтически приемлемым солям. Соединения настоящего изобретения обладают ингибирующей активностью в отношении активации рецептора VR1 и могут найти применение для профилактики или лечения боли. В общей формуле (I) L представляет собой низший алкилен, Е цикл представляет собой бензол или 5-членное гетероароматическое кольцо, содержащее атом серы в качестве гетероатома, D цикл представляет собой моноциклический или бициклический углеводородный цикл, необязательно конденсированный с С5-7циклоалкилом, 6-членный моноциклический гетероароматический цикл, содержащий атом азота в качестве гетероатома или 9-11-членный бициклический гетероароматический цикл, содержащий от 1 до 3 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и О, G цикл представляет собой 5-7-членный моноциклический насыщенный или частично насыщенный гетероцикл или 10-членный бициклический гетероцикл, содержащие от 1 до 3 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и О. Изобретение также относится к фармацевтической композиции на основе соединений изобретения, к их применению для получения профилактического или терапевтического средства против боли и к способу профилактики или лечения боли. 4 н. и 20 з.п. ф-лы, 41 табл.
Настоящее изобретение относится к новым производным бензамида или их солям, полезным в качестве лекарственных средств, особенно, в качестве ингибитора активации VR1 (ваниллоидного рецептора 1) рецептора капсаицина и лекарственных препаратов. Капсаицин, являющийся основным компонентом перца чили, представляет собой раздражающее вещество и вызывает боль путем активации VR1 рецептора капсаицина, присутствующего в первичных афферентных сенсорных нервах (в основном, С-волокнах). VR1 был клонирован [Nature 389: 816-824 (1997)] и обнаружено, что указанный рецептор представляет собой неселективный катионный канал с высокой Са2+ проницаемостью. VR1 активируется не только посредством капсаицина, но также тепловым воздействием или кислотной (протонной) стимуляцией. Кроме того, также обнаружено, что связанные с воспалением вещества, такие как АТФ и брадикинин, действуют на метаботропный рецептор и регулируют активность VR1 через активацию фосфолипазы С (PLC)/активацию протеинкиназы С (РКС). Более того, известно, что у мышей с дефицитом VR1 не только обусловленная капсаицином болевая реакция исчезает, но также снижается гипералгезия при воспалении [Nature 405: 183-187 (2000)]. На основании этих фактов можно сделать вывод, что VR1 принимает участие в болевом ощущении при различных клинических состояниях. Капсаицин вызывает боль путем активации VR1, но, как известно, и, наоборот, обладает анальгезирующим действием за счет десенсибилизации афферентных нервов в результате непрерывной активации и, таким образом, ингибирования последующей активации. На самом деле, капсаициновый крем используют для лечения невропатических болей, таких как постгерпетическая невралгия или боль при диабетической невропатии, и воспалительных болей, таких как ревматическая суставная боль. Кроме того, считается, что причина, по которой дисфункция мочевого пузыря, наблюдаемая у пациентов, таких как с повреждением спинного мозга и тому подобного, ослабляется при инъекции капсаицина или аналогичного вещества, регинифератоксина (RTX), в мочевой пузырь, основана на десенсибилизации афферентных нервов как в случае анальгезирующего действия. Не только десенсибилизация, индуцируемая агонистом VR1, но также антагонист VR1 обладает анальгезирующим действием. Установлено, что капсазепин, давно известный в качестве антагониста VR1, эффективен против невропатических болей и воспалительных болей на моделях животных [J. Pharmacol. Exp. Ther. 304: 56-62 (2003)]. Эндогенный лиганд VR1 не установлен, но сообщается о множестве перспективных соединений. Считается, что антагонист проявляет анальгезирующее действие благодаря ингибированию действия VR1 конкурентно с этими веществами. Таким образом, следует ожидать, что ингибирование активации VR1 не только приведет к анальгезирующему действию, но также обеспечит профилактику или терапию симптомов и болезней, имеющих отношение к активации VR1. Кроме того, предполагается, что соединение, обладающее ингибирующей активностью в отношении активации VR1, будет полезно при различных болях, включая невропатические боли и воспалительные боли, головных болях, таких как мигрень и гистаминовая головная боль, при зуде, заболеваниях мочевого пузыря, включающих гиперактивный мочевой пузырь и интерстициальный цистит. Недавно было успешно проведено исследование на соединениях, обладающих ингибирующей активностью в отношении активации VR1. Например, в описании международной публикации № 02/08221 (патентный документ 1) указано, что пиперазиновые производные, представленные общей формулой: где G, Q, T и W являются одинаковыми или различными и каждый означает N, CH или CR5, A отсутствует или означает O, S или тому подобное, каждый из R3 и R4 независимо означает атом водорода, атом галогена, гидрокси, амино, циано или тому подобное, R5 означает циано, гидрокси, амино или тому подобное и R9 означает атом галогена, циано, нитро или тому подобное (патентный документ 1 для уточнения символов в формуле), могут быть использованы для лечения хронических и острых болей, псориаза, недержания мочи и тому подобного в качестве рецепторного лиганда рецептора капсаицина. Далее, в описании международной публикации № 03/014064 (патентный документ 2) указано, что производные амина, представленные общей формулой: где Q означает CH или N, Y означает замещенный нафталин, R6 означает атом водорода или метил, R7 означает атом водорода или метил, X означает замещенный бензол, замещенный нафталин или тому подобное (публикацию для уточнения символов в формуле), могут быть использованы для терапии недержания мочи, гиперактивного мочевого пузыря, хронической боли, нейрогенных болей, послеоперационной боли и тому подобного. Кроме того, в описании международной публикации № 03/068749 (патентный документ 3) указано, что амидные производные, представленные общей формулой: где X и Y означают приведенную выше в таблице комбинацию, P означает фенил или гетероарил, или тому подобное, каждый из R1 и R2 означает галоген, алкил, алкокси, NR4R5 или тому подобное, R3 означает алкил, алкокси, фенил или тому подобное, который может быть замещен R2 группой, каждый из q, r и s равен 0-3 и каждый из R4 и R5 означает атом водорода, алкил, либо R4 и R5 вместе с атомом азота образуют гетероциклическое кольцо (публикацию для уточнения символов в формуле), могут быть использованы в качестве антагониста VR1 для терапии и профилактики различных болей. В заявке описаны соединения, где комбинация P и R3 означает бифенил, но, по сравнению с соединением, где бифенильный цикл содержит дополнительные заместители R3, все заместители являются низкомолекулярными группами, такими как низшие алкильные группы, галогены или замещенные алкоксигруппы. С другой стороны, описаны бифенилкарбоксамидные соединения, имеющие азотсодержащий гетероцикл, такой как хинолин или тетрагидрохинолин, на амидном азоте. Например, в описании международной публикации № 01/21577 (патентный документ 4) и международной публикации № 03/035624 (патентный документ 5) представлены тетрагидрохинолиновые производные и хинолиновые производные, соответственно, обладающие активностью против ожирения, основанной на антагонизме к MCH-рецептору. Кроме того, в описании международной публикации № 98/41508 (патентный документ 6) и в описании международной публикации № 97/48683 (патентный документ 7) представлены тетрагидроизохинолиновые производные, обладающие противосудорожной активностью. Однако все соединения ограничены соединениями, не имеющими заместителей, либо имеющими только низкомолекулярные заместители на бифенильном цикле. К тому же, отсутствует описание или предположение, касающееся ингибирующего действия в отношении активации VR1 рецептора. Как упомянуто выше, ожидается, что ингибитор активации VR1 рецептора капсаицина может служить в качестве терапевтического средства от различных болей, включая воспалительные боли и нейрогенные боли, мигрень, гистаминовую головную боль, заболевания мочевого пузыря, включающие гиперактивный мочевой пузырь, и тому подобное. Очень желательно разработать новый ингибитор активации VR1 рецептора капсаицина, отличающийся по химической структуре от вышеуказанных известных соединений и обладающий дополнительным улучшенным действием. Описание изобретения В результате обширных исследований на соединениях, обладающих ингибирующей активностью в отношении активации VR1 рецептора капсаицина, настоящими заявителями установлено, что соединение, обозначенное следующей общей формулой (I), где бензольный цикл соединен с D циклом (моноциклическое или бициклическое углеводородное кольцо или моноциклическое или бициклическое гетероароматическое кольцо) посредством амидной связи, бензольный цикл непосредственно связан с E циклом (моноциклическое или бициклическое углеводородное кольцо или моноциклическое или бициклическое гетероароматическое кольцо) и бензольный цикл дополнительно связан с A (аминогруппа, моноциклический или бициклический гетероцикл) через L (низший алкилен), обладает превосходной ингибирующей активностью в отношении активации VR1. Таким образом, настоящее изобретение было завершено. А именно, изобретение касается соединения, представленного следующей формулой (I), и соли указанного соединения, и лекарственного препарата, содержащего указанные соединения в качестве активного ингредиента. В таком контексте, изобретение включает соединения, в которых циклическая группа, обозначенная D, представляет собой азотсодержащий бициклический гетероцикл, такой как хинолин или тетрагидроизохинолин, однако, соединение отличается по химической структуре от конкретно раскрытых соединений, описанных в патентном документе 3, с той точки зрения, что бензольный цикл связан с A (аминогруппой, моноциклическим или бициклическим гетероциклом) через L (низший алкилен).
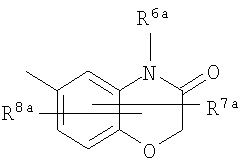
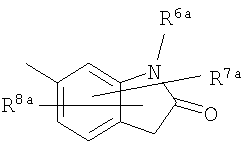
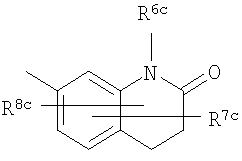
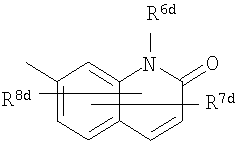
где символы имеют следующие значения: L: низший алкилен, D цикл и E цикл: одинаковые или различные, моноциклический или бициклический углеводородный цикл или 5-12-членный моноциклический или бициклический гетероароматический цикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O, G цикл: 4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O, R1-R9: одинаковые или различные, атом водорода, атом галогена, низший алкил, галогензамещенный низший алкил, -OH, -SH, -O-низший алкил, -O-низший алкил-NH-низший алкил, -O-низший алкил-N(низший алкил)2, =O, -NH2, -NH-низший алкил, -N(низший алкил)2, -S-низший алкил, -SO-низший алкил, -SO2-низший алкил, -CN, -COOH, -C(=O)-O-низший алкил, -C(=O)-NH2, -C(=O)-NH-низший алкил, -C(=O)-N(низший алкил)2, -NH-C(=O)-низший алкил, -NH-SO2-низший алкил, -SO2-NH2, -SO2-NH-низший алкил, -C(=O)-низший алкил, -NO2 или азотсодержащий насыщенный гетероцикл, R10: атом водорода или низший алкил, R11-R15: одинаковые или различные, атом водорода, атом галогена, низший алкил, галогензамещенный низший алкил, -OH, -O-низший алкил, -S-низший алкил, -SO-низший алкил, -SO2-низший алкил, =O, -C(=O)H, -C(=O)-низший алкил, -COOH, -CN, -NH2, -NH-низший алкил, -N(низший алкил)2, -C(=O)-NH2, -C(=O)-NH-низший алкил, -C(=O)-N(низший алкил)2, -C(=O)-арил, -C(=O)-NH-арил, -NH-C(=O)-низший алкил, -NH-C(=O)-арил, -NH-SO2-низший алкил, -N(низший алкил)-SO2-низший алкил, -низший алкилен-NH-SO2-низший алкил, -низший алкилен-NH-SO2-арил, -C(=O)-O-низший алкил, -низший алкилен-OH, -низший алкилен-C(=O)-NH-низший алкил, -низший алкилен-C(=O)-N(низший алкил)2, -низший алкилен-C(=O)-NH2, -низший алкилен-C(=O)-OH, -низший алкилен-O-низший алкил, -низший алкилен-S-низший алкил, -низший алкилен-O-C(=O)-низший алкил, -низший алкилен-NH-низший алкил, -низший алкилен-N(низший алкил)2, -низший алкилен-арил, циклоалкил, арил, -(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -O-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -низший алкилен-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -C(=O)-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -низший алкилен-N(низший алкил)-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), или -C(=O)-NH-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O) и вышеуказанный моноциклический или бициклический гетероцикл может иметь заместители, выбираемые из группы, включающей атом(ы) галогена(ов), низший алкил(ы), -O-низший алкил или -OH, и те же значения использованы далее, либо соль указанного соединения. [2] Соединение по приведенному выше п.[1], где символы, обозначенные D, E, R1-R9 и R11-R15 в приведенной выше формуле (I), имеют следующие значения: D цикл и E цикл: одинаковые или различные, бензольный цикл, нафталиновый цикл или 5-12-членный моноциклический или бициклический гетероароматический цикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O, R1-R9: одинаковые или различные, атом водорода, атом галогена, низший алкил, галогензамещенный низший алкил, -OH, -SH, -O-низший алкил, -O-низший алкил-NH-низший алкил, -O-низший алкил-N(низший алкил)2, =O, -NH2, -NH-низший алкил, -N(низший алкил)2, -S-низший алкил, -SO-низший алкил, -SO2-низший алкил, -CN, -COOH, -C(=O)-NH2, -C(=O)-NH-низший алкил, -C(=O)-N(низший алкил)2 или -NH-C(=O)-низший алкил, R11-R15: одинаковые или различные, атом водорода, атом галогена, низший алкил, галогензамещенный низший алкил, -OH, -O-низший алкил, -S-низший алкил, -SO-низший алкил, -SO2-низший алкил, =O, -C(=O)H, -C(=O)-низший алкил, -COOH, -CN, -NH2, -NH-низший алкил, -N(низший алкил)2, -C(=O)-NH2, -C(=O)-NH-низший алкил, -C(=O)-N(низший алкил)2, -C(=O)-арил, -C(=O)-NH-арил, -NH-C(=O)-низший алкил, -NH-C(=O)-арил, -NH-SO2-низший алкил, -N(низший алкил)-SO2-низший алкил, -C(=O)-O-низший алкил, -низший алкилен-O-низший алкил, -низший алкилен-NH-низший алкил, -низший алкилен-N(низший алкил)2, -низший алкилен-арил, циклоалкил, арил, 4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O, -низший алкилен-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -С(=O)-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -низший алкилен-N(низший алкил)-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O) или -C(=O)-NH-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O). В качестве предпочтительного варианта осуществления изобретения может быть упомянуто соединение, отвечающее п.[3], соединения, отвечающие пп.[4]-[9], представляют собой более предпочтительные варианты осуществления, и соединение, отвечающее п.[10], представляет в особенности предпочтительный вариант осуществления изобретения. [3] Соединение по приведенному выше п.[1], где цикл, обозначенный E в указанной выше формуле (I), означает бензольный или тиофеновый цикл, более предпочтительно, бензольный цикл. [4] Соединение по приведенному выше п.[3], где компонент, обозначенный A в указанной выше формуле (I), отвечает следующей формуле: [4a] Более предпочтительно, соединение по приведенному выше п.[4], где цикл, обозначенный G в указанной выше формуле (I), означает азотсодержащий насыщенный гетероцикл, более предпочтительно, цикл, выбираемый из группы, включающей тетрагидропиридин, тетрагидрохинолин, тетрагидроизохинолин, пиперидин, пирролидин, морфолин, азепан и 1,4-оксазепан, и азотный атом цикла связан с L. [4b] Более предпочтительно, соединение по приведенному выше п.[4], где цикл, обозначенный G в указанной выше формуле (I), выбирают из группы, включающей морфолин, пиперидин и пирролидин, и азотный атом цикла связан с L. [4c] Более предпочтительно, соединение по приведенному выше п.[4], где цикл, обозначенный D в указанной выше формуле (I), выбирают из группы, включающей бензотиазол, хинолин, изохинолин, индолин, тетрагидрохинолин, тетрагидроизохинолин, 3,4-дигидро-2H-1,4-бензоксазин, дигидрохинолин и дигидроизохинолин. [4d] Более предпочтительно, соединение по приведенному выше п.[4], еще предпочтительнее, по приведенному выше п.[4a], еще предпочтительнее, по приведенному выше п.[4b], где цикл, обозначенный D в указанной выше формуле (I), вместе с присоединенными группами, обозначенными R6-R9, образует группу, выбираемую из следующих формул: где символы имеют следующие значения: R6a и R6b: одинаковые или различные, атом водорода, низший алкил или галогензамещенный низший алкил и R7a, R8a, R7b и R8b: одинаковые или различные, атом водорода, атом галогена, низший алкил или галогензамещенный низший алкил. Либо, соединение по приведенному выше п.[4], еще предпочтительнее, по приведенному выше п.[4a], еще предпочтительнее, по приведенному выше п.[4b], где цикл, обозначенный D в указанной выше формуле (I), вместе с присоединенными группами, обозначенными R6-R9, образует группу, выбираемую из следующих формул: где символы имеют следующие значения: R6c и R6d: одинаковые или различные, атом водорода, низший алкил или галогензамещенный низший алкил и R7c, R8c, R7d и R8d: одинаковые или различные, атом водорода, атом галогена, низший алкил или галогензамещенный низший алкил. [4e] Соединение по приведенному выше п.[4], где, по меньшей мере, одна из групп, обозначенных R13-R15, означает атом галогена, низший алкил, галогензамещенный низший алкил, -OH, -O-низший алкил, -NH2, -N(низший алкил)2, -C(=O)-NH2, -C(=O)-N(низший алкил)2, -NH-C(=O)-низший алкил, -C(=O)-O-низший алкил, -низший алкилен-O-низший алкил, арил, -(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O) или -низший алкилен-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), а остальные означают атом водорода. Более предпочтительно, соединение по приведенному выше п.[4], где, по меньшей мере, один из символов, обозначенных R13-R15, означает низший алкил, -O-низший алкил, -N(низший алкил)2, -(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O) или -низший алкилен-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), а другие означают атом водорода. [5] Соединение по приведенному выше п.[3], где группа, обозначенная A в указанной выше формуле (I), имеет следующую формулу:
где символы имеют следующие значения: R11a и R12a: одинаковые или различные, атом водорода, низший алкил, галогензамещенный низший алкил, -O-низший алкил, -SO2-низший алкил, -C(=O)H, -C(=O)-низший алкил, -CN, -NH2, -NH-низший алкил, -N(низший алкил)2, -C(=O)-NH2, -C(=O)-NH-низший алкил, -C(=O)-N(низший алкил)2, -C(=O)-арил, -C(=O)-NH-арил, -NH-C(=O)-низший алкил, -NH-C(=O)-арил, -NH-SO2-низший алкил, -N(низший алкил)-SO2-низший алкил, -низший алкилен-NH-SO2-низший алкил, -низший алкилен-NH-SO2-арил, -C(=O)-O-низший алкил, -низший алкилен-OH, -низший алкилен-C(=O)-NH-низший алкил, -низший алкилен-C(=O)-N(низший алкил)2, -низший алкилен-C(=O)-NH2, -низший алкилен-C(=O)-OH, -низший алкилен-O-низший алкил, -низший алкилен-S-низший алкил, -низший алкилен-O-C(=O)-низший алкил, -низший алкилен-NH-низший алкил, -низший алкилен-N(низший алкил)2, -низший алкилен-арил, циклоалкил, арил, -(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -O-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -низший алкилен-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -C(=O)-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), -низший алкилен-N(низший алкил)-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O) или -C(=O)-NH-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O), и вышеуказанный моноциклический или бициклический гетероцикл может быть замещен группами, выбираемыми из группы, включающей атом(ы) галогена, низший алкил(ы), -O-низший алкил или -OH. [5a] Соединение по приведенному выше п.[5], где R11a означает низший алкил и R12a означает группу, выбираемую из группы, включающей -низший алкилен-O-низший алкил, -низший алкилен-S-низший алкил, -низший алкилен-NH-низший алкил, -низший алкилен-N(низший алкил)2, -низший алкилен-OH, -низший алкилен-C(=O)-NH-низший алкил, -низший алкилен-C(=O)-N(низший алкил)2, -низший алкилен-арил, циклоалкил, арил, -(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O) и -низший алкилен-(4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O). [5b] Более предпочтительно, соединение по приведенному выше п.[5], где цикл, обозначенный D в указанной выше формуле (I), означает цикл, выбираемый из группы, включающей бензотиазол, хинолин, изохинолин, индолин, тетрагидрохинолин, тетрагидроизохинолин, 3,4-дигидро-2H-1,4-бензоксазин, дигидрохинолин и дигидроизохинолин. [5c] Более предпочтительно, соединение по приведенному выше п.[5], еще предпочтительнее, соединение по приведенному выше п.[5a], где цикл, обозначенный D в указанной выше формуле (I), вместе с присоединенными группами, обозначенными R6-R9, образует группу, выбираемую из следующих формул: где символы имеют следующие значения: R6a и R6b: одинаковые или различные, атом водорода, низший алкил или галогензамещенный низший алкил и R7a, R8a, R7b и R8b: одинаковые или различные, атом водорода, атом галогена, низший алкил или галогензамещенный низший алкил. Либо, соединение по приведенному выше п.[5], более предпочтительно соединение по приведенному выше п.[5b], где цикл, обозначенный D в указанной выше формуле (I), вместе с присоединенными группами, обозначенными R6-R9, образует группу, выбираемую из следующих формул: где символы имеют следующие значения: R6c и R6d: одинаковые или различные, атом водорода, низший алкил или галогензамещенный низший алкил и R7c, R8c, R7d и R8d: одинаковые или различные, атом водорода, атом галогена, низший алкил или галогензамещенный низший алкил. [6] Соединение по приведенному выше п.[1], где R1-R5 являются одинаковыми или различными и каждый означает атом водорода, галоген, галогензамещенный низший алкил, низший алкил, -N(низший алкил)2 или -O-низший алкил. [7] Соединение по приведенному выше п.[1], где R6-R9 являются одинаковыми или различными и каждый означает атом водорода, атом галогена, низший алкил, галогензамещенный низший алкил, -OH, -O-низший алкил, =O, -NH-низший алкил, -N(низший алкил)2, -CN, -C(=O)-NH2, -NH-SO2-низший алкил, -SO2-NH2, -C(=O)-низший алкил, -NO2 или азотсодержащий насыщенный гетероцикл, более предпочтительно, атом водорода, галоген, галогензамещенный низший алкил, низший алкил, -OH, =O, -N(низший алкил)2 или -SO2-NH2. Еще предпочтительнее соединение по приведенному выше п.[1], где R6-R8 являются одинаковыми или различными и каждый означает атом водорода, атом галогена, низший алкил или галогензамещенный низший алкил и R9 означает =O. [8] Соединение по приведенному выше п.[1], где R10 в указанной выше формуле (I) означает атом водорода. [9] Соединение по приведенному выше п.[1], где группа, обозначенная L, означает метилен или этилен, более предпочтительно метилен. [10] Соединение по приведенному выше п.[1] или соль указанного соединения, где бензамидное производное, представленное вышеуказанной формулой (I), означает, по меньшей мере, одно соединение, выбираемое из группы, включающей N-1,3-бензотиазол-5-ил-2-{[циклогексил(изопропил)амино]метил}бифенил-4-карбоксамид, N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, N-(3,3-диметил-2-оксо-2,3-дигидро-1H-индол-6-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, 2-{[этил-(2-гидрокси-2-метилпропил)амино]метил}-N-(2-метил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)бифенил-4-карбоксамид, N-(1-метил-2-оксо-1,2-дигидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, N-(3-метил-2-оксо-1,2-дигидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, N-(2,4-диметил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, 2-{[этил(тетрагидро-2H-пиран-4-ил)амино]метил}-N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)бифенил-4-карбоксамид, N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-3-(пиперидин-1-илметил)-4-(2-тиенил)бензамид, 2-{[этил(тетрагидро-2H-тиопиран-4-ил)амино]метил}-N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)бифенил-4-карбоксамид, 2-{[изобутил-(2-пиперидин-1-илэтил)амино]метил}-N-(2-метил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)бифенил-4-карбоксамид, N,N-диэтил-4-[(4-{[(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)амино]карбонил}бифенил-2-ил)метил]морфолин-3-карбоксамид и 2-[(4-метил-1,3′-бипиперидин-1′-ил)метил]-N-(2-метил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)бифенил-4-карбоксамид. Кроме того, изобретение касается фармацевтической композиции, содержащей бензамидное производное, обозначенное вышеуказанной формулой (I), или соль указанного соединения и фармацевтически приемлемый носитель. Предпочтительно, вышеуказанной фармацевтической композиции, являющейся ингибитором активации VR1, и, более предпочтительно, вышеуказанной фармацевтической композиции, являющейся профилактическим или терапевтическим средством против боли. Кроме того, другие варианты осуществления включают применение бензамидного производного, обозначенного вышеуказанной формулой (I), по пп.[1]-[10] или соли указанного соединения для промышленного получения профилактического или терапевтического средства против боли и способ профилактики или терапии боли, включающий введение эффективного количества бензамидного производного, обозначенного вышеуказанной формулой (I), по пп.[1]-[10] или соли указанного соединения. Далее изобретение описано более подробно. Используемый в описании термин “ингибитор активации VR1 рецептора капсаицина” – общее название как соединений (антагонист VR1), связывающих VR1 рецептор и ингибирующих активацию VR1 посредством конкуренции с эндогенным лигандом, так и соединений (агонист VR1), десенсибилизирующих нервы, в случае наличия рецептора, и ингибирующих последующую активацию посредством непрерывной активации рецептора VR1. В качестве “ингибитора активации VR1” предпочтителен антагонист VR1. В определении приведенной в описании общей структурной формулы, если не оговорено особо, термин “низший” означает линейную или разветвленную углеродную цепь с 1-6 атомами углерода. Таким образом, “низший алкил” предпочтительно означает алкил с 1-5 атомами углерода, и в особенности предпочтительными являются метил, этил, пропил, изопропил, бутил, изобутил и 1,2-диметилпропил. В качестве “низшего алкилена” предпочтительны линейные алкилены, такие как метилен, этилен, пропилен и бутилен, и разветвленные алкилены, такие как метилметилен. В особенности предпочтительны метилен и этилен. “Атом галогена” включает атомы фтора, хлора, брома и йода. В особенности предпочтительны атом фтора и атом хлора. “Галогензамещенный низший алкил” означает группу, где вышеуказанный низший алкил замещен 1-3 галогенами, которые являются одинаковыми или различными. В особенности предпочтителен трифторметил. В качестве “моноциклического или бициклического углеводородного цикла” могут быть упомянуты бензол, нафталин, циклоалкильные циклы с 3-8 членами в цикле, циклоалкенильные циклы с 4-8 членами в цикле и арильные циклы, конденсированные с насыщенными углеводородными циклами, где циклоалкильный или циклоалкенильный цикл конденсирован с бензолом. Предпочтительными являются бензол, нафталин, индан и тетрагидронафталин. “Арил” означает арил, содержащий 6-14 атомов углерода и более предпочтительны фенил или нафтил. “Циклоалкил” предпочтительно означает циклоалкильную группу с 3-10 атомами углерода, которая может содержать мостиковую связь (связи), и более предпочтительными являются группы: циклопропил, циклопентил, циклогексил, циклогептил и адамантил. “Азотсодержащий насыщенный гетероцикл” означает 5-8-членный насыщенный или частично ненасыщенный моноциклический гетероцикл, который содержит один атом N и может дополнительно содержать один гетероатом, выбираемый из N, S и O, и предпочтительными являются пирролидиновый, пиперидиновый, пиперазиновый, азепановый, диазепановый, морфолиновый, тиоморфолиновый и тетрагидропиридиновый циклы. “5-12-членный моноциклический или бициклический гетероароматический цикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O” означает 5-6-членный моноциклический гетероароматический цикл, содержащий от 1 до 4 атомов гетероатомов, выбираемых из группы, включающей N, S и O, и бициклическую гетероарильную группу, где указанный моноциклический гетероароматический цикл конденсирован с бензольным циклом или 5-6-членным моноциклическим гетероароматическим циклом. Указанные циклы могут быть частично насыщенными. Причем, в случае, когда N атом или S атом включен в атомы цикла, атом может образовывать оксид или диоксид. В качестве 5-6-членного моноциклического гетероароматического цикла предпочтительны циклы: пиридин, пиримидин, пиразин, пиридазин, триазин, пиррол, фуран, тиофен, тиазол, имидазол, оксазол, изотиазол, пиразол, изозазол, тиадиазол, триазол и тетразол. В качестве бициклического гетероцикла предпочтительны циклы: бензотиазол, бензоизотиазол, бензоксазол, бензизоксазол, бензимидазол, бензотриазол, бензотиадиазол, бензоксадиазол, хинолин, изохинолин, нафтилидин, хиноксалин, хиназолин, фталазин, циннолин, индол, индазол, имидазопиридин, бензотиофен, бензотиофен-1,1-диоксид, бензофуран, дигидробензофуран, дигидро-1,3-бензоксазол, дигидро-1,3-бензотиазол, 1,3-бензодиоксол, бензазепин, бензодиазепин, бензоксазин, тетрагидробензоксазепин, тетрагидробензазепин, тетрагидрохинолин, тетрагидроизохинолин, тетрагидронафтопиридин, тетрагидрохиноксалин, хроман, дигидробензодиоксин, 3,4-дигидро-2H-1,4-бензотиазин, дигидробензотиазол, 3,4-дигидро-2H-1,4-бензоксазин, изохроман, индолин и птеридин. Более предпочтительными являются циклы: пиридин, бензотиазол, бензоксазол, хинолин, изохинолин, дигидрохинолин, дигидроизохинолин, индолин, тетрагидрохинолин, тетрагидроизохинолин, бензотиофен, 3,4-дигидро-2H-1,4-бензоксазин, 3,4-дигидро-2H-1,4-бензотиазин и дигидро-1,3-бензоксазол. “4-12-членный моноциклический или бициклический гетероцикл, содержащий от 1 до 4 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и O” означает, в дополнение к вышеуказанным моноциклическим или бициклическим гетероароматическим циклам, 4-8-членный насыщенный или частично ненасыщенный моноциклический гетероцикл и бициклический гетероцикл, полученный конденсацией указанного цикла с циклоалкильным циклом, циклоалкенильным циклом или насыщенным или частично ненасыщенным моноциклическим гетероциклом. Предпочтительными являются насыщенные или частично ненасыщенные моноциклические гетероциклы, такие как пирролидин, имидазолидин, пиразолидин, хинуклидин, пиперидин, пиперазин, морфолин, тиоморфолин, тиоморфолин-1,1-диоксид, азепан, азоцан (октагидроазоцин), 1,4-озазепан, азетидин, 1,2,3,6-тетрагидропиридин и имидазолин, и насыщенные или частично ненасыщенные бициклические гетероциклы, такие как декагидрохинолин и декагидроизохинолин. Более предпочтительны азотсодержащие насыщенные гетероциклы и, еще предпочтительнее, циклы: пирролидин, пиперидин, пиперазин и морфолин. В случае, когда заместитель обозначен как R7a или R8a в приведенной ниже формуле, это означает, что заместитель может быть связан с атомом углерода на любом, как левом, так и правом, циклах. Кроме того, среди соединений по изобретению присутствуют геометрические изомеры, таутомеры и оптические изомеры в зависимости от вида заместителей. Изобретение охватывает смеси таких изомеров и отдельные изомеры. В некоторых случаях соединения по изобретению образуют кислотно-аддитивные соли. Также, в ряде случаев указанные соединения образуют соли с основаниями. В частности, такие соли включают аддитивные соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; или с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, аспарагиновая кислота и глутаминовая кислота; соли с неорганическими основаниями, такие как соли натрия, калия, магния, кальция и алюминия; с органическими основаниями, такими как метиламин, этиламин, этаноламин, лизин и орнитин; соли аммония и тому подобное. Кроме того, изобретение охватывает гидраты соединений по изобретению, фармацевтически приемлемые различные сольваты, соединения, обладающие кристаллическим полиморфизмом, и тому подобное. Соединения по изобретению также включают соединения, способные превращаться в процессе обмена веществ в живом организме в соединение, представленное приведенной выше общей формулой (I), или в соли указанного соединения, так называемые пролекарства. Группы, образующие пролекарства соединений по изобретению, представляют собой группы, описанные в Prog. Med. 5:2157-2161 (1985), и группы, описанные в “Iyakuhinn no Kaihatsu (Development of Medicines) published by Hirokawa Shoten, 1990, Vol.7, Bunshi Sekkei (Molecular Design), pp.163-198. Способы получения Далее описаны характерные способы получения соединений по изобретению. В связи с этим, при осуществлении следующего способа получения, в зависимости от типа функциональных групп, иногда технически эффективно заменять функциональные группы подходящими защитными группами на стадии исходных материалов или промежуточных соединений, т.е. группами, способными легко превращаться в функциональные группы. После чего защитные группы могут быть удалены по мере необходимости, что приводит к получению требуемого соединения. В качестве таких функциональных групп могут служить, например, аминогруппа, гидроксильная группа, карбоксильная группа и тому подобные. В качестве таких защитных групп могут быть упомянуты защитные группы, описанные в Protective Groups in Organic Synthesis 3rd edition (written by T. W. Green and P. G. M. Wuts, published by JOHN WILLY & SONS, INC), которые могут быть соответственно использованы в зависимости от реакционных условий. Способ, описанный в указанной ссылке, может быть применен для введения и удаления защитных групп. Способ получения 1 Способ получения 1 представляет собой реакцию синтеза соединения (I) путем реакции конденсации карбоновой кислоты и амина с использованием соединения (II) и соединения (III). Рассматриваемое взаимодействие может быть осуществлено согласно общепринятому способу при использовании соединения (II) и производного амина (III) в эквимолярных количествах или при избытке одного из указанных соединений, в присутствии конденсирующего агента. В качестве конденсирующего агента удобно применять N,N-дициклогексилкарбодиимид (DCC), 1-этил-3-[3-(N,N-диметиламино)пропил]карбодиимид, O-бензотриазол-1-ил-N,N,N’,N’-тетраметилуронийгексафторфосфат (HBTU), карбонилдиимидазол, дифенилфосфорилазид (DPPA), диэтилфосфорилцианид или тому подобное. Такие конденсирующие агенты используют в эквимолярном количестве или при избыточном количестве карбоновой кислоты. В качестве растворителя может быть использован растворитель, который не принимает участия во взаимодействии, N,N-диметилформамид (ДМФА), диоксан, тетрагидрофуран, диэтиловый эфир, дихлорэтан, дихлорметан, хлороформ, четыреххлористый углерод, диметоксиметан, диметоксиэтан, этилацетат, бензол, ацетонитрил, диметилсульфоксид или смешанный растворитель на основе указанных растворителей, и растворитель обычно выбирают в соответствии с используемой методикой. Кроме того, в зависимости от используемой методики взаимодействие может протекать легче при осуществлении реакции в присутствии основания, такого как N-метилморфолин, триэтиламин, триметиламин, пиридин или 4-диметиламинопиридин, или при использовании основания в качестве растворителя. Обычно указанное взаимодействие осуществляют в диапазоне температур от условий охлаждения до комнатной температуры, но иногда предпочтительно осуществлять взаимодействие при повышенной температуре, в зависимости от типа реакции ацилирования. Кроме того, соединение (I) может также быть получено способом, включающим введение карбоновой кислоты в активное производное и последующей конденсацией полученного продукта с амином. В этом случае взаимодействие проводят, используя соединение (II) и производное амина (III) в эквимолярных количествах или при избытке одного из указанных соединений. В качестве активного производного карбоновой кислоты может быть упомянут активный сложный эфир, полученный взаимодействием кислоты с фенольным соединением, таким как п-нитрофенол, или N-гидроксиаминовым соединением, таким как 1-гидроксисукцинимид, или 1-гидроксибензотриазолом, моноалкилкарбонатом, смешанный ангидрид, полученный при взаимодействии с органической кислотой, смешанный ангидрид фосфатного типа, полученный при взаимодействии с дифенилфосфорилхлоридом и N-метилморфолином, азид кислоты, полученный последующим взаимодействием сложного эфира с гидразином и алкилнитритом, галогенангидрид, такой как хлорангидрид или бромангидрид и симметричный ангидрид. Взаимодействие осуществляют, используя реагент активации в эквимолярном количестве по отношению к соединению (II) или в избыточном количестве по отношению к указанному соединению. Реакционные условия в этом случае соответствуют условиям, используемым в случае применения конденсирующего агента. Кроме того, другие взаимодействия, отличные от указанных выше, могут быть использованы в случае, если приводят к образованию амидных связей. Способ получения 2 где X означает уходящую группу, такую как -Cl, -Br, -I, метансульфонилокси или толуолсульфонилокси, и то же самое применимо в дальнейшем. Способ получения 2 представляет собой реакцию синтеза соединения (I) по реакции нуклеофильного замещения с использованием соединения (IV) и аминного соединения A-H. Данное взаимодействие осуществляют, используя соединение (IV) и A-H в эквимолярных количествах, или при избытке одного из указанных соединений, в диапазоне температур от условий охлаждения льдом до повышенной температуры, добавляя основание (предпочтительно, карбонат калия, карбонат натрия, гидрокарбонат натрия, трет-бутилат калия, триэтиламин, пиридин, N-метилморфолин, гидроксид натрия), применяя в качестве растворителя растворитель, указанный в способе получения 1. В случае, когда соединения (I) по изобретению содержат различные боковые цепи и функциональные группы, эти соединения легко могут быть синтезированы с использованием в качестве исходных материалов соединений по изобретению или получаемых промежуточных соединений посредством взаимодействий, очевидных для специалиста в данной области, либо соответствующих видоизмененных методик. В качестве таких примеров может быть упомянута конверсия любого из заместителей R1-R9 соединения (I), полученного способом получения 1, или превращение по введению указанного заместителя заново. Например, могут быть использованы следующие взаимодействия. Соединение, где любой из заместителей R1-R9 в формуле (I) означает -SO2-NH2 или CO-NH2, может быть получен с применением соединения, где каждый из соответствующих заместителей R1-R9 означает -SO3H или CO2H. Взаимодействие осуществляют путем конденсации -SO3H или CO2H на R1-R9 с аммиаком в тех же условиях, что и условия, отвечающие первой реакции получения. Кроме того, соединение, где цикл D в формуле (I) представляет собой насыщенный цикл и любой из заместителей R1-R9 в формуле (I) означает -OH, может быть получен с использованием соединения, где присутствующий заместитель означает карбонильную группу, с применением общепринятой методики для реакции восстановления. Например, взаимодействие может быть осуществлено согласно методике, описанной в Tetrahedron, 35, 567-607 (1979). Кроме того, соединение, где цикл D или цикл E представляет собой гетероцикл и гетероатом в цикле окислен до оксида, может быть синтезировано путем окисления гетероатома с использованием методики для реакции окисления. Взаимодействие может быть осуществлено согласно методике, описанной в J. Hetrocycl. Chem. 19, 237-240, (1982), J. Chem. Soc. Perkin Trans. 1, 1949-1955, (1984). Способ получения исходных материалов Далее описаны характерные способы получения исходных материалов, указанных в способе получения 1 и способе получения 2. (1) Исходное соединение (II) Стадии получения исходного материала (II) для способа получения 1 охватывают с первой стадии по одиннадцатую стадию. где один из U и Q означает -Br, -Cl, -I или -O-SO2-CF3, а другой означает -B(OH)2 или -B(O-низший алкил)2, P1 означает защитную группу для карбоксила, такую как метильная группа, этильная группа, бензильная группа или трет-бутильная группа, и X1 означает -Cl, -Br или -I, и то же самое применимо в дальнейшем. Вначале, первой стадией является стадия получения соединения (VII) по реакции перекрестного сочетания с использованием соединения (V) и соединения (VI). Взаимодействие может быть осуществлено согласно методике, описанной в Synth. Commun., 11, 513-519 (1981), Synlett 2000, № 6, 829-831 и Chem. lett., 1989, 1405-1408. Второй стадией является стадия получения (VIII) путем обработки соединения (VII) галогенирующим агентом. Взаимодействие осуществляют в интервале температур от комнатной температуры до температуры кипения при нагревании с обратным холодильником, используя N-бромсукцинимид (NBS), бром, сульфурилхлорид или бромид меди в качестве галогенирующего агента, в растворителе, таком как четыреххлористый углерод, хлороформ или бензол, при добавлении бензоилпероксида, 2,2′-азобисизобутиронитрила, трет-бутилгидропероксида или тетракистрифенилфосфинпалладия или при облучении светом, по необходимости. Третья стадия представляет собой стадию получения соединения (IXa) путем удаления защитной группы P1 соединения (VIII) и одновременного гидролиза группы X1. Данное взаимодействие может быть осуществлено с использованием общепринятой методики для основного гидролиза галогенидов. Однако, в случае, когда защитная группа не снята посредством гидролиза с основанием, после гидролиза X1 группы соединения (VIII), реакция по снятию защитной группы может быть проведена путем гидролиза с кислотой, такой как хлористоводородная кислота или трифторуксусная кислота, или путем восстановления, такого как каталитическое гидрирование. Могут быть использованы условия взаимодействия, описанные в вышеупомянутом “Protective Groups in Organic Synthesis”. Четвертой стадией является стадия получения соединения (X) по реакции окисления соединения (VIII). Взаимодействие осуществляют, используя окисляющий агент, такой как N-метилморфолин-N-оксид, триметиламин-N-оксид, натриевая соль 2-нитропропана, описанный в J. Am. Chem. Soc., 71, 1767-1769 (1949), или нитрат серебра, в растворителе, таком как ацетонитрил или этанол, в условиях температур от охлаждения льдом до температуры кипения с обратным холодильником. Пятая стадия представляет собой стадию получения соединения (XI) из соединения (X). Взаимодействие осуществляют, используя (метоксиметил)трифенилфосфонийхлорид, (метоксиметил)трифенилфосфонийбромид или тому подобное в качестве реагирующего вещества, в присутствии основания, такого как н-бутиллитий, втор-бутиллитий, гидрид натрия, или трет-бутилат калия, в растворителе, таком как тетрагидрофуран, диэтиловый эфир или циклопентилметиловый эфир, при интервале температур от -78°C до повышенной температуры. Шестая стадия представляет собой стадию получения соединения (XIIa) посредством конденсации соединения (XI) с A-H по реакции восстановительного аминирования. Взаимодействие осуществляют, используя триацетоксиборгидрид натрия, боргидрид натрия или тому подобное в качестве восстанавливающего агента, при добавлении органической кислоты (предпочтительно, уксусной кислоты, муравьиной кислоты или п-толуолсульфоновой кислоты), кислоты Льюиса, такой как соль металла (предпочтительно, тетраизопропоксититан), по необходимости. Взаимодействие осуществляют, используя растворитель, такой как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод или тетрагидрофуран, в интервале температур от охлаждения льдом до повышенной температуры. Седьмая стадия и восьмая стадия представляют собой стадии получения соединений (XIIIa) и (XIIIb) путем восстановления формильной группы соединений (X) и (XI), соответственно. Взаимодействие может быть осуществлено согласно методике, описанной в Tetrahedron, 35, 567-607 (1979). Девятая стадия представляет собой стадию получения соединения (XIVa) путем галогенирования гидроксильной группы соединения (XIIIb) или путем превращения указанной группы в эфир сульфокислоты. Галогенирование осуществляют, используя галогенангидрид (предпочтительно, тионилхлорид, трихлорид фосфора, пентахлорид фосфора, оксихлорид фосфора или трибромид фосфора и т.д.) или используя трифенилфосфин и четыреххлористый углерод, трифенилфосфин и тетрабромид углерода или тому подобное. Конверсию до эфира сульфокислоты осуществляют путем обработки с помощью метансульфонилхлорида или п-толуолсульфонилхлорида в присутствии основания (предпочтительно, триэтиламина, пиридина или карбоната калия). Указанное превращение осуществляют, используя дихлорэтан, метиленхлорид, хлороформ, диоксан или гексан в качестве растворителя, в интервале температур от охлаждения льдом до нагревания до температуры кипения с обратным холодильником. К тому же, при обработке полученного хлорида, бромида или эфира сульфокислоты с помощью иодида натрия, иодида калия или тому подобного, может быть также получен иодид. В качестве растворителя в этом случае используют ацетон, 2-бутанон, этанол или тому подобное. Использование тех же реакционных условий, что и на девятой стадии, к соединению (XIIIa), гидроксильная группа соединения (XIIIa) может быть галогенирована или превращена в эфир сульфокислоты. Десятая стадия представляет собой стадию получения соединения (XII) путем взаимодействия соединения (VIV) с A-H. Взаимодействие осуществляют в тех же условиях, что приведены для способа получения 2. Одиннадцатая стадия представляет собой стадию получения соединения (II) путем удаления защитной группы P1 соединения (XII). Реакция снятия защиты предпочтительно может быть проведена с применением методик, описанных в вышеуказанном “Protective Groups in Organic Synthesis”. (2) Исходное соединение (IV) Стадии получения исходного соединения (IV) для способа получения 2 охватывают с двенадцатой стадии по пятнадцатую стадию. Вначале, соединение (IV) может быть получено последовательным осуществлением двенадцатой и пятнадцатой стадий. Взаимодействие может быть выполнено путем конденсации соединения (IX) и соединения (III) тем же способом, что и в способе получения 1 и затем галогенированием гидроксильной группы полученного соединения (XV) или превращением указанной группы в эфир сульфокислоты, как на девятой стадии. Кроме того, можно получить соединение формулы (IV), где X означает X1, то есть соединение (IVa), посредством тринадцатой стадии и четырнадцатой стадии. А именно, путем обработки соединения (IX) в условиях реакции галогенирования согласно девятой стадии, галогенирование гидроксильной группы и конверсию карбоксильной группы до галогенангидрида осуществляют одновременно, и амидная связь может быть получена при осуществлении взаимодействия образовавшегося галогенангидрида (XVI) с отдельно полученным производным амина (III). Взаимодействие осуществляют в дихлорэтане, метиленхлориде или тому подобном в присутствии основания (пиридина, триэтиламина, карбоната калия или гидрокарбоната натрия) при интервале температур от охлаждения до комнатной температуры, либо при повышенной температуре, в зависимости от типа ацильных взаимодействий. Далее, можно также синтезировать соединение (IV) путем удаления защитной группы P1 соединения (XIV) и конденсации полученной карбоновой кислоты с соединением амина (III) в тех же условиях, что для способа получения 1. Полученные таким образом соединения по изобретению могут быть выделены и очищены, в виде свободных соединений или соответствующих солей, с применением общепринятых химических операций, таких как экстракция, осаждение, фракционированная хроматография, фракционированная кристаллизация и перекристаллизация. Соли соединений могут быть получены путем обработки свободных соединений согласно общепринятым приемам солеобразования. Кроме того, в случае, когда соединение по изобретению содержит асимметрический углерод, присутствуют оптические изомеры. Такие оптические изомеры могут быть получены способами переведения в диастереомерные соли с оптически активными кислотой или основанием, с последующей фракционированной кристаллизацией и разделением оптических изомеров с использованием общепринятых методов, таких как колоночная хроматография или синтез с применением оптически активного исходного материала. Наилучший способ осуществления изобретения ПРИМЕРЫ Далее способ получения соединения по изобретению поясняется детально с помощью следующих примеров. В связи с этим, способы получения исходных материалов обозначены как стандартные примеры. Стандартный пример 1 В 150 мл воды суспендируют 55,9 г карбоната натрия и 38,6 г фенилбороновой кислоты. Добавляют 51,4 г этил 4-бром-3-метилбензоата, растворенного в 400 мл толуола, и затем добавляют 4,0 г тетракистрифенилфосфинпалладия, после чего нагревают в течение 2 часов до температуры кипения с обратным холодильником. После охлаждения реакционного раствора до комнатной температуры проводят фильтрование, используя целит, и органический слой экстрагируют толуолом. После высушивания органического слоя над безводным сульфатом магния растворитель удаляют путем выпаривания и полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), получая 50,4 г этил 2-метилбифенил-4-карбоксилата в виде бесцветного масла. Стандартный пример 2 В 130 мл четыреххлористого углерода растворяют 10 г этил 2-метилбифенил-4-карбоксилата, полученную смесь нагревают до 90°C и затем добавляют 1,0 г NBS и 136 мг 2,2′-азобисизобутиронитрила. После нагревания реакционной смеси до температуры кипения с обратным холодильником добавляют 6,78 г NBS и полученную смесь нагревают до температуры кипения с обратным холодильником в течение полутора часов. После охлаждения реакционного раствора до комнатной температуры осадок удаляют фильтрованием, к фильтрату добавляют воду и органический слой экстрагируют четыреххлористым углеродом. После высушивания полученного органического слоя над безводным сульфатом магния растворитель удаляют выпариванием, получая 13,6 г этил 2-(бромметил)бифенил-4-карбоксилата в виде белого твердого вещества. Стандартный пример 3 В 50 мл ДМФА растворяют 13,6 г этил 2-(бромметил)бифенил-4-карбоксилата и затем добавляют суспензию из 50 мл ДМФА, 6,2 мл пиперидина и 9,2 г карбоната калия, с последующим перемешиванием в течение 3 часов при комнатной температуре. К реакционному раствору добавляют воду, полученную смесь экстрагируют этилацетатом и образовавшийся органический слой сушат над безводным сульфатом магния с последующим удалением растворителя путем выпаривания. Полученный остаток очищают хроматографией на колонке с силикагелем (хлороформ:метанол:водный аммиак), получая 12,6 г этил 2-(пиперидин-1-илметил)бифенил-4-карбоксилата в виде светло-желтого масла. Стандартные примеры 4-16 Соединения по стандартным примерам 4-16, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 3. Стандартный пример 17 В 150 мл этанола растворяют 11 г этил 2-(пиперидин-1-илметил)бифенил-4-карбоксилата и затем добавляют 51 мл 1M водного гидроксида натрия, при охлаждении льдом, с последующим перемешиванием при комнатной температуре в течение 10 часов. При охлаждении льдом к реакционному раствору добавляют 51 мл 1M водной хлористоводородной кислоты и затем растворитель удаляют выпариванием, получая 12,6 г светло-розового твердого вещества, представляющего собой смесь 2-(пиперидин-1-илметил)бифенил-4-карбоновой кислоты и 1,5 эквивалентов хлорида натрия. Стандартные примеры 18-40 Соединения по стандартным примерам 18-30, представленные в приведенных ниже таблицах, получают тем же способом, что и в стандартном примере 17. Соединения по стандартным примерам 31-35, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 3. Соединения по стандартным примерам 36-40, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 17. Стандартный пример 41 В 100 мл ацетонитрила растворяют 9,3 г этил 2-(бромметил)бифенил-4-карбоксилата и затем добавляют при комнатной температуре 7,0 г N-метилморфолин-N-оксида с последующим перемешиванием в течение 4 часов. К реакционному раствору добавляют воду и затем экстрагируют этилацетатом. Образовавшийся органический слой сушат над безводным сульфатом магния. После удаления растворителя путем выпаривания полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), получая 4,94 г этил 2-формилбифенил-4-карбоксилата в виде белого твердого вещества. Стандартный пример 42 Суспензию 17,1 г (метоксиметил)трифенилфосфонийхлорида в 150 мл тетрагидрофурана охлаждают до -78°C и к суспензии добавляют по каплям 1,59 M раствор н-бутиллития в гексане с последующим перемешиванием в течение 30 минут. Далее, после нагревания реакционного раствора до -40°C и перемешивания в течение 10 минут указанный раствор вновь охлаждают до -78°C и добавляют по каплям, за период 20 минут 4,2 г этил 2-формилбифенил-4-карбоксилата, растворенного в 20 мл тетрагидрофурана. Реакционный раствор нагревают от -50°C до 10°C за период 12 часов, с последующим перемешиванием при комнатной температуре в течение 4 часов. Реакционный раствор упаривают и к остатку добавляют этилацетат и воду, с последующим отделением органического слоя. Органический слой сушат над безводным сульфатом магния, растворитель удаляют выпариванием и полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), получая 1,66 г бесцветного масла. Продукт растворяют в 50 мл 1,2-дихлорэтана и добавляют 25 мл муравьиной кислоты при комнатной температуре, с последующим перемешиванием в течение 51 часа. К реакционному раствору добавляют воду и этилацетат, осуществляют операцию по разделению и полученный органический слой сушат над безводным сульфатом магния. После удаления растворителя выпариванием остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), получая 1,06 г этил 2-(2-оксоэтил)бифенил-4-карбоксилата в виде белого твердого вещества. Стандартный пример 43 В 20 мл 1,2-дихлорэтана растворяют 1,06 г этил 2-(2-оксоэтил)бифенил-4-карбоксилата и затем добавляют 3,95 мл пиперидина, 589 мкл уксусной кислоты и 1,09 г триацетоксиборгидрида натрия, с последующим перемешиванием в течение 3 часов. К реакционному раствору добавляют воду и хлороформ и полученный операцией по отделению органический слой сушат над безводным сульфатом магния, с последующим удалением растворителя выпариванием. Полученный остаток очищают хроматографией на колонке с силикагелем (хлороформ:метанол:водный аммиак), что дает 1,3 г маслянистого этил 2-(пиперидин-1-илэтил)бифенил-4-карбоксилата. Стандартный пример 44 Соединение по стандартному примеру 44, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 17, используя этил 2-(пиперидин-1-илэтил)бифенил-4-карбоксилат в качестве исходного материала. Стандартные примеры 45-56 Соединение по стандартному примеру 45, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 1. Соединение по стандартному примеру 46, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 2. Соединения по стандартным примерам 47-50, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 3. Соединения по стандартным примерам 51-56, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 17. Стандартный пример 57 К 160 мл 1,2-дихлорэтана добавляют 14,71 г 2-(гидроксиметил)бифенил-4-карбоксилата и туда же добавляют 0,5 мл ДМФА и 11,75 мл тионилхлорида. После перемешивания реакционного раствора в течение 1 часа при нагревании до температуры кипения с обратным холодильником добавляют 8 мл тионилхлорида при комнатной температуре и полученную смесь перемешивают в течение 3 часов при нагревании до температуры кипения с обратным холодильником. После охлаждения до комнатной температуры реакционный растворитель выпаривают при пониженном давлении и к остатку добавляют 200 мл 1,2-дихлорэтана. При охлаждении льдом добавляют 8,07 г 1,3-бензотиазол-5-амина и 17,4 мл пиридина с последующим перемешиванием при комнатной температуре. Реакционный растворитель удаляют выпариванием при пониженном давлении и полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), что дает 11,23 г N-1,3-бензотиазол-5-ил-2-(хлорметил)бифенил-4-карбоксамида в виде желтой пенистой массы. Стандартный пример 58 В 50 мл метиленхлорида растворяют 2,5 г 6-нитроиндолина и затем добавляют 6,37 мл триэтиламина. При охлаждении льдом добавляют по каплям 3,51 г метансульфонилхлорида, реакционный раствор перемешивают при комнатной температуре в течение 3 часов и затем добавляют ледяную воду с последующим перемешиванием в течение 1 часа. Реакционный растворитель удаляют выпариванием при пониженном давлении, к остатку добавляют 1M водный раствор хлористоводородной кислоты и осадившийся продукт отделяют фильтрованием, тем самым получая 3,52 г 1-метилсульфонил-6-нитроиндолина в виде коричневого твердого вещества. Стандартный пример 59 В 11,5 мл ДМФА растворяют 500 мг 6-нитро-2H-бензотиазин-3(4H)-она и туда же добавляют 114 мг гидрида натрия, 55% чистоты, при охлаждении льдом, с последующим перемешиванием в течение 30 минут при комнатной температуре. К реакционному раствору добавляют 444 мкл метилиодида и полученную смесь перемешивают при комнатной температуре в течение 2 часов. К реакционному раствору добавляют 2 мл метанола, при охлаждении льдом, с последующим перемешиванием в течение 10 минут при комнатной температуре. После чего добавляют воду и органический слой экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и затем растворитель удаляют выпариванием. Полученный остаток очищают хроматографией на колонке с силикагелем (хлороформ), получая 308 мг 4-метил-6-нитро-2H-1,4-бензотиазин-3(4H)-она. Стандартные примеры 60 и 61 Соединения по стандартным примерам 60 и 61, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 59. Стандартный пример 62 В 7,4 мл тетрагидрофурана растворяют 160 мг 2-хлор-5-нитро-1,3-бензотиазола и туда же добавляют 1,86 мл 1M раствора диметиламина в тетрагидрофуране с последующим перемешиванием в течение 16,5 часов. К реакционному раствору добавляют воду и органический слой экстрагируют этилацетатом. После высушивания органического слоя над безводным сульфатом натрия растворитель удаляют выпариванием. Полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), получая 173 мг N,N-диметил-5-нитро-1,3-бензотиазол-2-амина в виде желтого твердого вещества. Стандартный пример 63 В 13,5 мл 2M раствора диметиламина в тетрагидрофуране растворяют 2,0 г 2,3-дихлорпиридина с последующим перемешиванием в течение 6 часов при 100°C в условиях запаянной ампулы. После охлаждения реакционного раствора до комнатной температуры добавляют насыщенный раствор бикарбоната натрия и экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия, фильтруют и фильтрат концентрируют при пониженном давлении, получая 693 мг желтого масла. Затем 693 мг полученного желтого масла растворяют в 5 мл концентрированной серной кислоты и медленно добавляют смешанный раствор 1,2 г дымящей азотной кислоты и 0,7 мл концентрированной серной кислоты. После перемешивания в течение 30 минут при охлаждении льдом к реакционному раствору добавляют охлажденную воду и затем добавляют карбонат натрия до тех пор, пока раствор не станет щелочным. Добавляют этилацетат, органический слой экстрагируют, сушат над сульфатом натрия и фильтруют, и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), что дает 347 мг 3-хлор-N-метил-5-нитропиридин-2-амина в виде желтого твердого вещества. Стандартный пример 64 В 20 мл трет-бутилового спирта растворяют 1,4 г 1-метил-6-нитро-1H-индола и затем добавляют, подразделяя на четыре порции, 3,5 г N-бромсукцинимида. После перемешивания при комнатной температуре в течение 4 часов реакционный раствор концентрируют при пониженном давлении. К остатку добавляют воду и органический слой экстрагируют этилацетатом. После высушивания органического слоя над безводным сульфатом магния упаривают растворитель. Полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), что дает 2,44 г 3,3-дибром-1-метил-6-нитро-1,3-дигидро-2H-индол-2-она в виде желтого твердого вещества. Стандартный пример 65 К 2,00 г 1-метилсульфонил-6-нитроиндолина и смешанному растворителю из 100 мл этанола и 100 мл тетрагидрофурана добавляют 300 мг 10% палладий/уголь в атмосфере аргона с последующим перемешиванием при комнатной температуре в атмосфере водорода в течение 3 часов. Реакционный раствор фильтруют через целит и органический растворитель удаляют из фильтрата при пониженном давлении. К остатку добавляют 200 мл смешанного растворителя из метанола, этилацетата и тетрагидрофурана. В атмосфере аргона добавляют 1 г смеси 10% палладий/уголь и полученную смесь перемешивают при комнатной температуре в течение 3 часов в атмосфере водорода. Реакционный раствор фильтруют через целит и органический растворитель удаляют из фильтрата при пониженном давлении, получая 1,66 г 1-метилсульфонил-6-аминоиндолина в виде светло-желтого твердого вещества. Стандартные примеры 66-71 Соединения по стандартным примерам 66-71, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 65. Стандартный пример 72 В 70 мл толуола растворяют 3,2 г этил 4-формил-3-нитробензоата и затем 5,75 г метилтрифенилфосфоранилиденацетата, с последующим перемешиванием в течение 6 часов при нагревании до температуры кипения с обратным холодильником. После охлаждения реакционный раствор концентрируют при пониженном давлении и полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), что дает 3,63 г этил 4-[(1E)-3-метокси-3-оксопроп-1-ен-1-ил]-3-нитробензоата в виде белого твердого вещества. Стандартный пример 73 К смеси 1,8 г этил 4-[(1E)-3-метокси-3-оксопроп-1-ен-1-ил]-3-нитробензоата, 32 мл этанола и 32 мл тетрагидрофурана добавляют 640 мг 10% палладий/уголь в атмосфере аргона с последующим перемешиванием при комнатной температуре в атмосфере водорода в течение 2 часов. Реакционный раствор фильтруют через целит и органический растворитель удаляют из фильтрата при пониженном давлении. К остатку добавляют 50 мл метанола и 2 капли концентрированной хлористоводородной кислоты с последующим перемешиванием в течение 30 минут при 60°C. После охлаждения до комнатной температуры реакционный раствор концентрируют при пониженном давлении и к остатку добавляют воду и хлороформ, после чего осуществляют операцию по разделению. Органический слой сушат над безводным сульфатом натрия и растворитель выпаривают. Полученный остаток очищают хроматографией на колонке с силикагелем (гексан:этилацетат), что дает 1,16 г этил 2-оксо-1,2,3,4-тетрагидрохинолин-7-карбоксилата в виде белого твердого вещества. Стандартный пример 74 В 10 мл толуола суспендируют 200 мг 1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-карбоновой кислоты и затем добавляют 268 мг дифенилфосфорилазида (DPPA), 722 мг трет-бутилового спирта и 0,135 мл триэтиламина с последующим перемешиванием в течение 14 часов при нагревании до температуры кипения с обратным холодильником. После охлаждения реакционный раствор концентрируют при пониженном давлении, к остатку добавляют воду и органический слой экстрагируют этилацетатом. После высушивания органического слоя над безводным сульфатом натрия растворитель удаляют выпариванием. К остатку добавляют 5 мл 4M раствора хлористоводородной кислоты в этилацетате с последующим перемешиванием при комнатной температуре в течение 7 часов. Затем реакционный раствор концентрируют при пониженном давлении. К остатку добавляют насыщенный водный гидрокарбонат натрия и органический слой экстрагируют хлороформом. После высушивания органического слоя над безводным сульфатом натрия растворитель удаляют выпариванием. Полученный остаток очищают хроматографией на колонке с силикагелем (хлороформ:метанол:водный аммиак), что дает 80 мг 7-амино-1-метил-3,4-дигидрохинолин-2(1H)-она в виде белого твердого вещества. Стандартный пример 75 Суспензию 329 мг 3-хлор-N-метил-5-нитропиридин-2-иламина, 489 мг железа в порошке и 9 мл уксусной кислоты перемешивают при 60°C в течение 2 часов. После охлаждения реакционного раствора до комнатной температуры добавляют этанол и раствор фильтруют через целит. Фильтрат концентрируют при пониженном давлении и добавляют этилацетат и насыщенный водный раствор бикарбоната натрия. К полученному разделением органическому слою добавляют 1M водный раствор гидроксида натрия с последующим разделением. Полученный органический слой сушат над безводным сульфатом натрия и фильтруют, и затем полученный фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (хлороформ:метанол), получая 193 мг 3-хлор-2-метиламино-5-аминопиридина в виде коричневого масла. Стандартные примеры 76-124 Соединение по стандартному примеру 76, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 1. Соединение по стандартному примеру 77, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 2. Соединения по стандартным примерам 78-80, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 3. Соединения по стандартным примерам 81-83, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 17. Соединения по стандартным примерам 84-89, представленные в приведенных ниже таблицах, получают тем же способом, что и в стандартном примере 1. Соединения по стандартным примерам 90-95, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 2. Соединения по стандартным примерам 96-124, представленные в приведенных ниже таблицах, получают тем же способом, что и в стандартном примере 3. Стандартный пример 125 2,4-Динитробензальдегид растворяют в диоксане и воде, добавляют метилакрилат и триэтилендиамин при комнатной температуре и образовавшуюся смесь перемешивают, получая метил 2-[(2,4-динитрофенил)(гидрокси)метил]акрилат. Стандартные примеры 126-162 Соединения по стандартным примерам 126-162, представленные в приведенных ниже таблицах, получают тем же способом, что и в стандартном примере 17. Стандартный пример 163 N-(8-Хлор-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)-2,2,2-трифторацетамид гидролизуют с помощью гидроксида натрия, получая 6-амино-8-хлор-2H-1,4-бензоксазин-3(4H)-он. Стандартные примеры 164-166 Соединение по стандартному примеру 164, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 41. Соединение по стандартному примеру 165, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 42. Соединение по стандартному примеру 166, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 43. Стандартный пример 167 Этил 2-[(этиламино)метил]бифенил-4-карбоксилат и тетрагидро-4H-пиран-4-он обрабатывают триацетоксиборгидридом натрия в присутствии уксусной кислоты, получая этил 2-{[этил(тетрагидро-2H-пиран-4-ил)амино]метил}бифенил-4-карбоксилат. Стандартные примеры 168-189 Соединения по стандартным примерам 168-170, представленные в приведенной ниже таблице, получают, используя те же реагенты, что в стандартном примере 167. Соединение по стандартному примеру 171, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 57. Соединение по стандартному примеру 172, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 58. Соединения по стандартным примерам 173-175, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 59. После N-алкилирования, осуществляемого тем же способом, что и в стандартном примере 59, соединения по стандартным примерам 176-177, представленные в приведенной ниже таблице, получают путем гидролиза сложноэфирной группы тем же способом, что и в стандартном примере 17. Соединения по стандартным примерам 178-179, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 63. Стандартный пример 180 Метил 2,6-дихлор-5-фторникотинат обрабатывают диметиламином в запаянной ампуле, получая метил 2-хлор-6-(диметиламино)-5-фторникотинат, который затем подвергают взаимодействию в атмосфере водорода, в присутствии палладий/уголь, получая метил 6-(диметиламино)-5-фторникотинат. Стандартные примеры 181-182 Соединения по стандартным примерам 181-182, представленные в приведенных ниже таблицах, получают тем же способом, что и в стандартном примере 65. Стандартный пример 183 Этил (2S)-2-(2,4-динитрофенокси)пропаноат подвергают реакции восстановления под действием палладий/уголь в атмосфере водорода, в этаноле, что дает (2S)-6-амино-2-метил-2H-1,4-бензоксазин-3(4H)-он. Стандартные примеры 184-186 Соединение по стандартному примеру 184, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 183. Соединения по стандартным примерам 185-186, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 72. Стандартный пример 187 Палладий/уголь добавляют к этанольному раствору дибензилового эфира [2,4-динитро-6-(трифторметил)фенил]малоновой кислоты и взаимодействие осуществляют в атмосфере водорода, получая 6-амино-4-(трифторметил)-1,3-дигидро-2H-индол-2-он. Стандартный пример 188 Соединение по стандартному примеру 188, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 187. Стандартный пример 189 Метил 3-амино-4-(1-гидрокси-3-метокси-2-метил-3-оксопропил)бензоат обрабатывают хлористоводородной кислотой в 1,4-диоксане, получая метил 3-метил-2-оксо-1,2-дигидрохинолин-7-карбоксилат. Стандартный пример 190 Метил 4-[(1E)-3-этокси-2-метил-3-оксопроп-1-ен-1-ил]-3-нитробензоат и палладий/уголь добавляют к этанолу и полученную смесь перемешивают в атмосфере водорода, получая метил 3-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-карбоксилат. Стандартные примеры 191-198 Соединения по стандартным примерам 191-198, представленные в приведенных ниже таблицах, получают тем же способом, что и в стандартном примере 74. Стандартный пример 199 Метил 2-[(2,4-динитрофенил)(гидрокси)метил]акрилат подвергают взаимодействию в этаноле в присутствии палладий/уголь, в атмосфере водорода, получая 7-амино-3-метилхинолин-2(1H)-он. Стандартный пример 200 4-(трет-Бутоксикарбонил)морфолин-2-карбоновую кислоту и диэтиламин растворяют в ДМФА, добавляют при комнатной температуре 1-этил-3-(3′-диметиламинопропил)карбодиимид и полученную смесь перемешивают, получая трет-бутил 2-[(диэтиламино)карбонил]морфолин-4-карбоксилат. Стандартные примеры 201-203 Соединения по стандартным примерам 201-203, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 201. Стандартный пример 204 N-(3-Аминофенил)ацетамид обрабатывают циннамоилхлоридом в присутствии основания и затем полученный N-[3-(ацетиламино)фенил]-3-фенилакриламид обрабатывают хлоридом алюминия, что дает N-(2-оксо-1,2-дигидрохинолин-7-ил)ацетамид. Стандартный пример 205 N-(3-Аминофенил)ацетамид обрабатывают 2-нитрофенилсульфонилхлоридом в присутствии триэтиламина и затем полученное соединение обрабатывают йодметаном и карбонатом калия. После чего продукт обрабатывают тиогликолевой кислотой, что дает N-[3-(метиламино)фенил]ацетамид. Стандартный пример 206 Соединение по стандартному примеру 206, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 204. Стандартный пример 207 1,2 M раствор N-(2-оксо-1,2-дигидрохинолин-7-ил)ацетамида в смеси хлористоводородная кислота-этанол нагревают до температуры кипения с обратным холодильником, получая 7-аминохинолин-2(1H)-он. Стандартный пример 208 Соединение по стандартному примеру 208, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 207. Стандартный пример 209 2-Хлор-1,5-динитро-3-(трифторметил)бензол обрабатывают дибензиловым эфиром малоновой кислоты в присутствии гидрида натрия, получая дибензиловый сложный эфир [2,4-динитро-6-(трифторметил)фенил]малоновой кислоты. Стандартный пример 210 Соединение по стандартному примеру 210, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 209. Стандартный пример 211 Этил-5,6-дихлорникотинат, (2,4-диметоксибензил)амингидрохлорид и триэтиламин добавляют к хлороформу и полученную смесь перемешивают при комнатной температуре, получая 5-хлор-6-[(2,4-диметоксибензил)амино]никотинат. Стандартный пример 212 5-Хлор-6-[(2,4-диметоксибензил)амино]никотинат обрабатывают гидроксидом натрия в этаноле, получая 5-хлор-6-[(2,4-диметоксибензил)амино]никотиновую кислоту. К соединению добавляют толуол, дифенилфосфорилазид (DPPA), трет-бутиловый спирт и триэтиламин, и образовавшуюся смесь перемешивают при нагревании до температуры кипения с обратным холодильником. Полученное соединение обрабатывают трифторуксусной кислотой, что дает 3-хлорпиридин-2,5-диамин. Стандартный пример 213 1-Метил-5-нитро-1H-индол-2,3-дион обрабатывают трифторидом (диэтиламино)серы, получая 3,3-дифтор-1-метил-5-нитро-1,3-дигидро-2H-индол-2-он. Стандартный пример 214 3,3-Дифтор-1-метил-5-нитро-1,3-дигидро-2H-индол-2-он подвергают реакции гидрирования, используя катализатор Ni Ренея, в токе водорода, что дает 5-амино-3,3-дифтор-1-метил-1,3-дигидро-2H-индол-2-он. Стандартный пример 215 5-Нитро-3-(трифторметил)пиридин-2(1H)-он обрабатывают тионилхлоридом и затем образовавшийся 2-хлор-5-нитро-3-(трифторметил)пиридин обрабатывают диметиламином, получая N,N-диметил-5-нитро-3-(трифторметил)пиридин-2-амин. Стандартный пример 216 В присутствии карбоната калия 1-фтор-2,4-динитробензол обрабатывают этил (2S)-(-)-2-гидроксипропаноатом, получая этил (2S)-2-(2,4-динитрофенил)пропионат. Стандартный пример 217 Соединение по стандартному примеру 217, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 216. Стандартный пример 218 Трифторуксусный ангидрид добавляют к смешанному раствору 6-амино-2H-1,4-бензоксазин-3(4H)-она и смеси хлороформ-тетрагидрофуран, получая 2,2,2-трифтор-N-(3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)ацетамид. Стандартный пример 219 2,2,2-Трифтор-N-(3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)ацетамид обрабатывают N-хлорсукцинимидом в ДМФА, получая N-(8-хлор-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)-2,2,2-трифторацетамид. Стандартные примеры 220-221 Соединения по стандартным примерам 220-221, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 219. Стандартный пример 222 Этил 3-хлор-4-гидрокси-5-метилбензоат обрабатывают ангидридом трифторметансульфокислоты в присутствии основания, получая этил 3-хлор-5-метил-4-{[(трифторметил)сульфонил]окси}бензоат. Стандартный пример 223 Этил 2-({этил[(2-нитрофенил)сульфонил]амино}метил)бифенил-4-карбоксилат обрабатывают тиогликолевой кислотой в присутствии основания, получая этил 2-[(этиламино)метил]бифенил-4-карбоксилат. Стандартный пример 224 1-Хлор-2-метилпропан-2-ол обрабатывают этиламином, получая 1-(этиламино)-2-метилпропан-2-ол. Стандартный пример 225 Трет-бутил-2-[(диэтиламино)карбонил]морфолин-4-карбоксилат обрабатывают 4M этилацетатным раствором хлористоводородной кислоты в этилацетате, получая N,N-диэтилморфолин-2-карбоксамидгидрохлорид. Стандартные примеры 226-229 Соединения по стандартным примерам 226-229, представленные в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 225. Стандартный пример 230 (2R,6S)-2,6-Диметилпиперазин обрабатывают ди-трет-бутилкарбонилом, получая 4-бутоксикарбонил-2,6-диметилпиперазин, который затем обрабатывают ацетилхлоридом в дихлорметане в присутствии триэтиламина, что дает 1-ацетил-4-бутоксикарбонил-2,6-диметилпиперазин. После чего соединение обрабатывают хлористоводородной кислотой, получая (2R,6S)-1-ацетил-2,6-диметилпиперазин. Стандартный пример 231 (2-Пиперидин-1-илэтил)амин обрабатывают 2-метилпропаноилхлоридом в присутствии триэтиламина, получая 2-метил-N-(2-пиперидин-1-илэтил)пропанамид. Стандартный пример 232 Соединение по стандартному примеру 232, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 231. Стандартный пример 233 (2R,6S)-1-Ацетил-2,6-диметилпиперазин восстанавливают литийалюмогидридом, получая (2R,6S)-1-этил-2,6-диметилпиперазин. Стандартный пример 234 3-(Изобутиламино)пропил-2-метилпропаноат восстанавливают литийалюмогидридом, получая N-(3-гидроксипропил)-2-метилпропанамид. Стандартный пример 235 Соединение по стандартному примеру 235, представленное в приведенной ниже таблице, получают тем же способом, что и в стандартном примере 234. Пример 1 В 20 мл 1,2-дихлорэтана суспендируют 500 мг смеси из 2-(пиперидин-1-илметил)бифенил-4-карбоновой кислоты и 1,5 эквивалентов хлорида натрия и затем добавляют 174 мг 3-метоксианилина, растворенного в 2 мл 1,2-дихлорэтана. При охлаждении льдом добавляют 694 мг O-бензотриазол-1-ил-N,N,N’,N’-тетраметилуронийгексафторфосфата и 211 мкл N-метилморфолина с последующим перемешиванием в течение 30 часов при комнатной температуре. К реакционному раствору добавляют воду и органический слой экстрагируют хлороформом. Органический слой сушат над безводным сульфатом магния с последующим удалением растворителя путем выпаривания. Полученный остаток очищают хроматографией на колонке с силикагелем (хлороформ:метанол:водный аммиак), что дает N-(3-метоксифенил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид. Соединение растворяют в 3 мл этилацетата и затем добавляют 1 мл 4M этилацетатного раствора хлористоводородной кислоты. Растворитель удаляют выпариванием и осуществляют кристаллизацию из этанола, получая 103 мг N-(3-метоксифенил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамидгидрохлорида в виде белого твердого порошка. Пример 2 Смесь 227 мг 3-аминофенола, 3-(пиперидин-1-илметил)бифенил-4-карбоновой кислоты (2,08 ммоль) и хлорида натрия суспендируют в 7 мл ДМФА и затем добавляют при комнатной температуре 599 мг 1-этил-3-(3′-диметиламинопропил)карбодиимида с последующим перемешиванием в течение 10 часов. К реакционному раствору добавляют этилацетат и 1M водный раствор хлористоводородной кислоты и гидрокарбонат натрия добавляют к водному слою, полученному путем отделения, до тех пор пока водный слой не станет щелочным. К водному слою добавляют этилацетат и осуществляют операцию разделения. Полученный водный слой сушат над безводным сульфатом магния и затем растворитель удаляют выпариванием. Полученное белое твердое вещество растворяют в этаноле и добавляют 4M этилацетатный раствор хлористоводородной кислоты с последующим удалением растворителя путем выпаривания. К полученному остатку добавляют этанол и воду и осуществляют кристаллизацию, получая 436 мг N-(3-гидроксифенил)-3-(пиперидин-1-илметил)бифенил-4-карбоксамидгидрохлорида в виде белого порошка. Примеры 3-9 Соединения по примерам 3-5, представленные в приведенной ниже таблице, получают тем же способом, что и в примере 2. Соединения по примерам 6-9, представленные в приведенной ниже таблице, получают тем же способом, что и в примере 1. Пример 10 К 30 мл тионилхлорида добавляют 500 мг смеси 2-(пиперидин-1-илметил)бифенил-4-карбоновой кислоты и 1,5 эквивалентов хлорида натрия и 1 каплю ДМФА, с последующим перемешиванием в течение 2 часов при комнатной температуре. Реакционный раствор концентрируют при пониженном давлении и к остатку добавляют толуол с последующей концентрацией при пониженном давлении. После высушивания остатка при пониженном давлении добавляют 20 мл метиленхлорида. При охлаждении льдом к реакционной смеси добавляют 277 мг 3,4,5-трихлоранилина и 0,59 мл триэтиламина и полученную смесь перемешивают при комнатной температуре в течение 3 часов и при 40°C в течение ночи. Реакционную смесь концентрируют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ:метанол: водный аммиак), получая N-(3,4,5-трихлорфенил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид. Соединение растворяют в хлороформе и добавляют 1 мл 4M диоксанового раствора хлористоводородной кислоты. Растворитель удаляют выпариванием и образовавшееся масло кристаллизуют из диэтилового эфира, получая 450 мг N-(3,4,5-трихлорфенил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамидгидрохлорида в виде белого порошка. Примеры 11-99 Соединение по примеру 11, представленное в приведенной ниже таблице, получают тем же способом, что и в примере 10. Соединения по примерам 12-43, представленные в приведенных ниже таблицах, получают тем же способом, что и в примере 1. Соединения по примерам 44-99, представленные в приведенных ниже таблицах, получают тем же способом, что и в примере 10. Пример 100 К 10 мл хлороформа добавляют 250 мг N-1,3-бензотиазол-5-ил-2-(хлорметил)бифенил-4-карбоксамида и 169 мг пиперидин-4-карбоксамида, с последующим перемешиванием в течение 3 дней при комнатной температуре. Реакционный растворитель удаляют выпариванием при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (хлороформ:метанол), получая вещество в виде желтой пены. К полученному веществу добавляют 2 мл этанола и 1 мл 4M этилацетатного раствора хлористоводородной кислоты, с последующим удалением растворителя при пониженном давлении. Остаток кристаллизуют (этанол:вода:этилацетат), получая 205 мг 1-({4-[(1,3-бензотиазол-5-иламино)карбонил]бифенил-2-ил}метил)пиперидин-4-карбоксамидгидрохлорида. Примеры 101-111 Соединения по примерам 101-111, представленные в приведенных ниже таблицах, получают тем же способом, что и в примере 100. Пример 112 В 5 мл N,N-диметилацетамида растворяют 230 мг N-(4-метил-3-оксо-3,4-дигидро-2H-1,4-бензотиазин-6-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамида и затем добавляют при охлаждении льдом 252 мг м-хлорпербензойной кислоты, с последующим перемешиванием в течение 24 часов при комнатной температуре. К реакционному раствору добавляют 5 мл воды и 1016 мг гидросульфита натрия, за две порции, с последующим перемешиванием в течение 2 часов при комнатной температуре. К реакционной системе добавляют воду и органический слой экстрагируют этилацетатом и сушат над безводным сульфатом натрия, и растворитель удаляют выпариванием. Полученный остаток очищают хроматографией на колонке с силикагелем (хлороформ:метанол:водный аммиак), получая желтое масло. Указанное масло растворяют в 5 мл этилацетата и затем добавляют 1 мл 4M этилацетатного раствора хлористоводородной кислоты. Растворитель удаляют выпариванием и полученный твердый продукт перекристаллизовывают из этанола, что дает 61 мг N-(4-метил-1,1-диоксо-3-оксо-3,4-дигидро-2H-1,4-бензотиазин-6-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамидгидрохлорида в виде белого порошка. Пример 113 Соединения по примеру 113, представленное в приведенной ниже таблице, получают тем же способом, что и в примере 10. Пример 114 В 15 мл метанола суспендируют 250 мг N-(3-оксо-2,3-дигидро-1H-1-инден-5-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамида и затем добавляют 40 мг боргидрида натрия при комнатной температуре. Реакционный раствор перемешивают при комнатной температуре в течение 1 часа и затем добавляют 5 мл воды. Реакционный раствор упаривают при пониженном давлении. После растворения полученного осадка в смешанном растворе из хлороформа и воды раствор экстрагируют хлороформом. Органический слой сушат над безводным сульфатом натрия и затем фильтруют, и растворитель удаляют выпариванием. Полученный остаток растворяют в 10 мл этанола и затем добавляют 0,5 мл 4M этилацетатного раствора хлористоводородной кислоты. Растворитель удаляют выпариванием и полученный остаток перекристаллизовывают из этанола, что дает 113 мг N-(3-гидрокси-2,3-дигидро-1H-1-инден-5-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамидгидрохлорида в виде белого порошка. Примеры 115-181 Соединения по примерам 115-121, представленные в приведенных ниже таблицах, получают тем же способом, что и в примере 1. Соединения по примерам 122-123, представленные в приведенной ниже таблице, получают тем же способом, что и в примере 2. Соединения по примерам 124-181, представленные в приведенных ниже таблицах, получают тем же способом, что и в примере 10. Пример 182 В 20 мл ДМФА растворяют 500 мг 4-{[(2-метил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)амино]карбонил}бифенил-2-ил)метилметансульфоната, 123 мг N-метилгексан-1-амина, 177 мг карбоната калия и 212 мг иодида калия с последующим перемешиванием в течение 3 часов при 70°C. После выполнения операции по разделению растворитель удаляют выпариванием. Полученный остаток очищают хроматографией на колонке с силикагелем (хлороформ:метанол:водный аммиак), что дает бесцветную вязкую массу. Добавляют этанол и 0,4 мл 4M этилацетатного раствора хлористоводородной кислоты и растворитель удаляют выпариванием. Остаток промывают смесью (2-пропанол:этанол), получая 233 мг 2-{[гексил(метил)амино]метил}-N-(2-метил-3-оксо-3,4-дигидро-2H-1,4-бензотиазин-6-ил)бифенил-4-карбоксамидгидрохлорида в виде белого твердого вещества. Примеры 183-196 Соединения по примерам 183-196, представленные в приведенных ниже таблицах, получают тем же способом, что и в примере 182. Пример 197 К 0,7 мл раствора 19 мг N-1,3-бензотиазол-5-ил-2-(хлорметил)бифенил-4-карбоксамида в 1,4-диоксане добавляют 0,1 мл раствора 12 мг 4-(4-хлорфенил)пирролидин-3-метилкарбоксилата в N-метил-2-пирролидиноне и затем добавляют 14 мг карбоната калия и 12 мг иодида калия, с последующим перемешиванием в течение 1 дня при комнатной температуре. К фильтрату, полученному фильтрованием реакционного раствора, добавляют 0,4 мл этилацетата, экстрагируют, пропуская через диатомовую колонку, содержащую 0,1 мл воды и элюируют 0,4 мл этилацетата. Растворитель из элюата удаляют выпариванием при пониженном давлении и полученный остаток очищают методом препаративной ЖХВР (колонка: Symmetry (зарегистрированная торговая марка) C18 5 мкм 19 мм Ч 100 мм, растворитель: смесь MeOH/0,1% HCOOH-H2O = 10/90 (0 мин) – 10/90 (1 мин) – 100/0 (9 мин) – 100/0 (12 мин), скорость потока: 30 мл/мин), получая 0,4 мг метил-(3R,4S)-1-({4-[(1,4-бензотиазоло-5-иламино)карбонил]бифенил-2-ил}метил)-4-(4-хлорфенил)пирролидин-3-карбоксилата. Примеры 198-232 Соединения по примерам 198-232, представленные в приведенных ниже таблицах, получают тем же способом, что и в примере 197. Структурные формулы и физические свойства вышеуказанных соединений по стандартным примерам и соединений по примерам приведены ниже в таблицах 1-38. Кроме того, соединения, представленные в следующих таблицах 39 и 40, легко могут быть получены примерно таким же способом, что и способы, описанные в приведенных выше стандартных примерах, примерах или способах получения, либо применением слегка измененных методик, очевидных для специалиста в данной области, после ознакомления с данными способами. В связи с этим, символы в таблицах имеют следующие значения. Rf: стандартный пример №, Ex: пример №, No: соединение №, Structure: структурная формула, salt: соль (2HCl:дигидрохлорид, не описана в виде свободного основания), Me: метильная группа, Et: этильная группа, Ac: ацетильная группа, iPr: изопропильная группа, nPr: н-пропильная группа, tBu: трет-бутильная группа, Boc: трет-бутоксикарбонильная группа, Ph: фенильная группа, Ts: п-толуолсульфонильная группа, Ms: метансульфонильная группа, DATA: данные по физическим свойствам, NMR: спектр ядерного магнитного резонанса ЯМР (TMS (ТМС)-внутренний стандарт: 1H-ЯМР: 400 МГц или 300 МГц, растворитель для случая, когда конкретно не указан: DMSO-d6 (ДМСО-d6), FP: FAB-MS(FAB-MC) (M+H)+, H: время удерживания на ЖХВР в указанных ниже условиях ЖХВР (минута). Условия Колонка: Wakosil-II 5C18 AR 2 мм Ч 30 мм, растворитель: смесь MeOH/5 мМ трифторуксусная кислота-H2O = 10/90 (0 мин) – 100/0 (4,0 мин) – 100/0 (4,5 мин), скорость потока: 1,2 мл/мин. Промышленная применимость Поскольку соединения по настоящему изобретению обладают превосходной ингибирующей активностью в отношении активации VR1 рецептора капсаицина, указанные соединения полезны в качестве лекарственных средств, в особенности, терапевтических средств против различных видов боли, включая невропатические боли и воспалительные боли, головные боли, такие как мигрень и гистаминовая головная боль, при зуде, заболеваниях мочевого пузыря, включающих гиперактивный мочевой пузырь и интерстициальный цистит, и тому подобное. Превосходная ингибирующая активность соединений по изобретению в отношении активации VR1 рецептора капсаицина подтверждается приведенными ниже методами испытаний. Пример испытания 1 Испытание на рецепторное связывание с применением клеток, устойчиво экспрессирующих VR1 1) Получение клеток, устойчиво экспрессирующих VR1 человека Первичный полноразмерный кодируемый кДНК VR1 человека получают следующим способом. Первоначально проводят обратную транскрипцию мРНК мозга человека, используя мРНК-зависимую ДНК-полимеразу для синтеза первой нити кДНК. Затем, используя первую нить кДНК в качестве матрицы, осуществляют тест с полимеразным усилением PCR согласно методике “горячего запуска”, используя Taq ДНК-полимеразу. Вышеуказанный PCR выполняют, первоначально проводя тепловую денатурацию при 98°C (1 мин) и затем повторяя цикл, включающий 98°C (15 сек)/63°C (30 сек)/72°C (3 мин), 35 раз, используя олигонуклеотид, состоящий из последовательности оснований от 424 до 443 в известной кДНК-последовательности VR1 человека (GenBank AJ277028.1), в качестве смыслового праймера и олигонуклеотид, состоящий из комплементарной последовательности оснований от 3082 до 3100 в качестве антисмыслового праймера. Амплифицированную фракцию ДНК клонируют, используя pCR-XL-TOPO-вектор (TOPO XL PCR Cloning Kit; Invitrogen, USA). Полученную плазмидную ДНК ферментируют с помощью рестриктазы EcoRI, выделяя в чистом виде VR1-кДНК, которую затем интегрируют в плазмид pcDNA3.1(+) (Invitrogen, USA). Вышеуказанные операции по осуществлению генной инженерии выполняют согласно известным методикам (Sambrook, J. et al, Molecular Cloning-A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY, 2001) и инструкциям, прилагаемым к отдельным реагентам. Далее, осуществляют трансдукцию полученного pcDNA3.1-VR1 в клетки HEK293 или клетки CHO-K1. Клетки VR1/HEK293 получают, используя DMEM среду (Invitrogen, USA), содержащую 10% FBS, 100 мкг/мл стрептомицина, 100 Ед/мл пенициллина и 400 мкг/мл G418, и клетки VR1/CHO получают, используя HumF12 среду (Invitrogen, USA), содержащую 10% FBS, 100 мкг/мл стрептомицина, 100 Ед/мл пенициллина и 400 мкг/мл G418, получая клеточные линии, устойчиво экспрессирующие VR1 человека. Клетки, устойчиво экспрессирующие рецептор, пассируют в соответствующей вышеуказанной среде. 2) Способ получения мембран После культивирования вышеуказанных клеток VR1/HEK293 в стеклянных чашках Петри в большом количестве среду удаляют и клетки соскабливают, добавляя охлажденный льдом PBS. Полученные клетки центрифугируют при 1000 об/мин при 4°C в течение 10 минут. После добавления к полученному осадку буфера для гомогенизации (25 мМ Tris-HCl, 220 мМ сахарозы, pH 7,4) и гомогенизации смеси осуществляют центрифугирование при 2200 об/мин, при 4°C, в течение 10 минут. Образовавшийся супернатант центрифугируют при 30000×g, при 4°C, в течение 20 минут и обрабатывают, добавляя 25 мМ Tris-HCl, pH 7,4 к полученному осадку, и центрифугирование при 30000×g, при 4°C, в течение 20 минут повторяют дважды. Полученный осадок суспендируют в 25 мМ Tris-HCl, pH 7,4 и содержание белка определяют, используя окрашивающий раствор для анализа на белок (BioRad, USA). Полученный таким образом мембранный препарат хранят при -80°C. 3) Испытание на рецепторное связывание Испытание проводят, используя модифицированную методику [Neurosci. 57: 747-757 (1993)]. Аналитический буфер (25 мМ Tris-HCl, 0,025% BSA, pH 7,4) (147 мкл), 3 мкл испытуемого соединения, 50 мкл [3H]RTX (около 50000 расп./мин; Perkin-Elmer Life Science, USA), 100 мкл вышеуказанного мембранного препарата (количество белка порядка 25 мкг) смешивают и инкубируют при 37°C в течение 60 минут, и затем все инкубируют на льду в течение 10 минут. Охлажденный льдом Например, соединения по примерам 1, 7, 21, 33, 60, 71, 78, 85, 87, 110, 117, 122, 123, 129, 130, 143, 163, 170, 181 и 195 дают значение IC50, равное 1 мкМ или менее. На основании данного испытания может быть сделан вывод о том, что соединения по изобретению обладают сродством к рецептору VR1. Пример испытания 2 Исследование поглощения 45Са, используя стабильно экспрессирующие клетки VR1 Клетки VR1/CHO высевают в 96-луночный белый культуральный планшет при плотности 30000 клеток на лунку. После 24 часов культивирования в вышеуказанной среде среду заменяют на 25 мкл аналитического буфера (PBS, 0,1 мМ CaCl2, 1 мМ MgCl2, 10 мМ HEPES, 10 мМ глюкозы, 0,025% BSA, pH 7,4) с последующей инкубацией в течение 10 минут при 37°C. К лунке добавляют 25 мкл смешанного раствора из приблизительно 4 кБк 45Ca, капсаицина (Sigma, USA), доведенного до конечной концентрации 300 нМ, и испытуемого соединения, с последующей инкубацией в течение 10 минут при 37°C. Смешанный раствор трижды промывают буфером для промывки (PBS, 0,1 мМ CaCl2, 1 мМ MgCl2), добавляют 17 мкл 0,1н. NaOH и 100 мкл жидкого сцинтиллятора (microscinti-PS; Perkin-Elmer Life Science, USA) и измеряют радиоактивность с помощью сцинтилляционного счетчика для микропланшета (Top Count; Perkin-Elmer Life Science, USA). Специфическое поглощение 45Ca рецептором VR1, индуцируемое капсаицином, определяют как снижение, вызываемое 10 мкМ капсазепина, антагониста VR1, (Sigma, USA), по сравнению с общим поглощением 45Ca в клетках при стимуляции 300 нМ капсаицина. Оценку испытуемого соединения проводят следующим образом. А именно, снижение поглощения при добавлении соединения определяют как относительную величину, принимая снижение поглощения при добавлении капсазепина за 100%. Затем значение IC50 рассчитывают методом логистической регрессии. В результате, соединения по изобретению обладают сильной ингибирующей активностью против поглощения 45Ca посредством VR1. Пример испытания 3 Испытание с помощью капсаицина Испытание проводят согласно [Neuropharmacol. 31: 1279-1285 (1992)]. Введение 1,6 мкг капсаицина в подошву стопы мыши (ddY, самец, возраст 4-5-недель) вызывает скребущее движение лапой. Измеряя время проявления скребущего движения лапой в течение 5 минут после введения, оценивают ингибирующее действие на проявление боли. Испытуемое соединение вводят интраперитонеально за 30 минут до введения капсаицина или вводят перорально за 45 минут до введения капсаицина. Оценку испытуемого соединения проводят, определяя степень ингибирования для каждой группы, получающей испытуемое соединение и принимая время проявления скребущего движения лапой в группе, получающей растворитель за 100%. В результате, соединения по изобретению обладают сильным ингибирующим действием на проявление боли как в случае интраперитонеального введения, так и в случае перорального введения. Что касается характерных соединений, отвечающих примерам, степени ингибирования для группы, получающей испытуемое соединение перорально (30 мг/кг), приведены ниже в таблице 41.
С другой стороны, в данном исследовании соединение по примеру 115, описанному в вышеуказанном патентном документе 3, не проявляет существенной ингибирующей активности даже при дозе 100 мг/кг. На основании приведенных примеров испытаний 1-3, поскольку соединения по изобретению проявляют заметное подавляющее боль действие, основанное на ингибировании активации рецептора VR1, следует ожидать, что указанные соединения окажутся эффективными болеутоляющими средствами. Фармацевтическая композиция, содержащая один или более типов соединений по изобретению и фармацевтически приемлемые соли указанных соединений в качестве активного ингредиента, может быть представлена в виде таблеток, порошков, мелких гранул, гранул, капсул, пилюль, жидкостей, инъекционных растворов, суппозиториев, мазей, кашиц и тому подобного, в которых использованы носители и наполнители, обычно используемые для формулирования, и другие добавки, вводимых перорально или парентерально. В качестве твердой композиции для перорального введения согласно изобретению используют таблетки, порошки, гранулы и тому подобное. Для такой твердой композиции одно или более активных веществ смешивают с, по меньшей мере, одним неактивным разбавителем, например, лактозой, маннитом, глюкозой, гидроксипропилцеллюлозой, микрокристаллической целлюлозой, крахмалом, поливинилпирролидоном, метасиликат-алюминатом магния и тому подобным. Согласно общепринятым способам композиция может содержать вспомогательные вещества, отличные от неактивных разбавителей, например, смазывающие вещества, такие как стеарат магния, дезинтеграторы, такие как целлюлоза, гликолят кальция, стабилизаторы, солюбилизаторы или способствующие разложению средства. По необходимости, таблетки и пилюли могут быть покрыты образующими оболочку средствами, способными растворяться в желудке и кишечнике. Жидкая композиция для перорального введения включает фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, и тому подобное, и содержит обычно используемые неактивные разбавители, например, очищенную воду или этиловый спирт. Композиция может содержать вспомогательные средства, такие как солюбилизаторы, способствующие растворению средства, увлажняющие и суспендирующие средства, подсластители, корригенты, ароматизаторы и консерванты. Инъекции для парентерального введения охватывают асептические, водные или неводные растворы, суспензии и эмульсии. Разбавители для водных растворов и суспензий включают, например, дистиллированную воду для инъекций и физиологический раствор. Разбавители для неводных растворов и суспензий включают, например, пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, спирты, такие как этиловый спирт, полисорбат 80 (торговая марка) и тому подобное. Такие композиции могут дополнительно содержать добавки, включающие изотонические средства, консерванты, увлажнители, эмульгаторы, диспергирующие средства, стабилизаторы, солюбилизаторы и способствующие растворению средства. Указанные композиции могут быть стерилизованы путем фильтрования, например, через задерживающий бактерии фильтр, путем смешивания с бактериальными средствами или облучением. Указанные композиции могут быть также получены в виде асептических твердых композиций, и композиции могут быть использованы после растворения в асептической воде или асептических растворителях для инъекций перед употреблением. Клиническую дозу соединений по изобретению для человека соответственно выбирают с учетом симптомов, массы тела, возраста, пола пациентов и тому подобного. Однако доза приблизительно составляет от 0,1 до 500 мг в день для взрослого, в случае перорального введения, и от 0,01 до 100 мг, в случае парентерального введения, указанную дозу вводят один раз в день или подразделяя на несколько доз. Поскольку доза может изменяться в зависимости от различных условий в ряде случаев достаточной является меньшая доза, чем верхний указанный предел.
Формула изобретения
1. Бензамидное производное, представленное общей формулой (I) где символы имеют следующие значения:
L представляет собой низший алкилен, Е цикл представляет собой бензол или 5-членное гетероароматическое кольцо, содержащее атом серы в качестве гетероатома; D цикл представляет собой моноциклический или бициклический углеводородный цикл, такой как нафталин или бензол, необязательно конденсированный с С5-7циклоалкилом; 6-членный моноциклический гетероароматический цикл, содержащий атом азота в качестве гетероатома или 9-11-членный бициклический гетероароматический цикл, содержащий от 1 до 3 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и О, G цикл представляет собой 5-7-членный моноциклический насыщенный или частично насыщенный гетероцикл или 10-членный бициклический гетероцикл, содержащие от 1 до 3 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и О, R1-R9 представляют собой одинаковые или различные, атом водорода, атом галогена, низший алкил, галогензамещенный низший алкил, -ОН, -О-низший алкил, =О, -NH2, -NH-низший алкил, -N(низший алкил)2, -S-низший алкил, -SO-низший алкил, -SO2-низший алкил, -C(=O)-NH2, -С(=О)-NH-низший алкил, -С(=О)-N(низший алкил)2, -NH-SO2-низший алкил, -SO2-NH2, -SO2-NH-низший алкил, -С(=О)-низший алкил, -NO2, R6-R9 представляют собой 6-членный насыщенный моноциклический гетероцикл, содержащий атом азота в качестве гетероатома; R10 представляет собой атом водорода, R11-R15 представляет собой одинаковые или различные атом водорода, атом галогена, низший алкил, галогензамещенный низший алкил, -ОН, -О-низший алкил, -СООН, -CN, -C(=O)-NH2, -С(=О)-NH-низший алкил, -С(=О)-N(низший алкил)2, -NH-С(=О)-низший алкил, -низший алкилен-NH-SO2-фенил, -С(=О)-О-низший алкил, -низший алкилен-ОН, -низший алкилен-С(=О)-NH-низший алкил, -низший алкилен-C(=О)-N(низший алкил)2, -низший алкилен-С(=О)-NH2, -низший алкилен-С(=О)-ОН, -низший алкилен-О-низший алкил, -низший алкилен-О-С(=О)-низший алкил, -низший алкилен-фенил, С3-6циклоалкил, фенил, -(5-6-членный насыщенный, ненасыщенный моноциклический гетероцикл, содержащий атом азота или кислорода или серы в качестве гетероатома, или бициклический гетероцикл, содержащий 1 гетероатом, выбираемый из группы, включающей N и О), -О-(7-членный бициклический гетероцикл, содержащий 2 одинаковых атома, выбираемых из О), -низший алкилен-(6-членный моноциклический насыщенный гетероцикл, содержащий атом азота в качестве гетероатома), -С(=О)-(6-членный моноциклический насыщенный гетероцикл, содержащий 1 атом азота в качестве гетероатома), и вышеуказанный моноциклический или бициклический гетероцикл может быть замещен атомом галогена(ов), низшим алкилом(ами), -О-низшим алкилом или -ОН, или его фармацевтически приемлемая соль. 2. Соединение по п.1, где D цикл, R1-R9 и R11-R15 имеют следующие значения: D цикл представляет собой моноциклический или бициклический углеводородный цикл, такой как нафталин или бензол, 6-членный моноциклический гетероароматический цикл, содержащий атом азота в качестве гетероатома или 9-11-членный бициклический гетероароматический цикл, содержащий от 1 до 3 атомов одинаковых или различных гетероатомов, выбираемых из группы, включающей N, S и О, R1-R9 представляют собой одинаковые или различные, атом водорода, атом галогена, низший алкил, галогензамещенный низший алкил, -ОН, -О-низший алкил, =О, -NH2, -NH-низший алкил, -N(низший алкил)2, -S-низший алкил, -SO-низший алкил, -SO2-низший алкил, -C(=O)-NH2, -С(=О)-NH-низший алкил, -С(=О)-N(низший алкил)2, -SO2-NH2, R11-R15 представляет собой одинаковые или различные, атом водорода, атом галогена, низший алкил, галогензамещенный низший алкил, -ОН, -О-низший алкил, -СООН, -CN, -C(=O)-NH2, -С(=О)-NH-низший алкил, -С(=О)-N(низший алкил)2, -NH-С(=О)-низший алкил, -С(=О)-О-низший алкил, -низший алкилен-О-низший алкил, -низший алкилен-фенил, С3-6циклоалкил, фенил, -(5-6-членный насыщенный, ненасыщенный моноциклический гетероцикл, содержащий атом азота в качестве гетероатома, или бициклический гетероцикл, содержащий 1 гетероатом, выбираемый из группы, включающей N и О), -низший алкилен-(6-членный моноциклический насыщенный гетероцикл, содержащий атом азота в качестве гетероатома), -С(=О)-(6-членный моноциклический насыщенный гетероцикл, содержащий 1 атом азота в качестве гетероатома). 3. Соединение по п.2, где группа, обозначенная А в приведенной выше формуле (I), отвечает следующей формуле:
где цикл G и R13-R15 принимают те же значения, что и в приведенной выше формуле (I). 4. Соединение по п.3, где цикл, обозначенный G в приведенной выше формуле (I), означает азотсодержащий насыщенный гетероцикл, и азотный атом цикла связан с L. 5. Соединение по п.3, где цикл, обозначенный G в приведенной выше формуле (I), представляет собой цикл, выбираемый из группы, включающей морфолин, пиперидин или пирролидин, и азотный атом цикла связан с L. 6. Соединение по п.3, где цикл, обозначенный D в приведенной выше формуле (I), представляет собой цикл, выбираемый из группы, включающей бензотиазол, хинолин, изохинолин, индолин, тетрагидрохинолин, тетрагидроизохинолин, 3,4-дигидро-2H-1,4-бензоксазин, дигидрохинолин и дигидроизохинолин. 7. Соединение по п.3, где цикл, обозначенный D в приведенной выше формуле (I), вместе с присоединенными группами, обозначенными R6-R9, образует группу, выбираемую из следующих формул:
где символы имеют следующие значения: R6a и R6b: одинаковые или различные, атом водорода, низший алкил или галогензамещенный низший алкил и R7a, R8a, R7b и R8b: одинаковые или различные, атом водорода, атом галогена, низший алкил или галогензамещенный низший алкил. 8. Соединение по п.3, где цикл, обозначенный D в приведенной выше формуле (I), вместе с присоединенными группами, обозначенными R6-R9, образует группу, выбираемую из следующих формул:
где символы имеют следующие значения: R6с и R6d: одинаковые или различные, атом водорода, низший алкил или галогензамещенный низший алкил и R7c, R8c, R7d и R8d: одинаковые или различные, атом водорода, атом галогена, низший алкил или галогензамещенный низший алкил. 9. Соединение по п.2, где группа, обозначенная А в приведенной выше формуле (I), имеет следующую формулу:
где символы имеют следующие значения: R11a и R12a представляют собой -низший алкилен-О-низший алкил, -низший алкилен-фенил, С3-6циклоалкил, фенил, -(6-членный насыщенный моноциклический гетероцикл, содержащий атом кислорода или серы в качестве гетероатома), -низший алкилен-(6-членный моноциклический насыщенный гетероцикл, содержащий атом азота в качестве гетероатома). 10. Соединение по п.9, где цикл, обозначенный D в приведенной выше формуле (I), вместе с присоединенными группами, обозначенными R6-R9, образует группу, выбираемую из следующих формул:
где символы имеют следующие значения: R6а и R6b: одинаковые или различные, атом водорода, низший алкил или галогензамещенный низший алкил и R7a, R8a, R7b и R8b: одинаковые или различные, атом водорода, атом галогена, низший алкил или галогензамещенный низший алкил. 11. Соединение по п.9, где цикл, обозначенный D в приведенной выше формуле (I), вместе с присоединенными группами, обозначенными R6-R9, образует группу, выбираемую из следующих формул:
где символы имеют следующие значения: R6c и R6d: одинаковые или различные, атом водорода, низший алкил или галогензамещенный низший алкил и R7c, R8c, R7d и R8d: одинаковые или различные, атом водорода, атом галогена, низший алкил или галогензамещенный низший алкил. 12. Соединение по п.1 или фармацевтически приемлемая соль указанного соединения, где бензамидное производное, представленное вышеуказанной формулой (I), означает, по меньшей мере, одно соединение, выбираемое из группы, включающей N-1,3-бензотиазол-5-ил-2-{[циклогексил(изопропил)амино]метил}бифенил-4-карбоксамид, N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, N-(3,3-диметил-2-оксо-2,3-дигидро-1N-индол-6-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, 2-{[этил-(2-гидрокси-2-метилпропил)амино]метил}-N-(2-метил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)бифенил-4-карбоксамид, N-(1-метил-2-оксо-1,2-дигидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, N-(3-метил-2-оксо-1,2-дигидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, N-(2,4-диметил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, 2-{[этил(тетрагидро-2H-пиран-4-ил)амино]метил}-N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)бифенил-4-карбоксамид, N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-3-(пиперидин-1-илметил)-4-(2-тиенил)бензамид, 2-{[этил(тетрагидро-2H-тиопиран-4-ил)амино]метил}-N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)бифенил-4-карбоксамид, 2-{[изобутил-(2-пиперидин-1-илэтил)амино]метил}-N-(2-метил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)бифенил-4-карбоксамид, N,N диэтил-4-[(4-{[(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)амино]карбонил}бифенил-2-ил)метил]морфолин-3-карбоксамид, 2-[(4-метил-1,3′-бипиперидин-1′-ил)метил]-N-(2-метил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)бифенил-4-карбоксамид, 2-(пиперидин-1-илметил)-N-(2,2,4-триметил-3-оксо-3,4-дигидро-2H-1,4-бензоксазин-6-ил)бифенил-4-карбоксамид, N-(2-оксо-1,2-дигидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, 4′-фтор-N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-2-[(2-метилпирролидин-1-ил)метил]бифенил-4-карбоксамид, N-(3-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид, N-[1-(2-фторэтил)-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил]-2-(пиперидин-1-илметил)бифенил-4-карбоксамид и N-[(2R)-2-метил-3-оксо-3,4-дигидро-2Н-1,4-бензоксазин-6-ил]-2-(пиперидин-1-илметил)бифенил-4-карбоксамид. 13. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении активации рецептора VR1, содержащая бензамидное производное, представленное общей формулой (I) по п.1, или фармацевтически приемлемую соль указанного производного и фармацевтически приемлемый носитель. 14. Композиция по п.13, являющаяся ингибитором активации VR1. 15. Композиция по п.13, являющаяся профилактическим или терапевтическим средством против боли. 16. Применение бензамидного производного, представленного общей формулой (I) по п.1, или фармацевтически приемлемой соли указанного производного для получения профилактического или терапевтического средства против боли. 17. Способ профилактики или лечения боли, включающий введение млекопитающему эффективного количества бензамидного производного, представленного общей формулой (I) по п.1, или фармацевтически приемлемой соли указанного производного. 18. Соединение по п.8, где, по меньшей мере, один из R13-R15 представляет собой низший алкил, -О-низший алкил, пиперидинил или низший алкилен-пиперидинил, а другие представляют собой водород. 19. Соединение по п.1 или его фармацевтически приемлемая соль, где бензамидное производное представленное формулой I представляет собой N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-2-[(2-пиперидин-1-ил)метил]бифенил-4-карбоксамид. 20. Соединение по п.1 или его фармацевтически приемлемая соль, где бензамидное производное представленное формулой I представляет собой 2-{[этил(тетрагидро-2Н-пиран-4-ил)амино]метил}-N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)бифенил-4-карбоксамид. 21. Соединение по п.1 или его фармацевтически приемлемая соль, где бензамидное производное представленное формулой I представляет собой 4′-фтор-N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-2-(пиперидин-1-илметил)бифенил-4-карбоксамид. 22. Соединение по п.1 или его фармацевтически приемлемая соль, где бензамидное производное представленное формулой I представляет собой N-[(2R)-2-метил-3-оксо-3,4-дигидро-2Н-1,4-бензоксазин-6-ил]-2-(пиперидин-1-илметил)бифенил-4-карбоксамид. 23. Соединение по п.1 или его фармацевтически приемлемая соль, где бензамидное производное представленное формулой I представляет собой N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)-2-[(2-метилпирролидин-1-ил)метил]бифенил-4-карбоксамид. 24. Соединение по п.1 или его фармацевтически приемлемая соль, где бензамидное производное представленное формулой I представляет собой 2-[(2,5-диметилпирролидин-1-ил)метил]-N-(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)бифенил-4-карбоксамид.
|
||||||||||||||||||||||||||||||||||||||

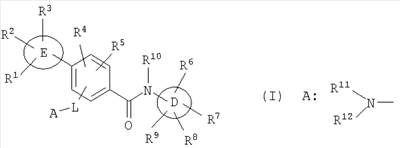
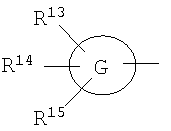 .
.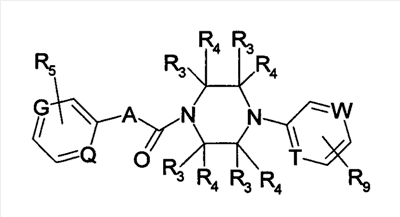
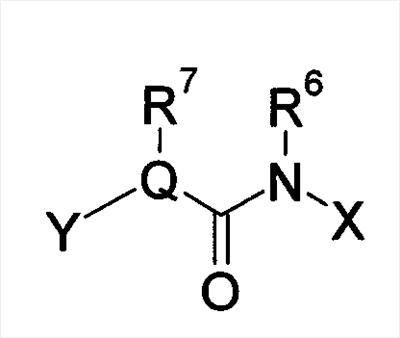
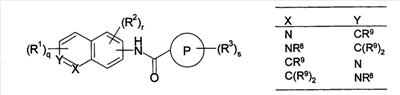
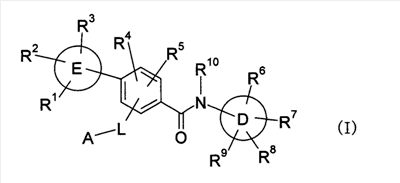
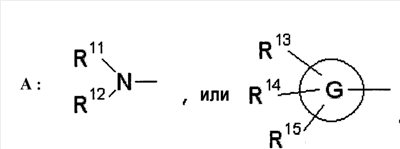
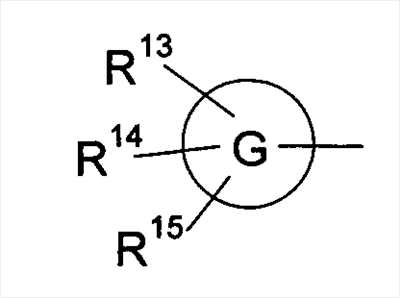
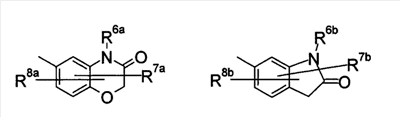
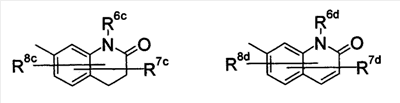
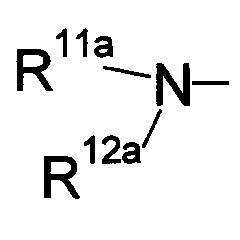
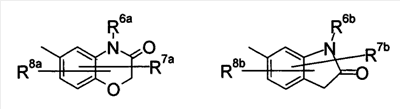
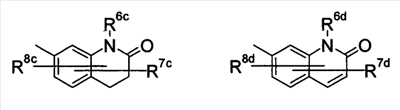
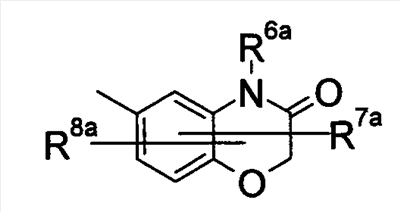
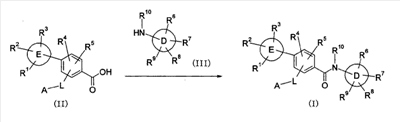
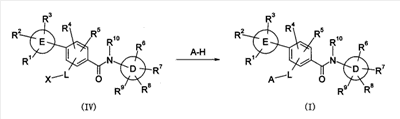
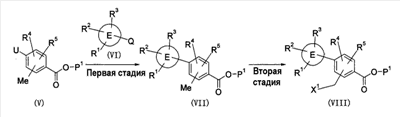
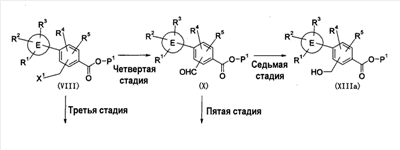
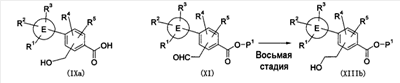
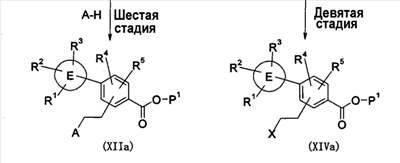
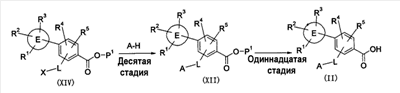
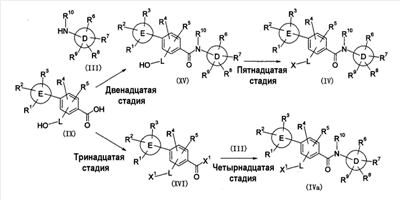
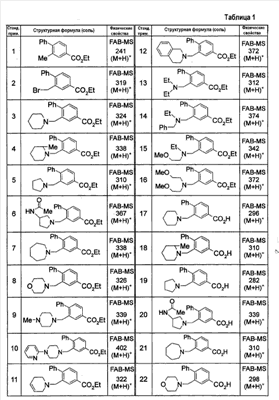
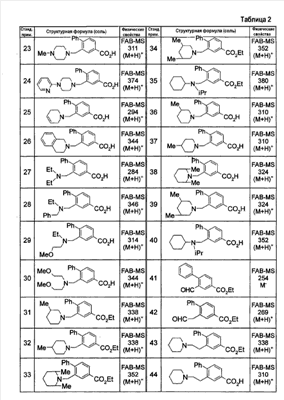
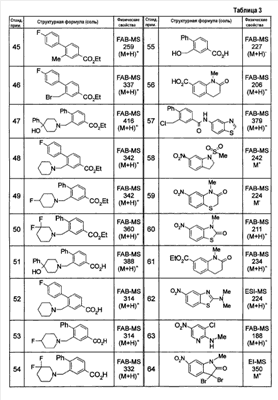
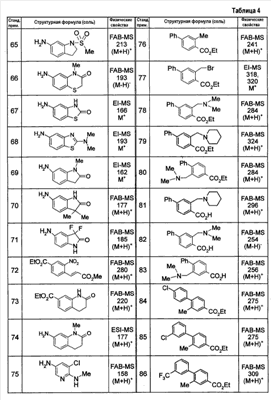
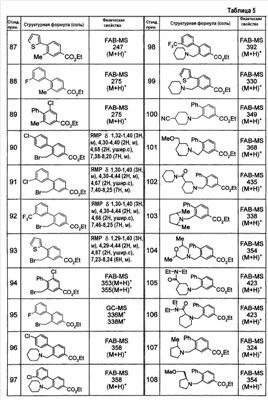
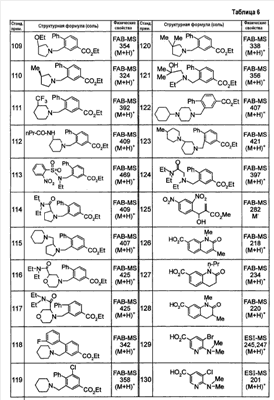
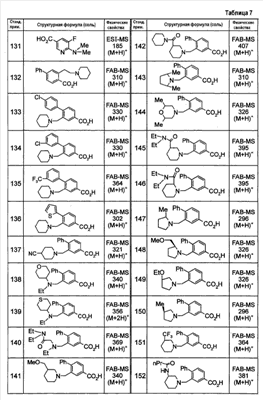
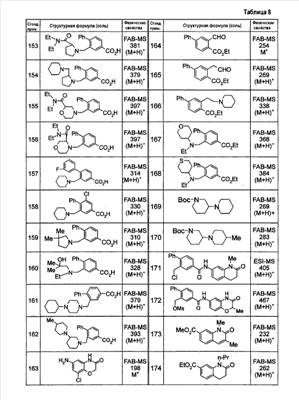
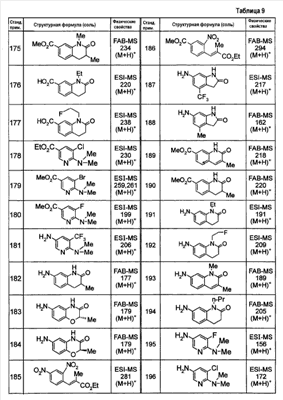
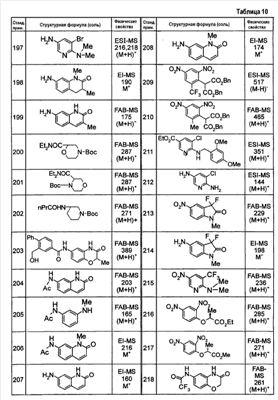
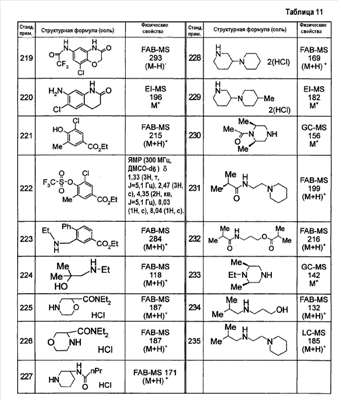
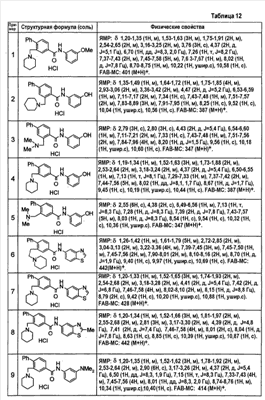
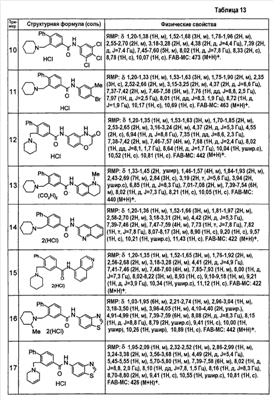

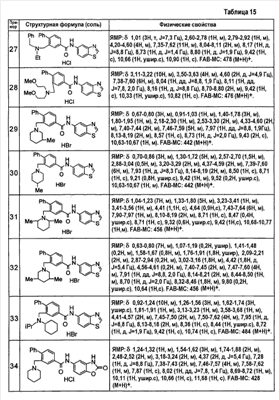
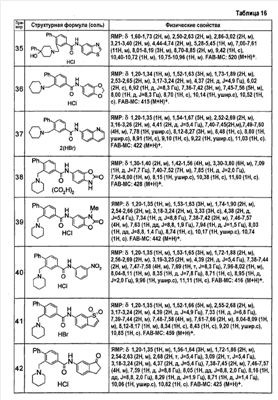
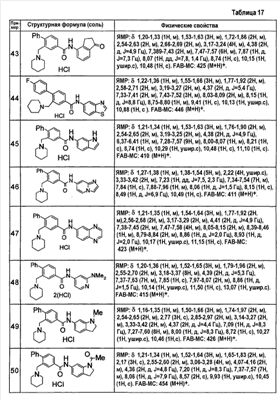
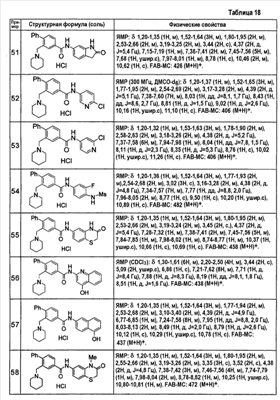
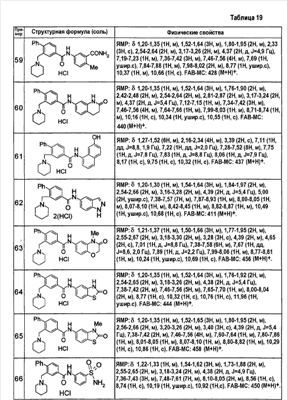
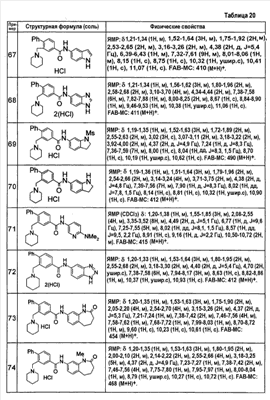
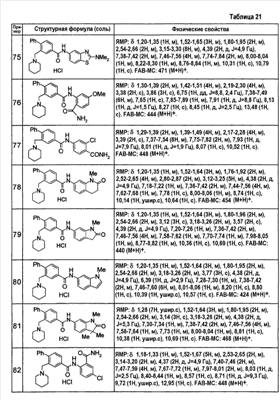
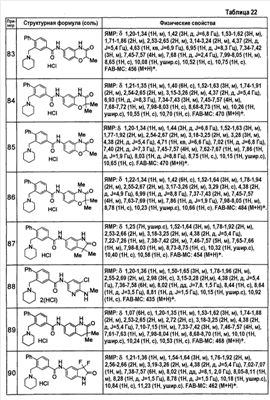
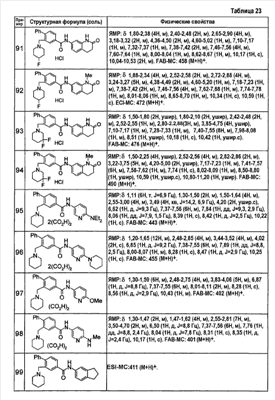
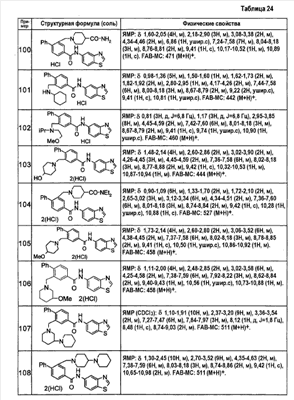
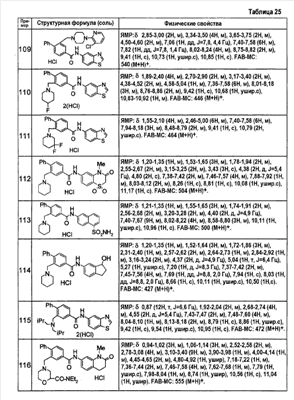
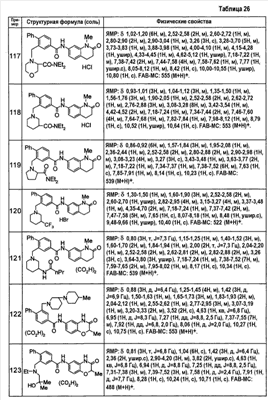
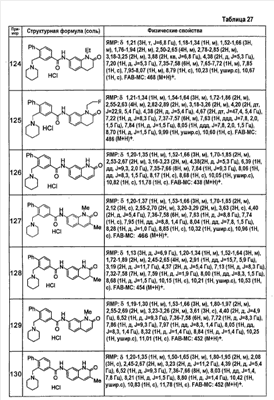
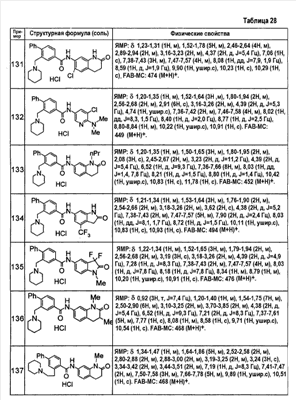

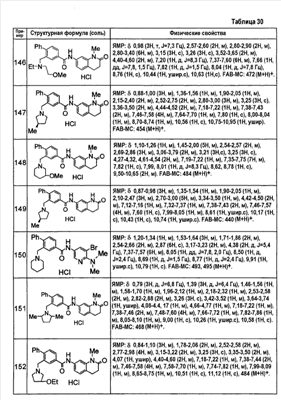
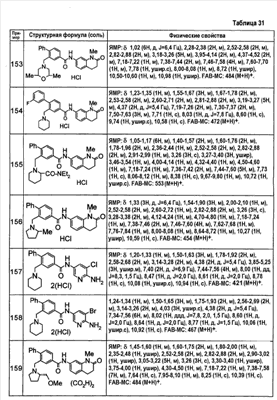
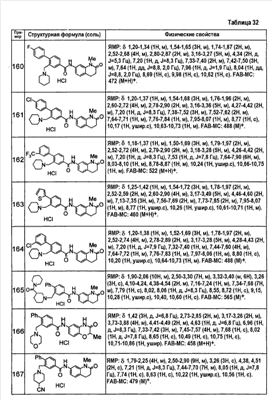

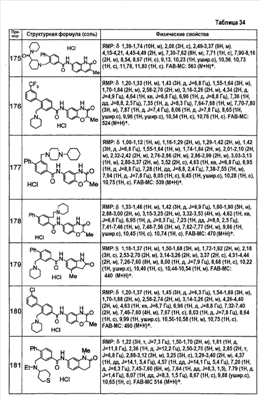
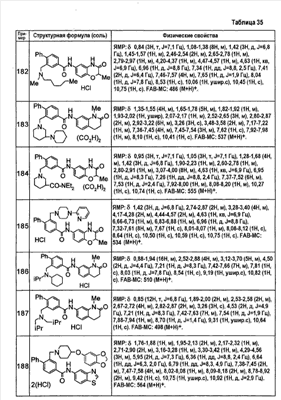
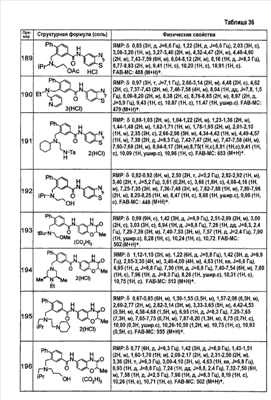
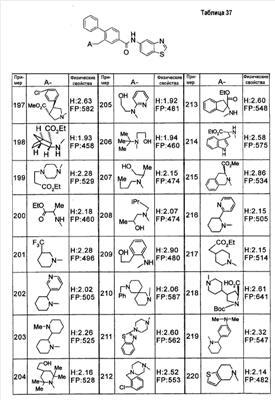
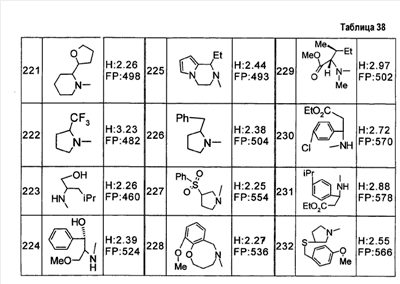
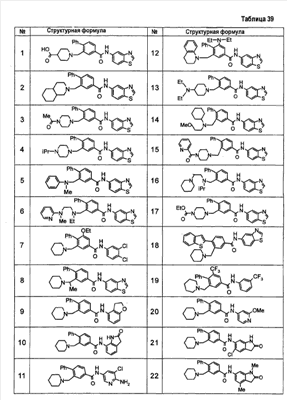
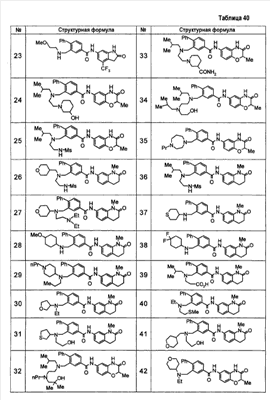
 1-кислотный белок (AGP; Sigma) добавляют в количестве 200 мкг/50 мкл, после чего дополнительно инкубируют в течение 5 минут. Инкубацию завершают быстрым фильтрованием смеси с использованием фильтра GF/B (Perkin-Elmer Life Science, USA). После семикратного промывания 25 мМ охлажденного льдом Tris-HCl-буфера (pH 7,4) радиоактивность фильтра измеряют при помощи жидкостного сцинтилляционного счетчика (2500TR; Packard, USA). Что касается специфического связывания, от величины общего связывания [3H]RTX и мембранных фракций клеток, устойчиво экспрессирующих VR1 человека, доля, замещенная 1 мкМ RTX, рассматривается как специфическое связывание, обусловленное VR1 рецептором. Оценку испытуемого соединения проводят следующим образом. А именно, уменьшение связывания при добавлении соединения определяют как относительную величину, принимая уменьшение связывания при добавлении RTX за 100%. Затем значение IC50 рассчитывают методом логистической регрессии.
1-кислотный белок (AGP; Sigma) добавляют в количестве 200 мкг/50 мкл, после чего дополнительно инкубируют в течение 5 минут. Инкубацию завершают быстрым фильтрованием смеси с использованием фильтра GF/B (Perkin-Elmer Life Science, USA). После семикратного промывания 25 мМ охлажденного льдом Tris-HCl-буфера (pH 7,4) радиоактивность фильтра измеряют при помощи жидкостного сцинтилляционного счетчика (2500TR; Packard, USA). Что касается специфического связывания, от величины общего связывания [3H]RTX и мембранных фракций клеток, устойчиво экспрессирующих VR1 человека, доля, замещенная 1 мкМ RTX, рассматривается как специфическое связывание, обусловленное VR1 рецептором. Оценку испытуемого соединения проводят следующим образом. А именно, уменьшение связывания при добавлении соединения определяют как относительную величину, принимая уменьшение связывания при добавлении RTX за 100%. Затем значение IC50 рассчитывают методом логистической регрессии.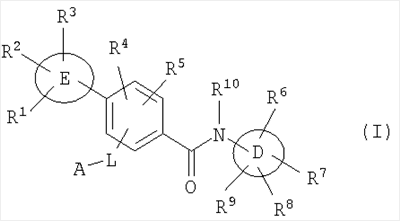
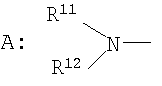 , или
, или 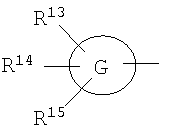 .
.