|
|
(21), (22) Заявка: 2005134569/14, 07.08.2003
(24) Дата начала отсчета срока действия патента:
07.08.2003
(30) Конвенционный приоритет:
09.08.2002 CA 2,395,584
(43) Дата публикации заявки: 27.08.2006
(46) Опубликовано: 10.09.2008
(56) Список документов, цитированных в отчете о
поиске:
RU 2141859 C1, 27.11.1999. RU 2043127 C1, 10.09.1995. US 5437660, 01.08.1995. ДОБКИН В.Г. и др. Использование различных типов лазеров в комплексном лечении больных туберкулезом органов дыхания. Проблемы туберкулеза. – 1996, №6, с 54-57.
(85) Дата перевода заявки PCT на национальную фазу:
09.11.2005
(86) Заявка PCT:
CA 03/001186 (07.08.2003)
(87) Публикация PCT:
WO 2004/014486 (19.02.2004)
Адрес для переписки:
119296, Москва, а/я 113, пат.пов. Э.П.Песикову, рег.№ 204
|
(72) Автор(ы):
Добкин Вадим Геннадьевич (RU),
ДУДЕЛЗАК Александр Е. (CA),
Кузьмин Геннадий Петрович (RU),
МИЛЛЕР Марк А. (CA),
Ловачева Ольга Викторовна (RU)
(73) Патентообладатель(и):
Добкин Вадим Геннадьевич (RU),
ДУДЕЛЗАК Александр Е. (CA),
Кузьмин Геннадий Петрович (RU),
МИЛЛЕР Марк А. (CA),
Ловачева Ольга Викторовна (RU)
|
(54) СПОСОБ И ЛАЗЕРНОЕ УСТРОЙСТВО ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ
(57) Реферат:
Изобретение относится к медицине, лазеротерапии. Проводят дренирование очага инфекции. Определяют спектр присутствующих в нем микроорганизмов. Ранжируют микроорганизмы, исходя из их относительных количеств. Очаг облучают лазером, излучающим ультрафиолетовый свет. При этом выбор длины волны облучения осуществляют для одного или нескольких видов микроорганизмов, занимающих наивысшее по ранжиру место. Способ повышает эффективность лечения за счет выбора длины волны с учетом ранжирования микроорганизмов. 3 табл., 1 ил.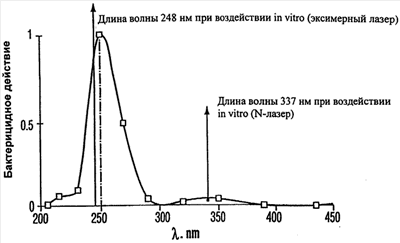
Настоящее изобретение относится к способу и устройству для лечения инфекций, в частности абсцессов, таких как кавернозный туберкулез, послеоперационные внутрибрюшные абсцессы и аналогичные состояния, а также ненормальных состояний тканей, таких как язвы, витилиго и псориаз.
Более точно, настоящее изобретение относится к системе, позволяющей одновременно осуществлять дренаж инфицированного пространства и проводить облучение очага инфекции ультрафиолетовым светом, генерированным лазером. Кроме того, настоящее изобретение относится к системе, позволяющей одновременно осуществлять дренаж внутриполостного пространства и проводить облучение очага инфекции ультрафиолетовым светом, генерированным лазером.
Применение ультрафиолетового света является известной и проверенной методикой стерилизации жидкостей и обработки питьевой воды, предназначенной для потребления в быту. В этих целях используют коротковолновое, спектрально неизбирательное коротковолновое излучение с длиной волны от около 200 нм до около 350 нм. Наиболее эффективное разрушающее действие на микроорганизмы, обычно присутствующие в необработанной воде, оказывает ультрафиолетовое излучение в так называемом диапазоне УФ-С (200-270 нм). Стандартные методики описаны в патенте США 5900211, выданном на имя Dunn и др., патенте США 4983307, выданном на имя Nesathurai, и патенте США 5236595, выданном на имя Wang.
Известно, что микроорганизмы в целом подразделяются на пять основных семейств, а именно: бактерии, вирусы, грибки, простейшие одноклеточные животные организмы (протозоа) и водоросли. Указанные пять семейств обладают различными свойствами, обитают в различных средах и по-разному реагируют на бактерицидные средства, такие как антибиотики. У бактерий, грибков, протозоа и водорослей обычно есть стенка клетки, цитоплазматическая мембрана и генетический материал, по существу, представляющий собой ДНК. Вирусы обладают некоторыми отличиями и обычно имеют наружную белковую оболочку, внутри которой заключен генетический материал, также представляющий собой ДНК. При облучении микроорганизмов жестким ультрафиолетовым светом происходит разрушение химических связей внутри структуры ДНК, в результате чего предотвращается репликация ДНК, необходимая для воспроизведения микроорганизмов. Если микроорганизм не способен к самовоспроизведению, по существу он уничтожен.
Тем не менее, клетки различных микроорганизмов неодинаковы. Микроорганизмы обладают различной восприимчивостью к излучению в УФ-диапазоне в зависимости от длины волны. Доза ультрафиолета, необходимая для разрушения различных микроорганизмов, также разнится. Такая доза (или аккумулированная энергия) зависит от периода времени, в течение которого микроорганизм подвергался воздействию света, а также от мощности излучения. Чаще всего мощность излучения измеряют в ваттах (Вт), а время в секундах.
Вышесказанное также относится к таким заболеваниям, как витилиго и псориаз даже, несмотря на то, что причиной их возникновения не являются микроорганизмы. На самом деле этиология обоих заболеваний является малопонятной, а их возбудители не выявлены.
ТАБЛИЦА 1
Средняя концентрация летальной дозы для различных микроорганизмов (в мВт·сек/см2), измеренная при иррадиации источником неизбирательного ультрафиолетового света (ксеноновая лампа с УФ-фильтром, установленным по центру в положении 254 нм). |
| Микроорганизм |
Доза/см2 |
Микроорганизм |
Доза/см2 |
| Bacillus anthracis |
8,8 |
Бациллы дизентерии |
4,2 |
| Shigella dysentariae |
4,3 |
Escherichia coli |
7,0 |
| Shigella flexneri |
3,4 |
Streptococcus faecalis |
10,0 |
| Corynbacterium Diphtheritae |
6,5 |
Staphylococcus epidermis |
5,8 |
| Vibri commo (холера) |
6,5 |
Бактериофаг (E.coli) |
6,5 |
| Гепатит |
8,0 |
Сальмонелла |
10,0 |
| Грипп |
6,6 |
Хлебопекарные дрожжи |
8,8 |
| Legionella pneumophilia |
3,8 |
Mycobacterium tuberculosis |
10,0 |
| Salmonella paratyphi |
6,1 |
Вирус полиомиелита |
7,0 |
| Salmonella typhosa |
7,0 |
|
|
Как следует из Таблицы 1, летальная доза, измеренная in vitro, неодинакова для различных микроорганизмов.
Помимо ультрафиолетового света для стерилизации жидкостей, таких как питьевая вода, в медицинской практике также применяют лазеры, генерирующие свет с узкой спектральной линией в диапазонах, отличающихся от УФ-диапазона. В данном случае важно разграничить применение в хирургических и иных целях лазеров, не излучающих ультрафиолетовый свет, и применение ультрафиолетового света для лечения инфекций, вызванных микроорганизмами. Например, некоторые методики терапии предусматривают применение гелиево-неоновых лазеров или лазеров на иттрий-алюминиевом гранате с неодимом в качестве локализованных источников тепла, за счет чего стимулируется кровоснабжение, и происходит нагрев или уничтожение выбранных тканей. Такие лазеры обычно излучают свет с длинами волна в инфракрасной или ближней инфракрасной части спектра. Любые присутствующие микроорганизмы буду поражены лазерным излучением лишь в том случае, если под действием тепла, генерированным лазером, температура таких микроорганизмов, достигнет или превысит примерно 40°С.Несмотря на то, что температуры такого уровня являются летальными для многих микроорганизмов, применение данных лазеров в качестве терапевтического средства для контроля микроорганизмов ограничено неприемлемым ущербом, который температура такого порядка несет для окружающих не пораженных инфекцией тканей.
Лечение деструктивных форм внутриполостных инфекций, таких как туберкулез и послеоперационные внутрибрюшные абсцессы является особо сложной терапевтической задачей. Патологические изменения, происходящие в структуре стенок полости и существенное количество гноя внутри полостей, препятствует эффективному введению антибиотиков. Кроме того, многие патогенные организмы, вызывающие внутриполостные инфекции, приобретают устойчивость к действию антибиотиков. Вышесказанное относится к лечению патологических изменений на поверхности тканей, таких как абсцессы, язвы, витилиго и псориаз.
Методики, применяемые в настоящее время для борьбы с внутриполостными инфекциями, не настолько эффективны, как это требуется. Обычно осуществляют двухступенчатую терапию. Во-первых, полость дренируют с целью удалить как можно больше содержимого, в том числе частиц клеток, пораженных инфекцией, и некоторое количество микроорганизмов, вызвавших инфекцию. Во-вторых, пациенту вводят антибиотик. Чтобы действие антибиотика (антибиотиков) было эффективным, необходимо в максимальной степени дренировать полость. Для этого в полость вслепую или в управляемом режиме подкожно вводят полый катетер. Вводом катетера обычно управляют при помощи ультразвукового зонда или эндоскопического волоконно-оптического устройства, встроенного в дренажный катетер. Тем не менее, дренаж затруднен текучестью жидкости и гноя, содержащего частицы клеток, удаляемых из полости, а также относительно малым размером катетера по сравнению с потенциальным объемом полости, которую требуется дренировать. Дополнительной проблемой является неизбежное присутствие микроорганизмов, как по всей полости, так и на катетере и вокруг него. Вследствие указанных проблем на практике редко удается дренировать полость в требуемой степени. Также важно отметить существование реальной опасности того, что некоторые микроорганизмы представляют собой так называемые супермикробы, являющиеся мутирующими штаммами обычных микроорганизмов, таких как стафилококки, устойчивыми к используемым в настоящее время антибиотикам.
Заболевания, вызванные внутриполостными инфекциями, такие как деструктивные формы туберкулеза и послеоперационные внутрибрюшные абсцессы, вызывают все больше беспокойства по всему миру. В Северной Америке послеоперационные внутрибрюшные абсцессы являются крупнейшим послеоперационным осложнением при проведении широкого спектра инвазивных хирургических вмешательств. По оценкам количество пациентов, у которых развиваются послеоперационные внутрибрюшные абсцессы, составляет около 30% в случае колоректальной хирургии, около 15% в случае хирургии поджелудочной железы или желчных путей и около 2% в случае гинекологической хирургии. Только в Северной Америке число пациентов, подвергаемых внутрибрюшному хирургическому вмешательству, ежегодно исчисляется миллионами. Существует несколько причин таких инфекций, включая как переносимые воздушно-капельным путем микроорганизмы, так и спонтанные утечки или перфорации желчных путей или кишечного тракта. Иными словами, любая методика, рассчитанная на лечение таких инфекций, должна исходить из того факта, что причиной инфекции почти наверняка являются несколько штаммов микроорганизмов, а каждый штамм по-разному реагирует на любое воздействие.
Из патента РФ 2141859, выданного в 1998 г. на имя Аполлонова и др., известно применение генерированного лазером ультрафиолетового света для лечения туберкулеза. При помощи соответствующего волоконно-оптического катетера генерированный лазером ультрафиолетовый свет используют для облучения и разрушения находящихся в каверне легких микроорганизмов, вызвавших туберкулезную инфекцию. При осуществлении способа деструктивную каверну легких прокалывают или дренируют, удаляют из каверны гнойное содержимое и затем подвергают внутреннюю поверхность каверны облучению генерированным лазерным источником ультрафиолетовым светом. При этом с целью обеспечить иррадиацию со средней плотностью энергии от 10 до 15 мВт·сек/см2 легкие в течение 10-12 минут подвергают расфокусированному пульсирующему облучению твердотельным лазером с длиной волны от около 220 нм до около 290 нм и плотностью энергии 200 мВт·сек/см2, при этом частоту следования импульсов регулируют в зависимости от степени разрушений в легких. Сеанс лечения завершают одноразовым введением в каверну 1,0 единицы стрептомицина или канамицина. Курс лечения состоит из 10-12 сеансов иррадиации каверны лазером.
Тем не менее, способ и устройство, описанные в патенте Аполлонова и др., имеют ряд недостатков, а именно:
(1) необходимость повторного прокалывания каверны, что увеличивает степень травмы, испытываемой пациентом.
(2) при каждом повторном прокалывании до осуществления процедуры необходимы повторные радиологические исследования, что увеличивает дозу рентгеновского облучения, которой подвергают пациента.
(3) каждый сеанс лечения завершают однократным введением в каверну полной суточной дозы противотуберкулезного лекарственного средства, растворенного в 2-3 мл 0,5% раствора новокаина. Введение полной суточной дозы противотуберкулезного лекарственного средства в виде однократной дозы не позволяет поддерживать концентрацию бактерицидов внутри каверны в течение 24 часов на постоянном уровне. Кроме того, с учетом количества противотуберкулезного лекарственного средства введение такой дозы часто вызывает раздражение тканей слизистой оболочки бронхов, дренирующих каверну, и приводит к ослабляющему кашлю и отхаркиванию с мокротой значительного количества противотуберкулезного лекарственного средства, введенного в каверну, снижению его концентрации и ослаблению его бактерицидного действия.
(4) для иррадиации каверны в патенте Аполлонова и др. используют излучение существующего лазера в УФ-С спектральном диапазоне (266 нм, четвертая гармоническая прямая лазера на иттрий-алюминиевом гранате с неодимом). Несмотря на то, что при этом обеспечивается бактерицидное водействие на патогенные организмы, вызывающие туберкулез, очевидно, что такая длина волны не является оптимальной с точки зрения уничтожения большинства микроорганизмов, вызывающих туберкулез. Указанная взаимосвязь графически представлена на чертеже. Как следует из чертежа, наиболее эффективной для уничтожения туберкулезных бактерий является волна длиной около 250 нм, а ультрафиолетовый свет с некоторыми длинами волн вообще не эффективен для лечения туберкулеза. В тоже время к свету с длинами волн, эффективными при лечении туберкулеза, более восприимчивы другие бактерии. Применение ультрафиолетового света с длиной волны, не являющейся наиболее эффективной с учетом специфики каждого штамма микроорганизма или класса штаммов, приводит к увеличению облучения, более высокой плотности энергии иррадиации и увеличению риска побочных эффектов.
Обычно пациенты, которым требуется антибактериальное лечение, уже находятся под воздействием сильного стресса, а их иммунная система часто ослаблена после обширного инвазивного хирургического вмешательства, либо они страдают от серьезной инфекции, такой как туберкулез или внутрибрюшной абсцесс.
Таким образом, крайне желательно, чтобы при проведении любой лечебной процедуры, связанной с такими инфекциями, пациент как можно в меньшей степени подвергался дополнительному стрессу. Следовательно, первоочередной задачей является избежать повторного внутриполостного хирургического проникновения.
Степень травмы, связанной с повторным внутриполостным проникновением, такова, что для контроля так называемых супермикробов, требуется применение антибиотиков в количествах, которые не способен перенести ослабленный пациент. Вышесказанное также относится к ненормальным состояниям поверхностей тканей, таким как язвы и абсцессы.
Авторы настоящего изобретения исходили из установленного факта, согласно которому летальная доза, необходимая для определенного микроорганизма, зависит от длины волны излучаемого ультрафиолетового света. Путем подбора длины волны ультрафиолетового света для определенного микроорганизма или класса микроорганизмов оптимизируют летальную дозу, повышают эффективность иррадиации и сводят к минимуму риск повреждения окружающих тканей за счет сведения к минимуму облучения ультрафиолетовым светом, которому подвергают пациента.
Как показано в приведенной выше Таблице 1, летальные дозы ультрафиолетового света неодинаковы для различных штаммов микроорганизмов. Данное утверждение справедливо в отношении витилиго и псориаза даже, несмотря на недоказанность участия микроорганизмов в их возникновении. При измерениях, сведенных в Таблице 1, применялась спектрально неизбирательная ультрафиолетовая иррадиация. В Таблицах 2 и 3 приведены результаты воздействия (in vitro) на различные микроорганизмы генерированным узкополосным лазером ультрафиолетовым светом, согласованным по спектру с наиболее эффективным бактерицидным действием (определенным путем измерения кривых для различных бактерий аналогично фиг.1). Средние летальные дозы для различных штаммов бактерий, облученных светом узкополосного лазера, существенно ниже по сравнению с дозами, приведенными в Таблице 1.

Таким образом, в первом широком варианте осуществления настоящего изобретения предложен способ лечения внутриполостных инфекций или ненормальных состояний поверхностей тканей, в ходе осуществления которого:
(а) выбирают длину волны ультрафиолетового света, на которой летальная доза в микроватт-секундах/см2 сведена до минимума,
(b) при необходимости дренируют очаг инфекции с целью удаления частиц, содержащихся в нем,
(c) облучают очаг инфекции пульсирующим ультрафиолетовым светом, генерированным лазером, с длиной волны, близкой длине волны, выбранной на стадии (а), и
(d) при необходимости повторно осуществляют стадии (b) и (с) до тех пор, пока не будет в желаемой степени получен благоприятный терапевтический эффект.
Во втором широком варианте осуществления настоящего изобретения предложен способ лечения внутриполостных инфекций или ненормальных состояний поверхностей тканей, в ходе осуществления которого:
(a) определяют спектр микроорганизмов, присутствующих в популяции микроорганизмов в полости или ткани, являющейся источником инфекции,
(b) ранжируют, по меньшей мере, основные инфицирующие микроорганизмы в популяции, присутствующей в полости, исходя из их относительных количеств,
(c) выбирают длину волны ультрафиолетового света, на которой летальная доза в микроватт-секундах/см2 сведена до минимума по меньшей мере для наивысшего по ранжиру микроорганизма, определенного на стадии (b),
(d) при необходимости дренируют очаг инфекции с целью удаления частиц, содержащихся в ней,
(e) облучают очаг инфекции пульсирующим ультрафиолетовым светом, генерированным лазером, с длиной волны, близкой длине волны, выбранной на стадии (с), и
(f) при необходимости повторно осуществляют стадии (d) и (е) до тех пор, пока не будет в желаемой степени получен благоприятный терапевтический эффект.
В третьем широком варианте осуществления настоящего изобретения предложено устройство для лечения очага инфекции, выбранной из группы, включающей внутриполостную инфекцию и ненормальное состояние поверхностей тканей, в целом имеющее:
(А) катетер, вводимый в очаг инфекции и удаляемый из него,
(B) лазерное устройство, генерирующее, по меньшей мере, один источник пульсирующего ультрафиолетового света с известной интенсивностью и длиной волны в диапазоне от около 200 нм до около 700 нм, и
(C) дренажную систему, служащую для удаления частиц жидкости из очага инфекции,
в котором:
(i) катетер имеет, по меньшей мере, один волоконно-оптический волновод, доставляющий ультрафиолетовый свет, генерированный лазерным устройством, к очагу внутри полости, а
(ii) лазерное устройство выбирают из группы, включающей лазерное устройство, генерирующее луч ультрафиолетового света с одной заданной длиной волны и интенсивностью, и лазерное устройство, генерирующее множество лучей ультрафиолетового света, каждый из которых имеет известную длину волны и интенсивность.
Предпочтительно, по меньшей мере, одно волоконно-оптическое устройство, доставляющее луч ультрафиолетового света, представляет собой устройство одноразового использования.
Предпочтительно, лазерное устройство представляет собой комбинационный твердотельный лазер с перестраиваемой частотой. Лазерное устройство также может представлять собой комбинационный твердотельный лазер с перестраиваемой частотой и накачкой светодиодами.
Предпочтительно, катетер имеет, по меньшей мере, волоконно-оптический волновод, соединяемый с лазером и позволяющий освещать полость, и отдельную прокачиваемую дренажную систему.
Предпочтительно, катетер дополнительно имеет вторую волоконно-оптическую систему, позволяющую осматривать внутренность полости.
В качестве альтернативы катетер также имеет ультразвуковую систему зондирования.
Предпочтительно, катетер также имеет дренажную систему, служащую для удаления частиц жидкости из очага инфекции.
Авторы настоящего изобретения исходили из того, что вопреки общеизвестности того факта, что ультрафиолетовый свет широкого спектра является летальным для разнообразных известных микроорганизмов, включая вирусы, обладающие исключительной устойчивостью к антибиотикам, до настоящего времени отсутствовало полное понимание того, что существует “наилучшая” частота для каждого микроорганизма, на которой ультрафиолетовый свет оказывает наиболее смертоносное воздействие на такой микроорганизм. Данное утверждение также справедливо в отношении витилиго и псориаза даже, несмотря на то, что возбудители обоих болезней до сих пор не выявлены. Благодаря этому для достижения желаемой степени благоприятного терапевтического эффекта возможно использовать наименьшую дозу в микроваттах/см. Однако при этом также возникает проблема, заключающаяся в том, что лазерные устройства, генерируют лазерный луч лишь с очень узким диапазоном длин волн, т.е. лазерный луч является преимущественно монохроматическим. Из этого следует, что при использовании лазерного устройства даже с перестраиваемой до определенной степени частотой на длину волны, соответствующую или по меньшей мере близкую требуемой, наиболее смертоносной длине волны, такое устройство генерирует луч лишь с одной длиной волны, являющейся наиболее смертоносной лишь для одного микроорганизма (или группы близкородственных микроорганизмов).
Тем не менее, как указывалось выше, в типичном случае обширного инвазивного хирургического вмешательства в брюшную полость причиной инфекций являются несколько микроорганизмов. Обычно в популяцию микроорганизмов, присутствующих в полости, входит целый спектр микроорганизмов, а причиной инфекции является вся популяция в целом. Для борьбы с таким широким спектром микроорганизмов потребовалось бы множество лазерных устройств.
В последнее время появился альтернативный лазерный источник, решающий указанные проблемы. Это так называемый комбинационный твердотельный лазер с накачкой светодиодами. Он относится к компактным твердотельным устройствам, работающим с высокой частотой следования импульсов и способным генерировать лучи с несколькими частотами путем последовательного введения различных комбинационных материалов в пульсирующий лазерный луч. Такие устройства также надежно работают с высокой частотой следования импульсов порядка 0,2 кГц. Таким образом, появилось лазерное устройство с реально перестраиваемой частотой, которое можно настроить таким образом, чтобы оно являлось наиболее смертоносным для нескольких микроорганизмов, вызывающих внутриполостную инфекцию, возникающую после обширного инвазивного хирургического вмешательства либо по иным причинам, например, инфекцию внутреннего уха. Лазерные устройства такого типа изготавливает канадская компания Passat Ltd., (Торонто, провинция Онтарио). Стандартное устройство способно генерировать до девяти лучей с различными, настраиваемыми длинами волн в диапазоне от около 200 нм до около 1200 нм. Такие устройства имеют небольшие размеры, отличаются компактностью, не используют при работе опасные газы и хорошо адаптированы к эксплуатации в медицинских учреждениях.
На первой стадии осуществления способа, предложенного в настоящем изобретении, оценивают очаг инфекции с целью определить длину волны, на которой требуемая эффективная доза будет сведена к минимуму. Поскольку большинство инфекций предполагает присутствие микроорганизмов, на первой стадии обычно необходимо оценить микроорганизмы с целью установить состав популяции и ранжировать микроорганизмы пропорционально их количеству в популяции. Затем определяют наиболее смертоносную длину волны для каждого из микроорганизмов, например, при помощи испытаний, которые проводят на образцах микроорганизмов, взятых из имеющихся коллекций. После этого создают банк данных, в котором для каждого микроорганизма указана наиболее предпочтительная частота иррадиации. Так, например, было установлено, что для микроорганизмов, вызывающих туберкулез, наиболее смертоносными являются длины волн в диапазоне от около 248 нм до около 337 нм, при этом более длинные волны являются гораздо менее эффективными. В то же время при определении наиболее смертоносной длины волны также желательно определить наиболее эффективную частоту следования лазерных импульсов.
На следующей стадии используют лазерное устройство, генерирующее излучение с длиной волны, желательной для одного вида микроорганизмов, занимающих наивысшее по ранжиру место в популяции либо для трех или четырех видов, занимающих наивысшие по ранжиру места.
Очаг инфекции затем повергают иррадиации с целью воздействия на пораженный очаг внутри полости требуемой дозой облучения в микроваттах/см2. Затем пациента наблюдают в течение соответствующего периода времени с целью определить, необходима ли повторная иррадиация полости.
Иррадиация с выбранной длиной волны или длинами волн может также сопровождаться обычной терапией с использованием антибиотиков.
В рамках объема настоящего изобретения также предусмотрено, что для сведения к минимуму стресса, испытываемого пациентом, используют единый многоканальный катетер, имеющий, по меньшей мере, как волоконную оптику, необходимую для работы лазера, так и каналы, необходимые для эффективного осуществления дренажа и промывания полости. Для эффективного лечения, по меньшей мере, некоторых внутриполостных инфекций желательно, чтобы медицинский персонал имел возможность непосредственного визуального контроля пространства полости при помощи волоконно-оптических устройств, излучающих свет видимого диапазона, либо косвенного контроля при помощи ультразвукового зонда. Известны катетеры такого типа. Типичные катетеры, совместимые с лазером и имеющие дренажные каналы и т.п., описаны среди прочего в патенте США 5437660, выданном на имя Johnson и др., патенте США 5593404, выданном на имя Costello и др., и патенте США 5957404, выданном на имя Doiron и др.
Формула изобретения
Способ обработки очага инфекции, включающий дренирование очага инфекции, определение спектра присутствующих микроорганизмов, выбор соответствующей длины волны, облучение очага лазером, излучающим ультрафиолетовый свет и имеющим выбранную длину волны, отличающийся тем, что ранжируют микроорганизмы, исходя из относительных количеств, а выбор длины волны облучения осуществляют для одного или нескольких видов микроорганизмов, занимающих наивысшее по ранжиру место.
РИСУНКИ
|
|