|
|
(21), (22) Заявка: 2004130281/15, 27.03.2003
(24) Дата начала отсчета срока действия патента:
27.03.2003
(30) Конвенционный приоритет:
28.03.2002 GB PCT/GB02/01578
(43) Дата публикации заявки: 20.01.2006
(46) Опубликовано: 10.09.2008
(56) Список документов, цитированных в отчете о
поиске:
WO 99/48482 А, 30.09.1999. WO 99/48507 А, 30.09.1999. WO 01/23406 А, 05.04.2007. ХАРКЕВИЧ Д.А. Фармакология. – М.: Медицина, 1987, с.47-48. БЕЛИКОВ В.Г. Фармацевтическая химия. – М.: Высшая школа, 1993, т.1, с.43-47.
(85) Дата перевода заявки PCT на национальную фазу:
27.10.2004
(86) Заявка PCT:
GB 03/01380 (27.03.2003)
(87) Публикация PCT:
WO 03/082893 (09.10.2003)
Адрес для переписки:
101000, Москва, Центр, а/я 732, “Агентство ТРИА РОБИТ”, пат.пов. Г.М.Вашиной, рег.№ 139
|
(72) Автор(ы):
РИС Дарэл (GB),
ГАННИНГ Фил (GB),
ОРСИ Антония (GB),
КСИА Зонгкин (CN),
ХУ Яар (CN)
(73) Патентообладатель(и):
Фитофарм ПиэЛСи (GB)
|
(54) ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ И ПРИМЕНЕНИЯ САПОГЕНИНОВ И ИХ ПРОИЗВОДНЫХ
(57) Реферат:
Изобретение относится к области фармакологии и медицины и касается применения средства общей формулы 1а в качестве активного компонента композиции для лечения людей и животных, страдающих от не связанной с познавательной функцией нейродегенерации, не связанной с познавательной функцией нервно-мышечной дегенерации, моторно-сенсорной нейродегенерации или дисфукции или потери рецепторов. Изобретение позволяет улучшить лечение указанных заболеваний. 2 з.п. ф-лы, 11 табл., 6 ил.
Текст описания приведен в факсимильном виде.                                             
Формула изобретения
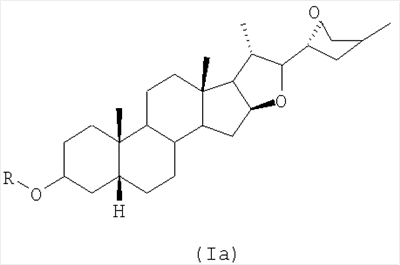
1. Применение активного средства, которое выбирают из соединений общей формулы Ia:
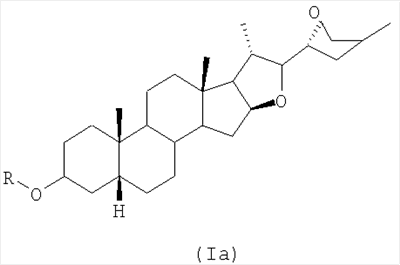
где группу R выбирают из атома водорода, алкилкарбонил-, алкоксикарбонил-, алкилкарбамоил- или арилкарбонилгруппы или сульфогруппы (HO3S); фосфоногруппы ((НО)2Р(О)-); или моно-, ди- или трисахарида, где алкилгруппу возможно замещают арил-, амино-, моно- или диалкиламиногруппой, остатком карбоновой кислоты (-СООН) или комбинацией их; и
всех их рацемических смесей, всех их фармацевтически приемлемых солей и всех их смесей и комбинаций
в качестве активного компонента композиции для лечения какой-либо из следующих болезней у людей и животных, страдающих от или восприимчивых к депрессии, шизофрении, мышечной дистрофии, включая плечелопаточно-лицевую миопатию (FSH), мышечную дистрофию Дюшенна, мышечную дистрофию Беккера и мышечную дистрофию Бруца, дистрофию Фука, миотоническую дистрофию, корнеальную дистрофию, рефлекторный синдром симпатической дистрофии (reflex sympathetic dystrophy syndrome, RSDSA), нейроваскулярную дистрофию, болезнь Хантингтона; мотонейронному заболеванию, включая боковой амиотрофической склероз (amyotrophic lateral sclerosis, ALS), травматической нейродегенерации, например последующий удар или последующую травму (например, травматическое повреждение головы или повреждение спинного мозга), болезнь Баттена, синдром Коккейна, синдром Дауна, кортикобазальную ганглионарную дегенерацию, множественную системную атрофию, церебральную атрофию, множественную системную атрофию, церебральную атрофию, оливопонтоцеребеллярную атрофию, дентаторубральную атрофию, паллидолуизианскую атрофию, спинобульбарную атрофию; ретробульбарному невриту, подострому склерозирующему панэнцефалиту (sclerosing panencephalitis, SSPE), расстройству недостаточности внимания, поствирусному энцефалиту, постполиомиелитному синдрому, синдрому Фара, синдрому Юберта, синдрому Гийена-Барре, лиссэнцефалии, болезни Моямоа, нейронным миграционным расстройствам, полиглутаминовой болезни, болезни Ниманна-Пика, прогрессирующей многоочаговой лейкодистрофии, ложной опухоли мозжечка, болезни Рефсума, синдрому Целлвегера, супрануклеарному параличу, наследственной атаксии Фридрейха, спиромозжечковой атаксии 2 типа, синдрому Ретта, синдрому Шая-Дрейджера, туберозному склерозу, болезни Пика, заболеванию нервной системы, включая наследственное заболевание нервной системы, диабетическую нейропатию и митотическую нейропатию, “prion-based” нейродегенерации, включая болезнь Крейтцфельдта-Якоба (Creutzfeldt-Jakob, CJD), вариант CJD, новый вариант CJD, бычью губкообразную энцефалопатию (bovine spongiform encephalopathy, BSE), GSS, FFI, куру и синдром Адлера; болезни Джозефа, острому рассеянному энцефаломиелиту, арахноидиту, сосудистым поражениям центральной нервной системы, потери нейронной функции конечности, болезни Шарко-Мари-Тута, восприимчивости к сердечной недостаточности и дегенерации желтого пятна.
2. Применение по п.1, в котором одно или несколько соединений выбирают из:
сарсасапогенина;
сарсасапогенина катилата;
сарсасапогенина ацетата;
сарсасапогенина сукцината и его фармацевтически приемлемых солей;
сарсасапогенина глицината и его фармацевтически приемлемых солей;
сарсасапогенина аланината и его фармацевтически приемлемых солей;
сарсасапогенина валината и его фармацевтически приемлемых солей;
сарсасапогенина фенилаланината и его фармацевтически приемлемых солей;
сарсасапогенина изолейцината и его фармацевтически приемлемых солей;
сарсасапогенина метионината и его фармацевтически приемлемых солей;
эписарсасапогенина;
эписарсасапогенина катилата;
эписарсасапогенина ацетата;
эписарсасапогенина сукцината и его фармацевтически приемлемых солей;
эписарсасапогенина глицината и его фармацевтически приемлемых солей;
эписарсасапогенина аланината и его фармацевтически приемлемых солей;
эписарсасапогенина валината и его фармацевтически приемлемых солей;
эписарсасапогенина фенилаланината и его фармацевтически приемлемых солей;
эписарсасапогенина изолейцината и его фармацевтически приемлемых солей;
эписарсасапогенина метионината и его фармацевтически приемлемых солей;
смилагенина;
смилагенина катилата;
смилагенина ацетата;
смилагенина сукцината и его фармацевтически приемлемых солей;
смилагенина глицината и его фармацевтически приемлемых солей;
смилагенина аланината и его фармацевтически приемлемых солей;
смилагенина валината и его фармацевтически приемлемых солей;
смилагенина фенилаланината и его фармацевтически приемлемых солей;
смилагенина изолейцината и его фармацевтически приемлемых солей;
смилагенина метионината и его фармацевтически приемлемых солей;
эписмилагенина;
эписмилагенина катилата;
эписмилагенина ацетата;
эписмилагенина сукцината и его фармацевтически приемлемых солей;
эписмилагенина глицината и его фармацевтически приемлемых солей;
эписмилагенина аланината и его фармацевтически приемлемых солей;
эписмилагенина валината и его фармацевтически приемлемых солей;
эписмилагенина фенилаланината и его фармацевтически приемлемых солей;
эписмилагенина изолейцината и его фармацевтически приемлемых солей;
эписмилагенина метионината и его фармацевтически приемлемых солей;
сапониновых производных сарсасапогенина, эписарсасапогенина, смилагенина и эписмилагенина, в которых в каждом случае атом углерода в 3-м положении содержит О-углеводный остаток, где углеводный остаток выбирают из глюкозы, маннозы, фруктозы, галактозы, мальтозы, целлобиозы, сахарозы, рамнозы, ксилозы, арабинозы, фукозы, хиновозы, апиозы, лактозы, галактозы-глюкозы, глюкозы-арабинозы, фукозы-глюкозы, рамнозы-глюкозы, глюкозы-глюкозы-глюкозы, глюкозы-рамнозы, маннозы-глюкозы, глюкозы-(рамнозы)-глюкозы, глюкозы-(рамнозы)-рамнозы, глюкозы-(глюкозы)-глюкозы, галактозы-(рамнозы)-галактозы;
и их фармацевтически приемлемых солей.
3. Применение по п.2, в котором одно или несколько соединений выбирают из сарсасапогенина и смилагенина.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 28.03.2009
Извещение опубликовано: 20.08.2010 БИ: 23/2010
|
|