|
|
(21), (22) Заявка: 2005134236/15, 29.03.2004
(24) Дата начала отсчета срока действия патента:
29.03.2004
(30) Конвенционный приоритет:
04.04.2003 US 60/460,659
(43) Дата публикации заявки: 10.06.2006
(46) Опубликовано: 10.09.2008
(56) Список документов, цитированных в отчете о
поиске:
WO 0230463 А2, 18.04.2002. EP 0909564 A1, 21.04.1999. WO 9704801 A1, 13.02.1997. RU 2104713 C1, 20.02.1998. RU 95107153 A, 27.11.1997.
(85) Дата перевода заявки PCT на национальную фазу:
07.11.2005
(86) Заявка PCT:
US 2004/009613 (29.03.2004)
(87) Публикация PCT:
WO 2004/091658 (28.10.2004)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
ЛЮ Цзюнь (US),
ШАЙР Стивен (US)
(73) Патентообладатель(и):
ДЖЕНЕНТЕК, ИНК. (US),
НОВАРТИС АГ (CH)
|
(54) ВЫСОКОКОНЦЕНТРИРОВАННЫЕ КОМПОЗИЦИИ АНТИТЕЛ И БЕЛКОВ
(57) Реферат:
Изобретение относится к фармакологии и аллергологии и представляет собой стабильную жидкую композицию, содержащую анти-IgE-антитело или моноклональное анти-IgE-антитело, аргинин-HCI, гистидин, полисорбат и может быть использовано для подкожного введения пациенту при необходимости. Изобретение обеспечивает оптимальные высококонцентрированные композиции антител, которые являются стабильными, имеют низкую вязкость и мутность, 14 н. и 25 з.п. ф-лы, 7 табл., 10 ил.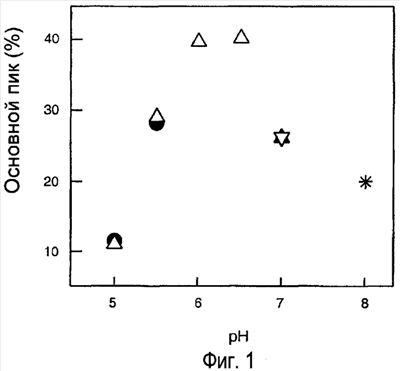
Уровень техники
Область техники, к которой относится изобретение
Настоящее изобретение относится к высококонцентрированным композициям антител, которые являются особенно подходящими для подкожного введения. Кроме того, изобретение относится к стабильным высококонцентрированным (например,  100 мг/мл белка) жидким композициям. 100 мг/мл белка) жидким композициям.
Описание предшествующего уровня техники
Существует значительная потребность в высококонцентрированных жидких композициях антител. Однако с высококонцентрированными композициями белков связаны некоторые проблемы. Одной проблемой является нестабильность вследствие образования частиц. В случае восстановленных лиофилизированных препаратов с получением жидких композиций эта проблема может быть преодолена путем использования поверхностно-активных веществ (например, полисорбата), но поверхностно-активные вещества непригодны для жидких композиций, так как они делают затруднительной последующую обработку. Кроме того, поверхностно-активные вещества в дальнейшем не уменьшают повышенную вязкость, обусловленную многочисленными межмолекулярными взаимодействиями вследствие макромолекулярной природы антител.
Хотя было показано, что поверхностно-активные вещества значительно снижают степень образования частиц белков, они не решают проблему повышенной вязкости, которая затрудняет манипуляцию и введение концентрированных композиций антител. Антитела имеют тенденцию к образованию вязких растворов при высокой концентрации вследствие их макромолекулярной природы и способности к межмолекулярным взаимодействиям. Кроме того, в качестве стабилизаторов часто используют большие количества фармацевтически приемлемых сахаров. Такие сахара могут усиливать межмолекулярные взаимодействия, повышая тем самым вязкость композиции. Композиции с высокой вязкостью трудны в получении, ими трудно наполнять шприц и подкожно вводить. Применение силы при манипулировании вязкими композициями приводит к избыточному образованию пены, что может приводить к денатурации и инактивации активных биологических веществ. Удовлетворительное решение этой проблемы отсутствует.
Хотя известный уровень техники указывает на многочисленные примеры эксципиентов, которые могут быть подходящим образом использованы для создания фармацевтических композиций, очень немногие белки могут быть успешно получены с концентрацией около 100 мг/мл и очень немногие способы для такого получения были описаны.
Авторы настоящего изобретения обнаружили, что аргинин, в частности аргинин-HCl, является особенно подходящим для высококонцентрированных жидких композиций белков или антител.
Стабильные изотонические лиофилизированные композиции белков описаны в публикации РСТ WO 97/04801, опубликованной 13 февраля 1997 года, полное описание которой приведено здесь в качестве ссылки. Описанные лиофилизированные композиции могут быть восстановлены с получением высококонцентрированных белковых жидких композиций без видимой потери стабильности. Однако возможные проблемы, связанные с высокой вязкостью этих восстановленных композиций, не решаются. Агрегацию белков ранее снижали добавлением сахаров, но тем самым могли разительно повысить вязкость и осмолярность, делая посредством этого непрактичными обработку и использование.
Авторы публикации РСТ заявки WO02/30463, опубликованной 18 апреля 2002 года, описывают композиции с высокой концентрацией белка, но низкой вязкостью, что достигается: 1) посредством низкого рН (около 4,0-5,3); 2) посредством высокого рН (около 6,5-12,0) или 3) увеличением общей ионной силы композиции путем добавления солей или буферов. Однако хотя увеличение ионной силы действительно снижает вязкость композиции (например, с использованием NaCl), такое увеличение также может приводить к увеличенной мутности раствора, которая часто связана с образованием белковых частиц (например, агрегацией). Таким образом, оптимальная высококонцентрированная белковая композиция должна преодолеть проблемы стабильности, вязкости, осмолярности и мутности.
Сущность изобретения
Настоящее изобретение относится к высококонцентрированным композициям белков и антител, которые являются стабильными и имеют низкую вязкость и мутность.
В частности, настоящее изобретение относится к высококонцентрированным композициям антител низкой вязкости, содержащим белок или антитело (100-260 мг/мл), гистидин (10-100 мМ), аргинин-HCl (50-200 мМ) и полисорбат (0,01%-0,1%), имеющим рН 5,5-7,0, вязкость 50 сСт или менее и осмолярность 200 мОсм/кг-450 мОсм/кг. Альтернативно белок или антитело в этих композициях может быть в диапазоне 120-260 мг/мл, альтернативно 150-260 мг/мл, альтернативно 180-260 мг/мл, альтернативно 200-260 мг/мл белка или антитела. Альтернативно концентрация аргинина-HCl находится в диапазоне 100-200 мМ, альтернативно 150-200 мМ, альтернативно 180-200 мМ.
Альтернативно настоящее изобретение относится к высококонцентрированным композициям антител низкой мутности, содержащим антитело (40-150 мг/мл), гистидин (10-100 мМ), сахар (например, трегалозу или сахарозу, 20-350 мМ) и полисорбат (0,01%-0,1%).
В конкретном варианте осуществления изобретение относится к композиции, содержащей высокие концентрации высокомолекулярных белков, таких как антитела или иммуноглобулины. Эти антитела могут быть, например, антителами, направленными против конкретно заданного антигена. В конкретном аспекте этим антигеном является IgE (например, rhuMAbE-25 и rhuMAbE-26, описанные в патенте США 6329509 и WO 99/01556). Альтернативно анти-IgE-антителом может быть антитело CGP-5101 (Hu-901), описанное Corne et al., J. Clin. Invest. 99(5): 879-887 (1997), WO 92/17207, и АТТС Deposit Nos. BRL-10706 и 11130, 11131, 11132, 11133. Альтернативно антиген может включать в себя: белки CD CD3, CD4, CD8, CD19, CD20, CD34 и CD40; члены семейства HER, такие как рецептор EGF, рецептор HER2, HER3 или HER4; 2С4, 4D5, PSCA, LDP-2, молекулы клеточной адгезии, такие как LFA-1, Mac1, p150, 95, VLA-4, ICAM-1, VCAM и интегрин  v/ v/ 3, в том числе его 3, в том числе его  – и – и  -субъединица (например, анти-CD11а-, анти-CD18- или анти-CD11 -субъединица (например, анти-CD11а-, анти-CD18- или анти-CD11 -антитела); факторы роста, такие как VEGF; антигены групп крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl, CTLA-4 и белок С. -антитела); факторы роста, такие как VEGF; антигены групп крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl, CTLA-4 и белок С.
Композиции по настоящему изобретению могут быть фармацевтическими композициями. В конкретном аспекте композиция доставляется подкожно.
Еще в одном из вариантов осуществления настоящее изобретение относится к способу лечения, профилактического или терапевтического, нарушения, лечение которого может осуществляться белком или антителом композиции, который предусматривает введение описанных здесь композиций, содержащих терапевтически эффективное количество белка или антитела. Такие композиции могут использоваться, в частности, для подкожного введения. В конкретном аспекте нарушением является IgE-опосредованное нарушение. Еще в одном конкретном аспекте IgE-опосредованным нарушением является аллергический ринит, астма (например, аллергическая астма и неаллергическая астма), атопический дерматит, аллергическая гастроэнтеропатия, гиперчувствительность (например, анафилаксия, крапивница, пищевые аллергии и т.д.), аллергический бронхо-легочный аспергиллез, паразитарные заболевания, интестициальный цистит, гипер-IgE-синдром, атаксия-телеангиэктазия, синдром Вискотта-Олдрича, алимфоплазия вилочковой железы, IgE-миелома и реакция трансплантат против хозяина.
Еще в одном из вариантов осуществления изобретение относится к изделию, включающему в себя контейнер, содержащий композицию, описанную здесь. В одном из аспектов, изделие является заранее наполненным шприцом. В другом конкретном аспекте заранее наполненный шприц дополнительно находится в инъекционном устройстве. В другом конкретном аспекте инъекционным устройством является шприц для самоинъекции.
Краткое описание графического материала
Фигура 1. Гидрофобная хроматография расщепленного пепсином моноклонального анти-IgE-антитела. Образцы готовили при разных рН и в разных буферах: ( ) 20 мМ ацетат, ( ) 20 мМ ацетат, ( ) 20 мМ сукцинат, ( ) 20 мМ сукцинат, ( ) 20 мМ Na2НРО4, ( ) 20 мМ Na2НРО4, ( ) 20 мМ К2РО4 и (*) 20 мМ Трис-буфер. Образцы хранили при 30оС в течение 6 месяцев. ) 20 мМ К2РО4 и (*) 20 мМ Трис-буфер. Образцы хранили при 30оС в течение 6 месяцев.
Фигура 2. Гель-фильтрационная хроматография моноклонального анти-IgE-антитела, которое хранили при 40оС в течение 6 месяцев. Образцы готовили при разных рН и в разных буферах: ( ) 20 мМ глутамат, ( ) 20 мМ глутамат, ( ) 20 мМ ацетат, ( ) 20 мМ ацетат, ( ) 20 мМ сукцинат, ( ) 20 мМ сукцинат, ( ) 20 мМ гистидин, ( ) 20 мМ гистидин, ( ) 20 мМ Na2НРО4, ( ) 20 мМ Na2НРО4, ( ) 20 мМ К2РО4 и (*) 20 мМ Трис-буфер. ) 20 мМ К2РО4 и (*) 20 мМ Трис-буфер.
Фигура 3. Активность моноклонального анти-IgE-антитела, которое хранили при 30оС в течение 6 месяцев. Образцы готовили при разных рН и в различных буферах: ( ) 20 мМ ацетат, ( ) 20 мМ ацетат, ( ) 20 мМ сукцинат, ( ) 20 мМ сукцинат, ( ) 20 мМ гистидин, ( ) 20 мМ гистидин, (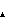 ) 20 мМ Na2НРО4, ( ) 20 мМ Na2НРО4, ( ) 20 мМ К2РО4 и (*) 20 мМ Трис-буфер. ) 20 мМ К2РО4 и (*) 20 мМ Трис-буфер.
Фигура 4. Эффект полисорбата 20 на мутность подвергнутого стрессу моноклонального IgE-антитела. Образцы содержат 100 мг/мл антитела, 20 мМ сукцината, 192 мМ трегалозы и различные количества полисорбата 20 при рН 6,0. Концентрации полисорбата равны ( ) 0, ( ) 0, (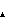 ) 0,01%, ( ) 0,01%, ( ) 0,02% и ( ) 0,02% и ( ) 0,05%. ) 0,05%.
Фигура 5. Мутность моноклонального анти-IgE-антитела при 150 мг/мл с различными эксципиентами (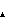 ) CaCl2, ( ) CaCl2, ( ) MgCl2 и ( ) MgCl2 и ( ) аргинин-HCl. ) аргинин-HCl.
Фигура 6. Мутность моноклонального анти-IgE-антитела при 150 мг/мл с различными эксципиентами. Образцы хранили при (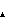 ) -70оС, ( ) -70оС, ( ) 2-8оС, ( ) 2-8оС, ( ) 15оС, ( ) 15оС, ( ) 30оС и ( ) 30оС и ( ) 40оС. ) 40оС.
Фигура 7. Анализы с использованием гиброфобной хроматографии расщепленного папаином моноклонального анти-IgE-антитела. Образцы готовили при 150 мг/мл с различными эксципиентами и хранили при ( ) -70оС, ( ) -70оС, ( ) 2-8оС, ( ) 2-8оС, (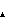 ) 15оС, ( ) 15оС, ( ) 30оС и ( ) 30оС и ( ) 40оС. ) 40оС.
Фигура 8. Гель-фильтрационная хроматография моноклонального анти-IgE-антитела при 150 мг/мл в ( ) 200 мМ аргинине-HCl, 23 мМ гистидине, рН 6,0; ( ) 200 мМ аргинине-HCl, 23 мМ гистидине, рН 6,0; (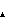 ) 182 мМ аргинине-HCl, 20 мМ гистидине, рН 6,0, ( ) 182 мМ аргинине-HCl, 20 мМ гистидине, рН 6,0, ( )182 мМ аргинине-HCl, 20 мМ гистидине, 91 мМ сахарозе, рН 6,0, ( )182 мМ аргинине-HCl, 20 мМ гистидине, 91 мМ сахарозе, рН 6,0, ( ) 50 мМ MgCl2, 27 мг/мл трегалозе, 0,01% ацетате, ( ) 50 мМ MgCl2, 27 мг/мл трегалозе, 0,01% ацетате, ( ) 50 мМ MgCl2, 30 мМ MgAc2, 0,01% ацетате и ( ) 50 мМ MgCl2, 30 мМ MgAc2, 0,01% ацетате и (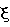 ) 50 мМ MgCl2, 45 мМ MgAc2, 0,01% ацетате. Образцы хранили при 30оС в течение 6 месяцев. ) 50 мМ MgCl2, 45 мМ MgAc2, 0,01% ацетате. Образцы хранили при 30оС в течение 6 месяцев.
Фигура 9. Анализы с использованием гидрофобной хроматографии расщепленного папаином моноклонального анти-IgE-антитела. Образцы готовили в ( ) 200 мМ аргинине-HCl, 23 мМ гистидине; ( ) 200 мМ аргинине-HCl, 23 мМ гистидине; (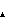 ) 182 мМ аргинине-HCl, 20 мМ гистидине, ( ) 182 мМ аргинине-HCl, 20 мМ гистидине, ( ) 182 мМ аргинине-HCl, 20 мМ гистидине, 91 мМ сахарозе, ( ) 182 мМ аргинине-HCl, 20 мМ гистидине, 91 мМ сахарозе, ( ) 50 мМ MgCl2, 27 мг/мл трегалозе, 0,01% ацетате, ( ) 50 мМ MgCl2, 27 мг/мл трегалозе, 0,01% ацетате, ( ) 50 мМ MgCl2, 30 мМ MgAc2, 0,01% ацетате и (о) 50 мМ MgCl2, 45 мМ MgAc2, 0,01% ацетате. Образцы хранили при 30оС в течение 6 месяцев. ) 50 мМ MgCl2, 30 мМ MgAc2, 0,01% ацетате и (о) 50 мМ MgCl2, 45 мМ MgAc2, 0,01% ацетате. Образцы хранили при 30оС в течение 6 месяцев.
Фигура 10. Показано сравнение полноразмерных последовательностей вариабельной и константной областей анти-IgE-антител Е25, Е26 и Hu-901. Район CDR Hu-901 подчеркнут. Для Е25 и Е26 районы CDR, определенные согласно Chotia, показаны жирным шрифтом, тогда как районы CDR, определенные согласно Kabat, заключены в скобки. На фигуре 10А показана последовательность легких цепей Е25, Е26 и Hu-901 (SEQ ID NO:1-3), тогда как на фигуре 10В показана последовательности тяжелых цепей Е25, Е26 и Hu-901 (SEQ ID NO:4-6).
Подробное описание предпочтительного варианта осуществления
I. Определения
Под «белком» понимают последовательность аминокислот, у которых длина цепи является достаточной для образования более высоких уровней третичной и/или вторичной структуры. Таким образом, белки отличаются от «пептидов», которые также являются молекулами, построенными на основе аминокислот, которые не имеют такой структуры. Обычно белок, как используют здесь, имеет молекулярную массу по меньшей мере приблизительно 15-20 кД, предпочтительно по меньшей мере приблизительно 20 кД.
Примеры белков, охватываемые настоящим определением, включают в себя белки млекопитающих, такие как, например, гормон роста, в том числе гормон роста человека и бычий гормон роста; высвобождающий гормон роста фактор; паратиреоидный гормон; тиреостимулирующий гормон; липопротеины;  -1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор фон Виллебранда; факторы против свертывания, такие как Протеин С; предсердный натриуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназа- или тканеспецифический активатор плазминогена (t-PA, например, Activase®, TNKase®, Retevase®); бомбазин; тромбин; фактор- -1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор фон Виллебранда; факторы против свертывания, такие как Протеин С; предсердный натриуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназа- или тканеспецифический активатор плазминогена (t-PA, например, Activase®, TNKase®, Retevase®); бомбазин; тромбин; фактор- и фактор- и фактор- некроза опухоли; энкефалиназа; RANTES (регулируемый при активации, нормально экспрессируемый и секретируемый Т-клетками); воспалительный белок макрофагов человека (MIP-1- некроза опухоли; энкефалиназа; RANTES (регулируемый при активации, нормально экспрессируемый и секретируемый Т-клетками); воспалительный белок макрофагов человека (MIP-1- ); сывороточный альбумин, такой как человеческий сывороточный альбумин; ингибирующее вещество клеток Мюллера; А-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; ДНКазу; ингибин; активин; васкулярный эндотелиальный фактор роста (VEGF); рецепторы для гормонов или факторов роста; интегрин; белок А или D; ревматоидные факторы; нейротрофический фактор, такой как происходящий из кости нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, такой как NGF- ); сывороточный альбумин, такой как человеческий сывороточный альбумин; ингибирующее вещество клеток Мюллера; А-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; ДНКазу; ингибин; активин; васкулярный эндотелиальный фактор роста (VEGF); рецепторы для гормонов или факторов роста; интегрин; белок А или D; ревматоидные факторы; нейротрофический фактор, такой как происходящий из кости нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, такой как NGF- ; тромбоцитарный фактор роста (PDGF); фибробластный фактор роста, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF- ; тромбоцитарный фактор роста (PDGF); фибробластный фактор роста, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF- и TGF- и TGF- , в том числе TGF- , в том числе TGF- 1, TGF- 1, TGF- 2, TGF- 2, TGF- 3, TGF- 3, TGF- 4 или TGF- 4 или TGF- 5; инсулиноподобный фактор роста I и II (IGF-I и IGF-II); дез(1-3)-IGF-I (IGF-I головного мозга); белки, связывающие инсулиноподобный фактор роста; дифференцировочные CD-белки, такие как CD3, CD4, CD8, CD19 и CD20; эритропоэтин (ЕРО); тромбопоэтин (ТРО); остеоиндуктивные факторы; иммунотоксины; морфогенетический костный белок (ВМР); интерферон, такой как интерферон- 5; инсулиноподобный фактор роста I и II (IGF-I и IGF-II); дез(1-3)-IGF-I (IGF-I головного мозга); белки, связывающие инсулиноподобный фактор роста; дифференцировочные CD-белки, такие как CD3, CD4, CD8, CD19 и CD20; эритропоэтин (ЕРО); тромбопоэтин (ТРО); остеоиндуктивные факторы; иммунотоксины; морфогенетический костный белок (ВМР); интерферон, такой как интерферон- , – , – и – и – ; колониестимулирующие факторы (CSF), например M-CSF, GM-CSF и G-CSF); интерлейкины (IL), например IL-1-IL-10; супероксиддисмутазу; рецепторы Т-клеток; белки наружной мембраны; ускоряющий разложение фактор (DAF); вирусный антиген, такой как, например, часть оболочки вируса СПИДа; транспортные белки; рецепторы «домашнего инстинкта»; адрессины; регуляторные белки; иммуноадгезины;, антитела и биологически активные фрагменты или варианты любых из вышеперечисленных полипептидов. ; колониестимулирующие факторы (CSF), например M-CSF, GM-CSF и G-CSF); интерлейкины (IL), например IL-1-IL-10; супероксиддисмутазу; рецепторы Т-клеток; белки наружной мембраны; ускоряющий разложение фактор (DAF); вирусный антиген, такой как, например, часть оболочки вируса СПИДа; транспортные белки; рецепторы «домашнего инстинкта»; адрессины; регуляторные белки; иммуноадгезины;, антитела и биологически активные фрагменты или варианты любых из вышеперечисленных полипептидов.
Белок, который получают в виде композиции, является предпочтительно по существу чистым и желательно по существу гомогенным (т.е. не содержащим примесных белков). «По существу чистый» белок означает композицию, содержащую по меньшей мере приблизительно 90 мас.% этого белка в расчете на общую массу этой композиции, предпочтительно по меньшей мере приблизительно 95 мас.%. «По существу гомогенный» белок обозначает композицию, содержащую по меньшей мере приблизительно 99 мас.% белка в расчете на общую массу этой композиции.
В некоторых вариантах осуществления этим белком является антитело. Это антитело может связываться, например, с любой из вышеупомянутых молекул. Примеры молекулярных мишеней для антител, охватываемых данным изобретением, включают в себя IgG, белки CD CD3, CD4, CD8, CD19, CD20, CD34 и CD40; члены семейства рецепторов HER, такие как рецептор EGF, HER2, рецептор HER2, HER3 или HER4; 2с4, 4D5, PSCA, LDP-2, молекулы клеточной адгезии, такие как LFA-1, Mac1, p150, 95, VLA-4, ICAM-1, VCAM и интегрин  v/ v/ 3, в том числе его 3, в том числе его  – и – и  -субъединицы (например, анти-CD11а-, анти-CD18- или анти-CD11 -субъединицы (например, анти-CD11а-, анти-CD18- или анти-CD11 -антитела); факторы роста, такие как VEGF; антигены групп крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl, CTLA-4 и белок С. -антитела); факторы роста, такие как VEGF; антигены групп крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl, CTLA-4 и белок С.
Термин «антитело» в данном контексте включает в себя моноклональные антитела (в том числе полноразмерные антитела, которые имеют Fc-район иммуноглобулина), композиции антител с полиэпитопной специфичностью, мультиспецифические антитела (например, биспецифические антитела, диатела и одноцепочечные молекулы, а также фрагменты антител (например, Fab, F(ab’)2 и Fv). Термин «иммуноглобулин» (Ig) используется здесь взаимозаменяемо с термином «антитело».
Основной единицей из 4 цепей антитела является гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. IgM-антитело состоит из 5 основных гетеротетрамерных единиц вместе с дополнительным полипептидом, названным J-цепью, и содержит 10 антигенсвязывающих сайтов, тогда как IgA-антитела содержат 2-5 основных содержащих 4 цепи единиц, которые могут полимеризоваться с образованием поливалентных ансамблей в комбинации с J-цепью. В случае IgG единица из 4 цепей имеет обычно массу приблизительно 150000 дальтон. Каждая L-цепь связана с Н-цепью одной ковалентной дисульфидной связью, в то время как две Н-цепи связаны друг с другом одной или несколькими дисульфидными связями в зависимости от изотипа Н-цепи. Каждая Н- и L-цепь имеет также расположенные с регулярными интервалами внутрицепочечные дисульфидные мостики. Каждая Н-цепь имеет N-конец, вариабельный домен (VH), за которым следуют три константных домена (CH) для каждой из  – и – и  -цепей и 4 СН-домена для изотипов -цепей и 4 СН-домена для изотипов  и и  . Каждая L-цепь имеет N-конец, вариабельный домен (VL), за которым следует константный домен на ее другом конце. VL выравнен с VH, а CL выравнен с первым константным доменом тяжелой цепи (СН1). Считается, что определенные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи. Спаривание VH и VL вместе образует единый антигенсвязывающий сайт. В отношении структуры и свойств различных классов антител см., например, Basic and Clinical Immunology, 8th Edition, Daniel P. Sties, Abba I. Terr and Tristram G. Parsolv (eds), Appleton & Lange, Norwalk, CT, 1994, page 71 and Chapter 6. . Каждая L-цепь имеет N-конец, вариабельный домен (VL), за которым следует константный домен на ее другом конце. VL выравнен с VH, а CL выравнен с первым константным доменом тяжелой цепи (СН1). Считается, что определенные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи. Спаривание VH и VL вместе образует единый антигенсвязывающий сайт. В отношении структуры и свойств различных классов антител см., например, Basic and Clinical Immunology, 8th Edition, Daniel P. Sties, Abba I. Terr and Tristram G. Parsolv (eds), Appleton & Lange, Norwalk, CT, 1994, page 71 and Chapter 6.
L-цепь любого вида позвоночных животных может быть отнесена к одному из двух явно различных типов, называемых каппа и лямбда, на основании аминокислотных последовательностей их константных доменов. В зависимости от аминокислотной последовательности константного домена их тяжелых цепей (СН) иммуноглобулины могут быть отнесены к различным классам или изотипам. Имеются пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющих тяжелые цепи, названные  , ,  , ,  , ,  и и  соответственно. Классы соответственно. Классы  и и  дополнительно подразделены на подклассы на основании относительно малых различий в последовательности и функции СН, например, люди экспрессируют следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. дополнительно подразделены на подклассы на основании относительно малых различий в последовательности и функции СН, например, люди экспрессируют следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Термин “вариабельные” относится к тому факту, что некоторые сегменты вариабельных доменов сильно различаются по последовательности среди антител. V-домен опосредует связывание антигена и определяет специфичность конкретного антитела в отношении его конкретного антигена. Однако вариабельность неравномерно распределена во всей протяженности вариабельных доменов. Вместо этого V-районы состоят из относительно инвариантных отрезков, называемых каркасными районами (FR) из приблизительно 15-30 аминокислотных остатков, разделенных более короткими районами чрезвычайной вариабельности, называемых «гипервариабельными районами» и иногда «определяющими комплементарность районами» (CDR), которые имеют (каждый) длину приблизительно 9-12 аминокислотных остатков. Вариабельные домены нативных тяжелых и легких цепей содержат четыре FR, в значительной степени принимающих конфигурации  -складки, соединенных тремя гипервариабельными районами, которые образуют петли, соединяющие и в некоторых случаях образующие ее часть, эту -складки, соединенных тремя гипервариабельными районами, которые образуют петли, соединяющие и в некоторых случаях образующие ее часть, эту  -складчатую структуру. Гипервариабельные районы в каждой цепи удерживаются вместе в тесной близости посредством FR и с гипервариабельными районами из другой цепи способствуют образованию антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие в антителозависимой клеточной цитотоксичности (ADCC). -складчатую структуру. Гипервариабельные районы в каждой цепи удерживаются вместе в тесной близости посредством FR и с гипервариабельными районами из другой цепи способствуют образованию антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие в антителозависимой клеточной цитотоксичности (ADCC).
Термин «гипервариабельный район» (также известный как определяющие комплементарность районы» или CDR) относится в данном контексте к аминокислотным остаткам антитела, которые находятся (обычно три или четыре коротких района чрезвычайной вариабельности последовательности) в домене V-области иммуноглобулина, которые образуют антигенсвязывающий сайт и являются основными детерминантами специфичности к антигену. Имеются по меньшей мере два способа идентификации этих CDR-остатков: (1) подход на основе перекрестно-видовой вариабельности последовательностей (т.е. Kabat et al., Sequences of Proteins of Immunological Interest, National Institutes of Health, Bethesda, MS (1991)); и (2) подход на основе кристаллографических исследований комплексов антиген-антитело (Chothia, C. et al., J. Mol. Biol. 196: 901-917 (1987)). Однако до той степени, что способы идентификации двух остатков определяют районы перекрывания, но не идентичные районы, они могут комбинироваться для определения гибридных CDR.
Термин «моноклональное антитело» в применении здесь относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие эту популяцию, являются идентичными за исключением возможных природно встречающихся мутаций и/или посттрансляционных модификаций (например, изомеризаций, амидирований), которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифическими, направленными против единственного антигенного сайта. Кроме того, в отличие от обычных (поликлональных) препаратов антител, которые обычно включают в себя различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на данном антигене. Кроме их специфичности моноклональные антитела имеют преимущество, заключающееся в том, что они синтезируются гибридомной культурой, не загрязненной другими иммуноглобулинами. Определение “моноклональное” указывает на характер антитела как полученного из по существу гомогенной популяции антител и не должно рассматриваться как требующее получения этого антитела каким-либо конкретным способом. Например, моноклональные антитела, которые должны быть использованы в соответствии с данным изобретением, могут быть получены гибридомным способом, впервые описанным Kohler et al., Nature, 256: 495 (1975), или могут быть получены способами рекомбинантных ДНК (см., например, патент США № 4816567). «Моноклональные антитела» могут быть также выделены из фаговых библиотек антител с использованием способов, описанных, например, в Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991).
Моноклональные антитела в данном описании особо включают в себя «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной относительно соответствующих последовательностей в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, в то время как остальная цепь (цепи) является (являются) идентичными с гомологами соответствующих последовательностей в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, пока они обнаруживают желаемую биологическую активность (патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Интересующие здесь химерные антитела включают в себя «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельного домена, происходящие из примата не человека (например, Old World Monkey, Ape etc.), и последовательности константной области человека.
“Интактным” антителом является антитело, которое содержит антигенсвязывающий сайт, а также CL и по меньшей мере домены тяжелой цепи СН1, СН2 и СН3. Эти константные домены могут быть константными доменами природной последовательности (например, константными доменами природной последовательности человека) или их вариантной аминокислотной последовательностью. Предпочтительно интактное антитело имеет одну или несколько эффекторных функций.
«Фрагмент антитела» содержит часть интактного антитела, предпочтительно антигенсвязывающий и/или вариабельный район интактного антитела. Примеры фрагментов антител включают в себя фрагменты Fab, Fab’, F(ab’)2 и Fv; диатела, линейные антитела (см. патент США 5641870, Пример 2; Zapata et al., Protein Eng. 8(10): 1057-1062 [1995]); одноцепочечные молекулы антител и мультиспецифические антитела, образованные из фрагментов антител.
Расщепление папаином антител давало два идентичных антигенсвязывающих фрагмента, названных «Fab»-фрагментами, и оставшийся «Fc»-фрагмент, (кристаллический фрагмент) – обозначение, отражающее способность легко кристаллизоваться. Fab-фрагмент состоит из полной L-цепи вместе с доменом вариабельной области Н-цепи (VH) и первым константным доменом одной тяжелой цепи (СН1). Каждый Fab-фрагмент является моновалентным в отношении связывания антигена, т.е. он имеет единственный антигенсвязывающий сайт. Обработка пепсином антитела дает единственный большой фрагмент F(ab’)2, который приближенно соответствует двум связанным дисульфидной связью Fab-фрагментам, имеющим разную антигенсвязывающую активность, и все еще способен перекрестно связывать антиген. Fab’-фрагменты отличаются от Fab-фрагментов тем, что они имеют несколько дополнительных остатков на карбокси-конце домена СН1, включающих в себя один или несколько цистеинов из шарнирной области антитела. Fab’-SH обозначает здесь Fab’, в котором остаток (остатки) цистеина константных доменов несут свободную тиоловую группу. Фрагменты F(ab’)2 антитела исходно были получены в виде пары Fab’-фрагментов, которые имеют между ними шарнирные цистеины. Известны также и другие химические связывания фрагментов антител.
Fc-фрагмент содержит карбоксиконцевые части обеих Н-цепей, удерживаемые вместе дисульфидными связями. Эффекторные функции антител определяются последовательностями в Fc-районе, районе, который также узнается Fc-рецепторами (FcR), обнаруживаемыми на определенных типах клеток.
«Fv» является минимальным фрагментом антител, который содержит полный сайт узнавания антигена и связывания антигена. Этот фрагмент состоит из димера домена вариабельной области одной тяжелой цепи и одной легкой цепи в прочной нековалентной связи. Из укладки этих двух доменов образуются шесть гипервариабельных петель (3 петли из каждой из Н- и L-цепи), которые обеспечивают аминокислотные остатки для связывания антигена и придают антигенсвязывающую специфичность этому антителу. Однако даже единственный вариабельный домен (или половина Fv, содержащая только три CDR, специфических в отношении антигена) способен узнавать и связывать антиген, хотя и при более низкой аффинности, чем полный сайт связывания.
“Одноцепочечные Fv”, также сокращаемые как “sFv” или “scFv”, являются фрагментами антител, которые содержат VH– и VL-домены антитела, соединенные в единую полипептидную цепь. Предпочтительно полипептид sFv дополнительно содержит полипептидный линкер между VH– и VL-доменами, который позволяет sFv образовывать желаемую структуру для связывания антигена. В отношении обзора по sFv см. Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
Термин «диатела» относится к малым фрагментам антител, полученным конструированием sFv-фрагментов (см. предыдущий абзац) с короткими линкерами (приблизительно 5-10 остатков) между VH– и VL-доменами таким образом, что получают межцепочечное, а не внутрицепочечное спаривание VL-доменов. Биспецифические диатела являются гетеродимерами двух “перекрестных” sFv-фрагментов, в которых VH– и VL-домены двух антител присутствуют на различных полипептидных цепях. Диатела описаны более подробно, например, в ЕР 404097; WO 93/11161; Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993).
Антитело, которое «специфически связывается с» конкретным полипептидом или эпитопом на конкретном полипептиде или является «специфическим в отношении» конкретного полипептида или эпитопа на конкретном полипептиде, является антителом, которое связывается с этим конкретным полипептидом или эпитопом на конкретном полипептиде без существенного связывания с любым другим полипептидом или эпитопом полипептида.
Термин «твердая фаза» описывает неводный матрикс, к которому может прикрепляться антитело данного изобретения. Примеры твердых фаз, включенных в этот термин, включают в себя твердые фазы, образованные частично или полностью из стекла (например, стекла с регулируемыми порами), полисахариды (например, агарозу), полиакриламиды, полистирол, поливиниловый спирт и силиконы. В некоторых вариантах осуществления в зависимости от контекста твердая фаза может быть лункой планшета для анализа; в других вариантах осуществления она является колонкой для очистки (например, колонкой для аффинной хроматографии). Этот термин включает в себя также прерывистую твердую фазу дискретных частиц, таких как частицы, описанные в патенте США № 4275149.
“Гуманизированные” формы антител не человека (например, мышиных антител) являются химерными иммуноглобулинами, цепями иммуноглобулинов или их фрагментами (такими как Fv, Fab, Fab’, F(ab’)2 или другими антигенсвязывающими субпоследовательностями антител) в основном последовательностей человека, которые содержат минимальную последовательность, происходящую из иммуноглобулина не человека. В большинстве случаев гуманизированные антитела являются иммуноглобулинами человека (реципиентное антитело), в которых остатки гипервариабельной области (также называемой CDR) реципиента заменены остатками из гипервариабельной области вида не человека (донорного антитела), такого как мышь, крыса или кролик, имеющей желаемую специфичность, аффинность и потенциал. В некоторых случаях остатки каркасной области (FR) Fv иммуноглобулина человека заменены соответствующими остатками не человека. Кроме того, «гуманизированные антитела» в данном контексте могут также содержать остатки, которые не обнаружены ни в реципиентном антителе, ни в донорном антителе. Эти модификации производят для дополнительного усовершенствования и оптимизации действия антитела. Гуманизированное антитело оптимально будет также содержать по меньшей мере часть константной области иммуноглобулина (Fc), обычно часть константной области иммуноглобулина человека. В отношении дополнительных деталей, см. Jones et al., Nature, 321:522-525 (1986); Reichmann et al., Nature, 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992).
«Зависимое от вида антитело», например антитело млекопитающего против человеческого IgE, является антителом, которое имеет более сильную аффинность связывания в отношении антигена из первого вида млекопитающего, чем в отношении гомолога этого антигена из второго вида млекопитающего. Обычно зависимое от вида антитела «связывается специфически» с антигеном человека (т.е. имеет величину аффинности связывания (Kd) не более, чем приблизительно 1·10-7 М, альтернативно не более, чем приблизительно 1·10-8 М, альтернативно не более, чем 1·10-9 М), но имеет связывающую аффинность в отношении гомолога этого антигена из второго вида млекопитающего не человека, которая является по меньшей мере приблизительно в 50 раз, по меньшей мере приблизительно в 500 раз или по меньшей мере приблизительно в 1000 раз более слабой, чем его аффинность связывания в отношении антигена не человека. Зависимое от вида антитело может быть любым из разнообразных типов антител, определенных выше, но предпочтительно оно является гуманизированным или человеческим антителом.
«Эффекторные функции» антитела обозначают биологические функции, относимые к Fc-району (Fc-району нативной последовательности или Fc-району аминокислотной последовательности варианта) антитела и варьируются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают в себя: связывание С1q и комплемент-зависимую цитотоксичность; связывание рецептора Fc; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, рецепторов В-клеток) и активацию В-клеток.
«Антителозависимая клеточноопосредованная цитотоксичность» или ADCC является формой цитотоксичности, в которой секретируемые Ig, связанные на рецепторах Fc (FcR), представленные на некоторых цитотоксических клетках для специфического связывания с несущей антиген клеткой-мишенью, затем убивают клетку-мишень цитотоксинами. Эти антитела «вооружают» цитотоксические клетки и являются необходимыми для уничтожения клетки-мишени по этому механизму. Первичные клетки для опосредования ADCC, НК-клетки, экспрессируют только Fc RIII, в то время как моноциты экспрессируют Fc RIII, в то время как моноциты экспрессируют Fc RI, Fc RI, Fc RII и Fc RII и Fc RIII. Экспрессия Fc на гемопоэтических клетках суммирована в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Для оценки активности ADCC интересующей молекулы может быть выполнен анализ ADCC in vitro, такой как анализ, описанный в патентах США №№ 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают в себя мононуклеарные клетки периферической крови (PBMC) и природные клетки-убийцы (НК-клетки). Альтернативно или дополнительно, активность ADCC интересующей молекулы может быть оценена in vivo, например, на модели животного, такой как модель, описанная в Clynes et al., PNAS USA 95:652-656 (1998). RIII. Экспрессия Fc на гемопоэтических клетках суммирована в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Для оценки активности ADCC интересующей молекулы может быть выполнен анализ ADCC in vitro, такой как анализ, описанный в патентах США №№ 5500362 или 5821337. Применимые эффекторные клетки для таких анализов включают в себя мононуклеарные клетки периферической крови (PBMC) и природные клетки-убийцы (НК-клетки). Альтернативно или дополнительно, активность ADCC интересующей молекулы может быть оценена in vivo, например, на модели животного, такой как модель, описанная в Clynes et al., PNAS USA 95:652-656 (1998).
«Рецептор Fc» или “FcR” обозначает рецептор, который связывается с Fc-районом антитела. Предпочтительным FcR является нативная последовательность FcR человека. Кроме того, предпочтительным FcR является FcR, который связывается с IgG-антителом (гамма-рецептор) и включает в себя рецепторы подклассов Fc RI, Fc RI, Fc RII и Fc RII и Fc RIII, в том числе аллельные варианты и альтернативно сплайсированные формы этих рецепторов, Fc RIII, в том числе аллельные варианты и альтернативно сплайсированные формы этих рецепторов, Fc RII-рецепторы включают в себя Fc RII-рецепторы включают в себя Fc RIIA («активирующий рецептор») и Fc RIIA («активирующий рецептор») и Fc RIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, которые различаются прежде всего в их цитоплазматических доменах. Активирующий рецептор Fc RIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, которые различаются прежде всего в их цитоплазматических доменах. Активирующий рецептор Fc RIIA содержит иммунорецепторный мотив активации (ITAM) на основе тирозина в его цитоплазматическом домене. Ингибирующий рецептор Fc RIIA содержит иммунорецепторный мотив активации (ITAM) на основе тирозина в его цитоплазматическом домене. Ингибирующий рецептор Fc RIIB содержит иммунорецепторный мотив ингибирования (ITIM) на основе тирозина в его цитоплазматическом домене (см. M. Daeron, Annu. Rev. Immunol. 15:203-234 (1997). FcR рассмотрены в обзоре Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994) и de HAAS et al., J. Lab. Clin. Med. 126: 330-41 (1995). Другие FcR, в том числе FcR, которые будут идентифицированы в будущем, также включены в термин «FcR», используемый здесь. Этот термин включает в себя также неонатальный рецептор, FcRn, который является ответственным за перенос материнских IgG в плод. Guyer et al., J. Immunol. 117: 587 (1976) и Klim et al., J. Immunol. 24: 249 (1994). RIIB содержит иммунорецепторный мотив ингибирования (ITIM) на основе тирозина в его цитоплазматическом домене (см. M. Daeron, Annu. Rev. Immunol. 15:203-234 (1997). FcR рассмотрены в обзоре Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994) и de HAAS et al., J. Lab. Clin. Med. 126: 330-41 (1995). Другие FcR, в том числе FcR, которые будут идентифицированы в будущем, также включены в термин «FcR», используемый здесь. Этот термин включает в себя также неонатальный рецептор, FcRn, который является ответственным за перенос материнских IgG в плод. Guyer et al., J. Immunol. 117: 587 (1976) и Klim et al., J. Immunol. 24: 249 (1994).
«Эффекторные клетки человека» являются лейкоцитами, которые экспрессируют один или несколько FcR и выполняют эффекторные функции. Предпочтительно эти клетки экспрессируют по меньшей мере Fc RIII и выполняют эффекторную функцию ADCC. Примеры лейкоцитов человека, которые опосредуют ADCC, включают в себя мононуклеарные клетки периферической крови (PBMC), природные клетки-убийцы (NK-клетки), моноциты, цитотоксические Т-клетки и нейтрофилы, причем предпочтительными являются PBMC и MNK-клетки. Эти эффекторные клетки могут быть выделены из природного источника, например, крови. RIII и выполняют эффекторную функцию ADCC. Примеры лейкоцитов человека, которые опосредуют ADCC, включают в себя мононуклеарные клетки периферической крови (PBMC), природные клетки-убийцы (NK-клетки), моноциты, цитотоксические Т-клетки и нейтрофилы, причем предпочтительными являются PBMC и MNK-клетки. Эти эффекторные клетки могут быть выделены из природного источника, например, крови.
«Комплементзависимая цитотоксичность» (CDC) обозначает лизис клетки-мишени в присутствии комплемента. Активация классического пути комплемента начинается связыванием первого компонента системы комплемента (С1q) с антителами (подходящего подкласса), которые связываются с их соответствующим антигеном. Для оценки активации комплемента может выполняться CDC-анализ, например, описанный в Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996).
«Выделенные» в применении для описания разнообразных полипептидов и описанных здесь антител означает полипептид или антитело, которые были идентифицированы, отделены и/или извлечены из компонента среды их получения. Предпочтительно выделенный полипептид не связан со всеми другими компонентами среды его получения. Загрязняющими компонентами среды его получения, такими как компоненты, происходящие из рекомбинантных клеток, являются вещества, которые обычно мешают диагностическим или терапевтическим применениям для этого полипептида и могут включать в себя ферменты, гормоны и другие белковые и небелковые растворенные вещества. В предпочтительных вариантах осуществления этот полипептид будет очищен (1) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающейся чашкой, или (2) до гомогенности при помощи электрофореза в ДСН-ПААГ при невосстанавливающих или восстанавливающих условиях с использованием красителя Кумасси синего или предпочтительно содержащего серебро красителя. Однако обычно выделенные полипептид или антитело получают с использованием по меньшей мере одной стадии очистки.
“Выделенной” молекулой нуклеиновой кислоты, кодирующей полипептиды и антитела, описанные здесь, является молекула нуклеиновой кислоты, которая является идентифицированной и отделенной по меньшей мере от одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно связана в среде, в которой она была получена. Предпочтительно эта выделенная нуклеиновая кислота свободна от всех компонентов, связанных со средой получения. Выделенные молекулы нуклеиновой кислоты, кодирующие полипептиды и антитела, описанные здесь, находится в форме, иной, чем та форма или окружение, в которой она обнаружена в природе. Таким образом, выделенные молекулы нуклеиновых кислот отличаются от нуклеиновой кислоты, кодирующей полипептиды и антитела, описанные здесь, существующей природно в клетке.
Термин “регуляторные последовательности” относится к ДНК-последовательностям, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Регуляторные последовательности, которые пригодны, например, для прокариот, включают в себя промотор, необязательно последовательность оператора и сайт связывания рибосом. Известно, что эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является “функционально связанной”, когда она помещена в функциональную взаимосвязь с другой последовательностью нуклеиновой кислоты. Например, ДНК для пре-последовательности или секреторного лидера функционально связана с ДНК для полипептида, если он экспрессируется в виде пре-протеина, который участвует в секреции этого полипептида; промотор или энхансер является функционально связанным с кодирующей последовательностью, если он влияет на транскрипцию этой последовательности; или сайт связывания рибосом является функционально связанным с кодирующей последовательностью, если он расположен таким образом, что он облегчает трансляцию. Обычно термин “функционально связанные” означает, что связываемые ДНК-последовательности являются смежными и в случае секреторного лидера смежными и находящимися в рамке считывания. Однако энхансеры не должны быть обязательно смежными. Связывание выполняется лигированием в удобных сайтах рестрикции. Если такие сайты не существуют, используют синтетические олигонуклеотидные адапторы или линкеры в соответствии с общепринятой практикой.
Термин «эпитоп-меченый» относится в данном контексте к химерному полипептиду, содержащему описанные здесь полипептид или антитело, слитый с «полипептидом-меткой». Этот полипептид-метка имеет достаточно остатков для обеспечения эпитопа, против которого может быть получено антитело, но все еще является достаточно коротким, чтобы не мешать активности полипептида, с которым он слит. Полипептид-метка предпочтительно является довольно уникальным, так что это антитело по существу не реагирует перекрестно с другими эпитопами. Подходящие полипептиды-метки обычно имеют по меньшей мере шесть аминокислотных остатков и обычно имеют приблизительно 8-50 аминокислотных остатков (предпочтительно приблизительно 10-20 аминокислотных остатков).
В применении здесь термин «иммуноадгезин» обозначает антитело-подобные молекулы, которые объединяют в себе специфичность связывания гетерологичного белка (“адгезина”) с эффекторными функциями константных доменов иммуноглобулина. Структурно иммуноадгезины содержат слияние аминокислотной последовательности с желаемой специфичностью связывания, которая является другой, чем сайт узнавания антигена и связывания антитела (т.е. “гетерологичной”), и последовательность константного домена иммуноглобулина. Адгезиновая часть молекулы иммуноадгезина обычно является последовательностью смежных аминокислот, содержащей по меньшей мере сайт связывания рецептора или лиганда. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, такого как подтипы IgG-1, IgG2, IgG-3 или IgG-4, IgA (в том числе IgA-1 и IgA-2), IgE, IgD или IgM. Эти Ig-слияния предпочтительно включают в себя введение в виде замены домена описанных здесь полипептида или антитела вместо по меньшей мере одного вариабельного района в молекуле Ig. В особенно предпочтительном варианте осуществления это слияние иммуноглобулина включает в себя шарнирную область, районы СН2 и СН3 или шарнирную область, районы СН1, СН2 и СН3 молекулы IgG1. В отношении получения слияний иммуноглобулинов см. также патент США № 5428130, выданный 27 июня 1995 года.
«Стабильная» композиция является композицией, в которой белок по существу сохраняет его физическую и химическую стабильность и целостность при хранении. В данной области доступны разнообразные аналитические способы для измерения стабильности белка, и обзор этих способов дается в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, New York, Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). Стабильность может быть измерена при выбранной температуре в течение выбранного периода времени. Для быстрого скрининга композиция может храниться при 40оС в течение 2 недель – 1 месяца, после чего измеряют стабильность. Если композиция должна храниться при 2-8оС, обычно эта композиция должна быть стабильной при 30оС или 40оС в течение по меньшей мере 1 месяца и/или стабильной при 2-8оС в течение по меньшей мере 2 лет. Если композиция должна храниться при 30оС, обычно эта композиция должна быть стабильной в течение по меньшей мере 2 лет при 30оС и/или стабильной при 40оС в течение по меньшей мере 6 месяцев. Например, в качестве индикатора стабильности белка может быть использована степень агрегации во время хранения. Таким образом, “стабильной композицией” может быть композиция, в которой менее чем приблизительно 10%, и предпочтительно менее, чем приблизительно 5%, этого белка присутствуют в виде агрегата в композиции. В других вариантах осуществления может быть определено любое увеличение образования агрегатов во время хранения этой композиции.
“Восстановленной” композицией является композиция, которая была получена растворением лиофилизированной композиции белка или антитела в разбавителе так, что белок был диспергирован во всем растворе. Восстановленная композиция может использоваться для введения (например, парентерального введения) пациенту, на которого направлено лечение этим интересующим белком, и в некоторых вариантах осуществления она может быть композицией, которая может использоваться для подкожного введения.
“Изотонической” является композиция, которая имеет по существу такое же осмотическое давление, что и кровь человека. Термин “гипотоническая” описывает композицию с осмотическим давлением, более низким, чем осмотическое давление крови человека. Соответственно термин “гипертоническая” используется для описания композиции с осмотическим давлением, более высоким, чем осмотическое давление крови человека. Композиции по настоящему изобретению являются гипертоническими в результате добавления соли и/или буфера.
“Восстановленной” композицией является композиция, которая была получена растворением лиофилизированной композиции белка в разбавителе так, что этот белок был диспергирован в восстановленной композиции. Эта восстановленная композиция может использоваться для введения (например, парентерального введения) пациенту, на которого направлено лечение интересующим белком, и в некоторых вариантах осуществления она может быть композицией, которая может использоваться для подкожного введения.
“Фармацевтически приемлемая кислота” включает в себя неорганические и органические кислоты, которые не являются токсичными в концентрации и способе, с помощью которых готовят. Например, подходящие неорганические кислоты включают в себя хлористоводородную, перхлорную, бромистоводородную, иодистоводородную, азотную, серную, сульфоновую, сульфиновую, сульфаниловую, фосфорную, угольную кислоту и т.д. Подходящие органические кислоты включают в себя содержащие алкил с прямой или разветвленной цепью, ароматические, циклические, циклоалифатические, арилалифатические, гетероциклические, насыщенные, ненасыщенные, моно-, ди- и трикарбоновые кислоты, в том числе, например, муравьиную, уксусную, 2-гидроксиуксусную, трифторуксусную, фенилуксусную, триметилуксусную, трет-бутилуксусную, антраниловую, пропановую, 2-гидроксипропановую, 2-оксопропановую, пропандиовую, циклопентанпропионовую, циклопентанпропионовую, 3-фенилпропионовую, бутановую, бутандиовую, бензойную, 3-(4-гидроксибензоил)бензойную, 2-ацетоксибензойную, аскорбиновую, коричную, лаурилсерную, стеариновую, муконовую, миндальную, янтарную, эмбоновую, фумаровую, яблочную, малеиновую, гидроксималеиновую, малоновую, молочную, лимонную, винную, гликолевую, гликоновую, глюконовую, пировиноградную, глиоксалевую, щавелевую, метилсульфониловую, янтарную, салициловую, фталевую, пальмовую, пальмеиновую, тиоциановую, метансульфоновую, этансульфоновую, 1,2-этандисульфоновую, 2-гидроксиэтансульфоновую, бензолсульфоновую, 4-хлорбензолсульфоновую, нафталин-2-сульфоновую, п-толуолсульфоновую, камфорсульфоновую, 4-метилбицикло[2.2.2]окт-2-ен-1-карбоновую, глюкогептоновую, 4,4′-метиленбис-3-(гидрокси-2-ен-1-карбоновую кислоту), гидроксинафтойную кислоту.
«Фармацевтически приемлемые основания» включают в себя неорганические и органические основания, которые не являются токсичными при концентрации и способе, с использованием которых их готовят. Например, подходящие основания включают в себя основания, образованные из образующих неорганическое основание металлов, таких как литий, натрий, калий, магний, кальций, аммоний, железо, цинк, медь, марганец, алюминий, N-метилглюкамин, морфолин, пиперидин и органические нетоксичные основания, включающие в себя первичный, вторичный и третичный амин, замещенные амины, циклические амины и основные ионообменные смолы [например, N(R‘)4 + (где R’ обозначает независимо Н или С1-4алкил, например, аммоний, Трис)], например изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, полиаминные смолы и т.п. Особенно предпочтительными органическими нетоксичными основаниями являются изопропиламин, диэтиламин, этаноламин, триметамин, дициклогексиламин, холин и кофеин.
Дополнительные фармацевтически приемлемые кислоты и основания, применимые с данным изобретением, включают в себя кислоты и основания, произведенные из аминокислот, например гистидина, глицина, фенилаланина, аспарагиновой кислоты, глутаминовой кислоты, лизина и аспарагина.
“Фармацевтически приемлемые” буферы и соли включают в себя буферы и соли, полученные как из кислотно-аддитивных, так и основно-аддитивных солей вышеуказанных кислот и оснований. Конкретные буферы и/или соли включают в себя гистидин, сукцинат и ацетат.
«Лиопротектор» является молекулой, которая при объединении с интересующим белком значимо предотвращает или уменьшает химическую и/или физическую нестабильность белка при лиофилизации и последующем хранении. Примеры лиопротекторов включают в себя сахара и их соответствующие сахароспирты; аминокислоту, такую как мононатрийглутамат или гистидин; метиламин, такой как бетаин; лиотропную соль, такую как сульфат магния; полиол, такой как трехатомные или более высокомолекулярные сахароспирты, например глицерин, декстран, эритрит, глицероль (глицерит), арабит, ксилит, сорбит и маннит; пропиленгликоль; полиэтиленгликоль; Pluronics®; и их комбинации. Дополнительные примеры лиопротекторов включают в себя глицерин и желатин и сахара меллибиозу, мелецитозу, рафинозу, маннотриозу и стахиозу. Пример редуцирующих сахаров включают в себя глюкозу, мальтозу, лактозу, мальтулозу, изомальтулозу и лактулозу. Примеры нередуцирующих сахаров включают в себя нередуцирующие гликозиды полигидроксисоединений, выбранные из сахароспиртов и других полиспиртов с прямой цепью. Предпочтительными сахароспиртами являются моногликозиды, в частности соединения, полученные восстановлением дисахаридов, таких как лактоза, мальтоза, лактулоза и мальтулоза. Гликозидная боковая группа может быть либо глюкозидной, либо галактозидной. Дополнительными примерами сахароспиртов являются глюцит, мальтит, лактит и изомальтоза. Предпочтительными лиопротекторами являются нередуцирующие сахара трегалоза или сахароза.
Лиопротектор добавляют к предлиофилизированной композиции в «лиопротективном количестве”, что означает, что после лиофилизации этого белка в присутствии лиопротективного количества лиопротектора этот белок по существу сохраняет его физическую и химическую стабильность и целостность при лиофилизации и хранении.
При получении композиций данного изобретения с уменьшенной вязкостью нужно следить за тем, чтобы использование вышеперечисленных эксципиентов, а также других добавок, в частности, при добавлении их в высокой концентрации, не увеличивало вязкость данной композиции.
“Фармацевтически приемлемым сахаром” является молекула, которая при объединении с интересующим белком предотвращает или уменьшает химическую и/или физическую нестабильность этого белка при хранении. Когда эта композиция должна быть лиофилизирована и затем восстановлена, “фармацевтически приемлемые сахара” могут также называться “лиопротектором”. Примеры сахаров и их соответствующих сахароспиртов включают в себя: аминокислоту, такую как мононатрийглутамат или гистидин; метиламин, такой как бетаин; лиотропную соль, такую как сульфат магния; полиол, такой как трехатомные или более высокомолекулярные сахароспирты, например глицерин, декстран, эритрит, глицероль (глицерит), арабит, ксилит, сорбит и маннит; пропиленгликоль; полиэтиленгликоль; Pluronics®; и их комбинации. Дополнительные примеры лиопротекторов включают в себя глицерин и желатин и сахара меллибиозу, мелецитозу, рафинозу, маннотриозу и стахиозу. Пример редуцирующих сахаров включают в себя глюкозу, мальтозу, лактозу, мальтулозу, изомальтулозу и лактулозу. Примеры нередуцирующих сахаров включают в себя нередуцирующие гликозиды полигидроксисоединений, выбранные из сахароспиртов и других полиспиртов с прямой цепью. Предпочтительными сахароспиртами являются моногликозиды, в частности соединения, полученные восстановлением дисахаридов, таких как лактоза, мальтоза, лактулоза и мальтулоза. Гликозидная боковая группа может быть либо глюкозидной, либо галактозидной. Дополнительными примерами сахароспиртов являются глюцит, мальтит, лактит и изомальтоза. Предпочтительными фармацевтически приемлемыми сахарами являются нередуцирующие сахара трегалоза или сахароза.
Фармацевтически приемлемые сахара добавляют к композиции в “протективном количестве” (например, перед лиофилизацией), что означает, что белок по существу сохраняет его физическую и химическую стабильность и целостность во время хранения (например, после восстановления и хранения).
Интересующим “разбавителем” в изобретении является разбавитель, который является фармацевтически приемлемым (безопасным и нетоксичным при введении человеку) и который может использоваться для получения жидкой композиции, такой как композиция, восстановленная после лиофилизации. Примеры разбавителей включают в себя стерильную воду, бактериостатическую воду для инъекции (BWFI), раствор с забуференным рН (например, забуференный фосфатом солевой раствор), стерильный физиологический раствор, раствор Рингера или раствор декстрозы. В альтернативном варианте разбавители могут включать в себя водные растворы солей и/или буферы.
«Консервантом» является соединение, которое может быть добавлено к композициям по изобретению для уменьшения бактериальной активности. Например, добавление консерванта может облегчать получение композиции для многоразового использования (мультидозируемой композиции). Примеры возможных консервантов включают в себя октадецилдиметилбензиламмонийхлорид, гексаметонийхлорид, бензалконийхлорид (смесь алкилбензилдиметиламмонийхлоридов, в которых алкильные группы являются длинноцепочечными, и бензэтонийхлорид). Другие типы консервантов включают в себя ароматические спирты, такие как фенол, бутиловый и бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехин, резорцин, циклогексанол, 3-пентанол и м-крезол. Наиболее предпочтительным консервантом для данного изобретения является бензиловый спирт.
Термин “лечение” относится как к терапевтическому лечению, так и профилактическим или превентивным мерам. Индивидуумы, нуждающиеся в лечении, включают в себя как индивидуумов, уже имеющих это нарушение, так и индивидуумов, у которых должно быть предотвращено данное нарушение.
“Млекопитающим” для целей лечения является любое животное, классифицируемое как млекопитающее, в том числе люди, домашние и сельскохозяйственные животные и животные зоопарков, используемые в спорте животные или домашние животные, такие как собаки, лошади, кролики, крупный рогатый скот, свиньи, хомяки, песчанки, мыши, хорьки, крысы, кошки и т.д. Предпочтительно млекопитающим является человек.
“Нарушение” представляет собой любое состояние, лечение которого белком могло бы иметь пользу. Оно включает в себя хронические и острые нарушения или заболевания, в том числе патологические состояния, которые предрасполагают к возникновению у млекопитающего рассматриваемого нарушения. Неограничивающие примеры нарушений, на которые может быть направлено лечение, включают в себя карциному и аллергию различных типов.
“Терапевтически эффективное количество” является по меньшей мере минимальной концентрацией, требуемой для осуществления измеримого улучшения или предупреждения конкретного нарушения. Терапевтически эффективные количества известных белков хорошо известны в данной области, в то время как эффективные количества белков, которые будут после этого описаны, могут быть определены стандартными способами, которые находятся в рамках квалификации специалиста в данной области, например, врача общей практики.
“Вязкость” в данном контексте может быть “кинематической вязкостью” или “абсолютной вязкостью”. “Кинематическая вязкость” является мерой резистивного потока жидкости под влиянием силы тяжести. При помещении двух жидкостей равного объема в идентичные капиллярные вискозиметры и предоставлении им возможности протекания под действием силы тяжести, вязкая жидкость обнаруживает более продолжительное время протекания через капилляр, чем менее вязкая жидкость. Если одна жидкость завершает протекание за 200 секунд, а другая жидкость за 400 секунд, то по шкале кинематической вязкости вторая жидкость является в два раза более вязкой, чем первая. “Абсолютная вязкость”, иногда называемая динамической или простой вязкостью, является произведением кинематической вязкости и плотности жидкости:
Абсолютная вязкость = Кинематическая Вязкость х Плотность
Размерностью кинематической вязкости является L2/Т, где L обозначает длину, а Т обозначает время. Обычно кинематическую вязкость выражают в сантистоксах (сСт). Единица СИ кинематической вязкости равна мм2/с, что равно 1 сСт. Абсолютную вязкость выражают в единицах сантипуазах (сП). Единица СИ абсолютной вязкости равна миллиПаскаль·секунде (мПа·с), где 1 сП=1 мПа·с.
«Антигистамин» является в данном контексте агентом, который оказывает антагонистическое действие на физиологический эффект гистамина. Связывание гистамина с его рецепторами, Н1 и Н2, приводит к характерным аллергическим симптомам и эффектам или к зуду, покраснению, опуханию и т.д. Многие антигистамины действуют посредством блокирования связывания гистамина с его рецепторами Н1 и Н2; однако считается, что другие антигистамины действуют посредством ингибирования высвобождения гистамина. Примерами антигистаминов являются хлорфенирамин, дифенгидрамин, прометазин, хромолин-натрий, астемизол, малеат азатадина, малеат брофенирамин, малеат карбиноксамина, гидрохлорид цетиризина, фумарат клемастина, гидрохлорид ципрогептадина, малеат дексбромфенирамина, малеат дексхлорфенирамина, дименгидринат, гидрохлорид дифенгидрамина, сукцинат доксиламина, гидрохлорид фексофендадина, гидрохлорид терфенадина, гидрохлорид гидроксизина, лоратидин, гидрохлорид меклицина, цитрат трипеланнамина, гидрохлорид трипеленнамина, гидрохлорид трипролидина.
«Бронходилататор», как используется здесь, относится к агентам, которые оказывают антагонистическое действие или обращают бронхоконстрикцию, физиологическое событие, которое обычно имеет место в астматических реакциях ранней фазы, приводящее к уменьшению максимальной вентиляции легких и одышке. Примеры бронходилататоров включают в себя эпинефрин, альфа- и бета-адренергические вещества широкого действия и бета-адренергические вещества альбутерол, пирбутерол, метапротеренол, салметерол и изоэтарин. Бронходилатация может также достигаться введением ксантинов, а том числе аминофиллина и теофиллина.
Термин «глюкокортикоид», как используется здесь, относится к агентам на основе стероидов, которые обладают противовоспалительной активностью. Глюкокортикоиды обычно используют для ослабления астматической реакции поздней фазы. Примеры глюкокортикоидов включают в себя преднизон, дипропионат беклометазона, ацетонид триамцинолона, флунизолид, бетаметазон, будезонид, дексаметазон, ацетат флудрокортизона, флунизолид, пропионат флутиказона, гидрокортизон, метилпреднизолон, преднизолон, преднизон и триамцинолон.
«Нестероидные противовоспалительные средства», или “НСПВС”, как используется здесь, относятся к агентам, обладающим противовоспалительной активностью, которые не основаны на стероидах. Примеры НСПВС включают в себя ацетаминофен, аспирин, бромфенак-натрий, диклофенак-натрий, дифлунизал, этодолак, фенопрофен-кальций, флубипрофен, ибупрофен, индометацин, кетопрофен, меклофекамат-натрий, мефекамовая кислота, набуметон, напроксен, напроксен-натрий, оксифенбутазон, фенилбутазон, пироксикам, сулиндак, толметин-натрий.
II. Способы проведения изобретения
А. Получение полипептидов и антител
Нижеследующее описание относится прежде всего к получению описанных здесь полипептидов или антител путем культивирования клеток, трансформированных или трансфицированных вектором, содержащим нуклеиновую кислоту, кодирующую полипептид или антитело, и очисткой полученного белка или антитела. Предполагается, конечно, что для получения таких полипептидов или антител могут быть использованы и альтернативные способы, которые хорошо известны в данной области. Например, такие последовательности или их части могут быть получены прямым пептидным синтезом с использованием твердофазных способов [см., например, Stewart et al., Solid-Phase Peptide Synthesis, W.H. Freeman Co., San Francisco, CA (1969); Merrifield, J. Am. Chem. Soc., 85:2149-2154 (1963)]. Синтез белков in vitro может выполняться вручную или механически. Автоматизированный синтез может выполняться, например, с использованием пептидного синтезатора Applied Biosystems (Foster City, CA) в соответствии с инструкциями изготовителя. Различные части белков или антител, описанных здесь, могут быть синтетически получены раздельно и объединены с использованием химических или ферментативных способов.
1. Выделение ДНК, кодирующей описанные здесь белки
ДНК, кодирующая описанные здесь белки, может быть получена из библиотеки кДНК, полученной из ткани, которая, как полагают, имеет соответствующую мРНК и экспрессирует ее на определяемом уровне. Таким образом, кодирующая белок человека ДНК может быть удобным образом получена из библиотеки кДНК, полученной из ткани человека, например, как описано в этих примерах. Кодирующий белок ген может быть также получен из геномной библиотеки или с использованием известных синтетических процедур (например, автоматизированного синтеза нуклеиновых кислот).
Библиотеки могут быть подвергнуты скринингу зондами (такими как олигонуклеотиды, имеющие по меньшей мере приблизительно 20-80 оснований), сконструированными для идентификации интересующего гена. Скрининг библиотеки кДНК или геномной библиотеки выбранным зондом может проводиться с использованием стандартных процедур, таких как описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989). Альтернативным способом выделения гена, кодирующего желаемый ген, является использование метода ПЦР [Sambrook et al., supra; Dieffenbach et al., PCR Primer: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1995)].
Приведенные ниже примеры описывают способы скрининга библиотеки кДНК. Олигонуклеотидные последовательности, выбранные в качестве зондов, должны быть достаточной длины и быть достаточно однозначными, чтобы минимизировать ложноположительные результаты. Этот олигонуклеотид является предпочтительно меченным таким образом, что он может быть определен при гибридизации с ДНК в подвергаемой скринингу библиотеке. Способы мечения хорошо известны в данной области и включают в себя использование радиоактивных меток, таких как 32Р-меченный АТФ, биотинилирование или мечение ферментом. Условия гибридизации, включающие в себя условия умеренной жесткости и условия высокой жесткости, описаны в Sambrook et al., выше.
Последовательности, идентифицированные в таких способах скрининга библиотек, могут быть сравнены и сопоставлены с другими известными последовательностями, депонированными в базах данных и доступными из баз данных, таких как GenBank или другие частные базы данных последовательностей. Идентичность последовательности (на аминокислотном или нуклеотидном уровне) в пределах определенных районов этой молекулы или во всей полноразмерной последовательности может быть определена с использованием способов известных в данной области и описанных здесь.
Нуклеиновая кислота, имеющая кодирующую белок последовательность, может быть получена скринингом выбранных библиотек кДНК или геномных библиотек с использованием впервые описанной здесь расшифрованной аминокислотной последовательности и, если необходимо, с использованием обычных процедур удлинения праймеров, описанных в Sambrook et al., выше, для детектирования предшественников и промежуточных продуктов процессинга мРНК, которые могли не быть обратно-транскрибированы в кДНК.
2. Выбор и трансформация клеток-хозяев
Клетки-хозяева трансфицируют или трансформируют экспрессирующими или клонирующими векторами, содержащими описанные здесь белки или антитела, и культивируют в обычной питательной среде, модифицированной должным образом, для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих эти желаемые последовательности. Условия культивирования, такие как среда, температура и рН и т.п., могут быть выбраны специалистом в данной области без чрезмерного экспериментирования. В целом принципы, протоколы и практические способы для максимизации продуктивности клеточных культур могут быть найдены в Mammalian Cell Biotechnology: A Practical Approach, M. Butler, ed. (IRL Press, 1991) и Sambrook et al., выше.
Способы трансфекции эукариотических клеток и трансформации прокариотических клеток известны специалисту в данной области, например, CaCl2-, СаРО4-опосредованный способ, опосредуемый липосомами способ и электропорация. В зависимости от используемой клетки-хозяина трансформацию выполняют с использованием стандартных способов, соответствующих таким клеткам. Обработку кальцием с использованием хлорида кальция, описанную в Sambrook et al., выше, или электропорацию используют обычно для прокариот. Инфицирование Agrobacterium tumefaciens используют для трансформации некоторых клеток растений, как описано Shaw et al., Gene, 23:315 (1983) и в WO 89/05859, опубликованном 29 июня 1989 года. Для клеток млекопитающих без таких клеточных стенок может быть использован способ преципитации фосфатом кальция Graham and van der Eb, Virology, 52:456-457 (1978). Общие аспекты систем трансфекций клеток-хозяев млекопитающих были описаны в патенте США № 4399216. Трансформации в дрожжи обычно проводят в соответствии со способом Van Solingen et al., J. Bact., 130:946 (1977) и Hsiao et al., Proc. Natl. Acad. Sci. (USA), 76:3829 (1979). Однако могут быть также использованы другие способы для введения ДНК в клетки, такие как ядерная микроинъекция, электропорация, слияние бактериальных протопластов с интактными клетками или способы с использованием поликатионов, например полибрена, полиорнитина. В отношении разнообразных способов трансформации клеток млекопитающих см. Keown et al., Methods in Enzymology, 185:527-537 (1990) и Mansour et al., Nature, 336:348-352 (1988).
Подходящие клетки-хозяева для клонирования или экспрессиии ДНК в описанных здесь векторах включают в себя клетки прокариот, дрожжи и высшие эукариотические клетки. Подходящие прокариоты включают в себя, но не ограничиваются ими, эубактерии, такие как грамотрицательные или грамположительные организмы, например Enterobacteriaceae, такие как E. coli. Различные штаммы E. coli являются публично доступными, такие как штамм E. coli K12 MM294 (АТСС 31446); E. Coli Х1776 (АТСС 31537); штамм E. coli W3110 (АТСС 27325) и К5 772 (АТСС 53635). Другие подходящие прокариотические клетки-хозяева включают в себя Enterobacteriaceae, такие как Escherichia, например E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например Salmonella typhimurium, Serratia, например Serratia marcescans и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41Р, описанный в DD 266710, опубликованном 12 апреля 1988 года), Pseudomonas, например P. aeruginosa, и Streptomyces. Эти примеры являются иллюстративными, а не ограничительными. Штамм W3110 является одним из особенно предпочтительных хозяев или исходных хозяев, так как он является обычным штаммом-хозяином для ферментации продуктов рекомбинантых ДНК. Предпочтительно клетка-хозяин секретирует минимальные количества протеолитических ферментов. Например, штамм W3110 может быть модифицирован для вызывания генетической мутации в генах, кодирующих белки, эндогенные для хозяина, причем примеры таких хозяев включают в себя штамм E. coli W3110 1А2, который имеет полный генотип tonA; штамм E. coli W3110 9E4, который имеет полный генотип tonA ptr3; штамм E. coli W3110 27С7 (АТСС 55244), который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompT kanr; штамм E. coli W3110 37D6, который имеет полный генотип tonA ptr3 phoA E15 (argF-lac)169 degP ompT rbs7 ilvG kanr; штамм E. coli W3110 40В4, который является штаммом 37D6 с не устойчивой к канамицину делеционной мутацией degP; и штамм E. coli, имеющий мутантную периплазматическую протеазу, описанные в патенте США № 4946783, выданном 7 августа 1990 года. Альтернативно пригодными являются способы клонирования in vitro, например, ПЦР или другие полимеразные реакции нуклеиновых кислот.
Кроме прокариот эукариотические микробы, такие как нитевидные грибы или дрожжи, являются подходящими клонирующими или экспрессирующими хозяевами для векторов, кодирующих описанные здесь белки или антитела. Saccharomyces cerevisiae является обычно используемым низшим эукариотическим микроорганизмом-хозяином. Другие включают в себя Schizosaccharomyces pombe (Beach and Nurse, Nature, 290:140 [1981]; EP 139383, опубликованный 2 мая 1985 года); хозяева Kluyveromyces (патент США № 4943529; Fleer et al., Bio/Technology, 9:968-975 (1991)), такие как K. lactis (MW98-8C, СВS683, CBS4574; Louvencourt et al., J. Bacteriol., 154(2): 737-42 [1983], K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906; Van den Berg et al., Bio/Technology, 8:135 (1990)), K. termotolerans и K. marxianus; Yarrowia (EP 402226); Pichia pastoris (EP 183070; Sreekrishna et al., J. Basic Microbiol., 28:265-278 [1988]); Candida; Trichoderma reesia (EP 244234); Neurospora crassa (Case et al., Proc. Natl. Acad. Sci. USA, 76:5259-5263 [1979]); Schwanniomyces, такой как Schwanniomyces occidentalis (EP 394538, опубликованный 31 октября 1990 года); и нитевидные грибы, такие как, например, Neurospora, Penicillium, Tolypocladium (WO 91/00357, опубликованный 10 января 1991 года) и хозяева Aspergillus, такие как A. nidulans (Ballance et al., Biochem. Biophys. Res. Commun., 112:284-289 [1983]; Tilburn et al., Gene, 26:205-221 [1983]; Yelton et al., Proc. Natl. Acad. Sci. USA, 81: 1470-1474 [1984]) и A. niger (Kelly and Hynes, EMBO J., 4:475-479 [1985]). Метилотрофные дрожжи являются подходящими для данного изобретения и включают в себя, но не ограничиваются ими, Hansenula, Candida, Kloeckera, Pichia, Saccharomyces, Torulopsis и Rhodotorula. Список конкретных видов, которые являются примерами этого класса дрожжей, может быть найден в C. Anthony, The Biochemistry of Methylotrophs, 269 (1982).
Подходящие клетки-хозяева для экспрессии гликозилированной формы описанных здесь полипептидов и антител получают из многоклеточных организмов. Примеры клеток беспозвоночных включают в себя клетки насекомых, такие как Drosophila S2 и Spodoptera Sf9, а также клетки растений. Примеры клеток-хозяев млекопитающих, которые могут использоваться, включают в себя клетки яичника Китайского хомячка (СНО) и клетки COS. Более конкретные примеры включают в себя линию CV1 почки обезьяны, трансформированную SV40 (COS-7, АТСС CRL 1651); линию клеток эмбриональной почки человека (клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol., 36:59 (1977)); клетки яичника Китайского хомячка/-DHFR (CHO, Urlaub and Chasin, Proc. Natl. Acad. Sci. USA, 77:4216 (1980)); мышиные клетки Сертоли (ТМ4, Mather, Biol. Reprod., 23:243-251 (1980)); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); и опухоли молочной железы мыши (ММТ 060562, АТСС CCL51). Предполагается, что выбор соответствующей клетки-хозяина находится в рамках квалификации специалиста в данной области.
3. Выбор и применение реплицируемого вектора
Нуклеиновая кислота (например, кДНК или геномная ДНК), кодирующая описанные здесь полипептиды и антитела, может быть встроена в реплицируемый вектор для клонирования (амплификация ДНК) или для экспрессии. Разнообразные векторы являются доступными. Этот вектор может быть, например, в форме плазмиды, космиды, вирусной частицы или фага. Подходящая последовательность нуклеиновой кислоты может быть инсертирована в этот вектор с использованием разнообразных процедур. Обычно ДНК встраивают в подходящий сайт (подходящие сайты) рестрикционной эндонуклеазы (рестрикатазы) с использованием способов, известных в данной области. Компоненты вектора обычно включают в себя, но не ограничиваются ими, одну или несколько сигнальных последовательностей, сайт инициации репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. Конструирование подходящих векторов, содержащих один или несколько из этих компонентов, использует стандартные способы лигирования, которые известны квалифицированному специалисту.
Рекомбинантное получение этих полипептидов или антител может выполняться не только прямым путем, но также в виде полипептида, слитого с гетерологичным полипептидом. Гетерологичная часть может быть сигнальной последовательностью или другим полипептидом, имеющим специфический сайт расщепления на N-конце зрелого белка или полипептида. Обычно эта сигнальная последовательность может быть компонентом этого вектора или она может быть частью ДНК, кодирующей полипептид или антитело, которая встроена в данный вектор. Эта сигнальная последовательность может быть прокариотической сигнальной последовательностью, выбранной, например, из группы щелочной фосфатазы, пенициллиназы, lpp, или лидеров термостабильного энтеротоксина II. Для дрожжевой секреции эта сигнальная последовательность может быть, например, лидером инвертазы дрожжей, лидером альфа-фактора (в том числе лидеров  -факторов Saccharomyces и Kluyveromyces, причем последние описаны в патенте США № 5010182), или лидером кислой фосфатазы, лидером глюкоамилазы С. albicans (ЕР 362179, опубликованный 4 апреля 1990 года) или сигнальной последовательностью, описанной в WO 90/13646, опубликованном 15 ноября 1990 года. При экспрессии в клетках млекопитающих для регуляции секреции рассматриваемого белка могут быть использованы сигнальные последовательности млекопитающих, такие как сигнальные последовательности из секретируемых полипептидов того же самого или родственного вида, а также вирусные секреторные лидеры. -факторов Saccharomyces и Kluyveromyces, причем последние описаны в патенте США № 5010182), или лидером кислой фосфатазы, лидером глюкоамилазы С. albicans (ЕР 362179, опубликованный 4 апреля 1990 года) или сигнальной последовательностью, описанной в WO 90/13646, опубликованном 15 ноября 1990 года. При экспрессии в клетках млекопитающих для регуляции секреции рассматриваемого белка могут быть использованы сигнальные последовательности млекопитающих, такие как сигнальные последовательности из секретируемых полипептидов того же самого или родственного вида, а также вирусные секреторные лидеры.
Как экспрессирующие, так и клонирующие векторы содержат последовательность нуклеиновой кислоты, которая позволяет этому вектору реплицироваться в одной или нескольких клетках-хозяевах. Такие последовательности хорошо известны для разнообразных бактерий, дрожжей и вирусов. Сайт инициации репликации из плазмиды pBR322 является пригодным для большинства грамотрицательных бактерий, сайт инициации репликации плазмиды 2 пригоден для дрожжей, а различные вирусные сайты инициации репликации (SV40, полиомавируса, аденовируса, VSV или BPV) являются применимыми для клонирующих векторов в клетках млекопитающих. пригоден для дрожжей, а различные вирусные сайты инициации репликации (SV40, полиомавируса, аденовируса, VSV или BPV) являются применимыми для клонирующих векторов в клетках млекопитающих.
Экспрессирующие и клонирующие векторы обычно содержат ген отбора, также называемый селектируемым маркером. Типичные гены отбора кодируют белки, которые (а) придают устойчивость к антибиотикам или другим токсинам, например к ампициллину, неомицину, метотрексату или тетрациклину, (b) дополняют ауксотрофные недостаточности или (с) поставляют критические питательные элементы, не доступные из комплексной среды, например, введением гена, кодирующего D-аланинрацемазу, для Bacilli.
Примерами подходящих селектируемых маркеров для клеток млекопитающих являются маркеры, которые делают возможной идентификацию клеток, компетентных для поглощения ДНК-последовательности, кодирующей описанные здесь полипептиды или антитела, такие как DHFR или тимидинкиназа. Подходящей клеткой-хозяином при использовании DHFR дикого типа, является линия клеток СНО, дефектная по активности DHFR, полученная и размноженная, как описано Urlaub et al., Proc. Natl. Acad. Sci. USA, 77:4216 (1980). Подходящим геном отбора для применения в дрожжах является ген trp1, присутствующий в дрожжевой плазмиде YRp7 [Stinchcomb et al., Nature, 282:39 (1979); Kingsman et al., Gene, 7:141 (1979); Tschemper et al., Gene, 10:157 (1980)]. Этот ген trp1 обеспечивает маркер отбора для мутантного штамма дрожжей, не способного расти в триптофане, например АТСС No. 44076 или PEP4-1 [Jones, Genetics, 85:12 (1977)].
Экспрессирующие и клонирующие векторы содержат обычно промотор, функционально связанный с такими ДНК-последовательностями, для регуляции синтеза мРНК. Промоторы, узнаваемые разнообразными потенциальтными клетками-хозяевами, хорошо известны. Промоторы, подходящие для использования с прокариотическими хозяевами, включают в себя промоторные системы лактамазы и лактозы [Chang et al., Nature, 275:615 (1978); Goeddel et al., Nature, 281:544 (1979)], промоторную систему щелочной фосфатазы, триптофана (trp) [Goeddel, Nucleic Acids Res., 8:4057 (1980); EP 36776], и гибридные промоторы, такие как промотор tac [de Boer et al., Proc. Natl. Acad. Sci. USA, 80:21-25 (1983)]. Промоторы для использования в бактериальных системах будут содержать последовательность Шайна-Далгарно, функционально связанную с такими ДНК-последовательностями.
Примеры подходящих промоторных последовательностей для использования в дрожжевых хозяевах включают в себя промоторы для 3-фосфоглицераткиназы [Hitzeman et al., J. Biol. Chem., 255:2073 (1980)] или других гликолитических ферментов [Hess et al., J. Adv. Enzyme Reg., 7:149 (1968); Holland, Biochemistry, 17:4900 (1978)], таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа.
Другие дрожжевые промоторы, которые являются индуцибельными промоторами, имеющими дополнительное преимущество транскрипции, регулируемой условиями роста, являются промоторными районами для алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, ферментов деградации, связанных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для использования в экспрессии дрожжей описаны в ЕР 73657.
Транскрипция векторов в клетках-хозяевах млекопитающих может регулироваться, например, промоторами, полученными из геномов вирусов, таких как полиомавирус, вирус птичьей оспы (UK 2211504, опубликованный 5 июля 1989 года), аденовирус (например, аденовирус 2), бычий папилломавирус, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В и вирус 40 обезьян (SV40), из гетерологичных промоторов млекопитающих, например, промотора актина или промотора иммуноглобулина, и из промоторов теплового шока, при условии, что такие промоторы совместимы с этими системами клеток-хозяев.
Транскрипция нуклеиновой кислоты, кодирующей описанные здесь полипептиды или антитела, высшими эукриотами может быть увеличена встраиванием в этот вектор энхансерной последовательности. Энхансеры являются цис-действующими элементами ДНК, состоящими из приблизительно 10-300 п.н., которые действуют на промотор, увеличивая его транскрипцию. Многочисленные энхансерные последовательности известны в настоящее время из генов млекопитающих (глобина, эластазы, альбумина,  -фетопротеина и инсулина). Однако обычно используют энхансер вируса эукариотических клеток. Примеры включают в себя энхансер SV40 на конце сайта инициации репликации (п.н. 100-270), энхансер раннего промотора цитомегаловируса, энхансер полиомавируса в конце сайта инициации репликации и аденовирусные энхансеры. Энхансер может быть введен сплайсингом в этот вектор в положении 5′ (слева) или 3′ (справа) относительно кодирующей последовательности, но предпочтительно он расположен в сайте 5′ (слева) от промотора. -фетопротеина и инсулина). Однако обычно используют энхансер вируса эукариотических клеток. Примеры включают в себя энхансер SV40 на конце сайта инициации репликации (п.н. 100-270), энхансер раннего промотора цитомегаловируса, энхансер полиомавируса в конце сайта инициации репликации и аденовирусные энхансеры. Энхансер может быть введен сплайсингом в этот вектор в положении 5′ (слева) или 3′ (справа) относительно кодирующей последовательности, но предпочтительно он расположен в сайте 5′ (слева) от промотора.
Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (дрожжах, грибах, насекомых, растении, животном, человеке или имеющих ядро клетках из других многоклеточных организмов), будут также содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности являются обычно доступными из 5′- и, необязательно, 3′-нетранслируемых районов эукариотических или вирусных ДНК или кДНК. Эти районы содержат нуклеотидные сегменты, транскрибируемые в виде фрагментов полиаденилирования в нетранслируемой части мРНК, кодирующей описанные здесь полипептиды или антитела.
Другие способы, векторы и клетки-хозяева, подходящие для адаптации к синтезу описанных здесь полипептидов или антител в культуре рекомбинантных клеток позвоночных животных, описаны в Gething et al., Nature, 293:620-625 (1981); Mantei et al., Nature, 281:40-46 (1979); ЕР 117060 и ЕР 117058.
4. Детектирование амплификации/экспрессии генов
Амплификация и/или экспрессия генов может быть измерена в пробе непосредственно, например, общепринятыми блоттингом по Саузерну, Нозерн-блоттингом для количественного определения транскрипции мРНК [Thomas, Proc. Natl. Acad. Sci. USA, 77:5201-5205 (1980)], дот-блоттингом (анализом ДНК) или гибридизацией in situ с использованием подходящим образом меченого зонда, основанного на обеспеченных здесь последовательностях. Альтернативно могут быть использованы антитела, которые могут узнавать специфические дуплексы, в том числе ДНК-дуплексы, РНК-дуплексы и ДНК-РНК-гибридные дуплексы или ДНК-белок-дуплексы. Эти антитела, в свою очередь, могут быть мечеными, и этот анализ может проводиться, когда этот дуплекс связан с поверхностью, так что при образовании дуплекса на этой поверхности может быть детектировано антитело, связанное с этим дуплексом.
Альтернативно экспрессия генов может быть измерена иммунологическими способами, такими как иммуногистохимическое окрашивание клеток или срезов тканей и анализ культуры клеток или жидкостей тела для количественного определения непосредственно экспрессии продукта гена. Антитела, применимые для иммуногистохимического анализа и/или анализа жидкостей образцы, могут быть либо моноклональными, либо поликлональными и могут быть получены в любом млекопитающем. Предпочтительно эти антитела могут быть получены против описанных здесь полипептидов или против синтетического пептида, полученного на основе ДНК-последовательностей, обеспеченных здесь, или против экзогенной последовательности, слитой с ДНК, кодирующей такие полипептиды и антитела и кодирующие специфический эпитоп антитела.
5. Очистка полипептида
Формы рассматриваемых здесь полипептидов или антител могут быть извлечены из культуральной среды или из лизатов клеток-хозяев. Если они являются мембраносвязанными, они могут быть выделены из мембраны с использованием раствора подходящего детергента (например, Тритона Х-100) или ферментативным отщеплением. Клетки, используемые при экспрессии описанных здесь полипептидов или антител, могут быть разрушены различными физическими или химическими способами, такими как чередование циклов замораживания-оттаивания, обработка ультразвуком, механическое разрушение или использование лизирующих клетки агентов.
Может быть желательной очистка описанных здесь полипептидов или антител от белков или других полипептидов рекомбинантных клеток. Примерами подходящих процедур очистки являются следующие процедуры: фракционирование на ионообменной колонке; осаждение этанолом; обращенно-фазовая ВЖХ; хроматография на силикагеле или на катионообменной смоле, такой как ДЭАЭ; хроматофокусирование; электрофорез в ДСН-ПААГ; осаждение сульфатом аммония; гель-фильтрация с использованием, например, Sephadex G-75; колонки протеин А-Сефарозы для удаления загрязнителей, таких как IgG; и металл-хелатирующие колонки для связывания меченных эпитопом форм этого полипептида или антитела. Могут быть использованы разнообразные способы очистки белка, и такие способы известны в данной области и описаны, например, в Deutscher, Methods in Enzymology, 182 (1990); Scopes, Protein Purification: Principles and Practice, Springer-Verlag, New York (1982). Выбранная(-ые) стадия(-ии) очистки будет(-ут) зависеть, например, от характера используемого способа получения и от конкретного полученного полипептида или антитела.
В. Получение антител
В некоторых вариантах осуществления данного изобретения выбранный белок является антителом. Далее следуют способы получения антител, в том числе поликлональных, моноклональных, гуманизированных, биспецифических и гетероконъюгатных антител.
1) Поликлональные антитела
Поликлональные антитела обычно индуцируют в животных множественными подкожными (п.к.) или внутрибрюшинными (в.б.) инъекциями релевантного антигена и адъюванта. Может быть полезным конъюгирование релевантного антигена с белком, который является иммуногенным в подлежащем иммунизации виде, например, гемоцианином фиссуреллы (KLH), сывороточным альбумином, бычьим тироглобулином или ингибитором трипсина сои с использованием бифункционального или дериватизирующего агента, например сложного эфира малеимидобензоилсульфосукцинимида (конъюгирование через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутарового альдегида, янтарного ангидрида, SOCl2 или R1N=C=NR, где R и R1 обозначают независимо низшие алкильные группы. Примеры адъювантов, которые могут быть использованы, включают в себя полный адъювант Фрейнда и адъювант MPL-TDM (монофосфориллипид А, синтетический дикориномиколат трегалозы). Протокол иммунизации может быть выбран специалистом с квалификацией в данной области без чрезмерного экспериментирования.
Животных имунизируют против этого антигена, иммуногенных конъюгатов или производных объединением, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и инъецированием этого раствора интрадермально во множественных участках. Спустя один месяц животных повторно иммунизируют (бустер-имунизацией) 1/5-1/10 исходного количества пептида или конъюгата в полном адъюванте Фрейнда подкожной инъекцией во множественных участках. Спустя семь-четырнадцать дней у животных берут кровь и сыворотку анализируют на титр антител. Животных повторно иммунизируют, пока не получают плато титра. Конъюгаты могут быть также получены в культуре рекомбинантных клеток в виде слитых белков. Кроме того, предпочтительно использовать агрегирующие агенты для усиления иммунной реакции.
2) Моноклональные антитела
Моноклональные антитела получают из популяции по существу гомогенных антител, т.е. индивидуальные антитела, составляющие эту популяцию, являются идентичными за исключением возможных природно встречающихся мутаций и/или посттрансляционных модификаций (например, изомеризаций, амидирований), которые могут присутствовать в минорных количествах. Таким образом, определение «моноклональные» указывает на характер антитела, как не являющегося смесью дискретных антител.
Например, моноклональные антитела могут быть получены с использованием гибридомного способа, впервые описанного Kohler et al., Nature, 256: 495 (1975), или могут быть получены способами рекомбинантных ДНК (патент США № 4816567).
В гибридомном способе мышь или другое подходящее животное-хозяин, такое как хомяк, иммунизируют, как описано выше, для индукции лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с белком, использованным для иммунизации. Альтернативно лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с миеломными клетками с использованием подходящего агента слияния, такого как полиэтиленгликоль, для образования гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986).
Агент иммунизации будет обычно включать в себя антигенный белок или его слитый вариант. Обычно используют либо лимфоциты периферической крови (“PBL”), если желательны клетки человеческого происхождения, либо клетки селезенки или клетки лимфатических узлов, если желательны источники клеток млекопитающего не человека. Затем эти лимфоциты сливают с иммортализованной клеточной линией с использованием подходящего агента слияния, такого как полиэтиленгликоль, для образования гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press (1986), pp. 59-103.
Иммортализованные клеточные линии являются обычно трансформированными клетками млекопитающих, в частности миеломными клетками грызуна, коровы или человека. Обычно используют линии клеток миеломы крысы или мыши. Полученные таким образом гибридомные клетки высевают и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или выживание неслитых, исходных клеток миеломы. Например, если исходные клетки миеломы не содержат фермента гипоксантингуанинфосфорибозилтрансферазы (HGPRT или HPRT), то эта культуральная среда для гибридом обычно будет содержать гипоксантин, аминоптерин и тимидин (среда НАТ), вещества, которые предотвращают рост HGPRT-недостаточных клеток.
Предпочтительными иммортализованными миеломными клетками являются клетки, которые эффективно сливаются, поддерживают стабильное продуцирование на высоком уровне антитела выбранными продуцирующими антитело клетками и являются чувствительными к такой среде, как среда НАТ. Среди них предпочтительными являются мышиные миеломные линии, такие как линии, произведенные из мышиных опухолей МОРС-21 и МРС-11, доступные из Salk Institute Cell Distribution Center, San Diego, California USA, и клетки SP-2 (и их производные, например, Х63-Ag8-653), доступные из American Type Culture Collection, Manassus, Virginia USA. Были также описаны линии клеток миеломы человека и линии клеток гетеромиеломы человек-мышь для получения моноклональных антител человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой растут гибридомные клетки, анализируют на продукцию моноклональных антител, направленных против рассматриваемого антигена. Предпочтительно специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют иммунопреципитацией или анализом связывания in vitro, таким как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
Культуральная среда, в которой культивируют гибридомные клетки, может быть проанализирована на присутствие моноклональных антител, направленных против желаемого антигена. Предпочтительно аффинность и специфичность связывания моноклонального антитела может быть определена иммунопреципитацией или анализом связывания in vitro, таким как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA). Такие способы и анализы известны в данной области. Например, аффинность связывания может быть определена Скетчард-анализом Munson et al., Anal. Biochem., 107:220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела желаемой специфичности, аффинности и/или активности, эти клоны могут быть субклонированы процедурами лимитирующих разведений и выращены стандартными способами (Goding, выше). Подходящие для этой цели культуральные среды включают в себя, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки могут выращиваться in vivo в виде асцитных опухолей в млекопитающем.
Моноклональные антитела, секретируемые этими субклонами, подходящим образом отделяют от культуральной среды, асцитной жидкости или сыворотки общепринятыми процедурами очистки иммуноглобулинов, такими как, например, способ с использованием протеин А-Сефарозы, гидроксиапатитная хроматография, гель-электрофорез, диализ или аффинная хроматография.
Моноклональные антитела могут быть получены способами рекомбинантных ДНК, такими как описанные в патенте США № 4816567 и как описанные выше способы. ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи мышиных антител). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки COS обезьян, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые в противном случае не продуцируют белок иммуноглобулина, для синтеза моноклональных антител в таких рекомбинантных клетках-хозяевах. Обзорные статьи по рекомбинантной экспрессии в бактериях ДНК, кодирующей это антитела, включают в себя Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) и Pluckthun, Immunol. Revs. 130:151-188 (1992).
В следующем варианте осуществления антитела могут быть выделены из фаговых библиотек антител с использованием способов, описанных в McCafferty et al., Nature, 348:552-554 (1990). Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991) описывают выделение антител мыши и человека соответственно, с использованием фаговых библиотек. Следующие публикации описывают получение высокоаффинных (в диапазоне нМ) антител человека перетасовкой цепи (Marks et al., Bio/Technology, 10:779-783 (1992), а также комбинаторное инфицирование и рекомбинацию in vivo в качестве стратегии для конструирования очень больших фаговых библиотек (Waterhouse et al., Nucl. Acids Res., 21:2265-2266 (1993)). Таким образом, эти способы являются жизнеспособными альтернативами традиционным гибридомным способам получения моноклональных антител для выделения моноклональных антител.
ДНК может быть также модифицирована, например, заменой кодирующей последовательностью для константных доменов тяжелой и легкой цепей человека гомологичных мышиных последовательностей (патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851 (1984) или ковалентным присоединением к кодирующей последовательности иммуноглобулина всей или части кодирующей последовательности полипептида, не являющегося иммуноглобулином. Обычно такими не-иммуноглобулиновыми полипептидами заменяют константные домены антитела, или ими заменяют вариабельные домены одного антигенсвязывающего сайта антитела для создания химерного бивалентного антитела, содержащего один антигенсвязывающий сайт, имеющий специфичность в отношении одного антигена, и другой антигенсвязывающий сайт, имеющий специфичность в отношении другого антигена.
Описанные здесь моноклональные антитела могут быть моновалентными антителами, получение которых хорошо известно в данной области. Например, один способ включает в себя рекомбинантную экспрессию легкой цепи и модифицированной тяжелой иммуноглобулина. Тяжелую цепь обычно укорачивают в любой точке Fc-района для предотвращения перекрестного связывания тяжелой цепи. Альтернативно релевантные остатки цистеина могут быть заменены другим аминокислотным остатком или делетированы для предотвращения перекрестного связывания. Способы in vitro также пригодны для получения моноклональных антител. Расщепление антител для получения их фрагментов, в частности Fab-фрагментов, может выполняться с использованием рутинных способов, известных в данной области.
Химерные или гибридные антитела могут быть также получены in vitro с использованием известных в синтетической химии белков способов, включающих в себя способы с использованием агентов сшивания. Например, могут быть сконструированы иммунотоксины с использованием реакции дисульфидного обмена или посредством образования тиоэфирной связи. Примеры подходящих реагентов для этой цели включают в себя иминотиолат и метил-4-меркаптобутиримидат.
3) Гуманизированные антитела
Антитела данного изобретения могут дополнительно включать в себя гуманизированные антитела или антитела человека. Гуманизированными формами антител не человека (например, мышиных антител) являются химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab’, F(ab’)2) или другие антигенсвязывающие субпоследовательности антител), которые содержат минимальную последовательность, происходящую из иммуноглобулина не человека. Гуманизированные антитела включают в себя иммуноглобулины человека (реципиентное антитело), в которых остатки из определяющего комплементарность района (CDR) реципиента заменены остатками из CDR вида не человека (донорного антитела), такого как мышь, крыса или кролик, имеющего желаемые специфичность, аффинность и потенциал. В некоторых случаях каркасные остатки Fv иммуноглобулина человека заменены соответствующими остатками не человека. Гуманизированные антитела могут также содержать остатки, которые не обнаружены ни в реципиентном антителе, ни в импортируемых последовательностях CDR или каркасных последовательностях. Обычно гуманизированное антитело будет содержать по существу все из по меньшей мере одного и обычно двух вариабельных доменов, в которых все или по существу все районы CDR соответствуют районам CDR иммуноглобулина не человека, и все или по существу все FR-районы являются FR-районами консенсусной последовательности иммуноглобулина человека. Оптимально гуманизированное антитело будет также содержать по меньшей мере часть константного района (Fc) иммуноглобулина, обычно часть Fc-района иммуноглобулина человека. Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) и Presta, Curr. Opin. Struct. Biol. 2: 593-596 (1992).
Способы гуманизации антител не человека хорошо известны в данной области. Обычно гуманизированное антитело имеет одну или несколько аминокислот, введенных в него, из источника, который не является человеком. Эти аминокислотные остатки «не человека» часто называют «импортными» остатками, которые обычно берутся из «импортного» вариабельного домена. Гуманизацию можно проводить в основном по способу Winter et al., Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988); Verhoeyen et al., Science 239:1534-1536 (1988) или посредством замены CDR или последовательностей CDR антитела человека соответствующими последовательностями грызуна. Таким образом, такие «гуманизированные» антитела являются химерными антителами (патент США № 4816567), в которых по существу менее, чем один интактный вариабельный домен человека, был заменен соответствующей последовательностью из вида не человека. На практике гуманизированные антитела являются обычно антителами человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из аналогичных участков в антителах грызуна.
Выбор вариабельных доменов, как легкой, так и тяжелой цепи, человека, для использования в получении гуманизированных антител является очень важным для уменьшения антигенности. В соответствии с так называемым «наилучшим образом подогнанным» способом последовательность вариабельного домена антитела грызуна подвергают скринингу против всей библиотеки известных последовательностей вариабельного домена человека. Затем последовательность человека, которая является наиболее близкой к последовательности грызуна, берут в качестве каркаса (FR) человека для гуманизированного антитела. Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987). Другой способ использует конкретный каркас, полученный из консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Такой же каркас может быть использован для нескольких других гуманизированных антител. Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993).
Кроме того, важно, что антитела должны быть гуманизированы с сохранением высокой аффинности в отношении антигена и других предпочтительных биологических свойств. Для решения этой задачи согласно предпочтительному способу гуманизированные антитела получают с использованием процесса анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются обычно доступными и известными специалистам с квалификацией в данной области. Доступны компьютерные программы, которые иллюстрируют и изображают возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулинов. Просмотр этих изображений позволяет проанализировать вероятную роль этих остатков в функционировании кандидатной последовательности иммуноглобулина, т.е. проанализировать остатки, которые влияют на способность кандидатного иммуноглобулина связывать его антиген. Таким путем, FR-остатки могут быть выбраны и комбинированы из реципиентных и донорных последовательностей таким образом, что достигается желаемое свойство антитела, такое как увеличенная аффинность в отношении антигена-мишени (антигенов-мишеней). Обычно остатки CDR прямо и наиболее существенно участвуют во влиянии на связывание антигена.
Рассматриваются разнообразные формы гуманизированного антитела. Например, гуманизированным антителом может быть фрагмент антитела, такой как Fab, который необязательно конъюгирован с одним или несколькими цитотоксическими агентами для генерирования иммуноконъюгата. Альтернативно гуманизированным антителом может быть интактное антитело, такое как интактное IgG1-антитело.
4) Антитела человека
В качестве альтернативы гуманизации могут быть получены антитела человека. Например, в настоящее время возможно получение трансгенных животных (например, мышей), которые способны, при иммунизации, продуцировать полный спектр антител человека в отсутствие эндогенного образования иммуноглобулина. Например, было описано, что гомозиготная делеция гена района соединения тяжелой цепи (JH) антитела в химерных и имеющих зародышевую мутацию мышах приводит к полному ингибированию эндогенного продуцирования антител. Перенос массива зародышевых генов иммуноглобулина человека в такую мышь с зародышевой мутацией будет приводить к продуцированию антител человека при введении антигена. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); патент США № 5591669 и WO 97/17852.
Альтернативно для получения антител и фрагментов антител человека in vitro из спектров генов вариабельного (V) домена иммуноглобулина из неиммунизированных доноров может быть использована технология фагового дисплея. McCafferty et al., Nature, 348:552-554 (1990); Hoogenboom and Winter, J. Mol. Biol. 227: 381 (1991). Согласно этому способу гены V-домена антитела клонируют в рамке считывания в ген большого или малого белка оболочки нитевидного бактериофага, такого как М13 или fd, и экспонируют в качестве функциональных фрагментов антитела на поверхности фаговой частицы. Поскольку эта нитевидная частица содержит копию одноцепочечной ДНК генома фага, отбор на основе функциональных свойств этого антитела также приведет к отбору гена, кодирующего антитело, проявляющее эти свойства. Таким образом, этот фаг имитирует некоторые из свойств В-клетки. Фаговый дисплей может выполняться в различных форматах, рассмотренных, например, в обзоре Johnson, Kevin S. and Chiswell, David J., Curr. Opin. Struct. Biol. 3:564-571 (1993). Несколько источников сегментов V-генов могут быть использованы для фагового дисплея. Clackson et al., Nature 352:624-628 (1991) выделили разнообразный массив антител против оксазолона из небольшой случайной комбинаторной библиотеки V-генов, происходящих из селезенок иммунизированных мышей. Можно конструировать спектр V-генов из неиммунизированных доноров-людей, и антитела к разнообразному массиву антигенов (в том числе своих антигенов) могут быть выделены с использованием в основном способов, описанных Marks et al., J. Mol. Biol. 222:581-597 (1991) или Griffith et al., EMBO J. 12:725-734 (1993). См. также патенты США №№ 5565332 и 5573905.
Способы Cole et al. и Boerner et al. также могут использоваться для получения моноклональных антител человека (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985) и Boerner et al., J. Immunol. 147(1): 86-95 (1991). Подобным образом антитела человека могут быть получены введением локусов иммуноглобулина человека в трансгенных животных, например, мышей, в которых эндогенные гены иммуноглобулина были частично или полностью инактивированы. При аллергизации наблюдают образование антител человека, которые очень сходны с антителами, наблюдаемыми в человеке, во всех отношениях, в том числе в реаранжировке генов, сборке и спектре антител. Этот подход описан, например, в патентах США №№ 5545807, 5545806, 5569825, 5625126, 5633425, 5661016 и в следующих научных публикациях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-13 (1994), Fishwild et al., Nature Biotechnology 14: 845-51 (1996), Neuberger, Nature Biotechnology 14: 826 (1996) и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
Наконец, антитела человека могут быть также генерированы in vitro активированными В-клетками (см. патенты США №№ 5567610 и 5229275).
5) Фрагменты антител
В некоторых случаях предпочтительно использовать фрагменты антител, а не целые антитела. Фрагменты малых размеров делают возможным быстрый клиренс и могут приводить к улучшенному доступу к солидным опухолям.
Были разработаны разнообразные способы для получения фрагментов антител. Традиционно эти фрагменты получали протеолитическим расщеплением интактных антител (см., например, Morimoto et al., J. Biochem. Biophys. Method. 24:107-117 (1992); и Brennan et al., Science 229:81 (1985)). Однако эти фрагменты могут быть продуцированы теперь рекомбинантными клетками-хозяевами. Фрагменты антител Fab, Fv и scFv могут быть, все, экспрессированы в E.coli и секретированы из E.coli, что позволяет легко получать большие количества этих фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, обсужденных выше. Альтернативно Fab’-SH-фрагменты могут быть непосредственно извлечены из E.coli и химически связаны с образованием F(ab’)2-фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). Согласно другому подходу F(ab’)2-фрагменты могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Fab и F(ab’)2 с увеличенным полупериодом существования в организме описаны в патенте США № 5869046. В других вариантах осуществления предпочтительным антителом является одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185; патент США № 5571894 и патент США № 5587458. Этот фрагмент антитела может быть также “линейным антителом”, например, описанным в патенте США 5641870. Такие линейные фрагменты антител могут быть моноспецифическими или биспецифическими.
6) Антителозависимая опосредованная ферментом пролекарственная терапия (ADEPT)
Антитела данного изобретения могут быть также использованы в ADEPT посредством конъюгирования антитела с активирующим пролекарство ферментом, который превращает пролекарство (например, пептидильный химиотерапевтический агент, см. WO 81/01145) в активное противораковое лекарственное средство. См., например, WO 88/07378 и патент США 4975278.
Ферментный компонент иммуноконъюгата, который может использоваться в ADEPT, включает в себя любой фермент, способный воздействовать на пролекарство таким образом, что оно превращается в его более активную, цитотоксическую форму.
Ферменты, которые могут использоваться в этом способе данного изобретения, включают в себя, но ими не ограничиваются, гликозидазу, глюкозооксидазу, лизоцим человека, глюкуронидазу человека, щелочную фосфатазу, применимую для превращения фосфатсодержащих пролекарств в свободные лекарственные средства; арилсульфатазу, применимую для превращения сульфатсодержащих пролекарств в свободные лекарственные средства; цитозиндеаминазу, применимую для превращения нетоксичного 5-фторцитозина в противораковое лекарственное средство 5-фторурацил; протеазы, такие как протеаза Serratia, термолизин, субтилизин, карбоксипептидазы (например, карбоксипептидазу G2 и карбоксипептидазу А) и катепсины (такие как катепсины В и L), которые применимы для превращения пептидсодержащих пролекарств в свободные лекарственные средства; D-аланилкарбоксипептидазы, применимые для превращения пролекарств, которые содержат D-аминокислотные заместители; расщепляющие углеводы ферменты, такие как  -галактозидаза и нейраминидаза, применимые для превращения гликозилированных пролекарств в свободные лекарственные средства; -галактозидаза и нейраминидаза, применимые для превращения гликозилированных пролекарств в свободные лекарственные средства;  -лактамазу, применимую для превращения лекарственных средств, дериватизованных -лактамазу, применимую для превращения лекарственных средств, дериватизованных  -лактамами, в свободные лекарственные средства; и пенициллинамидазы, такие как пенициллин V-амидаза или пенициллин G-амидаза, применимые для превращения лекарственных средств, дериватизованных при атомах азота их аминогрупп феноксиацетильной или фенилацетильной группой соответственно, в свободные лекарственные средства. Альтернативно антитела с ферментативной активностью, известные также как «абзимы» (“abzym”), могут быть использованы для превращения пролекарств данного изобретения в свободные активные лекарственные средства (см., например, Massey, Nature 328: 457-458 (1987)). Конъюгаты антитело-абзим могут быть получены, как описано здесь, для доставки этого абзима в популяцию опухолевых клеток. -лактамами, в свободные лекарственные средства; и пенициллинамидазы, такие как пенициллин V-амидаза или пенициллин G-амидаза, применимые для превращения лекарственных средств, дериватизованных при атомах азота их аминогрупп феноксиацетильной или фенилацетильной группой соответственно, в свободные лекарственные средства. Альтернативно антитела с ферментативной активностью, известные также как «абзимы» (“abzym”), могут быть использованы для превращения пролекарств данного изобретения в свободные активные лекарственные средства (см., например, Massey, Nature 328: 457-458 (1987)). Конъюгаты антитело-абзим могут быть получены, как описано здесь, для доставки этого абзима в популяцию опухолевых клеток.
Вышеупомянутые ферменты могут быть ковалентно связаны с описанными здесь полипептидами или антителами способами, хорошо известными в данной области, такими как применение гетеробифункциональных сшивающих агентов, обсуждаемых выше. Альтернативно могут быть сконструированы слитые белки, содержащие по меньшей мере антигенсвязывающий район антитела данного изобретения, связанный по меньшей мере с функционально активной частью фермента данного изобретения с использованием способов рекомбинантных ДНК, хорошо известных в данной области (см., например, Neuberger et al., Nature 312: 604-608 (1984)).
7) Биспецифические и полиспецифические антитела
Биспецифические антитела (BsAbs) являются антителами, которые имеют специфичности связывания в отношении по меньшей мере двух различных эпитопов, в том числе эпитопов на одном и том же или на другом белке. Альтернативно одно плечо может быть сконструировано для связывания с антигеном-мишенью, а другое плечо может быть объединено с плечом, которое связывается с триггерной молекулой на лейкоците, такой как молекула рецептора Т-клеток (например, CD3) или Fc-рецепторы для IgG (Fc R), такие как Fc R), такие как Fc RI (CD64), Fc RI (CD64), Fc RII (CD32) и Fc RII (CD32) и Fc RIII (CD16), таким образом, чтобы сфокусировать и локализовать защитные механизмы клетки в направлении клетки, экспрессирующей антиген-мишень. Такие антитела могут быть произведены из полноразмерных антител или фрагментов антител (например, F(ab’)2-биспецифические антитела)). RIII (CD16), таким образом, чтобы сфокусировать и локализовать защитные механизмы клетки в направлении клетки, экспрессирующей антиген-мишень. Такие антитела могут быть произведены из полноразмерных антител или фрагментов антител (например, F(ab’)2-биспецифические антитела)).
Биспецифические антитела могут быть также использованы для локализации цитотоксических агентов в клетках, которые экспрессируют антиген-мишень. Такие антитела имеют одно плечо, которое связывает желаемый антиген, и другое плечо, которое связывает цитотоксический агент (например, сапорин, анти-интерферон- , винкаалкалоид, цепь А рицина, метотрексат или гаптен с радиоактивным изотопом). Примеры известных биспецифических антител включают в себя анти-ErbВ2/анти-FcgRIII (WO 96/16673), анти-ERB2/анти-FcRI (патент США 5837234), анти-ErbВ2/анти-CD3 (патент США 5821337). , винкаалкалоид, цепь А рицина, метотрексат или гаптен с радиоактивным изотопом). Примеры известных биспецифических антител включают в себя анти-ErbВ2/анти-FcgRIII (WO 96/16673), анти-ERB2/анти-FcRI (патент США 5837234), анти-ErbВ2/анти-CD3 (патент США 5821337).
Способы получения биспецифических антител известны в данной области. Традиционное получение полноразмерных биспецифических антител основано на коэкспрессии двух пар тяжелых цепей и легких цепей иммуноглобулина, где эти две пары цепей имеют различные специфичности. Millstein et al., Nature, 305:537-539 (1983). Вследствие случайной реаранжировки тяжелых и легких цепей иммуноглобулина эти гибридомы (квадромы) образуют потенциальную смесь из 10 разных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Очистка этой правильной молекулы, которую обычно выполняют посредством стадий аффинной хроматографии, является довольно обременительной, выходы этого продукта являются низкими. Сходные процедуры описаны в WO 93/08829 и в Traunecker et al., EMBO J., 10:3655-3659 (1991).
В соответствии с другим подходом вариабельные домены антител с желаемыми специфичностями связывания (антитело-антигенсвязывающие сайты) сливают с последовательностями константных доменов тяжелой цепи. Предпочтительно это слияние является слиянием с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области, районы СН2 и СН3. Предпочтительно оно имеет первый константный район тяжелой цепи (СН1), содержащий сайт, необходимый для связывания легкой цепи, присутствующий по меньшей мере в одном из этих слияний. ДНК, кодирующие эти слияния тяжелых цепей иммуноглобулина и, если желательно, легкую цепь иммуноглобулина, встраивают в раздельные экспрессирующие векторы и котрансфицируют в подходящий организм-хозяин. Это обеспечивает большую гибкость в коррекции взаимных долей трех полипептидных фрагментов в вариантах осуществления в которых неравные доли этих трех полипептидных цепей, используемых в этой конструкции, обеспечивают оптимальные выходы. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам или когда эти соотношения не имеют особого значения.
В предпочтительном варианте осуществления этого подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью в одном плече и гибридной пары тяжелая цепь – легкая цепь иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Было обнаружено, что эта асимметричная структура облегчает отделение желаемого биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, так как присутствие легкой цепи иммуноглобулина только в одной половине этих биспецифических молекул обеспечивает легкий путь отделения. Этот подход описан в WO 94/04690. В отношении дополнительных подробностей образования биспецифических антител см., например, Suresh et al., Methods in Enzymology 121: 210 (1986).
В соответствии с другим подходом, описанным в WO 96/27011 или в патенте США 5731168, поверхность раздела между парой молекул антител может быть сконструирована таким образом, чтобы максимизировать процент гетеродимеров, которые извлекают из культуры рекомбинантных клеток. Предпочтительная поверхность раздела содержит по меньшей мере часть района СН3 константного домена антитела. В этом способе одна или несколько малых аминокислотных боковых цепей из поверхности раздела молекулы первого антитела заменены большими боковыми цепями (например, тирозина или триптофана). Компенсаторные «впадины» идентичного или сходного размера относительно больших боковых цепей создаются на поверхности раздела второй молекулы антитела заменой больших аминокислотных боковых цепей меньшими (например, аланина или треонина). Это обеспечивает механизм для увеличения выхода этого гетеродимера относительно других, нежелательных, конечных продуктов, таких как гомодимеры.
В литературе были описаны способы генерирования биспецифических антител из фрагментов антител. Например, биспецифические антитела могут быть получены с использованием образования химической связи. Brennan et al., Science 229: 81 (1985) описывают процедуру, в которой интактные антитела протеолитически расщепляют с генерированием F(ab’)2-фрагментов. Эти фрагменты восстанавливают в присутствии комплексирующего дитиолы агента арсенита натрия для стабилизации вицинальных дитиолов и предотвращения образования межмолекулярных дисульфидных связей. Затем полученные Fab’-фрагменты превращают в тионитробензоатные (TNB) производные. Затем одно из Fab’-TNB-производных повторно превращают в Fab’-TNB-производное для образования биспецифического антитела. Полученные биспецифические антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
Fab’-фрагменты могут быть непосредственно извлечены из E.coli и химически связаны с образованием биспецифических антител. Shalaby et al., J. Exp. Med. 175: 217-225 (1992) описывают образование полностью гуманизированных F(ab’)2-молекул биспецифического антитела. Каждый Fab’-фрагмент отдельно секретировался из E.coli и подвергался направленному химическому связыванию in vitro с получением биспецифического антитела. Образованное таким образом биспецифическое антитело было способно связываться с клетками, сверхэкспрессирующими рецептор ErbB2, и нормальными Т-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека против мишеней опухоли молочной железы человека.
Были также описаны разнообразные способы получения и выделения бивалентных фрагментов антител непосредственно из культуры рекомбинантных клеток. Например, были получены бивалентные гетеродимеры с использованием лейциновых молний. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии из белков Fos и Jun связывали с Fab’-частями двух разных антител слиянием генов. Эти гомодимеры антител восстанавливали в шарнирной области для образования мономеров и затем повторно окисляли для образования гетеродимеров антител. Способ «диатела», описанный Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), обеспечил альтернативный механизм для получения биспецифических/бивалентных фрагментов антител. Эти фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) посредством линкера, который является слишком коротким, чтобы сделать возможным спаривание между этими двумя доменами на одной и той же цепи. Таким образом, домены VH и VL одного фрагмента вынуждены спариваться с доменами VL и VH другого фрагмента с образованием посредством этого двух антигенсвязывающих сайтов. Сообщалась также другая стратегия для получения биспецифических/бивалентных фрагментов антител с использованием одноцепочечных димеров Fv (sFv). См. Gruber et al., J. Immunol. 152:5368 (1994).
Рассматриваются антитела с более чем двумя валентностями. Например, могут быть получены триспецифические антитела. Tutt et al., J. Immunol. 147: 60 (1991).
Примеры биспецифических антител могут связываться с двумя разными эпитопами на данной молекуле. Альтернативно анти-белок-плечо может объединяться с плечом, которое связывается с триггерной молекулой на лейкоците, такой как молекула рецептора Т-клеток (например, CD2, CD3, CD28 или В7) или Fc-рецепторы для IgG (Fc R), такие как Fc R), такие как Fc RI (CD64), Fc RI (CD64), Fc RII (CD32) и Fc RII (CD32) и Fc RIII (CD16), таким образом, чтобы сфокусировать и локализовать защитные механизмы клетки в направлении клетки, экспрессирующей конкретный белок. Такие антитела имеют белок-связывающее плечо и плечо, которое связывает цитотоксический агент или хелатор радионуклидов, такой как EOTUBE, DPTA, DOTA или TETA. Другое интересующее биспецифическое антитело связывает интересующий белок и, кроме того, связывает тканевой фактор (TF). RIII (CD16), таким образом, чтобы сфокусировать и локализовать защитные механизмы клетки в направлении клетки, экспрессирующей конкретный белок. Такие антитела имеют белок-связывающее плечо и плечо, которое связывает цитотоксический агент или хелатор радионуклидов, такой как EOTUBE, DPTA, DOTA или TETA. Другое интересующее биспецифическое антитело связывает интересующий белок и, кроме того, связывает тканевой фактор (TF).
6) Гетероконъюгатные антитела
Гетероконъюгатные антитела также находятся в объеме данного изобретения. Гетероконъюгатные антитела состоят из двух ковалентно соединенных антител. Например, одно из этих антител в гетероконъюгате может быть связано с авидином, другое с биотином. Такие антитела были, например, предложены для нацеливания клеток иммунной системы на нежелательные клетки, патент США 4676980, и для лечения инфекции ВИЧ, WO 91/00360, WO 92/200373 и ЕР 0308936. Предполагается, что эти антитела могут быть получены in vivo с использованием известных способов синтетической химии белков, в том числе способов с использованием агентов сшивания. Например, иммунотоксины могут быть сконструированы с использованием реакции дисульфидного обмена или посредством образования тиоэфирной связи. Примеры подходящих реагентов для этой цели включают в себя иминотиолат и метил-4-меркаптобутиримидат и реагенты, описанные, например, в патенте США № 4676980. Гетероконъюгатные антитела могут быть получены с использованием подходящих способов сшивания. Подходящие агенты сшивания хорошо известны в данной области и описаны в патенте США № 4676980 вместе с рядом способов сшивания.
7) Конструирование эффекторной функции
Может быть желательной модификация антитела данного изобретения в отношении эффекторной функции, так чтобы усилить эффективность этого антитела в лечении рака. Например, в Fc-район могут быть введены остаток (остатки) цистеина, что делает возможным образование межцепочечной дисульфидной связи в этом районе. Полученное таким образом гомодимерное антитело может иметь улучшенную способность интернализации и/или увеличенное опосредованное комплементом убивание клеток и увеличенную антителозависимую клеточноопосредованную цитотоксичность (ADCC). См. Caron et al., J. Exp. Med. 176:1191-1195 (1992) и Shopes, J. Immunol. 148: 2918-2922 (1992). Гомодимерные антитела с повышенной противоопухолевой активностью могут быть также получены с использованием гетеробифункциональных сшивающих агентов, как описано в Wolff et al., Cancer Research 53: 2560-2565 (1993). Альтернативно может быть сконструировано антитело, которое имеет двойные Fc-районы и может вследствие этого иметь повышенный лизис комплемента и увеличенные способности ADCC. См. Stevenson et al., Anti-Cancer Drug Design 3: 219-230 (1989).
8) Иммуноконъюгаты
Данное изобретение относится также к иммуноконъюгатам, содержащим антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтический агент, токсин (например, ферментативно активный токсин бактериального, грибного, растительного или животного происхождения или его фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
Химиотерапевтические агенты, применимые в генерировании таких иммуноконъюгатов, включают в себя BCNU, стрептозоицин, винкристин, винбластин, адриамицин и 5-фторурацил.
Ферментативно активные токсины и их фрагменты, которые могут быть использованы, включают в себя цепь А дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модеккина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены.
Конъюгаты антитела и цитотоксического агента получают с использованием разнообразных бифункциональных белоксвязывающих агентов, таких как N-сукцинимидил-3-(2-пиридинилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат-HCl), активные эфиры (такие как дисукциниимидилсуберат), альдегиды (такие как глутаровый альдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть получен, как описано в Vitetta et al., Science, 238:1098 (1987). Меченая 14С 1-изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (МХ-DTPA) является примером хелатообразующего агента для конъюгации радионуклида с антителом. См. WO 94/11026. Этот линкер может быть «расщепляемым линкером», облегчающим высвобождение цитотоксичного лекарственного средства в клетке. Например, могут быть использованы кислотолабильный линкер, чувствительный к пептидазе линкер, диметильный линкер или дисульфидсодержащий линкер (Chari et al., Cancer Res. 52:127-131 (1992)).
Кроме того, низкомолекулярные токсины, такие как калихеамицин, майтанзин (патент США 5208020), трихотен и СС1065, также обсуждаются в качестве конъюгируемых токсинов для применения с композицией данного изобретения. В одном варианте осуществления полноразмерное антитело или его антигенсвязывающие фрагменты могут быть конъюгированы с одной или несколькими молекулами майтанзиноида (например, приблизительно 1 – приблизительно 10 молекул майтанзиноида на молекулу антитела). Майтанзиноиды являются митотическими ингибиторами, которые действуют посредством ингибирования полимеризации тубулина. Майтанзиноиды, выделенные из природных источников или полученные синтетически, в том числе, майтанзин, майтанзинал и их производные, и аналоги были описаны, см. например, патент США № 5208020 и цитированные в нем ссылки (см. столбец 2, строка 53 – столбец 3, строка 10) и патенты США 3896111 и 4151042. Способ получения конъюгатов антитело-майтанзиноид также описаны в патенте США 5208020. В предпочтительном варианте осуществления майтанзиноид связан с антителом через дисульфидную или другую серусодержащую линкерную группу. Майтанзин может быть, например, превращен с May-SS-Me, который может быть восстановлен до May-SH3 и может взаимодействовать с модифицированным антителом с образованием иммуноконъюгата майтанзиноид-антитело. Chari et al., Cancer Res. 52:127-131 (1992). Это антитело может быть модифицировано известными способами, и затем это антитело, содержащее свободные или защищенные тиоловые группы, может взаимодействовать с содержащим дисульфид майтанзиноидом с образованием конъюгата. Цитотоксичность конъюгата антитело-майианзиноид может быть измерена in vitro или in vivo известными способами, и может быть определена IC50.
Другим интересующим иммуноконъюгатом является калихеамицин. Семейство антибиотиков калихеамицина способно образовывать разрывы двухцепочечной ДНК при субпикомолярных концентрациях. Структурные аналоги калихеамицина, которые могут быть использованы, включают в себя, но не ограничиваются ими,  1 1, 1 1,  2 1, 2 1,  3 1, N-ацетил- 3 1, N-ацетил- 1 1, PSAG и 1 1, PSAG и  1 1 (Hinman et al., Cancer Res. 53:3336-3342 (1993) и Lode et al., Cancer Res. 58:2925-2928 (1998)). Другие противоопухолевые лекарственные средства, с которыми может быть конъюгировано антитело, включают в себя QFA, который является антифолатом. Как калихеамицин, так и QFA имеют внутриклеточные участки действия и не могут легко пересекать цитоплазматическую мембрану. Таким образом, клеточное поглощение этих агентов посредством опосредованной антителами интернализации в значительно степени усиливает их цитотоксические эффекты. 1 1 (Hinman et al., Cancer Res. 53:3336-3342 (1993) и Lode et al., Cancer Res. 58:2925-2928 (1998)). Другие противоопухолевые лекарственные средства, с которыми может быть конъюгировано антитело, включают в себя QFA, который является антифолатом. Как калихеамицин, так и QFA имеют внутриклеточные участки действия и не могут легко пересекать цитоплазматическую мембрану. Таким образом, клеточное поглощение этих агентов посредством опосредованной антителами интернализации в значительно степени усиливает их цитотоксические эффекты.
Рассматриваются также иммуноконъюгаты, образованные между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза, ДНКаза).
Антитело может быть также конъюгировано с высокорадиоактивным атомом. Различные радионуклиды являются доступными для образования радиоконъюгированных антител. Примеры включают в себя At211, Bi212, I131, In131, Y20, Re186, Re188, Sm153, P32 и Pb212 и радиоактивные изотопы Lu. При использовании этого конъюгата для диагностики он может содержать радиоактивный атом для сцинтиграфических исследований, например, Tc99 или I123, или спиновую метку для визуализации с использованием ядерного магнитного резонанса (ЯМР) (также известного как томография с использованием ядерно-магнитного резонанса (ЯМР), такой как иод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть включены в этот конъюгат известными способами. Например, этот пептид может быть получен биосинтезом или может быть синтезирован химическим синтезом аминокислот с использованием предшественников аминокислот, содержащих, например, фтор-19 вместо водорода. Такие метки, как Tc99 или I123, Re186, Re188 и In111, могут быть присоединены через остаток цистеина в этом пептиде. Иттрий-90 может быть присоединен через остаток лизина. Для включения иода-123 может быть использован способ IODOGEN®, Fraker et al., Biochem. Biophys. Res. Commun. 80:49-57 (1978). Другие способы конъюгации радионуклидов описаны в “Monoclonal Antibodies in Immunoscintigraphy,” (Chatal, CRC Press 1989).
Альтернативно слитый белок, содержащий антитело и цитотоксический агент, может быть получен рекомбинантными способами или пептидным синтезом. Длина ДНК может содержать соответствующие районы, кодирующие две части конъюгата, либо смежные друг с другом, либо разделенные районом, кодирующим линкерный пептид, который не нарушает желаемые свойства этого конъюгата.
В другом варианте осуществления антитело может быть конъюгировано с “рецептором” (таким как стрептавидин) для использования в предварительном нацеливании на опухоль, в котором конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязанного конъюгата из кровотока с использованием очищающего агента и затем введением “лиганда” (например, авидина), который конъюгирован с цитотоксическим агентом (например, радионуклеотидом).
9) Иммунолипосомы
Описанные здесь антитела могут быть также получены в виде иммунолипосом. “Липосома” является малым пузырьком, состоящим из различных типов липидов, фосфолипидов и/или поверхностно-активного вещества, который применим для доставки лекарственного средства млекопитающему. Компоненты липосомы обычно выстроены в бислойном образовании, сходном с расположением липидов в биологических мембранах.
Липосомы, содержащие антитело, готовят способами, известными в данной области, такими как способы, описанные Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA, 77: 4030 (1980) и патенты США №№ 4485045 и 4544545. Липосомы с увеличенным временем циркуляции описаны в патенте США № 5013556.
Особенно применимые липосомы могут быть получены способом обращенно-фазового выпаривания с использованием липидной композиции, содержащей фосфатидилхолин, холестерин и ПЭГ-дериватизованный фосфатидилэтаноламин (ПЭГ-ФЭ). Липосомы экструдируют через фильтры с определенным размером пор с получением липосом с желаемым диаметром. Fab’-фрагменты антитела данного изобретения могут быть конъюгированы с этими липосомами, как описано в Martin et al., J. Biol. Chem., 257: 286-288 (1982) посредством реакции дисульфидного обмена. В липосоме необязательно содержится химиотерапевтический агент (такой как доксорубицин) См. Gabizon et al., J. National Cancer Inst. 81(19):1484 (1989).
10) Другие модификации антител
Здесь обсуждаются также другие модификации антитела. Например, антитело может быть связано с одним из различных небелковых полимеров, например полиэтиленгликолем, пропиленгликолем, полиоксиалкиленами или сополимерами полиэтиленгликоля и полипропиленгликоля. Это антитело может быть также заключено в микрокапсулах, полученных, например, способами коацервации или межфазной полимеризацией (например, микрокапсулах из гидроксиметилцеллюлозы или желатина и микрокапсулах из поли(метилметакрилата) соответственно), в коллоидальных системах доставки лекарственных средств (например, липосомах, микросферах из альбумина, микроэмульсиях и нанокапсулах) или в макроэмульсиях. Такие способы и другие подходящие композиции описаны в Remington: The Science and Practice of Pharmacy, 20th Ed., Alfonso Gennaro, Ed., Philadelphia College of Pharmacy and Science (2000).
С. Лиофилизированные композиции
Описанные здесь композиции могут быть также получены в виде повторно восстановленных лиофилизированных композиций. Описанные здесь белки или антитела лиофилизируют и затем восстанавливают для получения стабильных жидких композиций данного изобретения с уменьшенной вязкостью. В этом конкретном варианте осуществления после получения интересующего белка, как описано выше, получают «пре-лиофилизированную композицию». Количество белка, присутствующего в этой «пре-лиофилизированной композиции», определяют с учетом желаемых объемов дозы, способа (способов) введения и т.д. Например, исходная концентрация интактного антитела может быть от приблизительно 2 мг/мл до приблизительно 50 мг/мл, предпочтительно от приблизительно 5 мг/мл до приблизительно 40 мг/мл и, наиболее предпочтительно приблизительно 20-30 мг/мл.
1) Получение лиофилизированных композиций
Белок, который может использоваться в виде композиции, обычно присутствует в растворе. Например, в имеющих повышенную ионную силу и уменьшенную вязкость композициях данного изобретения белок может присутствовать в растворе с забуференным рН при рН приблизительно 4-8 и предпочтительно приблизительно 5-7. Концентрация буфера может быть от приблизительно 1 мМ до приблизительно 20 мМ, альтернативно от приблизительно 3 мМ до приблизительно 15 мМ в зависимости, например, от буфера и желаемой тоничности этой композиции (например, восстановленной композиции). Примерами буферов и/или солей являются буферы и соли, которые являются фармацевтически приемлемыми и могут быть образованы из подходящих кислот, оснований и их солей, таких как кислоты, основания и соли, которые определяются термином «фармацевтически приемлемые» кислоты, основания и соли.
В одном варианте осуществления к пре-лиофилизированной композиции добавляют лиопротектор. Количество лиопротектора в пре-лиофилизированной композиции обычно является таким, что при восстановлении полученная пре-лиофилизированная композиция будет изотонической. Однако могут также использоваться гипертонические восстановленные композиции. Кроме того, количество лиопротектора не должно быть слишком низким, таким, что при лиофилизации происходит неприемлемое количество деградации/агрегации данного белка. Однако примерными концентрациями лиопротектора в пре-лиофилизированной композиции являются концентрации от приблизительно 10 мМ до приблизительно 400 мМ, альтернативно от приблизительно 30 мМ до приблизительно 300 мМ, альтернативно от приблизительно 50 мМ до приблизительно 100 мМ. Примеры лиопротекторов включают в себя сахара и сахароспирты, такие как сахароза, манноза, трегалоза, глюкоза, сорбит, маннит. Однако при конкретных обстоятельствах некоторые лиопротекторы могут также способствовать увеличению вязкости композиции. Поэтому следует обращать внимание на то, чтобы были выбраны конкретные лиопротекторы, которые минимизируют или нейтрализуют это действие. Дополнительными лиопротекторами являются лиопротекторы, описанные выше под определением “лиопротекторы”, называемые здесь также “фармацевтически приемлемыми сахарами”.
Отношение белка к лиопротектору может изменяться для каждого конкретного белка или антитела и комбинации лиопротекторов. В случае антитела в качестве выбранного белка и сахара (например, сахарозы или трегалозы) в качестве лиопротектора для создания изотонической восстановленной композиции с высокой концентрацией белка молярное отношение лиопротектора к антителу может быть от приблизительно 100 до приблизительно 1500 моль лиопротектора на 1 моль антитела и, предпочтительно от приблизительно 200 до приблизительно 1000 моль лиопротектора на 1 моль антитела, например, от приблизительно 200 до приблизительно 600 моль лиопротектора на 1 моль антитела.
В предпочтительном варианте осуществления может быть желательным добавление поверхностно-активного вещества к пре-лиофилизированной композиции. Альтернативно или кроме того, это поверхностно-активное вещество может быть добавлено к лиофилизированной композиции и/или восстановленной композиции. Примеры поверхностно-активных веществ включают в себя неионогенные поверхностно-активные вещества, такие как полисорбаты (например, полисорбаты 20 или 80); полиоксамеры (например, полиоксамер 188); Тритон; натрий-октилгликозид; лаурил-, миристил-, линолеил- или стеарилсульфобетаин; лаурил-, миристил-, линолеил- или стеарилсаркозин; линолеил-, миристил- или цетилбетаин; лауроамидопропил-, кокамидопропил-, линолеамидопропил-, миристамидопропил-, пальмидопропил- или изостеарамидопропилбетаин (например, лауроамидопропил); миристамидопропил-, пальмидопропил- или изостеарамидопропилдиметиламин; натрий-метилкокоил- или динатрий-метилолеилтаурат; и серия MONAQUA (Mona Industries, Inc., Paterson, New Jersey), полиэтилгликоль, полипропилгликоль и сополимеры этилена и пропиленгликоля (например, Pluronics, PF68 и т.д.). Количество добавляемого поверхностно-активного вещества является таким количеством, которое уменьшает образование частиц восстановленного белка и минимизирует образование частиц после восстановления. Например, поверхностно-активное вещество может присутствовать в пре-лиофилизированной композиции в количестве от приблизительно 0,001 до 0,5%, альтернативно от приблизительно 0,005 до 0,05%. (Mona Industries, Inc., Paterson, New Jersey), полиэтилгликоль, полипропилгликоль и сополимеры этилена и пропиленгликоля (например, Pluronics, PF68 и т.д.). Количество добавляемого поверхностно-активного вещества является таким количеством, которое уменьшает образование частиц восстановленного белка и минимизирует образование частиц после восстановления. Например, поверхностно-активное вещество может присутствовать в пре-лиофилизированной композиции в количестве от приблизительно 0,001 до 0,5%, альтернативно от приблизительно 0,005 до 0,05%.
Смесь лиопротектора (такого как сахароза или трегалоза) и наполнителя (например, маннита или глицина) может быть использована в получении пре-лиофилизированной композиции. Наполнитель может позволить получение однородного лиофилизированного остатка без избыточных полостей в нем и т.д. В пре-лиофилизированную композицию (и/или лиофилизированную композицию и/или восстановленную композицию) могут быть включены другие фармацевтически приемлемые носители, эксципиенты или стабилизаторы, такие как описанные в Remington’s Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980), при условии, что они не действуют неблагоприятным образом на желаемые характеристики композиции. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными в отношении реципиентов при используемых дозах и концентрациях и включают в себя: дополнительные буферящие агенты; консерванты; корастворители; антиоксиданты, в том числе аскорбиновую кислоту и метионин; хелатообразующие агенты, такие как ЭДТА; комплексы металлов (например, комплексы Zn-белок); биодеградируемые полимеры, такие как полиэфиры; и/или солеобразующие противоионы, такие как натрий.
Композиция данного изобретения может также содержать более чем один белок, если это необходимо для конкретного подлежащего лечению показания, предпочтительно белки с дополняющими активностями, которые не влияют неблагоприятным образом на другой белок. Например, может быть желательным обеспечение двух или более антител, которые связываются с желаемой мишенью (например, рецептором или антигеном), в единой композиции. Такие белки предпочтительно присутствуют в этой комбинации в количествах, которые являются эффективными для предполагаемой цели.
Композиции, которые предназначены для введения in vivo, должны быть стерильными. Это легко достигается фильтрованием через стерильные фильтрующие мембраны до или после лиофилизирования и восстановления. Альтернативно стерильность полной смеси может достигаться автоклавированием ингредиентов за исключением белка при приблизительно 120оС, например, в течение приблизительно 30 минут.
После смешивания вместе белка, необязательного лиопротектора и других необязательных компонентов эту композицию лиофилизируют. Многочисленные сушилки с вымораживанием являются доступными для этой цели, такие как сушилки с вымораживанием Hull50 (Hull, USA) или GT20 (Hull, USA) или GT20 (Leybold-Heraeus, Germany). Лиофилизацию выполняют вымораживанием композиции и затем сублимацией льда из замороженного содержимого при температуре, подходящей для первичной сушки. В этих условиях температура продукта находится ниже эвтектической точки или температуры разрушения этой композиции. Обычно температура выдерживания для первичной сушки будет находиться в диапазоне от приблизительно -30 до 25оС (при условии, что этот продукт остается замороженным во время первичной сушки) при подходящем давлении, обычно в диапазоне приблизительно 50-250 мТор. Состав, размер и тип контейнера для образца (например, стеклянного флакона) и объем жидкости будут в основном определять время, необходимое для сушки, которое может быть в диапазоне от нескольких часов до нескольких дней (например, 40-60 часов). Необязательно может также выполняться стадия вторичной сушки в зависимости от желаемого остаточного уровня влажности в этом продукте. Температура, при которой проводят эту вторичную сушку, находится в диапазоне приблизительно 0-40оС в зависимости прежде всего от типа и размера контейнера и типа используемого белка. Например, температура выдерживания на протяжении фазы полного удаления воды лиофилизации может быть приблизительно 15-30оС (например, приблизительно 20оС). Время и давление, требуемые для вторичной сушки, будут такими, которые дают подходящий лиофилизированный остаток в зависимости, например, от температуры и других параметров. Время вторичной сушки диктуется желаемым остаточным уровнем влажности в этом продукте и обычно составляет приблизительно 5 часов (например, 10-15 часов). Давление может быть таким же, какое использовали во время стадии первичной сушки. Условия лиофилизации могут варьироваться в зависимости от конкретной композиции и размера флакона. (Leybold-Heraeus, Germany). Лиофилизацию выполняют вымораживанием композиции и затем сублимацией льда из замороженного содержимого при температуре, подходящей для первичной сушки. В этих условиях температура продукта находится ниже эвтектической точки или температуры разрушения этой композиции. Обычно температура выдерживания для первичной сушки будет находиться в диапазоне от приблизительно -30 до 25оС (при условии, что этот продукт остается замороженным во время первичной сушки) при подходящем давлении, обычно в диапазоне приблизительно 50-250 мТор. Состав, размер и тип контейнера для образца (например, стеклянного флакона) и объем жидкости будут в основном определять время, необходимое для сушки, которое может быть в диапазоне от нескольких часов до нескольких дней (например, 40-60 часов). Необязательно может также выполняться стадия вторичной сушки в зависимости от желаемого остаточного уровня влажности в этом продукте. Температура, при которой проводят эту вторичную сушку, находится в диапазоне приблизительно 0-40оС в зависимости прежде всего от типа и размера контейнера и типа используемого белка. Например, температура выдерживания на протяжении фазы полного удаления воды лиофилизации может быть приблизительно 15-30оС (например, приблизительно 20оС). Время и давление, требуемые для вторичной сушки, будут такими, которые дают подходящий лиофилизированный остаток в зависимости, например, от температуры и других параметров. Время вторичной сушки диктуется желаемым остаточным уровнем влажности в этом продукте и обычно составляет приблизительно 5 часов (например, 10-15 часов). Давление может быть таким же, какое использовали во время стадии первичной сушки. Условия лиофилизации могут варьироваться в зависимости от конкретной композиции и размера флакона.
2. Восстановление лиофилизированной композиции
Перед введением пациенту лиофилизированную композицию восстанавливают фармацевтически приемлемым разбавителем таким образом, что концентрация белка в этой восстановленной композиции равна по меньшей мере приблизительно 50 мг/мл, например приблизительно 50 мг/мл – приблизительно 400 мг/мл, альтернативно приблизительно 80 мг/мл – приблизительно 300 мг/мл, альтернативно приблизительно 90 мг/мл – приблизительно 150 мг/мл. Такие высокие концентрации белка в восстановленной композици считаются особенно выгодными, когда предполагается подкожная доставка восстановленной композиции. Однако для других способов введения, таких как внутривенное введение, могут быть желательными более низкие концентрации белка в восстановленной композиции (например, приблизительно 5-50 мг/мл или приблизительно 10-40 мг/мл белка в восстановленной композиции). В некоторых вариантах осуществления концентрация белка в восстановленной композиции является значительно более высокой, чем концентрация белка в пре-лиофилизированной композиции. Например, концентрация белка в восстановленной композиции может быть приблизительно в 2-40 раз, альтернативно в 3-10 раз, альтернативно в 3-6 раз (например, по меньшей мере в три раза или по меньшей мере в четыре раза) большей, чем концентрация пре-лиофилизированной композиции.
Восстановление обычно выполняют при температуре приблизительно 25оС для обеспечения полной гидратации, хотя, если желательно, могут быть использованы другие температуры. Время, необходимое для восстановления, будет зависеть, например, от типа разбавителя, количества эксципиента (эксципиентов) и белка. Примеры разбавителей включают в себя стерильную воду, бактериостатическую воду для инъекции (BWFI), раствор с забуференным рН (например, забуференный фосфатом солевой раствор), стерильный солевой раствор, раствор Рингера или раствор декстрозы. Разбавитель необязательно содержит консервант. Примеры консервантов были описаны выше, причем предпочтительными консервантами являются ароматические спирты, такие как бензиловый спирт или фенолоспирт. Количество используемого консерванта определяют оценкой различных концентраций консерванта на совместимость с белком и испытанием эффективности консерванта. Например, если консервант является ароматическим спиртом (таким как бензиловый спирт), он может присутствовать в количестве приблизительно 0,1-2,0% и предпочтительно приблизительно 0,5-1,5%, но наиболее предпочтительно приблизительно 1,0-1,2%.
Предпочтительно восстановленная композиция имеет менее 6000 частиц на флакон, которые имеют размер  10 мкм. 10 мкм.
D. Жидкие композиции
Терапевтические композиции получают для хранения смешиванием активного ингредиента, имеющего желаемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington’s Pharmaceutical Sciences 18th edition, Mack Publishing Co., Easton, Pa. 18042 [1990]). Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными в отношении реципиентов в используемых дозах и концентрациях и включают в себя буферы, антиоксиданты, в том числе аскорбиновую кислоту, метионин, витамин Е, метабисульфит натрия; консерванты, агенты изотоничности, стабилизаторы, комплексы металлов (например, комплексы Zn-белок); хелатообразующие агенты, такие как ЭДТА, и/или неионогенные поверхностно-активные вещества.
Когда терапевтический агент является фрагментом антитела, предпочтительным является наименьший ингибиторный фрагмент, который специфически связывается со связывающим доменом белка-мишени. Например, на основе последовательностей вариабельных районов антител могут быть сконструированы фрагменты антител или даже пептидные молекулы, которые сохраняют способность связывания с последовательностью белка-мишени. Такие пептиды могут быть синтезированы химически и/или получены технологией рекомбинантных ДНК (см., например, Marasco et al., Proc. Natl. Acad. Sci. USA, 90: 7889-7893 [1993]).
Для контроля рН в диапазоне, который оптимизирует терапевтическую эффективность, используют буферы, особенно в том случае, если стабильность зависит от рН. Буферы присутствуют предпочтительно в концентрациях в диапазоне от приблизительно 50 мМ до приблизительно 250 мМ. Подходящие буферящие агенты для использования с данным изобретением включают в себя как органические, так и неорганические кислоты и их соли. Например, цитрат, фосфат, сукцинат, тартрат, фумарат, глюконат, оксалат, лактат, ацетат. Дополнительно буферы могут состоять из солей гистидина и триметиламина, таких как Трис.
Для замедления роста микробов добавляют консерванты, и они обычно присутствуют в диапазоне 0,2%-1,0% (масса/объем). Подходящие консерванты для использования по данному изобретению включают в себя октадецилдиметилбензиламмонийхлорид; гексаметонийхлорид; бензалконийгалогениды (например, хлорид, бромид, иодид), бензэтонийхлорид; тимерозал, фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол, 3-пентанол и м-крезол.
Агенты тоничности, иногда известные как “стабилизаторы”, присутствуют для коррекции или поддержания тоничности жидкой композиции. При применении с большими заряженными биомолекулами, такими как белки и антитела, их часто называют “стабилизаторами”, так как они могут взаимодействовать с заряженными группами боковых цепей аминокислот, ослабляя тем самым потенциал в отношении меж- и внутриклеточных взаимодействий. Агенты тоничности могут присутствовать в любом количестве между 0,1 и 25 мас.%, предпочтительно 1-5 мас.% с учетом относительных количеств других ингредиентов. Агенты тоничности включают в себя многоатомные сахароспирты, предпочтительно трехатомные или более высокоатомные сахароспирты, такие как глицерин, эритрит, арабит, ксилит, сорбит и маннит.
Дополнительные эксципиенты включают в себя агенты, которые могут служить в качестве одного или нескольких их следующих компонентов: (1) наполнителей, (2) усилителей растворимости, (3) стабилизаторов и (4) агентов, предотвращающих денатурацию или прикрепление к стенке контейнера. Стабилизаторы могут присутствовать в диапазоне от 0,1 до 10000 частей на массу активного белка или антитела. Типичные стабилизаторы включают в себя: многоатомные сахароспирты (перечисленные выше); аминокислоты, такие как аланин, глицин, глутамин, аспарагин, гистидин, аргинин, лизин, орнитин, лейцин, 2-фенилаланин, глутаминовую кислоту, треонин и т.д.; органические сахара или сахароспирты, такие как сахароза, лактоза, лактит, трегалоза, стахиоза, манноза, сорбоза, ксилоза, рибоза, рибит, миоинозитоза, миоинозит, галактоза, галактит, глицерин, циклит (например, инозит), полиэтиленгликоль; серусодержащие восстанавливающие агенты, такие как мочевина, глутатион, тиоктовая кислота, тиогликолат натрия, тиоглицерин,  -монотиоглицерин и тиосульфат натрия; низкомолекулярные белки, такие как сывороточный альбумин человека, бычий сывороточный альбумин, желатин или другие иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; моносахариды (например, ксилозу, маннозу, фруктозу, глюкозу); дисахариды (например, лактозу, мальтозу, сахарозу); трисахариды, такие как рафиноза; и полисахариды, такие как декстрин или декстран. -монотиоглицерин и тиосульфат натрия; низкомолекулярные белки, такие как сывороточный альбумин человека, бычий сывороточный альбумин, желатин или другие иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; моносахариды (например, ксилозу, маннозу, фруктозу, глюкозу); дисахариды (например, лактозу, мальтозу, сахарозу); трисахариды, такие как рафиноза; и полисахариды, такие как декстрин или декстран.
Неионогенные поверхностно-активные вещества, или детергенты (также известные как “увлажняющие агенты”), присутствуют для усиления солюбилизации терапевтического агента, а также для защиты терапевтического белка против индуцируемой перемешиванием агрегации, что позволяет также композиции подвергаться стрессу касательного поверхностного напряжения без вызывания денатурации активного терапевтического белка или антитела. Неионогенные поверхностно-активные вещества присутствуют в диапазоне приблизительно 0,05 мг/мл – приблизительно 1,0 мг/мл, предпочтительно приблизительно 0,07 мг/мл – приблизительно 0,2 мг/мл.
Подходящие неионогенные поверхностно-активные вещества включают в себя полисорбаты (20, 40, 60, 65, 80 и т.д.), полиоксамеры (184, 188 и т.д.); полиолы Pluronics , Тритон®, простые моноэфиры полиоксиэтиленсорбитана (Твин®-20 Твин®-80 и т.д.), лауромакрогол 400, полиоксил(40)стеарат, полиоксиэтилированное гидрогенизированное касторовое масло 10, 50 и 60, моностеарат глицерина, эфир сахарозы и жирной кислоты, метилцеллюлозу и карбоксиметилцеллюлозу. Анионогенные детергенты, которые могут быть использованы, включают в себя лаурилсульфат натрия, диоктилнатрийсульфосукцинат и диоктилнатрийсульфонат. Катионогенные детергенты включают в себя бензалконийхлорид или бензэтонийхлорид. , Тритон®, простые моноэфиры полиоксиэтиленсорбитана (Твин®-20 Твин®-80 и т.д.), лауромакрогол 400, полиоксил(40)стеарат, полиоксиэтилированное гидрогенизированное касторовое масло 10, 50 и 60, моностеарат глицерина, эфир сахарозы и жирной кислоты, метилцеллюлозу и карбоксиметилцеллюлозу. Анионогенные детергенты, которые могут быть использованы, включают в себя лаурилсульфат натрия, диоктилнатрийсульфосукцинат и диоктилнатрийсульфонат. Катионогенные детергенты включают в себя бензалконийхлорид или бензэтонийхлорид.
Для возможности использования этих композиций для введения in vivo они должны быть стерильными. Композиция может быть получена стерильным фильтрованием через стерильные фильтрующие мембраны. Терапевтические композиции, описанные здесь, обычно помещают в контейнер, имеющий стерильное отверстие для доступа, например мешочек для внутривенного раствора, имеющий пробку, протыкаемую иглой для гиподермальной инъекции.
Способ введения соответствует известным и общепризнанным способам, таким как единственная или множественные инъекции ударной дозы или инфузия, на протяжении продолжительного периода времени подходящим способом, например, инъекция или инфузия подкожным, внутривенным, внутрибрюшинным, внутримышечным, интраартериальным путем, введение в повреждение или внутрь сустава, местное введение, ингаляция или способ поддерживаемого или пролонгированного высвобождения.
Описанная здесь композиция может также содержать более одного активного соединения, если это необходимо для конкретного подлежащего лечению показания, предпочтительно может содержать соединения с дополняющими активностями, которые не действуют неблагоприятным образом друг на друга. Альтернативно или кроме того, эта композиция может содержать цитотоксический агент, цитокин или ингибирующий рост агент. Такие молекулы предпочтительно присутствуют в комбинации в количествах, которые являются эффективными для предполагаемых целей.
Активные ингредиенты могут быть также заключены в микрокапсулах, полученных, например, способами коацервации или межфазной полимеризацией, например в микрокапсулах из гидроксиметилцеллюлозы или желатина и микрокапсулах из поли(метилметакрилата) соответственно, в коллоидальных системах доставки лекарственных средств (например, липосомах, микросферах из альбумина, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие способы описаны в Remington’s Pharmaceutical Sciences 18th edition, выше.
Могут быть получены препараты пролонгированного высвобождения. Подходящие примеры препаратов пролонгированного высвобождения включают в себя полупроницаемые матриксы твердых гидрофобных полимеров, содержащие антитело, причем эти матриксы находятся в виде формованных изделий, например, пленок или микрокапсул. Примеры матриксов пролонгированного высвобождения включают в себя полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и  -этил-L-глутамата, недеградируемый этилен-винилацетат, деградируемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT -этил-L-глутамата, недеградируемый этилен-винилацетат, деградируемые сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота. Микроинкапсулирование рекомбинантных белков для пролонгированного высвобождения было успешно выполнено с гормоном роста человека (rhGH), интерфероном человека (rhIFN-), интерлейкином-2 и MN rpg 120. Johnson et al., Nat. Med. 2: 795-799 (1996); Yasuda et al., Biomed. Ther. 27: 1221-1223 (1993); Hora et al., Bio/Technology 8: 755-758 (1990); Cleland, “Design and Production of Single Immunization Vaccines Using Polylactide Polyglycolide Microsphere Systems,” in Vaccine Design: The Subunit and Adjuvant Approach, Powell and Newman, eds., (Plenum Press: New York, 1995), pp. 439-462; WO 97/03692; WO 96/40072; WO 96/07399 и патент США № 5654010. (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида) и поли-D-(-)-3-гидроксимасляная кислота. Микроинкапсулирование рекомбинантных белков для пролонгированного высвобождения было успешно выполнено с гормоном роста человека (rhGH), интерфероном человека (rhIFN-), интерлейкином-2 и MN rpg 120. Johnson et al., Nat. Med. 2: 795-799 (1996); Yasuda et al., Biomed. Ther. 27: 1221-1223 (1993); Hora et al., Bio/Technology 8: 755-758 (1990); Cleland, “Design and Production of Single Immunization Vaccines Using Polylactide Polyglycolide Microsphere Systems,” in Vaccine Design: The Subunit and Adjuvant Approach, Powell and Newman, eds., (Plenum Press: New York, 1995), pp. 439-462; WO 97/03692; WO 96/40072; WO 96/07399 и патент США № 5654010.
Композиции пролонгированного высвобождения этих белков могут быть разработаны с использованием сополимера полимолочной и гликолевой кислоты (PLGA) вследствие его биосовместимости и широкого диапазона биодеградируемых свойств. Продукты деградации PLGA, молочная и гликолевая кислоты могут быстро выводиться из тела человека. Кроме того, деградируемость этого полимера может быть доведена с месяцев до лет в зависимости от его молекулярной массы и состава. Lewis, “Controlled release of bioactive agents from lactide/glycolide polymer”, in Biodegradable Polymers as Drug Delivery Systems (Marcel Dekker; New York, 1990), M. Chasin and R. Langer (Eds.) pp. 1-41.
В то время как такие полимеры, как этилен-винилацетат и молочная кислота-гликолевая кислота, способны высвобождать молекулы в течение более 100 дней, некоторые гидрогели высвобождают белки в течение более коротких периодов времени. Когда инкапсулированные антитела остаются в теле в течение продолжительного времени, они могут денатурироваться или агрегировать в результате подвергания действию влаги при 37оС, что приводит к потере биологической активности и возможным изменениям в иммуногенности. Могут быть разработаны рациональные стратегии для стабилизации в зависимости от участвующего в этом механизма. Например, если обнаружено, что механизмом агрегации является образование межмолекулярной S-S-связи посредством взаимообмена тиол-дисульфид, стабилизация может быть достигнута модификацией сульфгидрильных остатков, лиофилизацией из кислотного раствора, регуляцией содержания влаги с использованием подходящих добавок и развитием специфических композиций с использованием полимерного матрикса.
Для получения композиций белков или антител, описанных здесь, могут быть также использованы липосомные или протеиноидные композиции. См. патенты США №№ 4925673 и 5013556.
Стабильность описанных здесь белков и антител может быть усилена использованием нетоксичных «водорастворимых солей поливалентных металлов». Примеры включают в себя Са2+, Mg2+, Zn2+, Fe2+, Fe3+, Cu2+, Sn2+, Sn4+, Al2+ и Al3+. Примеры анионов, которые могут образовывать водорастворимые соли с вышеуказанными катионами поливалентных металлов, включают в себя анионы, образованные из неорганических кислот и/или органических кислот. Такие водорастворимые соли имеют растворимость в воде (при 20оС) по меньшей мере приблизительно 20 мг/мл, альтернативно по меньшей мере приблизительно 100 мг/мл, альтернативно по меньшей мере приблизительно 200 мг/мл.
Подходящие неорганические кислоты, которые могут быть использованы для образования «водорастворимых солей поливалентных металлов», включают в себя хлористоводородную, уксусную, серную, азотную, тиоциановую и фосфорную кислоту. Подходящие органические кислоты, которые могут быть использованы, включают в себя алифатические карбоновые кислоты и ароматические кислоты. Алифатические кислоты в пределах этого определения могут быть определены как насыщенные или ненасыщенные С2-9-карбоновые кислоты (например, алифатические моно-, ди- и трикарбоновые кислоты). Например, примеры монокарбоновых кислот в пределах этого определения включают в себя насыщенные С2-9-монокарбоновые кислоты: уксусную, пропионовую, масляную, валериановую, капроновую, энантовую, каприловую, пеларгоновую и каприоновую кислоты и ненасыщенные С2-9-монокарбоновые кислоты: акриловую, пропиоловую, метакриловую, кротоновую и изокротоновую кислоты. Примеры дикарбоновых кислот включают в себя насыщенные С2-9-дикарбоновые кислоты: малоновую, янтарную, глутаровую, адипиновую и пимелиновую кислоты, тогда как ненасыщенные С2-9-дикарбоновые кислоты включают в себя малеиновую, фумаровую, цитраконовую и мезаконовую кислоты. Примеры трикарбоновых кислот включают в себя насыщенные С2-9-трикарбоновые кислоты: трикарбаллиловую и 1,2,3-бутантрикарбоновую кислоту. Кроме того, карбоновые кислоты этого определения могут также содержать одну или две гидроксильные группы для образования гидроксикарбоновых кислот. Примеры гидроксикарбоновых кислот включают в себя гликолевую, молочную, глицериновую, тартроновую, яблочную, винную и лимонную кислоты. Ароматические кислоты в пределах этого определения включают в себя бензойную и салициловую кислоту.
Обычно используемые водорастворимые соли поливалентных металлов, которые могут быть использованы для усиления стабилизации инкапсулированных полипептидов данного изобретения, включают в себя, например,: (1) соли металлов неорганических кислот, выбранные из галогенидов (например, хлорида цинка, хлорида кальция), сульфатов, нитратов, фосфатов и тиоцианатов; (2) соли металлов и алифатических карбоновых кислот (например, ацетат кальция, ацетат цинка, пропионат кальция, гликолат цинка, лактат кальция, лактат цинка и тартрат цинка); и (3) соли металлов ароматических карбоновых кислот, выбранные из бензоатов (например, бензоата цинка) и салицилатов.
Е. Способы лечения:
Для профилактики или лечения заболевания подходящая доза активного агента будет зависеть от типа заболевания, на которое направлено лечение, определенного выше, тяжести и протекания этого заболевания, от того, вводится ли этот агент для превентивных или терапевтических целей, от предыдущей терапии, клинической истории пациента и реакции на этот агент и от мнения лечащего врача. Этот агент вводят подходящим образом пациенту единовременно или на протяжении ряда введений.
Предпочтительным способом введения является лечение IgE-опосредованных нарушений. IgE-опосредованные нарушения включают в себя атопические нарушения, которые характеризуются наследственным предрасположением к иммунологической реакции на многие обычные природно встречающиеся вдыхаемые или проглатываемые антигены и непрерывным продуцированием антител IgE. Конкретные атопические нарушения включают в себя аллергическую астму, аллергический ринит, атопический дерматит и аллергическую гастроэнтеропатию.
Атопические пациенты часто имеют множественные аллергии, что означает, что они имеют IgE-антитела ко многим аллергенам окружающей среды, в том числе пыльце, грибам (например, плесневым грибам), остаткам животных и насекомых и некоторым пищевым продуктам, и имеют соответствующие симптомы.
Однако нарушения, связанные с повышенными уровнями IgE, не ограничиваются нарушениями с наследственной (атопической) этиологией. Другие нарушения, связанные с повышенными уровнями IgE, которые, по-видимому, являются опосредованными IgE и могут лечиться композициями данного изобретения, включают в себя гиперчувствительность (аллергию) (например, анафилаксическую гиперчувствительность), экзему, крапивницу, аллергический бронхолегочный аспергиллез, паразитарные заболевания, гипер-IgE-синдром, атаксию-телеангиэктазию, синдром Вискотта-Олдрича, алимфоплазию вилочковой железы, IgE-миелому и реакцию трансплантат против хозяина.
Аллергический ринит, также известный как аллергический риноконъюнктивит, является наиболее частым проявлением атопической реакции на вдыхаемые аллергены, тяжесть и продолжительность которой часто коррелирует с интенсивностью и продолжительностью действия аллергена. Он представляет собой хроническое заболевание, которое может появляться впервые в любом возрасте, но обычно возникает в детстве и подростковом возрасте. Типичный приступ состоит из обильной водянистой ринореи, пароксизмального чихания, заложенности носа и зуда в носу и небе. Постназальное стекание слизи также вызывает ангину, першение в горле и кашель. Могут быть также симптомы аллергического блефароконъюнктивита с сильным зудом конъюнктивы и глазных век, покраснением, слезотечением и светофобией. Тяжелые приступы часто сопровождаются системным недомоганием, слабостью, усталостью и иногда болезненностью мышц после интенсивных периодов чихания.
Астма, также известная как обратимое обструктивное заболевание дыхательных путей, характеризуется гиперчувствительностью трахеобронхиального дерева к респираторным раздражителям и сужающим бронхи химическим препаратам, вызывающей приступы стерторозного дыхания, одышки, сжимания груди и кашля, которые обратимы самопроизвольно или при лечении. Астма является хроническим заболеванием, охватывающим все дыхательные пути, но она варьируется по тяжести от редких слабых транзиторных приступов до тяжелой, хронической, угрожающей жизни бронхиальной обструкции. Астма и атопия могут сосуществовать, но только приблизительно у половины астматиков проявляется также атопия, и еще более маленький процент пациентов с атопией также страдают от астмы. Однако атопия и астма не являются полностью независимыми потому, что астма встречается более часто среди больных с атопией, нежели чем у индивидуумов, не страдающих атопией, особенно в детстве. Астма исторически была дополнительно подразделена на две подгруппы, экзогенную астму и врожденную (наследственную) астму.
Экзогенная астма, также известная как аллергическая, атопическая или иммунологическая астма, относится к астме у больных, у которых астма развивается в раннем возрасте, обычно в младенчестве или детстве. Другие проявления атопии, в том числе экзема или аллергический ринит, часто сосуществуют. Астматические приступы могут иметь место во время сезонов пыльцы, в присутствии животных или при воздействии домашней пыли, пуховых подушек или других аллергенов. Кожные тесты показывают положительные реакции волдыря и гиперемии на вызывающие приступ аллергены. Интересно, что общие концентрации IgE в сыворотке часто являются повышенными, но иногда являются нормальными.
Врожденная астма, также известная как неаллергическая или идиопатическая астма, впервые обычно появляется у взрослых после или во время респираторной инфекции. Симтомы включают в себя хроническую и рецидивирующую бронхиальную обструкцию, не связанную с сезонами пыльцы или действием других аллергенов. Кожные тесты являются отрицательными в отношении обычных атопических аллергенов, концентрация IgE в сыворотке является нормальной. Дополнительные симптомы включают в себя кровь в мокроте и эозинофилию. Другие схемы классификации астмы на подгруппы, такие как аспирин-чувствительная, вызываемая физической нагрузкой, инфекционная и психологическая, определяют лишь наружные триггерные факторы, которые влияют на некоторых пациентов больше, чем другие факторы.
Наконец, важно отметить, что, хотя некоторые классификации исторически связывали только аллергическую астму с недостаточностью IgE, в настоящее время имеются значимые статистически значимые данные, указывающие на корреляцию между IgE и астмой (как аллергической, так и неаллергической). Chapter 27, “The Atopic Diseases”, A.I. Terr in Medical Immunology, 9th Ed., Simon and Schuster, Stites et al., ed. (1997). В результате, термин «IgE-опосредованные нарушения» для целей данной заявки включает в себя как аллергическую, так и неаллергическую астму.
Физические признаки приступа астмы включают в себя тахипноэ, слышимую одышку и использование вспомогательных мышц дыхания. Быстрый пульс и повышенное кровяное давление также обычно присутствуют, как и повышенные уровни эозинофилов в периферической крови и назальных выделениях. Легочные функции обнаруживают уменьшение скоростей тока и 1-секундного объема форсированного выдоха (FEV1). Общая жизненная емкость легких (ЖЕЛ) и функциональная остаточная емкость легких (ФОЕ) являются обычно нормальными или слегка увеличенными, но могут быть уменьшенными сильным бронхоспазмом.
Патология астмы может быть разделена на реакции ранней фазы и поздней фазы. Ранняя фаза харктеризуется сокращением гладких мышц, отеком и гиперсекрецией, тогда как реакции поздней фазы характеризуются клеточным воспалением. Астма может быть индуцирована различными неспецифическими триггерами, в том числе инфекциями (например, вирусными респираторными инфекциями), физиологическими факторами (например, физической нагрузкой, гипервентиляцией, глубоким дыханием, психологическими факторами), атмосферными факторами (например, диоксидом серы, аммиаком, холодным воздухом, озоном, парами дистиллированной воды), проглатываемыми лекарственными средствами (например, пропанололом, аспирином, нестероидными противовоспалительными средствами), экспериментальными ингалируемыми веществами (например, гипертоническими растворами, лимонной кислотой, гистамином, метахолином, простагландином F2 ) и производственными вдыхаемыми веществами (например, изоцианатами). Разнообразные дополнительные производственные или находящиеся в окружающей среде аллергены, которые вызывают аллергическую астму, могут включать в себя продукты животных, порошки насекомых, морских животных, растительные продукты, фрукты, семена, листья и пыльцу, органические краски и чернила, микробные агенты, ферменты, терапевтические агенты, стерилизующие агенты, неорганические и органические химикалии. ) и производственными вдыхаемыми веществами (например, изоцианатами). Разнообразные дополнительные производственные или находящиеся в окружающей среде аллергены, которые вызывают аллергическую астму, могут включать в себя продукты животных, порошки насекомых, морских животных, растительные продукты, фрукты, семена, листья и пыльцу, органические краски и чернила, микробные агенты, ферменты, терапевтические агенты, стерилизующие агенты, неорганические и органические химикалии.
Атопический дерматит, также известный как экзема, нейродерматит, атопическая экзема или пруриго (почесуха) Бесниера, является обычным хроническим кожным нарушением, специфическим для субпопуляции пациентов с семейными и иммунологическими признаками атопии. Существенным признаком является зудящая кожная воспалительная реакция, которая индуцирует характерную симметрично распределенную кожную сыпь с предрасположенностью в отношении определенных участков. Имеется также часто сверхпродукция IgE В-лимфоцитами. Хотя атопический дерматит классифицируется как кожная форма атопии, поскольку он ассоциирован с аллергическим ринитом и астмой и высокими уровнями IgE, однако тяжесть дерматита не всегда коррелирует с подверганием действию аллергенам при кожном тестировании, и десенсибилизация (в отличие от аллергических заболеваний) не является эффективным лечением. Хотя высокий уровень IgE в сыворотке согласуется с диагнозом аллергической астмы, нормальные уровни не исключает его. Возникновение заболевания может происходить в любом возрасте, и повреждения начинаются резко с эритематозной отечной папулы или бляшки с шелушением. Зуд приводит к выделению влаги и образованию струпьев, затем к хронической лихенификации. На клеточном уровне острое повреждение является отечным и кожа инфильтрирована мононуклеарными клетками, CD4-лимфоцитами. Нейтрофилы, эозинофилы, плазматические клетки и базофилы являются редкими, но присутствуют дегранулированные тучные клетки. Хронические повреждения обнаруживают эпидермальную гиперплазию, гиперкератоз и паракератоз и дерма инфильтрирована мононуклеарными клетками, клетками Лангерганса и тучными клетками. Могут быть также очаговые зоны фиброза, в том числе вовлечение периневрия малых нервов.
Аллергическая гастроэнтеропатия, также известная как эозинофильная гастроэнтеропатия, является необычной атопической манифестацией, в которой многочисленные пищевые IgE-чувствительности связаны с локальной реакцией слизистой оболочки желудочно-кишечного тракта. Она является редкой у взрослых людей, но более обычной, но преходящей, у младенцев. Это состояние возникает, когда принятые внутрь пищевые аллергены реагируют с локальными IgE-антителами в слизистой оболочке тощей кишки и высвобождают медиаторы тучных клеток, что приводит к желудочно-кишечным симптомам после еды. Продолжающееся экспонирование этим аллергенам вызывало хроническое воспаление, приводящее к потере желудочно-кишечных белков и гипопротеинемическому отеку. Потеря крови через воспаленную кишечную слизистую оболочку может быть достаточно существенной, чтобы вызвать железодефицитную анемию. Эта аллергическая реакция встречается локально в слизистой оболочке верхнего желудочно-кишечного тракта после экспонирования аллергену, но прекращается при избегании этого аллергена.
Анафилаксия и крапивница являются явно IgE-опосредованными, но они не имеют генетических детерминант и не имеют предрасположенности в отношении атопических индивидуумов. Анафилаксия является острой генерализованной аллергической реакцией с одновременным вовлечением нескольких систем органов, обычно сердечно-сосудистой, респираторной, кожной и желудочно-кишечной. Эта реакция является иммунологически опосредованной, и она имеет место при подвергании действию аллергена, к которому данный индивидуум был ранее сенсибилизирован. Крапивница и гигантская крапивница (отек Квинке) относятся к физическому опуханию, эритеме и зуду, возникающим вследствие стимулируемого гистамином рецептора в поверхностных кожных кровеносных сосудах, и являются отличительным критерием кожного признака системной анафилаксии. Системная анафилаксия является случаем IgE-опосредованной реакции одновременно во множественных органах, вызываемая лекарственным средством, ядом насекомого или пищевым продуктом. Она вызывается неожиданно индуцируемым аллергеном, тучными клетками, нагруженными IgE, приводя к глубокому и угрожающему жизни изменению в функционировании различных жизненно важных органов. Коллапс сосудов, острая обструкция дыхательных путей, кожная вазодилатация и отек и спазм желудочно-кишечных и мочеполовых мышц происходит почти одновременно, хотя не всегда до одной и той же степени.
Патология анафилаксии включает в себя гигантскую крапивницу и чрезмерно расширенные легкие, со слизью, закупоривающей дыхательные пути, и очаговым ателектазом. На клеточном уровне легкие кажутся такими, какие наблюдаются во время острого приступа астмы, с гиперсекрецией бронхиальных подслизистых желез, отеком слизитой и подслизистой оболочки, перибронхиальным сосудистым застоем и эозинофилией в бронхиальных стенках. Могут присутствовать отек и кровотечение легких. Могут также присутствовать спазм бронхиальных мышц, чрезмерное растяжение легких и даже разрыв альвеол. Важные признаки анафилаксии человека включают в себя отек, застой сосудов и эозинофилию в собственном слое слизистой оболочки глотки, трахеи, надгортанника и гортанной части глотки.
Подвергание действию аллергена может происходить через проглатывание, инъекцию, ингаляцию или контакт с кожей или слизистой оболочкой. Эта реакция начинается в пределах секунд или минут после подвергания действию аллергена. Может быть первоначальный испуг или чувство надвигающейся смерти с последующими быстро наступающими симптомами в одной или нескольких системах органов-мишеней: сердечно-сосудистой, респираторной, кожной и желудочно-кишечной.
Аллергены, ответственные за анафилаксию, отличаются от аллергенов, обычно ассоциированных с аллергией. Обычными источниками являются пищевые продукты, яды насекомых или латекс. Пищевые аллергены включают в себя аллергены, обнаруживаемые в ракообразных, моллюсках (например, омаре, креветках, крабах), рыбе, бобовых (например, земляном орехе (арахисе), бобах, солодке), семенах (например, кунжута, хлопчатника, тмина, горчицы, семенах льна, подсолнечника), орехах, ягодах, яичных белках, гречихе и молоке. Аллергены лекарственных средств включают в себя аллергены, обнаруженные в гетерологичных белках и полипептидах, полисахаридах и содержащих гаптены лекарственных средствах. Аллергены насекомых включают в себя перепончатокрылых (Hymenoptera) насекомых, в том числе пчелу медоносную, настоящих (складчатокрылых) ос, крупную осу, настоящую осу и муравья Рихтера.
В то время как эпинефрин является обычным способом лечения для анафилаксии, для менее тяжелой реакции крапивницы или ангиоэдемы обычно прописывают антигистамин или другие блокаторы гистамина.
F. Комбинаторные терапии
Способ данного изобретения может комбинироваться с известными способами лечения для IgE-опосредованного нарушения либо в виде комбинированных или дополнительных стадий лечения, либо в виде дополнительных компонентов терапевтической композиции.
Например, антигистаминные средства, в частности неседативные антигистаминные средства, могут быть введены предварительно, перед введением или одновременно с введением анти-IgE-антител данного изобретения. Подходящие антигистамины включают в себя алкиламин (например, хлорфенирамин), этаноламин (например, дифенгидрамин) и фенотиазин (например, прометазин). Хотя многие антигистамины противодействуют фармакологическим действиям гистамина блокированием его рецепторных сайтов на эффекторных клетках, другие общепринятые антигистаминные средства действуют блокированием высвобождения гистамина из тучных клеток, которые были сенсибилизированы и обеспечены аллерген-специфическим IgE (например, кромолин-натрий). Примеры антигистаминов включают в себя астемизол, малеат азатадина, малеат брофенирамина, малеат карбиноксамина, гидрохлорид цетиризина, фумарат клемастина, гидрохлорид ципрогептадина, малеат дексбромфенирамина, малеат дексхлорфенирамина, дименгидринат, гидрохлорид дифенгидрамина, сукцинат доксиламина, гидрохлорид фексофендадина, гидрохлорид терфенадина, гидрохлорид гидроксизина, лоратидин, гидрохлорид меклизина, цитрат трипеланнамина, гидрохлорид трепеленнамина, гидрохлорид трипролидина.
Конкретные симптомы IgE-опосредованных нарушений (например, реакции ранней фазы) могут быть ослаблены симпатомиметиками или лекарственными средствами, имеющими бронходилататорное действие. Эпинефрин является альфа- и бета-адренергетиком широкого действия, часто вводимым подкожно в дозе 0,2-0,5 мл водного раствора 1:100. Более долгосрочно действующая форма эпинефрина (т.е. тербуталин) в суспензии 1:200 также используется, когда желательно более продолжительное действие. Подходящие дополнительные бета-адренергетики включают в себя албутерол, пирбутерол, метапротеренол, салметерол, изоэтарин и формотерол для назального введения (например, ручным распылителем, дыхательным устройством с периодическим положительным давлением или находящимися под давлением ингаляторами с отмеренными дозами) или для перорального введения.
Бронходилатация может быть достигнута посредством введения ксантинов, в частности при их введении в комбинации с вышеуказанными симпатомиметическими лекарственными средствами. Примеры ксантинов включают в себя аминофиллин (i.v. 250-500 мг) и теофиллин (перорально, концентрация в сыворотке 10-20 мкг/мл).
Другие симптомы различных IgE-опосредованных нарушений (например, реакции поздней фазы) могут быть ослаблены лечением глюкокортикоидами или другими лекарственными средствами, имеющими противовоспалительные действия. Преднизон (30-60 мг в день) вводят системно для тяжелых приступов, тогда как для продолжительной поддерживающей терапии вводят дипропионат беклометазона, ацетонид триамцинолона и флунизолид в аэрозольной форме. Дополнительные кортикостероиды, которые имеют противовоспалительные эффекты, включают в себя: бетаметазон, будесонид, дексаметазон, ацетат флудрокортизона, флунизолид, пропионат флутиказона, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон.
Нестероидные противовоспалительные лекарственные средства, которые могут быть использованы в комбинации с терапевтическими способами данного изобретения, включают в себя ацетаминофен, аспирин, бромфенак-натрий, диклофенак-натрий, дифлунизал, этодолак, фенопрофен-натрий, флурбипрофен, ибупрофен, индометацин, кетопрофен, меклофенамат-натрий, мефенамовую кислоту, набуметон, напроксен, напроксен-натрий, оксифенбутазон, фенилбутазон, пироксикам, сулиндак, толметин-натрий.
Дополнительно максимальная терапевтическая польза может быть также достигнута введением противоотечных средств (например, фенилэфрина, кодеина или гидрокодона) или анальгезирующих средств (например, ацетаминофена, аспирина).
Десенсибилизация аллергена является формой лечения, в которой аллергены инъецируют в пациента с целью уменьшения или элиминации аллергической реакции. Она известна также как аллергенная терапия, гипосенсибилизация или терапия с инъецированием аллергена. Ее часто используют в комбинации с другими способами лечения аллергии, но не в качестве первичного лечения. Она успешно применялась в тех случаях, когда было невозможно избежать действия аллергена. Типичная десенсибилизация аллергена включает в себя подкожную инъекцию стерильного аллергена в увеличивающихся дозах один раз или два раза в неделю, пока не будет достигнута доза, которая дает временную небольшую локальную зону воспаления в месте инъекции. Затем эта доза предоставляется по поддерживающей схеме один раз каждые 2-4 недели. Аллергическую десенсибилизацию наиболее часто используют в лечении аллергической астмы и аллергического рининта, хотя она была успешной и в лечении анафилаксии. Десенсибилизацию использовали также успешно с использованием адъювантов, таких как неполный адъювант Фрейнда, который является эмульсией водного антигена в минеральном масле. Это физиологическое действие создает нерастворимое жидкое депо, из которого постепенно высвобождаются капельки аллергена. Другой формой десенсибилизации аллергена является полимеризация мономерных аллергенов с глутаровым альдегидом для создания молекулы с относительно низкой аллергенностью (т.е. вызывающей аллергическую реакцию), при сохранении эффективной степени иммуногенности).
G. Фармацевтические дозы
Дозы и желаемая концентрация лекарственного средства в фармацевтической композиции данного изобретения могут изменяться в зависимости от конкретного предполагаемого использования. Определение подходящей дозы или способа введения находится в пределах знаний обычного специалиста. Эксперименты на животных обеспечивают надежную рекомендацию для определения эффективных доз для терапии человека. Межвидовое масштабирование эффективных доз может выполняться в соответствии с принципами, установленными Mordenti, J. and Chappell, W. “The Use of Interspecies Scaling in Toxicokinetics,” In Toxicokinetics and New Drug Development, Yacobi et al., Eds, Pergamon Press, New York 1989, pp. 42-46.
При использовании введения in vivo описанных здесь полипептидов или антител нормальные дозовые количества могут варьироваться от приблизительно 10 нг/кг до приблизительно 100 мг/кг массы тела млекопитающего или большего количества на день, предпочтительно приблизительно 1 мг/кг/день-10 мг/кг/день в зависимости от способа введения. Руководство в отношении конкретных доз и способов доставки обеспечено в литературе; см., например, патенты США №№ 4657760; 5206344 или 5225212. В пределах объема данного изобретения находится то, что различные композиции будут эффективными для различных способов лечения и различных нарушений и что введение, предназначенное для лечения конкретных органа или ткани, может потребовать доставки способом, отличающимся от способа для других органа или ткани. Кроме того, дозы могут вводиться посредством одного введения или нескольких отдельных введений или непрерывной инфузией. Для повторяемых введений на протяжении нескольких дней или более длительного периода времени в зависимости от состояния лечение поддерживается до тех пор, пока не происходит желаемая супрессия симптомов заболевания. Однако могут быть применимыми и другие схемы введения доз. Ход этой терапии можно легко подвергнуть мониторингу с использованием общепринятых способов и анализов.
Н. Введение композиции
Композиции данного изобретения, в том числе, но не только восстановленные композиции, вводят животному, нуждающемуся в лечении этим белком, предпочтительно человеку, в соответствии с известными способами, такими как внутривенное введение в виде ударной дозы или непрерывной инфузии на протяжении некоторого периода времени, внутримышечным, внутрибрюшинным, интрацереброспинальным, подкожным, внутрисуставным, интрасиновиальным, подоболочечным, пероральным, местным или ингаляционным способом.
В предпочтительных вариантах осуществления эти композиции вводят млекопитающему подкожным (т.е. под кожу) введением. Для таких целей эта композиция может инъецироваться с использованием шприца. Однако другие устройства для введения этой композиции являются доступными, такие как инъекционные устройства (например, устройства Inject-ease и Genject и Genject ); ручки для инъекции (такие как GenPen ); ручки для инъекции (такие как GenPen ); автоинъекторные устройства, безыгольные устройства (например, MediJector ); автоинъекторные устройства, безыгольные устройства (например, MediJector и BioJector и BioJector ) и подкожные системы доставки в виде пластырей. ) и подкожные системы доставки в виде пластырей.
В конкретном варианте осуществления данное изобретение относится к наборам для элемента для введения отдельных доз. Такие наборы содержат контейнер водной композиции терапевтического белка или антитела, включающий в себя либо однокамерные, либо многокамерные предварительно наполненные шприцы. Примеры заранее наполненных шприцов доступны из Vetter GmbH, Ravensburg, Germany.
Подходящая доза («терапевтически эффективное количество») этого белка будет зависеть, например, от подлежащего лечению состояния, тяжести и протекания этого состояния, от того, вводят ли этот белок для превентивных или терапевтических целей, предыдущей терапии и мнения лечащего врача. Этот белок подходящим способом вводят пациенту единовременно или на протяжении ряда введений, и он может вводиться пациенту в любое время после установления диагноза. Этот белок вводят в виде единственной терапии или вместе с другими лекарственными средствами или способами терапии, применимыми в лечении рассматриваемого состояния.
Когда выбранным белком является антитело, начальной кандидатной дозой является доза приблизительно 0,1-20 мг/кг для введения пациенту, например, посредством одного или нескольких введений. Однако могут быть использованы и другие схемы введения доз. Ход этой терапии легко подвергают мониторингу общепринятыми способами.
Применения для анти-IgE-композиции (например, rhuMAbE-25, rhuMAbE-26, Hu-901) включают в себя лечение или профилактику IgE-опосредованных аллергических заболеваний, паразитарных инфекций, например интерстициального цистита и астмы. В зависимости от интересующего заболевания или нарушения, подлежащего лечению, терапевтически эффективное количество (например, приблизительно 1-15 мг/кг) анти-IgE-антитела вводят пациенту.
I. Изделия
В еще одном варианте осуществления изобретение относится к изделию, которое содержит эту композицию и предпочтительно содержит инстуркцию для его применения. Это изделие содержит контейнер. Подходящие контейнеры включают в себя, например, сосуды, флаконы (например, двухкамерные флаконы), шприцы (например, однокамерные или двухкамерные шприцы) и тест-пробирки. Этот контейнер может быть получен из различных материалов, таких как стекло или пластик. Контейнер содержит композицию и имеет этикетку или прилагаемую к нему аннотацию с указанием восстановления и/или использования композиции. Этикетка дополнительно указывает, что данная композиция применима или предназначена для подкожного введения. Котейнер, содержащий эту композицию, может быть флаконом многоразоваого использования, который позволяет выполнять повторные введения (например, из 2-6 введений) восстановленной композиции. Изделие может дополнительно содержать второй контейнер, содержащий подходящий разбавитель (например, BWFI). При смешивании разбавителя и лиофилизированной композиции конечная концентрация белка в восстановленной композиции будет обычно по меньшей мере 50 мг/мл. Изделие может дополнительно включать в себя другие материалы, желаемые с коммерческой точки зрения и точки зрения пользователя, в том числе другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши упаковки с инструкциями для применения.
Изобретение будет более понятно со ссылкой на нижеследующие примеры. Однако примеры не должны рассматриваться как ограничивающие объем данного изобретения. Все ссылки в описании включены конкретно в качестве ссылки.
В еще одном варианте осуществления изобретение относится к изделию, содержащему описанные здесь композиции, для введения в устройство для самостоятельной инъекции. Шприц для самоинъекции может быть описан как устройство для инъекций, которое при приведении в действие будет доставлять его содержимое без дополнительного действия пациента или вводящего композицию индивидуума. Они особенно пригодны для самостоятельного введения терапевтических композиций, когда скорость доставки должна быть константной и время доставки является большей, чем нескольких моментов.
ПРИМЕР 1
Получение композиции анти-IgE-rhuMAbE25 (“E25”)
Композиции моноклонального анти-IgE-rhuMAbE25 получали из всей остаточной партии К9094А Е25 (40 мг/мл rhuMAb Е25, 85 мМ трегалоза, 5 мМ гистидин, рН 6, 0,01% Твин 20) или Q-пула rhuMAbE25 (5 мг/мл rhuMAb E25, 25 мМ Трис, 200 мМ NaCl).
Водные растворы rhuMAbE25 готовили диализом в различные буферы (20 мМ His-HCl и 200 мМ Arg-HCl, рН 6,0) при 2-8оС с использованием диализной кассеты Slide-A-Lyzer (Pierce). Затем образцы переносили в резервуар для проб центрифужных микроконцентраторов Centricon-30 (Amicon). Белки концентрировали вращением концентратора Centricon-30 при 4000-5000 g, пока не достигалась желаемая концентрация белка.
Затем образцы концентрировали до 150 мг/мл rhuMAb Е25 с использованием ультрафильтрации. К каждому препарату добавляли Твин 20 до конечной концентрации 0,02%. Все композиции фильтровали, асептически помещали их во флаконы 3 сс Forma Vitrum и закрывали пробками 13-мМ Diakyo в помещении Class 100.
ПРИМЕР 2
Способ и материалы
Исследования стабильности: Все композиции помещали в объеме 1 мл во флаконы 3 сс Forma Vitrum и закрывали пробками 13-мМ Diakyo в стерильном помещении Class 100. Флаконы помещали при -70, 2-8, 15, 30 и 40оС в светонепроницаемые контейнеры.
Исследования встряхивания: Аликвоты каждой композиции помещали в стеклянные флаконы. Флаконы встряхивали горизонтально на настольном шейкере Glass-Col Bench Top при комнатной температуре. Этот шейкер устанавливали на 70 с длиной плеча 30 см (максимально). После встряхивания образцы обследовали и анализировали в соответствии со следующим протоколом.
Исследование замораживания-оттаивания: Образцы Е25 подвергали трем циклам замораживания-оттаивания. Каждый цикл состоял из замораживания при -70оС и последующего оттаивания при комнатной температуре в течение приблизительно одного часа. После каждого цикла образцы обследовали визуально с использованием светлого бокса для оценки окраски и прозрачности жидкости. Мутность и растворимые агрегаты измеряли согласно описанному ниже протоколу.
Аналитические способы: Образцы на стабильность анализировали способами, описанными в таблице 1.
Таблица 1
Аналитические способы |
| Анализ |
Цель |
| Цвет, прозрачность, вида |
Визуальное обследование жидких композиций |
| Гель-фильтрационная хроматография (SEC)b |
Измеряет % мономера, растворимых агрегатов и низкомолекулярных компонентов |
| Гидрофобная хроматография (HIC)c |
Измеряет уровень изомеризации Asp-32 и свободного тиола |
| UV Spec Scan (Gravimetric)f |
Измеряет концентрацию белка |
| Мутность (среднее OD 340-360 нм)d |
Измеряет растворимые и нерастворимые агрегаты |
| Активностьс |
Определяет активность связывания анти-IgE |
аудовлетворительно для цвета, вида и прозрачности:
Цвет, вид и прозрачность образцы оценивали визуально против белого и черного фона обследования и сравнивали с равным объемом отрицательного контроля. Образцы должны быть тщательно перемешаны для гарантии гомогенного смешивания, но не настолько сильно, чтобы образовались воздушные пузырьки.
bГель-фильтрационная хроматография:
Использовали колонку TSK SUPER SW3000 (4,6×300 мм) в хроматографической системе НР 1100. На эту колонку наносили 20 мкг белка и колонку элюировали 0,1М фосфатным буфером, рН 6,8. Пробу измеряли при 280 нм при помощи УФ-детектора.
сГидрофобная хроматография (HIC):
HIC-эксперименты проводили с использованием колонки TSK Phenyl-5PW (7,5×75 мм) (TosoHaas) в хроматографической системе НР 1100. На эту колонку наносили 28 мкг расщепленных папаином Fab-фрагментов и элюировали градиентом концентрации сульфата аммония в 20 мМ Трис-буфере от 2М до 0М. Пики наблюдали при 210 нм при помощи УФ-детектора.
dМутность:
Мутность проб определяли в кювете с длиной пути 1 см с использованием спектрофотометра НР. Мутность рассчитывали в виде средней оптической плотности из 340-360 нм.
еАктивность моноклонального анти-IgE-антитела определяли с использованием ингибиторного анализа связывания рецептора. Образцы разбавляли таким образом, чтобы они попадали в диапазон стандартной кривой от 100 и 1,56 мкг/мл, в разбавителе этого анализа, содержащем фосфатный буфер, 0,5% БСА, 0,05% полисорбат 20, 0,01% Тимерозол. Микротитрационный планшет покрывали IgE-рецептором, затем инкубировали с комплексом IgE-биотин и разводили пробу анти-IgE-антител. Количество комплекса IgE-биотин, связанного с рецептором, которое коррелировало с активностью моноклонального анти-IgE-антитела, измеряли с использованием комплекса стрептавидин-HRP. Эти данные анализировали с использованием программы подгонки логистических кривых из 4 параметров.
fКонцентрацию антитела получали на спектрофотометре с массивом диодов Hewlett Packard 8453 с использованием кварцевой кюветы с длиной пути света 1 см. Концентрацию рассчитывали с использованием коэффициента поглощения 1,5 см-1 (мг/мл)-1.
| Суммирование для жидких композиций |
| Композиции |
Диапазоны белков |
Буфер/диапазоны |
Эксципиент/диапазоны |
| 80 мг/мл Е25 |
40-150 мг/мл |
Диапазоны
His-HCl или
His-ацетата: 10 мМ-100 мМ |
Диапазоны сахаров трегалозы или сахарозы: 20 мМ-350 мМ
Полисорбата: 0,01%-0,1% |
| 50 мМ гистидин-HCl |
|
| 150 мМ трегалоза |
|
| 0,05 Полисорбат 20 |
|
|
| рН 6,0 |
|
|
|
| 150 мг/мл Е25 |
40-260 мг/мл |
Диапазоны His-HCl или His-ацетата:
10 мМ-100 мМ |
Диапазоны
Arg-HCl: 50 мМ-200 мМ
Полисорбата: 0,01%-0,1% |
| 20 мМ гистидин-HCl |
|
| 200 мМ Arg-HCl |
| 0,02 Полисорбат 20 |
|
| рН 6,0 |
|
|
|
| Результаты стабильности для 150 мг/мл Е25 в композиции с гистидином и Arg-HCl |
| Темпе-ратура (оС) |
Время (месяцы) |
Визуальное обследование |
pH |
SECa % мономера |
HICb % основного пика |
СилаC |
Мутностьd |
| 5 |
0 |
удовлетворительны |
6,2 |
99,0 |
64 |
106 |
0,25 |
| 1 |
удовлетворительны |
6,0 |
99,2 |
63 |
100 |
0,27 |
| 3 |
удовлетворительны |
6,0 |
99,3 |
63 |
111 |
0,25 |
| 16 |
удовлетворительны |
6,0 |
98,9 |
62 |
83 |
0,27 |
| 30 |
1 |
удовлетворительны |
5,9 |
98,43 |
54 |
91 |
0,25 |
| 3 |
удовлетворительны |
6,1 |
97,53 |
42 |
65 |
0,30 |
| 16 |
удовлетворительны |
6,0 |
90,63 |
19 |
28 |
0,54 |
| Результаты стабильности для 80 мг/мл Е25 в композиции с гистидином и трегалозой |
| Темпе-ратура (оС) |
Время (месяцы) |
Визуальное обследование |
pH |
SECa % мономера |
HICb % основного пика |
СилаC |
Мутностьd |
| 5 |
0 |
удовлетворительны |
5,7 |
99,1 |
64 |
100 |
0,20 |
| 1 |
удовлетворительны |
5,8 |
98,7 |
63 |
92 |
0,20 |
| 3 |
удовлетворительны |
5,7 |
98,8 |
63 |
124 |
0,20 |
| 6 |
удовлетворительны |
5,7 |
99,1 |
63 |
97 |
0,21 |
| 14 |
удовлетворительны |
5,7 |
99,0 |
62 |
83 |
0,21 |
| 24 |
удовлетворительны |
5,7 |
98,8 |
62 |
84 |
0,20 |
| 30 |
1 |
удовлетворительны |
5,8 |
98,7 |
55 |
77 |
0,20 |
| 3 |
удовлетворительны |
5,7 |
97,4 |
41 |
76 |
0,29 |
| 6 |
удовлетворительны |
5,8 |
95,5 |
31 |
48 |
0,38 |
| 14 |
удовлетворительны |
5,7 |
93,1 |
22 |
30 |
0,48 |
а.Гель-фильтрационная хроматография для измерения растворимых агрегатов и фрагментов
b.Гидрофобная хроматография для расщепленного папаином Е25
с.Ингибиторный анализ связывания рецептора IgE
d.Среднее OD (340-360 нм) |
| Исследования встряхивания: |
| |
TO |
Встряхивание после 3 дней |
| Композиция |
Визуальное обследование |
SEC
(% мономера) |
Мутность |
Визуальное обследование |
SEC
(% мономера) |
Мутность |
| 1 |
удовлетворительны |
99,5 |
0,18 |
удовлетворительны |
99,3 |
0,18 |
| 2 |
удовлетворительны |
99,0 |
0,19 |
удовлетворительны |
99,4 |
0,19 |
| Композиция 1: 156 мг/мл Е25, 300 мМ ArgHCl, 23 мМ His, 0,02% Т20 |
| Композиция 2: 150 мг/мл Е25, 182 мМ ArgHCl, 20 мМ His, 0,02% Т20 |
| Исследование замораживания-оттаивания: |
| |
TO |
После 1-го цикла |
После 3-го цикла |
| Композиция |
Визуальное обследование |
SEC
(% мономера) |
Мутность |
Визуальное обследование |
SEC
(% мономера) |
Мутность |
Визуальное обследование |
SEC
(% мономера) |
Мутность |
| 1 |
удовлетвори-тельны |
99,5 |
0,18 |
удовлетвори-тельны |
99,3 |
0,17 |
удовлетвори-тельны |
99,4 |
0,17 |
| 2 |
удовлетвори-тельны |
99,0 |
0,19 |
удовлетвори-тельны |
99,2 |
0,19 |
удовлетвори-тельны |
99,2 |
0,18 |
Композиция 1: 156 мг/мл Е25, 300 мМ ArgHCl, 23 мМ His, 0,02% Т20
Композиция 2: 150 мг/мл Е25, 182 мМ ArgHCl, 20 мМ His, 0,02% Т20 |
ПРИМЕР 3
Образцы жидких композиций моноклонального анти-IgE-антитела (Е25) готовили в 20 мМ буферах и затем хранили при 30оС и 40оС. Стабильность Е26 определяли хроматографией и измерениями активности. Гель-фильтрационную хроматографию использовали для определения растворимых агрегатов, а гидрофобную хроматографию использовали для измерения изомеризации расщепленной пепсином образцы. Активность образцы наблюдали с использованием ингибиторного анализа связывания IgE-рецептора. Как показано на фигурах 1, 2 и 3, деградация Е26 зависит в высокой степени от рН буферов. По-видимому, Е26 является наиболее стабильным около рН 6,0.
ПРИМЕР 4
Образование частиц является главной проблемой для получения высококонцентрированной жидкой композиции, так как оно обычно увеличивается с увеличением концентрации белка в условиях стресса. Фигура 4 показывает результат исследования встряхивания для концентрированной жидкой композиции Е26. Эту композицию готовили в 20 мМ сукцинате, 192 мМ трегалозе при рН 6,0 с различной концентрацией полисорбата 20. Образование частиц наблюдали посредством измерения мутности. Этот результат показывает, что мутность раствора Е26 увеличивается с увеличением времени встряхивания. Добавление по меньшей мере 0,01% полисорбата является существенным для уменьшения образования частиц в условиях стресса. Сходные результаты наблюдали также для концентрированной жидкой композиции Е25.
ПРИМЕР 5
Фигура 5 показывает жидкую композицию 150 мг/мл Е25, полученную восстановлением лиофилизированного Е25. Увеличение концентрации соли ингибирует обратимое образование частиц и приводит к уменьшению показания мутности. Среди всех испытанных солей композиция с Arg-HCl имеет, по-видимому, наименьшую мутность. Действие концентрации соли на снижение показания мутности наблюдали также для Е25, полученного с использованием TFF-способа.
ПРИМЕР 6
Жидкая композиция Е25 в присутствии Arg-HCl также имеет, по-видимому, лушую стабильность, чем другие жидкие композиции. Фигуры 6 и 7 показывают исследование стабильности Е25 при 150 мг/мл в жидких композициях, содержащих Arg-HCl, CaCl2 и MgCl2. Для жидкой композиции, содержащей Arg-HCl, с сахарозой или без сахарозы, имеется небольшое различие в их стабильности в показателях мутности, изомеризации и фрагментации. Жидкие композиции, содержащие Arg-HCl, являются более стабильными, чем композиция, содержащая MgCl2 и CaCl2.
ПРИМЕР 7
Фигура 8 показывает исследование стабильности жидкой композиции Е25 с ацетатом и гистидином в ее составе. Композиция с гистидином имеет более высокий рН, чем ацетатная композиция. Эти результаты ясно показывают, что Е25 в содержащей гистидин и содержащей Arg-HCl жидкой композиции является более стабильным, чем при других условиях.
ПРИМЕР 8
Высокая концентрация Е25 может образовывать твердый гель в присутствии некоторых ионов, таких как цитрат, сукцинат и сульфат (таблица I), в частности, при температуре хранения 2-8оС. Использование аргинина-HCl в качестве эксципиента позволяет авторам готовить Е25 с концентрацией до 200 мг/мл без образования геля или осадка.
Таблица I
Действие различных эксципиентов на образование геля Е25 при 125 мг/мл, рН6,0 |
| Эксципиент |
Концентрация эксципиента мМ |
Препарат |
Мутность при Т0 (340-360 нм) |
Концентрация антитела мг/мл |
Наблюдаемый визуально вид |
| SWFI |
|
Лио-Восстановленный |
0,21 |
125 |
Прозрачный |
| NaCl |
188 |
Лио-Восстановленный |
0,25 |
125 |
Прозрачный |
| Сукцинат |
94 |
Лио-Восстановленный |
0,31 |
125 |
Гель |
| Сукцинат |
19 |
Лио-Восстановленный |
0,28 |
125 |
Гель |
| Цитрат |
188 |
Лио-Восстановленный |
Незаконченная |
125 |
Гель |
| Цитрат |
19 |
Лио-Восстановленный |
Незаконченная |
125 |
Гель |
| Na2SO4 |
Незаконченная |
Лио-Восстановленный |
Незаконченная |
125 |
Гель |
| Na2SO4 |
Незаконченная |
Лио-Восстановленный |
Незаконченная |
125 |
Опалесцентный |
| Фосфат |
Незаконченная |
Лио-Восстановленный |
Незаконченная |
125 |
Опалесцентный |
| Ацетат |
188 |
Лио-Восстановленный |
Незаконченная |
125 |
Прозрачный |
| Ацетат |
94 |
Лио-Восстановленный |
Незаконченная |
125 |
Прозрачный |
| Ацетат |
19 |
Лио-Восстановленный |
Незаконченная |
125 |
Прозрачный |
| Гистидин |
94 |
Лио-Восстановленный |
0,19 |
125 |
Прозрачный |
| Гистидин |
47 |
Лио-Восстановленный |
0,24 |
125 |
Прозрачный |
| Аргинин-HCl |
150 |
Лио-Восстановленный |
0,25 |
137 |
Прозрачный |
| Аргинин-HCl |
200 |
TFF |
0,19 |
162 |
Прозрачный |
| Аргинин-SO4 |
150 |
Лио-Восстановленный |
0,27 |
137 |
Гель |
| CaCl2 |
125 |
TFF |
0,32 |
147 |
Прозрачный |
| MgCl2 |
125 |
TFF |
0,48 |
147 |
Опалесцентный |
ПРИМЕР 9
Экспрессия белка или антитела в E. coli
Этот пример иллюстрирует получение негликозилированной формы желаемого белка или антитела рекомбинантной экспрессией в E. coli.
Сначала амплифицировали ДНК-последовательность, кодирующую желаемые белок или антитело, с использованием выбранных ПЦР-праймеров. Эти праймеры должны содержать сайты рестриктаз, которые соответствуют сайтам рестриктаз на выбранном экспрессирующем векторе. Могут быть использованы различные экспрессирующие векторы. Примером подходящего вектора является pBR322 (полученная из E.coli; см. Bolivar et al., Gene, 2:95 (1977)), которая содержит гены устойчивости к ампициллину и тетрациклину. Этот вектор расщепляли рестрикционным ферментом (рестриктазой) и дефосфорилировали. Затем амплифицированные ПЦР последовательности лигировали в этот вектор. Этот вектор будет предпочтительно включать в себя последовательности, которые кодируют ген устойчивости к антибиотику, промотор trp, поли-His-лидер (в том числе первые шесть кодонов STII, поли-His-последовательность и сайт расщепления энтерокиназы), кодирующий район желаемого белка или антитела, терминатор транскрипции фага лямбда и ген ArgU. Кроме того, этот вектор может включать в себя по меньшей мере несущественные части нетранслируемых 5′- и 3′-районов нативной последовательности нуклеиновой кислоты, кодирующей желаемые белок или антитело.
Затем эту смесь для лигирования используют для трансформации выбранного штамма E.coli с использованием способов, описанных в Sambrook et al., выше. Трансформанты идентифицируют по их способности расти на LB-чашках и затем отбирают устойчивые к антибиотику колонии. Плазмидную ДНК выделяют и подтверждают рестрикционным анализом и секвенированием ДНК.
Выбранные клоны могут выращиваться в течение ночи в жидкой культуральной среде, такой как LB-бульон, дополненной антибиотиками. Ночная культура может быть затем использована для инокуляции крупномасштабной культуры. Затем клетки выращивают до желаемой оптической плотности, причем во время этого выращивания включают промотор экспрессии.
После культивирования этих клеток в течение еще нескольких часов клетки могут быть собраны центрифугированием. Осадок клеток, полученный центрифугированием, может быть солюбилизирован с использованием различных агентов, известных в данной области, и затем солюбилизированный желаемый белок или солюбилизированное желаемое антитело могут быть очищены с использованием металл-хелатирующей колонки в условиях, которые делают возможным плотное связывание солюбилизированного белка или антитела.
Желаемые белок или антитело могут быть экспрессированы в E. coli в поли-His-меченой форме с использованием следующей процедуры. ДНК, кодирующую желаемые белок или антитело, сначала амплифицируют с использованием выбранных ПЦР-праймеров. Эти праймеры будут содержать сайты рестриктаз, которые соответствуют сайтам рестриктаз на выбранном экспрессирующем векторе, и другие полезные последовательности, обеспечивающие эффективную и надежную инициацию трансляции, быструю очистку на металл-хелатирующей колонке и протеолитическое удаление энтерокиназой. Затем ПЦР-амплифицированные, поли-His-меченые последовательности лигируют в экспрессирующий вектор, который используют для трансформации хозяина E. coli, основанного на штамме 52 (W3110 fuhA(tonA) lon galE rpoHts(htpRts) clpP(lacIq). Трансформанты сначала выращивают в LB, содержащем 50 мг/мл карбенициллина, при 30°С при встряхивании, пока не достигается OD600 3-5. Затем культуры разбавляют в 50-100 раз в среде CRAP (полученной смешиванием 3,57 г (NH4)2SO4, 0,71 г цитрата натрия, 2Н2О, 1,07 г KCl, 5,36 г дрожжевого экстракта Difco, 5,36 г гиказы SF Шеффилда в 500 мл воды, а также 110 мМ MPOS, рН 7,3, 0,55% (масса/объем) глюкозы и 7 мМ MgSO4) и выращивают приблизительно 20-30 часов при 30°С при встряхивании. Образцы берут для подтверждения экспрессии электрофорезом в ДСН-ПААГ и всю культуру центрифугируют для осаждения клеток. Осадки клеток замораживают до очистки и рефолдинга.
Пасту E.coli из 0,5-1 л ферментации (6-10 г осадка) ресуспендируют в 10 объемах (масса/объем) в 7М гуанидине, 20 мМ Трис-буфере, рН 8. Добавляют твердый сульфит натрия и тетратионат натрия до конечной концентрации 0,1М и 0,02М соответственно и этот раствор перемешивают в течение ночи при 4оС. Эта стадия приводит к денатурированному белку со всеми остатками цистеинов, блокированными сульфитолизацией. Раствор центрифугируют при 40000 об/мин в ультрацентрифуге Бекмана в течение 30 минут. Супернатант разбавляют 3-5 объемами буфера для металл-хелатной колонки (6М гуанидин, 20 мМ Трис-буфер, рН 7,4) и фильтруют через фильтры 0,22 микрон для осветления. Осветленный экстракт наносят на металл-хелатную колонку Qiagen Ni-NTA 5 мл, уравновешенную в колоночном буфере металл-хелатной колонки. Эту колонку промывают дополнительным буфером, содержащим 50 мМ имидазол (Calbiochem, Utrol grade), рН 7,4. Белок элюируют буфером, содержащим 250 мМ имидазол. Фракции, содержащие желаемый белок, объединяют и хранят при 4оС. Концентрацию белка определяют приближенно по его оптической плотности при 280 нм с использованием рассчитанного коэффициента экстинкции на основе его аминокислотной последовательности.
Эти белки подвергают рефолдингу медленным разбавлением в свежеприготовленный буфер для рефолдинга, состоящий из: 20 мМ Триса, рН 8,6, 0,3М NaCl, 2,5М мочевины, 5 мМ цистеина, 20 мМ глицина и 1 мМ ЭДТА. Объемы рефолдинга выбирают таким образом, что концентрация полученного белка находится между 50 и 100 мкг/мл. Раствор рефолдинга осторожно перемешивают при 4оС в течение 12-36 часов. Реакцию рефолдинга гасят добавлением ТФУ до конечной концентрации 0,4% (рН приблизительно 3). Перед дополнительной очисткой этого белка раствор фильтруют через фильтр 0,22 микрон и добавляют ацетонитрил до конечной концентрации 2-10%. Повторно уложенный белок хроматографируют на обращенно-фазовой колонке Poros R1/H с использованием подвижного буфера 0,1% ТФУ с элюцией градиентом ацетонитрила от 10 до 80%. Аликвоты фракций с оптической плотностью при А280 анализируют на гелях ДСН-ПААГ и фракции, содержащие гомогенный повторно уложенный белок, объединяют. Обычно правильно уложенные молекулы большинства белков элюируются при самых низких концентрациях ацетонитрила, так как эти молекулы являются наиболее компактными с их гидрофобными внутренними частями, защищенными от взаимодействия с обращенно-фазовой смолой. Агрегированные частицы обычно элюируются при более высоких концентрациях ацетонитрила. Кроме различения ошибочно уложенных форм белков от желаемой формы эта обращенно-фазовая стадия удаляет также эндотоксин из этих проб.
Фракции, содержащие уложенные желаемый белок или антитело, объединяют и ацетонитрил удаляют с использованием осторожного тока азота, направленного на этот раствор. Белки готовят в 20 мМ HEPES, рН 6,8 с 0,14М хлоридом натрия и 4% маннитом посредством диализа или посредством гель-фильтрации с использованием колонок G25 Superfine (Pharmacia), уравновешенных в буфере для получения, и стерильно фильтруют.
ПРИМЕР 10
Экспрессия белка или антитела в клетках млекопитающих
Этот пример иллюстрирует получение потенциально гликозилированных форм желаемого белка или антитела рекомбинантной экспрессией в клетках млекопитающих.
В качестве экспрессирующего вектора используют вектор, pRK5 (см. ЕР 307247, опубликованный 15 марта 1989 года). Необязательно, ДНК, кодирующую желаемые белок или антитело, лигируют в pRK5 с выбранными рестриктазами, чтобы сделать возможной инсертирование такой ДНК с использованием способов лигирования, описанных в Sambrook et al., выше.
В одном варианте осуществления выбранными клетками-хозяевами могут быть клетки 293. Клетки 293 человека (АТСС CCL 1573) выращивают до конфлюентности в чашках для культуры ткани в среде, такой как DMEM, дополненной фетальной телячьей сывороткой и, необязательно, питательными компонентами и/или антибиотиками. Приблизительно 10 мкг, если ДНК, кодирующая желаемые белок или антитело, лигирована в pRK5, смешивают с приблизительно 1 мкг ДНК, кодирующей ген РНК VA [Thimmappaya et al., Cell, 31:543 (1982)], и растворяют в 500 мкл 1 мМ Трис-HCl, 0,1 мМ ЭДТА, 0,227М CaCl2. К этой смеси добавляют по каплям 500 мкл 50 мМ HEPES (рН 7,35), 280 мМ NaCl, 1,5 мМ NaPO4 и дают возможность образовываться остатку в течение 10 минут при 25оС. Осадок суспендируют и добавляют к клеткам 293 и дают ему оседать в течение приблизительно четырех часов при 37оС. Культуральную среду аспирируют и добавляют 2 мл 20% глицерина в ЗФР в течение 30 секунд. Затем клетки 293 промывают бессывороточной средой, добавляют свежую среду и клетки инкубируют в течение приблизительно 5 дней.
Спустя приблизительно 24 часа после трансфекций культуральную среду удаляют и заменяют только культуральной средой или культуральной средой, содержащей 200 мкКи/мл 35S-цистеина и 200 мкКи/мл 35S-метионина. После 12 часов инкубации эту кондиционированную среду собирают, концентрируют на вращающемся фильтре и наносят на 15% ДСН-гель. Обработанный гель может быть высушен и экспонирован на пленке в течение выбранного периода времени для выявления присутствия желаемого белка или антитела. Культуры, содержащие трансфицированные клетки, могут быть подвергнуты дополнительной инкубации (в бессывороточной среде) и эту среду тестируют в выбранных биоанализах.
В альтернативном способе желаемый белок или желаемое антитело могут быть введены в клетки 293 транзиторно с использованием декстрансульфатного способа, описанного Somparyrac et al., Proc. Natl. Acad. Sci. USA, 12:7575 (1981). Клетки 293 выращивают до максимальной плотности в центрифужной колбе и добавляют 700 мкг ДНК, кодирующей желаемые белок или антитело, лигированной в pRK5. Эти клетки сначала концентрируют из центрифужной колбы центрифугированием и промывают ЗФР. Осадок ДНК-декстран инкубируют на осадке клеток в течение четырех часов. Эти клетки обрабатывают 20% глицерином в течение 90 секунд, промывают средой для культуры ткани и повторно вводят в центрифужную колбу, содержащую среду для культуры ткани, 5 мкг/мл бычьего инсулина и 0,1 мкг/мл бычьего трансферрина. Спустя приблизительно четыре дня эту кондиционированную среду центрифугируют и фильтруют для удаления клеток и остатков клеток. Проба, содержащая экспрессированные желаемые белок или антитело, может быть затем концентрирована и очищена любым выбранным способом, таким как диализ и/или колоночная хроматография.
В другом варианте осуществления желаемые белок или антитело могут экспрессироваться в клетках СНО. ДНК, кодирующая желаемые белок или антитело, лигированная в pRK5, может быть трансфицирована в клетки СНО с использованием известных реагентов, таких как CaPO4 или ДЭАЭ-декстран. Как описано выше, культуры клеток могут быть инкубированы и среда может быть заменена только культуральной средой или средой, содержащей радиоактивную метку, такую как 35S-метионин. После определения присутствия желаемых белка или антитела эта культуральная среда может быть заменена бессывороточной средой. Предпочтительно эти культуры инкубируют в течение приблизительно 6 дней и затем эту кондиционированную среду собирают. Затем среда, содержащая экспрессированные желаемые белок или антитело, может быть сконцентрирована и очищена любым выбранным способом.
Меченные эпитопом варианты желаемых белка или антитела могут быть также экспрессированы в клетках-хозяевах СНО. ДНК, кодирующая желаемые белок или антитело, лигированная в pRK5, может быть субклонирована из вектора pRK5. Инсерт субклона может быть подвергнут ПЦР для слияния в рамке считывания с выбранной эпитопной меткой, такой как поли-His-метка, в бакуловирусный экспрессирующий вектор. Поли-His-меченая ДНК, кодирующая инсерцию желаемого белка или антитела, может быть затем субклонирована в регулируемый SV40 вектор, содержащий селектируемый маркер, такой как DHFR, для отбора стабильных клонов. Наконец, клетки СНО могут быть трансфицированы (как описано выше) регулируемым SV40 вектором. Мечение может быть выполнено, как описано выше, для подтверждения экспрессии. Затем культуральная среда, содержащая экспрессируемые поли-His-меченые белок или антитело, может быть сконцентрирована и очищена любым селектируемым способом, таким как Ni2+-хелатная аффинная хроматография.
Желаемые белок или антитело могут быть затем экспрессированы в клетках СНО и/или COS процедурой транзиторной экспрессии или в клетках СНО другой процедурой стабильной экспрессии.
Стабильную экспрессию в клетках СНО выполняют с использованием следующей процедуры. Белки экспрессируют в виде IgG-конструкции (иммуноадгезина), в которой кодирующие последовательности для растворимых форм (например, внеклеточных доменов) соответствующих белков сливают с последовательностью константного района IgG1, содержащей шарнирную область, домены СН2 и СН3, и/или являются поли-His-меченой формой.
После ПЦР-амплификации соответствующие ДНК субклонируют в экспрессирующий вектор СНО с использованием стандартных способов, описанных в Ausubel et al., Current Protocols of Molecular Biology, Unit 3.16, John Wiley and Sons (1997). Экспрессирующие векторы СНО конструируют таким образом, что они имеют совместимые сайты рестрикции 5′- (слева) и 3′- (справа) от интересующего ДНК для создания возможности подходящей перетасовки кДНК. Экспрессия с использованием вектора в клетках СНО описана в Lucas et al., Nucl. Acids Res. 24:9 (1774-1779 (1996) и использует ранний промотор/энхансер SV40 для запуска экспрессии интересующего кДНК и дигидрофолатредуктазы (DHFR). Экспрессия DHFR делает возможным отбор на стабильное сохранение этой плазмиды после трансфекции.
Двенадцать микрограммов желаемой плазмидной ДНК вводят в приблизительно 10 миллионов клеток СНО с использованием коммерчески доступных реагентов трансфекции Superfect® (Qiagen), Dosper® или Fugene® (Boehringer Mannheim). Клетки выращивают, как описано в Lucas et al., выше. Приблизительно 3×10-7 клеток замораживают в ампуле для дальнейшего роста и продуцирования, как описано ниже.
Ампулы, содержащие плазмидную ДНК, оттаивают помещением в водяную баню и смешивают на вортексе. Содержимое пипетируют в центрифужную пробирку, содержащую 10 мл среды, и центрифугируют при 1000 об/мин в течение 5 минут. Супернатант аспирируют и клетки суспендируют в 10 мл селективной среды (0,2 Фм-отфильтрованной PS20 с 5% 0,2 Фм-диафильтрованной фетальной бычьей сывороткой). Затем эти клетки помещают в виде аликвот в центрифужный сосуд на 100 мл, содержащий 90 мл селективной среды. Спустя 1-2 дня эти клетки переносили в центрифужный сосуд на 250 мл, наполненный 150 мл селективной среды для выращивания, и инкубировали при 37оС. Спустя еще 2-3 дня центрифужные сосуды на 250 мл, 500 мл и 2000 мл засевали 3×105 клеток/мл. Эту клеточную среду заменяли свежей средой центрифугированием и ресуспендированием в производственной питательной среде. Хотя может быть использована любая подходящая среда для СНО, фактически может быть использована производственная питательная среда, описанная в патенте США № 5122469, выданном 16 июня 1992 года. Производственный центрифужный сосуд на 3 л засевают при 1,2×106 клеток/мл. В день 0 определяют количество клеток и рН. В день 1 из этого центрифужного сосуда берут пробу и начинают барботирование отфильтрованным воздухом. В день 2 из центрифужного сосуда берут пробу, температуру снижают до 33оС и добавляют 30 мл 500 г/л глюкозы и 0,6 мл 10% пеногасителя (например, 35% эмульсии полидиметилсилоксана, Dow Corning 365 Medical Grade Emulsion). Во время производства рН корректируют, когда это необходимо, для поддержания его при приблизительно 7,2. Спустя 10 дней или когда жизнеспособность падает ниже 70%, культуру клеток собирают центрифугированием и фильтрованием через фильтр 0,22 Фм. Этот фильтр либо хранят при 4оС, либо сразу наносят на колонки для очистки.
Для поли-His-меченых конструкций эти белки очищают с использованием колонки Ni-NTA (Qiagen). Перед очисткой к кондиционированной среде добавляют имидазол до концентрации 5 мМ. Эту кондиционированную среду подают насосом на колонку 6 мл Ni-NTA, уравновешенную при 4оС в 20 мМ HEPES-буфере, рН 7,4, содержащем 0,3М NaCl и 5 мМ имидазол, при скорости тока 4-5 мл/мин. После нанесения эту колонку промывают дополнительным количеством буфера для уравновешивания и белок элюируют буфером для уравновешивания, содержащим 0,25М имидазол. Затем этот высокоочищенный белок обессоливают в буфер для хранения, содержащий 10 мМ HEPES, 0,14М NaCl и 4% маннит, рН 6,8, с 25 мл колонки G25 Superfine (Pharmacia) и хранят при -80оС.
Иммуноадгезиновые (Fc-содержащие) конструкции очищают от кондиционированной среды следующим образом. Кондиционированную среду подают насосом на 5 мл Протеин А-колонки (Pharmacia), которая была уравновешена 200 мМ Na фосфатным буфером, рН 6,8. После нанесения колонку промываают буфером для уравновешивания, перед элюцией 100М уксусной кислотой, рН 3,5. Элюированный белок сразу же нейтрализуют сбором фракций 1 мл в пробирки, содержащие 275 Фл 1М Трис-буфера, рН 9. Затем этот высокоочищенный белок обессоливают в буфер для хранения, как описано выше для поли-His-меченых белков. Гомогенность оценивают с использованием ДСН-полиакриламидных гелей и секвенированием N-концевых аминокислот способом деградации Эдмана.
ПРИМЕР 11
Экспрессия белка или антител в дрожжах
Следующий способ описывает рекомбинантную экспрессию желаемого белка или антитела в дрожжах.
Сначала конструируют дрожжевые экспрессирующие векторы для внутриклеточного продуцирования или секреции желаемого белка или антитела от промотора ADH2/GAPDH. ДНК, кодирующую желаемые белок или антитело, и этот промотор встраивают в подходящие сайты рестрикционных ферментов в выбранной плазмиде для регуляции внутриклеточной экспрессии. Для секреции ДНК, кодирующая желаемые белок или антитело, может быть клонирована в выбранную плазмиду вместе с ДНК, кодирующей промотор ADH2/GAPDH, нативный сигнальный пептид или сигнальный пептид другого млекопитающего или, например, дрожжевой альфа-фактор или секреторную сигнальную/лидерную последовательность инвертазы, и линкерные последовательности (если необходимо) для экспрессии желаемого белка или антитела.
Клетки дрожжей, такие как штамм дрожжей АВ110, могут быть затем трансформированы описанными выше экспрессионными плазмидами и культивированы в выбранной ферментационной среде. Супернатанты трансформированных дрожжей могут анализироваться осаждением 10% трихлоруксусной кислотой и разделением электрофорезом в ДСН-ПААГ с последующим окрашиванием гелей красителем Кумасси синим.
Затем рекомбинантные белок или антитело могут быть выделены и очищены удалением клеток дрожжей из ферментационной среды центрифугированием и затем концентрированием этой среды с использованием выбранных фильтров-патронов. Концентрат, содержащий рекомбинантный белок или рекомбинантное антитело, может быть дополнительно очищен с использованием выбранных смол для колоночной хроматографии.
ПРИМЕР 12
Экспрессия белка или антитела в инфицированных бакуловирусом клетках насекомых
Следующий способ описывает рекомбинантную экспрессию желаемого белка или антитела в инфицированных бакуловирусом клетках насекомых.
Последовательность, кодирующую желаемый белок или желаемое антитело, сливают слева от эпитопной метки, содержащейся в бакуловирусном экспрессионном векторе. Такие эпитопные метки включают в себя поли-His-метки и иммуноглобулиновые метки (такие как Fc-районы IgG). Могут быть использованы различные плазмиды, в том числе плазмиды, произведенные из коммерчески доступных плазмид, таких как pVL1393 (Novagen). Вкратце последовательность, кодирующую желаемую часть белка или антитела, такую как последовательность, кодирующая внеклеточный домен трансмембранного белка, или последовательность, кодирующую зрелый белок, если этот белок является внеклеточным, амплифицируют при помощи ПЦР с праймерами, комплементарными 5′- и 3′-районам. 5′-праймер может включать в себя фланкирующие (выбранные) сайты рестрикционных ферментов. Затем этот продукт расщепляют этими выбранными рестриктазами и субклонируют в экспрессирующий вектор.
Рекомбинантный бакуловирус генерируют котрансфекцией описанной выше плазмиды и ДНК вируса BaculoGold (Pharmingen) в клетки Spodoptera frugiperda (“SF9”) (АТСС CRL 1711) с использованием липофектина (коммерчески доступного из Gibco BRL). Спустя 4-5 дней инкубирования при 28оС высвобожденные вирусы собирали и использовали для дополнительных амплификаций. Инфицирование вирусом и экспрессию белка выполняли, как описано O’Reilley et al., Baculovirus expression vectors: A Laboratory Manual, Oxford: Oxford University Press (1994). (Pharmingen) в клетки Spodoptera frugiperda (“SF9”) (АТСС CRL 1711) с использованием липофектина (коммерчески доступного из Gibco BRL). Спустя 4-5 дней инкубирования при 28оС высвобожденные вирусы собирали и использовали для дополнительных амплификаций. Инфицирование вирусом и экспрессию белка выполняли, как описано O’Reilley et al., Baculovirus expression vectors: A Laboratory Manual, Oxford: Oxford University Press (1994).
Затем экспрессированные поли-His-меченые белок или антитело могут быть очищены, например, Ni2+-хелатной аффинной хроматографией, следующим образом. Получают экстракты из инфицированных рекомбинантным вирусом клеток SF9, как описано Rupert et al., Nature, 362:175-179 (1993). Вкратце клетки SF9 промывают, ресуспендируют в буфере для обработки ультразвуком (25 мл HEPES, рН 7,9; 12,5 мМ MgCl2; 0,1 мМ ЭДТА; 10% глицерин; 0,1% NP-40; 0,4М KCl) и обрабатывают ультразвуком два раза в течение 20 секунд на льду. Обработанные ультразвуком экстракты осветляют центрифугированием и супернатант разбавляют в 50 раз в буфере для нанесения (50 мМ фосфат, 300 мМ NaCl, 10% глицерин, рН 7,8) и фильтруют через фильтр 0,45 Фм. Ni2+-NTA-агарозную колонку (коммерчески доступную из Qiagen) готовят с объемом слоя 5 мл, промывают 25 мл воды и уравновешивают 25 мл буфера для нанесения. Отфильтрованный клеточный экстракт наносят на эту колонку при 0,5 мл/мин. Колонку промывают до фонового уровня А280 буфером для нанесения, после чего начинают сбор отдельных фракций. Затем колонку промывают вторым промывочным буфером (50 мМ фосфат; 300 мМ NaCl, 10% глицерин, рН 6,0), который элюирует неспецифически связанный белок. После достижения снова фоновой линии А280, эту колонку проявляют градиентом 0-500 мМ имидазола во втором промывочном буфере. Собирают фракции по 1 мл и анализируют электрофорезом в ДСН-ПААГ и окрашиванием серебром или Вестерн-блоттингом с Ni2+-NTA-конъюгированным со щелочной фосфатазой (Qiagen). Фракции, содержащие элюированный His10-меченый белок или антитело, объединяют и диализуют против буфера для нанесения.
Альтернативно очистка IgG-меченого (или Fc-меченого) белка или антитела может быть выполнена с использованием известных хроматографических способов, в том числе, например, Протеин А- или Протеин G-колоночной хроматографией.
ПРИМЕР 13
Получение антител
Этот пример иллюстрирует получение моноклональных антител, которые могут специфически связывать интересующий белок или желаемый антиген.
Способы получения моноклональных антител известны в данной области и описаны, например, в Goding, выше. Иммуногены, которые могут быть использованы, включают в себя очищенный желаемый белок или антиген-мишень, слитые белки, содержащие желаемый белок или антиген-мишень, и клетки, экспрессирующие такой рекомбинантный белок или антиген на клеточной поверхности. Выбор иммуногена может быть сделан специалистом с квалификацией в данной области без чрезмерного экспериментирования.
Таких мышей, как Balb/c, иммунизируют желаемым иммуногеном, белком или антигеном-мишенью, эмульгированным в полном адъюванте Фрейнда, и инъецируют подкожно или внутрибрюшинно в количестве 1-100 микрограммов. Альтернативно этот иммуноген эмульгируют в адъюванте MPL-TDM (Ribi Immunochemical Research, Hamilton, MT) и инъецируют в подушечки задних лапок животного. Затем иммунизированных мышей подвергают бустингу спустя 10-12 дней дополнительным количеством иммуногена, эмульгированного в выбранном адъюванте. После этого в течение нескольких недель мыши могут также подвергаться бустингу дополнительными иммунизационными инъекциями. Образцы сыворотки могут быть получены периодически из мышей ретроорбитальным кровопусканием для тестирования в анализах ELISA для детектирования антител, направленных на желаемый белок или антиген.
После детектирования титра подходящего антитела животные, “положительные” в отношении антител, могут быть инъецированы конечной внутривенной инъекцией желаемого белка или антигена-мишени. Спустя три-четыре для мышей умерщвляют и собирают клетки селезенки. Затем эти клетки селезенки сливают (с использованием 35% полиэтиленгликоля) с выбранной мышиной клеточной линией миеломы, такой как P3X63AgU.1, доступной из АТСС No. CRL 1597. Эти слияния генерируют гибридомные клетки, которые могут затем высеваться в 96-луночные планшеты для культуры ткани, содержащие НАТ-среду (гипоксантин, аминоптерин и тимидин) для ингибирования пролиферации неслитых клеток, миеломных гибридов и гибридов клеток селезенки.
Гибридомные клетки подвергают скринингу в ELISA на реактивность против желаемого белка или антигена-мишени. Определение «положительных» гибридомных клеток, секретирующих такие моноклональные антитела, находится в пределах квалификации специалиста в данной области.
Положительные гибридомные клетки могут быть инъецированы внутрибрюшинно сингенным мышам Balb/c для получения асцитов, содержащих такие моноклональные антитела. Альтернативно эти гибридомные клетки могут выращиваться в колбах для культуры ткани или роллерных флаконах. Очистка моноклональных антител, продуцированных в асцитах, может выполняться с использованием осаждения сульфатом аммония с последующей гель-фильтрационной хроматографией. Альтернативно может быть использована аффинная хроматография на основе связывания антитела с белком А или белком G.
ПРИМЕР 14
Очистка желаемого белка с использованием специфических антител
Желаемый белок, в нативной или рекомбинантной форме, может быть очищен различными стандартными способами в области очистки белков. Например, формы про-полипептида, зрелого полипептида или пре-полипептида желаемого белка могут быть очищены иммуноаффинной хроматографией с использованием антител, специфических в отношении желаемого белка. Обычно иммуноаффинную колонку получают ковалентным связыванием антитела, которое специфически связывает белок с активированной хроматографической смолой.
Поликлональные антитела получают из иммунных сывороток либо осаждением сульфатом аммония, либо очисткой на иммобилизованном Белке А (Pharmacia LKB Biotechnology, Piscataway, N.J.). Подобным образом моноклональные антитела получают из мышиной асцитной жидкости осаждением сульфатом аммония или хроматографией на иммобилизованном Белке А. Частично очищенный иммуноглобулин ковалентно связывают с хроматографической смолой, такой как CnBr-активированная SEPHAROSE (Pharmacia LKB Biotechnology). Это антитело связывают со смолой, смолу блокируют и эту дериватизованную смолу промывают в соответствии с инструкциями изготовителя. (Pharmacia LKB Biotechnology). Это антитело связывают со смолой, смолу блокируют и эту дериватизованную смолу промывают в соответствии с инструкциями изготовителя.
Такую иммуноаффинную колонку используют в очистке желаемого белка получением фракции из клеток, экспрессирующих его в растворимой форме. Этот препарат получают солюбилизацией фракции целых клеток или субклеточной фракции, полученной дифференциальным центрифугированием посредством добавления детергента или другими способами, хорошо известными в данной области. Альтернативно растворимый белок, содержащий сигнальную последовательность, может быть секретирован в применимом количестве в среду, в которой растут эти клетки.
Солюбилизированный препарат, содержащий желаемый белок, пропускают через иммуноаффинную колонку и эту колонку промывают при условиях, которые делают возможным преимущественное поглощение желаемого белка (например, буферы высокой ионной силы в присутствии детергента). Затем эту колонку элюируют при условиях, которые разрушают связывание антитела с белком (например, буфер с низким рН, таким как приблизительно рН 2-3, или высокая концентрация хаотропа, такого как мочевина или тиоцианатный ион), и затем может быть собран желаемый белок.




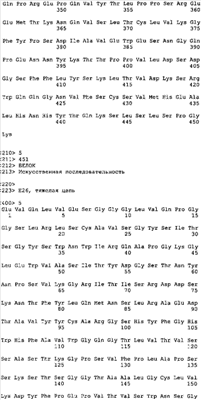



Формула изобретения
1. Стабильная жидкая композиция, содержащая (а) анти-IgE-антитело в количестве 100-260 мг/мл, (b) аргинин-HCl в количестве 50-200 мМ, (с) гистидин в количестве 10-100 мМ, (d) полисорбат в количестве 0,01-0,1%, где композиция дополнительно имеет рН в диапазоне 5,5-7,0, кинематическую вязкость приблизительно 50 сСт или менее, осмолярность в диапазоне 200-450 мОсм/кг и мутность 0,30 O.D. или менее средней оптической плотности.
2. Композиция по п.1, где концентрация антитела находится в диапазоне от 120 до 260 мг/мл.
3. Композиция по п.1, где концентрация антитела находится в диапазоне от 150 до 260 мг/мл.
4. Композиция по п.1, где концентрация антитела находится в диапазоне от 180 до 260 мг/мл.
5. Композиция по п.1, где концентрация антитела находится в диапазоне от 200 до 260 мг/мл.
6. Композиция по п.1, где концентрация антитела равна приблизительно 150 мг/мл.
7. Композиция по п.1, где осмолярность находится в диапазоне от 250 до 350 мОсм/кг.
8. Композиция по п.1, где концентрация аргинина-HCI находится в диапазоне от 100 до 200 мМ.
9. Композиция по п.1, где анти-IgE-антитело выбрано из rhuMAbE25, rhuМАbЕ26 и Hu-901.
10. Композиция по п.9, где анти-IgE-антитело является rhuMAbE25.
11. Композиция по п.9, где анти-IgE-антитело является rhuMAbE26.
12. Композиция по п.9, где анти-IgE-антитело является Hu-901.
13. Стабильная жидкая композиция, содержащая (а) моноклональное анти-IgE-антитело в количестве приблизительно 150 мг/мл, (b) аргинин-HCl в количестве 200 мМ, (с) гистидин в количестве 20 мМ, (d) полисорбат в количестве 0,02%, где композиция дополнительно имеет рН 6,0 и мутность 0,30 O.D. или менее средней оптической плотности.
14. Композиция по п.13, где анти-IgE-антителом является Е25.
15. Изделие, содержащее контейнер, в котором заключена композиция по п.1.
16. Изделие по п.15, где контейнер является шприцом.
17. Изделие по п.16, где шприц, кроме того, содержится в инъекционном устройстве.
18. Изделие по п.17, где инъекционное устройство является шприцом для самоинъекции.
19. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13.
20. Способ по п.19, где IgE-опосредованное нарушение выбрано из группы, состоящей аллергического ринита, астмы, аллергической астмы, неаллергической астмы, атопического дерматита и гастроэнтеропатии.
21. Способ по п.19, где IgE-опосредованным нарушением является аллергический ринит.
22. Способ по п.19, где IgE-опосредованным нарушением является аллергическая астма.
23. Способ по п.19, где IgE-опосредованным нарушением является астма.
24. Способ по п.19, где IgE-опосредованным нарушением является атопический дерматит.
25. Способ по п.19, где IgE-опосредованное нарушение выбрано из группы, состоящей из гиперчувствительности, аллергического бронхолегочного аспергиллеза, паразитарных заболеваний, интерстициального цистита, гипер-IgE-синдрома, атаксии-телеангиэктазии, синдрома Вискотта-Олдрича, алимфоплазии вилочковой железы, IgE-миеломы и реакции трансплантат против хозяина.
26. Способ по п.19, где IgE-опосредованным нарушением является гиперчувствительность.
27. Способ по п.26, где гиперчувствительность выбрана из группы, состоящей из анафилаксии, крапивницы и пищевой аллергии.
28. Способ по п.27, где аллергическим нарушением является пищевая аллергия.
29. Способ по п.28, где пищевая аллергия вызвана приемом бобового растения.
30. Способ по п.29, где бобовым растением является арахис.
31. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13 в сочетании с антигистаминным препаратом.
32. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13 в сочетании с введением антигистаминного препарата.
33. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13 в сочетании с бронходилататором.
34. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13 в сочетании с введением бронходилататора.
35. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13 в сочетании с глюкокортикоидом.
36. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13 в сочетании с введением глюкокортикоида.
37. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13 в сочетании с применением десенсибилизации аллергена.
38. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13 в сочетании с НПВС.
39. Способ лечения IgE-опосредованного нарушения, предусматривающий введение пациенту, при необходимости, терапевтически эффективного количества композиции по п.13 в сочетании с введением НПВС.
РИСУНКИ
|
|