|
|
(21), (22) Заявка: 2006101985/15, 31.10.2003
(24) Дата начала отсчета срока действия патента:
31.10.2003
(30) Конвенционный приоритет:
25.06.2003 US 10/606,969
(43) Дата публикации заявки: 27.07.2006
(46) Опубликовано: 10.09.2008
(56) Список документов, цитированных в отчете о
поиске:
WO 03034988, 01.05.2003. RU 2121830 C1, 20.11.1998. RU 2056843 С1, 27.03.1996. RU 2177314 С2, 27.12.2001. WO 9827962 A2, 02.07.1998. US 2002034532, 21.03.2002.
(85) Дата перевода заявки PCT на национальную фазу:
25.01.2006
(86) Заявка PCT:
US 03/34763 (31.10.2003)
(87) Публикация PCT:
WO 2005/009408 (03.02.2005)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
ЧЭНЬ Гохуа (US),
ПРЕБЕ Дэвид (US),
БАННИСТЕР Рой (US),
ХЬЮСТОН Пол (US),
КЛЕЙНЕР Лотар (US)
(73) Патентообладатель(и):
АЛЗА КОРПОРЕЙШН (US)
|
(54) ДОЗИРОВАННЫЕ ФОРМЫ АНЕСТЕЗИРУЮЩИХ СРЕДСТВ С ДЛИТЕЛЬНЫМ ВЫСВОБОЖДЕНИЕМ ДЛЯ ОБЕЗБОЛИВАНИЯ
(57) Реферат:
Изобретение относится к области фармацеи, а именно к дозированным формам с длительным высвобождением. Раскрыты системы и наборы для доставки лекарственных средств, высвобождающие анестетик кратковременного действия, такой как бупивакаин. Раскрыты также способы введения и приготовления таких систем. Системы доставки лекарственных средств включают кратковременно действующий гелевый носитель и анестезирующее средство, растворенное или диспергированное в гелевом носителе. Гелевый носитель содержит биоэродируемый биологически совместимый полимер со средней молекулярной массой от 3000 до 10000 и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и образования геля с полимером. Одним из способов измерения эффективности системы доставки лекарственных средств является коэффициент эффективности, который для достижения желательного профиля высвобождения может регулироваться, например, составом гелевого носителя. Использование изобретения обеспечивает эффективное обезболивание у субъектов, например, для устранения послеоперационной боли за счет высвобождения заданного количества анестезирующего средства кратковременного действия в оперируемую область в течение продолжительного периода времени. 5 н. и 29 з.п. ф-лы, 15 ил.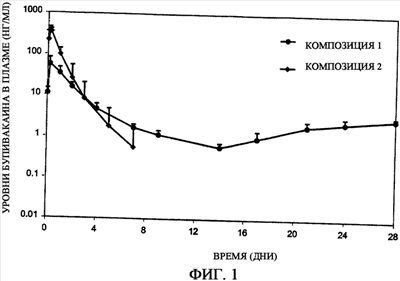
Настоящая заявка является частичным продолжением патентной заявки США с регистрационным No.10/606969, поданной 25 июня 2003 года и включенной в данное описание посредством ссылки, для которой испрошен приоритет по предварительной заявке США с регистрационным No. 60/391867, поданной 25 июня 2002 года и включенной в данное описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к дозированным формам с длительным высвобождением и наборам, содержащим анестезирующее средство для применения в требуемом участке воздействия. Настоящее изобретение также относится к способам приготовления и введения дозированных форм.
УРОВЕНЬ ТЕХНИКИ
Обезболивание, например устранение послеоперационной боли, для пациента является важным шагом на пути к выздоровлению. Несмотря на то что для каждого пациента существует много факторов, влияющих на оптимальность обезболивающей терапии, существует настоятельная необходимость в легко применяемых средствах.
Одним из способов устранения послеоперационной боли является использование местных анестетиков, например, бупивакаина. Бупивакаин – местный анестетик продолжительного действия, вводящийся путем локальной инфильтрации для блокады периферических нервов и эпидуральной блокады каудального и люмбального отделов. Как общепринято в данной области техники, для лечения послеоперационной боли подходит бупивакаина гидрохлорид, например, в виде единственного раствора для парентерального введения, в виде раствора для инъекций с глюкозой и в комбинации с адреналином.
Послеоперационная боль, сопровождающая все типы манипуляций, такие как большие оперативные вмешательства (например, торакотомия, пластика аорты, резекция кишки), средние оперативные вмешательства (например, кесарево сечение, экстирпация матки, аппендэктомия), и малые оперативные вмешательства (например, ушивание грыжи, лапароскопия, артроскопия, биопсия молочной железы) может быть изнурительной и требовать обезболивания в течение трех-пяти дней после операции. Однако местная анестезия раствором, например, 0,5% бупивакаина гидрохлорида с адреналином обеспечивает местную аналгезию только на период примерно от четырех до девяти часов. Поэтому стандартная послеоперационная терапия, использующая анестезирующие средства, такие как бупивакаин, требует или их частой инъекции или постоянного внутривенного вливания.
Остается большая потребность в системах доставки лекарственных средств, содержащих анестезирующее средство, способных обеспечить длительное высвобождение при краткой продолжительности действия. Также существует необходимость в отдельном введении систем доставки анестезирующего средства, обеспечивающих длительное высвобождение в течение нескольких дней.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении представлены системы доставки лекарственных средств и наборы, которые высвобождают анестезирующие средства кратковременного действия, такие как бупивакаин. Также раскрываются способы введения и приготовления таких систем. В соответствии с настоящим изобретением системы доставки лекарственных средств, например дозированные формы с длительным высвобождением, содержат гелевый носитель кратковременного действия и анестезирующее средство, растворенное или диспергированное в гелевом носителе. Гелевый носитель содержит низкомолекулярный биоэродируемый биологически совместимый полимер и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и образования геля с полимером. В некоторых случаях наряду с несмешивающимся с водой растворителем используется составной растворитель.
Дозированные формы согласно настоящему изобретению имеют преимущество над обычным системным обезболиванием, требующим или частых инъекций, или постоянного внутривенного вливания раствора. Например, в отношении послеоперационного обезболивания системы доставки лекарственных средств по настоящему изобретению, способные высвобождать заданное количество анестезирующего средства, такого как бупивакаин, в оперированную область в течение продолжительного периода времени, имеют преимущество над стандартной системной послеоперационной обезболивающей терапией, предусматривающей частые инъекции или постоянное внутривенное вливание. Преимущество также достигается однократностью введения дозированных форм по настоящей заявке. С другой стороны, предполагается также, что дозированные формы по настоящему изобретению могут вводиться в виде повторных доз.
Задачей настоящего изобретения является разработка дозированных форм анестезирующих средств кратковременного действия с длительным высвобождением, например, бупивакаина, которые могут применяться для обезболивания у субъектов, например для устранения послеоперационной боли. Коэффициентом эффективности, служащим одним из способов измерения эффективности системы доставки лекарственных средств, является отношение максимальной достигнутой концентрации полезного вещества (Cmax), например анестетика, вскоре после введения дозированной формы, и средней концентрации полезного вещества, измеряемой в течение заданного отрезка времени после достижения максимальной концентрации (Cсредняя), например между 2 и 9 днями после введения. Коэффициент эффективности может регулироваться составом гелевого носителя для достижения желательного профиля высвобождения. Соотношение полимера и растворителя в гелевом носителе может влиять на коэффициент эффективности так же, как и выбор несмешивающегося с водой растворителя или смесей растворителей, составных растворителей и/или выбор наполнителя. Кроме того, на коэффициент эффективности может также влиять молекулярная масса полимера и/или средний размер частиц полезного вещества. На основе потребностей субъекта можно специально задавать коэффициенты эффективности, а также введение полезного вещества, и коэффициенты эффективности могут варьировать от приблизительно 1 до приблизительно 200. В некоторых случаях коэффициенты эффективности могут варьировать от приблизительно 5 до приблизительно 100.
Как правило, для послеоперационного обезболивания желательно доставить лекарственное средство с достижением достаточно высокого Cmax анестезирующего средства для практически немедленного обезболивания и затем поддерживать стабильный уровень анестезирующего средства в течение определенного времени. В этом случае может быть желателен более высокий коэффициент эффективности. Однако в других ситуациях для уменьшения потенциальных побочных эффектов высокой дозировки лекарственного средства может быть полезно поддержание строго контролируемого уровня активного вещества как в циркулирующей крови, так и его локального распределения в тканях. Для таких ситуаций может быть желателен более низкий коэффициент эффективности. Также по причине индивидуальных различий у пациентов и терапевтической необходимости желательно регулировать коэффициент эффективности дозированной формы доставки лекарственного средства.
Что касается выполняемого в соответствии с настоящим изобретением соотношения между полимером и растворителем, рассматривались соотношения с примерными интервалами от 5:95 и до 90:10, примерными интервалами от 20:80 и до 80:20 и/или примерными интервалами от 30:70 и до 75:25.
Дозированные формы кратковременного действия с длительным высвобождением, например гелевые композиции для инъекций с замедленным всасыванием (гелевые депо-композиции), описанные в совместно рассматриваемой заявке США с регистрационным No. 10/606969, включенной в настоящий документ посредством ссылки, могут обеспечивать как системную, так и локальную доставку полезного вещества у субъекта в течение короткого промежутка времени. В частности, кратковременно действующие дозированные формы с длительным высвобождением могут высвобождать полезное вещество, например анестетик, такой как бупивакаин, в течение приблизительно двух недель или менее после введения их субъекту, получающему лечение. В других вариантах осуществления настоящего изобретения регулируется высвобождение в течение периода, равного приблизительно семи дням или меньше. Тем не менее, в других вариантах осуществления возможно регулирование высвобождения полезного вещества в период от приблизительно 24 часов до семи дней.
При том что для использования в настоящем изобретении не ограничивается выбор подходящих анестезирующих средств, в патенте США No.6432986, на который ссылается настоящее изобретение, приводится несколько примеров: в одном аспекте настоящего изобретения анестезирующее средство выбирается из группы, состоящей из бупивакаина, лево-бупивакаина, ропивакаина, лево-ропивакаина, тетракаина, этидокаина, лево-этидокаина, декстро-этидокаина, лево-мепивакаина и их комбинации. В других аспектах анестезирующее средство содержит бупивакаин.
В дополнительных аспектах настоящего изобретения приблизительно 7 мас.% или менее от массы растворителей гелевого носителя при 25°C может смешиваться с водой. В одном из вариантов осуществления настоящего изобретения дозированная форма не содержит растворителей, имеющих смешиваемость с водой более 7 мас.% при 25°C. При том что для настоящего изобретения подходит много растворителей, в одном аспекте настоящего изобретения растворитель выбран из группы, состоящей из ароматических спиртов, низших алкиловых эфиров ариловых кислот, низших аралкиловых эфиров ариловых кислот; арилкетонов, аралкилкетонов, низших алкилкетонов, низших алкиловых эфиров лимонной кислоты и их комбинаций. Пригодные растворители, используемые в настоящем изобретении, включают бензиловый спирт, бензилбензоат, этилбензоат, триацетин и их смеси, но не ограничены вышеперечисленными.
Дополнительные вышеупомянутые аспекты настоящего изобретения включают дозированные формы с длительным высвобождением, дополнительно содержащие составные растворители, выбираемые из группы, состоящей из триацетина, диацетина, трибутирина, триэтилцитрата, трибутилцитрата, ацетилтриэтилцитрата, ацетилтрибутилцитрата, триэтилглицеридов, триэтилфосфата, диэтилфталата, диэтилтартрата, минерального масла, полибутена, силиконовой жидкости, глицерина, этиленгликоля, полиэтиленгликоля, октанола, этиллактата, пропиленгликоля, пропиленкарбоната, этиленкарбоната, бутиролактона, этиленоксида, пропиленоксида, N-метил-2-пирролидона, 2-пирролидона, глицеролформаля, метилацетата, этилацетата, метилэтилкетона, диметилформамида, диметилсульфоксида, тетрагидрофурана, капролактама, децилметилсульфоксида, олеиновой кислоты и 1-додецилазациклогептан-2-она и их комбинаций.
В других вариантах осуществления настоящего изобретения гелевый носитель содержит полимер на основе молочной кислоты или сополимер молочной кислоты и гликолевой кислоты (PLGA). В других вариантах осуществления используются полимеры на основе капролактона. Полимеры могут также быть выбраны из группы, состоящей из полилактидов, полигликолидов, поли(капролактона), полиангидридов, полиаминов, полиамидоэфиров, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, полифосфоэфиров, полиэфиров, полибутилентерефталата, полиортокарбонатов, полифосфазенов, сукцинатов, поли(яблочной кислоты), поли(аминокислот), поливинилпирролидона, полиэтиленгликоля, полигидроксицеллюлозы, полисахаридов, хитина, хитозана, гиалуроновой кислоты и сополимеров, тройных сополимеров и их смесей. Полимеры, используемые в настоящем изобретении, могут содержать эфирную концевую группу или концевую группу с карбоновой кислотой. К тому же полимеры могут иметь среднюю молекулярную массу в промежутке от приблизительно 1000 до приблизительно 10000, в промежутке от приблизительно 3000 до приблизительно 10000, в промежутке от приблизительно 3000 до приблизительно 8000, в промежутке от приблизительно 4000 до приблизительно 6000 и/или приблизительно 5000.
Дозированные формы в соответствии с настоящим изобретением содержат от приблизительно 0,1% до приблизительно 50% массы анестезирующего средства, от приблизительно 0,5% до приблизительно 40% массы анестезирующего средства, и/или от приблизительно 1% до приблизительно 30% массы анестезирующего средства.
Другие аспекты настоящего изобретения включают частицы анестезирующего средства, имеющие средний размер частиц менее чем приблизительно 250 мкм, от приблизительно 5 мкм до 250 мкм, от приблизительно 20 мкм до приблизительно 125 мкм и/или от приблизительно 38 мкм до приблизительно 63 мкм.
К тому же дополнительные аспекты в соответствии с настоящим изобретением включают вышеупомянутые дозированные формы с длительным высвобождением, содержащие по меньшей мере одно из следующего: наполнитель, такой как стеариновая кислота, эмульгирующее средство, порообразующее средство, модулятор растворимости для анестезирующего средства и вещество, изменяющее осмотическое давление (осмотический агент).
Другие варианты осуществления настоящего изобретения включают дозированные формы с длительным высвобождением анестезирующего средства, содержащие гелевый носитель кратковременного действия, содержащий сополимер на основе молочной кислоты с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и при этом для образования геля с ним; анестезирующее средство, содержащее бупивакаин, где анестезирующее средство растворено или диспергировано в гелевом носителе; и регулируемый коэффициент эффективности для достижения профиля высвобождения; где средняя молекулярная масса полимера на основе молочной кислоты составляет от приблизительно 3000 до приблизительно 10000.
Дополнительные варианты осуществления настоящего изобретения включают дозированные формы с длительным высвобождением анестезирующего средства, содержащие гелевый носитель кратковременного действия, который включает сополимер молочной кислоты и гликолевой кислоты (PLGA) с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и при этом для образования геля с ним; анестезирующее средство, содержащее бупивакаин, где анестезирующее средство растворено или диспергировано в гелевом носителе; и регулируемый коэффициент эффективности для достижения профиля высвобождения; где средняя молекулярная масса сополимера составляет от приблизительно 3000 до приблизительно 10000.
Настоящее изобретение также включает способы лечения локальной боли у субъекта с использованием дозированной формы с длительным высвобождением, причем способы включают введение дозированной формы кратковременного действия с длительным высвобождением, содержащей гелевый носитель, который включает биоэродируемый биологически совместимый полимер с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и, таким образом, для образования геля; и анестезирующее средство, растворенное или диспергированное в гелевом носителе.
Другие способы включают лечение послеоперационной локальной боли у субъекта с использованием дозированной формы с длительным высвобождением, причем способы включают введение дозированной формы кратковременного действия с длительным высвобождением, содержащей гелевый носитель, который включает биоэродируемый биологически совместимый полимер на основе молочной кислоты или сополимер молочной кислоты и гликолевой кислоты (PLGA), с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и, таким образом, для образования геля; анестезирующее средство, содержащее бупивакаин, растворенный или диспергированный в гелевом носителе; и имеющий регулируемый коэффициент эффективности для достижения профиля высвобождения.
Дозированные формы по настоящему изобретению могут вводиться однократно или повторно. Дозированные формы могут применяться местно в случае локальной боли. В других аспектах настоящего изобретения дозированная форма вводится в виде инъекции в область локализации боли. Анестезирующее средство может доставляться системно или локально. Доставка анестезирующего средства также может проводиться к нескольким участкам, например многократно вокруг области локализации боли.
Другой аспект настоящего изобретения включает способы изготовления дозированной формы с длительным высвобождением, при этом способ включает изготовление гелевого носителя кратковременного действия, содержащего низкомолекулярный биоэродируемый биологически совместимый полимер и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и, таким образом, для образования геля с целью создания раствора или геля полимера/растворителя; уравновешивание раствора или геля полимера/растворителя до получения прозрачного гомогенного раствора или геля, например, при температуре в пределах от комнатной температуры до 65°C; растворение или диспергирование анестезирующего средства в растворе или геле полимера/растворителя; смешивание анестезирующего средства и раствора или геля полимера/растворителя для образования дозированной формы с длительным высвобождением; и регулирование коэффициента эффективности для достижения профиля высвобождения.
Также в соответствии с настоящим изобретением представлены наборы для введения длительно доставляемого анестезирующего средства субъекту с локальной болью, содержащие гелевый носитель кратковременного действия, который содержит биоэродируемый биологически совместимый полимер с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и для образования геля; анестезирующее средство, растворенное или диспергированное в гелевом носителе; и, необязательно, одно или более из следующих: наполнитель, такой как стеариновая кислота, эмульгирующее средство, порообразующее средство, модулятор растворимости для анестезирующего средства, необязательно связанный с анестезирующим средством, и вещество, изменяющее осмотическое давление; где по меньшей мере анестезирующее средство, необязательно связанное с модулятором растворимости, сохраняется отдельно от растворителя до момента введения анестезирующего средства субъекту.
Эти и другие варианты осуществления будут очевидны для специалистов в данной области техники с учетом их раскрытия в данном документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина гидрохлорида in vivo, полученный при использовании композиций с замедленным всасыванием (депо-композиций) по настоящему изобретению (композиции 1-2).
Фиг.2 представляет собой график, иллюстрирующий профиль высвобождения основы бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиция 3-4).
Фиг.3 представляет собой график, иллюстрирующий начальную часть профиля высвобождения (до 7 дня) основы бупивакаина in vivo, полученный при использовании композиции с замедленным всасыванием по настоящему изобретению (композиция 4).
Фиг.4 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 5-6).
Фиг.5 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 6-7).
Фиг.6 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 7-8).
Фиг.7 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 8-9).
Фиг.8 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 10-11).
Фиг.9 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 10, 12).
Фиг.10 представляет собой график, иллюстрирующий начальную часть (до 4 дня) профиля высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 10, 12).
Фиг.11 представляет собой график, иллюстрирующий профиль высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 12, 13).
Фиг.12 представляет собой график, иллюстрирующий начальную часть (до 4 дня) профиля высвобождения бупивакаина in vivo, полученный при использовании композиций с замедленным всасыванием по настоящему изобретению (композиции 12, 13).
Фиг.13 представляет собой диаграмму дифференциальной сканирующей калориметрии (ДСК) низкомолекулярных PLGA с эфирной концевой группой, применяемых для различных композиций по настоящему изобретению (композиции 2, 4, 5, 6 и 7).
Фиг.14 представляет собой диаграмму ДСК низкомолекулярных PLGA с карбоксильной концевой группой, применяемых для различных композиций по настоящему изобретению (композиции 8 и 13).
Фиг.15 представляет собой график, иллюстрирующий in vitro профиль распада полимеров PLGA с вариабельной молекулярной массой и с различными концевыми группами.
ПОДРОБНОЕ ОПИСАНИЕ
В настоящем изобретении представлены системы доставки лекарственных средств и наборы, которые высвобождают анестезирующее средство кратковременного действия, такое как бупивакаин. Также рассматриваются способы введения и изготовления таких систем. Системы доставки лекарственных средств в соответствии с настоящим изобретением включают гелевый носитель кратковременного действия и анестезирующее средство, растворенное или диспергированное в гелевом носителе. Гелевый носитель содержит биоэродируемый биологически совместимый полимер с низкой молекулярной массой и несмешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и образования геля с полимером. В некоторых случаях используется составной растворитель наряду с несмешивающимся с водой растворителем. Коэффициент эффективности, который является одним из способов измерения эффективности системы доставки, может регулироваться, например, составом гелевого носителя для достижения желательного профиля высвобождения. Соотношение полимера и растворителя в гелевом носителе так же, как и выбор несмешивающегося с водой растворителя или смесей растворителей, составного растворителя и/или выбор наполнителя, может влиять на коэффициент эффективности. Кроме того, на коэффициент эффективности может также влиять молекулярная масса полимера и/или средний размер частиц полезного вещества. Коэффициенты эффективности так же, как и введение полезного вещества, могут быть специально заданы на основе потребностей субъекта и могут варьировать от приблизительно 1 до приблизительно 200. В некоторых случаях коэффициенты эффективности могут варьировать от приблизительно 5 до приблизительно 100.
Для послеоперационного обезболивания обычно желательно доставить лекарственное средство с достижением достаточно высокого Cmax анестезирующего средства для практически немедленного обезболивания и затем поддерживать стабильный уровень анестезирующего средства в течение определенного времени. В этом случае может быть желателен более высокий коэффициент эффективности. Однако в других ситуациях для уменьшения потенциальных побочных эффектов высокой дозировки лекарственного средства может быть полезно поддержание строго контролируемого уровня активного вещества как в циркулирующей крови, так и его локального распределения в тканях. Для таких ситуаций может быть желателен более низкий коэффициент эффективности. Также по причине индивидуальных различий у пациентов и терапевтической необходимости желательно регулировать коэффициент эффективности дозированной формы доставки лекарственного средства.
В целом, композиции настоящего изобретения являются гелеподобными и по существу образуют гомогенную непористую структуру по всему объему имплантата при имплантации и в течение доставки лекарственного средства даже при его затвердевании. Кроме того, в то время как полимерный гелевый имплантат будет медленно затвердевать при попадании в водную среду, затвердевший имплантат может удерживать эластичную (мягкую) композицию с температурой стеклования Tg ниже 37°C.
Когда композиция предназначена для имплантации посредством инъекции, вязкость может необязательно модифицироваться эмульгаторами и/или тиксотропными добавками для получения гелевой композиции, имеющей достаточно низкую вязкость, допускающую прохождение гелевой композиции через иглу. Также наряду с обычными фармацевтическими наполнителями и другими добавками, которые не изменяют полезное вещество по настоящему изобретению, к системам имплантации для обеспечения желательного профиля высвобождения из систем имплантации могут быть добавлены порообразующие средства и модуляторы растворимости полезного вещества. Добавление модулятора растворимости к системе имплантации позволяет использовать растворитель, имеющий растворимость 7% или более, для системы имплантации с минимальными выбросами и поддерживать доставку при конкретных обстоятельствах. Однако в настоящее время в системе имплантации предпочтительно использовать по меньшей мере один растворитель, имеющий растворимость в воде менее 7 мас.%, независимо от того, присутствует ли единственный растворитель или как часть смеси растворителей. Также выявлено, что при использовании смесей растворителей, включающих растворитель, имеющий растворимость в воде 7 мас.% или менее, и одного или более смешивающихся растворителей, необязательно имеющих более высокую растворимость, системы имплантации проявляют ограниченное поглощение воды и минимальные выбросы и достигаются стабильные характеристики доставки.
Определения
В описании и формуле настоящего изобретения будет использоваться следующая терминология в соответствии с нижеизложенными определениями.
Формы единственного числа включают в себя ссылки на множественное число, если из контекста явно не следует иначе. Таким образом, например, ссылка на “растворитель” включает в себя единственный растворитель, а также смесь двух или более различных растворителей, ссылка на “анестетик (анестезирующее средство)” включает единственное анестезирующее средство, а также два или более различных анестезирующих средства в комбинации, и т.п.
Термин “коэффициент эффективности” определяется как отношение Cmax/Cсредняя. Сmax – это максимальная достигнутая концентрация полезного вещества, например анестезирующего средства, вскоре после введения дозированной формы. Cсредняя – это средняя концентрация полезного вещества, измеряемая в течение заданного отрезка времени после достижения максимальной концентрации, основанная на продолжительности высвобождения дозированной формы. Например, для дозированной формы с высвобождением в течение семи дней Cmax измеряется через 1 час, и Cсредняя измеряется в течение более 1 дня и до 7 дней.
Фраза “растворенный или диспергированный” подразумевает охват всех средств определения присутствия полезного вещества в гелевой композиции и включает раствор, дисперсию, суспензию и т.п.
Термин “системный” в отношении доставки или введения полезного вещества субъекту означает, что полезное вещество поддается обнаружению на биологически значимом уровне в плазме крови субъекта.
Термин “местный” в отношении доставки или введения полезного вещества субъекту означает, что полезное вещество доставляется в локализованную область у субъекта, но не поддается обнаружению на биологически значимом уровне в плазме крови субъекта.
Термины “кратковременный период” или “кратковременная продолжительность действия” используются взаимозаменяемо и относятся к периоду времени, за который происходит высвобождение полезного вещества из гелевой композиции замедленного всасывания по настоящему изобретению, который в целом будет равен двум неделям или менее, предпочтительно от приблизительно 24 часов до приблизительно 2 недель, предпочтительно приблизительно 10 дням или короче; предпочтительно приблизительно 7 дням или короче, более предпочтительно от приблизительно 3 дней до приблизительно 7 дней.
Термин “гелевый носитель” обозначает композицию, образованную смесью полимера и растворителя в отсутствие полезного вещества.
Термин “модулятор растворимости” в отношении полезного вещества обозначает вещество, которое может изменить растворимость полезного вещества, со ссылкой на полимерный растворитель или воду, в отличие от растворимости полезного вещества в отсутствие модулятора. Модулятор может увеличивать или замедлять растворимость полезного вещества в растворителе или воде. Однако в присутствии высоко водорастворимых полезных веществ модулятор растворимости в целом будет веществом, замедляющим растворимость полезного вещества в воде. Эффекты модуляторов растворимости полезного вещества могут быть результатом взаимодействия модулятора растворимости с растворителем или непосредственно с полезным веществом, а именно с формированием комплексов, или и с тем и другим. Для вышеперечисленных целей при «связывании» модулятора растворимости с полезным веществом предполагаются все вышеупомянутые наблюдающиеся взаимодействия или образования. Модуляторы растворимости по ситуации могут быть смешаны с полезным веществом раньше его комбинирования с вязким гелем или могут быть добавлены к вязкому гелю раньше добавления полезного вещества.
Термины “субъект” и “пациент” в отношении введения композиции по настоящему изобретению обозначают животное или человека.
Так как все растворители, по меньшей мере на молекулярном уровне, являются растворимыми в воде (то есть смешивающимися с водой) с некоторым очень ограниченным исключением, термин “несмешивающийся”, используемый в настоящем изобретении, обозначает, что 7 мас.% или меньше, предпочтительно 5 мас.% или меньше растворителя растворяются или смешиваются с водой. Для раскрытия этого термина принято, что значения растворимости растворителя в воде будут определяться при 25°C. Так как в целом подтверждается, что определение значений растворимости не всегда может проводиться при одинаковых условиях, пределы растворимости, о которых в настоящем изобретении говорится как о проценте по массе, смешивающемся или растворимом в воде, не могут быть абсолютными в части диапазона или в верхнем пределе. Например, если в настоящем изобретении говорится о верхнем пределе растворимости растворителя в воде как о “7 мас.%” и не представлено никаких дополнительных ограничений на растворитель, считается, что растворитель триацетин, который имеет подтвержденную водорастворимость 7,17 граммов на 100 мл воды, будет включен в пределы 7%. Предел растворимости в воде менее 7 мас.%, используемый в настоящем изобретении, не включает в себя растворитель триацетин или растворители, имеющие растворимость в воде, равную или больше, чем у триацетина.
Термин “биоэродируемый” относится к материалу, который постепенно разлагается, растворяется, гидролизуется и/или разрушается in situ. В целом “биоэродируемые” полимеры по настоящему изобретению – это полимеры, которые являются гидролизуемыми и подвергаются биоэродированию in situ прежде всего путем гидролиза.
Термин “низкомолекулярный (НМ) полимер (полимер с низкой молекулярной массой)” относится к биоэродируемым полимерам, имеющим среднюю молекулярную массу в пределах от приблизительно 1000 до приблизительно 10000; предпочтительно от приблизительно 3000 до приблизительно 10000; более предпочтительно от приблизительно 3000 до приблизительно 8000, более предпочтительно от приблизительно 4000 до приблизительно 8000; и более предпочтителен низкомолекулярный полимер, имеющий молекулярную массу приблизительно 7000, приблизительно 6000, приблизительно 5000, приблизительно 4000 и приблизительно 3000 при определении гель-проникающей хроматографией (ГПХ).
Полимер, растворитель и другие вещества по настоящему изобретению должны быть “биологически совместимыми”; это означает, что они не должны вызывать некроз и вызывать допустимые реакции раздражения или воспаления в среде применения. Среда применения – это жидкая среда, она может содержать подкожный, внутримышечный, внутрисосудистый (сосуды с высоким и низким кровотоком), интрамиокардиальный, адвентициальный, внутриопухолевый или интрацеребральный участки, область раны, герметичные суставные щели или полости тела человека или животного.
Термин “алкил”, используемый в настоящем изобретении, относится к группе насыщенных углеводородов, обычно, но необязательно содержащей от 1 до приблизительно 30 атомов углерода, таких как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, октил, децил, и т.п., а также циклоалкильные группы, такие как циклопентил, циклогексил и т.п. В целом, хотя и необязательно, алкильные группы по настоящему изобретению содержат от 1 до приблизительно 12 атомов углерода. Термин “низший алкил” предназначен для алкильной группы размером от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода. “Замещенный алкил” относится к алкилу, замещенному одной или более группой заместителя, а термины “гетероатом-содержащий алкил” и “гетероалкил” относятся к алкилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не определено иначе, термины “алкил” и “низший алкил” включают линейный, разветвленный, циклический, незамещенный, замещенный и/или гетероатом-содержащий алкил или низший алкил.
Термин “арил”, используемый в настоящем изобретении, если не определено иначе, относится к ароматическому заместителю, содержащему единственное ароматическое кольцо или множественные ароматические кольца, конденсированные вместе, связанные ковалентной связью или привязанные к общей группе, такой как метиленовой или этиленовой функциональной группе. Арильные группы содержат предпочтительно одно ароматическое кольцо или два соединенных или связанных ароматических кольца, например фенил, нафтил, дифенил, дифенилэфир, дифениламин, бензофенон, и т.п., и наиболее предпочтительно моноциклические арильные группы. “Замещенный арил” относится к арильной функциональной группе, замещенной одной или более группой заместителей, и термины “гетероатом-содержащий арил” и “гетероарил” относятся к арилу, в котором по меньшей мере один атом углерода заменен гетероатомом. Если не обозначено иначе, термин “арил” включает в себя группы гетероарила, замещенного арила и замещенного гетероарила.
Термин “аралкил” относится к алкильной группе, замещенной на арильную группу, в которой алкил и арил определены выше. Термин “гетероаралкил” относится к алкильной группе, замещенной на гетероарильную группу. Если не обозначено иначе, термин “аралкил” включает в себя группы гетероалкила и замещенного аралкила, а также незамещенные аралкильные группы. В целом термин “аралкил” в настоящем изобретении относится к группам арилзамещенных низших алкилов, предпочтительно фенилзамещенной группе низших алкилов, таких как бензил, фенетил, 1-фенилпропил, 2-фенилпропил, и т.п.
I. Инъецируемые композиции с замедленным всасыванием (депо-композиции):
Как описано выше, инъецируемые композиции с замедленным всасыванием для доставки полезных веществ за короткий период времени могут быть образованы в виде вязких гелей до введения депо-композиции субъекту. Вязкий гель способствует обеспечению адекватных профилей доставки диспергированного полезного вещества, то есть профилей, включающих в себя регуляцию начального выброса полезного вещества, поскольку полезное вещество высвобождается из депо через некоторое время.
Полимер, растворитель и другие вещества по настоящему изобретению должны быть биологически совместимы; это означает, что они не должны вызвать раздражения или некроза в среде применения. Среда применения – это жидкая среда, она может содержать подкожный, внутримышечный, внутрисосудистый (сосуды с высоким и низким кровотоком), интрамиокардиальный, адвентициальный, внутриопухолевый или интрацеребральный участки, область раны, герметичные суставные щели или полости тела человека или животного. В некоторых вариантах осуществления, чтобы избежать или минимизировать системные побочные эффекты, полезное вещество может применяться местно. Гели по настоящему изобретению, содержащие полезное вещество, могут вводиться/имплантироваться непосредственно внутрь или применяться наружно в желательной локализации, например подкожно, внутримышечно, внутрисосудисто, интрамиокардиально, адвентициально, интратуморально или интрацеребрально, в область раны, в герметичные суставные щели или в полости тела человека или животного.
Как правило, вязкий гель вводится в виде инъекции стандартным подкожным шприцем, катетером или троакаром, которые предварительно заполняются полезным веществом – вязкой гелевой композицией в качестве депо. Чаще предпочитается проведение инъекции с использованием самого маленького размера иглы (то есть наименьшего диаметра) или катетера для уменьшения дискомфорта у субъекта при введении подкожно, внутримышечно, внутрисосудисто (сосуды с высоким и низким кровотоком), интрамиокардиально, адвентициально, интратуморально или интрацеребрально, в область раны, в герметичные суставные щели или в полости тела человека или животного.
Желательно иметь возможность вводить гели через иглу или катетер в пределах от 16 калибра и выше, предпочтительно 20 калибра и выше, более предпочтительно 22 калибра и выше, даже более предпочтительно 24 калибра и выше. С очень вязкими гелями, то есть гелями, имеющими вязкость приблизительно 100 пуаз или больше, усилия во время инъекции для продвижения геля в шприце, имеющего иглу в пределах 20-30 размера, могут быть столь велики, что сделать инъекцию вручную трудно или обоснованно невозможно. В то же время высокая вязкость геля желательна для поддержания целостности депо после инъекции и в течение периода дозирования и также способствует заданным характеристикам суспензии полезного вещества в геле.
Определенные преимущества представляет композиция полимера и полимерного растворителя, который необязательно включает в себя вещество, придающее тиксотропные характеристики вязкому гелю, образованному полимерным растворителем и полимером. Тиксотропный гель проявляет пониженную вязкость с приложением сдвигающей силы. Объем снижения вязкости частично является функцией скорости сдвига геля при приложении сдвигающей силы. Когда сдвигающая сила перестает действовать, вязкость тиксотропного геля возвращается к вязкости, равной или близкой к той, которая выявлялась до приложения сдвигающей силы. Соответственно можно приложить сдвигающую силу к тиксотропному гелю при инъекции через шприц или катетер, которые временно уменьшают его вязкость в процессе инъекции. Когда процесс инъекции закончен, сдвигающая сила перестает действовать и гель возвращается очень близко к своему предыдущему состоянию.
Способность композиции для инъекций значительно разжижаться при сдвиге позволяет минимизировать инвазивность доставки полезного вещества через иглу или катетер к различным участкам внешней и/или внутренней поверхности тела. Дополнительная инъекция через иглу или введение катетером позволяет точно воздействовать желательным количеством композиции в желательной локализации при значительном удерживании депо гелевой композиции в месте доставки при обеспечении стабильности доставки полезного вещества от места введения. В некоторых вариантах осуществления катетер для введения может включать устройство дозирования или дополнительное устройство, содействующее точной доставке композиции.
Биоэродируемый биологически совместимый полимер:
Полимеры, являющиеся полезными в соединении со способами и композициями по настоящему изобретению, являются биоэродируемыми, то есть они постепенно распадаются, например, ферментативно или путем гидролиза, растворения, физического разрушения, или дезинтегрируют иначе в жидких средах организма пациента. В целом полимеры биоэродируют в результате гидролиза или физической эрозии, хотя первичным процессом биоэрозии обычно является гидролиз или ферментативное расщепление.
Такие полимеры включают полилактиды, полигликолиды, полиангидриды, полиамины, полиамидоэфиры, полиортоэфиры, полидиоксаноны, полиацетали, поликетали, поликарбонаты, полиортокарбонаты, полифосфазены, сукцинаты, поли(яблочную кислоту), поли(аминокислоты), поливинилпирролидон, полиэтиленгликоль, полигидроксицеллюлозу, полифосфоэфиры, хитин, хитозан, гиалуроновую кислоту и сополимеры, тройные сополимеры и их смеси, но не ограничены вышеперечисленным.
В настоящее время предпочтительными полимерами являются полилактиды, то есть полимер на основе молочной кислоты, который может быть основан исключительно на молочной кислоте или может являться сополимером на основе молочной кислоты и гликолевой кислоты, который может включать небольшие количества другого сомономера, по существу не влияющие на возможные предпочтительные результаты, достигаемые в соответствии с настоящим изобретением. При использовании в настоящем изобретении термин “молочная кислота” включает в себя изомеры L-молочной кислоты, D-молочной кислоты, D,L-молочной кислоты и лактиды, в то время как термин “гликолевая кислота” включает в себя гликолид. Наиболее предпочтительными являются сополимеры поли(лактид-со-гликолида), обычно упоминаемые как PLGA. Полимер может иметь соотношение мономеров молочной кислоты/гликолевой кислоты от приблизительно 100:0 до приблизительно 15:85, предпочтительно от приблизительно 60:40 до приблизительно 75:25 и в особенности полезный сополимер имеет соотношение мономеров молочной кислоты/гликолевой кислоты приблизительно 50:50.
Как обозначено в вышеупомянутом патенте США No. 5242910, полимер может изготовляться в соответствии с указаниями патента США No. 4443340. Альтернативно полимер на основе молочной кислоты может быть приготовлен непосредственно из молочной кислоты или смеси молочной кислоты и гликолевой кислоты (вместе с дополнительным сомономером или без него) в соответствии с технологиями, сформулированными в патенте США No. 5310865. Включены ссылки на содержание всех вышеупомянутых патентов. Подходящий полимер на основе молочной кислоты является коммерчески доступным.
Примеры полимеров включают Поли(D,L-лактид-co-гликолид) 50:50 Resomer® RG502, код 0000366, Поли(D,L-лактид-co-гликолид) 50:50 Resomer® RG502H, PLGA 502-Н, код № 260187, Поли-D,L-лактид (Resomer® R 202, Resomer® R 203); Полидиоксанон (Resomer® X 210) (Boehringer Ingelheim Chemicals, Inc, Petersburg, VA), но не ограничены вышеперечисленным.
Дополнительные примеры включают D,L-лактид/гликолид 100:0 (MEDISORB® Полимер 100 DL High, MEDISORB® Полимер 100 DL Low); D,L-лактид/гликолид 85/15 (MEDISORB® Полимер 8515 DL High, MEDISORB® Полимер 8515 DL Low); D,L-лактид/гликолид 75/25 (MEDISORB® Полимер 7525 DL High, MEDISORB® Полимер 7525 DL Low); DL-лактид/гликолид 65/35 (MEDISORB® Полимер 6535 DL High, MEDISORB® Полимер 6535 DL Low); D,L-лактид/гликолид 54/46 (MEDISORB® Полимер 5050 DL High, MEDISORB® Полимер 5050 DL Low); и D,L-лактид/гликолид 54/46 (MEDISORB® Полимер 5050 DL 2A(3), MEDISORB® Полимер 5050 DL 3A(3), MEDISORB® Полимер 5050 DL 4A(3)) (Medisorb Technologies International L.P., Cincinatti, OH); и Поли-D,L-лактид-co-гликолид 50:50; Поли-D,L-лактид-co-гликолид 65:35; Поли-D,L-лактид-co-гликолид 75:25; Поли-D,L- лактид-co-гликолид 85:15; Поли-D,L-лактид; Поли-L-лактид; Поли-гликолид; Поли- -капролактон; Поли-D,L-лактид-co-капролактон 25:75; и Поли-D,L-лактид-co-капролактон 75:25 (Birmingham Polymers, Inc, Birmingham, AL), но не ограничены вышеперечисленным. -капролактон; Поли-D,L-лактид-co-капролактон 25:75; и Поли-D,L-лактид-co-капролактон 75:25 (Birmingham Polymers, Inc, Birmingham, AL), но не ограничены вышеперечисленным.
К удивлению было выявлено, что гелевые депонируемые композиции для инъекций настоящего изобретения, содержащие низкомолекулярные полимеры, обеспечивают регулируемое стабильное высвобождение полезного вещества за короткую продолжительность времени, равную двум неделям или менее. Профиль скорости высвобождения может регулироваться выбором соответствующего полимера с низкой молекулярной массой, несмешивающегося с водой растворителя, соотношения полимер/растворитель, эмульгирующего вещества, тиксотропного вещества, порообразующего средства, модификатора растворимости для полезного вещества, вещества, изменяющего осмотическое давление, и т.п.
Биологически совместимый полимер присутствует в гелевой композиции в количественных пределах от приблизительно 5 до приблизительно 90 мас.%, предпочтительно от приблизительно 10 до приблизительно 85 мас.%, предпочтительно от приблизительно 15 до приблизительно 80 мас.%, предпочтительно от приблизительно 20 до приблизительно 75 мас.%, предпочтительно от приблизительно 30 до приблизительно 70 мас.% и обычно от приблизительно 35 до приблизительно 65 мас.%, и часто от приблизительно 40 до приблизительно 60 мас.% от массы упомянутого вязкого геля, содержащего объединенные количества биологически совместимого полимера и растворителя. Растворитель добавляется к полимеру в нижеописанных количествах, обеспечивающих композиции депонируемого геля для инъекций.
Растворители и вещества:
Инъецируемые композиции замедленного всасывания по настоящему изобретению содержат несмешивающийся с водой растворитель в дополнение к биоэродируемому полимеру и полезному веществу. В предпочтительных вариантах осуществления описываемые в настоящем изобретении композиции также не содержат растворителей, имеющих смешиваемость с водой более 7 мас.% при 25°C.
Растворитель должен быть биологически совместимым, должен образовывать вязкий гель с полимером и ограничивать поглощение воды имплантатом. Растворитель может быть единственным растворителем или являться смесью растворителей, проявляющих вышеупомянутые свойства. Термин “растворитель”, если специально не обозначено иначе, обозначает единственный растворитель или смесь растворителей. Подходящие растворители по существу ограничивают поглощение воды имплантатом и могут быть охарактеризованы как несмешивающиеся с водой, то есть имеющие растворимость в воде менее 7 мас.%. Предпочтительно растворители имеют растворимость в воде 5 мас.% или менее; более предпочтительно, растворимость в воде 3 мас.% или менее; и наиболее предпочтительно растворимость в воде 1 мас.% или менее. Наиболее предпочтительная растворимость растворителя в воде равна 0,5 мас.% или менее.
Экспериментально смешиваемость с водой может быть определена следующим образом: воду (1-5 г) помещают в тарированную прозрачную емкость при регулируемой температуре приблизительно 20°C, взвешивают и добавляют по капле подходящий растворитель. Раствор вращают для выявления фазового разделения. При достижении точки насыщения, выявляемой наблюдением фазового разделения, раствор оставляют стоять на ночь и снова проверяют на следующий день. Если насыщение раствора все еще продолжается, что выявляется наблюдением фазового разделения, то определяют процент массового соотношения (мас./мас.) добавляемого растворителя. В противном случае добавляется еще большее количество растворителя и процесс повторяется. Растворимость или смешиваемость определяются путем деления полной массы добавляемого растворителя на конечную массу смеси растворитель/вода. При использовании смеси растворителя, например 20% триацетина и 80% бензилбензоата, перед добавлением их к воде они предварительно смешиваются.
Вышеупомянутые полезные растворители по настоящему изобретению в целом имеют растворимость в воде менее 7 мас.%. Растворители, имеющие вышеуказанные параметры растворимости, выбираются из ароматических спиртов, низших алкиловых и аралкиловых эфиров ариловых кислот, таких как бензойная кислота, фталевые кислоты, салициловая кислота, низшие алкиловые эфиры лимонной кислоты, такие как триэтилцитрат и трибутилцитрат и т.п., и арилкетонов, аралкилкетонов и низших алкилкетонов.
Многие из полезных растворителей по настоящему изобретению являются коммерчески доступными (Aldrich Chemicals, Sigma Chemicals) или могут быть приготовлены традиционной этерификацией соответствующих арилалканоловых кислот с использованием галогенангидридов, и необязательно, катализаторов этерификации, как описано в патенте США No.5556905, на который ссылается настоящее изобретение, и в случае кетонов путем окисления их соответствующих вторичных спиртовых прекурсоров.
Предпочтительные растворители, как описано выше, включают в себя ароматические спирты, низшие алкиловые и аралкиловые эфиры ариловых кислот. Представителями кислот являются бензойная кислота и фталевые кислоты, такие как фталевая кислота, изофталевая кислота и терефталевая кислота. Наиболее предпочтительными растворителями являются бензиловый спирт и производные бензойной кислоты, они включают в себя метилбензоат, этилбензоат, н-пропилбензоат, изопропилбензоат, бутилбензоат, изобутилбензоат, вторичный бутилбензоат, третичный бутилбензоат, изоамилбензоат и бензилбензоат, в особенности наиболее предпочитаемый бензилбензоат, но не ограничены вышеперечисленными.
Композиция по настоящему изобретению в дополнение к несмешивающемуся с водой растворителю (растворителям) может также включать один или более дополнительных смешивающихся растворителей (“составных растворителей”), при условии что любой такой дополнительный растворитель не является низшим алканолом. Составные растворители, совместимые и смешивающиеся с исходным растворителем (растворителями), могут иметь более высокую смешиваемость с водой, и получающиеся смеси могут продолжать проявлять значительное ограничение поглощения воды имплантатом. На такие смеси ссылаются как на “смеси составных растворителей”. Полезные смеси составных растворителей могут проявлять более высокую, чем непосредственно исходные растворители, растворимость в воде, обычно в диапазоне между 0,1 мас.% и до 50 мас.% включительно, предпочтительно до 30 мас.% включительно, и наиболее предпочтительно 10 мас.% включительно, не оказывая отрицательного воздействия на ограничение поглощения воды, проявляемое имплантатами настоящего изобретения.
Составными растворителями, полезными для смесей составных растворителей, являются растворители, которые могут смешиваться с исходным растворителем или смесью растворителей, и включают в себя триацетин, диацетин, трибутирин, триэтилцитрат, трибутилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, триэтилглицериды, триэтилфосфат, диэтилфталат, диэтилтартрат, минеральное масло, полибутен, силиконовую жидкость, глицерин, этиленгликоль, полиэтиленгиколь, октанол, этиллактат, пропиленгликоль, пропиленкарбонат, этиленкарбонат, бутиролактон, этиленоксид, пропиленоксид, н-метил-2-пирролидон, 2-пирролидон, глицеролформаль, метилацетат, этилацетат, метилэтилкетон, диметилформамид, диметилсульфоксид, тетрогидрофуран, капролактам, децилметилсульфоксид, олеиновую кислоту и 1-додецилазациклогептан-2-он, и их смеси, но не ограничены вышеперечисленным.
Растворитель или смесь растворителя способны растворять полимер с образованием вязкого геля, который может сохранять частицы полезного вещества в растворенном или диспергированном виде и изолировать их от среды применения до высвобождения. Композиции по настоящему изобретению обеспечивают имплантаты, полезные как для системного, так и местного введения полезного вещества, а именно имплантаты, имеющие низкий индекс выброса. Поглощение воды регулируется с помощью растворителя или смеси составных растворителей, которые растворяют или пластифицируют полимер, но по существу ограничивают поглощение воды имплантатом. Дополнительно, предпочтительные композиции могут обеспечивать вязкие гели, имеющие температуру стеклования менее 37°C, то есть гель остается эластичным на период в 24 часа или более после имплантации.
Композиции, предназначенные для местной доставки полезного вещества, образованы тем же образом, что и предназначенные для системного применения. Однако в связи с тем, что местная доставка полезного вещества не приводит к определяемым в плазме субъекта уровням полезного вещества, у таких систем правильнее определять процент полезного вещества, высвобожденного в заданный начальный период, а не индекс выброса, как представлено в настоящем изобретении. Чаще всего принято, что этот период составляет первые 24 часа после имплантации и процентное содержание будет равно количеству веса полезного вещества, высвобожденного за период (например, 24 часа), разделенному на количество веса полезного вещества, намеченного для доставки в течение всей продолжительности периода доставки; умноженному на 100. Композиции по настоящему изобретению для большинства заявок будут иметь исходные выбросы 40% или менее, предпочтительно 30% или менее, наиболее предпочтительно 20% или менее.
Во многих случаях желательно уменьшить исходный выброс полезного вещества во время местного введения для предотвращения побочных эффектов. Например, имплантаты настоящего изобретения, содержащие химиотерапевтические средства, подходят для прямого введения в опухоли. Однако при системном применении многие химиотерапевтические средства могут проявлять токсические побочные эффекты. Следовательно, терапией выбора может быть местное введение в опухоль. Однако необходимо избегать введения химиотерапевтического средства с большим выбросом, поскольку существует возможность проникновения такого средства в сосудистую или лимфатическую системы, что может вызвать побочные эффекты. Соответственно в таких случаях, как описано выше, является предпочтительным ограничение выброса у имплантируемых систем настоящего изобретения.
В плане коэффициентов эффективности, как правило, для послеоперационного обезболивания желательно доставить лекарственное средство с достижением достаточно высокого Cmax полезного вещества, например анестезирующего средства, для практически немедленного обезболивания и затем поддерживать стабильный уровень анестезирующего средства в течение определенного времени. В этом случае может быть желателен более высокий коэффициент эффективности. Однако в других ситуациях для уменьшения потенциальных побочных эффектов высокой дозировки лекарственного средства может быть полезно поддержание строго контролируемого уровня активного вещества как в циркулирующей крови, так и его локального распределения в тканях. Для таких ситуаций может быть желателен более низкий коэффициент эффективности. Также по причине индивидуальных различий у пациентов и терапевтической необходимости желательно регулировать коэффициент эффективности дозированной формы для доставки лекарственного средства.
Полезные вещества:
При том что для использования в настоящем изобретении не ограничивается выбор подходящих анестезирующих средств, в патенте США No. 6432986, на который ссылается настоящее изобретение, приводится несколько примеров: в одном аспекте настоящего изобретения анестезирующее средство выбирается из группы, состоящей из бупивакаина, лево-бупивакаина, ропивакаина, лево-ропивакаина, тетракаина, этидокаина, лево-этидокаина, декстро-этидокаина, лево-мепивакаина и их комбинации. В других аспектах анестезирующее средство содержит бупивакаин.
Предпочтительно внедрение полезного вещества в вязкий гель, образованный полимером и растворителем в виде частиц, обычно имеющих средний размер от приблизительно 5 до приблизительно 250 мкм, предпочтительно от приблизительно 20 до приблизительно 125 мкм и часто от 38 до 63 мкм.
Для образования суспензии или дисперсии частиц полезного вещества в вязком геле, образованном полимером и растворителем, может использоваться любое традиционное устройство уменьшения усилия сдвига, такое как планетарная мешалка двойного действия Ross а при условиях окружающей среды. Таким образом, по существу может достигаться эффективное распределение полезного вещества без распада полезного вещества. а при условиях окружающей среды. Таким образом, по существу может достигаться эффективное распределение полезного вещества без распада полезного вещества.
Полезное вещество в композиции настоящего изобретения обычно растворено или диспергировано в количестве от приблизительно 0,1 мас.% до приблизительно 50 мас.%, предпочтительно в количестве от приблизительно 0,5 мас.% до приблизительно 40 мас.%, более предпочтительно в количестве от приблизительно 1 мас.% до приблизительно 30 мас.%, и часто от 2 до 20 мас.% от массы общих количеств полимера, растворителя и полезного вещества. В зависимости от количества полезного вещества, присутствующего в композиции настоящего изобретения, можно получить различные профили высвобождения и индексы выброса. Более определенно, для конкретного полимера и растворителя, регулируя количества этих компонентов и количество полезного вещества, можно получить профиль высвобождения, который больше зависит от распада полимера, чем от диффузии полезного вещества из композиции или наоборот. В этом отношении при более низком содержании полезного вещества в целом получается профиль высвобождения, отражающий распад полимера, в котором уровень высвобождения со временем увеличивается. При более высоком содержании в целом получается профиль высвобождения, исходящий из диффузии полезного вещества, в котором уровень высвобождения со временем уменьшается. В промежуточных уровнях содержания получаются комбинированные профили высвобождения, и при желании можно достичь по существу постоянного уровня высвобождения. Для минимизации выброса является предпочтительным содержание полезного вещества порядка 30% или меньше общей массы гелевой композиции по настоящему изобретению, то есть полимера, растворителя и полезного вещества, и более предпочтительно содержание 20% или меньше.
Для обеспечения терапевтически эффективной доставки полезного вещества в течение предусмотренного периода замедленной доставки регулируются уровни высвобождения и содержания полезного вещества. Предпочтительно полезное вещество присутствует в полимерном геле в концентрациях, являющихся вышеописанными концентрациями насыщения полезного вещества в воде для обеспечения резервуара лекарственного средства, из которого распределяется полезное вещество. Так как скорость высвобождения полезного вещества зависит от конкретных обстоятельств, таких как вводимое полезное вещество, возможно получение скоростей высвобождения порядка от приблизительно 0,1 до приблизительно 100 мкг/день, предпочтительно от около 1 до около 10 мкг в день, в течение периода от около 3 дней до около двух недель. Возможно увеличение количества доставленных доз при сокращении продолжительности доставки. В целом при толерантности к большому выбросу возможно применение высокой скорости высвобождения. В случаях хирургической имплантации гелевой композиции или применения «забытого депо» при одновременном проведении оперативного вмешательства по поводу заболевания или другого состояния возможно обеспечение более высоких доз по сравнению с обычным введением имплантата в виде инъекции. Дополнительно, доза полезного вещества может регулироваться в соответствии с объемом имплантируемого геля или вводимого геля для инъекции.
II. Применение и введение:
Средства введения гелевых композиций замедленного всасывания не ограничиваются введением в виде инъекции, хотя этот путь доставки часто может быть предпочтительным. В случае введения гелевой композиции замедленного всасывания в качестве продукта забытого депо она может принимать форму полости организма, образованной после завершения операции, или она может применяться как текучий гель, наносимый кистью или наслаиваемый на остаточную ткань или кость. При таком введении возможно содержание полезного вещества в геле в более высокой, чем обычно концентрации, присутствующей в композициях для инъекций.
Композиции по настоящему изобретению без полезного вещества применяются для заживления ран, репарации кости и в других целях сохранения структуры.
Для дополнительного понимания различных аспектов настоящего изобретения в соответствии со следующими примерами получены результаты, сформулированные в ранее описанных фигурах.
Ниже представлены несколько примеров конкретных вариантов осуществления настоящего изобретения. Примеры предлагаются только для иллюстративных целей и никаким образом не ограничивают объем настоящего изобретения.
Пример 1
Приготовление депонируемого геля
Гелевый носитель, используемый в инъекционных формах замедленного всасывания настоящей композиции, изготовлялся следующим способом. Стеклянная емкость тарировалась на весах Mettler PJ3000 с верхней загрузкой. Поли-(D,L-лактид-co-гликолид) (PLGA), доступный в соотношении 50:50 DL-PLG с характеристической вязкостью 0,15 (PLGA-BPI, Birmingham Polymers, Inc., Birmingham, AL) и 50:50 Resomer® RG502 (PLGA RG 502), навешивался в стеклянную емкость. Содержащая полимер стеклянная емкость тарировалась, и добавлялся соответствующий растворитель. Количества, выраженные в виде процентного содержания различных комбинаций полимера/растворителя, отражены в таблице 1, ниже. Смесь полимера/растворителя перемешивалась со скоростью 250±50 об/мин (электрическая мешалка IKA, IKH-Werke GmbH и Co., Stanfen, Germany) в течение около 5-10 минут с образованием липкой пастообразной субстанции, содержащей полимерные частицы. Емкость, содержащую смесь полимер/растворитель, герметично закупоривали и помещали в терморегулируемый инкубатор, выставленный на 37°C на срок от 1 до 4 дней с периодическим перемешиванием в зависимости от растворителя, типа полимера и соотношения полимера и растворителя. Инкубацию смеси полимер/растворитель прекращали при образовании прозрачного янтарного гомогенного раствора. После этого смесь помещали в термостат (65°C) на 30 минут. Было отмечено, что PLGA растворялся в смеси при удалении из термостата.
Дополнительные гелевые носители замедленного всасывания приготовляли, используя следующие растворители или смеси растворителей: бензилбензоат (“ББ”), бензиловый спирт (“БС”), этилбензоат (“ЭБ”), ББ/БС, ББ/этанол, ББ/ЭБ и следующие полимеры: Поли-(D,L-лактид) Resomer® L104, PLA-L104, кодовый № 33007, Поли-(D,L-лактид-co-гликолид) 50:50 Resomer® RG502, кодовый № 0000366, Поли-(D,L-лактид-co-гликолид) 50:50 Resomer® RG502H, PLGA 502-Н, кодовый № 260187, Поли-(D,L-лактид-co-гликолид) 50:50 Resomer® RG503, PLGA-503, кодовый № 0080765, Поли-(D,L-лактид-co-гликолид) 50:50 Resomer® RG755, PLGA-755, кодовый № 95037, Поли-L-лактид MW 2000 (Resomer® L 206, Resomer® L 207, Resomer® L 209, Resomer® L 214); Поли-D,L-лактид (Resomer® R 104, Resomer® R 202, Resomer® R 203, Resomer® R 206, Resomer® R 207, Resomer® R 208); Поли-L-лактид-co-D,L-лактид 90:10 (Resomer® LR 209); Поли-D-L-лактид-co-гликолид 75:25 (Resomer® RG 752, Resomer® RG 756); Поли-D,L-лактид-co-гликолид 85:15 (Resomer® RG 858); Поли-L-лактид-co-триметилена карбонат 70:30 (Resomer® LT 706); Полидиоксанон (Resomer® X 210) (Boehringer Ingelheim Chemicals, Inc., Petersburg, VA); DL-лактид/гликолид 100:0 (MEDISORB® Polymer 100 DL High, MEDISORB® Polymer 100 DL Low); DL-лактид/гликолид 85/15 (MEDISORB® Polymer 8515 DL High, MEDISORB® Polymer 8515 DL Low); DL-лактид/гликолид 75/25 (MEDISORB® Polymer 7525 DL High, MEDISORB® Polymer 7525 DL Low); DL- лактид/гликолид 65/35 (MEDISORB® Polymer 6535 DL High, MEDISORB® Polymer 6535 DL Low); DL-лактид/гликолид 54/46 (MEDISORB® Polymer 5050 DL High, MEDISORB® Polymer 5050 DL Low); и DL-лактид/гликолид 54/46 (MEDISORB® Polymer 5050 DL 2A(3), MEDISORB® Polymer 5050 DL 3A(3), MEDISORB® Polymer 5050 DL 4A(3)) (Medisorb Technologies International L.P., Cincinnati, OH); и Поли-D,L-лактид-со-гликолид 50:50; Поли-D,L-лактид-со-гликолид 65:35; Поли-D,L-лактид-со-гликолид 75:25; Поли-D,L- лактид-со-гликолид 85:15; Поли-D,L-лактид; Поли-L-лактид; Поли-гликолид; Поли- -капролактон; Поли-D,L-лактид-co-капролактон 25:75; и Поли-D,L-лактид-co-капролактон 75:25 (Birmingham Polymers, Inc., Birmingham, AL). -капролактон; Поли-D,L-лактид-co-капролактон 25:75; и Поли-D,L-лактид-co-капролактон 75:25 (Birmingham Polymers, Inc., Birmingham, AL).
Пример 2
Приготовление основания бупивакаина
Бупивакаина гидрохлорид (Sigma-Aldrich Corporation, St. Louis, MO) растворяли в деионизированной воде (ДВ) при концентрации в 40 мг/мл (насыщение). Расчетное количество гидроксида натрия (1-нормальный раствор) добавляли к раствору, и pH конечной смеси доводили до 10 для преципитации основания БП (бупивакаинового препарата). Продукт преципитации фильтровали и затем промывали ДВ по меньшей мере три раза. Продукт преципитации высушивали при температуре около 40°C в вакууме в течение 24 часов.
Пример 3
Приготовление бупивакаиновой частицы
Частицы лекарственного средства бупивакаин при использовании бупивакаина гидрохлорида (Sigma-Aldrich Corporation, St. Louis, МО) или основания бупивакаина, приготовленного согласно примеру 4, и соль гидрохлорида приготовляли следующим образом. Бупивакаин растирался и затем просеивался до заданного диапазона с использованием 3″ фильтра из нержавеющей стали. Обычные диапазоны составляли от 25 мкм до 38 мкм, от 38 мкм до 63 мкм и от 63 мкм до 125 мкм.
Пример 4
Приготовление частицы бупивакаин-стеариновая кислота
Частицы бупивакаина приготовляли следующим образом: бупивакаина гидрохлорид (100 г, Sigma-Aldrich Corporation, St. Louis, МО) растирался и просеивался через фильтры в 63-125 микрон. Частицы бупивакаина и стеариновую кислоту (100 г, чистота 95%, Sigma-Aldrich Corporation, St. Louis, МО) перемешивали и растирали. Полученный после растирания материал спрессовывали в круглой форме диаметром 13 мм с силой 5000 фунтов в течение 5 минут. Спрессованные таблетки растирали и просеивали через сито номер 120 с последующим просеиванием через сито номер 230 для получения частиц, имеющих размеры в диапазоне 63-125 микрон.
Пример 5
Содержание лекарственного средства
К гелевому носителю в количестве 10-30 мас.% добавляли частицы, содержащие полезное вещество или вместе со стеариновой кислотой, или без нее, приготовленное вышеупомянутым способом, и смешивали вручную до полного смачивания сухого порошка. После этого молочная светло-желтая смесь частиц/геля тщательно перемешивалась традиционным смешиванием с использованием механической мешалки Caframo, снабженной металлической лопаткой с квадратным наконечником. Полученные в результате композиции показаны ниже в таблицах 1-3.
| Таблица 1 |
| Состав |
PLGA RG502а (мас.%) |
Низкомолекулярный PLGAb (мас.%) |
Бензилбензоат (мас.%) |
| 1c |
45 |
0 |
45 |
| 2c |
0 |
45 |
45 |
| 3d |
45 |
0 |
45 |
| 4d |
0 |
45 |
45 |
| |
a=PLGA RG 502, молекулярная масса ММ=16000.
b=Низкомолекулярная масса (НММ, ММ=8000) PLGA со сложноэфирной концевой группой.
c=10% содержание бупивакаина гидрохлорида.
d=10% содержание основания бупивакаина. |
|
| Таблица 2 |
| Состав |
Низкомолекулярный PLGAf (мас.%) |
Низкомолекулярный PLGAcg (мас.%) |
Бензилбензоат (мас.%) |
Бензиловый спирт (мас.%) |
| 5h |
58,5 |
0 |
31,5 |
0 |
| 6h |
58,5 |
0 |
0 |
31,5 |
| 7h |
67,5 |
0 |
0 |
22,5 |
| 8h |
0 |
67,5 |
0 |
22,5 |
| 9i |
0 |
60 |
0 |
20 |
f=Низкомолекулярная масса (НММ, ММ=8000) PLGA со сложноэфирной концевой группой.
g=Низкомолекулярная масса (НММ, ММ=10000) PLGA с карбоксильной концевой группой.
h=10% содержание бупивакаина гидрохлорида.
i=содержание 10% бупивакаина гидрохлорида и 10% стеариновой кислоты СК. |
| Таблица 3 |
| Состав |
Низкомолекулярный PLGAcj(мас.%) |
Бензилбензоат (мас.%) |
Бензиловый спирт (мас.%) |
| 10k |
52,5 |
0 |
17,5 |
| 11l |
52,5 |
0 |
17,5 |
| 12k |
45,5 |
0 |
24,5 |
| 13k |
45,5 |
12,3 |
12,3 |
| j=Низкомолекулярная масса (НММ, ММ=10000) PLGA с карбоксильной концевой группой. |
k=30% содержание бупивакаина гидрохлорида, размер частиц 63-125 мкм.
l=30% содержание бупивакаина гидрохлорида, размер частиц 38-63-мкм. |
В соответствии с вышеприведенными процедурами приготовлено репрезентативное количество имплантируемых гелевых композиций с замедленным всасыванием и протестировано in vitro на высвобождение полезного вещества в зависимости от времени, а также в исследованиях in vivo у крыс для определения высвобождения полезного вещества по определению концентраций полезного вещества в плазме крови в зависимости от времени.
В соответствии с вышеприведенными процедурами также приготовлено репрезентативное количество имплантируемых гелевых композиций с замедленным всасыванием и протестировано в исследованиях in vivo у крыс для определения локального высвобождения полезного вещества по определению его в образцах тканей в зависимости от времени.
Пример 6A
Бупивакаин в исследованиях in vivo
Исследования in vivo у крыс (4 или 5 на группу) выполнялись в соответствии с открытым протоколом определения уровней бупивакаина в плазме при системном введении бупивакаина через имплантируемые системы по настоящему изобретению. Одноразовые шприцы 0,5 см3 заполняли гелевыми композициями бупивакаина с замедленным всасыванием. Одноразовые иглы 18 калибра соединяли со шприцами и нагревали до 37°C с использованием циркулярной ванны. Крысам вводили гелевые композиции бупивакаина с замедленным всасыванием, и в определенные интервалы времени (через 1 час, 4 часа и на 1, 2, 5, 7, 9, 14, 21 и 28 день) забиралась кровь и анализировалась на бупивакаин с использованием жидкостной хроматографии – масс-спектрометрии (ЖХ/МС).
Пример 6B
Исследование местного введения бупивакаина
Исследования in vivo у крыс (4 или 5 на группу) выполнялись в соответствии с открытым протоколом определения уровней бупивакаина в плазме при местном введении бупивакаина через имплантируемые системы внедрения настоящего изобретения. Одноразовые шприцы 0,5 см3 заполняли гелевыми составами бупивакаина с замедленным всасыванием. Одноразовые иглы 18 калибра соединяли со шприцами и нагревали до 37°C с использованием циркулярной ванны. Крысам вводили гелевые композиции бупивакаина с замедленным всасыванием, и в определенные интервалы времени (через 1 час, 4 часа и на 1, 2, 5, 7, 9, 14, 21 и 28 день) забирались образцы тканей и гомогенизировались. Анализ на бупивакаин, экстрагированный из тканей, проводился с использованием ЖХ/МС.
Пример 7
Высвобождение бупивакаина за короткий период
На фиг.1, 2 и 3 показаны репрезентативные профили высвобождения бупивакаина гидрохлорида и основания бупивакаина из различных композиций с замедленным всасыванием, полученные in vivo у крыс, включая композиции настоящего изобретения. Высвобождение композиций с замедленным всасыванием с низкомолекулярным PLGA (композиции 2 и 4 на фиг.1, 2 и 3) in vivo имеет профиль, показывающий краткую продолжительность высвобождения в течение около 7 дней, сопоставимый с контрольными композициями (с PLGA с более высокой молекулярной массой). Таким образом, инъекционные гелевые композиции замедленного всасывания настоящего изобретения, содержащие низкомолекулярные полимеры, обеспечивают регулируемое стабильное высвобождение полезного вещества за короткий период времени, равный двум неделям или меньше.
Как показано в таблицах 2 и 3 и на фиг.1-12, различные композиции замедленного всасывания могут быть изготовлены из низкомолекулярного PLGA или с эфирной или карбоксильной концевой группой с использованием различных растворителей, таких как бензилбензоат (ББ), бензиловый спирт (БС), этилбензоат (ЭБ), смесей ББ/этанол, ББ/БС, ББ/ЭБ и т.д., с вариабельными соотношениями полимера/растворителя, содержанием лекарственного средства и формами лекарственного средства. Частицы лекарственного средства могут быть изготовлены или вместе с гидрофобными наполнителями, такими как стеариновая кислота (СК), или без нее.
Пример 8
Влияние растворителя на высвобождение бупивакаина
Фиг.4 показывает репрезентативные профили высвобождения бупивакаина in vivo у крыс, полученные от композиций с замедленным всасыванием, изготовленных из низкомолекулярного PLGA в ББ или же в БС (композиции 5 и 6). Фиг.11 и 12 показывают репрезентативные профили высвобождения бупивакаина in vivo у крыс, полученные от композиций с замедленным всасыванием, изготовленных из низкомолекулярного PLGA в БС или же в смеси БС с ББ (БС/ББ, 50/50) (композиции 12 и 13). Профили уровня высвобождения бупивакаина из депо такой короткой продолжительности могут изменяться и регулироваться используемым в композициях растворителем. В итоговой таблице 4 показано, что на Cmax, Cсреднее и коэффициент эффективности (Cmax/Cсреднее) может оказывать влияние растворитель, используемый в композициях с замедленным всасыванием.
| Таблица 4 |
| Состав |
Cmax a |
Ссреднее b |
Коэффициент эффективности |
| 5с |
147±51 |
26±34 |
5,7 |
| 6с |
417±53 |
5±3 |
83,4 |
| 12d |
350±55 |
21±8 |
16,6 |
| 13d |
229±90 |
29±21 |
7,9 |
a=Cmax=максимальная концентрация бупивакаина в плазме;
b=Ссреднее=средняя концентрация бупивакаина в плазме от 2 дня до 9 дня;
c=10% содержание бупивакаина гидрохлорида;
d=30% содержание бупивакаина гидрохлорида. |
Пример 9
Влияние соотношений полимер/растворитель
на высвобождение бупивакаина
Фиг.5 показывает репрезентативные профили высвобождения бупивакаина in vivo у крыс, полученные от композиций с замедленным всасыванием, изготовленных из низкомолекулярного PLGA с эфирной концевой группой в БС с различными соотношениями полимера/растворителя (композиции 6 и 7). Фиг.9 и 10 показывают репрезентативные профили высвобождения бупивакаина in vivo у крыс, полученные от композиций с замедленным всасыванием, изготовленных из низкомолекулярного PLGA с карбоксильной группой в БС с различными соотношениями полимера/растворителя (композиции 10 и 12). Профили уровня высвобождения бупивакаина из депо такой короткой продолжительности могут изменяться и регулироваться соотношениями полимера/растворителя в композициях. В итоговой таблице 5 показано, что на Cmax, Cсреднее и коэффициент эффективности (Cmax/Cсреднее) могут оказывать влияние соотношения полимера/растворителя в композициях с замедленным всасыванием.
| Таблица 5 |
| Состав |
Cmax a |
Ссреднее b |
Коэффициент эффективности |
| 6с |
417±53 |
5±3 |
83,4 |
| 7с |
177±62 |
12±6 |
14,8 |
| 10d |
235±72 |
25±13 |
9,6 |
| 12d |
350±55 |
21±8 |
16,6 |
a=Cmax=максимальная концентрация бупивакаина в плазме;
b=Ссреднее=средняя концентрация бупивакаина в плазме от 2 дня до 9 дня;
с=10% содержание бупивакаина гидрохлорида, низкомолекулярный PLGA с эфирной концевой группой, ММ=8000;
d=30% содержание бупивакаина гидрохлорида, низкомолекулярный PLGA с карбоксильной концевой группой, ММ=10000. |
Пример 10
Влияние наполнителя лекарственного средства
на высвобождение бупивакаина
Фиг.7 показывает репрезентативные профили высвобождения бупивакаина in vivo у крыс, полученные от композиций с замедленным всасыванием, изготовленных из низкомолекулярного PLGA в БС с частицами лекарственного средства, полученных вместе с СК или без него (композиции 8 и 9). Профили уровня высвобождения бупивакаина из депо такой короткой продолжительности могут изменяться и регулироваться наполнителем лекарственного средства, использованного в композициях. В итоговой таблице 6 показано, что на Cmax, Cсреднее и коэффициент эффективности (Cmax/Cсреднее) может оказывать влияние наполнитель лекарственного средства, такой как стеариновая кислота, используемый в композициях с замедленным всасыванием.
| Таблица 6 |
| Состав |
Cmax a |
Ссреднее b |
Коэффициент эффективности |
| 8c |
128±22 |
24±18 |
5,3 |
| 9d |
79±22 |
17±6 |
4,6 |
a=Cmax=максимальная концентрация бупивакаина в плазме;
b=Ссреднее=средняя концентрация бупивакаина в плазме от 2 дня до 9 дня;
c=10% содержание бупивакаина гидрохлорида, низкомолекулярный PLGA с карбоксильной концевой группой, ММ=10000;
d=20% содержание бупивакаина гидрохлорида, спрессованного с 10% стеариновой кислотой, низкомолекулярным PLGA с карбоксильной концевой группой, ММ=10000; |
Пример 11
Измерения полимеров PLGA
дифференциальным сканирующим калориметром (ДСК)
Температуру стеклования различных низкомолекулярных полимеров PLGA, используемых в настоящем изобретении, определяли, используя дифференциальный сканирующий калориметр (ДСК) (Perkin Elmer Pyris 1, Shelton, CT). Кювета для образцов ДСК тарировалась на весах Mettler PJ3000 с верхней загрузкой. В кювету помещали по меньшей мере 20 мг образца полимера. Массу образца регистрировали. Кювету закрывали крышкой от кюветы ДСК и для герметизации кюветы использовали пресс. Сканирование температуры проводилось с приращением в 10°C от -50°C до 90°C.
Фиг.13 и 14 показывают различия в диаграммах ДСК низкомолекулярных PLGA, используемых в композициях согласно настоящему изобретению, с эфирной концевой группой или карбоксильной концевой группой. Фиг.13 показывает диаграмму ДСК низкомолекулярного PLGA (соотношение лактид/гликолид (Л/Г) 50/50, ММ=8000) с эфирной концевой группой. Фиг.14 показывает диаграмму ДСК низкомолекулярного PLGA (соотношение лактид/гликолид (Л/Г) 50/50, ММ=10000) с карбоксильной концевой группой. Эти данные демонстрируют, что низкомолекулярные полимеры PLGA, используемые в настоящем изобретении, имеют температуру стеклования (Tg) выше 30°C.
Пример 12
Распад полимеров PLGA in vitro
Для определения уровня потери массы полимера PLGA в зависимости от времени устанавливали in vitro при 37°C в физиологическом растворе с фосфатным буфером (PBS) профили распада низкомолекулярных полимеров PLGA, используемых в настоящем изобретении. Каждый из сополимеров содержал один набор образца. Спрессовывали примерно 25 дисков (каждый по 100±5 мг) с использованием формы диаметром 13 мм из нержавеющей стали. Образец спрессовывали с силой 10 тонн в течение примерно 10 мин, используя Carver Press. Диски хранились в стеклянной пробирке в вакуумном термостате при температуре окружающей среды и 25 мм ртутного столба (Hg) до готовности к использованию в деградационной ванне. Эту процедуру повторяли для каждого тестируемого полимера. Приготовляли фосфатно-буферный солевой раствор (PBS) (50 ммоль, pH 7,4) с азидом натрия (0,1 N). В тарированной пробирке взвешивали один диск образца и регистрировали данные как исходную массу (Mисх). Из пипетки в каждую пробирку капали PBS (10 мл). Пробирку надежно закрывали и помещали в водяную баню-шейкер при 37°C. Буфер заменяли два раза в неделю, перед каждой заменой регистрировали pH раствора. В предварительно определенные моменты времени образцы вынимали из буферной ванны, ополаскивали деионизированной водой Milli-Q, высушивали их поверхностно и взвешивали. Массу образца регистрировали как мокрую массу (Mмокрая). Образец помещали в 10-мл пробирку для лиофилизации и помещали в морозильник (-20°C) до лиофилизации. После лиофилизации образцы снова взвешивали и данные регистрировали как сухую массу (Mлиофилизированная). Процент потери массы определяли как {(Mлиофилизированный)-Mисх)/Mисх}×100%.
Фиг.15 показывает профили потери массы из трех PLGA, используемых в вышеописанных составах. По этой фигуре можно отметить, что каждый из этих трех используемых полимеров по скорости распада значительно отличается друг от друга. Низкомолекулярный PLGA как с эфирной концевой группой, так и с карбоксильной концевой группой имеет значительно большую скорость распада, чем PLGA с более высокой молекулярной массой. Это более благоприятно по отношению к депо короткой продолжительности, для которого предпочтительным является распад полимера с момента высвобождения активных веществ из депо. В соответствии с различными аспектами настоящего изобретения возможно получение одного или более значительных преимуществ. Более определенно, используя простые этапы обработки, возможно получение гелевой композиции с замедленным всасыванием, которая без хирургического вмешательства может инъецироваться в какое-либо место у животного с использованием слабой распределяющей силы через стандартные иглы. Будучи однократно введенной, композиция быстро возвращается к своей первоначальной вязкости и может проявлять быстрое застывание, чтобы по существу избегать эффекта выброса и обеспечивать желательный профиль высвобождения полезного вещества. Кроме того, после полного однократного введения полезного вещества нет никакой необходимости в удалении композиции, так как она является полностью биоразлагаемой. Дополнительным преимуществом также является возможность избежать использования в настоящем изобретении технологий микрочастиц или микрокапсулирования, способных разлагать некоторые полезные вещества, такие как лекарственные препараты на основе пептидов и нуклеиновой кислоты и, возможно, трудноудаляемых из среды применения упомянутых микрочастиц и микрокапсул. Так как при образовании вязкого геля нет необходимости в воде, крайних значениях температуры или в других растворителях, суспендированные частицы полезного вещества остаются сухими и в своей первоначальной конфигурации, что содействует стабильности вышеуказанных частиц. Дополнительно, после образования массы гелевая композиция для инъекций с замедленным всасыванием при желании может быть извлечена из среды применения.
Пример 13
Влияние средней молекулярной массы на высвобождение бупивакаина
Фиг.6 показывает репрезентативные профили высвобождения бупивакаина in vivo у крыс, полученные от композиций с замедленным всасыванием, изготовленных из низкомолекулярного PLGA (8000) с эфирной концевой группой в БС (композиция 7) и низкомолекулярного PLGA (10000) с карбоксильной концевой группой в БС (композиция 8). Профили уровня высвобождения бупивакаина из депо такой короткой продолжительности могут изменяться и регулироваться молекулярной массой полимера и/или концевой группой в PLGA, используемых в композициях.
Пример 14
Влияние среднего размера частиц полезного вещества
на высвобождение бупивакаина
Фиг.8 показывает репрезентативные профили высвобождения бупивакаина in vivo у крыс, полученные от композиций с замедленным всасыванием, изготовленных из низкомолекулярного PLGA (10000) с карбоксильной концевой группой в БС со средним размером частиц бупивакаина гидрохлорида 63-125 мкм (композиция 10) и 38-63 мкм (композиция 11). Профили уровня высвобождения бупивакаина из депо такой короткой продолжительности могут изменяться и регулироваться средним размером частиц активного вещества.
Формула изобретения
1. Дозированная форма анестезирующего средства с длительным высвобождением, содержащая:
гелевый носитель кратковременного действия, включающий биоэродируемый, биологически совместимый полимер со средней молекулярной массой приблизительно от 3000 до 10000 Дальтон и не смешивающийся с водой растворитель, в количестве, эффективном для пластификации полимера и образования геля с вышеупомянутым полимером; и
анестезирующее средство, растворенное или диспергированное в гелевом носителе,
при этом дозированная форма с длительным высвобождением дополнительно имеет регулируемый коэффициент эффективности для достижения профиля высвобождения.
2. Дозированная форма с длительным высвобождением по п.1, где коэффициент эффективности находится приблизительно между 1 и 200, предпочтительно приблизительно между 5 и 100.
3. Дозированная форма с длительным высвобождением по п.1, где длительное высвобождение происходит за период, меньший или равный приблизительно четырнадцати дням, предпочтительно, длительное высвобождение происходит за период, меньший или равный приблизительно семи дням и, более предпочтительно, длительное высвобождение продолжается в течение периода приблизительно от 24 ч до семи дней.
4. Дозированная форма с длительным высвобождением по п.1, где анестезирующее средство выбрано из группы, состоящей из бупивакаина, левобупивакаина, ропивакаина, леворопивакаина, тетракаина, этидокаина, левоэтидокаина, декстроэтидокаина, левомепивакаина и их комбинаций.
5. Дозированная форма с длительным высвобождением по п.1, где анестезирующее средство содержит бупивакаин.
6. Дозированная форма с длительным высвобождением по п.1, где растворитель имеет смешиваемость с водой меньше или равную приблизительно 7 мас.% при 25°С.
7. Дозированная форма с длительным высвобождением по п.1, где дозированная форма не содержит растворителей, имеющих смешиваемость с водой более 7 мас.% при 25°С.
8. Дозированная форма с длительным высвобождением по п.1, где растворитель выбран из группы, состоящей из ароматического спирта, низших алкиловых эфиров ариловых кислот, низших аралкиловых эфиров ариловых кислот; арилкетонов, аралкилкетонов, низших алкилкетонов, низших алкиловых эфиров лимонной кислоты, и их комбинаций.
9. Дозированная форма с длительным высвобождением по п.1, где растворитель содержит компонент, выбранный из группы, состоящей из бензилового спирта, бензилбензоата, этилбензоата, триацетина и из смесей.
10. Дозированная форма с длительным высвобождением по п.1, где растворитель содержит составной растворитель, выбранный из группы, состоящей из триацетина, диацетина, трибутирина, триэтилцитрата, трибутилцитрата, ацетилтриэтилцитрата, ацетилтрибутилцитрата, триэтилглицеридов, триэтилфосфата, диэтилфталата, диэтилтартрата, минерального масла, полибутена, силиконовой жидкости, глицерина, этиленгликоля, полиэтиленгликоля, октанола, этиллактата, пропиленгликоля, пропиленкарбоната, этиленкарбоната, бутиролактона, этиленоксида, пропиленоксида, N-метил-2-пирролидона, 2-пирролидона, глицеролформаля, метилацетата, этилацетата, метилэтилкетона, диметилформамида, диметилсульфоксида, тетрагидрофурана, капролактама, децилметилсульфоксида, олеиновой кислоты и 1-додецилазациклогептан-2-она и их комбинаций.
11. Дозированная форма с длительным высвобождением по п.1, где полимер содержит полимер на основе молочной кислоты, или сополимер молочной кислоты и гликолевой кислоты (PLGA), или полимер на основе капролактона, или выбран из группы, состоящей из полилактидов, полигликолидов, поли(капролактона), полиангидридов, полиаминов, полиамидоэфиров, полиортоэфиров, полидиоксанонов, полиацеталей, поликеталей, поликарбонатов, полифосфоэфиров, полиэфиров, полибутилентерефталата, полиортокарбонатов, полифосфазенов, сукцинатов, поли(яблочной кислоты), поли(аминокислот), поливинилпирролидона, полиэтиленгликоля, полигидроксицеллюлозы, полисахаридов, хитина, хитозана, гиалуроновой кислоты и сополимеров, тройных сополимеров и их смесей.
12. Дозированная форма с длительным высвобождением по п.11, где полимер содержит сополимер молочной кислоты и гликолевой кислоты (PLGA) и где сополимер имеет соотношение мономеров молочной кислоты и гликолевой кислоты приблизительно 50:50.
13. Дозированная форма с длительным высвобождением по п.11 или 12, где полимер содержит эфирную концевую группу или концевую группу карбоновой кислоты.
14. Дозированная форма с длительным высвобождением по п.1, где, предпочтительно, полимер имеет среднюю молекулярную массу приблизительно между 3000 и 8000, более предпочтительно полимер имеет среднюю молекулярную массу приблизительно между 4000 и 6000, еще более предпочтительно полимер имеет среднюю молекулярную массу приблизительно 5000.
15. Дозированная форма с длительным высвобождением по п.1, где дозированная форма содержит от приблизительно 0,1 до приблизительно 50 мас.% анестезирующего средства, предпочтительно дозированная форма содержит от приблизительно 0,5 до приблизительно 40 мас.% анестезирующего средства и более предпочтительно дозированная форма содержит от приблизительно 1 до приблизительно 30 мас.% анестезирующего средства.
16. Дозированная форма с длительным высвобождением по п.1, где соотношение между полимером и растворителем находится в диапазоне между приблизительно 5:95 и приблизительно 90:10, предпочтительно соотношение между полимером и растворителем находится в диапазоне между приблизительно 20:80 и приблизительно 80:20 и более предпочтительно соотношение между полимером и растворителем находится в диапазоне между приблизительно 30:70 и приблизительно 75:25.
17. Дозированная форма с длительным высвобождением по п.1, дополнительно содержащая по меньшей мере одно из следующего: наполнитель, эмульгирующее средство, порообразующее средство, модулятор растворимости для анестезирующего средства и вещество, изменяющее осмотическое давление.
18. Дозированная форма с длительным высвобождением по п.1, где анестезирующее средство содержит частицы, имеющие средний размер менее приблизительно 250 мкм, предпочтительно анестезирующее средство содержит частицы, имеющие средний размер от приблизительно 5 до 250 мкм, более предпочтительно средний размер частиц составляет от приблизительно 20 до приблизительно 125 мкм и более предпочтительно средний размер частиц составляет от приблизительно 38 до приблизительно 63 мкм.
19. Дозированная форма с длительным высвобождением по п.1, где полимер содержит полимер на основе молочной кислоты, а анестезирующее средство содержит бупивакаин.
20. Дозированная форма с длительным высвобождением по п.19, где полимер содержит сополимер молочной кислоты и гликолевой кислоты (PLGA).
21. Дозированная форма с длительным высвобождением по п.20, где сополимер имеет соотношение мономеров молочной кислоты и гликолевой кислоты приблизительно 50:50.
22. Дозированная форма с длительным высвобождением по п.20 или 21, где сополимер содержит поли (D,L-лактид-со-гликолид).
23. Дозированная форма с длительным высвобождением по п.20 или 21, где сополимер содержит поли (L-лактид-со-гликолид).
24. Применение анестезирующего средства в изготовлении дозированной формы с длительным высвобождением по п.1 для лечения локальной боли у субъекта.
25. Применение по п.24, в котором дозированная форма предназначена для однократного введения.
26. Применение по п.24, в котором дозированная форма предназначена для местного применения к очагу локальной боли, или дозированная форма предназначена для инъекции вблизи очага локальной боли, или дозированная форма предназначена для системной доставки анестезирующего средства, или дозированная форма предназначена для доставки анестезирующего средства к нескольким участкам.
27. Применение по п.26, в котором дозированная форма предназначена для инъекции в несколько участков вокруг очага локальной боли.
28. Применение по п.24, в котором дозированная форма предназначена для повторного введения.
29. Применение бупивакаина в изготовлении дозированной формы с длительным высвобождением, содержащей гелевый носитель кратковременного действия, включающий биоэродируемый, биологически совместимый полимер на основе молочной кислоты со средней молекулярной массой приблизительно от 3000 до 10000 и не смешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и для образования геля с вышеупомянутым полимером; анестезирующее средство, содержащее бупивакаин, растворенный или диспергированный в гелевом носителе и имеющий регулируемый коэффициент эффективности для достижения профиля высвобождения; где дозированная форма предназначена для лечения послеоперационной локальной боли у субъекта.
30. Применение по п.29, в котором полимер содержит сополимер молочной кислоты и гликолевой кислоты (PLGA).
31. Применение по п.30, в котором сополимер имеет соотношение мономеров молочной кислоты и гликолевой кислоты приблизительно 50:50.
32. Способ изготовления дозированной формы с длительным высвобождением, включающий:
приготовление гелевого носителя, который содержит биоэродируемый, биосовместимый полимер со средней молекулярной массой приблизительно от 3000 до 10000 и не смешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и для образования геля с вышеупомянутым полимером, с получением раствора или геля полимер/растворитель;
уравновешивание смеси полимер/растворитель до получения прозрачного гомогенного раствора или геля;
причем уравновешивание раствора или геля полимер/растворитель происходит при температуре в пределах от комнатной температуры до приблизительно 65°С;
растворение или диспергирование анестезирующего средства в растворе или геле полимера/растворителя;
смешивание анестезирующего средства и раствора или геля полимера/растворителя для образования дозированной формы с длительным высвобождением и
регулирование коэффициента эффективности для достижения профиля высвобождения.
33. Способ по п.32, в котором анестезирующее средство содержит бупивакаин.
34. Набор для введения анестезирующего средства с замедленным высвобождением субъекту с локальной болью, содержащий:
гелевый носитель кратковременного действия, который содержит биоэродируемый, биосовместимый полимер со средней молекулярной массой приблизительно от 3000 до 10000 и не смешивающийся с водой растворитель в количестве, эффективном для пластификации полимера и для образования геля с вышеупомянутым полимером;
анестезирующее средство, растворенное или диспергированное в гелевом носителе, и, необязательно, одно или более из следующего:
наполнитель;
эмульгирующее средство;
порообразующее средство;
модулятор растворимости для анестезирующего средства, необязательно связанный с анестезирующим средством;
и
вещество, изменяющее осмотическое давление;
в котором анестезирующее средство, необязательно связанное с модулятором растворимости, сохраняется отдельно от растворителя до момента введения анестезирующего средства субъекту.
РИСУНКИ
|
|