|
|
(21), (22) Заявка: 2003127837/15, 18.02.2002
(24) Дата начала отсчета срока действия патента:
18.02.2002
(30) Конвенционный приоритет:
05.06.2001 DE 10127011.9
(43) Дата публикации заявки: 10.03.2005
(46) Опубликовано: 10.09.2008
(56) Список документов, цитированных в отчете о
поиске:
ЕР 0970711 А2, 12.01.2000. DE 19744135 C1, 25.03.1999. RU 84040913 A1, 27.11.1996.
(85) Дата перевода заявки PCT на национальную фазу:
16.09.2003
(86) Заявка PCT:
EP 02/01707 (18.02.2002)
(87) Публикация PCT:
WO 02/065947 (29.08.2002)
Адрес для переписки:
129010, Москва, ул. Б. Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Ю.Д.Кузнецову, рег.№ 595
|
(72) Автор(ы):
ВНЕНДТ Штефан (DE),
ФОН ОЭПЕН Рандольф (DE),
КУТТЛЕР Бернд (DE),
ЛАНГ Герхард (DE)
(73) Патентообладатель(и):
ЭББОТТ ЛЭБОРАТРИЗ ВАСКЬЮЛАР ЭНТЕРПРАЙЗИЗ ЛИМИТЕД (IE),
АСТЕЛЛАС ФАРМА ИНК (JP)
|
(54) ИМПЛАНТАТЫ С FK506
(57) Реферат:
Изобретение относится к медицине, конкретно к имплантатам, в частности, внутрикавернозным или интраваскулярным имплантатам, предпочтительно для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности, сужений, или, соответственно, стенозов или рестенозов, предпочтительно для профилактики рестеноза, которые в химически ковалентно или нековалентно связанной или физически фиксированной форме содержат FK506, к способу их получения и их применению. Применение имплантатов приводит у уменьшению очагов воспаления. 6 н. и 46 з.п. ф-лы, 7 ил., 10 табл.
Изобретение относится к имплантатам, в частности, внутрикавернозным или интраваскулярным имплантатам, предпочтительно для лечения или профилактики коронарных или периферических закупорок сосудов или сужений сосудов, в особенности сужений, соответственно, стенозов или рестенозов, предпочтительно для профилактики рестеноза, которые содержат FK506 в химически ковалентно или нековалентно связанной или физически фиксированной форме, к способу их получения и их применению.
Возникновение артериосклеротических патологических изменений в артериальных кровеносных сосудах является заболеванием, лежащим в основе широкого круга клинических симптомов, которые простираются от стенокардии через синдром Шарко вплоть до инфаркта миокарда и ишемического инсульта, всех, базирующихся на атеромном образовании и/или вызванных стенозом повреждениях. Понятие “вызванные стенозом повреждения” означает локальное уменьшение просвета сосуда до менее чем 60-70 % его нормального диаметра, что в свою очередь приводит к отчетливому снижению снабжения соответствующей ткани кислородом и питательными веществами. Хотя фармакотерапия (статин, ингибиторы ангиотензинконвертирующих ферментов, блокаторы gpIIa/IIIb и активаторы плазминогена), в частности, в области сердечно-сосудистых заболеваний, в течение последних десятилетий показала хорошие терапевтические успехи, все еще необходимы хирургические вмешательства (операции шунтирования и т.д.) в случае многих пациентов, у которых обнаружена полная ишемическая картина болезни. Впрочем, эти операции являются относительно сложными и дорогостоящими и они связаны с риском тяжелых осложнений.
Для предотвращения возникновения ишемических болезней сердца разработаны минимально инвазивные хирургические способы. Изобретение чрескожной внутрипросветной ангиопластики венечных сосудов сердца (Percutaneous Transluminal Coronary Angioplasty (РТСА)) в конце 70-х годов явилось большим прорывом в кардиологии. В случае РТСА используют надувные баллоны, которые продвигают вплоть до вызванного стенозом повреждения в коронарных артериях. Эти баллоны затем надувают в соответствующих заданных положениях и достигают расширения стенозированной области. Подобный способ действия можно применять также в случае дилатации каротидных или периферических артерий.
Несмотря на это, относительно скоро было установлено, что у относительно большого числа подвергнутых РТСА пациентов в местах, которые были расширены с помощью баллонного катетера, развился повторный стеноз. При этом было обнаружено, что этот так называемый рестеноз возникает за счет новообразования васкулярной “архитектуры” тканевых слоев. Изобретение трубчатых васкулярных металлических имплантатов, так называемых стентов, улучшает ситуацию в случае внутрипросветной обработки стеноза. При клинических исследованиях (Serruys и др., N. Engl. J. Med., 331, 489-495 (1994)) было обнаружено, что применением стентов в расширенных с помощью баллона местах можно уменьшать появление рестеноза от примерно 45% до примерно 30%. Хотя это нужно рассматривать уже как значительное улучшение в случае предотвращения остаточного рестеноза, все еще имеется отчетливое стремление к терапевтическим улучшениям. При детализированных исследованиях патофизиологии рестеноза в случае стента обнаружено, что он отличается от индуцированного РТСА рестеноза. Воспалительные реакции, гиперпролиферация и иммиграция гладкомышечных клеток (smooth muscle cells (SMCs)) являются важными факторами образования неоинтимы, которые приводят к рестенозу в случае стента. В случае животной модели рестеноза и даже в случае человеческой ткани установлено, что гиперпролиферация SMCs сопровождается инфильтрацией ткани около креплений стента за счет макрофагов и Т-клеток (Grewe и др., J. Am. Coll. Cardiol., 35, 157-163 (2000)). По аналогии с другими клиническими показаниями, в случае которых играют роль воспалительные реакции и гиперпролиферация клеток и которые можно контролировать путем медикаментозной обработки, также пытались лечить рестеноз путем фармакотерапии. Выбранные биологически активные вещества вводили либо перорально или внутривенно, либо с помощью перфорированного катетера в место действия. К сожалению, вплоть до настоящего времени ни одно из этих биологически активных веществ решающим образом не смогло уменьшить рестеноз (Gruberg и др., Exp. Opin. Invest. Drugs, 9, 2555-2578 (2000)).
Прямое выделение фармакологически активных веществ покрытыми биологически активным веществом стентами в данном случае представляет собой выбранный метод. Опыты на животных и первые результаты клинических испытаний покрытых биологически активным веществом стентов производят впечатление, что замедленное высвобождение иммуносупрессивных или антипролиферативных биологически активных веществ может снижать риск рестеноза. Паклитаксел, цитостатическое биологически активное вещество, и рапамицин, иммуносупрессивное и цитостатическое биологически активное вещество тестировали в опытах на животных. Оба соединения ингибируют образование неоинтимы (Herdeg и др., Semin Intervent Cardiol., 3, 197-199 (1998); Hunter и др., Adv. Drug. Delivery Rev., 26, 199-207 (1997); Burke и др., J. Cardiovasc. Pharmacol., 33, 829-835 (1999); Gallo и др., Circulation, 99, 2164-2170 (1999)). Несмотря на это, спустя 6 месяцев после имплантации покрытых паклитакселом стентов в случае свиней наблюдали прекращение действия (Heldman, International Local Drug Delivery Meeting and Cardiovascular Course on Radiation, Женева, 25-27 января 2001 г.). Рапамицин показал хорошую эффективность с полным прекращением рестеноза при первых клинических применениях (Sousa и др., Circulation, 103, 192-195 (2001)). С другой стороны, по-видимому, это происходит совместно с замедленным излечением поврежденной за счет баллонной ангиопластики и имплантации стента стенки сосуда.
Вообще говоря, очень важным является равновесие между излечением артериальной стенки сосуда после ангиопластики и имплантации стента, с одной стороны, и сдерживанием образования неоинтимы. Для достижения этого равновесия нужно использовать биологически активные вещества, которые селективно интерферируют со специфическими механизмами, приводящими к образованию неоинтимы.
Поэтому задачей изобретения являлось получение имплантатов с благоприятными свойствами для лечения и профилактики рестеноза.
Объектом изобретения вследствие этого является имплантат, содержащий FK506 в химически ковалентно или нековалентно связанной или физически фиксированной форме, а также, в случае необходимости, по меньшей мере, одно другое биологически активное вещество.
При этом в случае каждого, указанного в рамках настоящего изобретения биологически активного вещества, включая биологически активное вещество FK506, имеет значение то, что понятие “биологически активное вещество” включает также непосредственные производные биологически активного вещества, а также биологически активное вещество во всех его видах, как соли, энантиомеры, рацематы, основания или свободные кислоты, а также их смеси.
Предпочтительно, когда имплантатом является внутрикавернозный, предпочтительно интраваскулярный, имплантат.
При этом под термином “внутрикавернозный” понимают как находящийся внутри полости, в частности, внутри полого органа или полых органов, таких как кровеносные сосуды, пищеводы, мочеточники, желчные протоки, и т.д.
Под термином “интраваскулярный” нужно понимать, в частности, использование в кровеносном сосуде.
Также предпочтительно, когда имплантат пригоден для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности, сужений или стенозов или рестенозов, предпочтительно для профилактики рестеноза.
Поэтому особенно предпочтительным является внутрикавернозный, предпочтительно интраваскулярный, имплантат для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности, сужений или стенозов или рестенозов, предпочтительно для профилактики рестеноза, содержащий FK506 в химически ковалентно или нековалентно связанной или физически фиксированной форме, а также, в случае необходимости, по меньшей мере, одно другое биологически активное вещество.
Макролидный антибиотик FK506 (такролимус; [3S-[3R*[E(1S*,3S*,4S*)],4S*,5R*,8S*,9E,12R*,14R*,15S*,16R*,18S*, 19S*,26aR*]]-5,6,8,11,12,13,14,15,16,17,18,19,24,25,25,26,26a-гексадекагидро-5,19-дигидрокси-3-[2-(4-гидрокси-3-метоксициклогексил)-1-метилентенил]-14,16-диметокси-4,10,12,18-тетраметил-8-(2-пропенил)-15,19-эпокси-3Н-пиридо[2,1-c][1,4]оксаазациклотрикозин-1,7,20,21(4Н,23Н)-тетрон; фирма Merck; номер по каталогу 9000) представляет собой созданное для трансплантационной медицины биологически активное вещество. FK506 ингибирует выделение интерлейкина-2 (IL-2) и -интерферона (IFN-) из Т-клеток и при этом блокирует отторжение имплантата (трансплантата) (Wiederrecht и др., Ann. NY Acad. Sci., 696, 9-19 (1993)). FK506 исследовали также в SMC-культурах в отношении ингибирования пролиферации гладкомышечных клеток (Mohacsi и др., J. Heart. Lung Transplant., 16, 484-492 (1997); Marx и др., Circulation Res., 76, 412-417 (1995)) и их миграции (Poon и др., J. Clin. Invest., 98, 2777-2283 (1996)). В общем, FK506 из-за его незначительной потенции различными исследователями был оценен как непригодный для профилактики рестеноза (Mohacsi и др. (1997); Poon и др. (1996); Marx и др. (1995); Dell, Curr. Med. Chem., 5, 179-194 (1998)). Mohacsi и др. обнаружили полумаксимальное ингибирование SMC-пролиферации между 100 нмоль и 1 мкмоль, в то время как Marx и др. при концентрациях вплоть до 123 нмоль не наблюдали никакого эффекта. В противоположность этому, рапамицин при ингибировании пролиферации SMC-культур активен в наномолярной области концентраций.
Исходя из этого уровня техники, использование именно FK506 для торможения рестеноза, казалось вообще не предвещало успеха (Mohacsi и др. (1997); Poon и др. (1996)). Однако, в противоположность мнению специалистов, неожиданно оказалось, что в частности, использование FK506 в качестве части стента, а также других имплантатов очень эффективно при лечении и профилактике рестеноза. Прямое локальное применение FK506 является благоприятным для предотвращения рестеноза и действие очень сбалансировано, так как оно позволяет осуществляться хорошей реэндотелиализации поврежденной стенки сосуда.
Не предполагая этого с самого начала, это, пожалуй, может объясняться иммуномодуляторной активностью FK506, которая проявляется в полумаксимальном ингибировании высвобождения IL-2 при концентрациях около 0,1 нмоль (Kino и др., J. Antibiot., 40, 1256-1265 (1987)) и ингибирующем воздействии на SMC-пролиферацию при концентрациях около 300-500 нмоль. Соответственно, поэтому использование FK506 является благоприятным.
При этом под стенозом понимают закупорку или сужение сосуда и под рестенозом понимают повторное возникновение стеноза.
Далее, в настоящем контексте под термином “содержащий” понимают, в том числе, также, например, нековалентно-связанное покрытие.
Далее, в настоящем контексте термин “периферический” относится к сосудам или другим полым органам вне сердца и венечных сосудов сердца.
Под выражением “химически нековалентно связанный” нужно понимать, в частности, связи за счет взаимодействий, такие как водородные мостики, гидрофобные взаимодействия, ван-дер-Ваальсовы силы и т.д.
Под выражением “физически фиксированный” нужно понимать, например, включение, например, через мембрану в отверстии или стерический захват благодаря выбору размеров отверстий и т.д.
Под имплантатом нужно понимать любую форму искусственного объекта, который вводят (также только ограниченно по времени). В частности, при этом речь идет о внутрикавернозных, например, интраваскулярных, имплантатах. Примерами являются стенты, трансплантаты, стент-трансплантаты, трансплантат-соединители, мандрены, катетерные насосы или катетеры.
Под стентом понимают, в смысле настоящего изобретения, продолговатый, полый внутри имплантат, по меньшей мере, с двумя отверстиями и чаще всего с круглым или эллиптическим, однако, также с любым другим поперечным сечением (чаще всего из металла, однако, в случае необходимости, также из синтетических материалов или полимеров) предпочтительно перфорированной, решеткообразной структуры, который имплантируют в сосуды, в частности, в кровеносные сосуды, чтобы сохранять их открытыми или нормально функционирующими.
Под трансплантатом понимают, в смысле настоящего изобретения, продолговатый, полый внутри имплантат, по меньшей мере, с двумя отверстиями и чаще всего с круглым или эллиптическим, однако, также с любым другим поперечным сечением и, по меньшей мере, с одной гомогенной или, в случае необходимости, тканой из различных жгутов, плотной и непроницаемой для корпускулярных компонентов крови и/или для воды полимерной поверхностью, который служит, в общем, в качестве протеза сосуда и который используют чаще всего в случае поврежденных сосудов или вместо сосудов.
Под стент-трансплантатом понимают, в смысле настоящего изобретения, сочетание стента с трансплантатом. Соответственно, стент-трансплантат по своей сути представляет собой усиленный стентом протез сосуда (трансплантат, см. выше), причем полимерный слой является гомогенным или, в случае необходимости, тканым из различных жгутов, плотным и непроницаемым для корпускулярных компонентов крови и/или для воды. В более узком смысле, это стент, который, по меньшей мере, на 20 % поверхности имплантата обладает одним перфорированным (решеткообразным), предпочтительно металлическим, наружным слоем и, по меньшей мере, одним, находящимся внутри или снаружи этого наружного слоя, гомогенным или, в случае необходимости, тканым из различных жгутов, плотным и непроницаемым для корпускулярных компонентов крови и/или для воды полимерным слоем, а также в случае необходимости (в случае находящегося снаружи перфорированного слоя) другим, находящимся внутри полимерного слоя, перфорированным (решеткообразным), предпочтительно металлическим, внутренним слоем или находящимся снаружи или вне перфорированного слоя гомогенным или, в случае необходимости, тканым из различных жгутов, плотным и непроницаемым для корпускулярных компонентов крови и/или для воды полимерным слоем.
Под трансплантат-соединителем понимают, в смысле настоящего изобретения, имплантат, который связывает, по меньшей мере, два полых органа, сосуда или трансплантата, состоит из предназначенных для трансплантатов или стент-трансплантатов материалов и/или имеет определенную для них структуру и, соответственно, имеет, по меньшей мере, два, предпочтительно три или четыре отверстия, в частности, имеет асимметрическую “Т”-форму.
Под катетером понимают, в смысле настоящего изобретения, трубчатый инструмент для введения в полые органы. В более узком, предпочтительном смысле, имеются направляющие катетеры, катетеры для ангиографии или баллонные катетеры.
Под катетерным насосом понимают, в смысле настоящего изобретения, снабженный на его верхушке пропеллером катетер, который может поддерживать помпаж миокарда.
Существует другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата, когда имплантат имеет, по меньшей мере, один(одну), состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность.
Под металлом или сплавом металлов, в смысле настоящего изобретения, нужно понимать, в частности, сталь, или стальные сплавы, однако, также никель или никелевые сплавы, причем понятие металл уже с самого начала также охватывает сплавы металлов.
Под термином “перфорированный” нужно понимать, в частности, решеткообразные, тканые или плетеные структуры.
Существует другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата, когда имплантат имеет, по меньшей мере, один(одну), состоящий(щую) из полимера, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность.
Согласно предпочтительному варианту выполнения имплантат имеет, по меньшей мере, один полимерный слой, который полностью или частично покрывает состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность, предпочтительно состоящую из металла или сплава металлов, в случае необходимости, решеткообразную, структуру.
Согласно особенно предпочтительного варианту выполнения имплантат имеет, по меньшей мере, один(одну), состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность и, по меньшей мере, один(одну), состоящий(щую) из полимера, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность.
При этом особенно предпочтительно, когда в случае этого имплантата состоящий(щая) из металла или сплава металлов слой или поверхность представляет собой состоящую из металла или сплава металлов, в случае необходимости, решеткообразую структуру и/или состоящий(щая) из полимера слой или поверхность является гомогенной плотной или тканой и/или водонепроницаемой и/или корпускулонепроницаемой и/или последовательность слоев или поверхностей снаружи внутрь представляет собой металл-полимер, полимер-металл, металл-полимер-металл или полимер-металл-полимер и/или либо состоящий(щая) из полимера слой или поверхность нехимически (ковалентно или нековалентно) связан (связана) с состоящим(щей) из металла или сплава металлов слоем или поверхностью, либо состоящий(щая) из полимера слой или поверхность посредством клея связан (связана) с состоящим(щей) из металла или сплава металлов слоем или поверхностью.
Далее, предпочтительно, когда применяемый в рамках имплантатов полимер выбирают из дакрона; растяжимого или нерастяжимого политетрафторэтилена (PTFE/тефлон); или полиуретана; предпочтительно из растяжимого или нерастяжимого политетрафторэтилена (PTFE); или полиуретана; в частности, из PTFE.
Также предпочтительным вариантом осуществления изобретения является вариант, когда имплантат представляет собой стент, стент-трансплантат, трансплантат, трансплантат-соединитель, мандрен, катетер или катетерный насос, предпочтительно стент, стент-трансплантат, трансплантат или трансплантат-соединитель, в частности, стент или стент-трансплантат.
Особенно предпочтительно, когда предлагаемый согласно изобретению имплантат покрыт FK506.
Локальное применение FK506 достигается путем прямого выделения из нагруженной биологически активным веществом поверхности коронарного или периферического стента. Нагруженная биологически активным веществом поверхность стента может достигаться путем применения различных технологических приемов. Любой из этих приемов можно осуществлять таким образом, что биологически активное вещество выделяется из поверхности либо за короткий промежуток времени (часы), либо в течение длительного периода времени (дни). Кинетику высвобождения можно приспосабливать тем, что на поверхности производятся специфические модификации, такие как, например, гидрофобные или гидрофильные боковые цепи полимерного носителя или керамическая поверхность. Также эти поверхности, со своей стороны, можно снова модифицировать на поверхности, например, благодаря Si-группам на слое из оксида алюминия.
Кинетику высвобождения можно приспосабливать тем, что используют специфические полимеры, блоксополимеры, смеси полимеров, привитые сополимеры, индивидуально или в виде слоистой структуры. Для регулирования кинетики высвобождения особенно пригодно применение нанокапсул и/или липосом и вышеописанных комбинаций полимеров. Под нанокапсулами понимают, в общем, покрытие оболочкой мицеллярных систем или коллоидальных твердых веществ до получения ультратонких частиц с твердым покрытием. Заключенные в оболочку частицы, размер которых находится в области нанометров, растворяются с образованием коллоидных растворов. Наноинкапсулированные биологически активные вещества таким образом можно использовать с отсроченной эффективностью. Липосомы получают, в общем, из фосфолипидов путем диспергирования в водных средах и в этой связи они представляют интерес, так как гидрофильные биологически активные вещества можно вводить в водный внутренний объем, а также в водные промежуточные слои, а гидрофобные биологически активные вещества можно встраивать в липидные слои. Если используются нанокапсулы и/или липосомы различного состава, то их можно нагружать различными биологически активными веществами и таким образом целенаправленно высвобождать комбинацию биологически активных веществ.
Керамическое покрытие
Покрытие из оксида алюминия (заявки на патенты ФРГ 19855421 и 19910188; Международная заявка WO-00/25841) с пористой поверхностью можно нагружать FK506 в количествах от 10 мкг до 10 мг либо путем окунания, напыления, либо подходящей технологией. Доза биологически активного вещества зависит от рода сосуда-мишени и от состояния пациента и выбирается так, что в достаточной степени ингибируется пролиферация, миграция и ответ Т-клеток, не мешая процессу излечивания. FK506 можно применять в виде водного или органического раствора, например, в диметилсульфоксиде, диметилформамиде и этаноле. После напыления или окунания (в случае необходимости, при слабом вакууме) обработанный стент высушивают и процесс повторяют 2-10 раз. Другая возможность нанесения состоит в прямом нанесении раствора биологически активного вещества на тент-жгуты с помощью микропипетки или автоматического устройства для дозирования. После последней стадии высушивания стент можно промывать в течение одной минуты при комнатной температуре в воде или в изотоническом солевом растворе и затем снова высушивать. Содержание биологически активного вещества после извлечения его с помощью пригодного растворителя определяют стандартными методами (высокоэффективная жидкостная хроматография (HPLC), масс-спектрометрия с жидкостной хроматографией (LC-MS)). Кинетики высвобождения можно измерять при применении стандартной аппаратуры для определения высвобождения. Нанесение керамического покрытия можно комбинировать с нанесением полимерного (в случае необходимости, биоразлагаемого) покрытия.
Впрочем, аналогично можно использовать любой вид покрытий из оксида металла, в частности, например, из оксида иридия, как описывается в патенте США 6245104-В1. Соответственно, любое упоминание оксида алюминия в дальнейшем нужно понимать так, что под ним нужно подразумевать также другие оксиды металлов, как, например, оксид иридия.
Мембрана из политетрафторэтилена (PTFE): стент-трансплантат
В этом случае используют сопоставимый с вышеописанным прием. FK506 вносят в углубления пористой мембраны из PTFE.
Общее полимерное покрытие
Для нагружения биологически активным веществом пригодны различные полимеры: полиметакрилаты, полиуретановые покрытия, PTFE-покрытия, покрытия из гидрогеля. Биологически активное вещество можно либо наносить на конечную поверхность (см. выше), либо добавлять прямо в полимеризационный раствор. В остальных деталях этот технологический прием соответствует уже описанным выше приемам.
Можно использовать различные полимеры, а также их комбинации в виде смесей полимеров, систем со слоистой структурой, блоксополимеров, привитых сополимеров. Пригодными полимерами являются следующие: полиакрилаты и полиметакрилаты, силиконы, как, например, полидиметилсилоксан, сложный полиметиленмалоновый эфир, простые полиэфиры, сложные полиэфиры, биорезорбируемые полимеры, полимеры из виниловых мономеров, как, например, поливинилпирролидон и простые виниловые эфиры, поли-цис-1,4-бутадиен, поли-цис-1,4-изопрен, поли-транс-1,4-изопрен, а также вулканизированные продукты, полиуретаны, поликарбамиды, полиамиды, полиимиды, полисульфоны, а также биополимеры, как, например, целлюлоза и ее производные и протеины и фибриновый клей. Особенно интересные свойства проявляют гидрогели, которые из-за их высокого водопоглощения в качестве самого крайнего наружного (top coat) слоя обладают очень хорошей гемосовместимостью. Согласно настоящему изобретению можно использовать гидрогели, как, например, полиакриламид, полиакриловая кислота, полимеры с атомом кислорода в качестве гетероатома в основной цепи, как, например, полиэтиленоксид, полипропиленоксид, политетрагидрофуран. Биологически активное вещество можно либо наносить на конечную поверхность, либо вводить в нанокапсулы и/или вносить в липосомы. Биологически активное вещество, однако, также может находиться непосредственно в полимеризационном растворе или в растворе полимера. В случае некоторых систем полимер/биологически активное вещество, биологически активное вещество можно иммобилизировать путем набухания.
Механический прием
Механический прием основывается на углублениях, которые создают с помощью лазера на укосинах стента. Эти углубления затем можно заполнять FK506. Механический (углубления) прием можно комбинировать с нанесением полимерного, в случае необходимости, биоразлагаемого покрытия, которое само нагружено биологически активным веществом. После первоначального высвобождения из полимерного покрытия биологически активное вещество может в течение длительного периода времени высвобождаться из заполненных биологически активным веществом углублений. В остальных деталях этот технологический прием соответствует уже описанным выше приемам.
Соответственно, имеется другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата, когда имплантат имеет керамическое покрытие, в частности, из оксида алюминия, с которым связан FK506.
Другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата представляет собой вариант, когда имплантат обладает полимерным покрытием, в частности, из полиметакрилатов, полиуретана, PTFE, гидрогеля или смеси гидрогель/полиуретан, в частности, из PTFE, с которым связан FK506 или в котором растворен FK506 перед нанесением покрытия.
Имеется другой предпочтительный вариант выполнения предлагаемого согласно изобретению имплантата, когда металл имплантата имеет выполненные с помощью лазера углубления, которые заполнены FK506. При этом особенно благоприятно, когда снабженный заполненными FK506 углублениями металл или, по меньшей мере, углубления покрывают биологически разлагаемым полимерным материалом, причем, в случае необходимости, FK506 связывается с полимерным покрытием или перед полимеризацией покрытия FK506 растворен в полимерном материале.
Согласно другому, очень благоприятному варианту выполнения предлагаемого в изобретении имплантата, имплантат получают способом, при котором
а) используют имеющий, по меньшей мере, один(ну), состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность имплантат по любому из п.п. 4, 6 или 7-10, на который наносят керамическое покрытие, в частности, из оксида алюминия; или
b) используют имеющий, по меньшей мере, один(ну), состоящий(щую) из полимера, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность имплантат по любому из п.п. 5-10; или
c) используют имплантат по любому из п.п. 1-10, который покрывают с помощью полимерного или полимеризующегося на поверхности покрытия, в частности, из полиметакрилатов, полиуретана, PTFE, гидрогеля или смеси гидрогель/полиуретан; или
d) используют имплантат по любому из п.п. 4, 6 или 7-10, по меньшей мере, с одним(ной), состоящим(щей) из металла или сплава металлов, гомогенным(ной) или образованным(ной) из различных жгутов, плотным(ной) или перфорированным(ной) слоем или поверхностью, в котором(рой) с помощью лазера выполняют углубления, которые заполняют FK506, и затем на имплантат наносят полимерное или полимеризующееся на поверхности биоразлагаемое покрытие;
e) затем имплантат согласно а), b), c) или d) вводят в контакт с раствором FK506 в водном или органическом растворителе, например, путем обрызгивания, напыления или погружения, в случае необходимости, в вакууме;
f) после этого, в случае необходимости, имплантат высушивают, предпочтительно вплоть до удаления растворителя из стадии е);
g) затем, в случае необходимости, повторяют стадию е), в случае необходимости, с последующей стадией f), предпочтительно многократно, в частности, 1-5 раз, а также,
h) после этого, в случае необходимости, имплантат одно- или многократно промывают водой или изотоническим солевым раствором; и
i) затем, в случае необходимости, высушивают.
При этом предпочтительно, когда при изготовлении этого, таким образом получаемого согласно изобретению имплантата на стадии е) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 0,5-5 г/л FK506 в этаноле, и/или на стадии е) имплантат вводят в контакт с раствором FK506 в водном или органическом растворителе, в вакууме, предпочтительно в течение ночи, путем погружения, и/или не осуществляют стадию f) и/или стадию g), и/или в стадии h) имплантат многократно промывают солевым раствором, и/или на стадии i) имплантат высушивают в течение ночи.
Согласно альтернативному, особенно предпочтительному варианту осуществления изобретения предпочтительно, когда при изготовлении этого, получаемого как описано выше согласно изобретению имплантата на стадии е) имплантат, предпочтительно стерильный, вносят в предпочтительно стерильный сосуд с герметизирующейся по окончании перфорации, перфорируемой крышкой, например, в склянку для инъекций, сосуд заполняют раствором FK506, предпочтительно стерильным, закрывают его с помощью герметизирующейся по окончании перфорации, перфорируемой крышки, путем перфорации через крышку вставляют тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку, например, канюлю, создают вакуум и предпочтительно раствор FK506 перемешивают и затем, предпочтительно по истечении примерно 12 часов, тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку удаляют, и/или на стадии е) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 3,3 мг FK506 в 1 мл этанола, и/или имплантат вплоть до использования оставляют в предпочтительно стерильном закрытом стеклянном сосуде согласно стадии е), и/или стадии f)-i) не осуществляют.
Согласно другому, очень благоприятному варианту выполнения предлагаемого согласно изобретению имплантата имплантат получают способом, при котором перед образованием, по меньшей мере, одного (одной), состоящего(щей) из полимера, плотного(ной) или перфорированного(ной) слоя или поверхности или полимерного покрытия имплантата FK506 растворяют в полимеризационном материале.
Далее, особенно предпочтительно, когда FK506 высвобождается после имплантации предлагаемого согласно изобретению имплантата. При этом особенно благоприятно, когда высвобождение происходит с задержкой. При этом особенно предпочтительным вариантом осуществления изобретения является вариант, когда FK506 высвобождается из имплантата в течение периода времени 24 часа, предпочтительно 48 часов, в частности, в течение более, чем 96 часов, после имплантации. В особенности также благоприятно, когда FK506 высвобождается из имплантата после имплантации: а) в течение < 48 часов, или b) в течение, по меньшей мере, 48 часов, предпочтительно в течение, по меньшей мере, 7 дней, в частности, в течение, по меньшей мере, 2-21 дней; или с) имплантат проявляет оба вида высвобождения а) и b).
Непосредственно последнего варианта можно достигать тогда, когда выбирают два различных вида покрытия – связывание или физическую фиксацию. Примером являются “запечатанные” с помощью нагруженных FK506 биоразлагаемых мембран углубления, выполненные с помощью лазера, с FK506. После быстрого высвобождения из мембраны происходит длительное высвобождение из углублений.
Следующим предпочтительным вариантом осуществления изобретения является вариант, когда в имплантате содержится, по меньшей мере, одно другое биологически активное вещество, предпочтительно фармацевтическое биологически активное вещество, в частности, другое биологически активное вещество, выбираемое из следующих биологически активных веществ, или их производных:
(группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например, BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин); гидралазин; верапамил, дилтиазем, нифедипин, нимодипин или другие блокаторы Са2+-канала; каптоприл, эналаприл, лизиноприл, квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора;
(группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; 17-бета-эстрадиол; циклоспорин; микофеноловая кислота; VEGF, активаторы VEGF-рецептора; траниласт; мелоксикам, целебрекс, виокс или другие антагонисты СОХ-2; индометацин, диклофенак, ибупрофен, напроксен или другие ингибиторы СОХ-1; ингибиторы активатора-1 плазминогена или серпинен; ингибиторы тромбина, например, гирудин, гирулог, агратробан, РРАСК или интерлейкин-10;
(группа 3): рапамицин, SDZ RAD (40-О-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; цисплатин; винбластин; митоксантрон; комбретастатин А4; топотекан; метотрексат; флавопиридол;
актиномицин D; реопро/абциксимаб или пробукол.
При этом особенно предпочтительным является то, что, когда другое биологически активное вещество выбирают из группы 1, оно высвобождается из имплантата в течение первых 24-72 часов после имплантации, и/или, когда другое биологически активное вещество выбирают из группы 2, оно высвобождается из имплантата в течение первых 48 часов – 21 дня после имплантации, и/или, когда другое биологически активное вещество выбирают из группы 3, оно высвобождается из имплантата в течение времени от 14 дней до трех месяцев после имплантации.
Следующим объектом изобретения является способ получения предлагаемого согласно изобретению имплантата, при котором перед образованием, по меньшей мере, одного (одной), состоящего(щей) из полимера, плотного(ной) или перфорированного(ной) слоя или поверхности или полимерного покрытия имплантата FK506 растворяют в полимеризационном материале.
Еще одним объектом изобретения является способ получения предлагаемого согласно изобретению имплантата со следующими стадиями:
а) используют имеющий, по меньшей мере, один(ну), состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность имплантат по любому из п.п. 4, 6 или 7-10, на который наносят керамическое покрытие, в частности, из оксида алюминия; или
b) используют имеющий, по меньшей мере, один(ну), состоящий(щую) из полимера, гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность имплантат по любому из п.п. 5-10; или
c) используют имплантат по любому из п.п. 1-10, который покрывают с помощью полимерного или полимеризующегося на поверхности покрытия, в частности, из полиметакрилатов, полиуретана, PTFE, гидрогеля или смеси гидрогель/полиуретан; или
d) используют имплантат по любому из п.п. 4, 6 или 7-10, по меньшей мере, с одним(ной), состоящим(щей) из металла или сплава металлов, гомогенным(ной) или образованным(ной) из различных жгутов, плотным(ной) или перфорированным(ной) слоем или поверхностью, в котором(рой) с помощью лазера выполняют углубления, которые заполняют FK506, и затем на имплантат наносят полимерное или полимеризующееся на поверхности, предпочтительно биоразлагаемое покрытие;
e) затем имплантат согласно а), b), c) или d) вводят в контакт с раствором FK506 в водном или органическом растворителе, например, путем обрызгивания, напыления или погружения, в случае необходимости, в вакууме;
f) после этого, в случае необходимости, имплантат высушивают, предпочтительно вплоть до испарения растворителя из стадии е);
g) затем, в случае необходимости, повторяют стадию е), в случае необходимости, с последующей стадией f), предпочтительно многократно, в частности, 1-5 раз; а также,
h) после этого, в случае необходимости, имплантат одно- или многократно промывают водой или изотоническим солевым раствором; и
i) затем, в случае необходимости, высушивают.
Этот способ является особенно предпочтительным, когда в стадии е) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 0,5-5 г/л FK506 в этаноле, и/или в стадии е) имплантат вводят в контакт с раствором FK506 в водном или органическом растворителе, в вакууме, предпочтительно в течение ночи, путем погружения, и/или не осуществляют стадию f) и/или стадию g), и/или на стадии h) имплантат многократно промывают солевым раствором, и/или на стадии i) имплантат высушивают в течение ночи.
Особенно предпочтительной альтернативой предлагаемого согласно изобретению способа является способ, когда на стадии е) имплантат, предпочтительно стерильный, вносят в предпочтительно стерильный сосуд с герметизирующейся по окончании перфорации перфорируемой крышкой, например, в склянку для инъекций, сосуд заполняют раствором FK506, предпочтительно стерильным, закрывают его с помощью герметизирующейся по окончании перфорации перфорируемой крышкой, путем перфорации через крышку вставляют тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку, например, канюлю, создают вакуум и предпочтительно раствор FK506 перемешивают и затем, предпочтительно по истечении примерно 12 часов, тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку удаляют, и/или на стадии е) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 3,3 мг FK506 в 1 мл этанола, и/или имплантат вплоть до использования оставляют в предпочтительно стерильном закрытом стеклянном сосуде согласно стадии е), и/или стадии f)-i) не осуществляют.
Эта альтернатива способа является особенно благоприятной, до сих пор была совершенно неизвестна и чрезвычайно выгодна как в отношении расходов, так и также в отношении затрат времени и стадий на получение, так как имплантат получают сразу уже стерильно упакованным. Этот альтернативный способ также может применяться в общем и, естественно, не ограничен использованием FK506, а функционирует с множеством биологически активных веществ. Однако непосредственно такому выгодному и простому способу присущ недостаток, так что в этом случае имеется проблема.
Дальнейшим отдельным объектом заявки поэтому является нижеуказанный общий способ получения покрытых биологически активными веществами имплантатов со следующими стадиями:
а) имплантат, предпочтительно стерильный, вносят в предпочтительно стерильный сосуд с герметизирующейся по окончании перфорации перфорируемой крышкой, например, в склянку для инъекции;
b) в сосуд вводят предпочтительно стерильный раствор биологически активного вещества, предпочтительно в органическом растворителе с малым давлением пара, в частности, в спирте таком, как этанол или метанол;
с) сосуд закрывают с помощью герметизирующейся по окончании перфорации перфорируемой крышкой;
d) путем перфорации через крышку вставляют тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку, например, канюлю;
е) в случае необходимости, создают вакуум, причем предпочтительно раствор биологически активного вещества перемешивают;
f) затем, предпочтительно по истечении примерно 12 часов, тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку удаляют и,
g) в случае необходимости, имплантат вплоть до использования оставляют в предпочтительно стерильном закупоренном стеклянном сосуде согласно стадии а).
При этом такой общий способ благоприятен тогда, когда имплантат стадии а) имеет, по меньшей мере, одну (один) металлическую(кий) перфорированную(ный) или плотную(ный) поверхность или слой, имеет керамическое покрытие, имеет полимерное покрытие и/или имеет, по меньшей мере, одну (один) полимерную(ный) перфорированную(ный) или плотную(ный) поверхность или слой.
Точно также предпочтителен общий способ получения имплантата, который представляет собой стент, стент-трансплантат, трансплантат, трансплантат-соединитель, стент с полимерными поверхностями или катетер.
Далее, общий способ предпочтителен, когда биологически активное вещество выбирают из фармацевтических биологически активных веществ таких, как, например, иммуносупрессивные средства или антибиотики, предпочтительно выбирают из следующих биологически активных веществ, или их производных:
(группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например, BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин); гидралазин; верапамил, дилтиазем, нифедипин, нимодипин или другие блокаторы Са2+-канала; каптоприл, эналаприл, лизиноприл, квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора;
(группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; FK506 (такролимус); 17-бета-эстрадиол; циклоспорин; микофеноловая кислота; VEGF, активаторы VEGF-рецептора; траниласт; мелоксикам, целебрекс, виокс или другие антагонисты СОХ-2; индометацин, диклофенак, ибупрофен, напроксен или другие ингибиторы СОХ-1; ингибиторы активатора-1 плазминогена или серпинен; ингибиторы тромбина, например, гирудин, гирулог, агратробан, РРАСК или интерлейкин-10;
(группа 3): сиролимус; рапамицин, SDZ RAD (40-О-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; цисплатин; винбластин; митоксантрон; комбретастатин А4; топотекан; метотрексат; флавопиридол;
актиномицин D; реопро/абциксимаб или пробукол;
в частности, выбирают из следующих биологически активных веществ:(группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например, BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин); каптоприл, эналаприл, лизиноприл, квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора;
(группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; FK506 (такролимус); VEGF, активаторы VEGF-рецептора; ингибиторы активатора-1 плазминогена или серпинен;
(группа 3): сиролимус; рапамицин, SDZ RAD (40-О-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; митоксантрон; комбретастатин А4; флавопиридол.
Следующим объектом изобретения является применение предлагаемого согласно изобретению имплантата для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в особенности сужений, соответственно, стенозов или рестенозов, предпочтительно для профилактики рестеноза.
Другим важным объектом заявки является, называемое в дальнейшем как FK506-применение, применение FK506 для покрытия или для получения имплантата в целях лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности, сужений, соответственно, стенозов или рестенозов, предпочтительно для профилактики рестеноза.
В случае FK506-применения предпочтительно, когда имплантат представляет собой стент, стент-трансплантат, трансплантат, трансплантат-соединитель, мандрен, катетер или катетерный насос, предпочтительно стент, стент-трансплантат, трансплантат или трансплантат-соединитель, в частности, стент или стент-трансплантат, или стент с полимерными поверхностями.
Далее, в случае FK506-применений благоприятно, когда FK506 связан или нанесен на имплантат таким образом, что после имплантации FK506 высвобождается из имплантата, предпочтительно с задержкой.
Следующим отдельным объектом изобретения является применение FK506 для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в особенности сужений, или стенозов или рестенозов, предпочтительно для профилактики рестеноза. Как указано выше, в данном случае FK506, как установлено в рамках настоящей заявки, обладает особенно благоприятными свойствами.
В рамках изобретения, для FK506 оказался особенно пригодным обладающий полимерным слоем или состоящий из полимеров стент или трансплантат, или стент-трансплантат. Такого рода имплантаты, обобщенно называемые в рамках настоящего изобретения как стенты с полимерными поверхностями, с покрытием биологически активным веществом до сих пор еще не были применены. Однако на основании проведенных в рамках настоящей заявки исследований они исключительно пригодны непосредственно для этого, так как их можно легко нагружать биологически активным веществом и затем равномерно и эффективно они снова выделяют биологически активное вещество. Это свойство, однако, не ограничено FK506, так что следующим отдельным объектом заявки является стент с полимерными поверхностями, содержащий в химически ковалентно или нековалентно связанной или физически фиксированной форме, по меньшей мере, одно действующее физиологически и/или фармацевтически активное вещество. В смысле настоящего изобретения, под стентом с полимерными поверхностями понимают интраваскулярный имплантат согласно изобретению, который имеет полимерную поверхность. В более широком смысле, стенты с полимерными поверхностями охватывают, таким образом, трансплантаты, а также стент-трансплантаты, трансплантат-соединители, покрытые полимерами или состоящие из полимеров стенты; в более узком смысле, покрытые полимерами или состоящие из полимером стенты, а также стент-трансплантаты.
В случае стентов с полимерными поверхностями предпочтительно, когда биологически активное вещество выбрано из фармацевтических активных веществ, как, например, иммуносупрессивные средства или антибиотики, предпочтительно выбирают из следующих биологически активных веществ или их производных:
(группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например, BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин); гидралазин; верапамил, дилтиазем, нифедипин, нимодипин или другие блокаторы Са2+-канала; каптоприл, эналаприл, лизиноприл, квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора;
(группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; FK506 (такролимус); 17-бета-эстрадиол; циклоспорин; микофеноловая кислота; VEGF, активаторы VEGF-рецептора; траниласт; мелоксикам, целебрекс, виокс или другие антагонисты СОХ-2; индометацин, диклофенак, ибупрофен, напроксен или другие ингибиторы СОХ-1; ингибиторы активатора-1 плазминогена или серпинен; ингибиторы тромбина, например, гирудин, гирулог, агратробан, РРАСК или интерлейкин-10;
(группа 3): сиролимус; рапамицин, SDZ RAD (40-О-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; цисплатин; винбластин; митоксантрон; комбретастатин А4; топотекан; метотрексат; флавопиридол;
актиномицин D; реопро/абциксимаб или пробукол;
в частности, выбирают из следующих биологически активных веществ:
(группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например, BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин); каптоприл, эналаприл, лизиноприл, квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора;
(группа 2): дексаметазон, бетаметазон, преднизон или кортикостероиды; FK506 (такролимус); VEGF, активаторы VEGF-рецептора; ингибиторы активатора-1 плазминогена или серпинен;
(группа 3): сиролимус; рапамицин, SDZ RAD (40-О-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; митоксантрон; комбретастатин А4; флавопиридол;и/или стент с полимерными поверхностями содержит, по меньшей мере, два, предпочтительно 2 или 3 действующих физиологически и/или фармацевтически активных вещества, выбираемых из одной из групп 1-3, предпочтительно максиимально одно биологически активное вещество из одной группы.
В случае другого предпочтительного варианта выполнения этого стента с полимерными поверхностями имеет значение то, что, когда другое биологически активное вещество выбирают из вышеуказанной группы 1, оно высвобождается имплантатом в течение первых 24-72 часов после имплантации, и/или, когда другое биологически активное вещество выбирают из вышеуказанной группы 2, оно высвобождается имплантатом в течение первых 48 часов – 21 дня после имплантации, и/или, когда другое биологически активное вещество выбирают из вышеуказанной группы 3, оно высвобождается имплантатом в течение времени от 14 дней до 3 месяцев после имплантации.
В общем, в случае предлагаемых согласно изобретению стентов с полимерными поверхностями имеет значение то, что все вышеописанные варианты и виды выполнения, способы получения и применения особого, содержащего FK506 имплантата также предпочтительны для предлагаемых согласно изобретению стентов с полимерными поверхностями и тем самым являются объектами настоящего изобретения, поскольку вариантами выполнения являются еще стенты с полимерными поверхностями.
Следующим объектом изобретения является также лечение человека или животного, которому необходимо это лечение, с помощью или посредством предлагаемого согласно изобретению имплантата или стента с полимерными поверхностями.
В следующем разделе изобретение поясняется далее с помощью примеров, однако без ограничения ими объема охраны изобретения.
Примеры и фигуры
Фигуры
На фигуре 1 представлено высвобождение FK506 из коронарного стент-трансплантата, в котором состоящая из PTFE поверхность нагружена FK506.
На фигуре 2 представлено высвобождение кандесартана и квинаприла из стент-трансплантата, в котором состоящая из PTFE поверхность нагружена с помощью кандесартана и квинаприла.
На фигуре 3 представлено высвобождение кандесартана и квинаприла из покрытого полиуретаном стента, в котором это покрытие обогащено кандесартаном и квинаприлом.
На фигуре 4 представлено высвобождение кандесартана и квинаприла из покрытого смесью полиуретан/гидрогель стента, в котором это покрытие обогащено кандесартаном и квинаприлом.
На фигуре 5 представлено высвобождение FK506 в кровь после имплантации стента с соответственно нанесенным покрытием кролика.
На фигуре 6 представлена поверхность интимы на имплантированном стенте с соответствующим покрытием с FK506 или без него.
На фигуре 7 показана воспалительная реакция на имплантацию стента с соответствующим покрытием с FK506 или без него.
Примеры
Пример 1
Загрузка представляющих интерес соединений в стент-трансплантаты
Все величины указаны в мкг.
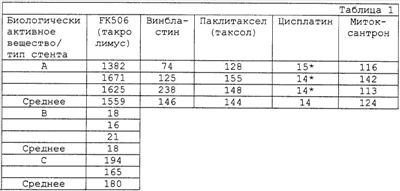
* измерено путем атомно-абсорбционной спектрометрии;
А: опыты с растворенными твердыми веществами, при которых стент-трансплантаты с полимерным слоем из PTFE погружали в раствор;
В: опыты с внутривенно вводимыми растворами, при которых стент-имплантаты с полимерным слоем из PTFE погружали в раствор;
С: опыты с внутривенно вводимыми растворами, при которых покрытые полиуретаном стенты погружали в раствор.
Пример 2
Примеры высвобождения для различных, полученных согласно изобретению стент-трансплантатов, а также всех стентов с полимерными поверхностями
Все величины указаны в мкг.
Для анализа в отношении высвобождения биологически активного вещества стент инкубировали при температуре 37°С в 10 мл забуференного фосфатом физиологического раствора (стабилизированного с помощью азида натрия). По истечении определенного промежутка времени 2х1 мл раствора удаляли и анализировали. Эти 2 мл заменяли свежим забуференным фосфатом физиологическим раствором (стабилизированным с помощью азида натрия).
В таблицах указано общее высвободившееся количество биологически активного вещества в растворе. Это означает, что количество биологически активного вещества в отобранном для анализа объеме буфера добавляли к отобранному в последующий момент количеству.
| Таблица 2 |
| Винбластин |
спустя
1 час |
спустя
3 часа |
спустя
8 часов |
спустя
24 часа |
спустя
96 часа
спустя 72 часа |
| Биологически Активное Вещество /тип А |
73 и 75
среднее: 74 |
108 и 114
среднее: 109 |
121 и 126
среднее: 124 |
106 и 120
среднее: 113 |
132 и 140 (96 часов)
среднее: 136 |
| |
37 и 41
среднее:
39 |
48 и 51
среднее:
50 |
47 и 58
среднее:
42 |
57 и 62
среднее: 60 |
56 и 57
(72 часа)
среднее: 57 |
| |
80 и 86
среднее: 83 |
99 и 104 среднее: 102 |
108 и 117
среднее: 113 |
117 и 127
среднее: 122 |
113 и 121 (72 часа)
среднее: 117 |
А: опыты с растворенными твердыми веществами, при которых стент-трансплантаты с полимерным слоем из PTFE погружали в раствор.
| Таблица 3 |
FK506
(такро-лимус) |
спустя
1 час |
спустя
3 часа |
спустя
8 часов |
спустя 24 часа |
спустя
96 часов |
спустя
192 часов |
Биологически
активное
вещество/тип |
|
|
|
|
|
|
А
1. стент |
14 и 13
среднее: 14 |
62 и 62
среднее: 62 |
92 и 99
среднее: 95 |
148 и 145 среднее: 147 |
145 и 151
среднее: 148 |
195 и 198 среднее:196 |
| |
спустя
1 час |
спустя
3 часа |
спустя
8 часов |
спустя 24 часа |
спустя
96 часов |
|
А
2. стент |
34 и 26
среднее:
30 |
56 и 57
среднее:
57 |
82 и 78
среднее:
80 |
108 и 109
среднее:
109 |
159 и 164
среднее:
161 |
|
| |
|
|
|
|
|
|
| |
|
|
|
|
|
|
| |
спустя
1 час |
спустя
3 часа |
спустя
8 часов |
спустя 24 часа |
Спустя
96 часов |
|
А
3. стент |
12 и 9
среднее: 11 |
47 и 43
среднее: 45 |
101 и 93
среднее: 95 |
154 и 155
среднее: 154 |
184 и 190
среднее: 187 |
|
| |
|
|
|
|
|
|
| |
|
|
|
|
|
|
А: опыты с растворенными твердыми веществами, при которых стент-трансплантаты с полимерным слоем из PTFE погружали в раствор.
| Таблица 4 |
FK506
(такро-лимус) |
спустя
1 час |
спустя
3 часа |
спустя
8 часов |
спустя 24 часа |
спустя
96 часов |
|
Биологически
активное
вещество/тип |
|
|
|
|
|
|
| С |
19 и 20
среднее: 20 |
25 и 26
среднее: 26 |
33 и 33
среднее: 33 |
41 и 39 среднее: 40 |
43 и 38
среднее: 41 |
|
| 1. стент |
|
|
|
|
|
|
| |
|
|
|
|
|
|
| |
|
|
|
|
|
|
| |
спустя
1 час |
спустя
3 часа |
спустя
8 часов |
спустя 24 часа |
спустя
96 часов |
спустя
264 часов |
| С |
20 и 27
среднее: 24 |
21 и 24
среднее: 22 |
26 и 30
среднее: 28 |
34 и 31
среднее: 32 |
37 и 35
среднее: 36 |
среднее:
85 |
| 2. стент |
|
|
|
|
|
|
| |
спустя 367 часов |
|
|
|
|
|
| |
88 и 94
среднее: 91 |
|
|
|
|
|
С: опыты с внутривенно вводимыми растворами, при которых покрытые полиуретаном стенты погружали в раствор.
| Таблица 5 |
| Пакситаксел |
спустя
1 час |
спустя
3 часа |
спустя
8 часов |
спустя 24 часа |
спустя
96 часов |
спустя
192 часа |
Биологически
активное
вещество/тип |
|
|
|
|
|
|
| А |
0,14 и 0,23
среднее: 0,19 |
0,46 и 0,53
среднее: 0,50 |
1,42 и 1,25
среднее: 1,34 |
1,65 и 1,42
среднее: 1,54 |
1,42 и 1,93
среднее: 1,68 |
2,22 и 2,24
среднее: 2,23 |
| |
0,42 и 0,52
среднее: 0,47 |
0,90 и 0,90
среднее: 0,90 |
1,16 и 1,21
среднее: 1,19 |
2,44 и 2,40
среднее: 2,42 |
2,79 и 2,78
среднее: 2,79 |
|
| |
0,20 и 0,0,16
среднее: 0,18 |
0,51 и 0,95
среднее: 0,73 |
0,89 и 0,94
среднее: 0,92 |
2,26 и 2,27
среднее: 2,27 |
2,82 и 2,82
среднее: 2,82 |
|
А: опыты с растворенными твердыми веществами, при которых стент-трансплантаты с полимерным слоем из PTFE погружали в раствор.
| Таблица 6 |
| Цисплатин |
спустя
1 час |
спустя
3 часа |
спустя
8 часов |
спустя
24 часа |
Биологически
активное
вещество/тип |
|
|
|
|
| А |
11,7 и 11,9
среднее: 11,8 |
15,4 и 15,4
среднее: 15,4 |
16,3 и 16,5
среднее: 16,4 |
16,1 и 15,9
среднее: 16,0 |
| |
5,7 и 5,4
среднее: 5,5 |
7,8 и 7,7
среднее: 7,8 |
9,9 и 9,8
среднее: 9,8 |
10,9 и 11,1
среднее: 11,0 |
| |
10,0 и 10,0
среднее: 10,0 |
11,4 и 11,8
среднее: 11,6 |
12,2 и 12,3
среднее: 12,2 |
12,4 и 12,2
среднее: 12,3 |
А: опыты с растворенными твердыми веществами, при случае которых стент-трансплантаты с полимерным слоем из PTFE погружали в раствор.
| Таблица 7 |
| Митоксантрон |
спустя
1 час |
спустя
3 часа |
спустя
8 часов |
спустя
24 часа |
Биологически
активное
вещество/тип |
|
|
|
|
| А |
57 и 86
среднее: 71 |
55 и 52
среднее: 54 |
49 и 47
среднее: 48 |
42 и 49
среднее: 45 |
| |
70 и 74
среднее: 72 |
80 и 83
среднее: 81 |
80 и 82
среднее: 81 |
72 и 75
среднее: 74 |
| |
29 и 27
среднее: 28 |
25 и 27
среднее: 26 |
23 и 21
среднее: 22 |
24 и 29
среднее: 27 |
А: опыты с растворенными твердыми веществами, при которых стент-трансплантаты с полимерным слоем из PTFE погружали в раствор.
Пример 3
Способ получения (1) покрытых FK506 имплантатов
10 мг FK506 растворяют в 3 мл этанола. Стенты из высококачественной стали без покрытия погружают в раствор и выдерживают под вакуумом в течение ночи при комнатной температуре. Промывают трижды по одной минуте солевым раствором. Высушивают в течение ночи.
Пример 4
Способ получения (2) покрытых FK506 стент-трансплантатов
Дозировку FK506 можно изменять в зависимости от длины стента и диаметра, а также в зависимости от применения в организме. В данном случае используют дозировку 10-200 мкг FK506 на см длины стента. FK506 растворяют в этаноле в маленьком стеклянном сосуде (соответственно желательной дозировке) и раствор визуально оценивают на наличие кристаллов. Предварительно не подвергнутые обработке стент-трансплантаты (“JOSTENT Coronary Stent Graft”), состоящие из сэндвичевой конструкции двух стентов из высококачественной стали с мембраной из PTFE, устанавливают на держателях. С помощью пипетки на установленный стент-трансплантат наносят соответствующее количество раствора FK506 (5-30 мкл). Эту стадию по желанию можно повторять с целью нанесения на имплантат гораздо больших количеств FK506, обычно одно или двукратно. В настоящем случае процесс повторяют двукратно. После того, как стент-трансплантат полностью нагружен, его осторожно снимают с держателя. После кратковременного высушивания на воздухе (примерно в течение 5 минут), в случае необходимости, при подводе тепла стенты можно упаковывать. Все стенты исследуют под лупой на наличие коагулятов медикаментов и, в случае необходимости, отбрасывают.
Пример 5
Способ получения (3) покрытых FK506 стентов, имеющих керамическое покрытие
50 мг FK506 растворяют в 10 мл этанола в стеклянном сосуде. Из этого исходного раствора при необходимости путем разведения приготовляют любые другие концентрации (разведения от 1:1 до 1:20). Раствор визуально оценивают на наличие кристаллов. Ненагруженные, покрытые слоем оксида алюминия (согласно заявке РСТ WO-00/25841, см. также пример 7 в отношении керамического покрытия) стенты устанавливают на держателях. С помощью шприца для инъекций на стент наносят по каплям раствор FK506 (5-50 мкл). При этом раствор должен быть распределен по всему стенту. Нагруженный стент осторожно снимают с держателя. После кратковременного высушивания на воздухе (примерно в течение 5 минут), в случае необходимости, при подводе тепла стенты можно упаковывать. Все стенты исследуют под лупой на наличие коагулятов медикаментов и, в случае необходимости, отбрасывают.
Пример 6
Новый альтернативный способ получения (4) (применим, в частности, для FK506, однако также для других биологически активных веществ), в частности, для получения стерильных стентов, стент-трансплантатов или, соответственно, стентов с полимерными поверхностями
Используют маленькие склянки для инъекций, которые не очень намного больше, чем стенты. Стерильные коронарные стент-трансплантаты (CSG’s) в стерильных условиях помещают в стерильные склянки для инъекций. В склянки добавляют 0,5 мл подвергнутого стерильной фильтрации раствора FK506 (3,3 мг/мл в этаноле). Склянки закрывают резиновыми пробками. Стерильную канюлю для инъекции со стерильным фильтром вводят путем прокалывания через середину резиновой пробки. Склянки устанавливают горизонтально в эксикаторе под вакуумом на роликовом устройстве. Склянки вращают в течение ночи в вакууме. Иглу для инъекции удаляют. Не промывают. Стерильные CSG’s готовы для употребления.
Пример 7
Выбор возможных биологически активных веществ для высвобождающего биологически активное вещество стента, в частности, с несколькими слоями, как, например, стенты с полимерными поверхностями или стент-трансплантаты, и т.д.
Способы загрузки описываются ниже в виде технологических приемов. Перечисленные биологически активные вещества охватывают также производные и все виды солей, энантиомеров, рацематов, оснований или свободных кислот. Особый интерес в данном случае представляют стенты, стент-трансплантаты или стенты с полимерными поверхностями, которые содержат и, соответственно, высвобождают одно, два или три из нижеперечисленных биологически активных веществ. При этом перечисленные биологически активные вещества по их предпочтительному профилю высвобождения или периоду высвобождения разделяют на группы 1-3. При этом также предпочтительно, когда стенты, стент-трансплантаты или стенты с полимерными поверхностями содержат биологически активные вещества из разных групп.
| Таблица 8 |
Фаза I – вазодилатация (группа 1)
Биологически активные вещества, которые высвобождаются, в частности, в течение первых 24-72 часов после введения стента |
| Биологически активное вещество |
|
|
| Молсидомин, линсидомин, нитропруссид натрия, нитроглицерин, общие доноры NO |
|
|
| Стимуляторы растворимой гуанилатциклазы, как BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин) |
|
|
| Гидралазин |
|
|
| Верапамил, дилтиазем, нифедипин, нимодипин и другие блокаторы Са2+-канала |
|
|
| Каптоприл, эналаприл, лизиноприл, квинаприл и другие ингибиторы ангиотензинконвертирующих ферментов |
|
|
| Лосартан, кандесартан, ирбесартан, валсартан и другие антагонисты рецептора ангиотензина II |
|
|
| Таблица 9 |
Фаза II – ингибирование воспаления, иммуносупрессии, активации роста эндотелиальных клеток, ингибирование миграции клеток (группа 2)
Биологически активные вещества, которые высвобождаются, в частности, в течение первых 2-21 дней после введения стента |
| Биологически активное вещество |
|
|
| Дексаметазон, бетаметазон, перднизон и другие кортикостероиды |
|
|
| 17-бета-эстрадиол |
|
|
| FK506 (такролимус) |
|
|
| Циклоспорин |
|
|
| Микофеноловая кислота |
|
|
| VEGF, активаторы VEGF-рецептора |
|
|
| Траниласт |
|
|
| Мелоксикам, целебрекс, виокс и другие антагонисты СОХ-2 |
|
|
| Индометацин, диклофенак, ибупрофен, напроксен и другие ингибиторы СОХ-1 |
|
|
| Ингибитор-1 активатора плазминогена и другие серпины |
|
|
| Ингибиторы тромбина, как гирудин, гирулог, агратробан, РРАСК и т.д. |
|
|
| Интерлейкин-10 |
|
|
| Таблица 10 |
Фаза III – ингибирование клеточной пролиферации (группа 3)
Биологически активные вещества, которые высвобождаются, в частности, в течение первых 14 дней – 3 месяцев после введения стента |
| Биологически активное вещество |
|
|
| Сиролимус, SDZ RAD (40-О-(2-гидроксиэтил)рапамицин) и другие производные рапамицина |
|
|
| Антагонисты PDGF |
|
|
| Паклитаксел |
|
|
| Цисплатин |
|
|
| Винбластин |
|
|
| Митоксантрон |
|
|
| Комбретастатин А4 |
|
|
| Топотекан |
|
|
| Метотрексат |
|
|
| Флавопиридол |
|
|
Локальное применение биологически активного вещества достигается путем прямого выделения с нагруженной биологически активным веществом поверхности коронарного или периферического стента. Нагруженная биологически активным веществом поверхность стента может достигаться за счет использования различных технологических приемов. Любой из этих приемов можно осуществлять таким образом, что биологически активное вещество высвобождается поверхностью либо в течение короткого (часы), либо в течение длительного периода времени (дни). Кинетику высвобождения можно приспосабливать благодаря тому, что на поверхности производятся специфические модификации, такие как, например, гидрофобные или гидрофильные боковые цепи полимерного носителя или керамическая поверхность.
Керамическое покрытие
Покрытие из оксида алюминия (заявки на патенты ФРГ 19855421 и 19910188, Международная заявка WO-00/25841) с пористой поверхностью можно нагружать биологически активным веществом (например, FK506 в количествах от 10 мкг до 10 мг) либо путем погружения, напыления или с помощью сравнимой технологии. Доза биологически активного вещества зависит от рода сосуда-мишени и от состояния пациента и выбирается таким образом, что в достаточной степени ингибируется пролиферация, миграция и ответ Т-клеток, не мешая процессу излечивания. Биологически активное вещество можно применять в виде водного или органического раствора, например, в диметилсульфоксиде, диметилформамиде и этаноле. После опрыскивания или погружения (при слабом вакууме) обработанный стент высушивают и процесс повторяют 1-5 раз. После последней стадии высушивания стент промывают в течение 1 минуты при комнатной температуре в воде или изотоническом солевом растворе и затем снова высушивают. Содержание биологически активного вещества после извлечения биологически активного вещества с помощью пригодного растворителя может определяться стандартными методами (HPLC, масс-спектрометрия с жидкостной хроматографией). Кинетики высвобождения можно измерять при использовании стандартной аппаратуры для определения высвобождения.
Мембрана из PTFE: стент-трансплантат
В этом случае используют идентичный описанному выше прием. Биологически активное вещество включают в углубления пористой мембраны из PTFE.
Общее полимерное покрытие
Для нагрузки биологически активным веществом пригодны различные полимеры: полиметакрилаты, полиуретановые покрытия, покрытия из PTFE или покрытия из гидрогеля. Биологически активное вещество можно либо наносить на конечную поверхность (см. выше), либо вводить непосредственно в полимеризационный раствор. В остальных деталях этот технологический прием соответствует уже описанным выше.
Механический прием
Механический прием основан на углублениях, которые делают на укосинах стента с помощью режущего лазера. Эти углубления затем можно заполнять биологически активным веществом. Механический (углубления) прием можно комбинировать с таковым для нанесения тонкого биоразлагаемого покрытия, которое само нагружено биологически активным веществом. После первоначального высвобождения из биоразлагаемого покрытия биологически активное вещество может длительно высвобождаться из заполненных биологически активным веществом углублений. В остальных деталях этот технологический прием соответствует уже описанным выше.
Пример 8
Высвобождение биологически активных веществ кандесартана и квинаприла из имплантатов с (полимерным) покрытием
а) Стенты снабжают пористой мембраной из PTFE. Эту мембрану затем нагружают смесью биологически активных веществ из кандесартана и квинаприла (по 1 мг). Оба биологически активных вещества высвобождаются одновременно. Высвобождение определяют в забуференном фосфатом солевом растворе. На фигуре 2 представлено высвобождение биологически активных веществ кандесартана и квинаприла из стента.
b) Стенты с открытыми порами из высококачественной стали снабжали полиуретановым покрытием. Смесь биологически активных веществ из кандесартана и квинаприла (по 15 % в расчете на содержание полиуретана) вносили в 5 %-ный раствор полиуретана в диметилацетамиде и наносили на стент по способу опрыскивания. На фигуре 3 представлено соответствующее высвобождение биологически активных веществ.
с) Стенты с открытыми порами из высококачественной стали снабжали покрытием из смеси полиуретан/гидрогель. Смесь биологически активных веществ из кандесартана и квинаприла (по 15 % в расчете на содержание полимеров) вносили в 5 %-ный раствор смеси полимеров в диметилацетамиде и наносили на стент по способу опрыскивания. На фигуре 4 представлено соответствующее высвобождение биологически активных веществ.
Пример 9
Изучение кинетики высвобождения и способа действия FK506 в случае животного
На коронарные стенты из высококачественной стали (JOSTENT Flex, 16 мм) наносили керамический слой из оксида алюминия. Это покрытие служило в качестве носителя FK506 (как описано в примере 5, а также в примере 7 под заголовком “Керамическое покрытие”). В этом случае стенты нагружали в целом 60 мкг FK506. При исследовании на животном эти, покрытые FK506 стенты, а также обычные стенты без покрытия имплантировали в сонную артерию новозеландских кроликов (n = 7). Исследовали высвобождение FK506, а также действие FK506 на рост интимы и образование макрофагов и лимфоцитов.
Высвобождение FK506 определяли путем определения с помощью HPLC количества FK506 в крови кроликов спустя 1 час, 8 часов, 24 часа и 48 часов. На фигуре 5 отчетливо представлена очень хорошая кинетика высвобождения FK506 в течение времени. Спустя 28 дней кроликов умерщвляли и исследовали имплантированные стенты. При этом количественно определяли под микроскопом площадь новой выросшей интимы (неоинтима) внутри стента. На фигуре 6 можно отчетливо видеть, что образование неоинтимы в случае стентов с керамическим покрытием, которые нагружены с помощью FK506, отчетливо уменьшено по сравнению с обычными стентами. При нагрузке с помощью 60 мкг FK506 обнаруживают снижение на 53%. Это снижение к тому же сопровождается ощутимым уменьшением очагов воспаления. Как можно видеть на фигуре 7, отчетливо уменьшено образование макрофагов, а также лимфоцитов по сравнению с обычным стентом.
Применение стентов с керамическим покрытием, на которое наносится FK506, таким образом приводит, после имплантации, к отчетливому уменьшению неоинтимы, а также очагов воспаления.
Формула изобретения
1. Внутрикавернозный, предпочтительно интраваскулярный, имплантат, предназначенный для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности сужений, или, соответственно, стенозов, или рестенозов, предпочтительно для профилактики рестеноза, отличающийся тем, что имеет а) по меньшей мере, один(ну), состоящий(щую) из металла или сплава металлов гомогенный(ную) или образованный(ную) из различных жгутов, плотный(ную) или перфорированный(ную) слой или поверхность, на который(ую) нанесено керамическое покрытие из оксида алюминия или оксида иридия и в котором находится в химически ковалентно или нековалентно связанной или физически фиксированной форме FK506, или б) выполнен, по меньшей мере, с одним(ной) состоящим(щей) из металла или сплава металлов, гомогенным(ной) или образованным(ной) из различных жгутов, плотным(ной) или перфорированным(ной) слоем или поверхностью, в котором(рой) с помощью лазера выполнены углубления, заполненные FK506, и с нанесенным полимерным или полимеризующимся на поверхности биоразлагаемым покрытием.
2. Имплантат по п.1, отличающийся тем, что имплантат предназначен для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности сужений, или, соответственно, стенозов, или рестенозов, предпочтительно для профилактики рестеноза.
3. Имплантат по п.1, отличающийся тем, что имплантат представляет собой стент, стент-трансплантат, трансплантат, трансплантат-соединитель, мандрен, катетер или катетерный насос, предпочтительно стент, стент-трансплантат, трансплантат или трансплантат-соединитель, в частности стент или стент-трансплантат.
4. Имплантат по п.1, отличающийся тем, что керамическое покрытие полностью или частично покрыто полимерным, предпочтительно биологически разлагаемым покрытием, с которым, в случае необходимости, связан (связано) FK506 и/или другое биологически активное вещество или в котором растворен (растворено) FK506 и/или другое биологически активное вещество перед нанесением покрытия.
5. Имплантат по п.4, отличающийся тем, что имплантат имеет полимерное покрытие, в частности, из полиметакрилатов, полиуретана, PTFE, гидрогеля или смеси гидрогель/полиуретан, в частности из PTFE, с которым связан FK506 или в котором растворен FK506 перед нанесением покрытия.
6. Имплантат по п.1, отличающийся тем, что металл имплантата имеет выполненные посредством лазера углубления, которые заполнены FK506.
7. Имплантат по п.6, отличающийся тем, что снабженный заполненными FK506 углублениями металл или, по меньшей мере, углубления покрываются биологически разлагаемым полимерным материалом, причем, в случае необходимости, FK506 связывается с полимерным покрытием или FK506 перед нанесением покрытия растворен в полимерном материале.
8. Имплантат по п.1, отличающийся тем, что FK506 находится в форме нагруженных наночастиц или липосом.
9. Имплантат по п.1, получаемый по способу, при котором а) имплантат вводят в контакт с раствором FK506 в водном или органическом растворителе, например, путем обрызгивания, напыления или погружения, в случае необходимости, в вакууме; b) после этого, в случае необходимости, имплантат высушивают предпочтительно вплоть до удаления растворителя из стадии а); с) затем, в случае необходимости, повторяют стадию а), в случае необходимости, с последующей стадией b), предпочтительно многократно, в частности 1-5 раз; а также d) после этого, в случае необходимости, имплантат одно- или многократно промывают водой или изотоническим солевым раствором и е) затем, в случае необходимости, высушивают.
10. Имплантат по п.9, отличающийся тем, что на стадии a) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 0,5-5 г/л FK506 в этаноле, и/или на стадии а) имплантат вводят в контакт с раствором FK506 в водном или органическом растворителе в вакууме предпочтительно в течение ночи путем погружения, и/или исключают стадии b) и/или с), и/или на стадии d) имплантат многократно промывают солевым раствором, и/или на стадии b) имплантат высушивают в течение ночи.
11. Имплантат по п.9, отличающийся тем, что на стадии е) имплантат, предпочтительно стерильный, вносят в предпочтительно стерильный сосуд с герметизирующейся по окончании перфорации перфорируемой крышкой, например в склянку для инъекций, сосуд заполняют раствором FK506, предпочтительно стерильным, закрывают его с помощью герметизирующейся по окончании перфорации перфорируемой крышки, путем перфорации через крышку вставляют тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку, например канюлю, создают вакуум и предпочтительно раствор FK506 перемешивают и затем, предпочтительно по истечении примерно 12 ч, тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку удаляют, и/или на стадии а) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 3,3 мг FK506 в 1 мл этанола, и/или имплантат вплоть до использования оставляют в предпочтительно стерильном закрытом стеклянном сосуде согласно стадии а), и/или стадии b)-е) исключают.
12. Имплантат по п.2 или 3, получаемый по способу, при котором перед образованием, по меньшей мере, одного (одной) состоящего(щей) из полимера плотного(ной) или перфорированного(ной) слоя или поверхности или полимерного покрытия имплантата FK506 растворяют в полимеризационном материале.
13. Имплантат по п.1, отличающийся тем, что после имплантации имплантата высвобождается FK506.
14. Имплантат по п.13, отличающийся тем, что высвобождение происходит с задержкой.
15. Имплантат по п.14, отличающийся тем, что FK506 высвобождается из имплантата в течение периода времени 24 ч, предпочтительно 48 ч, в частности в течение более, чем 96 ч, после имплантации.
16. Имплантат по п.14, отличающийся тем, что FK506 высвобождается из имплантата после имплантации: а) в течение менее чем 48 ч, или b) в течение, по меньшей мере, 48 ч, предпочтительно в течение, по меньшей мере, 7 дней, в частности в течение, по меньшей мере, 2-21 дней; или с) имплантат проявляет оба вида высвобождения а) и b).
17. Имплантат по п.1, отличающийся тем, что имплантат содержит, по меньшей мере, одно другое биологически активное вещество, предпочтительно фармацевтическое биологически активное вещество, в частности другое биологически активное вещество, выбираемое из следующих биологически активных веществ или их производных: (группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]-пиридин-3-ил]пиримидин-4-иламин); гидралазин; верапамил, дилтиазем, нифедипин, нимодипин или другие блокаторы Са2+-канала; каптоприл, эналаприл, лизиноприл, квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора; (группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; 17-бета-эстрадиол; циклоспорин; микофеноловая кислота; VEGF, активаторы VEGF-рецептора; траниласт; мелоксикам, целебрекс, виокс или другие антагонисты СОХ-2; индометацин, диклофенак, ибупрофен, напроксен иди другие ингибиторы СОХ-1; ингибиторы активатора-1 плазминогена или серпинен; ингибиторы тромбина, например, гирудин, гирулог, агратробан, РРАСК; интерлейкин-10; (группа 3): сиролимус, рапамицин, SDZ RAD (40-O-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; цисплатин; винбластин; митоксантрон; комбретастатин А4; топотекан; метотрексат; флавопиридол; актиномицин D; реопро/абциксимаб или пробукол.
18. Имплантат по п.17, отличающийся тем, что выбранное из группы 1 другое биологически активное вещество высвобождается из имплантата в течение первых 24-72 ч после имплантации, и/или выбранное из группы 2 другое биологически активное вещество высвобождается из имплантата в течение первых 48 ч – 21 дня после имплантации, и/или выбранное из группы 3 другое биологически активное вещество высвобождается из имплантата в течение времени от 14 дней до трех месяцев после имплантации.
19. Внутрикавернозный, предпочтительно интраваскулярный, имплантат, содержащий в химически ковалентно или нековалентно связанной или физически фиксированной форме FK506, пригодный для лечения и профилактики рестеноза, при этом имплантат содержит покрытие из FK506 и, по меньшей мере, один(одну) состоящий(щую) из полимера, гомогенный(ную) или образованный(ную) из различных жгутов плотный(ную) или перфорированный(ную) слой или поверхность, отличающийся тем, что, по меньшей мере, один полимерный слой полностью или частично покрывает состоящий(щую) из металла или сплава металлов, гомогенный(ную) или образованный(ную) из различных жгутов плотный(ную) или перфорированный(ную) слой или поверхность, предпочтительно состоящую из металла или сплава металлов, в случае необходимости, решеткообразную структуру, причем имплантат имеет керамическое покрытие, в частности, из оксида алюминия или оксида иридия, с которым связан FK506.
20. Имплантат по п.19, отличающийся тем, что состоящий(щая) из металла или сплава металлов слой или поверхность представляет собой состоящую из металла или сплава металлов, в случае необходимости, решеткообразую структуру и/или состоящий(щая) из полимера слой или поверхность является гомогенной плотной, или тканой, и/или водонепроницаемой, и/или корпускулонепроницаемой, и/или последовательность слоев и поверхностей снаружи внутрь представляет собой металл-полимер, полимер-металл, металл-полимер-металл или полимер-металл-полимер и/или либо состоящий(щая) из полимера слой или поверхность нехимически (ковалентно или нековалентно) связан (связана) с состоящим(щей) из металла или сплава металлов слоем или поверхностью, либо состоящий(щая) из полимера слой или поверхность посредством клея связан (связана) с состоящим(щей) из металла или сплава металлов слоем или поверхностью.
21. Имплантат по п.19, отличающийся тем, что полимер выбран из дакрона; растяжимого или нерастяжимого политетрафторэтилена (PTFE/тефлон); полиуретана; полиметакрилатов; гидрогеля или смеси гидрогель/полиуретан, предпочтительно из растяжимого или нерастяжимого политетрафторэтилена (PTFE); или полиуретана, в частности из PTFE.
22. Имплантат по п.19, отличающийся тем, что имплантат предназначен для лечения или профилактики коронарных или периферических сужений или закупорок сосудов, в частности сужений, или, соответственно, стенозов, или рестенозов, предпочтительно для профилактики рестеноза.
23. Имплантат по п.19, отличающийся тем, что имплантат представляет собой стент, стент-трансплантат, трансплантат, трансплантат-соединитель, мандрен, катетер или катетерный насос, предпочтительно стент, стент-трансплантат, трансплантат или трансплантат-соединитель, в частности стент или стент-трансплантат.
24. Имплантат по п.19, отличающийся тем, что керамическое покрытие полностью или частично покрыто полимерным предпочтительно биологически разлагаемым покрытием, с которым, в случае необходимости, связан (связано) FK506 и/или другое биологически активное вещество или в котором растворен (растворено) FK506 и/или другое биологически активное вещество перед нанесением покрытия.
25. Имплантат по п.19, отличающийся тем, что имплантат имеет полимерное покрытие, в частности, из полиметакрилатов, полиуретана, PTFE, гидрогеля или смеси гидрогель/полиуретан, в частности из PTFE, с которым связан FK506 или в котором растворен FK506 перед нанесением покрытия.
26. Имплантат по п.19, отличающийся тем, что металл имплантата имеет выполненные посредством лазера углубления, которые заполнены FK506.
27. Имплантат по п.19, отличающийся тем, что снабженный заполненными FK506 углублениями металл или, по меньшей мере, углубления покрываются биологически разлагаемым полимерным материалом, причем, в случае необходимости, FK506 связывается с полимерным покрытием или FK506 перед нанесением покрытия растворен в полимерном материале.
28. Имплантат по п.19, отличающийся тем, что FK506 находится в форме нагруженных наночастиц или липосом.
29. Имплантат по п.19, получаемый по способу, при котором а) имплантат вводят в контакт с раствором FK506 в водном или органическом растворителе, например, путем обрызгивания, напыления или погружения, в случае необходимости, в вакууме; b) после этого, в случае необходимости, имплантат высушивают предпочтительно вплоть до удаления растворителя из стадии а); с) затем, в случае необходимости, повторяют стадию а), в случае необходимости, с последующей стадией b), предпочтительно многократно, в частности 1-5 раз; а также d) после этого, в случае необходимости, имплантат одно- или многократно промывают водой или изотоническим солевым раствором и е) затем, в случае необходимости, высушивают.
30. Имплантат по п.29, отличающийся тем, что на стадии а) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 0,5-5 г/л FK506 в этаноле, и/или в стадии а) имплантат вводят в контакт с раствором FK506 в водном или органическом растворителе в вакууме предпочтительно в течение ночи путем погружения, и/или исключают стадии b) и/или с), и/или на стадии d) имплантат многократно промывают солевым раствором, и/или на стадии е) имплантат высушивают в течение ночи.
31. Имплантат по п.29, отличающийся тем, что на стадии а) имплантат, предпочтительно стерильный, вносят в предпочтительно стерильный сосуд с герметизирующейся по окончании перфорации перфорируемой крышкой, например в склянку для инъекций, сосуд заполняют раствором FK506, предпочтительно стерильным, закрывают его с помощью герметизирующейся по окончании перфорации перфорируемой крышки, путем перфорации через крышку вставляют тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку, например канюлю, создают вакуум и предпочтительно раствор FK506 перемешивают и затем предпочтительно по истечении примерно 12 ч тонкую предпочтительно стерильную воздухопроницаемую вентиляционную трубку удаляют, и/или на стадии а) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 3,3 мг FK506 в 1 мл этанола, и/или имплантат вплоть до использования оставляют в предпочтительно стерильном закрытом стеклянном сосуде согласно стадии а), и/или стадии b)-е) исключают.
32. Имплантат по п.19, получаемый по способу, при котором перед образованием, по меньшей мере, одного (одной) состоящего(щей) из полимера плотного(ной) или перфорированного(ной) слоя или поверхности или полимерного покрытия имплантата FK506 растворяют в полимеризационном материале.
33. Имплантат по п.19, отличающийся тем, что после имплантации имплантата высвобождается FK506.
34. Имплантат по п.33, отличающийся тем, что высвобождение происходит с задержкой.
35. Имплантат по п.34, отличающийся тем, что FK506 высвобождается из имплантата в течение периода времени 24 ч, предпочтительно 48 ч, в частности в течение более, чем 96 ч, после имплантации.
36. Имплантат по п.34, отличающийся тем, что FK506 высвобождается из имплантата после имплантации: а) в течение менее чем 48 ч, или b) в течение, по меньшей мере, 48 ч, предпочтительно в течение, по меньшей мере, 7 дней, в частности в течение, по меньшей мере, 2-21 дней; или с) имплантат проявляет оба вида высвобождения а) и b).
37. Имплантат по п.19, отличающийся тем, что имплантат содержит, по меньшей мере, одно другое биологически активное вещество, предпочтительно фармацевтическое биологически активное вещество, в частности другое биологически активное вещество, выбираемое из следующих биологически активных веществ или их производных: (группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]-пиридин-3-ил]пиримидин-4-иламин); гидралазин; верапамил, дилтиазем, нифедипин, нимодипин или другие блокаторы Са2+-канала; каптоприл, эналаприл, лизиноприл, квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора; (группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; 17-бета-эстрадиол; циклоспорин; микофеноловая кислота; VEGF, активаторы VEGF-рецептора; траниласт; мелоксикам, целебрекс, виокс или другие антагонисты СОХ-2; индометацин, диклофенак, ибупрофен, напроксен или другие ингибиторы СОХ-1; ингибиторы активатора-1 плазминогена или серпинен; ингибиторы тромбина, например, гирудин, гирулог, агратробан, РРАСК; интерлейкин-10; (группа 3): сиролимус, рапамицин, SDZ RAD (40-O-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; цисплатин; винбластин; митоксантрон; комбретастатин А4; топотекан; метотрексат; флавопиридол; актиномицин D; реопро/абциксимаб или пробукол.
38.Имплантат по п.37, отличающийся тем, что выбранное из группы 1 другое биологически активное вещество высвобождается из имплантата в течение первых 24-72 ч после имплантации, и/или выбранное из группы 2 другое биологически активное вещество высвобождается из имплантата в течение первых 48 ч – 21 дня после имплантации, и/или выбранное из группы 3 другое биологически активное вещество высвобождается из имплантата в течение времени от 14 дней до трех месяцев после имплантации.
39. Способ получения имплантата по п.1 или 19 содержащий следующие стадии: а) имплантат вводят в контакт с раствором FK506 в водном или органическом растворителе, например, путем обрызгивания, напыления или погружения, в случае необходимости, в вакууме; б) после этого, в случае необходимости, имплантат высушивают, предпочтительно вплоть до испарения растворителя из стадии а); с) затем, в случае необходимости, повторяют стадию (а), в случае необходимости, с последующей стадией b), предпочтительно многократно, в частности 1-5 раз; а также d) после этого, в случае необходимости, имплантат одно- или многократно промывают водой или изотоническим солевым раствором и е) затем, в случае необходимости, высушивают.
40. Способ по п.39, отличающийся тем, что на стадии а) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 0,5-5 г/л FK506 в этаноле, и/или на стадии а) имплантат вводят в контакт с раствором FK506 в водном или органическом растворителе в вакууме предпочтительно в течение ночи путем погружения, и/или исключают стадии b) и/или с), и/или на стадии d) имплантат многократно промывают солевым раствором, и/или на стадии е) имплантат высушивают в течение ночи.
41. Способ по п.39, отличающийся тем, что на стадии а) имплантат, предпочтительно стерильный, вносят в предпочтительно стерильный сосуд с герметизирующейся по окончании перфорации перфорируемой крышкой, например в склянку для инъекций, сосуд заполняют раствором FK506, предпочтительно стерильным, закрывают его с помощью герметизирующейся по окончании перфорации перфорируемой крышки, путем перфорации через крышку вставляют тонкую, предпочтительно стерильную, воздухопроницаемую вентиляционную трубку, например канюлю, создают вакуум и предпочтительно раствор FK506 перемешивают и затем, предпочтительно по истечении примерно 12 ч, тонкую предпочтительно стерильную воздухопроницаемую вентиляционную трубку удаляют, и/или на стадии a) FK506 растворяют в спирте, предпочтительно в этаноле, в частности, в концентрации 3,3 мг FK506 в 1 мл этанола, и/или имплантат вплоть до использования оставляют в предпочтительно стерильном закрытом стеклянном сосуде согласно стадии а), и/или стадии b)-е) исключают.
42. Способ получения имплантата по п.19, при котором перед образованием, по меньшей мере, одного (одной) состоящего(щей) из полимера плотного(ной) или перфорированного(ной) слоя или поверхности или полимерного покрытия имплантата FK506 растворяют в полимеризационном материале.
43. Способ получения покрытых биологически активными веществами имплантатов, покрытых активными веществами с FK506 содержащий следующие стадии: а) имплантат по п.1, предпочтительно стерильный, вносят в предпочтительно стерильный сосуд с герметизирующейся по окончании перфорации перфорируемой крышкой, например в склянку для инъекции; b) в сосуд вводят предпочтительно стерильный раствор биологически активного вещества предпочтительно в органическом растворителе с малым давлением пара, в частности в спирте, таком, как этанол или метанол; с) сосуд закрывают с помощью герметизирующейся по окончании перфорации перфорируемой крышкой; d) путем перфорации через крышку вставляют тонкую предпочтительно стерильную воздухопроницаемую вентиляционную трубку, например канюлю; е) в случае необходимости, создают вакуум, причем предпочтительно раствор биологически активного вещества перемешивают; f) затем предпочтительно по истечении примерно 12 ч, тонкую предпочтительно стерильную воздухопроницаемую вентиляционную трубку удаляют и g) в случае необходимости, имплантат вплоть до использования оставляют в предпочтительно стерильном закупоренном стеклянном сосуде согласно стадии а).
44. Способ по п.43, отличающийся тем, что имплантат согласно стадии а) имеет, по меньшей мере, одну(один) металлическую(кий) перфорированную(ный) или плотную(ный) поверхность или слой, имеет керамическое покрытие, имеет полимерное покрытие и/или имеет, по меньшей мере, одну (один) полимерную(ный) перфорированную(ный) или плотную(ный) поверхность или слой.
45. Способ по п.42 или 43, отличающийся тем, что имплантат представляет собой стент, стент-трансплантат, трансплантат, трансплантат-соединитель, стент с полимерными поверхностями или катетер.
46. Способ по п.42 или 43, отличающийся тем, что биологически активное вещество выбирают из фармацевтических биологически активных веществ, как, например, иммуносупрессивных средств или антибиотиков, предпочтительно выбирают из следующих биологически активных веществ или их производных: (группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин); гидралазин; верапамил, дилтиазем, нифедипин, нимодипин или другие блокаторы Са2+-канала; каптоприл, эналаприл, лизиноприл; квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора; (группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; FK506 (такролимус); 17-бета-эстрадиол; циклоспорин; микофеноловая кислота; VEGF, активаторы VEGF-рецептора; траниласт; мелоксикам, целебрекс, виокс или другие антагонисты СОХ-2; индометацин, диклофенак, ибупрофен, напроксен или другие ингибиторы СОХ-1; ингибиторы активатора-1 плазминогена или серпинен; ингибиторы тромбина, например, гирудин, гирулог, агратробан, РРАСК; интерлейкин-10; (группа 3): сиролимус; рапамицин, SDZ RAD (40-O-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; цисплатин; винбластин; митоксантрон; комбретастатин А4; топотекан; метотрексат; флавопиридол; актиномицин D; реопро/абциксимаб или пробукол; в частности выбирают из следующих биологически активных веществ: (группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин); каптоприл, эналаприл, лизиноприл, квинаприл или; другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора; (группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; FK506 (такролимус); VEGF, активаторы VEGF-рецептора; ингибиторы активатора-1 плазминогена или серпинен; (группа 3): сиролимус; рапамицин, SDZ RAD (40-O-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел 1 или 7-гексаноилтаксол; митоксантрон; комбретастатин А4; флавопиридол.
47. Применение FK506 для покрытия или для получения имплантата в целях лечения коронарных или периферических сужений или закупорок сосудов, в том числе сужений или, соответственно, стенозов или рестенозов, предпочтительно для профилактики рестеноза.
48. Применение по п.47, отличающееся тем, что имплантат представляет собой стент, стент-трансплантат, трансплантат, трансплантат-соединитель, мандрен, катетер или катетерный насос, предпочтительно стент, стент-трансплантат, трансплантат или трансплантат-соединитель, в частности стент, или стент-трансплантат, или стент с полимерными поверхностями.
49. Применение по п.47 или 48, отличающееся тем, что FK506 связан или прикреплен к имплантату таким образом, что после имплантации он высвобождается из имплантата, предпочтительно с задержкой.
50. Стент с полимерными поверхностями, содержащий, по меньшей мере, одно физиологически и/или фармацевтически активное вещество с FK506 в химически ковалентно или нековалентно связанной или физически фиксированной форме и, по меньшей мере, одно другое биологически активное вещество для лечения и профилактики рестеноза.
51. Стент по п.50, отличающийся тем, что биологически активное вещество выбрано из фармацевтических активных веществ, таких, как, например, иммуносупрессивных средств или антибиотиков, предпочтительно выбрано из следующих биологически активных веществ или их производных: (группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло[3,4-n]пиридин-3-ил]пиримидин-4-иламин); гидралазин; верапамил, дилтиазем, нифедипин, нимодипин или другие блокаторы Са2+-канала; каптоприл, эналаприл, лизиноприл, квинаприл или другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора; (группа 2): дексаметазон, бетаметазон, преднизон или другие кортикостероиды; FK506 (такролимус); 17-бета-эстрадиол; циклоспорин; микофеноловая кислота; VEGF, активаторы VEGF-рецептора; траниласт; мелоксикам, целебрекс, виокс или другие антагонисты СОХ-2; индометацин, диклофенак, ибупрофен, напроксен или другие ингибиторы СОХ-1; ингибиторы активатора-1 плазминогена или серпинен; ингибиторы тромбина, например, гирудин, гирулог, агратробан, РРАСК; интерлейкин-10; (группа 3): сиролимус; рапамицин, SDZ RAD (40-O-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; цисплатин; винбластин; митоксантрон; комбретастатин А4; топотекан; метотрексат; флавопиридол; актиномицин D; реопро/абциксимаб или пробукол; в частности, выбрано из следующих биологически активных веществ: (группа 1): молсидомин, линсидомин, нитропруссид натрия, нитроглицерин или общие доноры NO; стимуляторы растворимой гуанилатциклазы (sGC/растворимая гуанилатциклаза), например BAY 41-2272 (5-(циклопропил-2-[1-(2-фторбензил)-1Н-пиразоло [3,4-n]пиридин-3-ил]пиримидин-4-иламин); каптоприл, эналаприл, лизиноприл, квинаприл или; другие ингибиторы ангиотензинконвертирующих ферментов; лосартан, кандесартан, ирбесартан, валсартан или другие антагонисты ангиотензин II-рецептора; (группа 2): дексаметазон, бетаметазон, преднизон или кортикостероиды; FK506 (такролимус); VEGF, активаторы VEGF-рецептора; ингибиторы активатора-1 плазминогена или серпинен; (группа 3): сиролимус; рапамицин, SDZ RAD (40-O-(2-гидроксиэтил)рапамицин) или другие производные рапамицина; антагонисты PDGF; паклитаксел или 7-гексаноилтаксол; митоксантрон; комбретастатин А4; флавопиридол; и/или стент с полимерными поверхностями содержит, по меньшей мере, два, предпочтительно 2 или 3, физиологически и/или фармацевтически активных вещества, выбираемых из одной из групп 1-3, предпочтительно максимально одно биологически активное вещество из одной группы.
52. Стент по п.51, отличающийся тем, что выбранное из группы 1 другое биологически активное вещество высвобождается из имплантата в течение первых 24-72 ч после имплантации, и/или выбранное из группы 2 другое биологически активное вещество высвобождается из имплантата в течение первых 48 ч – 21 дня после имплантации, и/или выбранное из группы 3 другое биологически активное вещество высвобождается из имплантата в течение времени от 14 дней до 3 месяцев после имплантации.
РИСУНКИ
|
|