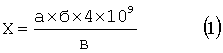Патент на изобретение №2332667
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ОЦЕНКИ ГРАНУЛОЦИТОПОЭЗСТИМУЛИРУЮЩЕЙ АКТИВНОСТИ ФАРМАКОЛОГИЧЕСКИХ ВЕЩЕСТВ
(57) Реферат:
Изобретение относится к области экспериментальной медицины, конкретно к гематологии и фармакологии. Предложенный способ заключается в том, что после воспроизведения гипоплазии кроветворения у экспериментальных животных (мышей) путем однократного введения цитостатика в максимально переносимой дозе (МПД) (циклофосфана либо 5-фторурацила) производят подсчет абсолютного количества клеток гранулоцитарного ростка кроветворения – нейтрофилов – в периферической крови до и после введения вещества, при этом достоверным критерием гранулоцитипоэзстимулирующей активности вводимого фармакологического вещества является увеличение числа нейтрофилов до 150% и более. Технический результат представляет собой упрощение способа определения гранулоцитопоэзстимулирующей активности фармакологических веществ и расширение сферы его применения. 3 табл.
(56) (продолжение): Изобретение относится к области экспериментальной медицины, конкретно к гематологии и фармакологии. Известны адекватные и высокочувствительные способы определения гранулоцитопоэзстимулирующей активности различных фармакологических средств и синтетических и природных соединений [1]. Однако их общим недостатком во всех случаях является значительная трудоемкость, необходимость развитой материально-технической базы и сложность используемых методик. Известен способ определения гранулоцитопоэзстимулирующей активности фармакологических веществ по регистрации абсолютного количества незрелых нейтрофильных гранулоцитов в костном мозге экспериментальных животных до и после введения фармакологического вещества на фоне моделирования цитостатической миелосупрессии, и при увеличении их количества не менее чем в 2 раза считают вводимое вещество активным [1]. Данный способ является наиболее близким к предлагаемому по технической сущности и достигаемому результату и выбран в качестве прототипа. Изучение показателей, регистрируемых по способу-прототипу, требует значительных трудозатрат, навыка исследователя и достаточно длительного времени (изучение общей клеточности костного мозга и подсчет миелограмм). Задачей, решаемой данным изобретением, является упрощение способа определения гранулоцитопоэзстимулирующей активности фармакологических веществ. Поставленная задача достигается тем, что после воспроизведения гипоплазии кроветворения у экспериментальных животных (мышей) путем однократного введения цитостатика в максимально переносимой дозе (МПД) (циклофосфана либо 5-фторурацила) производят подсчет абсолютного количества клеток гранулоцитарного ростка кроветворения – нейтрофилов – в периферической крови, при этом критерием достаточной гранулоцитопоэзстимулирующей эффективности является увеличение их числа до 150% и более. Новым в предлагаемом способе является определение количества клеток гранулоцитарного ростка кроветворения в периферической крови и использование в качестве критерия гранулоцитопоэзстимулирующей активности увеличение абсолютного числа нейтрофилов до 150% и более после введения фармакологического вещества. Одной из актуальных проблем экспериментальной гематологии и фармакологии является поиск новых эффективных лекарственных средств, способных стимулировать кроветворение при гипопластических состояниях различного генеза. Используемые в настоящее время с этой целью в эксперименте и клинике препараты зачастую являются малоэффективными, либо обладают рядом нежелательных эффектов, либо высокой стоимостью [1, 2, 3]. Таким образом, весьма перспективным можно считать создание и изучение потенциальных стимуляторов, в том числе и грануломоноцитопоэза. В связи с этим становится актуальной и проблема разработки быстрой, качественной и достоверной оценки гранулоцитопоэзстимулирующей активности средств, планируемых к применению в качестве гемостимуляторов. Клетки гранулоцитарного ряда периферической крови (нейтрофилы) представляют собой очень мобильную фракцию клеточных элементов: при их выходе из органов гемопоэза они могут участвовать в создании маргинального сосудистого резервного пула лейкоцитов, циркулировать определенное время в токе крови либо, напротив, быстро мигрировать в ткани организма [4, 5]. В связи с этим даже при одном уровне продукции нейтрофилов в гемопоэтической ткани и их одинаково быстром выходе из органов гемопоэза при различных физиологических и патологических состояниях число нейтрофилов в периферической крови может колебаться в определенных пределах. Поэтому факт использования в качестве достоверного критерия эффективности гранулоцитопоэзстимулирующей активности увеличение в периферической крови числа нейтрофилов до 150% и более с целью упрощения способа определения гранулоцитопоэзстимулирующей активности веществ для специалиста является неочевидным. Заявляемые существенные признаки проявили в совокупности новые свойства, не являющиеся очевидными для специалиста и не вытекающие явным образом из уровня техники в данной области. Новые признаки позволяют быстро, качественно и достоверно определять гранулоцитипоэзстимулирующую активность веществ, планируемых к применению в качестве стимуляторов гранулоцитопоэза, и предлагаемое изобретение может быть использовано в экспериментальной медицине с выходом в практическое здравоохранение для создания новых эффективных гемостимуляторов. Идентичной совокупности признаков при исследовании уровня техники по патентной и научно-медицинской литературе не обнаружено. Исходя из вышеизложенного, следует считать заявляемое техническое решение соответствующим критериям: «новизна», «изобретательский уровень», «промышленная применимость». Способ осуществляют следующим образом. Экспериментальным животным (мыши) путем однократного внутрибрюшинного введения цитостатика в максимально переносимой дозе (МПД) (циклофосфан, 5-фторурацил) воспроизводится гипоплазия кроветворения. Через 24 ч после инъекции цитостатика опытным мышам начинают вводить препарат, планируемый к применению в качестве стимулятора гранулоцитопоэза. Режим и доза введения каждого препарата определяется индивидуально в зависимости от его ожидаемой специфической активности, токсичности, побочных эффектов и пр. факторов. Контрольные животные после введения цитостатика аналогичным способом введения и в соответствующем режиме получают физиологический раствор. На следующие сутки после окончания введения испытуемого средства у мышей обеих групп производят забор периферической крови для исследования лейкоцитов. Для этой цели можно использовать как автоматический гематологический анализатор, так и общепринятые стандартные гематологические методы [6], один из которых приведен ниже. В этом случае из надреза предварительно обработанного спиртом кончика хвоста выдавливают каплю крови, которая набирается до отметки «0,5» в смеситель для белой крови и разводится до метки «11» 3-5%-ным раствором уксусной кислоты, после чего содержимое смесителя тщательно перемешивается в течение 2-3 мин. Перед заполнением камеры Горяева две капли жидкости из смесителя удаляют. Подсчет ведут в 100 больших квадратах, сгруппированных по 4 (объектив 8, окуляр 15). Подсчитав число лейкоцитов во всех 100 квадратах, записывают результат, а затем производят расчет по формуле:
где Х – количество лейкоцитов в 1 л крови; а – сумма лейкоцитов, подсчитанных в 100 квадратах; б – разведение крови в 20 раз; в – число сосчитанных малых квадратов – 1600; 4×109 – множитель, приводящий результат к 1 л крови. Одновременно с набором крови в смеситель готовят тонкие мазки крови для подсчета лейкоцитарной формулы на заранее обезжиренных предметных стеклах и высушивают их на воздухе. Зафиксированные (3-5 мин в метаноле) мазки окрашивают по методу Нохта-Максимова. Краска для этого готовится путем смешивания очищенной воды, 0,1%-ного водного раствора азура II (ТУ 6-09-07-553-75) и 0,1%-ного водного раствора эозина (ТУ 6-09-183-75) в соотношении 6:1:0,5. Окрашивание длится 35-45 минут, после чего мазки промывают и высушивают. Подсчет лейкоцитарной формулы производят с помощью иммерсионной системы микроскопа. При этом сосчитывают не менее 100 лейкоцитов, а затем определяют процентное содержание их отдельных морфологических форм. Затем вычисляют абсолютное содержание лейкоцитов каждого вида в периферической крови. При этом используется следующая пропорция: а – 100%; Х – б, где Х – содержание лейкоцитов определенного вида в 1 л крови; а – общее количество лейкоцитов в крови, подсчитанное в камере Горяева; б – процентное содержание лейкоцитов соответствующего вида, подсчитанное в мазке крови. Анализируя полученные данные, сравнивают абсолютное количество сегментоядерных нейтрофилов в 1 л периферической крови у мышей, получавших только циклофосфан, и у животных, получавших испытуемый препарат на фоне циклофосфана. Величина указанного показателя в опытной группе должна составлять не менее 150% от таковой у контрольных животных. Предлагаемый способ был изучен в экспериментах на мышах линии CBA/CaLac (животные 1 категории, конвенциональные линейные мыши) в количестве 298 шт., массой 18-20 г. Животные получены из питомника отдела экспериментального биомедицинского моделирования ГУ НИИ фармакологии ТНЦ СО РАМН (сертификат имеется). Пример 1. Определяли специфическую (гранулоцитопоэзстимулирующую) активность рчГ-КСФ («Нейпоген», Hoffman-la-Roche, Швейцария). Для тестирования активности препарата использовали мышей-самцов линии CBA/CaLac массой 18-20 г. Все животные получали однократно внутрибрюшинно циклофосфан в максимально переносимой дозе (250 мг/кг) в 0,2 мл физиологического раствора. Через 24 ч после инъекции цитостатика опытным мышам начинали вводить рчГ-КСФ в дозе 125 мкг/кг в объеме 0,2 мл подкожно, ежедневно в течение 4-х дней. В качестве растворителя использовали забуференный физиологический раствор. Контрольные животные после введения цитостатика получали четырехкратно в эквивалентном объеме растворитель. На 5-е сутки после введения циклофосфана (на следующий день после окончания введения рчГ-КСФ) у мышей обеих групп производили забор периферической крови для определения абсолютного количества нейтрофилов. При этом для подтверждения уровня активности гиперпластических процессов в костном мозге определяли абсолютное количество незрелых и зрелых нейтрофильных гранулоцитов (по способу-прототипу) и число гранулоцитарных колониеобразующих единиц (КОЕ-Г) в костном мозге с помощью метода клонирования в полувязкой среде [6]. В ходе исследований введение рчГ-КСФ достоверно повышало уровень содержания нейтрофилов в периферической крови до 237,9% от контрольных значений. При этом описанные изменения явились отражением возрастания содержания КОЕ-Г в костном мозге до 608,6% от контрольных значений и числа незрелых и зрелых нейтрофильных гранулоцитов в гемопоэтической ткани (до 243,8% и 116,5% от контрольных значений соответственно) (табл.1).
Таким образом, рчГ-КСФ приводил к увеличению числа нейтрофилов в периферической крови более чем на 150% от контрольных значений, отражающему и соответствующему высокой интенсивности репаративных процессов в костном мозге, вызванном введением данного препарата. Пример 2. Определяли специфическую (гранулоцитопоэзстимулирующую) активность субстанции глюкуроновой кислоты (фармацевтическая компания «Поиск», Томск). Для тестирования активности субстанции использовали мышей линии CBA/CaLac массой 18-20 г. Все животные получали однократно внутрибрюшинно 5-фторурацил в максимально переносимой дозе (228 мг/кг) в 0,2 мл физиологического раствора. Через 24 ч после инъекции цитостатика опытным мышам начинали вводить раствор субстанции глюкуроновой кислоты в дозе 30 мг/кг в объеме 0,2 мл внутривенно, ежедневно в течение 3-х дней. В качестве растворителя использовали физиологический раствор. Контрольные животные после введения цитостатика получали трехкратно в эквивалентном объеме растворитель. На 4-е сутки после введения 5-фторурацила у мышей обеих групп производили забор периферической крови для определения абсолютного количества нейтрофилов. При этом для подтверждения уровня активности гиперпластических процессов в костном мозге определяли абсолютное количество незрелых и зрелых нейтрофильных гранулоцитов (по способу-прототипу) и число гранулоцитарных колониеобразующих единиц (КОЕ-Г) в костном мозге с помощью метода клонирования в полувязкой среде [6]. В ходе исследований введение глюкуроновой кислоты достоверно повышало уровень содержания нейтрофилов в периферической крови до 159,1% от контрольных значений. При этом в костном мозге, в отличие от контроля, отмечалось появление КОЕ-Г и регистрировалось возрастание числа незрелых и зрелых нейтрофильных гранулоцитов в гемопоэтической ткани (до 241,2% и 158,3% от контрольных значений соответственно) (табл.2).
Таким образом, глюкуроновая кислота приводила к увеличению числа нейтрофилов в периферической крови более чем в 1,5 раза, сопровождавшемуся возрастанием интенсивности гиперпластических процессов в костном мозге, вызванным введением данного препарата, также регистрируемым способом-прототипом. Пример 3. Определяли специфическую (гранулоцитопоэзстимулирующую) активность жидкого экстракта шлемника байкальского (ЭШБ), полученного из ГНЦЛС (Харьков, Украина). Для тестирования активности субстанции использовали мышей линии CBA/CaLac массой 18-20 г. Все животные получали однократно внутрибрюшинно циклофосфан в максимально переносимой дозе (250 мг/кг) в 0,2 мл физиологического раствора. Через 24 ч после инъекции цитостатика опытным мышам начинали вводить зондом per os раствор экстракта шлемника байкальского в дозе 1 мл/кг в объеме 0,2 мл, ежедневно в течение 9-ти дней. Контрольные животные после введения цитостатика получали в течение 9-ти дней эквивалентный объем физиологического раствора. На 10-е сутки после введения циклофосфана у мышей обеих групп производили забор периферической крови для определения абсолютного количества нейтрофилов. При этом для подтверждения уровня активности гиперпластических процессов в костном мозге определяли абсолютное количество незрелых и зрелых нейтрофильных гранулоцитов (по способу-прототипу) и число гранулоцитарных колониеобразующих единиц (КОЕ-Г) в костном мозге с помощью метода клонирования в полувязкой среде [6]. В ходе исследований введение экстракта шлемника байкальского достоверно повышало уровень содержания нейтрофилов в периферической крови до 123,0% от контрольных значений. При этом в костном мозге не регистрировалось статистически значимых изменений содержания КОЕ-Г по сравнению с контрольными значениями и числа незрелых нейтрофильных гранулоцитов в гемопоэтической ткани. В то же время имела место тенденция к снижению количества зрелых нейтрофильных гранулоцитов, но не достигающая статистической значимости (табл.3).
Таким образом, экстракт шлемника байкальского приводил к увеличению числа нейтрофилов в периферической крови, но менее чем в 1,5 раза от контроля. При этом не отмечалось возрастания интенсивности регенераторных процессов в костном мозге, определяемых как по способу-прототипу, так и с помощью более чувствительных культуральных методов. В связи с этим можно утверждать, что выявленное увеличение количества нейтрофилов в периферической крови являлось результатом активации определенных перераспределительных механизмов и не было связано со специфической гранулоцитопоэзстимулирующей активностью исследуемого вещества. Таким образом, увеличение количества нейтрофилов в периферической крови до 150% и более после введения средств, планируемых к применению в качестве стимуляторов гранулоцитопоэза, на фоне моделирования гипоплазии кроветворения у экспериментальных животных (мышей) путем однократного введения цитостатика в максимально переносимой дозе (циклофосфана либо 5-фторурацила) является достоверным и простым в методическом плане критерием оценки гранулоцитопоэзстимулирующей активности веществ. Предлагаемый способ позволяет достоверно и просто определять наличие гранулоцитопоэзстимулирующей активности. Литература 2. Гершанович М.Л. Осложнения при химио- и гормонотерапии злокачественных опухолей. – М.: Медицина, 1982. – 224 с. 4. Маянский А.Н., Маянский Д.Н. Очерки о нейтрофиле и макрофаге. – Новосибирск: Наука, 1989. – 344 с. 5. Дыгай A.M., Клименко Н.А. Воспаление и гемопоэз. – Томск: Изд-во ТГУ, 1992. – 276 с. 6. Гольдберг Е.Д., Дыгай A.M., Шахов В.П. Методы культуры ткани в гематологии. – Томск: Изд-во ТГУ, 1992. – 272 с.
Формула изобретения
Способ оценки гранулоцитопоэзстимулирующей активности, заключающийся в определении после моделирования цитостатической гипоплазии костного мозга количества клеток гранулоцитарного ростка кроветворения до и после введения фармакологического вещества, отличающийся тем, что определение проводят в периферической крови и при увеличении абсолютного числа нейтрофилов до 150% и более после введения вещества, данное фармакологическое вещество оценивают как обладающее гранулоцитопоэзстимулирующей активностью.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||