Патент на изобретение №2332237
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ ПРОИЗВОДНОЕ БЕНЗИМИДАЗОЛА, СМЕШАННОЕ С МИКРОКРИСТАЛЛИЧЕСКОЙ ЦЕЛЛЮЛОЗОЙ, И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ
(57) Реферат:
Настоящее изобретение относится к области лекарственных средств, в частности к фармацевтическому препарату для перорального применения в форме пеллет, в которых производное бензимидазола стабилизировано путем его комбинирования с микрокристаллической целлюлозой со средним размером 100 мкм или менее, количество которой составляет от 25% (мас.) до 150% (мас.) количества производного бензимидазола. Кроме того, изобретение относится к способу получения указанного фармацевтического препарата и применению микрокристаллической целлюлозы для стабилизации производного бензимидазола. Технический результат заключается в увеличении стабильности производного бензимидазола в пеллетах. 3 н. и 15 з.п. ф-лы, 2 табл.
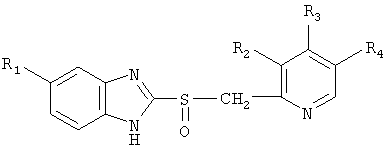
Настоящее изобретение относится к новой галеновой лекарственной форме производного бензимидазола, в частности омепразола, но также лансопразола, рабепразола или пантопразола, обладающей отличной стабильностью при хранении. Эта стабильность достигается путем комбинирования упомянутого производного бензимидазола в смеси с микрокристаллической целлюлозой в форме слоя, содержащего активный ингредиент, на инертной сердцевине (нейтральной пеллете). Изобретение относится также к способу изготовления лекарственной формы вышеупомянутого типа и применению микрокристаллической целлюлозы для стабилизации производного бензимидазола этого типа. Производные бензимидазола формулы I
где R1 – водород, метокси- или дифторметоксигруппа, R2 – водород, метил или метоксигруппа, R3 – метокси-, 2,2,2-трифторэтокси- или 3-метоксипропоксигруппа и R4 – водород, метил или метоксигруппа, являются хорошо известными и высокоэффективными лекарственными веществами, широко применяемыми для лечения желудочных расстройств. К таким соединениям относятся, в частности, омепразол, лансопразол, рабепразол и пантопразол. Однако производные бензимидазола формулы I склонны к разложению, и приготовление достаточно стабильных фармацевтических препаратов, содержащих эти соединения, является трудной задачей. Так, производные бензимидазола формулы I, в частности омепразол, нестабильны в водных растворах, имеющих кислую реакцию, и по этой причине производные бензимидазола вначале комбинировали в галеновых лекарственных формах со щелочным буфером. Пример лекарственной формы этого типа описан в публикации ЕР-А 0247983. Комбинирование производных бензимидазола со щелочным буфером позволяет получать галеновы лекарственные формы очень высокой стабильности. С такими галеновыми лекарственными формами связаны, однако, некоторые сложности; так, например, кислотные группы, содержащиеся в желудочно-резистентном покрытии лекарственных форм, могут вступать в реакцию с содержащимися в сердцевине соединениями щелочного характера. Хотя отделение сердцевины, имеющей щелочной характер, от желудочно-резистентного покрытия с помощью разделительного слоя хорошо известно, при приготовлении галеновых лекарственных форм такого типа следует обращать особое внимание на обеспечение соответствия толщины и типа разделительного слоя и типа желудочно-резистентного покрытия со щелочностью сердцевины с целью получения галеновой лекарственной формы достаточно высокой стабильности и биодоступности. Эти проблемы обсуждаются, например, в Примере 1 публикации ЕР-А 0247983. Были разработаны также лекарственные формы, в которых производные бензимидазола не комбинированы со щелочным буфером. Пример лекарственной формы такого типа описан в патенте США 5626875, соответствующем публикации ЕР-А 0773025. В этой публикации описана лекарственная форма, содержащая инертную сердцевину, покрытую первым слоем, содержащим производное бензимидазола совместно с водорастворимым полимером, а также второй слой, содержащий водорастворимый полимер, и третий слой, состоящий из желудочно-резистентного покрытия. Описанные конкретные фармацевтические препараты содержат, в первую очередь, производное бензимидазола, смешанное с тальком. Кроме того, разработаны также фармацевтические препараты, содержащие омепразол, в которых омепразол смешан с конкретными стабилизаторами с целью повышения устойчивости омепразола. К известным стабилизаторам относятся, например, маннит (ЕР-А 0646006), TiO2 (WO 96/37195) и циклодекстрин (WO 98/40069), а также аминокислоты. Наконец, в публикации DE-A 19959419 (соответствующей WO 01/41734) описана стабилизация производных бензимидазола формулы I путем комбинирования их с соединением, обеспечивающим конкретное значение рН ниже 7, предпочтительно с дигидрофосфатом натрия (NaH2PO4). Фармацевтические препараты, описанные в DE-A 19959419, обладают высокой стабильностью, однако производство таких фармацевтических препаратов иногда является сложным и трудоемким процессом, поскольку диапазон рН, в котором достигается оптимальная устойчивость, относительно узок, и исходные материалы, применяемые для изготовления таких препаратов, для обеспечения желаемого диапазона рН необходимо тщательно и постоянно контролировать. Таким образом, существует потребность в галеновых лекарственных формах производных бензимидазола формулы I, обладающих высокой стабильностью. Такие лекарственные формы должны иметь максимально простое строение и не должны быть стабилизированы путем установления конкретного значения рН. Приемы приготовления таких лекарственных форм должны быть известными в галеновом производстве. Наконец, лекарственные формы этого типа должны иметь по меньшей мере такую же стабильность, как имеющиеся на рынке фармацевтические препараты, и предпочтительно превосходить последние по стабильности. Неожиданно было обнаружено, что микрокристаллическая целлюлоза способна стабилизировать производные бензимидазола формулы I, в частности омепразол, пантопразол, рабепразол и лансопразол. Известно применение микрокристаллической целлюлозы в фармацевтической практике для разнообразных целей, в частности в качестве наполнителя и связующего, при гранулировании, для прямого таблетирования, в качестве агента, способствующего дезинтеграции таблеток и в качестве наполнителя при производстве капсул, однако не является обычным ее применение при изготовлении пеллет способом нанесения покрытия, например порошкового или суспензионного покрытия, то есть пеллет, имеющих инертную сердцевину, на которую наносятся слои покрытий (например, из раствора или суспензии). При использовании микрокристаллической целлюлозы в соответствии с настоящим изобретением для стабилизации производных бензимидазола формулы I в слое пеллеты, содержащем активный ингредиент, особое предпочтение отдается варианту, в котором частицы микрокристаллической целлюлозы имеют как можно меньший размер, и предполагается, что стабилизация происходит вследствие взаимодействия с обширной поверхностью микрокристаллической целлюлозы. Таким образом, в соответствии с настоящим изобретением особое предпочтение отдается микрокристаллической целлюлозе с минимальным размером частиц. Далее, распределение частиц по размерам должно обеспечивать минимальное количество крупных частиц. Термин “микрокристаллическая целлюлоза” в настоящем документе относится, если в явном виде не указано иное, к типу, соответствующему стандартам, изложенным в Фармакопее США и/или в Европейской фармакопее, и/или в Германской фармакопее, либо в соответствующих этим фармакопеям монографиях. Существуют различные методы измерения размеров частиц микрокристаллической целлюлозы или определения распределения ее частиц по размерам, например способ светорассеяния, используемый в устройствах фирмы Malvern Instruments, например “Malvern MasterSizer X”, рассев на виброситах, применяемый фирмой FMC для определения гранулометрического состава выпускаемых ею продуктов типа AVICEL РН®, а также “воздушно-струйный” ситовой анализ, который можно выполнять, например, с применением “воздушно-струйного” прибора ALPINA® модели 200. Характеристики среднего размера частиц или распределения частиц по размерам в пределах настоящего описания, если явно не указано или не очевидно иное, относятся к значениям, полученным с применением механических вибросит. Для этой цели пробу массой 100 г просеивали в течение 20 мин на механическом виброустройстве, снабженном ситами с отверстиями соответствующих размеров. Этот способ соответствует определению среднего размера частиц и/или распределения частиц по размерам, указанному для продуктов AVICEL РН® в технических условиях на эти продукты, а также, например, для продуктов AVICEL РН®, описанных в литературе, например в монографии Фидлера “Энциклопедия вспомогательных веществ для фармации, косметики и смежных областей” (Fiedler’s Encyclopedia of Excipients Used in Pharmaceutical, Cosmetic and Related Fields, 5th Ed., 2002). В случаях, когда определение указанным методом технически невозможно для данного продукта, определение выполняют, если не указано иное, с помощью так называемого “воздушно-струйного” ситового анализа, например, с применением “воздушно-струйного” прибора ALPINA® модели 200, под пониженным давлением приблизительно 10-12 дюймов (250-300 мм) водяного столба. На сите 60 меш. (размер отверстий 0,25 мм) 100 г пробы обрабатывают в течение 3 мин, на сите 100 меш. (размер отверстий 0,15 мм) 50 г пробы обрабатывают также в течение 3 мин, на сите 200 меш. (размер отверстий 0,074 мм) 50 г пробы обрабатывают в течение 6 мин, а на сите 400 меш. (размер отверстий 0,037 мм) 20 г пробы обрабатывают в течение 3 мин. Если распределение частиц по размерам в настоящем описании характеризуется данными, относящимися к значениям d10-, d50- и d90-, то значение d10- означает, что 10% частиц имеют размер менее указанного значения d10-, если не указано иное (соответствующее определение относится также к значениям d50- и d90-). Вместо использования точных данных о распределении частиц по размерам предпочтительная характеристика микрокристаллической целлюлозы для целей настоящего изобретения может быть определена через посредство данных о насыпной плотности. Если не указано иное, насыпную плотность определяют следующим образом. Сосуд внутренним диаметром 30,0±2,0 мм и калиброванным объемом 25,0±0,5 мл взвешивают и помещают под устройством для измерения объема, снабженным ситом 10 меш. (размер отверстий 2,0 мм). Порошок медленно насыпают с высоты 2 дюйма (50 мм) над воронкой через устройство для измерения объема со скоростью, исключающей комкование, до переполнения сосуда. Избыток порошка удаляют (не допуская уплотнения порошка и падения излишнего количества порошка в сосуд), после чего взвешивают заполненный сосуд. Насыпную плотность определяют путем деления массы порошка в сосуде на объем сосуда. В случае работы с очень мелкозернистым порошком допускается удаление сита 10 меш. по техническим соображениям. Условия определения описаны также в германском промышленном стандарте DIN-ISO 697: 1984-01. При характеризации микрокристаллической целлюлозы по данным о среднем размере частиц и распределении частиц по размерам предпочтение в соответствии с настоящим изобретением отдается микрокристаллической целлюлозе со средним размером частиц 100 мкм или менее; предпочтительно также, чтобы микрокристаллическая целлюлоза вышеупомянутого типа имела гранулометрический состав (распределение частиц по размерам), при котором менее чем 10% частиц имеют размер 250 мкм или более и менее чем 50% частиц имеют размер 75 мкм или более. Еще более предпочтительной является микрокристаллическая целлюлоза со средним размером частиц 50 мкм или менее; при этом предпочтительно, чтобы микрокристаллическая целлюлоза вышеупомянутого типа имела распределение частиц по размерам, при котором менее чем 2% частиц имеют размер 250 мкм или более и менее чем 30% частиц имеют размер 75 мкм или более. Еще большее предпочтение отдается микрокристаллической целлюлозе со средним размером частиц, например приблизительно 30 мкм, приблизительно 25 мкм, приблизительно 20 мкм, приблизительно 15 мкм или приблизительно 10 мкм. Распределение частиц такой микрокристаллической целлюлозы по размерам должно быть как можно более узким, при этом предпочтительно, чтобы менее чем 0,1% частиц имели размер 250 мкм или более и менее чем 1% частиц имели размер 75 мкм или более. Если распределение частиц микрокристаллической целлюлозы по размерам определяют методом светорассеяния, то микрокристаллические целлюлозы, которым отдается предпочтение при применении, охарактеризованы в нижеприведенной таблице (где определение выполнено с использованием прибора MasterSizer фирмы Malvern Instruments).
Если микрокристаллическая целлюлоза характеризуется на основании насыпной плотности, то предпочтение отдается микрокристаллической целлюлозе с насыпной плотностью 0,30 г/см3 или менее, более предпочтительной является микрокристаллическая целлюлоза с насыпной плотностью 0,29 г/см3 или менее, еще более предпочтительной является микрокристаллическая целлюлоза с насыпной плотностью 0,28 г/см3 или менее и наиболее предпочтительной является микрокристаллическая целлюлоза с насыпной плотностью 0,27 г/см3 или менее. Используемая микрокристаллическая целлюлоза должна быть как можно более мелкозернистой, однако по технологическим соображениям может оказаться целесообразным применение микрокристаллической целлюлозы со средним размером частиц, например, 1 мкм или более, например 5 мкм или более. Целесообразным может оказаться также применение микрокристаллической целлюлозы с насыпной плотностью 0,109 г/см3 или более, например 0,15 г/см3 или более, например 0,20 г/см3 или более. В соответствии с настоящим изобретением предпочтительно применять микрокристаллические целлюлозы, имеющиеся на рынке. Пригодными являются микрокристаллические целлюлозы серии AVICEL РН®, выпускаемые фирмой FMC, которые подробно описаны, например, в вышеупомянутой монографии Фидлера; продукты серии EMCOCEL фирмы Mendell; микрокристаллические целлюлозы серии ELCEMA фирмы Degussa AG; микрокристаллические целлюлозы серии SANACEL фирмы Cerestar Deutschland; микрокристаллические целлюлозы серии SOLKA-FLOC фирмы Paul Brem; и микрокристаллические целлюлозы серии VIVAPUR фирмы Rettenmeier & Sons. Наиболее предпочтительными являются продукты AVICEL РН® фирмы FMC. Что касается характеристик продуктов и, в частности, размера частиц и распределения частиц по размерам в вышеупомянутых предпочтительных типах микрокристаллической целлюлозы, то их можно найти в вышеупомянутой монографии Фидлера, а также в известных и опубликованных технических условиях производителей. Фармацевтические препараты по настоящему изобретению состоят из пеллет с инертной сердцевиной, на которую нанесен слой, содержащий активный ингредиент. На упомянутый слой с активным ингредиентом предпочтительно нанесен один или несколько инертных слоев (разделительных слоев). Кроме того, пеллета имеет внешний слой, содержащий желудочно-резистентное покрытие, т.е. желудочно-резистентный слой. Инертной сердцевиной предпочтительно является известная сахарно-крахмальная сердцевина. Сердцевины такого типа имеются на рынке. Слой с активным ингредиентом, нанесенный на сердцевину, содержит активный ингредиент – производное бензимидазола – и микрокристаллическую целлюлозу, а также факультативно другие фармацевтически приемлемые вспомогательные вещества. Как правило, слой с активным ингредиентом содержит также связующее. Разделительный слой предпочтительно также содержит микрокристаллическую целлюлозу и, как правило, содержит также связующее. В нем могут также присутствовать дополнительные известные вспомогательные вещества. Желудочно-резистентное покрытие служит в качестве классического желудочно-резистентного слоя. Он содержит обычные желудочно-резистентные вещества, известные в отрасли, например сложные эфиры целлюлозы и сополимеры метакриловой кислоты, например сополимеры алкиловых сложных эфиров метакриловой кислоты и (мет)акриловой кислоты, выпускаемые, например, под торговыми наименованиями Eudragit® L или Eudragit® S. В качестве пластификаторов в желудочно-резистентный слой могут быть введены предпочтительно триэтилцитрат, дибутилфталат, пропиленгликоль и/или полиэтиленгликоль. Желудочно-резистентное покрытие может содержать также другие известные вспомогательные вещества. В качестве связующего в слое с активным ингредиентом и в факультативных разделительных слоях присутствует предпочтительно водорастворимый полимер или полимер, быстро разлагающийся в воде. Предпочтительно в слое с активным ингредиентом и во всех разделительных слоях, где присутствует связующее, применяют один и тот же водорастворимый полимер; однако возможно также использование в различных слоях различных водорастворимых полимеров или полимеров, быстро разлагающихся в воде. Согласно настоящему изобретению особое предпочтение отдается применению в качестве связующих гидроксипропил-метилцеллюлозы и гидроксипропилцеллюлозы. В каждом из слоев лекарственной формы могут присутствовать обычные фармацевтически приемлемые вспомогательные вещества, известные специалистам. Специалист может легко определить тип и количество таких вспомогательных веществ, основываясь на общих знаниях в этой области. Если не указано иное, то упомянутые вспомогательные вещества включают обычные связующие, пластификаторы, красители, пигменты, например диоксид титана, тальк, и другие известные вспомогательные вещества. Как правило, пеллеты помещают в обычные желатиновые капсулы или прессуют в так называемые “многоэлементные таблетки”. В случае прессования во “многоэлементные таблетки” желудочно-резистентный слой должен быть сформирован так, чтобы он не разрушался в процессе прессования, и способность к хранению таблеток не нарушалась. Способы формирования желудочно-резистентного слоя, обеспечивающие возможность прессования во “многоэлементные таблетки” известны специалистам, например, из публикации ЕР-А 723436 или из публикации “Лекарственные средства, производимые в Германии” (Drugs made in Germany, 37, No. 2, 1994, с.53 и далее). Количество активного ингредиента в слое пеллеты, содержащем упомянутый активный ингредиент, выбирают так, чтобы обеспечить введение в организм желаемой дозы при приеме дозированной лекарственной формы, например желатиновой капсулы или “многоэлементной таблетки”. Единичные дозы, применяемые в типичных случаях, составляют, например, для омепразола 10 мг, 20 мг или 40 мг на одну капсулу. Возможны, однако, и другие дозы. Как правило, количество активного ингредиента выбирают так, чтобы слой каждой пеллеты, содержащий упомянутый активный ингредиент, содержал (в зависимости от величины пеллеты и желаемой единичной дозы) от 0,001 мг до 10 мг, предпочтительно от 0,01 мг до 1 мг, в частности от 0,05 мг до 5 мг производной бензимидазола формулы I. Количество микрокристаллической целлюлозы в слое, содержащем активный ингредиент, можно варьировать в широких пределах. Количество микрокристаллической целлюлозы в слое с упомянутым активным ингредиентом составляет предпочтительно от 10% до 150%, более предпочтительно от 25% до 150%, в частности от 50% до 150% массы активного ингредиента. Наиболее предпочтительным является вариант, в котором количество микрокристаллической целлюлозы приблизительно одинаково с количеством активного ингредиента в слое, содержащем упомянутый активный ингредиент или меньше этого количества, например, составляет приблизительно 50% количества активного ингредиента в упомянутом слое, содержащем активный ингредиент. Количество связующего в слое с активным ингредиентом не ограничено конкретными пределами, и его нетрудно оценить специалисту. По сравнению с количеством активного ингредиента в упомянутом слое, содержащем активный ингредиент, количество связующего составляет предпочтительно от 25% (мас.) до 150% (мас.), более предпочтительно от 50% (мас.) до 125% (мас.), а наиболее предпочтительным является вариант, в котором количество связующего практически одинаково с количеством активного ингредиента в слое, содержащем упомянутый активный ингредиент, или меньше этого количества. Фармацевтический препарат по настоящему изобретению предпочтительно содержит по меньшей мере один разделительный слой, расположенный между слоем, содержащим активный ингредиент, и желудочно-резистентным покрытием; особое предпочтение отдается одному разделительному слою. Как правило, разделительный слой содержит также связующее, предпочтительно то же связующее, которое применено в слое, содержащем активный ингредиент. Однако возможно использование также других известных связующих, как указано выше. Разделительный слой предпочтительно содержит также микрокристаллическую целлюлозу, как указано выше. Количество микрокристаллической целлюлозы строго не ограничено, хотя предпочтительно количество микрокристаллической целлюлозы в разделительном слое составляет от 25% до 100% массы связующего. Разделительный слой может содержать также другие обычные вспомогательные вещества. Фармацевтический препарат по настоящему изобретению изготовляют по известным методам. Стадии нанесения покрытий предпочтительно выполняют в аппарате с псевдоожиженным слоем, причем между стадиями нанесения покрытий предпочтительно выполняют операции сушки. При выполнении операции сушки не обязательно прерывание процесса в псевдоожиженном слое, хотя, разумеется, набрызгивание во время сушки должно быть прервано. В случае выполнения операции сушки она длится приблизительно от 10 мин до 20 мин. Согласно настоящему изобретению активный ингредиент предпочтительно диспергируют вместе со вспомогательными веществами, в частности с микрокристаллической целлюлозой и связующим, в соответствующем растворителе, предпочтительно в воде, и водную дисперсию затем наносят известным способом путем разбрызгивания на нейтральные гранулы. Стабилизирующий эффект микрокристаллической целлюлозы особенно значителен при использовании этого способа изготовления. После выполнения необязательной операции сушки наносят, предпочтительно аналогичным способом, разделительный слой, после чего, предпочтительно после операции сушки, наносят аналогичным способом путем разбрызгивания желудочно-резистентное покрытие. Настоящее изобретение более подробно описано в нижеприведенных примерах. Сопоставительный пример 1 a) Изготовление пеллет, содержащих активный ингредиент, методом нанесения слоя суспензии 6,7 кг гидроксипропилметилцеллюлозы (НРМС) типа 603 растворяют в 50 л деминерализованной воды. В другом сосуде вначале растворяют 1,0 кг Na2HPO4 (соединения со щелочной реакцией) в 5 л деминерализованной воды. В этом втором растворе диспергируют 13,3 кг омепразола с помощью устройства Ultra-Turrax. Наконец, с дисперсией, содержащей активный ингредиент, смешивают 1,0 кг полисорбата-80. Медленно сливают упомянутые раствор и дисперсию друг с другом при осторожном перемешивании. Полученную смесь затем наносят разбрызгиванием на 36,5 кг нейтральных гранул в обычном аппарате с псевдоожиженным слоем, пригодном для этой цели (например, в аппарате типа Glatt-Wurster). Скорость разбрызгивания и температуру воздуха на входе регулируют так, чтобы получить температуру продукта 35-40°С. b) Нанесение разделительного слоя Разделительный слой наносят на пеллеты, содержащие активный ингредиент, из водного раствора. Этот раствор приготовляют путем растворения 3,5 кг ПЭГ-4000 и 17,3 кг гидроксипропилметилцеллюлозы типа 603 в деминерализованной воде общим объемом 216 л. Полученный раствор затем также наносят разбрызгиванием на содержащие активный ингредиент пеллеты, полученные на стадии а), в том же аппарате при тех же параметрах. c) Нанесение желудочно-резистентного покрытия Вначале диспергируют 1,3 кг глицеринмоностеарата в 30 кг деминерализованной воды, подогретой до 65°С, и охлаждают дисперсию. Отдельно растворяют в 70 кг деминерализованной воды 6,0 кг ПЭГ-6000, и этот раствор затем смешивают с суспензией глицеринмоностеарата. После охлаждения смеси до комнатной температуры добавляют 133 кг Eudragit L30D55, и медленно перемешивают полученную дисперсию. Факультативно устанавливают рН дисперсии с помощью NaOH. Затем дисперсию материала покрытия наносят разбрызгиванием в соответствующем аппарате для нанесения покрытия на пеллеты, покрытые разделительным слоем, полученные на стадии b). Сопоставительный пример 2 Пеллеты, содержащие омепразол, изготовляют по методике, аналогичной описанной в Сопоставительном примере 1, но в качестве пластификатора при нанесении желудочно-резистентного покрытия вместо полиэтиленгликоля используют триэтилцитрат. Пример 1 2,8 кг омепразола и 1,4 кг микрокристаллической целлюлозы типа AVICEL-PH®-105 фирмы FMC (средний размер частиц 20 мкм, распределение частиц по размерам таково, что менее чем 0,1% частиц имеют размер 250 мкм или более и менее чем 1% частиц имеют размер 75 мкм или более) диспергируют с помощью устройства Ultra-Turrax в 15,8 кг деминерализованной воды. В другом сосуде растворяют 2,8 кг гидроксипропилметилцеллюлозы также в 15,8 кг деминерализованной воды. Сливают упомянутые раствор и дисперсию друг с другом и слегка перемешивают, а затем наносят на 2,8 кг нейтральных пеллет, используя аппаратуру и способ, описанные в Сопоставительном примере 1. Разделительный слой наносят, как описано в Сопоставительном примере 1, используя 1,6 кг микрокристаллической целлюлозы типа AVICEL-PH®-105 и 3,1 кг гидроксипропилметилцеллюлозы в 35 кг деминерализованной воды. Затем наносят желудочно-резистентное покрытие, как описано в Сопоставительном примере 1, используя дисперсию 17,5 кг Eudragit L30D55, 1,3 кг ПЭГ-6000, 200 г глицеринмоностеарата и 14,9 кг деминерализованной воды. Покрытие наносят способом разбрызгивания. Пример 2 Пеллеты, содержащие активный ингредиент, получают, как описано в Примере 1, с применением лансопразола в качестве активного ингредиента. Применяемые вспомогательные вещества и их количества представлены в нижеприведенной таблице. Пример 3 Пеллеты, содержащие активный ингредиент, получают, как описано в Примере 1, с применением омепразола в качестве активного ингредиента. Применяемые вспомогательные вещества и их количества представлены в нижеприведенной таблице. Пеллеты прессуют в “многоэлементную дозированную лекарственную форму” в соответствии с известной технологией. Пример 4 Пеллеты, изготовленные по сопоставительным примерам и по примерам, подвергали обычному испытанию на стабильность при хранении на открытом воздухе (40°С, 75% относительной влажности) и определяли степень разложения активного ингредиента после 4-недельного хранения по известным методикам. В нижеприведенной таблице указаны компоненты пеллет, полученных по сопоставительным примеру 1 и примеру 2 и по примеру 1, примеру 2 и примеру 3, и приведены результаты испытаний на стабильность при хранении.
Полученные результаты показывают, что степень разложения омепразола в фармацевтических препаратах по настоящему изобретению значительно ниже по сравнению с препаратами, в которых омепразол был стабилизирован не микрокристаллической целлюлозой, а путем добавления небольшого количества щелочного буферного соединения, обеспечивающего значение рН щелочной среды. Количество продукта Eudragit было подобрано так, чтобы получить сравнимые значения толщины микрокристаллической целлюлозы при соблюдении рекомендаций производителя желудочно-резистентного полимера. Это исключало влияние различий в толщине желудочно-резистентного покрытия. Для исключения любого сомнения в стабилизирующем эффекте микрокристаллической целлюлозы для желудочно-резистентных покрытий в сопоставительных примерах были выбраны как минимум несколько большие значения толщины; таким образом, для пеллет по сопоставительным примерам было более вероятно ожидать более эффективной стабилизации активного ингредиента. Пример 5 Стабильность пеллет по Примеру 1 сопоставляли с устойчивостью имеющегося на рынке продукта ANTRA MUPS®. ANTRA MUPS® представляет собой “многоэлементную дозированную форму” с омепразолом в качестве активного ингредиента, т.е. содержащие омепразол пеллеты, спрессованные в таблетки. В вышеописанных условиях (хранение на открытом воздухе при 40°С, 75% относительной влажности в течение 4 недель) степень разложения активного ингредиента в продукте ANTRA MUPS® достигала 25% против 13% для фармацевтического препарата по Примеру 3, что опять-таки демонстрирует отличную эффективность стабилизации, достижимую по настоящему изобретению в результате комбинирования микрокристаллической целлюлозы и производного бензимидазола формулы I.
Формула изобретения
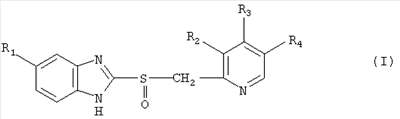
1. Фармацевтический препарат для перорального применения в форме пеллет, содержащий эффективное количество производного бензимидазола формулы I где R1 – водород, метокси- или дифторметоксигруппа, R2 – водород, метил или метоксигруппа, R3 – метокси-, 2,2,2-трифторэтокси- или 3-метоксипропоксигруппа и R4 – водород, метил или метоксигруппа, включающих в себя (a) инертную сердцевину, (b) на которую нанесен слой, содержащий активный ингредиент, который содержит производное бензимидазола формулы I, смешанное с микрокристаллической целлюлозой, состоящей из частиц, имеющих средний размер 100 мкм или менее, количество которой составляет от 25 до 150 мас.% количества производного бензимидазола формулы I, (c) по меньшей мере один разделительный слой, и (d) наружный слой, включающий желудочно-резистентное покрытие. 2. Фармацевтический препарат по п.1, в котором производным бензимидазола формулы I является омепразол, лансопразол, рабепразол или пантопразол. 3. Фармацевтический препарат по п.1, в котором микрокристаллическая целлюлоза состоит из частиц, имеющих средний размер 50 мкм или менее. 4. Фармацевтический препарат по п.3, в котором микрокристаллическая целлюлоза состоит из частиц, имеющих средний размер приблизительно 20 мкм. 5. Фармацевтический препарат по п.1, в котором распределение частиц микрокристаллической целлюлозы по размерам таково, что менее чем 10% частиц имеют размер 250 мкм или более и менее чем 50% частиц имеют размер 75 мкм или более. 6. Фармацевтический препарат по п.3, в котором распределение частиц микрокристаллической целлюлозы по размерам таково, что менее чем 2% частиц имеют размер 250 мкм или более и менее чем 30% частиц имеют размер 75 мкм или более. 7. Фармацевтический препарат по п.4, в котором распределение частиц микрокристаллической целлюлозы по размерам таково, что менее чем 0,1% частиц имеют размер 250 мкм или более и менее чем 1% частиц имеют размер 75 мкм или более. 8. Фармацевтический препарат по п.1, в котором микрокристаллическая целлюлоза имеет насыпную плотность 0,30 г/см3 или менее. 9. Фармацевтический препарат по п.8 в котором микрокристаллическая целлюлоза имеет насыпную плотность 0,28 г/см3 или менее. 10. Фармацевтический препарат по п.1, в котором упомянутый слой с активным ингредиентом содержит связующее, которым является гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза. 11. Фармацевтический препарат по п.1, который включает разделительный слой, содержащий микрокристаллическую целлюлозу и связующее. 12. Фармацевтический препарат по п.11, в котором упомянутый разделительный слой содержит связующее, которым является гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза. 13. Фармацевтический препарат по п.11, в котором упомянутый разделительный слой содержит микрокристаллическую целлюлозу в количестве от 25 до 100 мас.% количества связующего. 14. Способ изготовления фармацевтического препарата по одному из пп.1-13, в котором производное бензимидазола формулы I в смеси с микрокристаллической целлюлозой наносят на инертную сердцевину, образуя таким образом слой с активным ингредиентом, и на этот слой с активным ингредиентом факультативно наносят по меньшей мере один разделительный слой, а также наружный слой в форме желудочно-резистентного покрытия. 15. Способ по п.14, в котором слой с активным ингредиентом наносят из водной дисперсии. 16. Применение микрокристаллической целлюлозы, состоящей из частиц, имеющих средний размер 100 мкм или менее, для повышения стабильности производного бензимидазола формулы I
где R1 – водород, метокси- или дифторметоксигруппа, R2 – водород, метил или метоксигруппа, R3 – метокси-, 2,2,2-трифторэтокси- или 3-метоксипропоксигруппа и R4 – водород, метил или метоксигруппа, в слое с активным ингредиентом пеллеты, включающей в себя инертную сердцевину, слой, содержащий активный ингредиент, по меньшей мере один разделительный слой и наружный слой, состоящий из желудочно-резистентного покрытия. 17. Применение по п.16, отличающееся тем, что производным бензимидазола формулы I является омепразол, лансопразол, рабепразол или пантопразол. 18. Применение по п.16 или 17, отличающееся тем, что микрокристаллическая целлюлоза состоит из частиц, имеющих средний размер 100 мкм или менее.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

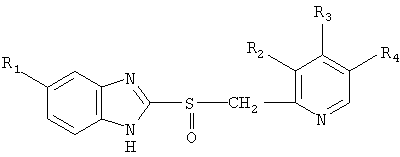 ,
,