|
|
(21), (22) Заявка: 2005107475/15, 25.07.2003
(24) Дата начала отсчета срока действия патента:
25.07.2003
(30) Конвенционный приоритет:
17.08.2002 (пп.1-25) DE 10237739.1
(43) Дата публикации заявки: 10.04.2006
(46) Опубликовано: 27.08.2008
(56) Список документов, цитированных в отчете о
поиске:
US 20020025299 А1, 28.02.2002. WO 0232899 А1, 25.04.2002. WO 0158425 А2, 16.08.2001.
(85) Дата перевода заявки PCT на национальную фазу:
17.03.2005
(86) Заявка PCT:
EP 03/08222 (25.07.2003)
(87) Публикация PCT:
WO 2004/022058 (18.03.2004)
Адрес для переписки:
101000, Москва, Малый Златоустинский пер., 10, кв.15, “ЕВРОМАРКПАТ”, пат.пов. Н.В.Кузенковой
|
(72) Автор(ы):
ПЕРЕ Мишель (DE),
МИД Кристофер Джон Монтагью (DE),
ПИПЕР Михаэль Пауль (DE)
(73) Патентообладатель(и):
БЁРИНГЕР ИНГЕЛЬХАЙМ ФАРМА ГМБХ УНД КО.КГ (DE)
|
(54) ИНГАЛЯЦИОННЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СОДЕРЖАЩИЕ НОВОЕ АНТИХОЛИНЕРГИЧЕСКОЕ СРЕДСТВО В СОЧЕТАНИИ С КОРТИКОСТЕРОИДАМИ И БЕТАМИМЕТИКАМИ
(57) Реферат:
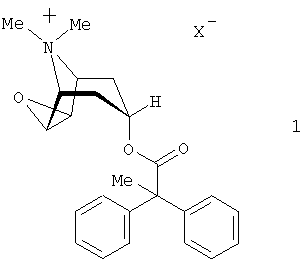
Настоящее изобретение относится к области лекарственных средств, в частности к лекарственному составу для ингаляции, содержащему антихолинергическое средство формулы 1
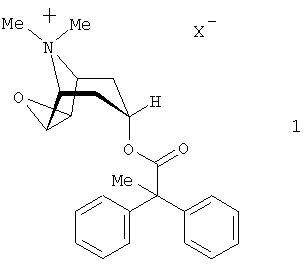
в которой X– обозначает однозарядный анион, а также кортикостероид и бетамиметик. Кроме того, изобретение относится к применению указанного лекарственного состава для лечения воспалительных и/или обструктивных заболеваний дыхательных путей. Технический результат – положительный терапевтический эффект и синергетический эффект, оказываемый заявленным лекарственным составом. 2 н. и 23 з.п. ф-лы, 3 ил.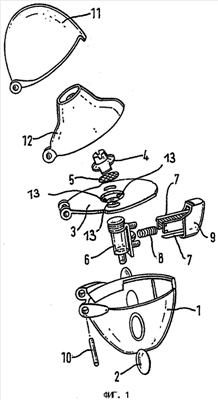
Настоящее изобретение относится к новым лекарственным композициям на основе нового антихолинергического средства, кортикостероидов и бетамиметиков, к способу их получения, а также к их применению при терапии заболеваний дыхательных путей.
Подробное описание изобретения
В настоящем изобретении предлагаются новые лекарственные композиции для ингаляции на основе нового антихолинергического средства, кортикостероидов и бетамиметиков, способ их получения, а также их применение при терапии заболеваний дыхательных путей.
Согласно изобретению было установлено, что при применении нового антихолинергического средства совместно с одним или несколькими кортикостероидами и совместно с одним или несколькими бетамиметиками неожиданно проявляется положительный терапевтический эффект и прежде всего синергетический эффект при лечении воспалительных или обструктивных заболеваний дыхательных путей. Наличие подобного синергетического эффекта позволяет применять предлагаемые в изобретении лекарственные композиции в меньшей дозировке, чем это было бы необходимо в противном случае при традиционной монотерапии, предусматривающей для достижения сходного действия применение каждого из соединений по отдельности. Благодаря этому удается уменьшить нежелательные побочные действия, которые могут сопровождать, например, применение кортикостероидов и бетамиметиков.
Согласно настоящему изобретению в качестве антихолинергического средства используются соли формулы 1
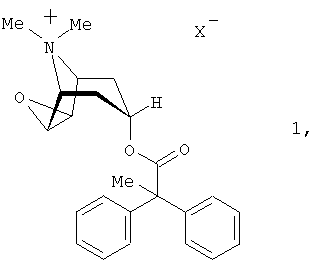
в которой X– обозначает однозарядный анион, предпочтительно анион, выбранный из группы, включающей хлорид, бромид, иодид, сульфат, фосфат, метансульфонат, нитрат, малеат, ацетат, цитрат, фумарат, тартрат, оксалат, сукцинат, бензоат и n-толуолсульфонат.
Предпочтительно использовать соли формулы 1, в которой X– обозначает однозарядный анион, выбранный из группы, включающей хлорид, бромид, 4-толуолсульфонат и метансульфонат, предпочтительно бромид.
Наиболее предпочтительно использовать соли формулы 1, в которой X– обозначает однозарядный анион, выбранный из группы, включающей хлорид, бромид и метансульфонат, предпочтительно бромид.
Особенно предпочтительной согласно изобретению является та соль формулы 1, в которой X– обозначает бромид.
Соли формулы 1 известны из заявки WO 02/32899. При упоминании солей формулы 1 подразумеваются также их возможные гидраты и сольваты.
В описании настоящего изобретения в тех случаях, когда речь конкретно идет о фармакологически активном катионе формулы
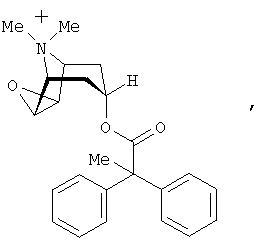
для ссылки на него используется обозначение 1′. Очевидно, что при упоминании соединений 1 имеется в виду и соответствующий катион 1′.
Под кортикостероидами (обозначаемыми ниже как 2) согласно настоящему изобретению подразумеваются соединения, выбранные из группы, включающей флунисолид, беклометазон, триацинолон, будесонид, флутиказон, мометазон, циклесонид, рофлепонид, GW 215864, KSR 592, ST-126 и дексаметазон. Соединение 2 предпочтительно выбирать из группы, включающей флунисолид, беклометазон, триацинолон, будесонид, флутиказон, мометазон, циклесонид и дексаметазон. В наиболее предпочтительном варианте соединение 2 выбрано из группы, включающей будесонид, флутиказон, мометазон и циклесонид. В некоторых случаях в настоящем описании вместо понятия “кортикостероиды 2” используется также только понятие “стероиды 2”. При упоминании в настоящем описании стероидов 2 подразумеваются также соли или производные 2′, которые могут быть образованы стероидами. В качестве примера подобных возможных солей или производных 2′ можно назвать натриевые соли, сульфобензоаты, фосфаты, изоникотинаты, ацетаты, пропионаты, дигидрофосфаты, пальмитаты, пивалаты или фуроаты. При определенных условиях соединения 2 могут быть также представлены в виде их гидратов.
В качестве бетамиметиков 3 согласно изобретению предлагается использовать соединения из группы, включающей бамбутерол, битолтерол, карбутерол, кленбутерол, фенотерол, формотерол, гексопреналин, ибутерол, пирбутерол, прокатерол, репротерол, салметерол, сульфонтерол, тербуталин, толубутерол, 4-гидрокси-7-[2-{[2-{[3-(2-фенилэтокси)пропил]сульфонил}этил]амино}этил]-2(3Н)-бензотиазолон, 1-(2-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-N,N-диметиламинофенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-{4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламино}этанол, 5-гидрокси-8-(1-гидрокси-2-изопропиламинобутил)-2Н-1,4-бензоксазин-3-(4Н)-он, 1-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламино)этанол и 1-(4-этоксикарбониламино-3-циано-5-фторфенил)-2-(трет-бутиламино)этанол.
Предпочтительно согласно изобретению использовать в качестве бетамиметиков 3 в предлагаемых в нем комбинациях действующих веществ формотерол, салметерол, 4-гидрокси-7-[2-{[2-{[3-(2-фенил-этокси)пропил]сульфонил}этил]амино}этил]-2(3Н)-бензотиазолон, 1-(2-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-N,N-диметиламинофенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол или 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-{4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламино}этанол.
Согласно изобретению в качестве бетамиметиков 3 наиболее предпочтительно использовать соли салметерола или формотерола. Термин “бетамиметики 3” охватывает также соответствующие энантиомеры или их смеси. Так, например, при упоминании наиболее предпочтительных согласно изобретению соединений 3, которыми являются соли салметерола и формотерола, подразумеваются и соответствующие энантиомерные соли R-салметерола, S-салметерола, R,R-формотерола, S,S-формотерола, R,S-формотерола, S,R-формотерола, а также их смеси, при этом особое значение придается энантиомерным солям R-салметерола и R,R-формотерола. Согласно изобретению соединения 3 могут быть представлены далее в виде их гидратов или сольватов.
При упоминании соединений 3 согласно настоящему изобретению имеются в виду физиологически совместимые кислотно-аддитивные соли. Под такими физиологически совместимыми кислотно-аддитивными солями бетамиметиков 3 в соответствии с изобретением подразумеваются фармацевтически приемлемые соли, выбранные из солей соляной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, уксусной кислоты, фумаровой кислоты, янтарной кислоты, молочной кислоты, лимонной кислоты, винной кислоты, 1-гидрокси-2-нафталинкарбоновой кислоты, коричной кислоты, 4-фенилкоричной кислоты, дифлунисала или малеиновой кислоты. В некоторых случаях для получения солей 3 можно также использовать смеси указанных кислот. Предпочтительны в соответствии с изобретением соли бетамиметиков 3, выбранные из группы, включающей гидрохлорид, гидробромид, сульфат, фосфат, фумарат, метансульфонат, 4-фенилциннамат, дифлунисал и ксинафоат. При использовании салметерола в качестве бетамиметика 3 его соли наиболее предпочтительно выбирать среди тех солей, растворимость которых в воде составляет 0,1 мг/мл или менее, предпочтительно 0,05 мг/мл или менее, особенно предпочтительно 0,04 мг/мл или менее. В этом отношении в качестве примера наиболее предпочтительных солей салметерола можно назвать ксинафоат, 4-фенилциннамат и дифлунисал. В особенно предпочтительном варианте используют соли 3 салметерола с растворимостью в воде 0,035 мг/мл или менее, как, например, 4-фенилциннамат или дифлунисал. При использовании формотерола в качестве бетамиметика 3 его соли наиболее предпочтительно выбирать среди гидрохлорида, сульфата и фумарата, из которых особенно предпочтительны гидрохлорид и фумарат. Особое значение согласно изобретению имеет формотеролфумарат.
В описании настоящего изобретения в тех случаях, когда речь идет о бетамиметиках, не представленных в виде соли, такие соединения обозначаются как 3′. Так, например, под предпочтительными согласно изобретению бетамиметиками 3′, которые не представлены в виде соли, подразумеваются формотерол или салметерол в виде свободного основания, тогда как под особенно предпочтительными согласно изобретению соединениями 3 имеются в виду, например, салметеролксинафоат, салметерол-4-фенилциннамат или формотеролфумарат.
В некоторых случаях в настоящем описании вместо понятия “бетамиметики 3” используется также понятие “симпатомиметики” или “агонисты  2-рецептора” (“ 2-рецептора” (“ 2-агонисты”). Все такие обозначения рассматриваются согласно настоящему изобретению как эквивалентные. 2-агонисты”). Все такие обозначения рассматриваются согласно настоящему изобретению как эквивалентные.
Предлагаемые в изобретении лекарственные композиции, содержащие комбинацию действующих веществ 1, 2 и 3, предпочтительно вводить в организм путем ингаляции. С этой целью могут использоваться соответствующие ингаляционные порошки, которые в расфасованном в соответствующие капсулы виде (в виде ингалеток) вводятся в организм с помощью пригодных для этой цели ингаляторов для порошков. В соответствии с этим еще одним объектом настоящего изобретения является лекарственное средство, содержащее комбинацию действующих веществ 1, 2 и 3.
Еще одним объектом настоящего изобретения является лекарственное средство, содержащее одну или несколько солей 1, одно или несколько соединений 2 и одно или несколько соединений 3, необязательно в виде их сольватов или гидратов. В этом случае действующие вещества либо могут совместно входить в состав одной единственной лекарственной формы, либо могут входить в состав двух раздельных лекарственных форм, либо могут по отдельности входить в состав трех раздельных лекарственных форм. Предпочтительны согласно изобретению лекарственные средства, в которых действующие вещества 1, 2 и 3 присутствуют в одной единственной лекарственной форме.
Еще одним объектом настоящего изобретения является лекарственное средство, в состав которого наряду с действующими веществами 1, 2 и 3, взятыми в терапевтически эффективных количествах, входит также фармацевтически приемлемый носитель. Следующим объектом настоящего изобретения является лекарственное средство, которое помимо действующих веществ 1, 2 и 3, взятых в терапевтически эффективных количествах, не содержит никакого фармацевтически приемлемого носителя.
Настоящее изобретение относится далее к применению действующих веществ 1, 2 и 3 для получения содержащего их в терапевтически эффективных количествах лекарственного средства, предназначенного для лечения воспалительных и/или обструктивных заболеваний дыхательных путей, прежде всего астмы и/или хронического обструктивного заболевания легких (ХОЗЛ), путем одновременного или последовательного введения в организм этих действующих веществ. Предлагаемые в изобретении лекарственные композиции могут использоваться для получения лекарственного средства, предназначенного для лечения, например, кистозного фиброза или аллергического альвеолита (легких фермера) путем одновременного или последовательного введения в организм действующих веществ. Действующие вещества в их предлагаемых в изобретении комбинациях не применяют только в том случае, когда противопоказано лечение одним из фармацевтически активных действующих веществ.
Настоящее изобретение относится также к одновременному или последовательному применению указанной выше комбинации действующих (лекарственных) веществ 1, 2 и 3 в терапевтически эффективных дозах для лечения воспалительных или обструктивных заболеваний дыхательных путей, прежде всего астмы и/или хронического обструктивного заболевания легких (ХОЗЛ), при условии, что лечение стероидами или бетамиметиками не противопоказано с терапевтической точки зрения. Изобретение относится далее к одновременному или последовательному применению указанной выше комбинации действующих (лекарственных) веществ 1, 2 и 3 в терапевтически эффективных дозах для лечения, например, кистозного фиброза или аллергического альвеолита (легких фермера).
В предлагаемых в изобретении комбинациях действующих веществ 1, 2 и 3 эти компоненты 1, 2 и 3 могут быть представлены в виде их энантиомеров, смесей энантиомеров или в виде рацематов. Предлагаемые в изобретении лекарственные средства содержат действующие вещества 1, 2 и 3, например, в количестве, которое соответствует дозировке комбинации действующих веществ 1, 2 и 3, составляющей из расчета на один прием от 1 до 10000 мкг, предпочтительно от 10 до 2000 мкг.
Соотношение, в котором действующие вещества 1, 2 и 3 могут применяться в их предлагаемой в изобретении комбинации, является переменной величиной. Действующие вещества 1, 2 и 3 при определенных условиях могут быть представлены в виде их сольватов или гидратов. В зависимости от выбора конкретных соединений 1, 2 и 3 применяемое согласно настоящему изобретению массовое соотношение между компонентами в их комбинации варьируется из-за различий молекулярных масс различных соединений, а также из-за различий в степени проявляемого ими действия. Массовое соотношение между соединениями 1′ и 2 в предлагаемых в изобретении содержащих их лекарственных композициях обычно может составлять от 1:250 до 250:1, предпочтительно от 1:150 до 150:1. В наиболее предпочтительных лекарственных композициях, которые наряду с соединением 1′ содержат в качестве стероида 2 соединение, выбранное из группы, включающей будесонид, флутиказон, мометазон, ST-126 и циклесонид, массовое соотношение между соединениями 1′ и 2 предпочтительно составляет примерно от 1:40 до 40:1, наиболее предпочтительно от 1:30 до 30:1.
Предпочтительные предлагаемые в изобретении комбинации действующих веществ 1 и 2 могут содержать катион 1′ и один из указанных выше предпочтительных для применения стероидов 2, например, в следующих массовых соотношениях (но не ограничиваясь только ими): 1:20, 1:19, 1:18, 1:17, 1:16, 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 11:1, 12:1, 13:1, 14:1, 15:1, 16:1, 17:1, 18:1, 19:1, 20:1.
Обычно при применении предлагаемых в изобретении лекарственных средств, содержащих комбинации действующих веществ 1 и 2, соединения 1′ и 2 совместно вводят в организм в дозировке, составляющей из расчета на один прием от 5 до 5000 мкг, предпочтительно от 10 до 2000 мкг, более предпочтительно от 15 до 1000 мкг, преимущественно от 20 до 800 мкг, согласно изобретению предпочтительно от 30 до 700 мкг, более предпочтительно от 40 до 600 мкг, преимущественно от 50 до 500 мкг, еще более предпочтительно от 40 до 500 мкг, наиболее предпочтительно от 50 до 400 мкг. Предлагаемые в изобретении комбинации действующих веществ 1 и 2 содержат катион 1′ и стероид 2, например, в таких количествах, которые соответствуют общей дозировке, равной из расчета на один прием примерно 35 мкг, 45 мкг, 50 мкг, 55 мкг, 60 мкг, 65 мкг, 70 мкг, 75 мкг, 80 мкг, 85 мкг, 90 мкг, 95 мкг, 100 мкг, 105 мкг, 110 мкг, 115 мкг, 120 мкг, 125 мкг, 130 мкг, 135 мкг, 140 мкг, 145 мкг, 150 мкг, 155 мкг, 160 мкг, 165 мкг, 170 мкг, 175 мкг, 180 мкг, 185 мкг, 190 мкг, 195 мкг, 200 мкг, 205 мкг, 210 мкг, 215 мкг, 220 мкг, 225 мкг, 230 мкг, 235 мкг, 240 мкг, 245 мкг, 250 мкг, 255 мкг, 260 мкг, 265 мкг, 270 мкг, 275 мкг, 280 мкг, 285 мкг, 290 мкг, 295 мкг, 300 мкг, 305 мкг, 310 мкг, 315 мкг, 320 мкг, 325 мкг, 330 мкг, 335 мкг, 340 мкг, 345 мкг, 350 мкг, 355 мкг, 360 мкг, 365 мкг, 370 мкг, 375 мкг, 380 мкг, 385 мкг, 390 мкг, 395 мкг, 400 мкг, 405 мкг, 410 мкг, 415 мкг, 420 мкг, 425 мкг, 430 мкг, 435 мкг, 440 мкг, 445 мкг, 450 мкг, 455 мкг, 460 мкг, 465 мкг, 470 мкг, 475 мкг, 480 мкг, 485 мкг, 490 мкг, 495 мкг, 500 мкг, 505 мкг, 510 мкг, 515 мкг, 520 мкг, 525 мкг, 530 мкг, 535 мкг, 540 мкг, 545 мкг, 550 мкг, 555 мкг, 560 мкг, 565 мкг, 570 мкг, 575 мкг, 580 мкг, 585 мкг, 590 мкг, 595 мкг, 600 мкг, 605 мкг, 610 мкг или аналогичному количеству. Дозы, в которых из расчета на один прием можно вводить в организм предлагаемую в изобретении комбинацию действующих веществ, не ограничены указанными выше конкретными численными значениями, которые лишь в качестве примера отражают возможные количества. Очевидно, что предлагаемую в изобретении комбинацию действующих веществ можно вводить в организм и в иных дозах, которые отличаются от приведенных выше численных значений в ту или иную сторону на величину в интервале примерно ±2,5 мкг, прежде всего в интервале десятых долей. В таких интервалах дозировок массовое соотношение между действующими веществами 1′ и 2′ соответствует указанным выше значениям.
Предлагаемые в изобретении комбинации действующих веществ 1 и 2 могут содержать катион 1′ и стероид 2, например, в таких количествах (но не ограничиваясь только ими), чтобы обеспечить за один прием введение в организм 16,5 мкг компонента 1′ и 25 мкг компонента 2, 16,5 мкг компонента 1′ и 25 мкг компонента 2, 16,5 мкг компонента 1′ и 50 мкг компонента 2, 16,5 мкг компонента 1′ и 100 мкг компонента 2, 16,5 мкг компонента 1′ и 150 мкг компонента 2, 16,5 мкг компонента 1′ и 200 мкг компонента 2, 16,5 мкг компонента 1′ и 250 мкг компонента 2, 33,0 мкг компонента 1′ и 25 мкг компонента 2, 33,0 мкг компонента 1′ и 50 мкг компонента 2, 33,0 мкг компонента 1′ и 100 мкг компонента 2, 33,0 мкг компонента 1′ и 150 мкг компонента 2, 33,0 мкг компонента 1′ и 200 мкг компонента 2, 33,0 мкг компонента 1′ и 250 мкг компонента 2, 49,5 мкг компонента 1′ и 25 мкг компонента 2, 49,5 мкг компонента 1′ и 50 мкг компонента 2, 49,5 мкг компонента 1′ и 100 мкг компонента 2, 49,5 мкг компонента 1′ и 150 мкг компонента 2, 49,5 мкг компонента 1′ и 200 мкг компонента 2, 49,5 мкг компонента 1′ и 250 мкг компонента 2, 82,6 мкг компонента 1′ и 25 мкг компонента 2, 82,6 мкг компонента 1′ и 50 мкг компонента 2, 82,6 мкг компонента 1′ и 100 мкг компонента 2, 82,6 мкг компонента 1′ и 150 мкг компонента 2, 82,6 мкг компонента 1′ и 200 мкг компонента 2, 82,6 мкг компонента 1′ и 250 мкг компонента 2, 165,1 мкг компонента 1′ и 25 мкг компонента 2, 165,1 мкг компонента 1′ и 50 мкг компонента 2, 165,1 мкг компонента 1′ и 50 мкг компонента 2, 165,1 мкг компонента 1′ и 100 мкг компонента 2, 165,1 мкг компонента 1′ и 150 мкг компонента 2, 165,1 мкг компонента 1′ и 200 мкг компонента 2, 165,1 мкг компонента 1′ и 250 мкг компонента 2, 206,4 мкг компонента 1′ и 25 мкг компонента 2, 206,4 мкг компонента 1′ и 50 мкг компонента 2, 206,4 мкг компонента 1′ и 100 мкг компонента 2, 206,4 мкг компонента 1′ и 150 мкг компонента 2, 206,4 мкг компонента 1′ и 200 мкг компонента 2, 206,4 мкг компонента 1′ и 250 мкг компонента 2, 412,8 мкг компонента 1′ и 25 мкг компонента 2, 412,8 мкг компонента 1′ и 50 мкг компонента 2, 412,8 мкг компонента 1′ и 100 мкг компонента 2, 412,8 мкг компонента 1′ и 150 мкг компонента 2, 412,8 мкг компонента 1′ и 200 мкг компонента 2, 412,8 мкг компонента 1′ и 250 мкг компонента 2.
Если в качестве предпочтительной согласно изобретению комбинации действующих веществ 1 и 2 используется комбинация, в которой солью 1 является бромид, а компонентом 2 является один из упомянутых выше в качестве предпочтительных стероидов, то указанные выше в качестве примера количества вводимых в организм за один прием действующих веществ 1′ и 2 соответствуют следующим количествам действующих веществ 1 и 2 из расчета на один прием: 20 мкг компонента 1 и 25 мкг компонента 2, 20 мкг компонента 1 и 50 мкг компонента 2, 20 мкг компонента 1 и 100 мкг компонента 2, 20 мкг компонента 1 и 150 мкг компонента 2, 20 мкг компонента 1 и 200 мкг компонента 2, 20 мкг компонента 1 и 250 мкг компонента 2, 40 мкг компонента 1 и 25 мкг компонента 2, 40 мкг компонента 1 и 25 мкг компонента 2, 40 мкг компонента 1 и 50 мкг компонента 2, 40 мкг компонента 1 и 100 мкг компонента 2, 40 мкг компонента 1 и 150 мкг компонента 2, 40 мкг компонента 1 и 200 мкг компонента 2, 40 мкг компонента 1 и 250 мкг компонента 2, 60 мкг компонента 1 и 25 мкг компонента 2, 60 мкг компонента 1 и 50 мкг компонента 2, 60 мкг компонента 1 и 100 мкг компонента 2, 60 мкг компонента 1 и 150 мкг компонента 2, 60 мкг компонента 1 и 200 мкг компонента 2, 60 мкг компонента 1 и 250 мкг компонента 2, 100 мкг компонента 1 и 25 мкг компонента 2, 100 мкг компонента 1 и 50 мкг компонента 2, 100 мкг компонента 1 и 100 мкг компонента 2, 100 мкг компонента 1 и 150 мкг компонента 2, 100 мкг компонента 1 и 200 мкг компонента 2, 100 мкг компонента 1 и 250 мкг компонента 2, 200 мкг компонента 1 и 25 мкг компонента 2, 200 мкг компонента 1 и 50 мкг компонента 2, 200 мкг компонента 1 и 100 мкг компонента 2, 200 мкг компонента 1 и 150 мкг компонента 2, 200 мкг компонента 1 и 200 мкг компонента 2, 200 мкг компонента 1 и 250 мкг компонента 2, 250 мкг компонента 1 и 25 мкг компонента 2, 250 мкг компонента 1 и 50 мкг компонента 2, 250 мкг компонента 1 и 100 мкг компонента 2, 250 мкг компонента 1 и 150 мкг компонента 2, 250 мкг компонента 1 и 200 мкг компонента 2, 250 мкг компонента 1 и 250 мкг компонента 2, 500 мкг компонента 1 и 25 мкг компонента 2, 500 мкг компонента 1 и 50 мкг компонента 2, 500 мкг компонента 1 и 100 мкг компонента 2, 500 мкг компонента 1 и 150 мкг компонента 2, 500 мкг компонента 1 и 200 мкг компонента 2, 500 мкг компонента 1 и 250 мкг компонента 2.
Одновременно с этим соотношение между соединением 1 и соединением 3 может составлять от 1:300 до 30:1, предпочтительно от 1:230 до 20:1, более предпочтительно от 1:150 до 10:1, преимущественно от 1:50 до 5:1, наиболее предпочтительно от 1:35 до 2:1.
Массовое соотношение между катионом 1′ и свободным основанием 3′ в предлагаемых в изобретении комбинациях действующих веществ может в случае, например, формотерола составлять, например, от 1:10 до 300:1, предпочтительно от 1:5 до 200:1, более предпочтительно от 1:3 до 150:1, наиболее предпочтительно от 1:2 до 100:1.
Предпочтительные предлагаемые в изобретении комбинации действующих веществ 1 и 3 могут содержать катион 1′ и формотерол 3′, например, в следующих массовых соотношениях (но не ограничиваясь только ими): 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 11:1, 12:1, 13:1, 14:1, 15:1, 16:1, 17:1, 18:1, 19:1, 20:1, 21:1, 22:1, 23:1, 24:1, 25:1, 26:1, 27:1, 28:1, 29:1, 30:1, 31:1, 32:1, 33:1, 34:1, 35:1, 36:1, 37:1, 38:1, 39:1, 40:1, 41:1, 42:1, 43:1, 44:1, 45:1, 46:1, 47:1, 48:1, 49:1, 50:1, 51:1, 52:1, 53:1, 54:1, 55:1, 56:1, 57:1, 58:1, 59:1, 60:1, 61:1, 62:1, 63:1, 64:1, 65:1, 66:1, 67:1, 68:1, 69:1, 70:1, 71:1, 72:1, 73:1, 74:1, 75:1, 76:1, 77:1, 78:1, 79:1, 80:1, 81:1, 82:1, 83:1, 84:1, 85:1, 86:1, 87:1, 88:1, 89:1, 90:1, 91:1, 92:1, 93:1, 94:1, 95:1, 96:1, 97:1, 98:1, 99:1, 100:1.
Обычно при применении предлагаемых в изобретении лекарственных средств, содержащих комбинации действующих веществ 1 и 3, фармакологически активный катион 1′ и формотерол 3′ совместно вводят в организм в дозировке, составляющей от 5 до 5000 мкг, предпочтительно от 10 до 2000 мкг, более предпочтительно от 15 до 1000 мкг, преимущественно от 20 до 800 мкг, согласно изобретению предпочтительно от 30 до 600 мкг, наиболее предпочтительно от 40 до 500 мкг.
Предлагаемые в изобретении комбинации действующих веществ 1 и 3 содержат катион 1′ и формотерол 3′, например, в таких количествах, которые соответствуют общей дозировке, равной из расчета на один прием примерно 10 мкг, 15 мкг, 20 мкг, 25 мкг, 30 мкг, 35 мкг, 45 мкг, 50 мкг, 55 мкг, 60 мкг, 65 мкг, 70 мкг, 75 мкг, 80 мкг, 85 мкг, 90 мкг, 95 мкг, 100 мкг, 105 мкг, 110 мкг, 115 мкг, 120 мкг, 125 мкг, 130 мкг, 135 мкг, 140 мкг, 145 мкг, 150 мкг, 155 мкг, 160 мкг, 165 мкг, 170 мкг, 175 мкг, 180 мкг, 185 мкг, 190 мкг, 195 мкг, 200 мкг, 205 мкг, 210 мкг, 215 мкг, 220 мкг, 225 мкг, 230 мкг, 235 мкг, 240 мкг, 245 мкг, 250 мкг, 255 мкг, 260 мкг, 265 мкг, 270 мкг, 275 мкг, 280 мкг, 285 мкг, 290 мкг, 295 мкг, 300 мкг, 305 мкг, 310 мкг, 315 мкг, 320 мкг, 325 мкг, 330 мкг, 335 мкг, 340 мкг, 345 мкг, 350 мкг, 355 мкг, 360 мкг, 365 мкг, 370 мкг, 375 мкг, 380 мкг, 385 мкг, 390 мкг, 395 мкг, 400 мкг, 405 мкг, 410 мкг, 415 мкг, 420 мкг, 425 мкг, 430 мкг, 435 мкг, 440 мкг, 445 мкг, 450 мкг, 455 мкг, 460 мкг, 465 мкг, 470 мкг, 475 мкг, 480 мкг, 485 мкг, 490 мкг, 495 мкг, 500 мкг, 505 мкг, 510 мкг, 515 мкг, 520 мкг, 525 мкг, 530 мкг, 535 мкг, 540 мкг, 545 мкг, 550 мкг, 555 мкг, 560 мкг, 565 мкг, 570 мкг, 575 мкг, 580 мкг, 585 мкг, 590 мкг, 595 мкг, 600 мкг или аналогичному количеству. Дозы, в которых из расчета на один прием можно вводить в организм предлагаемую в изобретении комбинацию действующих веществ, не ограничены указанными выше конкретными численными значениями, которые лишь в качестве примера отражают возможные количества. Очевидно, что предлагаемую в изобретении комбинацию действующих веществ можно вводить в организм и в иных дозах, которые отличаются от приведенных выше численных значений в ту или иную сторону на величину в интервале примерно ±2,5 мкг, прежде всего в интервале десятых долей. В таких интервалах дозировок массовое соотношение между действующими веществами 1′ и 3′ соответствует указанным выше значениям.
Предлагаемые в изобретении комбинации действующих веществ 1 и 3 могут содержать катион 1′ и формотерол 3′, например, в таких количествах (но не ограничиваясь только ими), чтобы обеспечить за один прием введение в организм 8,3 мкг компонента 1′ и 2,5 мкг компонента 3′, 8,3 мкг компонента 1′ и 4,9 мкг компонента 3′, 8,3 мкг компонента 1′ и 9,8 мкг компонента 3′, 8,3 мкг компонента 1′ и 14,7 мкг компонента 3′, 8,3 мкг компонента 1′ и 19,6 мкг компонента 3′, 8,3 мкг компонента 1′ и 24,4 мкг компонента 3′, 16,5 мкг компонента 1′ и 2,5 мкг компонента 3′, 16,5 мкг компонента 1′ и 4,9 мкг компонента 3′, 16,5 мкг компонента 1′ и 9,8 мкг компонента 3′, 16,5 мкг компонента 1′ и 14,7 мкг компонента 3′, 16,5 мкг компонента 1′ и 19,6 мкг компонента 3′, 16,5 мкг компонента 1′ и 24,4 мкг компонента 3′, 33,0 мкг компонента 1′ и 2,5 мкг компонента 3′, 33,0 мкг компонента 1′ и 4,9 мкг компонента 3′, 33,0 мкг компонента 1′ и 9,8 мкг компонента 3′, 33,0 мкг компонента 1′ и 14,7 мкг компонента 3′, 33,0 мкг компонента 1′ и 19,6 мкг компонента 3′, 33,0 мкг компонента 1′ и 24,4 мкг компонента 3′, 49,5 мкг компонента 1′ и 2,5 мкг компонента 3′, 49,5 мкг компонента 1′ и 4,9 мкг компонента 3′, 49,5 мкг компонента 1′ и 9,8 мкг компонента 3′, 49,5 мкг компонента 1′ и 14,7 мкг компонента 3′, 49,5 мкг компонента 1′ и 19,6 мкг компонента 3′, 49,5 мкг компонента 1′ и 24,4 мкг компонента 3′, 82,6 мкг компонента 1′ и 2,5 мкг компонента 3′, 82,6 мкг компонента 1′ и 4,9 мкг компонента 3′, 82,6 мкг компонента 1′ и 9,8 мкг компонента 3′, 82,6 мкг компонента 1′ и 14,7 мкг компонента 3′, 82,6 мкг компонента 1′ и 19,6 мкг компонента 3′, 82,6 мкг компонента 1′ и 24,4 мкг компонента 3′, 165,1 мкг компонента 1′ и 2,5 мкг компонента 3′, 165,1 мкг компонента 1′ и 4,9 мкг компонента 3′, 165,1 мкг компонента 1′ и 9,8 мкг компонента 3′, 165,1 мкг компонента 1′ и 14,7 мкг компонента 3′, 165,1 мкг компонента 1′ и 19,6 мкг компонента 3′, 165,1 мкг компонента 1′ и 24,4 мкг компонента 3′, 206,4 мкг компонента 1′ и 2,5 мкг компонента 3′, 206,4 мкг компонента 1′ и 4,9 мкг компонента 3′, 206,4 мкг компонента 1′ и 9,8 мкг компонента 3′, 206,4 мкг компонента 1′ и 14,7 мкг компонента 3′, 206,4 мкг компонента 1′ и 19,6 мкг компонента 3′, 206,4 мкг компонента 1′ и 24,4 мкг компонента 3′, 412,8 мкг компонента 1′ и 2,5 мкг компонента 3′, 412,8 мкг компонента 1′ и 4,9 мкг компонента 3′, 412,8 мкг компонента 1′ и 9,8 мкг компонента 3′, 412,8 мкг компонента 1′ и 14,7 мкг компонента 3′, 412,8 мкг компонента 1′ и 19,6 мкг компонента 3′, 412,8 мкг компонента 1′ и 24,4 мкг компонента 3′.
Если в качестве предпочтительной согласно изобретению комбинации действующих веществ 1 и 3 используется комбинация, в которой солью 1 является бромид, а компонентом 3 является формотеролфумарат, то указанные выше в качестве примера количества вводимых в организм за один прием действующих веществ 1′ и 3′ соответствуют следующим количествам действующих веществ 1 и 3 из расчета на один прием: 10 мкг компонента 1 и 2,9 мкг компонента 3, 10 мкг компонента 1 и 5,7 мкг компонента 3, 10 мкг компонента 1 и 11,5 мкг компонента 3, 10 мкг компонента 1 и 17,2 мкг компонента 3, 10 мкг компонента 1, и 22,9 мкг компонента 3, 10 мкг компонента 1 и 28,5 мкг компонента 3, 20 мкг компонента 1 и 2,9 мкг компонента 3, 20 мкг компонента 1 и 5,7 мкг компонента 3, 20 мкг компонента 1 и 11,5 мкг компонента 3, 20 мкг компонента 1 и 17,2 мкг компонента 3, 20 мкг компонента 1 и 22,9 мкг компонента 3, 20 мкг компонента 1 и 28,5 мкг компонента 3, 40 мкг компонента 1 и 2,9 мкг компонента 3, 40 мкг компонента 1 и 5,7 мкг компонента 3, 40 мкг компонента 1 и 11,5 мкг компонента 3, 40 мкг компонента 1 и 17,2 мкг компонента 3, 40 мкг компонента 1 и 22,9 мкг компонента 3, 40 мкг компонента 1 и 28,5 мкг компонента 3, 60 мкг компонента 1 и 2,9 мкг компонента 3, 60 мкг компонента 1 и 5,7 мкг компонента 3, 60 мкг компонента 1 и 11,5 мкг компонента 3, 60 мкг компонента 1 и 17,2 мкг компонента 3, 60 мкг компонента 1 и 22,9 мкг компонента 3, 60 мкг компонента 1 и 28,5 мкг компонента 3, 100 мкг компонента 1 и 2,9 мкг компонента 3, 100 мкг компонента 1 и 5,7 мкг компонента 3, 100 мкг компонента 1 и 11,5 мкг компонента 3, 100 мкг компонента 1 и 17,2 мкг компонента 3, 100 мкг компонента 1 и 22,9 мкг компонента 3, 100 мкг компонента 1 и 28,5 мкг компонента 3, 200 мкг компонента 1 и 2,9 мкг компонента 3, 200 мкг компонента 1 и 5,7 мкг компонента 3, 200 мкг компонента 1 и 11,5 мкг компонента 3, 200 мкг компонента 1 и 17,2 мкг компонента 3, 200 мкг компонента 1 и 22,9 мкг компонента 3, 200 мкг компонента 1 и 28,5 мкг компонента 3, 250 мкг компонента 1 и 2,9 мкг компонента 3, 250 мкг компонента 1 и 5,7 мкг компонента 3, 250 мкг компонента 1 и 11,5 мкг компонента 3, 250 мкг компонента 1 и 17,2 мкг компонента 3, 250 мкг компонента 1 и 22,9 мкг компонента 3, 250 мкг компонента 1 и 28,5 мкг компонента 3, 500 мкг компонента 1 и 2,9 мкг компонента 3, 500 мкг компонента 1 и 5,7 мкг компонента 3, 500 мкг компонента 1 и 11,5 мкг компонента 3, 500 мкг компонента 1 и 17,2 мкг компонента 3, 500 мкг компонента 1 и 22,9 мкг компонента 3, 500 мкг компонента 1 и 28,5 мкг компонента 3.
Если в качестве предпочтительной согласно изобретению комбинации действующих веществ 1 и 3 используется комбинация, в которой компонентом 3 является дигидрат формотеролфумарата, а солью 1 является бромид, то указанные выше в качестве примера количества вводимых в организм за один прием действующих веществ 1′ и 3′ соответствуют следующим количествам действующих веществ 1 и 3 из расчета на один прием: 10 мкг компонента 1 и 3 мкг компонента 3, 10 мкг компонента 1 и 6 мкг компонента 3, 10 мкг компонента 1 и 12 мкг компонента 3, 10 мкг компонента 1 и 18 мкг компонента 3, 10 мкг компонента 1 и 24 мкг компонента 3, 10 мкг компонента 1 и 30 мкг компонента 3, 20 мкг компонента 1 и 3 мкг компонента 3, 20 мкг компонента 1 и 6 мкг компонента 3, 20 мкг компонента 1 и 12 мкг компонента 3, 20 мкг компонента 1 и 18 мкг компонента 3, 20 мкг компонента 1 и 24 мкг компонента 3, 20 мкг компонента 1 и 30 мкг компонента 3, 40 мкг компонента 1 и 3 мкг компонента 3, 40 мкг компонента 1 и 6 мкг компонента 3, 40 мкг компонента 1 и 12 мкг компонента 3, 40 мкг компонента 1 и 18 мкг компонента 3, 40 мкг компонента 1 и 24 мкг компонента 3, 40 мкг компонента 1 и 30 мкг компонента 3, 60 мкг компонента 1 и 3 мкг компонента 3, 60 мкг компонента 1 и 6 мкг компонента 3, 60 мкг компонента 1 и 12 мкг компонента 3, 60 мкг компонента 1 и 18 мкг компонента 3, 60 мкг компонента 1 и 24 мкг компонента 3, 60 мкг компонента 1 и 30 мкг компонента 3, 100 мкг компонента 1 и 3 мкг компонента 3, 100 мкг компонента 1 и 6 мкг компонента 3, 100 мкг компонента 1 и 12 мкг компонента 3, 100 мкг компонента 1 и 18 мкг компонента 3, 100 мкг компонента 1 и 24 мкг компонента 3, 100 мкг компонента 1 и 30 мкг компонента 3, 200 мкг компонента 1 и 3 мкг компонента 3, 200 мкг компонента 1 и 6 мкг компонента 3, 200 мкг компонента 1 и 12 мкг компонента 3, 200 мкг компонента 1 и 18 мкг компонента 3, 200 мкг компонента 1 и 24 мкг компонента 3, 200 мкг компонента 1 и 30 мкг компонента 3, 250 мкг компонента 1 и 3 мкг компонента 3, 250 мкг компонента 1 и 6 мкг компонента 3, 250 мкг компонента 1 и 12 мкг компонента 3, 250 мкг компонента 1 и 18 мкг компонента 3, 250 мкг компонента 1 и 24 мкг компонента 3, 250 мкг компонента 1 и 30 мкг компонента 3, 500 мкг компонента 1 и 3 мкг компонента 3, 500 мкг компонента 1 и 6 мкг компонента 3, 500 мкг компонента 1 и 12 мкг компонента 3, 500 мкг компонента 1 и 18 мкг компонента 3, 500 мкг компонента 1 и 24 мкг компонента 3, 500 мкг компонента 1 и 30 мкг компонента 3.
В случае же, например, салметерола массовое соотношение между катионом 1′ и свободным основанием 3′ в предлагаемых в изобретении комбинациях действующих веществ может составлять примерно от 1:30 до 400:1, предпочтительно от 1:25 до 200:1, более предпочтительно от 1:20 до 100:1, наиболее предпочтительно от 1:15 до 50:1.
Предпочтительные предлагаемые в изобретении комбинации действующих веществ 1 и 3 могут содержать катион 1′ и салметерол 3′, например, в следующих массовых соотношениях (но не ограничиваясь только ими): 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 11:1, 12:1, 13:1, 14:1, 15:1, 16:1, 17:1, 18:1, 19:1, 20:1, 21:1, 22:1, 23:1, 24:1, 25:1, 26:1, 27:1, 28:1, 29:1, 30:1, 31:1. 32:1, 33:1, 34:1, 35:1.
Обычно при применении предлагаемых в изобретении лекарственных средств, содержащих комбинации действующих веществ 1 и 3, фармакологически активный катион 1′ и салметерол 3′ совместно вводят в организм в дозировке, составляющей из расчета на один прием от 5 до 5000 мкг, предпочтительно от 10 до 2000 мкг, более предпочтительно от 15 до 1000 мкг, преимущественно от 20 до 800 мкг, согласно изобретению предпочтительно от 30 до 750 мкг, наиболее предпочтительно от 40 до 700 мкг.
Предлагаемые в изобретении комбинации действующих веществ 1 и 3 содержат катион 1′ и салметерол 3′, например, в таких количествах, которые соответствуют общей дозировке, равной из расчета на один прием примерно 15 мкг, 20 мкг, 25 мкг, 30 мкг, 35 мкг, 45 мкг, 50 мкг, 55 мкг, 60 мкг, 65 мкг, 70 мкг, 75 мкг, 80 мкг, 85 мкг, 90 мкг, 95 мкг, 100 мкг, 105 мкг, 110 мкг, 115 мкг, 120 мкг, 125 мкг, 130 мкг, 135 мкг, 140 мкг, 145 мкг, 150 мкг, 155 мкг, 160 мкг, 165 мкг, 170 мкг, 175 мкг, 180 мкг, 185 мкг, 190 мкг, 195 мкг, 200 мкг, 205 мкг, 210 мкг, 215 мкг, 220 мкг, 225 мкг, 230 мкг, 235 мкг, 240 мкг, 245 мкг, 250 мкг, 255 мкг, 260 мкг, 265 мкг, 270 мкг, 275 мкг, 280 мкг, 285 мкг, 290 мкг, 295 мкг, 300 мкг, 305 мкг, 310 мкг, 315 мкг, 320 мкг, 325 мкг, 330 мкг, 335 мкг, 340 мкг, 345 мкг, 350 мкг, 355 мкг, 360 мкг, 365 мкг, 370 мкг, 375 мкг, 380 мкг, 385 мкг, 390 мкг, 395 мкг, 400 мкг, 405 мкг, 410 мкг, 415 мкг, 420 мкг, 425 мкг, 430 мкг, 435 мкг, 440 мкг, 445 мкг, 450 мкг, 455 мкг, 460 мкг, 465 мкг, 470 мкг, 475 мкг, 480 мкг, 485 мкг, 490 мкг, 495 мкг, 500 мкг, 505 мкг, 510 мкг, 515 мкг, 520 мкг, 525 мкг, 530 мкг, 535 мкг, 540 мкг, 545 мкг, 550 мкг, 555 мкг, 560 мкг, 565 мкг, 570 мкг, 575 мкг, 580 мкг, 585 мкг, 590 мкг, 595 мкг, 600 мкг, 605 мкг, 610 мкг, 615 мкг, 620 мкг, 625 мкг, 630 мкг, 635 мкг, 640 мкг, 645 мкг, 650 мкг, 655 мкг, 660 мкг, 665 мкг, 670 мкг, 675 мкг, 680 мкг, 685 мкг, 690 мкг, 695 мкг, 700 мкг или аналогичному количеству. Дозы, в которых из расчета на один прием можно вводить в организм предлагаемую в изобретении комбинацию действующих веществ, не ограничены указанными выше конкретными численными значениями, которые лишь в качестве примера отражают возможные количества. Очевидно, что предлагаемую в изобретении комбинацию действующих веществ можно вводить в организм и в иных дозах, которые отличаются от приведенных выше численных значений в ту или иную сторону на величину в интервале примерно ±2,5 мкг, прежде всего в интервале десятых долей. В таких интервалах дозировок массовое соотношение между действующими веществами 1′ и 3′ соответствует указанным выше значениям.
Предлагаемые в изобретении комбинации действующих веществ 1 и 3 могут содержать катион 1′ и салметерол 3′, например, в таких количествах (но не ограничиваясь только ими), чтобы обеспечить за один прием введение в организм 8,3 мкг компонента 1′ и 12,5 мкг компонента 3′, 8,3 мкг компонента 1′ и 25 мкг компонента 3′, 8,3 мкг компонента 1′ и 50 мкг компонента 3′, 8,3 мкг компонента 1′ и 75 мкг компонента 3′, 8,3 мкг компонента 1′ и 100 мкг компонента 3′, 8,3 мкг компонента 1′ и 200 мкг компонента 31, 16,5 мкг компонента 1′ и 12,5 мкг компонента 3′, 16,5 мкг компонента 1′ и 25 мкг компонента 3′, 16,5 мкг компонента 1′ и 50 мкг компонента 3′, 16,5 мкг компонента 1′ и 75 мкг компонента 3′, 16,5 мкг компонента 1′ и 100 мкг компонента 3′, 16,5 мкг компонента 1′ и 200 мкг компонента 3′, 33,0 мкг компонента 1′ и 12,5 мкг компонента 3′, 33,0 мкг компонента 1′ и 25 мкг компонента 3′, 33,0 мкг компонента 1′ и 50 мкг компонента 3′, 33,0 мкг компонента 1′ и 75 мкг компонента 3′, 33,0 мкг компонента 1′ и 100 мкг компонента 3′, 33,0 мкг компонента 1′ и 200 мкг компонента 3′, 49,5 мкг компонента 1′ и 12,5 мкг компонента 3′, 49,5 мкг компонента 1′ и 25 мкг компонента 3′, 49,5 мкг компонента 1′ и 50 мкг компонента 3′, 49,5 мкг компонента 1′ и 75 мкг компонента 3′, 49,5 мкг компонента 1′ и 100 мкг компонента 3′, 49,5 мкг компонента 1′ и 200 мкг компонента 3′, 82,6 мкг компонента 1′ и 12,5 мкг компонента 3′, 82,6 мкг компонента 1′ и 25 мкг компонента 3′, 82,6 мкг компонента 1′ и 50 мкг компонента 3′, 82,6 мкг компонента 1′ и 75 мкг компонента 3′, 82,6 мкг компонента 1′ и 100 мкг компонента 3′, 82,6 мкг компонента 1′ и 200 мкг компонента 3′, 165,1 мкг компонента 1′ и 12,5 мкг компонента 3′, 165,1 мкг компонента 1′ и 25 мкг компонента 3′, 165,1 мкг компонента 1′ и 50 мкг компонента 3′, 165,1 мкг компонента 1′ и 75 мкг компонента 3′, 165,1 мкг компонента 1′ и 100 мкг компонента 3′, 165,1 мкг компонента 1′ и 200 мкг компонента 3′, 206,4 мкг компонента 1′ и 12,5 мкг компонента 3′, 206,4 мкг компонента 1′ и 25 мкг компонента 3′, 206,4 мкг компонента 1′ и 50 мкг компонента 3′, 206,4 мкг компонента 1′ и 75 мкг компонента 3′, 206,4 мкг компонента 1′ и 100 мкг компонента 3′, 206,4 мкг компонента 1′ и 200 мкг компонента 3′, 412,8 мкг компонента 1′ и 12,5 мкг компонента 3′, 412,8 мкг компонента 1′ и 25 мкг компонента 3′, 412,8 мкг компонента 1′ и 50 мкг компонента 3′, 412,8 мкг компонента 1′ и 75 мкг компонента 3′, 412,8 мкг компонента 1′ и 100 мкг компонента 3′, 412,8 мкг компонента 1′ и 200 мкг компонента 3′.
Если в качестве предпочтительной согласно изобретению комбинации действующих веществ 1 и 3 используется комбинация, в которой солью 1 является бромид, а компонентом 3 является салметеролксинафоат, то указанные выше в качестве примера количества вводимых в организм за один прием действующих веществ 1′ и 3′ соответствуют следующим количествам действующих веществ 1 и 3 из расчета на один прием: 10 мкг компонента 1 и 18,2 мкг компонента 3, 10 мкг компонента 1 и 36,3 мкг компонента 3, 10 мкг компонента 1 и 72,6 мкг компонента 3, 10 мкг компонента 1 и 108,9 мкг компонента 3, 10 мкг компонента 1 и 145,2 мкг компонента 3, 10 мкг компонента 1 и 290,4 мкг компонента 3, 20 мкг компонента 1 и 18,2 мкг компонента 3, 20 мкг компонента 1 и 36,3 мкг компонента 3, 20 мкг компонента 1 и 72,6 мкг компонента 3, 20 мкг компонента 1 и 108,9 мкг компонента 3, 20 мкг компонента 1 и 145,2 мкг компонента 3, 20 мкг компонента 1 и 290,4 мкг компонента 3, 40 мкг компонента 1 и 18,2 мкг компонента 3, 40 мкг компонента 1 и 36,3 мкг компонента 3, 40 мкг компонента 1 и 72,6 мкг компонента 3, 40 мкг компонента 1 и 108,9 мкг компонента 3, 40 мкг компонента 1 и 145,2 мкг компонента 3, 40 мкг компонента 1 и 290,4 мкг компонента 3, 60 мкг компонента 1 и 18,2 мкг компонента 3, 60 мкг компонента 1 и 36,3 мкг компонента 3, 60 мкг компонента 1 и 72,6 мкг компонента 3, 60 мкг компонента 1 и 108,9 мкг компонента 3, 60 мкг компонента 1 и 145,2 мкг компонента 3, 60 мкг компонента 1 и 290,4 мкг компонента 3, 100 мкг компонента 1 и 18,2 мкг компонента 3, 100 мкг компонента 1 и 36,3 мкг компонента 3, 100 мкг компонента 1, и 72,6 мкг компонента 3, 100 мкг компонента 1 и 108,9 мкг компонента 3, 100 мкг компонента 1 и 145,2 мкг компонента 3, 100 мкг компонента 1 и 290,4 мкг компонента 3, 200 мкг компонента 1 и 18,2 мкг компонента 3, 200 мкг компонента 1 и 36,3 мкг компонента 3, 200 мкг компонента 1 и 72,6 мкг компонента 3, 200 мкг компонента 1 и 108,9 мкг компонента 3, 200 мкг компонента 1 и 145,2 мкг компонента 3, 200 мкг компонента 1 и 290,4 мкг компонента 3, 250 мкг компонента 1 и 18,2 мкг компонента 3, 250 мкг компонента 1 и 36,3 мкг компонента 3, 250 мкг компонента 1 и 72,6 мкг компонента 3, 250 мкг компонента 1 и 108,9 мкг компонента 3, 250 мкг компонента 1 и 145,2 мкг компонента 3, 250 мкг компонента 1 и 290,4 мкг компонента 3, 500 мкг компонента 1 и 18,2 мкг компонента 3, 500 мкг компонента 1 и 36,3 мкг компонента 3, 500 мкг компонента 1 и 72,6 мкг компонента 3, 500 мкг компонента 1 и 108,9 мкг компонента 3, 500 мкг компонента 1 и 145,2 мкг компонента 3, 500 мкг компонента 1 и 290,4 мкг компонента 3.
Аналогичным путем можно рассчитать вводимые в организм за один прием количества действующих веществ в предлагаемых в изобретении лекарственных композициях, в которых вместо салметеролксинафоата используются другие соединения 3, которые также предпочтительныы для применения в предусмотренных изобретениях целях и к которым относятся соль салметерол-4-фенилкоричной кислоты (4-фенилциннамат) и соль салметерол-5-(2,4-дифторфенил)салициловой кислоты (5-(2,4-дифторфенил)салицилат, дифлунисал).
Предлагаемые в изобретении комбинации действующих веществ 1, 2 и 3 предпочтительно вводить в организм путем ингаляции. С этой целью компоненты 1, 2, и 3 должны быть представлены в пригодных для ингаляции лекарственных формах. К подобным ингалируемым лекарственным формам относятся в соответствии с изобретением ингаляционные порошки, дозированные аэрозоли с пропеллентом или ингаляционные растворы без пропеллента. Согласно изобретению ингаляционные порошки, содержащие комбинацию действующих веществ 1, 2 и 3, могут состоять только из них либо из их смеси с физиологически совместимыми вспомогательными веществами. В некоторых случаях в описании настоящего изобретения вместо термина “вспомогательное вещество” используется также термин “носитель”. Согласно настоящему изобретению под выражением “ингаляционные растворы без пропеллента” подразумеваются также концентраты или стерильные, готовые к применению ингаляционные растворы. В соответствии с изобретением используемые в комбинации между собой действующие вещества 1, 2 и 3 могут содержаться либо совместно в одной лекарственное форме, либо в двух отдельных лекарственных формах, либо раздельно в трех отдельных лекарственных формах. Такие используемые согласно настоящему изобретению лекарственные формы более подробно рассмотрены в последующей части описания.
А) Ингаляционные порошки, содержащие предлагаемые в изобретении комбинации действующих веществ 1, 2 и 3
В предлагаемых в изобретении ингаляционных порошках действующие вещества 1, 2 и 3 могут содержаться либо индивидуально, либо в смеси с приемлемыми физиологически безвредными вспомогательными веществами.
Если действующее вещества 1, 2 и 3 содержатся в предлагаемых в изобретении ингаляционных порошках в смеси с физиологически безвредными вспомогательными веществами, то для получения таких порошков могут использоваться следующие физиологически безвредные (совместимые) вспомогательные вещества: моносахариды (например, глюкоза или арабиноза), дисахариды (например, лактоза, сахароза, мальтоза), олиго- и полисахариды (например, декстраны), полиспирты (например, сорбит, маннит, ксилит), соли (например, хлорид натрия, карбонат кальция) или смеси этих вспомогательных веществ между собой. Предпочтительно использовать моно- или дисахариды, при этом особенно предпочтительно применение лактозы или глюкозы, прежде всего, но не исключительно, в виде их гидратов. Особенно предпочтительно согласно изобретению применять в качестве вспомогательного вещества лактозу, наиболее предпочтительно ее моногидрат.
Максимальный средний размер частиц вспомогательных веществ, применяемых в предлагаемых в изобретении ингаляционных порошках, составляет вплоть до 250 мкм, предпочтительно от 10 до 150 мкм, наиболее предпочтительно от 15 до 80 мкм. При определенных условиях может оказаться целесообразным примешивать к указанным выше вспомогательным веществам их же фракции с меньшим средним размером частиц, составляющим от 1 до 9 мкм. Подобные вспомогательные вещества, представленные в виде частиц меньшей крупности, также выбирают из описанной выше группы вспомогательных веществ, применяемых в ингаляционных порошках. Помимо этого при получении предлагаемых в изобретении ингаляционных порошков предлагается примешивать к смеси вспомогательных веществ микронизированные действующие вещества 1, 2 и 3, средний размер частиц которых предпочтительно составляет от 0,5 до 10 мкм, наиболее предпочтительно от 1 до 5 мкм. Способы получения предлагаемых в изобретении ингаляционных порошков путем размола и микронизации компонентов с последующим их смешением известны из уровня техники. Предлагаемые в изобретении ингаляционные порошки можно получать и применять либо в виде единой порошковой смеси, одновременно содержащей действующие вещества 1, а также 2 и 3, либо в виде отдельных ингаляционных порошков, каждый из которых содержит соответственно только одно из действующих веществ 1, 2 и 3.
Для введения в организм предлагаемых в изобретении ингаляционных порошков можно использовать известные из уровня техники ингаляторы. Для введения предлагаемых в изобретении ингаляционных порошков, которые наряду с действующими веществами 1, 2 и 3 содержат также физиологически безвредные (совместимые) вспомогательные вещества, можно использовать, например, ингаляторы, в которых разовая доза из расходной емкости выдается с помощью дозирующей камеры, описанной, в частности, в патенте US 4570630, или с помощью иных устройств, описанных, в частности, в DE 3625685 А. Однако предлагаемые в изобретении ингаляционные порошки, которые наряду с действующими веществами 1, 2 и 3 содержат также физиологически безвредные (совместимые) вспомогательные вещества, предпочтительно расфасовывать в капсулы (с получением так называемых ингалеток), которые применяются в ингаляторах, описанных, например, в WO 94/28958.
Для применения предлагаемых в изобретении лекарственных композиций в ингалетках наиболее предпочтительно использовать ингалятор, показанный на фиг.1. Такой ингалятор (карманный ингалятор), предназначенный для ингаляции порошковых лекарственных средств из капсул, отличается наличием корпуса 1 с двумя окошками 2, пластинчатой перегородки 3, в которой предусмотрены впускные отверстия для воздуха и которая снабжена сеткой 5, удерживаемой в собранном состоянии соответствующим крепежным элементом 4, соединенной с пластинчатой перегородкой 3 камеры 6 для капсулы с ингаляционным составом, сбоку которой (камеры) предусмотрена нажимная кнопка 9, снабженная двумя шлифованными иглами 7 и выполненная подвижной против усилия пружины 8, а также наличием мундштука 12, который выполнен откидным с возможностью поворота вокруг оси 10, соединяющей его с корпусом 1, пластинчатой перегородкой 3 и колпачком 11 и сквозных отверстий 13 для прохода воздуха, служащих для регулирования аэрогидродинамического сопротивления.
Если предлагаемые в изобретении ингаляционные порошки с учетом вышеуказанного предпочтительного метода их применения предполагается расфасовывать в капсулы (с получением ингалеток), то каждую капсулу целесообразно заполнять ингаляционным порошком в количестве от 1 до 30 мг, предпочтительно от 3 до 20 мг, более предпочтительно от 5 до 10 мг. Содержание в указанных количествах действующих веществ, используемых совместно либо раздельно, соответствует согласно изобретению уже указанным выше для компонентов 1, 2 и 3 дозировкам из расчета на один прием.
Б) Ингаляционные аэрозоли с пропеллентом, содержащие предлагаемые в изобретении комбинации действующих веществ 1, 2 и 3
В предлагаемых в изобретении ингаляционных аэрозолях с пропеллентом действующие вещества 1, 2 и 3 могут присутствовать в растворенном или в диспергированном в пропелленте виде. При этом действующие вещества 1, 2 и 3 могут содержаться в раздельных лекарственных формах либо в одной единой лекарственной форме, причем указанные компоненты 1, 2 и 3 либо все три могут присутствовать в растворенном виде, либо все три могут присутствовать в диспергированном виде, либо только один или два из них могут присутствовать в растворенном, а другие, соответственно другой – в диспергированном виде.
Используемые для получения предлагаемых в изобретении ингаляционных аэрозолей пропелленты известны из уровня техники. Пригодные для этой цели пропелленты выбирают из группы, включающей углеводороды, такие как н-пропан, н-бутан или изобутан, и галогензамещенные углеводороды, такие как фторированные производные метана, этана, пропана, бутана, циклопропана или циклобутана. Указанные выше пропелленты могут при этом использоваться индивидуально либо в виде их смесей. Наиболее предпочтительными пропеллентами являются галогенированные производные алканов, выбранные из группы, включающей TG134, TG27, а также их смеси.
В состав предлагаемых в изобретении ингаляционных аэрозолей с пропеллентом могут входить также другие компоненты, такие как сорастворители, стабилизаторы, поверхностно-активные вещества (ПАВ), антиоксиданты, смазывающие вещества, консерванты, а также средства для регулирования значения рН. Все такие компоненты известны из уровня техники.
Предлагаемые в изобретении ингаляционные аэрозоли с пропеллентом могут содержать до 5 мас.% действующего вещества 1, 2 и/или 3. Так, например, предлагаемые в изобретении аэрозоли могут содержать действующее вещество 1, 2 и/или 3 в количестве от 0,002 до 5 мас.%, от 0,01 до 3 мас.%, от 0,015 до 2 мас.%, от 0,1 до 2 мас.%, от 0,5 до 2 мас.% или от 0,5 до 1 мас.%.
Если действующие вещества 1, 2 и/или 3 представлены в диспергированном виде, то средний размер их частиц предпочтительно составляет до 10 мкм, более предпочтительно от 0,1 до 5 мкм, наиболее предпочтительно от 1 до 5 мкм. Для введения в организм описанных выше предлагаемых в изобретении ингаляционных аэрозолей с пропеллентом могут использоваться известные из уровня техники ингаляторы (ингаляторы, выдающие мерную дозу препарата). В соответствии с этим еще одним объектом настоящего изобретения является лекарственное средство в виде описанных выше аэрозолей с пропеллентом в сочетании с одним или несколькими пригодными для введения таких аэрозолей ингаляторов. Еще одним объектом настоящего изобретения являются ингаляторы, отличающиеся тем, что они содержат составы для получения описанных выше предлагаемых в изобретении аэрозолей с пропеллентом. Настоящее изобретение относится также к сменным баллончикам (патронам), которые, будучи оснащены соответствующим клапаном, могут использоваться в соответствующем ингаляторе и которые содержат один из описанных выше составов для получения предлагаемых в изобретении ингаляционных аэрозолей с пропеллентом. Подобные сменные баллончики и способы их заполнения составами для получения предлагаемых в изобретении ингаляционных аэрозолей с пропеллентом известны из уровня техники.
В) Ингаляционные растворы или суспензии без пропеллента, содержащие предлагаемые в изобретении комбинации действующих веществ 1, 2 и 3
Предлагаемую в изобретении комбинацию действующих веществ наиболее предпочтительно применять в виде не содержащих пропеллента ингаляционных растворов и ингаляционных суспензий. В качестве таких растворов могут использоваться водные или спиртовые, предпочтительно этанольные, растворы. Растворителем при этом может служить только вода либо смесь воды с этанолом. Относительное содержание этанола в пересчете на количество воды не ограничено какими-либо конкретными пределами, предпочтительно, однако, чтобы максимальное содержание этанола составляло до 70 об.%, прежде всего до 60 об.%, наиболее предпочтительно до 30 об.%. Остальное количество, недостающее до 100 об.%, приходится на воду. Значение рН растворов или суспензий, содержащих компоненты 1, 2 и 3 по отдельности или совместно, устанавливают с помощью пригодных для этой цели кислот на 2-7, предпочтительно на 2-5. Для регулирования значения рН с целью его установки на указанные выше значения могут использоваться кислоты из числа неорганических или органических кислот. В качестве примера предпочтительных в этом отношении неорганических кислот можно назвать соляную кислоту, бромистоводородную кислоту, азотную кислоту, серную кислоту и/или фосфорную кислоту. В качестве примера наиболее пригодных для применения в указанных целях органических кислот можно назвать аскорбиновую кислоту, лимонную кислоту, яблочную кислоту, винную кислоту, малеиновую кислоту, янтарную кислоту, фумаровую кислоту, уксусную кислоту, муравьиную кислоту и/или пропионовую кислоту, а также другие кислоты. Предпочтительными неорганическими кислотами являются соляная кислота и серная кислота. Возможно также использование кислот, которые с одним из действующих веществ уже образуют кислотно-аддитивную соль. Среди органических кислот предпочтительны аскорбиновая кислота, фумаровая кислота и лимонная кислота. При определенных условиях допустимо использование и смесей указанных кислот, прежде всего в случае тех кислот, которые наряду с их повышающими кислотность свойствами обладают и иными свойствами, например, в качестве вкусовых веществ, антиоксидантов или комплексообразователей, как, например, лимонная кислота или аскорбиновая кислота. Для регулирования значения рН согласно изобретению наиболее предпочтительно использовать соляную кислоту.
Согласно изобретению можно отказаться от добавления к предлагаемому в нем препарату эдитиновой кислоты (ЭДТК) или одной из ее известных солей, в частности эдетата натрия, в качестве стабилизатора или комплексообразователя. Однако в других вариантах предусматривается использование этого(-их) соединения(-ий). В одном из таких предпочтительных вариантов, в котором предусмотрено применение эдетата натрия, его концентрация в растворе составляет менее 100 мг на 100 мл, предпочтительно менее 50 мг на 100 мл, наиболее предпочтительно менее 20 мг на 100 мл. В принципе предпочтительны такие ингаляционные растворы, содержание эдетата натрия в которых составляет от 0 до 10 мг на 100 мл.
К предлагаемым в изобретении ингаляционным растворам без пропеллента можно добавлять сорастворители и/или другие вспомогательные вещества. В качестве таких сорастворителей предпочтительно использовать таковые, которые содержат гидроксильные группы или иные полярные группы, например спирты, прежде всего изопропиловый спирт, гликоли, прежде всего пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, гликолевый эфир, глицерин, полиоксиэтиленовые спирты и эфиры полиоксиэтилена и жирных кислот. Под вспомогательными веществами и добавками в данном контексте подразумевается любое физиологически совместимое вещество, которое не является действующим веществом, но которое для улучшения качественных характеристик препарата можно включать в его состав совместно с действующим(-и) веществом(-ами) в физиологически приемлемом растворителе. Эти вещества не должны проявлять никакого или с учетом целевого терапевтического эффекта не должны проявлять никакого сколь-нибудь значительного или по меньшей мере никакого нежелательного фармакологического действия. К подобным вспомогательным веществам и добавкам относятся, например, поверхностно-активные вещества, такие как соевый лецитин, олеиновая кислота, сорбитановый эфир, в частности полисорбаты, поливинилпирролидон, прочие стабилизаторы, комплексообразователи, антиоксиданты и/или консерванты, обеспечивающие сохранность готового лекарственного препарата или позволяющие продлить срок его годности, вкусовые вещества, витамины и/или иные известные из уровня техники добавки. К таким добавкам относятся также физиологически безвредные соли в качестве придающих изотоничность агентов, такие, например, как хлорид натрия.
К числу предпочтительных вспомогательных веществ относятся антиоксиданты, такие, например, как аскорбиновая кислота, если только она уже не используется для регулирования значения рН, витамин А, витамин Е, токоферол и аналогичные встречающиеся в организме человека витамины или провитамины.
Консерванты могут использоваться для защиты препарата от заражения патогенными микроорганизмами. В качестве подобных консервантов могут использоваться известные из уровня техники вещества, прежде всего цетилпиридинийхлорид, бензалконийхлорид или бензойная кислота, соответственно бензоаты, такие как бензоат натрия, в известных из уровня техники концентрациях. Концентрация указанных выше консервантов предпочтительно должна составлять до 50 мг на 100 мл раствора, наиболее предпочтительно от 5 до 20 мг на 100 мл раствора.
Предпочтительные препараты помимо растворителя, которым является вода, и комбинации действующих веществ 1, 2 и 3 содержат также только бензалконийхлорид и эдетат натрия. В другом предпочтительном варианте предлагается полностью отказаться от применения эдетата натрия.
Для введения в организм предлагаемых в изобретении ингаляционных растворов без пропеллента наиболее пригодны такие ингаляторы, которые позволяют в течение нескольких секунд распылять небольшое количество жидкого препарата в терапевтически необходимой дозировке в виде аэрозоля, вводимого ингаляций в терапевтических целях. Согласно настоящему изобретению предпочтительны такие ингаляторы, которые в оптимальном случае уже при однократном приведении их в действие (за один ход поршня) позволяют выдавать распыляемый в виде аэрозоля со средним размером капелек менее 20 мкм, предпочтительно менее 10 мкм, раствор действующего вещества или действующих веществ порцией менее 100 мкл, предпочтительно менее 50 мкл, наиболее предпочтительно от 20 до 30 мкл, таким образом, чтобы ингалируемая, т.е. непосредственно попадающая в дыхательные пути, доля аэрозоля уже соответствовала терапевтически эффективному количеству действующего вещества или действующих веществ.
Подобное устройство, предназначенное для ингаляционного введения жидкого лекарственного средства, распыляемого в дозированных количествах в виде аэрозоля без помощи пропеллента, подробно рассмотрено, например, в заявке WO 91/14468, а также в заявке WO 97/12687 (в частности, представлено на фиг.6а и 6b этой заявки). Описанные в указанных заявках распылители или ингаляторы (устройства) известны также под названием Respimat®.
Именно подобный ингалятор (Respimat®) наиболее целесообразно использовать для генерирования предлагаемых в изобретении ингалируемых аэрозолей, содержащих комбинацию действующих веществ 1, 2 и 3. Пациент всегда может иметь при себе подобное устройство, которое благодаря его близкой к цилиндрической форме и подобранным по руке размерам, составляющим от менее 9 до 15 см в длину и от 2 до 4 см в ширину, удобно держать в руке и которое не занимает много места. Подобный ингалятор позволяет за счет создания высокого давления распылять через мелкие сопла (сопловые отверстия) строго определенный объем лекарственного препарата с образованием ингалируемых аэрозолей.
В предпочтительном варианте такой ингалятор состоит в основном из верхней корпусной детали, корпуса насоса, распылительной головки с сопловым отверстием или сопловыми отверстиями, стопорно-зажимного механизма, корпусной детали для размещения пружины, собственно пружины и расходной емкости и отличается наличием
– корпуса насоса, который (корпус) закреплен в верхней корпусной детали, и на одном конце которого расположена распылительная головка с сопловым отверстием, соответственно системой сопловых отверстий,
– полого поршня с клапанным элементом,
– ведомого фланца, в котором закреплен полый поршень и который расположен в верхней корпусной детали,
– стопорно-зажимного механизма, расположенного в верхней корпусной детали,
– корпусной детали с размещенной в ней пружиной, которая (корпусная деталь) смонтирована на верхней корпусной детали в поворотной опоре с возможностью поворота относительно этой верхней корпусной детали, и
– нижней корпусной детали, насаженной в осевом направлении на корпусную деталь для размещения пружины.
Указанный выше полый поршень с клапанным элементом соответствует описанному в заявке WO 97/12687 устройству. Этот полый поршень частично выступает в цилиндр корпуса насоса и может перемещаться в этом цилиндре в осевом направлении. В этом отношении следует прежде всего сослаться на фиг.1-4 указанной заявки, в частности на фиг.3, и на соответствующие разделы описания к этой заявке. В момент освобождения или спуска пружины полый поршень с клапанным элементом создает на стороне его высокого давления приложенное к жидкости, т.е. к дозируемому раствору действующего вещества или действующих веществ, давление величиной от 5 до 60 МПа (примерно от 50 до 600 бар), предпочтительно от 10 до 60 МПа (примерно от 100 до 600 бар). При этом объем одной порции лекарственного препарата, выдаваемой за один ход поршня, предпочтительно составляет от 10 до 50 мкл, более предпочтительно от 10 до 20 мкл, наиболее предпочтительно 15 мкл.
Клапанный элемент предпочтительно расположен на том конце полого поршня, который обращен к распылительной головке.
Сопло (сопловое отверстие) в распылительной головке предпочтительно выполнено микроструктурированным, т.е. изготовлено методами микротехники. Микроструктурированные распылительные головки описаны, например, в заявке WO 94/07607, которая тем самым в полном объеме включена в настоящее описание в качестве ссылки, что относится прежде всего к фиг.1 приложенных к этой заявке чертежей и к описанию этой фиг.1. Распылительная головка состоит, например, из двух прочно соединенных между собой пластин из стекла и/или кремния, из которых по меньшей мере в одной пластине имеется один или несколько микроструктурированных каналов, соединяющих входную сторону распылительной головки с ее выходной стороной. На выходной стороне распылительной головки расположено по меньшей мере одно круглое или некруглое отверстие глубиной от 2 до 10 мкм и шириной от 5 до 15 мкм, при этом предпочтительные значения глубины такого отверстия составляют от 4,5 до 6,5 мкм, а длины – от 7 до 9 мкм. При использовании нескольких, предпочтительно двух, сопловых (распылительных) отверстий они могут проходить в распылительной головке параллельно друг другу и тем самым формировать параллельные между собой струи или же они могут под наклоном друг к другу сходиться в направлении выходной стороны распылительной головки. У распылительной головки по меньшей мере с двумя сопловыми отверстиями на выходной стороне угол, образуемый между формируемыми ими и наклоненными друг к другу струями, может составлять от 20 до 160°, предпочтительно от 60 до 150°, прежде всего от 80 до 100°. Сопловые отверстия предпочтительно располагать на расстоянии от 10 до 200 мкм друг от друга, более предпочтительно на расстоянии от 10 до 100 мкм друг от друга, особенно предпочтительно на расстоянии от 30 до 70 мкм друг от друга. Наиболее предпочтительное расстояние между сопловыми отверстиями составляет 50 мкм. В соответствии с этим струи, формируемые такими сопловыми отверстиями, пересекаются непосредственно вблизи них.
Как уже указывалось выше, жидкий лекарственный состав нагнетается к распылительной головке под давлением, достигающим на входе в нее 600 бар, предпочтительно составляющим от 200 до 300 бар, и затем распыляется через ее сопловые отверстия в виде ингалируемого аэрозоля. Размер капелек такого аэрозоля предпочтительно составляет до 20 мкм, предпочтительно от 3 до 10 мкм.
Стопорно-зажимной механизм содержит в качестве аккумулятора механической энергии пружину, предпочтительно цилиндрическую винтовую пружину сжатия. Подобная пружина воздействует на ведомый фланец, который представляет собой скачкообразно выталкиваемый элемент, перемещение которого определяется положением стопора. Ход ведомого фланца точно ограничен верхним и нижним упорами. Сжатие (взведение) пружины предпочтительно обеспечивается передаточным механизмом в виде преобразователя силы, например упорно-винтовым механизмом, обеспечивающим поступательное перемещение звеньев, под действием внешнего крутящего момента, создаваемого при повороте верхней корпусной детали относительно находящейся в нижней корпусной детали корпусной детали для размещения пружины. В этом случае верхняя корпусная деталь и ведомый фланец содержат одно- или многозаходный клиновой механизм.
Стопор вместе с его запорными поверхностями кольцом охватывает ведомый фланец. Такой стопор представляет собой, например, упруго деформируемое в радиальном направлении кольцо из пластмассы или металла. Это кольцо расположено в плоскости, перпендикулярной продольной оси ингалятора. После сжатия или взведения пружины стопорные поверхности стопора смещаются вбок и оказываются на пути перемещения ведомого фланца, препятствуя тем самым разжатию пружины. Стопор выключается с помощью спусковой кнопки. Такая спусковая кнопка соединена или связана со стопором. Для спуска стопорно-зажимного механизма необходимо нажать на спусковую кнопку, сместив ее параллельно плоскости расположения указанного выше кольца, а именно сместив ее предпочтительно внутрь распылителя, что сопровождается деформированием такого деформируемого кольца в плоскости его расположения. Конструктивные особенности подобного стопорно-зажимного механизма более подробно описаны в заявке WO 97/20590.
Нижняя корпусная деталь насаживается в осевом направлении на корпусную деталь для размещения пружины и закрывает элементы крепления, соответственно опорные элементы, привод шпинделя и расходную емкость с жидкостью.
При приведении ингалятора в действие верхнюю корпусную деталь поворачивают относительно нижней корпусной детали, вместе с которой одновременно поворачивается и корпусная деталь для размещения пружины. При этом пружина сжимается и взводится упорно-винтовым механизмом, и стопорный механизм автоматически фиксируется в застопоренном положении. Предпочтительно, чтобы угол поворота верхней корпусной детали относительно нижней корпусной детали был в целое число раз меньше 360°, например, равнялся 180°. Одновременно со сжатием пружины ведомая деталь (ведомый фланец) перемещается в верхней корпусной детали на заданное расстояние, а полый поршень отводится назад внутри цилиндра в корпусе насоса, в результате чего в полость высокого давления, расположенную перед распылительной головкой, из расходной емкости всасывается определенная порция жидкости.
В ингалятор при необходимости можно последовательно вставлять и использовать несколько содержащих распыляемую жидкость сменных расходных емкостей (сменных баллончиков). Расходная емкость при этом заполнена предлагаемым в изобретении распыляемым в виде аэрозоля составом на водной основе.
Для распыления лекарственного препарата необходимо слегка надавить на спусковую кнопку. При этом стопорный механизм деблокирует ведомую деталь (ведомый фланец), освобождая ей путь. Одновременно с этим сжатая пружина, разжимаясь, перемещает поршень в цилиндр корпуса насоса. В результате жидкость выходит из распылительной головки ингалятора в распыленном виде.
Более подробно другие конструктивные особенности такого устройства описаны в заявках WO 97/12683 и WO 97/20590, которые тем самым в полном объеме включены в настоящее описание в качестве ссылки.
Детали и элементы ингалятора (аэрозольного распылителя) выполнены с учетом их функционального назначения из соответствующего материала. Так, в частности, корпус ингалятора, а также другие его детали, если это допустимо с точки зрения выполняемой ими функции, предпочтительно выполнены из пластмассы, например, литьем под давлением. В целом же для изготовления устройств, предназначенных для применения в медицинских целях, используют физиологически безвредные материалы.
На прилагаемых к настоящему описанию фиг.2а и 2б, которые идентичны фиг.6а и 6b заявки WO 97/12687, показан ингалятор (Respimat®), применение которого предпочтительно для ингаляции предлагаемых в изобретении распыляемых в виде аэрозоля составов на водной основе.
На фиг.2а ингалятор показан в продольном разрезе со сжатой (взведенной) пружиной, а на фиг.2б ингалятор показан в продольном разрезе с разжатой пружиной.
В верхней корпусной детали (51) размещен корпус (52) насоса, на конце которого (корпуса) расположен держатель (53) распылительной головки. В держателе находится распылительная головка (54) и фильтр (55). Закрепленный в ведомом фланце (56) стопорно-зажимного механизма полый поршень (57) частично выступает в цилиндр корпуса насоса. На одном из концов этого полого поршня расположен клапанный элемент (58). Полый поршень уплотнен уплотнением (59). Ведомый фланец имеет упор (60), которым ограничивается ход этого ведомого фланца внутри верхней корпусной детали при разжатой пружине. Ведомый фланец имеет также упор (61), ограничивающий ход этого ведомого фланца при сжатой пружине. После сжатия пружины стопор (62) смещается в промежуток между упором (61) и опорой (63) в верхней корпусной детали. Со стопором соединена спусковая кнопка (64). Верхняя корпусная деталь оканчивается мундштуком (65) и закрыта надеваемым на нее съемным защитным колпачком (66).
Корпусная деталь (67) вместе с размещенной в ней пружиной (68) сжатия закреплена на верхней корпусной детали с помощью фиксаторов-защелок (69) и смонтирована в поворотной опоре с возможностью поворота относительно этой верхней корпусной детали. На корпусную деталь для размещения пружины насажена нижняя корпусная деталь (70). Внутри корпусной детали для размещения пружины расположена сменная расходная емкость (71) (сменный баллончик), заполненная распыляемой жидкостью (72). Расходная емкость закрыта пробкой (73), сквозь которую проходит выступающий в расходную емкость полый поршень, погруженный одним из его концов в жидкость (в раствор действующего вещества или действующих веществ).
В боковую наружную стенку корпусной детали для размещения пружины встроен шпиндель (74) механического счетчика. На том конце этого шпинделя, который обращен к верхней корпусной детали, расположена приводная шестерня (75). На шпинделе установлен бегунок (76).
Описанный выше ингалятор может использоваться для распыления предлагаемых в изобретении составов в виде пригодного для ингаляции аэрозоля.
При использовании для распыления предлагаемого в изобретении препарата описанного выше устройства (Respimat®) порция композиции, выдаваемая по меньшей мере при 97%, предпочтительно по меньшей мере при 98%, всех циклов приведения ингалятора в действие (ходов поршня), должна соответствовать некоторому заданному количеству лекарственного препарата при допустимом отклонении от этого количества, равном максимум 25%, предпочтительно 20%. При этом такая заданная порция препарата, выдаваемая за один ход поршня, предпочтительно составляет от 5 до 30 мг, наиболее предпочтительно от 5 до 20 мг.
Для распыления предлагаемого в изобретении препарата можно, однако, использовать не только описанный выше ингалятор, но и ингаляторы иных типов, например струйные ингаляторы.
В соответствии с этим еще одним объектом настоящего изобретения являются лекарственные средства в виде описанных выше ингаляционных растворов или суспензий без пропеллента в сочетании с пригодным для их введения в организм устройством, предпочтительно в сочетании с ингалятором типа Respimat®. В этом отношении в предпочтительном варианте в настоящем изобретении предлагаются ингаляционные растворы или суспензии без пропеллента, отличающиеся тем, что в их состав входит предлагаемая в изобретении комбинация действующих веществ 1, 2 и 3 и что такие растворы предназначены для их распыления с помощью известного под названием Respimat® устройства. Настоящее изобретение относится далее к описанным выше устройствам для ингаляции, предпочтительно к устройству типа Respimat®, которые отличаются тем, что они содержат описанные выше предлагаемые в изобретении ингаляционные растворы или суспензии без пропеллента.
Предлагаемые в изобретении ингаляционные растворы или суспензии без пропеллента помимо рассмотренных выше, предусмотренных для применения в сочетании с устройством типа Respimat® растворов или суспензий могут быть также представлены в виде концентратов или стерильных, готовых к применению ингаляционных растворов, соответственно суспензий. Из подобных концентратов добавлением к ним, например, придающих изотоничность растворов поваренной соли можно получать готовые к применению препараты. Для введения в организм таких стерильных, готовых к применению препаратов могут использоваться работающие от источника энергии стационарные или портативные распылители, создающие ингалируемые аэрозоли с помощью ультразвука или сжатого воздуха на основе принципа Вентури или иного принципа.
В соответствии с этим еще одним объектом настоящего изобретения являются лекарственные средства в виде описанных выше ингаляционных растворов или суспензий без пропеллента, которые представлены в виде концентратов или стерильных, готовых к применению препаратов, в сочетании с пригодным для введения в организм таких растворов или суспензий устройством, отличающиеся тем, что подобным устройством является работающий от источника энергии стационарный или портативный распылитель, создающий ингалируемые аэрозоли с помощью ультразвука или сжатого воздуха на основе принципа Вентури или иного принципа.
Представленные ниже примеры, которые носят исключительно иллюстративный характер, служат для более подробного пояснения лежащих в основе настоящего изобретения принципов и не ограничивают его объем описанными ниже конкретными вариантами его осуществления.
Примеры композиций или препаратов
А) Ингаляционные порошки
| 1) |
|
| Компоненты |
Количество в мкг на капсулу |
| 1′-бромид |
100 |
| будесонид |
200 |
| салметеролксинафоат |
55,9 |
| лактоза |
4644,1 |
| Всего |
5000 |
| 2) |
|
| Компоненты |
Количество в мкг на капсулу |
| 1′-бромид |
75 |
| ксинафоат салметерола |
125 |
| флутиказонпропионат |
50 |
| лактоза |
4650 |
| Всего |
5000 |
| 3) |
|
| Компоненты |
Количество в мкг на капсулу |
| 1′-бромид |
75 |
| мометазонфуроат |
250 |
| дигидрат формотеролфумарата |
12 |
| лактоза |
4663 |
| Всего |
5000 |
| 4) |
|
| Компоненты |
Количество в мкг на капсулу |
| 1′-бромид |
100 |
| флутиказонпропионат |
250 |
| дигидрат формотеролфумарата |
12 |
| лактоза |
4638 |
| Всего |
5000 |
| 5) |
|
| Компоненты |
Количество в мкг на капсулу |
| 1′-бромид |
200 |
| дигидрат формотеролфумарата |
12 |
| флутиказонпропионат |
250 |
| лактоза |
24538 |
| Всего |
25000 |
| 6) |
|
| Компоненты |
Количество в мкг на капсулу |
| 1′-бромид |
75 |
| флутиказонпропионат |
125 |
| салметеролдифлунисал |
50 |
| лактоза |
24750 |
| Всего |
25000 |
Б) Ингаляционные аэрозоли с пропеллентом
1) Суспензия для получения аэрозоля:
| Компоненты |
Количество в мас.% |
| 1′-бромид |
0,035 |
| будесонид |
0,4 |
| дигидрат формотеролфумарата |
0,066 |
| соевый лецитин |
0,2 |
| TG134a/TG227 в соотнош. 2:3 |
до 100 |
2) Суспензия для получения аэрозоля:
| Компоненты |
Количество в мас.% |
| 1′-бромид |
0,039 |
| флутиказонпропионат |
0,3 |
| салметеролксинафоат |
0,033 |
| изопропилмиристат |
0,1 |
| TG227 |
до 100 |
3) Суспензия для получения аэрозоля:
| Компоненты |
Количество в мас.% |
| 1′-бромид |
0,039 |
| мометазонфуроат |
0,6 |
| салметеролдифлунисал |
0,066 |
| изопропилмиристат |
0,1 |
| TG227 |
до 100 |
4) Суспензия для получения аэрозоля:
| Компоненты |
Количество в мас.% |
| 1′-бромид |
0,035 |
| флутиказонпропионат |
0,3 |
| салметерол-4-фенилциннамат |
0,066 |
| соевый лецитин |
0,2 |
| TG11/TG12 в соотнош. 2:3 |
до 100 |
5) Суспензия для получения аэрозоля:
| Компоненты |
Количество в мас.% |
| 1′-бромид |
0,039 |
| салметеролксинафоат |
0,033 |
| будесонид |
0,4 |
| этанол, абсолютный |
0,5 |
| изопропилмиристат |
0,1 |
| TG227 |
до 100 |
Формула изобретения
1. Лекарственный состав для ингаляции, отличающийся тем, что он содержит антихолинергическое средство формулы 1
в которой X– обозначает однозарядный анион, а также кортикостероид (действующее вещество 2) и бетамиметик (действующее вещество 3), каждый в виде их энантиомеров, смесей энантиомеров или в виде рацематов.
2. Лекарственный состав по п.1, отличающийся тем, что X– обозначает однозарядный анион, выбранный из группы, включающей хлорид, бромид, иодид, сульфат, фосфат, метансульфонат, нитрат, малеат, ацетат, цитрат, фумарат, тартрат, оксалат, сукцинат, бензоат и n-толуолсульфонат.
3. Лекарственный состав по п.1 или 2, отличающийся тем, что действующие вещества 1, 2 и 3 присутствуют в виде их сольватов или гидратов.
4. Лекарственный состав по п.1 или 2, отличающийся тем, что действующие вещества 1, 2 и 3 присутствуют совместно с физиологически безвредным вспомогательным веществом.
5. Лекарственный состав по п.1 или 2, отличающийся тем, что действующие вещества 1, 2 и 3 присутствуют либо совместно в одной единственной лекарственной форме, либо в двух отдельных лекарственных формах, либо раздельно в трех отдельных лекарственных формах.
6. Лекарственный состав по п.1 или 2, отличающийся тем, что действующее вещество 1 выбрано из группы солей, в которых X– обозначает однозарядный анион, выбранный из группы, включающей хлорид, бромид, 4-толуолсульфонат и метансульфонат.
7. Лекарственный состав по пп.1 и 2, отличающийся тем, что действующее вещество 2 выбрано из группы, включающей флунисолид, беклометазон, триацинолон, будесонид, флутиказон, мометазон, циклесонид, рофлепонид, GW 215864, KSR 592, ST-126 и дексаметазон.
8. Лекарственный состав по п.7, отличающийся тем, что действующее вещество 2 выбрано из группы, включающей флунисолид, беклометазон, триацинолон, будесонид, флутиказон, мометазон, циклесонид и дексаметазон.
9. Лекарственный состав по пп.1 и 2, отличающийся тем, что действующее вещество 3 выбрано из группы, включающей бамбутерол, битолтерол, карбутерол, кленбутерол, фенотерол, формотерол, гексопреналин, ибутерол, пирбутерол, прокатерол, репротерол, салметерол, сульфонтерол, тербуталин, толубутерол, 4-гидрокси-7-[2-{[2-{[3-(2-фенилэтокси)пропил]сульфонил}этил]амино}этил]-2(3Н)-бензотиазолон, 1-(2-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[3-(4-метоксибензил-амино)-4-гидроксифенил]-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-N,N-диметиламинофенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-6ензоксазин-8-ил]-2-{4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламино}этанол, 5-гидрокси-8-(1-гидрокси-2-изопропиламинобутил)-2Н-1,4-бензоксазин-3-(4Н)-он, 1-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламино)этанол и 1-(4-этоксикарбониламино-3-циано-5-фторфенил)-2-трет-бутиламино)этанол.
10. Лекарственный состав по п.9, отличающийся тем, что действующее вещество 3 выбрано из группы, включающей формотерол, салметерол, 4-гидрокси-7-[2-{[2-{[3-(2-фенилэтокси)пропил]сульфонил}этил]амино}этил]-2(3Н)-бензотиазолон, 1-(2-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-N,N-диметиламинофенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол и 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-{4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламино}этанол.
11. Лекарственный состав по пп.1 и 2, отличающийся тем, что массовое соотношение между катионом действующего вещества 1‘ и действующим веществом 2 составляет от 1:250 до 250:1, предпочтительно от 1:150 до 150:1.
12. Лекарственный состав по пп.1 и 2, отличающийся тем, что массовое соотношение между действующим веществом 1 и действующим веществом 3 составляет от 1:300 до 30:1, предпочтительно от 1:230 до 20:1.
13. Лекарственный состав по пп.1 и 2, отличающийся тем, что разовая доза комбинации действующих веществ 1, 2 и 3 составляет от 1 до 10000 мкг, предпочтительно от 10 до 2000 мкг.
14. Лекарственный состав по пп.1 и 2, отличающийся тем, что он представлен в виде пригодной для ингаляции лекарственной формы.
15. Лекарственный состав по п.14, отличающийся тем, что лекарственная форма выбрана из группы, включающей ингаляционные порошки, дозированные аэрозоли с пропеллентом и ингаляционные растворы или суспензии без пропеллента.
16. Лекарственный состав по п.15, отличающийся тем, что он представляет собой ингаляционный порошок, содержащий действующие вещества 1, 2 и 3 в смеси с приемлемыми физиологически безвредными вспомогательными веществами, выбранными из группы, включающей моносахариды, дисахариды, олиго- и полисахариды, многоатомные спирты, соли и смеси таких вспомогательных веществ между собой.
17. Лекарственный состав по п.16, представляющий собой ингаляционный порошок с максимальным средним размером частиц вспомогательного вещества вплоть до 250 мкм, предпочтительно от 10 до 150 мкм.
18. Лекарственный состав по п.15, отличающийся тем, что он представляет собой ингаляционный порошок, который содержит в качестве его компонентов только действующие вещества 1, 2 и 3.
19. Лекарственный состав по п.15, отличающийся тем, что он представляет собой ингаляционный аэрозоль с пропеллентом, содержащий действующие вещества 1, 2 и 3 в растворенном или диспергированном виде.
20. Лекарственный состав по п.19, представляющий собой ингаляционный аэрозоль с пропеллентом, таким как углеводороды, в частности н-пропан, н-бутан или изобутан, или галогенированные углеводороды, такие как хлорированные и/или фторированные производные метана, этана, пропана, бутана, циклопропана или циклобутана.
21. Лекарственный состав по п.20, представляющий собой ингаляционный аэрозоль с пропеллентом, таким как TG134a, TG227 или их смесь.
22. Лекарственный состав по п.19, представляющий собой ингаляционный аэрозоль с пропеллентом, который необязательно содержит один или несколько других компонентов, выбранных из группы, включающей сорастворители, стабилизаторы, поверхностно-активные вещества, антиоксиданты, смазывающие вещества и средства для регулирования значения рН.
23. Лекарственный состав по п.19, представляющий собой ингаляционный аэрозоль с пропеллентом, в котором содержание действующего вещества 1, 2 и/или 3 может составлять вплоть до 5 мас.%.
24. Применение состава по пп.1 и 2 для получения медикамента, предназначенного для лечения воспалительных и/или обструктивных заболеваний дыхательных путей.
25. Применение состава по п.24 для получения медикамента, предназначенного для лечения астмы или хронического обструктивного заболевания легких.
РИСУНКИ
|
|