|
|
(21), (22) Заявка: 2006125847/15, 17.07.2006
(24) Дата начала отсчета срока действия патента:
17.07.2006
(43) Дата публикации заявки: 27.01.2008
(46) Опубликовано: 27.08.2008
(56) Список документов, цитированных в отчете о
поиске:
Регистр лекарственных средств России. Энциклопедия лекарств, 2005, В.12. – М.: ООО РЛС-2005, с.994. Лазарева Е.Б., Меньшиков Д.Д. Опыт и перспективы использования пектинов в лечебной практике. Антибиотики и химиотерапия, 1999, том 44, вып.2, с.37-40. RU 2182483, 20.05.2002. RU 2076716, 10.04.1997. RU 2195937, 06.02.2002. RU 2247561, 10.03.2005. EP 650728, 03.05.1995.
Адрес для переписки:
357532, Ставропольский край, г. Пятигорск, пр. Калинина, 11, Пятигорская государственная фармацевтическая академия
|
(72) Автор(ы):
Овчаренко Людмила Петровна (RU),
Компанцева Евгения Владимировна (RU),
Кузнецова Людмила Степановна (RU),
Ушакова Вера Алексеевна (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Пятигорская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию” (ГОУ ВПО Пятигорская ГФА Росздрава) (RU)
|
(54) ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, ОБЛАДАЮЩИЙ ПРОТИВОТУБЕРКУЛЕЗНОЙ АКТИВНОСТЬЮ
(57) Реферат:
Изобретение относится к химико-фармацевтической промышленности и медицины и касается фармацевтического состава, обладающего противотуберкулезной активностью и пригодного для лечения туберкулеза. Состав обладает туберкулостатической активностью по отношению к изониазид-устойчивым М.tuberculosis, а также усиливает специфическое фармакологическое действие изониазида и этамбутола гидрохлорида за счет синергизма. Состав выполнен в виде гранул, содержащих компоненты в следующих количествах в граммах: изониазид 0,3000, этамбутол гидрохлорид 0,3000, пектин 0,3000. Состав обладает высокой туберкулостатической активностью, гораздо более низкой токсичностью и уменьшенными побочными эффектами входящих в него ингредиентов: изониазида и этамбутола гидрохлорида. 1 з.п. ф-лы, 4 табл.
Изобретение относится к области медицины и касается фармацевтического состава, обладающего противотуберкулезной активностью, и пригодно для лечения туберкулеза.
Повсеместное ухудшение экологической обстановки и снижение социального благосостояния населения в России привело в последние 10-15 лет к росту заболеваемости туберкулезом, которая в отдельных районах начинает принимать характер эпидемии.
Основными химиотерапевтическими средствами для лечения различных форм туберкулеза являются производные изоникотиновой кислоты, прежде всего изониазид, а также лекарственные препараты, различные по химической структуре и механизмам действия, например этамбутола гидрохлорид, обладающий высокой противотуберкулезной активностью (Справочник. Видаль. Лекарственные препараты в России. Изд. 12-е переработанное, исправленное и дополненное. Астра Фарм Сервис, 2006 г. стр.1497, 1554). Изониазид по своей бактериостатической активности до сих пор остается основным препаратом для лечения туберкулеза. Однако в настоящее время отмечается, что особенностью лечения туберкулеза является лекарственная устойчивость M.tuberculita. В этом случае назначают одновременный прием нескольких туберкулостатических лекарственных средств различных химических групп и механизмов действия. Для обеспечения комфортности лечения больных целесообразно создание комплексных лекарственных средств.
Для достижения стойкого лечебного эффекта основной курс химиотерапии при различных формах туберкулеза длителен и составляет от 6 до 12 месяцев; профилактические курсы проводят 2 раза в год, и их продолжительность составляет 2-3 месяца (А.А.Визель, М.Э.Гурылева. Туберкулез. М., Медицина, 1999, стр.131-140). При пероральном приеме в виде таблеток и капсул в организм наравне с лекарственным веществом поступает значительное количество вспомогательных веществ, не всегда индифферентных, а иногда и токсичных для человека, например тальк, который вызывает раздражение слизистой желудочно-кишечного тракта.
Прототипами изобретения являются таблетки изониазида и таблетки этамбутола гидрохлорида (Справочник. Видаль. Лекарственные препараты в России. Изд. 12-е переработанное, исправленное и дополненное. Астра Фарм Сервис, 2006 г. стр.1497, 1554), а также комбинированный лекарственный препарат: таблетки, содержащие 0,15 г изониазида и 0,4 г этамбутола гидрохлорида – «Фтизоэтам» (Регистр лекарственных средств России. Энциклопедия лекарств, 2005, В.12, Инфармхим., М., ООО «РЛС-2005», стр.994). Этот лекарственный препарат применяется для лечения туберкулеза. Недостатком его является высокая токсичность, быстрое выведение из организма, высокие дозы лекарственных веществ, входящих в состав препаратов, большое количество вспомогательных веществ.
Для создания стабильной, удовлетворяющей фармакопейным требованиям твердой лекарственной формы необходимо использовать вспомогательные вещества, индифферентные для организма, в количествах, определяемых фармацевтической и терапевтической целесообразностью.
Задачей данного изобретения является создание комбинированного фармацевтического состава для лечения туберкулеза, удовлетворяющего всем требованиям к фармацевтическим средствам и устойчивого в течение достаточно длительного времени (не менее 2-х лет), который можно будет производить в условиях отечественной фармацевтической промышленности.
Обеспечение оптимальных биофармацевтических свойств ингредиентов лекарственного препарата изониазида и этамбутола гидрохлорида может быть достигнуто путем введения в качестве вспомогательного вещества пектина, который обеспечит пролонгирование действия лекарственных веществ и понизит гепатотоксичность изониазида (Л.А.Саджая. Биохимическое обоснование путей снижения гепатотоксичности изониазида на основе сочетания с полисахаридами. Дис. канд. фармац. наук. – Пятигорск, 1999. – 120 с.).
В заявляемый состав входят в качестве действующих веществ изониазид и этамбутола гидрохлорид и вспомогательные вещества, взятые в количестве от 40 до 50% от массы действующих веществ. Фармацевтический состав выполнен в виде гранул. Состав соответствует требованиям на фармацевтические средства и обладает повышенной стабильностью при хранении.
Техническим заданием предлагаемого изобретения является создание комплексного состава, обладающего туберкулостатической активностью по отношению к изониазид-устойчивым M.tuberculosis, a также усиливающим специфическое фармакологическое действие изониазида и этамбутола гидрохлорида за счет синергизма. Задание решено с помощью следующего состава гранул в граммах:
| Изониазида |
0,3000 |
| Этамбутола гидрохлорида |
0,3000 |
| Пектина |
0,3000 |
| Спирта этилового 70% |
0,396 |
Пример 1.
Приготовление гранул осуществляется методом влажного гранулирования.
Изониазид и этамбутола гидрохлорид предварительно высушивают в термостате при температуре 60°С до остаточной влажности 2-3%. Взвешенное сырье (количества изониазида 0,75 кг и этамбутола гидрохлорида 0,75 кг) предварительно измельчали в барабане шаровой мельницы вместе с шарами при оптимальной скорости в течение 5-8 минут. Измельченные продукты просеивали через сито-капрон №38 с диаметром отверстия 0,16±0,025 мм.
Для приготовления увлажнителя на весах отвешивали 0,655 кг спирта этилового и 0,335 кг воды и помещали их в емкость для приготовления увлажнителя. 0,75 кг пектина предварительно просеивали через сито №2. В смеситель с зеттаобразными лопастями загружали пектин, этамбутола гидрохлорид и изониазид и перемешивали 5-8 минут. Затем из емкости для приготовления увлажнителя частями добавляли увлажнитель при постоянном перемешивании. Однородность и увлажненность массы контролировали визуально.
Масса с оптимальной влажностью представляет собой влажную, компактную смесь, не прилипающую к руке, но рассыпающуюся при сдавливании на отдельные комочки. Далее осуществляли влажное гранулирование в грануляторе методом продавливания через сетку с диаметром отверстия 4 мм. Гранулят выгружали в лотки из нержавеющей стали тонким слоем 1-2 см. Сушку гранул производили в вакуум-сушильном шкафу при периодическом перемешивании при температуре 30-40°С и вакууме 0,7-0,8 кгс/см2. Продолжительность сушки 30 минут до остаточной влажности 2,5-3,0%.
Затем проводили сухое гранулирование на универсальном грануляторе через сетку с диаметром отверстий 2 мм.
Гранулы представляли собой светло-желтые частички неправильной формы, обладающие необходимой механической прочностью, масса полученных гранул составляла 2,14 кг.
Установление сроков годности гранул проводили методом «ускоренного старения» в двух температурных режимах при 40 и 60°С, а также в естественных условиях («Инструкция по проведению работ с целью определения сроков годности лекарственных средств на основе метода «ускоренного старения» при повышенной температуре И 42-2-82»). В качестве опытных образцов использовали 3 серии гранул, таблетки этамбутола гидрохлорида и таблетки изониазида, таблетки «Фтизоэтама». О стабильности ингредиентов заявляемого фармацевтического состава и прототипов судили по содержанию посторонних примесей и количественному содержанию лекарственных веществ в испытуемых образцах. Контроль качества проводили через равные промежутки времени, эквивалентные 6 месяцам хранения. Для гранул срок хранения составил три года, для таблеток изониазида – три года, для таблеток этамбутола гидрохлорида – два года и восемь месяцев, для таблеток «Фтизоэтама» – два года и пять месяцев.
Для изучения специфической антимикробной активности гранул, содержащих этамбутола гидрохлорид и изониазид по отношению к изониазид-резистенным штаммам M.tuberculosis, использовали метод абсолютных концентраций на среде Левенштейна-Йенсена (приказ МЗ РФ №109 от 21.03.2003 г). Опыты проводили на трех сериях гранул в трехкратной повторности. Определение проводили на 10-ти штаммах M.tuberculosis, выделенных от больных.
Результаты представлены в табл.1.
Из данных, представленных в табл.1, следует, что по отношению к изониазид-чувствительным штаммам 4273 и 3946 проявляют активность все образцы патентуемого фармацевтического состава в виде гранул. Показано, что таблетки этамбутола гидрохлорида подавляют рост четырех штаммов микобактерий туберкулеза. Изониазид-резистентные штаммы 4251 и 3860 чувствительны к этамбутола гидрохлориду. Предлагаемый фармацевтический состав, содержащий оба противотуберкулезных лекарственных вещества, подавляет рост 8 штаммов микобактерий. Подавление роста штаммов 4251 и 3860 обусловлено присутствием этамбутола гидрохлорида в фармацевтическом составе. Чувствительность штаммов 3951, 3974, 3850 и 4167 обусловлена совместным действием изониазида и этамбутола гидрохлорида. Патентуемый фармацевтический состав в виде гранул активнее прототипов изониазида и этамбутола гидрохлорида. Следовательно, можно предложить взаимное синергическое влияние ингредиентов фармацевтического состава.
Определение острой токсичности гранул изониазида и этамбутола гидрохлорида и прототипов (таблеток изониазида и таблеток этамбутола гидрохлорида) проводили на белых беспородных мышах обоего пола массой 18±2 г. Первой группе животных перорально вводили суспензию таблеток изониазида, диспергированных в 0,9% растворе натрия хлорида; второй группе – суспензию таблеток этамбутола гидрохлорида в 0,9% растворе натрия хлорида; третьей – суспензию таблеток «Фтизоэтама» в 0,9% растворе натрия хлорида, четвертой – суспензию патентуемого фармацевтического состава гранул изониазида с этамбутола гидрохлоридом. Наблюдение за поведением и состоянием животных проводили в течение 10 дней. Далее рассчитывали величину ЛД50 по методике Беренса (М.Л.Беленький. Элементы количественного учета фармакологического эффекта. СПб.: Мед. лит., 1963. – 250 с.). Результаты эксперимента представлены в табл.2.
Анализ полученных данных свидетельствует о том, что токсичность изониазида с этамбутола гидрохлоридом, введенных животным в виде гранул патентуемого фармацевтического состава, ниже в 2,1 раза по сравнению с токсичностью прототипов, а именно изониазида и этамбутола гидрохлорида в таблетках, а также в 2 раза ниже по сравнению с токсичностью таблеток «Фтизоэтама».
Для объективной оценки биодоступности и фармакологического действия предлагаемого фармацевтического состава в соответствии с требованиями «Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ» (Москва, 2000. МЗ РФ, 680 с.) Было проведено сравнительное изучение фармакокинетики гранул изониазида и этамбутола гидрохлорида и прототипов (таблеток изониазида и таблеток этамбутола гидрохлорида). Определение проводили на белых крысах обоего пола с массой тела 200-300 г. Перед опытом животных не кормили в течение суток. Испытуемые вещества вводили перорально в виде суспензии в 0,9% растворе натрия хлорида, в дозах 40 мг/кг таблеток изониазида в пересчете на изониазид (первая группа), 40 мг/кг таблеток этамбутола гидрохлорида в пересчете на действующее вещество (вторая группа), 147 мг/кг таблеток «Фтизоэтама», содержащих по 40 мг/кг изониазида и этамбутола гидрохлорида (третья группа), 120 мг/кг гранул, содержащих по 40 мг/кг изониазида и этамбутола гидрохлорида (четвертая группа). Через 0,5; 1; 2; 3; 6; 9; 12; 24 часов после введения животных декапитировали, кровь собирали, центрифугировали и в полученной сыворотке определяли содержание изониазида и этамбутола гидрохлорида. Количество изониазида определяли методом высокоэффективной жидкостной хроматографии. Содержание этамбутола гидрохлорида определяли методом экстракционной фотометрии по реакции с бромкрезоловым зеленым. В табл.3 представлены результаты количественного определения содержания изониазида и этамбутола гидрохлорида в крови крыс (средние результаты из шести параллельных определений).
По полученным данным построили фармакокинетические кривые и рассчитали следующие фармакокинетические характеристики: кажущийся объем распределения (V, мл), константа элиминации (Kel, ч-1), общий клиренс (Cl, мл/ч), период полувыведения (Т1/2, ч), площадь под фармакокинетической кривой (AUC , мг·ч/мл), относительная биологическая доступность. Расчеты проводили по формулам, приведенным в литературе (Соколов В.И., Фирсов А.А.. Филов В.А. Фармакокинетика. – М.: Медицина, 1980. – 422 с.). Результаты представлены в табл.4. Анализ полученных данных свидетельствует о том, что из гранул в системном кровотоке как изониазид, так и этамбутол находятся в бактериостатической концентрации на 19 и 12 часов дольше, чем прототипы (соответственно). , мг·ч/мл), относительная биологическая доступность. Расчеты проводили по формулам, приведенным в литературе (Соколов В.И., Фирсов А.А.. Филов В.А. Фармакокинетика. – М.: Медицина, 1980. – 422 с.). Результаты представлены в табл.4. Анализ полученных данных свидетельствует о том, что из гранул в системном кровотоке как изониазид, так и этамбутол находятся в бактериостатической концентрации на 19 и 12 часов дольше, чем прототипы (соответственно).
Константы элиминации изониазида и этамбутола из гранул в 4,75; 3,75; 2,6 и 2,0 раза меньше, чем у прототипов (соответственно). Период полувыведения изониазида и этамбутола гидрохлорида из гранул в 45,75; 2,44 (изониазид из таблеток изониазида и «Фтизоэтама») и 3,8; 1,57 (этамбутола гидрохлорид из таблеток этамбутола и «Фтизоэтама») раза больше, чем прототипов (соответственно). Следовательно, заявляемый фармацевтический состав обеспечивает пролонгированное нахождение изониазида и этамбутола в крови.
Увеличение площадей под фармакокинетическими кривыми изониазида и этамбутола гидрохлорида в гранулах в 5,3 и 1,6 раза (соответственно) по сравнению с прототипами может свидетельствовать о повышении терапевтической эффективности как изониазида, так и этамбутола гидрохлорида в заявляемом фармацевтическом составе.
Применение предлагаемого фармацевтического состава, обладающего высокой туберкулостатической активностью, позволит уменьшить токсичность, а следовательно, и побочные эффекты входящих в него ингредиентов: изониазида и этамбутола гидрохлорида. Кроме того, применение предлагаемого фармацевтического состава обеспечит пролонгирование действия изониазида и этамбутола гидрохлорида в организме.
Таблица 1
Сравнительная оценка антимикробной активности таблеток изониазида, таблеток этамбутола гидрохлорида, таблеток «Фтизоэтам», гранул изониазида с этамбутола гидрохлоридом |
| Номер штамма |
Определяемое вещество, концентрация |
Контроль |
| Таблетки изониазида, 1 мкг/мл |
Таблетки этамбутола, гидрохлорида 1 мкг/мл |
Таблетки «Фтизоэтам», 1 мкг/мл |
Гранулы изониазида, 1 мкг/мл, этамбутола гидрохлорида, 1 мкг/мл |
| 4273 |
– |
– |
– |
– |
+ |
| 3946 |
– |
– |
– |
– |
+ |
| 3951 |
+ |
+ |
+ |
– |
+ |
| 4251 |
+ |
– |
+ |
– |
+ |
| 4106 |
+ |
+ |
+ |
+ |
+ |
| 3860 |
+ |
– |
+ |
– |
+ |
| 3974 |
+ |
+ |
– |
– |
+ |
| 3850 |
+ |
+ |
– |
– |
+ |
| 4167 |
+ |
+ |
+ |
– |
+ |
| 4054 |
+ |
+ |
+ |
+ |
+ |
«-» – отсутствие роста свидетельствует о чувствительности к лекарственному препарату;
«+» – роста на среде свидетельствует об устойчивости к лекарственному препарату. |
Таблица 2
Определение острой токсичности известных прототипов (изониазида в таблетках, этамбутола гидрохлорида в таблетках, таблеток «Фтизоэтам») и предлагаемого фармацевтического состава в виде гранул изониазида и этамбутола гидрохлорида |
| Дозы мг/кг* |
Число павших/Число выживших |
Накопительные частоты |
Смертность, в % |
|
| Таблетки изониазида |
| 300 |
0/10 |
0/20 |
– |
d=50 |
| 350 |
6/4 |
6/10 |
37,5 |
A=350 мг/кг |
| 400 |
8/2 |
14/6 |
70,0 |
В=400 мг/кг |
| 450 |
8/2 |
22/4 |
– |
а-37,5% |
| 500 |
8/2 |
30/2 |
– |
b=70,0% |
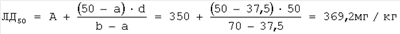 |
| Таблетки этамбутола гидрохлорида |
| 3000 |
0/10 |
|
0 |
|
| 4000 |
0/10 |
|
0 |
|
| 5000 |
0/10 |
|
0 |
|
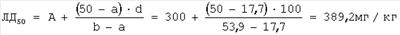 |
| Таблетки «Фтизоэтам» |
| 362 |
3/7 |
6/14 |
– |
d=40 |
| 385 |
6/4 |
12/8 |
39,1 |
A=385 мг/кг |
| 400 |
8/2 |
14/6 |
70,2 |
В=400 мг/кг |
| |
|
|
|
а=39,1% |
| |
|
|
|
b=70,2% |
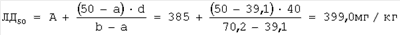 |
| Гранулы изониазида 0,15 и этамбутола гидрохлорида 0,15 |
| 725 |
2/8 |
2/16 |
– |
d=40 |
| 767 |
4/6 |
6/8 |
42,9 |
А=767 мг/кг |
| 800 |
8/2 |
14/2 |
87,5 |
В=800 мг/кг |
| |
|
|
|
а=42,9% |
| |
|
|
|
b=87,5% |
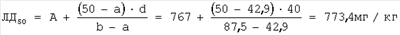 |
| * – в таблице приведены дозы лекарственных препаратов в пересчете на действующее вещество |
Таблица 3
Результаты определения содержания лекарственных веществ в крови крыс |
| Определяемое лекарственное вещество |
Содержание действующих веществ в крови (мкг/кг) через, (час) |
| 0,5 |
1 |
2 |
3 |
6 |
9 |
12 |
24 |
| Изониазид в таблетках |
190,4±0,17 |
139,7±0,14 |
121,7±0,19 |
109,5±0,23 |
0,60±0,05 |
– |
– |
– |
| Этамбутола гидрохлорид в таблетках |
81,5±0,66 |
130,5±0,53 |
140,92±0,68 |
154,1±0,40 |
128,0±0,62 |
116,6±0,51 |
38,4±0,56 |
– |
| Изониазид в таблетках «Фтизоэтам» |
120,3±0,15 |
140,8±0,10 |
110,8±0,20 |
85,9±0,90 |
0,52±0,14 |
– |
– |
– |
| Этамбутола гидрохлорид в таблетках «Фтизоэтам» |
70,8±0,30 |
110,2±0,14 |
135,9±0,40 |
120,4±0,53 |
108,0±0,70 |
80,9±0,45 |
44,5±0,30 |
– |
| Изониазид в гранулах |
100,8±0,28 |
123,7±0,30 |
156,1±0,41 |
131,3±0,32 |
114,2±0,29 |
80,6±0,17 |
66,7±0,14 |
1,78±0,21 |
| Этамбутола гидрохлорид в гранулах |
75,4±0,49 |
88,3±0,65 |
109,4±0,69 |
118,9±0,37 |
124,7±0,66 |
130,9±0,51 |
77,5±0,32 |
58,1±0,54 |
Таблица 4
Фармакокинетические характеристики лекарственных веществ после однократного перорального введения |
| Определяемое лекарственное вещество |
Фармакокинетические параметры |
| V, мл |
Kel, ч-1 |
Cl, мл/ч |
Т1/2, ч |
AUC , мг·ч/мл , мг·ч/мл |
F, % |
| Изониазид в таблетках |
637,5 |
0,95 |
605,6 |
0,73 |
38,86 |
100,0 |
| Изониазид в таблетках «Фтизоэтам» |
630,9 |
0,75 |
428,8 |
1,42 |
88,52 |
102,0 |
| Изониазид в гранулах |
628,4 |
0,20 |
125,7 |
3,47 |
206,10 |
105,0 |
| Этамбутола гидрохлорид в таблетках |
254,0 |
0,13 |
33,02 |
5,33 |
91,12 |
100,0 |
| Этамбутола гидрохлорид в таблетках «Фтизоэтам» |
390,4 |
0,10 |
29,7 |
12,8 |
105,14 |
101,4 |
| Этамбутола гидрохлорид в гранулах |
402,4 |
0,05 |
18,27 |
20,12 |
146,45 |
104,6 |
Формула изобретения
1. Комбинированный фармацевтический состав, содержащий в качестве действующих веществ противотуберкулезные средства изониазид и этамбутола гидрохлорид, отличающийся тем, что вспомогательным веществом является пектин, снижающий токсичность композиции, и обеспечивает пролонгированный эффект лекарственных веществ, входящих в него в следующих соотношениях, г:
| Изониазида |
0,30 |
| Этамбутола гидрохлорида |
0,30 |
| Пектина |
0,30 |
2. Комбинированный фармацевтический состав, обладающий противотуберкулезной активностью, по п.1, отличающийся тем, что представляет собой гранулы.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 18.07.2008
Извещение опубликовано: 10.07.2010 БИ: 19/2010
|
|