|
(21), (22) Заявка: 2006140359/28, 15.11.2006
(24) Дата начала отсчета срока действия патента:
15.11.2006
(46) Опубликовано: 20.08.2008
(56) Список документов, цитированных в отчете о
поиске:
SU 1422076 A1, 30.12.1985. SU 1408340 A1, 17.11.1986. US 2003221961 A, 04.12.2003. DE 200318295 U1, 19.02.2004. GB 2273780 A, 29.06.1994. US 4931172 A, 05.06.1990.
Адрес для переписки:
644099, Омск-99, а/я 91, ООО “Патентное агентство”, пат.пов. Т.А.Шишуриной, рег. №551
|
(72) Автор(ы):
Карелин Владимир Александрович (RU),
Микуцкая Елена Николаевна (RU)
(73) Патентообладатель(и):
Карелин Владимир Александрович (RU),
Микуцкая Елена Николаевна (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ФТОРИД-ИОНОВ В ВОДЕ (ВАРИАНТЫ)
(57) Реферат:
Изобретение относится к потенциометрическим методам определения концентрации фторид-ионов в водной среде. Для измерений используют фторидный ионоселективный электрод с твердой мембраной из трифторида лантана. Измерения осуществляют в растворах с добавкой фонового электролита, в качестве которого используют или 0,01 N раствор химически чистой азотной кислоты, при этом рН измеряемой водной среды поддерживают в пределах 2,0±0,1 ед., или 0,01 N раствор химически чистой уксусной кислоты с добавкой комплексообразователя – 0,01 N раствора динатриевой соли этилендиамин тетрауксусной кислоты (Трилона Б) и поддержанием рН измеряемой водной среды в пределах 3,4±0,1 ед. Оба состава фонового электролита позволяют получить высокие метрологические характеристики фторидселективного электрода в области низких концентраций, что обеспечивает возможность измерения низких концентраций фторид-ионов. Последнее позволяет применить способ для контроля глубокообессоленных вод атомных, тепловых электростанций и установок электронной техники, характеризующихся низким содержанием фторид-ионов. 2 н. и 4 з.п. ф-лы, 8 ил.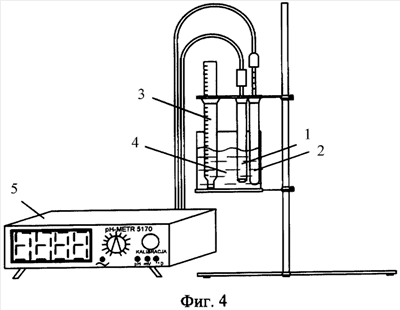
Область техники, к которой относится изобретение
Заявляемое изобретение относится к области физико-химического анализа, конкретнее к потенциометрическим методам определения концентрации фторид-ионов в водной среде, преимущественно в глубокообессоленных водах атомных, тепловых электростанций и установок электронной техники.
Уровень техники
В связи с развитием атомной и тепловой энергетики в последнее время все большее значение приобретают вопросы надежности, экономичности и безаварийности работы оборудования электростанций и ядерных энергетических установок, что в значительной мере обеспечивается применяемым водно-химическим режимом, конкретнее чистотой используемой воды. Для снижения коррозии оборудования необходимо минимизировать в теплоносителе содержание ионов, оказывающих наибольшее коррозионное воздействие, прежде всего хлорид- и фторид-ионов. В требованиях, предъявляемых к водному теплоносителю тепловых и атомных электростанций, строго регламентируется содержание хлорид- и фторид-ионов, например в питательной воде и обессоленном конденсате ядерных реакторов суммарное содержание хлорид- и фторид-ионов не должно превышать 4,0 и 10,0 мкг/дм3 соответственно. Однако в настоящее время известные методы контроля качества вод позволяют определить только микроконцентрацию хлорид-ионов. Известные же на сегодняшний момент методы определения содержания фторид-ионов характеризуются недостаточной чувствительностью, большими погрешностями измерений или отсутствием возможности непрерывного измерения концентрации примесей в протоке.
Известен гравиметрический метод, основанный на осаждении фторид-ионов в виде осадка в результате соответствующей реакции с известным веществом. Метод трудоемок и длителен из-за множества выполняемых операций: осаждение, отмывка осадка, прокаливание, взвешивание, вследствие чего не позволяет производить оперативный контроль технологических процессов. Чувствительность метода определяется растворимостью весовой формы осадка, содержащего фторид-ионы. Лучшей растворимостью характеризуется осадок в виде фторида кальция (CaF2), однако даже он не позволяет определить концентрации F–-ионов ниже 16 мг/дм3.
Известен комплексонометрический метод определения концентрации фторид-ионов. Метод характеризуется проведением подготовительных операций по концентрированию фтора из-за его низкого содержания в единичных пробах, что резко увеличивает время проведения анализа и приводит к значительному повышению систематической и случайной погрешности определения концентрации примесей, значения которых могут достигать 200-500% [см. Аналитическая химия элементов. Фтор. – М.: Наука, 1970].
Известны объемные (титриметрические) методы, основанные на связывании фторид-ионов с металлами в виде слабоионизированных соединений. Конечная точка титрования – исчезновение фторид-ионов в исследуемом растворе, фиксируется возникновением окрашенного лака или изменением кислотности раствора. Ошибка метода при макроанализах составляет ±0,5%, а для микроанализов (для 5-0,05 мг F–) – 10-20%, что позволяет его применять только в качестве арбитражного.
Наиболее перспективным и практически применимым для контроля вод высокой чистоты является потенциометрический метод, основанный на зависимости потенциала ионоселективного электрода от концентрации определяемого вещества (см. Васильев. Аналитическая химия. 4.2, М.: Высшая школа, 1989 г., с.188-206). Его преимущества перед другими методами: простота, оперативность, не требуется приготовления большого количества реактивов, отсутствие субъективной ошибки, т.к. показания снимают приборы. Все это позволяет использовать упомянутый метод как в лабораторных условиях, так и в непрерывном автоматическом варианте.
Для определения фторид-ионов используют фторидселективный электрод с твердой мембраной в виде диска из монокристаллического фтористого лантана (LaF3). Упомянутый электрод характеризуется высокой селективностью по отношению к фтору и низким пределом обнаружения, вследствие чего получил широкое применение для определения фтора в различных объектах, в том числе и в воде.
Известен выпускаемый отечественной промышленностью фторидселективный электрод с твердой мембраной из LaF3 типа ИСЭ-F-01, Ленинградского государственного университета под руководством академика Б.П.Никольского. Среди его зарубежных аналогов известны электроды: Orion 94-09A, Beckman 39600, Metrohm EA306F, Activion 003-15-008, Leeds and Northrup 117405, Tacussel PF4, Coleman 3-803 и др. Электрод фирмы Orion имеет мембрану, кристалл которой легирован фтористым европием EuF2 для уменьшения электросопротивления мембраны.
Высокая избирательность вышеупомянутых электродов позволяет определять даже малые концентрации фторид-ионов в большом количестве различных примесей, за исключением гидрооксид-ионов (ОН-ионов), наличие которых значительно ухудшает работу упомянутых электродов. Для точного определения концентраций фторидселективные электроды можно использовать только в некотором заданном диапазоне рН, ширина которого зависит от концентрации фторид-ионов, при этом ионная сила анализируемых проб должна быть одинаковой. Для выполнения упомянутых условий, т.е. для поддержания постоянного значения ионной силы, коэффициентов активности ионов и постоянного значения рН измеряемой среды, в исследуемые и стандартные растворы добавляют фоновый электролит.
Известен способ определения фторид-иона в питьевой воде (см. кн. Дорохова Е.И. Аналитическая химия: физико-химические методы анализа. М.: Высшая школа, 1991 г., с.237-238) методом прямой потенциометрии с помощью фторидселективного электрода с мембраной из монокристалла трифторида лантана. Определение концентрации осуществляют по градуировочному графику зависимости концентрации от ЭДС, построенному по стандартным растворам NaF. Для поддержания постоянной ионной силы, т.е. в качестве фонового электролита, используют раствор нитрата калия KNO3. Измерения проводят в статических условиях в электрохимической ячейке, включающей емкость с раствором, в который погружены фторидселективный электрод и электрод сравнения. Способ не отличается высокой чувствительностью электродов в диапазоне низких концентраций (менее 10 мкг/л), однако для питьевой воды этого не требуется.
В качестве прототипа для обоих заявляемых вариантов способа выбран способ определения концентрации фторид-ионов посредством лантанфторидного ионселективного электрода в паспортных условиях фонового электролита TISAB (1 моль/дм3 хлорида натрия, 0,001 моль/дм цитрата натрия, 0,25 моль/дм3 уксусной кислоты, 0,75 моль/дм3 ацетата натрия), при поддержании оптимальной величины рН измеряемой водной среды в пределах 5,0-5,5 ед. Ионная сила буфера TISAB равна 1,75 моль/дм3. Измерения производили в статических условиях измерительной ячейки прямым потенциометрическим методом, заключающимся в измерении разности потенциалов лантанфторидного ионселективного электрода и электрода сравнения. Концентрацию определяли по калибровочному графику. Предел обнаружения фторид-ионов составил 19 мкг/дм3.
Упомянутый способ был также применен в известном анализаторе фторида в питьевой воде фирмы LANGE (источник: Рекламный буклет, представленный на страницах Интернета: Яндекс/фторида>промышленные анализаторы НАСН>Экоинструмент). В известном анализаторе измерения осуществляются в динамических условиях, т.е. в потоке образца дифференциальным потенциометрическим методом с использованием двух лантанфторидных ионоселективных электродов. Предел обнаружения фторид-ионов составляет 0.05 мг/л (=50 мкг/дм3).
Основным недостатком прототипа является низкая чувствительность измерительного фторидселективного электрода в паспортных условиях упомянутого фонового электролита TISAB, который позволяет получить линейную теоретическую зависимость концентрации от ЭДС только в диапазоне от 1·10-6 до 1·10-3 моль/дм3 (т.е. от 19 мкг/дм3 до 19 мг/дм3), что не позволяет определить концентрацию фторид-ионов ниже 1·10-6 моль/дм3 (т.е. менее 19 мкг/дм3).
Таким образом, известный способ не может быть использован для определения микроконцентраций фторид-ионов в глубокообессоленных водах.
Раскрытие изобретения
Задачей, на решение которой направлено заявляемое изобретение, является повышение чувствительности способа, что позволило бы использовать его для контроля чистоты водного теплоносителя тепловых и атомных электростанций.
Поставленная задача решена тем, что в способе определения концентрации фторид-ионов в воде дифференциальным потенциометрическим методом с использованием двух лантанфторидных ионоселективных электродов, включающем построение градуировочных зависимостей по стандартным растворам и использование фонового электролита в качестве добавки ко всем стандартным и анализируемым растворам, в которых осуществляют измерения, согласно заявляемому изобретению в качестве фонового электролита используют 0,01 N* раствор химически чистой азотной кислоты, при этом рН анализируемой водной среды поддерживают в пределах 2,0±0,1 ед.
Поставленная задача решена также тем, что в способе определения концентрации фторид-ионов в воде прямым или дифференциальным потенциометрическим методом с использованием лантанфторидных ионоселективных электродов и электрода сравнения, включающем построение градуировочных зависимостей по стандартным растворам и использование фонового электролита в качестве добавки ко всем стандартным и анализируемым растворам, в которых осуществляют измерения, согласно заявляемому изобретению в качестве фонового электролита используют 0,01 N* раствор химически чистой уксусной кислоты с добавкой комплексообразователя – 0,01 N* раствора динатриевой соли этилендиамин тетрауксусной кислоты (Трилона Б) 0,01 N раствор – это 0,01 грамм-эквивалент вещества в 1 литре раствора, при этом рН анализируемой водной среды поддерживают в пределах 3,4±0,1 ед.
Новый состав фонового электролита в каждом из заявляемых вариантов способа, обеспечивает высокие (лучшие) метрологические характеристики лантанфторидного ионоселективного электрода в диапазоне низких концентраций 2-20 мкг/дм3, что позволяет получить новый технический результат, а именно позволяет, по сравнению с прототипом, расширить диапазон измеряемых концентраций на порядок величины (с 20,0 до 2,0 мкг/дм3) и проводить высокоточные измерения в упомянутом диапазоне низких концентраций фторид-ионов. Последнее, в свою очередь, делает возможным применение заявляемого способа для контроля чистоты глубокообессоленных вод и конденсата.
Были проведены экспериментальные и теоретические исследования характеристик лантанфторидного ионоселективного электрода в различных фоновых электролитах.
В качестве последних использовали кислые растворы различных кислот.
В таблице 1 (см. фиг.1) приведены для сравнения наилучшие градуировочные характеристики фторидселективного электрода, полученные в растворах сильных кислот: соляной и азотной.
В таблице 2 (см. фиг.2) приведены для сравнения наилучшие градуировочные характеристики фторидселективного электрода, полученные в растворах относительно слабых уксусной и лимонной кислот.
Исследования в обоих случаях производили для водных растворов с концентрациями фторид-ионов от 100 до 2 мкг/дм3. В качестве сравнительных характеристик в таблицах приведены значения квадратического отклонения (в %), характеризующего точность измерений, и градиент (в мВ), показывающий возможность проведения измерения определяемого вещества (т.е. фторид-иона).
Как видно из таблицы 1 (см. фиг.1), при использовании фонового электролита в виде раствора 0,01 N азотной кислоты фторидселективный электрод имеет значительно больший градиент, чем при использовании соляной кислоты (суммарное значение градиента 71 мВ и 55 мВ соответственно), при сравнительно одинаковой точности измерений в диапазоне низких концентраций. Так при измерениях в стандартном растворе с концентрацией 2 мкг/дм3 квадратическое отклонение составило 30% в обоих случаях.
Таким образом, использование в качестве фонового электролита раствора 0,01 N азотной кислоты позволяет получить наилучшие основные метрологические характеристики фторидселективного электрода в диапазоне микроконцентраций фторид-ионов.
Сравнивая фоновые электролиты более слабых кислот, т.е. лимонной и уксусной, можно сделать вывод о том, что при использовании уксусной кислоты электрод имеет более высокие характеристики:
– существенно более высокая чувствительность электрода (63 мВ, что на 12 мВ выше, чем в лимонной);
– высокая точность измерений. Квадратическое отклонение, полученное при измерениях микроконцентраций (2 мкг/дм3) фторид-ионов, составляет 62,5%, что примерно в 2 раза меньше, чем при измерениях в лимонной кислоте (125%).
Таким образом, можно сделать вывод о том, что среди слабых кислот в диапазоне микроконцентраций (2-100 мкг/дм3) фторид-ионов наиболее предпочтительным является использование в качестве фонового электролита раствора 0,01 N уксусной кислоты.
Однако если при использовании фонового электролита в виде азотной кислоты (при рН=2,0±0,1 ед.) фторидные комплексы примесей с алюминием и железом – нестойки и не препятствуют определению концентрации, то при использовании фонового электролита в виде уксусной кислоты (при рН=3,4±0,1 ед.) примеси катионов Al3+, Fe3+ и др. образуют устойчивые фторидные комплексы, мешающие определению фторид-ионов. Для исключения влияния упомянутых примесей и связывания их в устойчивые комплексы в уксусную кислоту добавляют комплексообразователь в виде динатриевой соли этилендиаминтетрауксусной кислоты Na2H2(CH2COO)4N2C2H4 (далее Трилон Б).
Для определения оптимальной концентрации Трилона Б были проведены исследования влияния добавок Трилона Б различной концентрации: 0,01, 0,005, 0,002, 0,001 и 0,0005 N. Результаты исследований влияния концентрации комплексообразователя – Трилона Б на характеристики электрода ИСЭ-F-01 представлены в таблице 3 (см. фиг.3).
Из полученных данных видно, что при уменьшении концентрации Трилона Б с 0,01 N до 0,001 N происходит увеличение градиента с 63 до 67 мВ, следовательно улучшаются метрологические характеристики электрода. Это происходит из-за того, что уменьшается ионная сила раствора, т.е. количество посторонних ионов, вводимых для увеличения электропроводности раствора. Однако при дальнейшем уменьшении концентрации Трилона Б до 0,0005 N происходит резкое уменьшение градиента до 60 мВ. Это связано с тем, что количество Трилона Б становится недостаточным для связывания в комплексы катионов Al3+ и Fe3+, присутствующих в виде примесей в воде.
С уменьшением концентрации Трилона Б с 0,01 N до 0,005 N погрешность измерения в диапазоне низких (2-10 мкг/дм3) концентраций F–-ионов уменьшается, значения квадратического отклонения составляют соответственно 40 и 20%. Однако дальнейшее уменьшение концентрации Трилона Б приводит к резкому увеличению погрешности. Так, при концентрации Трилона Б 0,001 N погрешность увеличивается до 98%, что в 5 раз выше, чем при концентрации 0,005 N.
Из полученных данных видно, что наилучшие характеристики фторидселективного электрода позволяет получить добавка Трилона Б в концентрации 0,005 N, однако ее недостаточно для связывания катионов Al3+ и Fe3+, содержащихся в технологических водах (содержание которых достигает 100 мкг/дм3).
Исходя из вышесказанного, оптимальной концентрацией добавки комплексообразователя Трилона Б в уксусную кислоту для использования последней в качестве фонового электролита является добавка с концентрацией 0,01 N.
Поскольку Трилон Б – соль, образованная катионом сильного основания (Na+) и анионом сильной этилендиаминтетрауксусной кислоты, то добавка Трилона Б в раствор, уже содержащий в качестве фонового электролита уксусную кислоту, обеспечивающую рН=3,4±0,1 ед., никак не изменит величину рН растворов.
Таким образом, оба заявляемых варианта состава фонового электролита обеспечивают наилучшие метрологические характеристики фторидселективного электрода в области низких концентраций, а значит обеспечивают получение одного и того же технического результата. Высокие метрологические характеристики указанного электрода в обоих случаях позволяют определить низкие (до 2 мкг/дм3) концентрации фторид-ионов в водных средах. Следовательно, оба варианта способа позволяют решить одну и ту же техническую задачу: возможность контроля чистоты глубокообессоленных вод по фторид-иону, а значит отвечают требованию «единства изобретения».
Построение градуировочных графиков (калибровочных зависимостей) концентрации фторид-ионов от ЭДС осуществляют по данным потенциометрических измерений в стандартных растворах с известной концентрацией. Определение концентрации фторид-ионов в анализируемом образце водной среды осуществляют путем сравнения данных потенциометрических измерений в анализируемом образце с упомянутой калибровочной зависимостью.
Использование метода градуировочного графика является предпочтительным в диапазоне низких концентраций от 2 до 20 мкг/дм3, т.к. с уменьшением содержания F-ионов резко снижается чувствительность других известных методов определения.
Заявляемые составы фоновых электролитов (оба варианта) позволяют проводить измерения как в статических условиях, так и в динамических, т.е. в потоке образца.
Краткое описание чертежей
На фиг.1 приведена таблица градуировочных характеристик лантанфторидного ионоселективного электрода, полученных при добавлениях фоновых электролитов в виде азотной и соляной кислот.
На фиг.2 приведена таблица градуировочных характеристик лантанфторидного ионоселективного электрода, полученных при добавлениях фоновых электролитов в виде уксусной и лимонной кислот.
На фиг.3 – таблица, иллюстрирующая влияние концентрации комплексообразователя Трилона Б на метрологические характеристики фторидселективного электрода.
На фиг.4 – лабораторная установка для проведения измерений прямым методом.
На фиг.5 – лабораторная установка для проведения измерений дифференциальным методом.
На фиг.6 изображен фторидселективный электрод типа ИСЭ-F-01.
На фиг.7 показан вид градуировочного (калибровочного) графика фторидселективного электрода ИСЭ-F-01.
На фиг.8 изображен датчик фторидомера для определения концентрации фторид-ионов в динамических условиях.
Осуществление изобретения
Пример 1. Определение концентрации фторид-ионов в статических условиях при использовании в качестве фонового электролита 0,01 N раствора химически чистой уксусной кислоты с добавкой комплексообразователя – 0,01 N раствора Трилона Б при рН=3,4±0,1 ед.
Измерения осуществляли двумя методами: прямым и дифференциальным.
Установка для проведения измерений прямым методом (см. фиг.4) содержит фторидселективный электрод 1, электрод 2 сравнения и термометр 3, помещенные в измерительную ячейку 4, а также вторичный цифровой регистрирующий прибор 5.
Установка для проведения измерений дифференциальным методом (см. фиг.5) содержит два фторидселективных электрода 1, один из которых помещен в стандартный раствор 6, а другой в исследуемый раствор 7, электролитические ключи 8 и регистрирующий прибор 5.
В качестве фторидселективного использовали электрод типа ИСЭ-F-01, Ленинградского государственного университета под руководством академика Б.П.Никольского, содержащий (см. фиг.6) мембрану 9 из монокристалла трифторида лантана и серебряную проволоку 10 с покрытием из AgCl, размещенную в приэлектродном растворе 11. В качестве электрода сравнения использовали хлорсеребряный электрод ЭВЛ-1М3. Для снятия показаний в качестве вторичного измерительного прибора 5 применяли потенциометр с внутренним сопротивлением не менее 100 МОм, т.к. необходимо, чтобы внутреннее сопротивление прибора было на 2 порядка выше внутреннего сопротивления измерительного фторидселективного электрода.
Порядок осуществления способа
Осуществляют калибровку измерительного фторидселективного электрода по заранее приготовленным стандартным калибровочным растворам фторида натрия с добавками фонового электролита на соответствующей выбранному методу установке по фиг.4 или 5.
Для приготовления стандартных калибровочных растворов фторида натрия производят ряд подготовительных операций.
Навеску NaF квалификации ос.ч. 9-3 ТУ 6-09-3322-73, равную 4,1988 г, помещают в мерную колбу вместимостью 1000 см3, добавляют небольшое количество дистиллированной воды и затем доводят до метки дистиллированной водой. Переносят раствор в полиэтиленовую емкость. Полученный таким образом основной раствор имеет концентрацию 10-1 моль/дм3 F–ионов.
Последующим разбавлением основного раствора бидистиллированной водой по ГОСТ 6709-72 получают аттестованные смеси АС №1, АС №2 и АС №3 с концентрациями F–-ионов: 1 г/дм3, 10 мг/дм3 и 100 мкг/дм3 соответственно. Из упомянутых аттестованных смесей последовательным разбавлением готовят калибровочные растворы (порядок приготовления стандартных растворов известен).
Для проведения прямых потенциометрических измерений готовят калибровочные растворы с концентрациями F–-ионов: 10-4, 10-5, 10-6, 10-7 моль/дм3.
Для проведения исследований дифференциальным методом готовят серию калибровочных растворов с концентрацией фторид-ионов 2, 10, 20, 50 и 100 мкг/дм3.
Затем в каждую колбу с калибровочным раствором добавляют необходимое количество раствора фонового электролита, после чего раствор доводят до нужной метки дистиллированной водой и переносят в полиэтиленовую емкость. Раствор фонового электролита готовят разбавлением из соответствующего 0,1 М раствора химически чистой уксусной кислоты, в который затем добавляется 0,01 N раствор Трилона Б.
Значение рН раствора в пределах 3,4±0,1 ед. контролируют с помощью рН селективного стеклянного электрода.
Производят измерения ЭДС в калибровочных растворах с добавками фонового электролита на соответствующих установках (фиг.4 или 5). Измерения производят от меньшей концентрации фторид-ионов к большей.
По результатам измерений осуществляют построение соответствующих градуировочных графиков – зависимости ЭДС от концентрации фторид-ионов. Вид графика показан на фиг.7.
Определение концентрации фторид-ионов в образце воды осуществляют следующим образом.
В пробу исследуемого (анализируемого) образца добавляют раствор фонового электролита – 0,01 N раствор химически чистой уксусной кислоты с добавкой комплексообразователя – 0,01 N раствора Трилона Б, при этом значение рН раствора в пределах 3,4±0,1 ед. контролируют с помощью рН селективного стеклянного электрода. Подготовленным анализируемым раствором (пробой) дважды промывают измерительную ячейку. После промывки в измерительную ячейку 4 заливают упомянутый анализируемый раствор и выдерживают в течение 5 минут. Снимают показания ЭДС со вторичного прибора 5 и определяют концентрацию фторид-ионов по градуировочному графику.
Пример 2. Определение концентрации фторид-ионов в статических условиях при использовании в качестве фонового электролита 0,01 N раствора химически чистой азотной кислоты. Измерения производят дифференциальным методом. Для чего собирают соответствующую установку (фиг.5).
Осуществляют калибровку измерительного фторидселективного электрода 1 по заранее приготовленным стандартным калибровочным растворам фторида натрия. Приготовление калибровочных растворов осуществляют аналогично примеру 1. В каждую колбу с упомянутым раствором добавляют фоновый электролит в виде 0,01 N раствора химически чистой азотной кислоты. Значение рН раствора поддерживают в пределах = 2,0±0,1 ед., контролируя с помощью рН селективного стеклянного электрода. По результатам измерений осуществляют построение соответствующего градуировочного графика – зависимости ЭДС от концентрации фторид-ионов. Вид графика аналогичен приведенному на фиг.7.
В пробу исследуемого образца добавляют упомянутый фоновый электролит в виде 0,01 N раствора химически чистой азотной кислоты. Подготовленным исследуемым раствором дважды промывают измерительную ячейку 4, после чего в нее заливают этот раствор и выдерживают в течение 5 минут. Снимают показания ЭДС со вторичного прибора 5 и определяют концентрацию фторид-ионов по градуировочному графику.
Пример 3. Определение концентрации фторид-ионов в динамических условиях (в протоке). В качестве добавки может быть использован любой из заявляемых вариантов фонового электролита.
Собирают датчик фторидомера для непрерывного автоматического определения концентрации фторид-ионов, изображенный на фиг.8, где:
| 12 – дозатор, |
15 – клапан тонкой регулировки, |
18 – электролитический бачок, |
| 13 – моностат, |
16 – коллектор, |
19 – промежуточный бачок, |
| 14 – смеситель, |
17 – капилляр, |
20 – слив. |
Для поддержания заявляемых значений рН во фторидомере имеется дозатор 12 фоновых электролитов, отградуированный соответственно используемому фоновому электролиту.
Производят калибровку фторидселективного электрода 1 по стандартным калибровочным растворам аналогично примеру 1, только в динамических условиях (в протоке) на фторидомере (фиг.8), и строят соответствующую градуировочную зависимость ЭДС от концентрации фторид-ионов.
В измерительную ячейку 4 подают исследуемый раствор (образец) 21 с неизвестной концентрацией фторид-ионов, содержащий один из фоновых электролитов. Через 10 мин после подачи упомянутого раствора со вторичного прибора 5 снимают значение ЭДС и по градуировочному графику определяют концентрацию фторид-ионов.
Заявляемый способ определения концентрации фторид-ионов в воде обеспечивает возможность измерения промышленно выпускаемым фторидселективным электродом низких концентраций фторид-ионов вплоть до 2,0 мкг/дм3.
Таким образом, заявляемый способ позволяет осуществлять аналитический контроль нормируемого показателя по фторид-иону в глубокообессоленных водах атомных, тепловых электростанций и установок электронной техники.
Формула изобретения
1. Способ определения концентрации фторид-ионов в воде дифференциальным потенциометрическим методом с использованием двух лантанфторидных ионоселективных электродов, включающий построение градуировочных зависимостей по стандартным растворам и использование фонового электролита в качестве добавки ко всем стандартным и анализируемым растворам, в которых осуществляют измерения, отличающийся тем, что в качестве фонового электролита используют 0,01 N раствор химически чистой азотной кислоты, при этом рН измеряемой водной среды поддерживают в пределах 2,0±0,1 ед.
2. Способ по п.1, отличающийся тем, что измерения осуществляют в стационарных условиях.
3. Способ по п.1, отличающийся тем, что измерения осуществляют в динамических условиях, в потоке образца.
4. Способ определения концентрации фторид-ионов в воде прямым или дифференциальным потенциометрическим методом с использованием лантанфторидных ионоселективных электродов и электрода сравнения, включающий построение градуировочных зависимостей по стандартным растворам и использование фонового электролита в качестве добавки ко всем стандартным и анализируемым растворам, в которых осуществляют измерения, отличающийся тем, что в качестве фонового электролита используют 0,01 N раствор химически чистой уксусной кислоты с добавкой комплексообразователя -0,01 N раствора динатриевой соли этилендиамин тетрауксусной кислоты (Трилона Б), при этом рН измеряемой водной среды поддерживают в пределах 3,4±0,1 ед.
5. Способ по п.4, отличающийся тем, что измерения осуществляют в стационарных условиях.
6. Способ по п.4, отличающийся тем, что измерения осуществляют в динамических условиях, в потоке образца.
РИСУНКИ
|