|
|
(21), (22) Заявка: 2005108070/04, 22.08.2003
(24) Дата начала отсчета срока действия патента:
22.08.2003
(30) Конвенционный приоритет:
23.08.2002 US 60/405,467
11.10.2002 US 60/417,837
15.05.2003 US 60/471,373
22.08.2003 US 10/646,348
(43) Дата публикации заявки: 27.08.2005
(46) Опубликовано: 20.08.2008
(56) Список документов, цитированных в отчете о
поиске:
RU 2147233 C1, 10.04.2000. ЕР 1348706 А, 01.10.2003. ЕР 1180518 А, 20.02.2002. WO 0174811 А1, 11.10.2001. WO 0178648 А, 25.10.2001.
(85) Дата перевода заявки PCT на национальную фазу:
23.03.2005
(86) Заявка PCT:
US 03/26478 (22.08.2003)
(87) Публикация PCT:
WO 2004/018463 (04.03.2004)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
СИНГХ Раджиндер (US),
ГОФФ Дейн (US),
ПАРТРИДЖ Джон (US),
ЛУ Генри (US)
(73) Патентообладатель(и):
РАЙДЖЕЛ ФАРМАСЬЮТИКАЛЗ, ИНК. (US)
|
(54) ПИРИДИЛЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛЫ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ИНФЕКЦИИ, ВЫЗВАННОЙ ВИРУСОМ ГЕПАТИТА С
(57) Реферат:
Изобретение относится к соединениям формулы (I), их фармацевтически приемлемой соли или N-оксиду в качестве ингибитора репликации и/или пролиферации HCV, к способу ингибирования репликации или пролиферации вириона гепатита С с использованием соединений формулы (I), а также к фармацевтической композиции на их основе. Соединения могут найти применение для лечения и профилактики инфекции, вызванной вирусом гепатита С. В общей формуле (I)

цикл В представляет собой ароматическое или неароматическое кольцо, которое включает два гетероатома, где Х и Y, каждый, независимо друг от друга, выбран из С, СН, N или О, при условии, что Х и Y, оба, не являются О и что Х и Y, оба, не являются N; U и Т представляют собой С; Z представляет собой -СН-; А представляет собой N или -CR2-; В представляет собой -CR3-; D представляет собой N или -CR4-; Е представляет собой N или -CR5-; G представляет собой N или -CR6-; J представляет собой N или -CR14-; К представляет собой -CR8-; L представляет собой N или -CR9-; М представляет собой N или -CR10-; R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из водорода, галогена, C1-С6алкила, замещенного C1-С6алкила, C1-С6алкокси, C1-С6замещенного алкокси, C1-С6алкоксикарбонила, циклогетероалкила, замещенного циклогетероалкила, -O-карбамоила, замещенного -O-карбамоила, галоген C1-С6алкила, диС1-С6алкиламино, замещенного диС1-С6алкиламино и силиловых простых эфиров, где циклогетероалкил представляет 3-7-членное кольцо, включающее 1-2 гетероатома, выбраннх из N и О, при условии, что один из R2 и R6 отличается от водорода; R3 и R5, каждый, независимо друг от друга, выбран из группы, состоящей из водорода, галогена; R4 представляет собой водород; R7 представляет -NR11C(O)R12; R8, R9, R10 и R14, каждый, независимо друг от друга, представляет водород; R11 представляет водород, C1-С6алкил; и R12 выбран из группы, состоящей из галоген C1-С6алкила; где каждая замещенная группа замещена одной или несколькими группами, выбранными из -Q, -R40, -OR40, -C(O)R40, -C(O)OR40, где каждый Q независимо представляет галоген, R40 и R41 независимо выбран из группы, состоящей из водорода, С1-С6алкила, C1-С6алкокси; при условии, что: (i) по крайней мере, один из A, D, Е, G, J, L или М представляет собой N; (ii) не более чем один из А, D, Е или G представляет собой N; и (iii) не более чем один из J, L или М представляет собой N. 4 н. и 29 з.п. ф-лы, 63 ил., 1 табл.
1. Область техники
По данной заявке в соответствии с Разделом 35 Кодекса законов США § 119(e) испрашивается множественный приоритет на основании заявки 60/405467, поданной 23 августа 2002 г., заявки 60/417837, поданной 11 октября 2002, и заявки 60/471373, поданной 15 мая 2003, содержание которых включено в настоящее описание в виде ссылки.
2. Область техники
Данное изобретение относится к пиридилзамещенным гетероциклам и их композициям, полезным для лечения или профилактики инфекционных заболеваний, вызванных вирусом гепатита С (HCV) (далее в тексте HCV-инфекция). В частности, данное изобретение относится к пиридилзамещенным гетероциклам и соответствующим гидрированным изомерам, композициям на их основе и применению указанных соединений и композиций для ингибирования репликации и/или пролиферации HCV как терапевтическому подходу к лечению и/или профилактике HCV-инфекций у людей и животных.
3. Предшествующий уровень техники
Инфекционное заболевание, вызванное вирусом гепатита С (HCV), представляет глобальную проблему здоровья человека, с приблизительно 150000 новых регистрируемых каждый год случаев заболевания только в Соединенных Штатах. HCV представляет собой вирус, содержащий одноцепочечную РНК, который является этиологическим агентом, идентифицированным в большинстве случаев посттрансфузионного и посттрансплантационного гепатита, вызванного инфекционным агентом, антигенно отличным от вирусов гепатита А и В, и который является общеизвестной причиной острого спорадического гепатита (Choo et al., Science 244:359, 1989; Kuo et al., Science 244:362, 1989; and Alter et al., in Current Perspective in Hepatology, p. 83, 1989). Установлено, что более чем 50% пациентов, инфицированных HCV, становятся хронически инфицированными и у 20% из них развивается цирроз печени в течение 20 лет (Davis et al., New Engl. J. Med. 321:1501, 1989; Alter et al., in Current Perspective in Hepatology, p. 83, 1989; Alter et al., New Engl. J. Med. 327:1899, 1992; and Dienstag Gastroenterology 85:430, 1983). Кроме того, единственной терапией, общедоступной для лечения HCV-инфекции, является интерферон- . (INTRON® A, PEG-INTRON® A, Schering-Plough; ROFERON-A®, Roche). Большинство пациентов являются невосприимчивыми к лечению интерфероном- . (INTRON® A, PEG-INTRON® A, Schering-Plough; ROFERON-A®, Roche). Большинство пациентов являются невосприимчивыми к лечению интерфероном- , однако, среди пациентов, реагирующих на него, имеет место высокая частота рецидивов в пределах 6-12 месяцев после прекращения лечения (Liang et al., J. Med. Virol. 40:69, 1993). Рибавирин, аналог гуанозина с широким спектром активности в отношении многих РНК- и ДНК-содержащих вирусов, как было показано при клинических испытаниях, является эффективным против хронической HCV-инфекции при использовании в комбинации с интерфероном- , однако, среди пациентов, реагирующих на него, имеет место высокая частота рецидивов в пределах 6-12 месяцев после прекращения лечения (Liang et al., J. Med. Virol. 40:69, 1993). Рибавирин, аналог гуанозина с широким спектром активности в отношении многих РНК- и ДНК-содержащих вирусов, как было показано при клинических испытаниях, является эффективным против хронической HCV-инфекции при использовании в комбинации с интерфероном- (см., например, Poynard et al., Lancet 352:1426-1432, 1998; Reichard et al., Lancet 351:83-87, 1998), и эта комбинированная терапия была недавно одобрена (REBETRON, Schering-Plough). Однако степень ответа, по-прежнему, значительно ниже 50%. Поэтому, существует потребность в дополнительных соединениях для лечения и профилактики инфекционного заболевания, вызванного HCV. (см., например, Poynard et al., Lancet 352:1426-1432, 1998; Reichard et al., Lancet 351:83-87, 1998), и эта комбинированная терапия была недавно одобрена (REBETRON, Schering-Plough). Однако степень ответа, по-прежнему, значительно ниже 50%. Поэтому, существует потребность в дополнительных соединениях для лечения и профилактики инфекционного заболевания, вызванного HCV.
4. Краткое описание изобретения
В одном аспекте, данное изобретение предлагает пиридилзамещенные гетероциклы, которые представляют собой сильнодействующие ингибиторы репликации и/или пролиферации вируса гепатита С (“HCV”). В одном варианте осуществления соединения представляют собой пиридилзамещенные гетероциклы и их гидрированные изомеры цикла В в соответствии со структурной формулой (I), имеющие следующий “остов” с принятым порядком нумерации:

где цикл В представляет собой ароматическое или неароматическое кольцо, которое содержит от одного до четырех гетероатомов. X, Y, Z, каждый, независимо друг от друга, выбран из С, CH, N, NR16, NR18, S или O, и U и T, каждый, независимо друг от друга, выбран из C, CH или N, при условии, что X и Y, оба, не являются O. Один из циклов “A” или “C” представляет собой пиридильное кольцо, а другой представляет собой фенильное кольцо или пиридильное кольцо. Когда “A” и/или “C” представляет собой пиридил, цикл может быть присоединен к иллюстрируемому циклу “B” через любой доступный атом углерода. Таким образом, циклы “A” и/или “C” могут представлять собой пирид-2-ильные, пирид-3-ильные или пирид-4-ильные кольца.
Цикл “A” включает заместитель, расположенный в ортоположении к месту присоединения (2′- или 6′-положение), и может необязательно включать от 1 до 4 дополнительных заместителей. Природа заместителей может широко варьироваться. Типичные группы-заместители, используемые для замещения цикла “A”, включают галоген, фтор, хлор, алкил, алкилтио, алкокси, алкоксикарбонильные, арилалкилоксикарбонильные, арилоксикарбонильные, циклогетероалкильные, карбамоильные, галогеналкильные, диалкиламино или сульфамоильные группы и их замещенные варианты. В одном варианте осуществления, цикл “A” является дизамещенным в 2′- и 6′-положениях и незамещенным во всех других положениях.
Цикл “C” является замещенным в мета(3″ или 5″)-положении заместителем формулы -NR11C(O)R12, где R11 представляет собой водород, алкил или метил и R12 представляет замещенный алкил, галогеналкил, дигалогенметил, дихлорметил, циклогетероалкил или замещенный циклогетероалкил. В одном варианте осуществления, R12 представляет собой галогеналкильную или дихлорметильную группу. Цикл “C” может быть также необязательно замещен в одном или нескольких из 2″-, 4″-, 5″- и/или 6″-положений одинаковыми или различными группами галогена.
Как должно быть очевидно квалифицированным специалистам в данной области, фактическое распределение электронов или порядок расположения двойных связей в цикле “B” будет зависеть от природы заместителей X, Y, Z, T и/или U. В частности, имеется в виду, что приведенная выше структурная формула (I) включает, по крайней мере, следующие шесть структур:


где A, B, D, E, G, J, K, L, M, R11 и R12 такие, как определено ниже.
В частности, имеется в виду, что приведенная выше структурная формула (I) включает, например, по крайней мере, следующие гидрированные изомеры цикла В:

где A, B, D, E, G, J. K, L, M11, R12, R16 и R18 такие, как определено ниже.
В другом аспекте, настоящее изобретение предлагает композиции, включающие соединения данного изобретения. Композиции обычно включают пиридил-замещенный гетероцикл или гидрированный изомер (обсуждаемый на протяжении всего описания) данного изобретения или его соль, гидрат, сольват или N-оксид и подходящий эксципиент, носитель или разбавитель. Композиция может быть формулирована для применения в ветеринарии или для применения для людей.
Соединения данного изобретения являются сильнодействующими ингибиторами репликации и/или пролиферации HCV. Соответственно, в следующем аспекте, настоящее изобретение предлагает способы ингибирования репликации и/или пролиферации HCV, включающие контактирование вириона гепатита С с соединением или композицией данного изобретения в количестве, эффективном для ингибирования репликации и/или пролиферации HCV. Способы могут быть осуществлены на практике in vitro или in vivo, и могут быть использованы в качестве терапевтического подхода к лечению и/или профилактике инфекционных заболеваний, вызванных HCV.
В конечном аспекте, настоящее изобретение предлагает способы лечения и/или профилактики HCV-инфекций. Способы обычно включают введение субъекту, который имеет HCV-инфекцию, или субъекту с повышенным риском развития HCV-инфекции соединения или композиции данного изобретения в количестве, эффективном для лечения или профилактики HCV-инфекции. Указанный способ может быть применен на практике для животных в ветеринарных ситуациях или для людей.
5. Краткое описание чертежей
Фиг.1 представляет иллюстративные соединения данного изобретения: и
Фиг. 2-63 представляют иллюстративные схемы синтеза для получения соединений данного изобретения.
6. Подробное описание предпочтительных вариантов осуществления
6.1 Определения
Имеется в виду, что используемые в настоящем описании следующие термины имеют следующие значения:
“Алкил“, отдельно или как часть другого заместителя, относится к насыщенному или ненасыщенному, разветвленному, с прямой цепью или циклическому моновалентному углеводородному радикалу, полученному путем удаления одного водородного атома от одного атома углерода исходного алкана, алкена или алкина. Типичные алкильные группы включают, но ими не ограничиваются, метил; этильные группы, такие как этанил, этенил, этинил; пропильные группы, такие как пропан-1-ил, пропан-2-ил, циклопропан-1-ил, проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), циклопроп-1-ен-1-ил, циклопроп-2-ен-1-ил, проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутильные группы, такие как бутан-1-ил, бутан-2-ил, 2-метилпропан-1-ил, 2-метилпропан-2-ил, циклобутан-1-ил, бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил, бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и т.п.
В частности, имеется в виду, что термин “алкил” включает группы, имеющие любую степень или уровень насыщенности, т.е., группы, имеющие исключительно простые углерод-углеродные связи, группы, имеющие одну или несколько двойных углерод-углеродных связей, группы, имеющие одну или несколько тройных углерод-углеродных связей, и группы, имеющие смеси простых, двойных и тройных углерод-углеродных связей. В тех случаях, когда имеется в виду определенный уровень насыщенности, используют выражения “алканил”, “алкенил” и “алкинил”. Предпочтительно, алкильная группа содержит от 1 до 15 атомов углерода (С1-С15алкил), более предпочтительно от 1 до 10 атомов углерода (С1-С10алкил) и еще более предпочтительно от 1 до 6 атомов углерода (С1-С6алкил или низший алкил).
“Алканил“, отдельно или как часть другого заместителя, относится к насыщенному, разветвленному, с прямой цепью или циклическому алкильному радикалу, полученному путем удаления одного атома водорода от одного углеродного атома исходного алкана. Типичные алканильные группы включают, но ими не ограничиваются, метанил; этанил; пропанильные группы, такие как пропан-1-ил, пропан-2-ил (изопропил), циклопропан-1-ил и т.д.; бутанильные группы, такие как бутан-1-ил, бутан-2-ил (втор-бутил), 2-метилпропан-1-ил (изобутил), 2-метилпропан-2-ил (трет-бутил), циклобутан-1-ил и т.д.; и т.п.
“Алкенил“, отдельно или как часть другого заместителя, относится к ненасыщенному, разветвленному, с прямой цепью или циклическому алкильному радикалу, имеющему, по крайней мере, одну углерод-углеродную двойную связь, полученному путем удаления одного атома водорода от одного углеродного атома исходного алкена. Группа может находиться либо в цис-, либо в трансформах относительно двойной связи(ей). Типичные алкенильные группы включают, но ими не ограничиваются, этенил; пропенильные группы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен-2-ил, циклопроп-1-ен-1-ил, циклопроп-2-ен-1-ил; бутенильные группы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метилпроп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил и т.д.; и т.п.
“Алкинил“, отдельно или как часть другого заместителя, относится к ненасыщенному, разветвленному, с прямой цепью или циклическому алкильному радикалу, имеющему, по крайней мере, одну углерод-углеродную тройную связь, полученному путем удаления одного атома водорода от одного углеродного атома исходного алкина. Типичные алкинильные группы включают, но ими не ограниваются, этинил; пропинильные группы, такие как проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутинильные группы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и т.п.
“Алкокси“, отдельно или как часть другого заместителя, относится к радикалу формулы -OR30, где R30 представляет собой алкильную или циклоалкильную группу, определенную в данном описании. Типичные примеры алкоксигрупп включают, но ими не ограниваются, метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, циклопропилокси, циклопентилокси, циклогексилокси и т.п.
“Алкоксикарбонил“, отдельно или как часть другого заместителя, относится к радикалу формулы -C(O)-алкокси, где алкоксигруппа такая, как определено выше.
“Алкилтио“, отдельно или как часть другого заместителя, относится к радикалу формулы -SR31, где R31 представляет собой алкильную или циклоалкильную группу, определенную выше. Типичные примеры включают, но ими не ограничиваются, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, трет-бутилтио, циклопропилтио, циклопентилтио, циклогексилтио и т.п.
“Арил“, отдельно или как часть другого заместителя, относится к моновалентной ароматической углеводородной группе, полученной путем удаления одного атома водорода от одного углеродного атома определенной в данном описании исходной ароматической циклической системы. Типичные арильные группы включают, но ими не ограничиваются, группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, асимм-индацена, симм-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плейадена, пирена, пирантрена, рубицена, трифенилена, тринафталина и т.п. Предпочтительно, арильная группа включает от 6 до 20 углеродных атомов (C6-C20арил), более предпочтительно от 6 до 15 углеродных атомов (C6-C15арил) и еще более предпочтительно от 6 до 10 углеродных атомов (C6-C10арил).
“Арилалкил“, отдельно или как часть другого заместителя, относится к ациклической алкильной группе, в которой один из атомов водорода, связанный с углеродным атомом, обычно концевым или sp3-гибридизированным атомом углерода, заменен определенной выше арильной группой. Типичные арилалкильные группы включают, но ими не ограничиваются, бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. В тех случаях, когда имеются в виду определенные алкильные части, используют терминологию арилалканила, арилалкенила и/или арилалкинила. Предпочтительно, арилалкильная группа представляет собой (C6-C30)арилалкил, например, алканильная, алкенильная или алкинильная часть арилалкильной группы представляет собой (C1-C10)алкил и арильная часть представляет собой (C6-C20)арил, более предпочтительно, арилалкильная группа представляет собой (C6-C20)арилалкил, например, алканильная, алкенильная или алкинильная часть арилалкильной группы представляет собой (C1-C8)алкил и арильная часть представляет собой (C6-C12)арил, и еще более предпочтительно, арилалкильная группа представляет собой (C6-C15)арилалкил, например, алканильная, алкенильная или алкинильная часть арилалкильной группы представляет собой (C1-C5)алкил и арильная часть представляет собой (C6-C10)арил.
“Арилокси“, отдельно или как часть другого заместителя, относится к радикалу формулы -O-арил, где арил является таким, как определено выше.
“Арилалкилокси“, отдельно или как часть другого заместителя, относится к радикалу формулы -O-арилалкил, где арилалкил является таким, как определено выше.
“Арилоксикарбонил“, отдельно или как часть другого заместителя, относится к радикалу формулы -C(O)-O-арил, где арил является таким, как определено выше.
“Карбамоил“, отдельно или как часть другого заместителя, относится к радикалу формулы -C(O)NR32R33, где R32 и R33, каждый, независимо друг от друга, выбран из группы, состоящей из водорода, определенных выше алкила и циклоалкила, или, альтернативно, R32 и R33, взятые вместе с атомом азота, с которым они связаны, образуют определенную в данном описании циклогетероалкильную циклическую структуру.
Термин “Соединения данного изобретения” относится к соединениям, обобщенным различными описаниями и общими формулами, раскрытыми в данном описании. Соединения данного изобретения могут быть идентифицированы или по их химической структуре и/или по химическому названию. В тех случаях, когда химическая структура и химическое название вступают в противоречие, химическая структура является определяющим фактором, описывающим данные соединения. Соединения данного изобретения могут содержать один или несколько хиральных центров и/или двойных связей и, поэтому, могут существовать в виде стереоизомеров, таких как изомеры по двойной связи (т.е., геометрические изомеры), ротамеры, энантиомеры или диастереоизомеры. Соответственно, в тех случаях, когда стереохимия в хиральных центрах не оговорена особо, химические структуры, изображенные в данном описании, охватывают все возможные конфигурации в указанных хиральных центрах, включая стереоизомерно чистую форму (например, геометрически чистую, энантиомерно чистую или диастереомерно чистую) и энантиомерные и стереоизомерные смеси. Энантиомерные и стереоизомерные смеси могут быть разделены на их компоненты, энантиомеры или стереомеры, используя известные специалистам в данной области методы разделения или методы хирального синтеза. Соединения данного изобретения могут также существовать в нескольких таутомерных формах, включая енольную форму, кетоформу и их смеси. Соответственно, изображенные в данном описании химические структуры охватывают все возможные таутомерные формы иллюстрируемых соединений. Соединения данного изобретения могут также включать меченные изотопом соединения, где один или несколько атомов имеют атомную массу, отличающуюся от атомной массы, обычно встречающейся в природе. Примеры изотопов, которые могут быть включены в соединения данного изобретения, включают, но ими не ограничиваются, 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl. Соединения данного изобретения могут находиться в несольватированных формах, также как и сольватированных формах, включая формы гидратов, и в виде N-оксидов. В общем, гидратные, сольватированные и N-оксидные формы, все, входят в объем настоящего изобретения. Некоторые соединения настоящего изобретения могут существовать в различных кристаллических или аморфных формах. В общем, все физические формы соединений являются эквивалентными для предполагаемых согласно настоящему изобретению применений, и при этом имеется в виду, что все указанные формы не выходят за рамки объема настоящего изобретения.
“Циклоалкил“, отдельно или как часть другого заместителя, относится к насыщенному или ненасыщенному циклическому алкильному радикалу, определенному выше. В тех случаях, когда имеется в виду определенный уровень ненасыщенности, используют терминологию “циклоалканил” или “циклоалкенил”. Типичные циклоалкильные группы включают, но ими не ограничиваются, группы, полученные из циклопропана, циклобутана, циклопентана, циклогексана и т.п. Предпочтительно, циклоалкильная группа включает от 3 до 10 кольцевых атомов (C3-C10циклоалкил) и более предпочтительно от 3 до 7 кольцевых атомов (C3-C7циклоалкил).
“Циклогетероалкил“, отдельно или как часть другого заместителя, относится к насыщенному или ненасыщенному циклическому алкильному радикалу, в котором один или несколько углеродных атомов (и необязательно любые связанные водородные атомы) независимо заменены одинаковыми или различными гетероатомами. Типичные гетероатомы для замены атома(ов) углерода включают, но ими не ограничиваются, N, P, O, S, Si и т.д. В тех случаях, когда имеется в виду определенный уровень насыщенности, используют терминологию “циклогетероалканил” или “циклогетероалкенил”. Типичные циклогетероалкильные группы включают, но ими не ограничиваются, группы, полученные из эпоксидов, азиринов, тииранов, имидазолидина, морфолина, пиперазина, пиперидина, пиразолидина, пирролидона, хинуклидина и т.п. Предпочтительно, циклогетероалкильная группа включает от 3 до 10 кольцевых атомов ((3-10)-членный циклогетероалкил)) и более предпочтительно от 3 до 7 кольцевых атомов ((3-7)-членный циклогетероалкил)).
“Диалкиламино“, отдельно или как часть другого заместителя, относится к радикалу формулы -NR34R35, где R34 и R35, каждый, независимо друг от друга, выбран из группы, состоящей из алкила и циклоалкила, определенных выше. Типичные примеры диалкиламиногрупп включают, но ими не ограничиваются, диметиламино, метилэтиламино, ди(1-метилэтил)амино, (циклогексил)(метил)амино, (циклогексил)(этил)амино, (циклогексил)(пропил)амино и т.п.
“Галоген” или “гало“, сами по себе или как часть другого заместителя, относятся к радикалу фтора, хлора, брома и/или иода.
“Галогеналкил“, отдельно или как часть другого заместителя, относится к определенной выше алкильной группе, в которой один или несколько водородных атомов заменены группой галогена. В частности, имеется в виду, что термин “галогеналкил” включает моногалогеналкилы, дигалогеналкилы, тригалогеналкилы и т.д., вплоть до пергалогеналкилов. Галогенные группы, замещающие галогеналкильную группу, могут быть одинаковыми или различными. Например, выражение “(C1-C2)галогеналкил” включает 1-фторметил, 1-фтор-2-хлорэтил, дифторметил, трифторметил, 1-фторэтил, 1,1-дифторэтил, 1,2-дифторэтил, 1,1,1-трифторэтил, перфторэтил и т.д.
“Гетероарил“, отдельно или как часть другого заместителя, относится к моновалентому гетероароматическому радикалу, полученному удалением одного атома водорода от одного атома исходных гетероароматических циклических систем, определенных в данном описании. Типичные гетероарильные группы включают, но ими не ограничиваются, группы, полученные из акридина, арсиндола, карбазола,  -карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена и т.п. Предпочтительно, гетероарильная группа включает от 5 до 20 кольцевых атомов (5-20-членный гетероарил), более предпочтительно от 5 до 10 кольцевых атомов (5-10-членный гетероарил). Предпочтительными гетероарильными группами являются группы, полученные из тиофена, пиррола, бензотиофена, бензофурана, индола, пиридина, хинолина, имидазола, оксазола и пиразина. -карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена и т.п. Предпочтительно, гетероарильная группа включает от 5 до 20 кольцевых атомов (5-20-членный гетероарил), более предпочтительно от 5 до 10 кольцевых атомов (5-10-членный гетероарил). Предпочтительными гетероарильными группами являются группы, полученные из тиофена, пиррола, бензотиофена, бензофурана, индола, пиридина, хинолина, имидазола, оксазола и пиразина.
“Гетероцикл” относится к соединениям, входящим в объем данного изобретения, определяемым признаком “цикл B”, который изображен в данном описании. Такие соединения могут быть ароматическими или неароматическими (гидрированные изомеры). Цикл В имеет общую формулу:

которое включает от одного до четырех гетероатомов, где X, Y, Z, каждый, независимо друг от друга представляет C, CH, N, NR16, NR18, S или O; и U и T, каждый, независимо друг от друга представляет C, CH или N. R16 и R18, каждый, независимо друг от друга, выбран из группы, состоящей из водорода, низшего алкила, замещенного низшего алкила, низшего гетероалкила, замещенного низшего гетероалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, низшего галогеналкила, моногалогенметила, дигалогенметила, тригалогенметила, трифторметила, низшего алкилтио, замещенного низшего алкилтио, низшего алкокси, замещенного низшего алкокси, метокси, замещенного метокси, низшего гетероалкокси, замещенного низшего гетероалкокси, циклоалкокси, замещенного циклоалкокси, циклогетероалкокси, замещенного циклогетероалкокси, низшего галогеналкокси, моногалогенметокси, дигалогенметокси, тригалогенметокси, трифторметокси, низшего ди- или моноалкиламино, замещенного низшего ди- или моноалкиламино, арила, замещенного арила, арилокси, замещенного арилокси, фенокси, замещенного фенокси, арилалкила, замещенного арилалкила, арилалкилокси, замещенного арилалкилокси, бензила, бензилокси, гетероарила, замещенного гетероарила, гетероарилокси, замещенного гетероарилокси, гетероарилалкила, замещенного гетероарилалкила, гетероарилалкилокси, замещенного гетероарилалкилокси, карбоксила, низшего алкоксикарбонила, замещенного низшего алкоксикарбонила, арилоксикарбонила, замещенного арилоксикарбонила, арилалкилоксикарбонила, замещенного арилалкилоксикарбонила, карбамата, замещенного карбамата, карбамоила, замещенного карбамоила, сульфамоила, замещенного сульфамоила и группы формулы -L-R17, где “L” представляет собой линкер и R17 представляет собой циклоалкил, замещенный циклоалкил, циклогетероалкил или замещенный циклогетероалкил. Линкер может представлять собой любую группу атомов, подходящих для присоединения части R17 к атому азота. Подходящие линкеры включают, но ими не ограничиваются, части, выбранные из группы, состоящей из -(CH2)1-6-, S, -C(O)-, -SO2-, -NH-, -C(O)-SO2NH- и их комбинаций.
Подходящие гетероциклы включают, например, изоксазолы, пиразолы, оксадиазолы, оксазолы, тиазолы, имидазолы, триазолы, тиадиазолы и их гидрированные изомеры. Подходящие гидрированные изомеры указанных выше гетероциклических соединений включают, например, дигидрированные изомеры, а также тетрагидрированные изомеры. Такие гидрированные изомеры включают, например, 2-изоксазолин, 3-изоксазолин, 4-изоксазолины, изоксазолидины,
1,2-пиразолины, 1,2-пиразолидины,
(3H)-дигидро-1,2,4-оксадиазолы,
(5H)-дигидро-1,2,4-оксадиазолы, оксазолины, оксазолидины,
(3H)-дигидротиазолы, (5H)-дигидротиазолы, тиазолидины
(тетрагидротиазолы), (3H)-дигидротриазолы, (5H)-дигидротриазолы,
триазолидины (тетрагидротриазолы), дигидрооксадиазолы,
тетрагидрооксадиазолы, (3H)-дигидро-1,2,4-тиадиазолы,
(5H)-дигидро-1,2,4-тиадиазолы,
1,2,4-тиадиазолидины (тетрагидротиадиазолы),
(3H)-дигидроимидазолы, (5H)-дигидроимидазолы и
тетрагидроимидазолы.
“Исходная ароматическая циклическая система” относится к ненасыщенной циклической или полициклической системе, имеющей сопряженную систему  -электронов. В частности, термин “исходная ароматическая циклическая система” включает конденсированные циклические системы, в которых один или несколько циклов являются ароматическими и один или несколько циклов являются насыщенными или ненасыщенными, такие как, например, флуорен, индан, инден, фенален и т.д. Типичные исходные ароматические циклические системы включают, но ими не ограничиваются, ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, хризен, коронен, флуорантен, флуорен, гексацен, гексафен, гексален, асимм-индацен, симм-индацен, индан, инден, нафталин, октацен, октафен, октален, овален, пента-2,4-диен, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пицен, плейаден, пирен, пирантрен, рубицен, трифенилен, тринафталин и т.п. -электронов. В частности, термин “исходная ароматическая циклическая система” включает конденсированные циклические системы, в которых один или несколько циклов являются ароматическими и один или несколько циклов являются насыщенными или ненасыщенными, такие как, например, флуорен, индан, инден, фенален и т.д. Типичные исходные ароматические циклические системы включают, но ими не ограничиваются, ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, хризен, коронен, флуорантен, флуорен, гексацен, гексафен, гексален, асимм-индацен, симм-индацен, индан, инден, нафталин, октацен, октафен, октален, овален, пента-2,4-диен, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пицен, плейаден, пирен, пирантрен, рубицен, трифенилен, тринафталин и т.п.
“Исходная гетероароматическая циклическая система” относится к исходной ароматической циклической системе, в которой один или несколько углеродных атомов (и необязательно любые связанные водородные атомы), каждый, независимо заменены одинаковыми или различными гетероатомами. Типичные гетероатомы для замены углеродных атомов включают, но ими не ограничиваются, N, P, O, S, Si и т.д. В частности, термин “исходная гетероароматическая циклическая система” включает конденсированные циклические структуры, в которых один или несколько циклов являются ароматическими и один или несколько циклов являются насыщенными или ненасыщенными, такие как, например, арсиндол, бензодиоксан, бензофуран, хроман, хромен, индол, индолин, ксантен и т.д. Типичные исходные гетероароматические циклические системы включают, но ими не ограничиваются, арсиндол, карбазол,  -карболин, хроман, хромен, циннолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, перимидин, фенантридин, фенантролин, феназин, фталазин, птеридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиадиазол, тиазол, тиофен, триазол, ксантен и т.п. -карболин, хроман, хромен, циннолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, перимидин, фенантридин, фенантролин, феназин, фталазин, птеридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиадиазол, тиазол, тиофен, триазол, ксантен и т.п.
“Фармацевтически приемлемая соль” относится к соли соединения данного изобретения, которая образована с противоионами, которые, как правило, известны в данной области, как приемлемые для фармацевтических применений, и которая обладает желаемой фармакологической активностью исходного соединения. Такие соли включают: (1) аддитивные соли кислоты, образуемые с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или образуемые с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.; или (2) соли, образуемые в том случае, когда кислый протон, присутствующий в исходном соединении, заменяют ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; или координирует с органическими основаниями, такими как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин, морфолин, пиперидин, диметиламин, диэтиламин и т.п. Включены также соли аминокислот, такие как аргинаты и т.п., и соли органических кислот, подобных глюкуроновой или галактуроновой (galactunoric) кислотам и т.п. (см., например, Berge et al., 1977, J. Pharm. Sci. 66:1-19).
“Фармацевтически приемлемый наполнитель” относится к разбавителю, адъюванту (вспомогательному веществу), эксципиенту или носителю, с которым вводят соединение данного изобретения.
“Защитная группа” относится к группе, которая, при присоединении к реакционноспособной функциональной группе в молекуле, маскирует функциональную группу, снижает или препятствует проявлению ее реакционной способности. Как правило, защитная группа может быть селективно удалена, если это требуется, во время синтеза. Примеры защитных групп можно найти в Greene and Wuts, Protective Groups in Organic Chemistry, 3rd Ed., 1999, John Wiley & Sons, NY and Harrison et al., Compendium of Synthetic Organic Methods, Vols. 1-8, 1971-1996, John Wiley & Sons, NY. Типичные амино-защитные группы включают, но ими не ограничиваются, формил, ацетил, трифторацетил, бензил, бензилоксикарбонил (“CBZ”), трет-бутоксикарбонил (“Boc”), триметилсилил (“TMS”), 2-триметилсилилэтансульфонил (“SES”), тритил и замещенные тритильные группы, аллилоксикарбонил, 9-флуоренилметилоксикарбонил (“FMOC”), нитровератрилоксикарбонил (“NVOC”) и т.п. Типичные гидроксил-защитные группы включают, но ими не ограничиваются, группы, где гидроксильная группа либо ацилирована (например, метиловые и этиловые сложные эфиры, ацетатные или пропионатные группы или гликолевые сложные эфиры), либо алкилирована, такие как бензиловые и тритиловые простые эфиры, а также алкиловые простые эфиры, тетрагидропираниловые простые эфиры, триалкилсилиловые простые эфиры (например, TMS или TIPPS группы) и аллиловые простые эфиры.
“Пролекарство” относится к производному активного соединения (лекарственного средства), которое подвергается превращению в условиях применения, такого как в организме, высвобождая при этом активное лекарственное средство. Пролекарства являются зачастую, но не обязательно, фармакологически неактивными до тех пор, пока не превратятся в активное лекарственное средство. Пролекарства обычно получают маскированием функциональной группы в лекарственном средстве, которая, как полагают, является отчасти необходимой для проявления активности пролекарственной группой (определенной ниже) с образованием предшественника, который подвергается превращению, такому как расщепление, в конкретных условиях применения, высвобождая при этом функциональную группу и, следовательно, лекарственное средство. Расщепление предшественника может протекать спонтанно, например, путем реакции гидролиза, или оно может быть катализировано или вызываться другим агентом, таким как, например, фермент, источник света, кислота, или изменением или воздействием на физический или относящийся к окружающей среде параметр, такой как изменение температуры. Агент может быть эндогенным по отношению к условиям применения, таким, например, как фермент, присутствующий в клетках, в которые вводят пролекарство, или кислая среда желудка, или он может быть введен экзогенно. В конкретном варианте осуществления, термин пролекарство включает гидрированные изомеры соединений изобретения. Такие гидрированные изомеры, входящие в объем данного изобретения, могут окисляться в физиологических условиях до соответствующей ароматической циклической системы.
Большое разнообразие пролекарственных групп, а также получающихся в результате предшественников, подходящих для маскирования функциональных групп в активных соединениях, для получения пролекарств, известно в данной области. Например, гидроксильные функциональные группы могут быть маскированы в виде сульфонатного, сложноэфирного или карбонатного предшественника, который может быть гидролизован in vitro с получением гидроксильной группы. Функциональную аминогруппу можно маскировать в виде амидного, иминного, фосфинильного, фосфонильного, фосфорильного предшественника, который может быть гидролизован in vivo с получением аминогруппы. Карбоксильную группу можно маскировать в виде сложноэфирного (включая силиловые сложные эфиры и тиоэфиры), амидного или гидразидного предшественника, который может быть гидролизован in vivo с получением карбоксильной группы. Специалистам в данной области очевидны и другие конкретные примеры подходящих пролекарственных групп и соответствующих им предшественников.
“Пролекарственная группа” относится к типу защитной группы, которая, при использовании для маскирования функциональной группы внутри лекарственного средства с образованием предшественника, превращает лекарственное средство в пролекарство. Пролекарственные группы обычно присоединяют к функциональной группе лекарственного средства посредством связей, которые могут расщепляться в конкретных условиях применения. Таким образом, пролекарственная группа представляет собой ту часть предшественника, которая отщепляется, высвобождая функциональную группу в конкретных условиях применения. В качестве конкретного примера, амидный предшественник формулы -NH-C(O)CH3 содержит пролекарственную группу -C(O)CH3.
“Силиловый простой эфир” относится к типу защитной группы, которая, при использовании для маскирования гидроксильной группы внутри лекарственного средства с образованием предшественника, превращает лекарственное средство в пролекарство. Силиловые простые эфиры известны в данной области и относятся к удаляемой группе, которая предотвращает участие гидроксигруппы в реакции, осуществляемой в молекуле. Такие группы рассмотрены T. W. Greene в главах 2 и 7 “Protective Groups in Organic Synthesis”, John Wiley and Sons, New York, 1981; и J.W. Barton в главе 2 “Protective Groups in Organic Chemistry”, J.F.W. McOmie, ed., Plenum Press, New York, которые включены в настоящее описание во всей своей полноте в виде ссылки. Силиловые простые эфиры включают, например, триметилсилильную, триэтилсилильную, трет-бутилдиметилсилильную и метилдиизопропилсилильную группы.
Термин “замещенный“, при использовании для модификации определенной группы или радикала, означает, что один или несколько водородных атомов определенной группы или радикала, каждый, независимо друг от друга, заменен одинаковыми или различными заместителями. Типичные заместители включают, но ими не ограниваются, -M, -R40, -O–, =O, -OR40, -SR40, -S–, =S, -NR40R41, =NR40, -CM3, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2O–, -S(O)2OH, -S(O)2R40, -OS(O2)O–, -OS(O)2R40, -P(O)(O–)2, -P(O)(OR40)(O–), -OP(O)(OR40))(OR41), -C(O)R40, -C(S)R40, -C(O)OR40, -C(O)NR40R41, -C(O)O–, -C(S)OR40, -NR42C(O)NR40N41, -NR42C(S)NR40R41, -NR42C(NR43)NR40R41 и -C(NR42)NR40N41, где каждый M представляет независимо галоген; R40, R41, R42, R43 и R44, каждый, независимо друг от друга, выбран из группы, состоящей из водорода, алкила, замещенного алкила, алкокси, замещенного алкокси, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, -NR45R46, -C(O)R45 и -S(O)2R45, или, альтернативно, R40 и R41 и/или R45 и R46, взятые вместе с соответствующими атомами азота, с которыми они связаны, образуют циклогетероалкильный или замещенный циклогетероалкильный цикл, как определено выше.
“Сульфамоил“, отдельно или как часть другого заместителя, относится к радикалу формулы -S(O)2NR36R37, где R36 и R37, каждый, независимо друг от друга представляет водород, определенные выше алкил или циклоалкил, или, альтернативно, R36 и R37, взятые вместе с атомом азота, с которым они связаны, образуют определенные выше циклогетероалкильный или замещенный циклогетероалкильный циклы.
7. Соединения
В одном варианте осуществления, соединения данного изобретения представляют собой пиридилзамещенные гетероциклы и гидрированные изомеры цикла В согласно структурной формуле (I):

или их фармацевтически приемлемые соли, их гидраты, сольваты или N-оксиды, где:
цикл B представляет собой ароматическое или неароматическое кольцо, которое содержит от одного до четырех гетероатомов, где
X, Y, Z, каждый, независимо друг от друга, выбран из C, CH, N, NR16, NR18, S или O, при условии, что X и Y, оба, не являются O;
U и T, каждый, независимо друг от друга, выбран из C, CH или N;
Z представляет N или -CH-;
A представляет N или -CR2-;
B представляет N или -CR3-;
D представляет N или -CR4-;
E представляет N или -CR5-;
G представляет N или -CR6-;
J представляет N или -CR14-;
K представляет N или -CR8-;
L представляет N или -CR9-;
M представляет N или -CR10-;
R2 и R6, каждый, независимо друг от друга, выбраны из группы, состоящей из группы, состоящей из водорода, галогена, тора, хлора, алкила, метила, замещенного алкила, алкилтио, замещенного алкилтио, алкокси, метокси, изопропокси, замещенного алкокси, алкоксикарбонила, замещенного алкоксикарбонила, арилалкилоксикарбонила, замещенного арилалкилоксикарбонила, арилоксикарбонила, замещенного арилоксикарбонила, циклогетероалкила, замещенного циклогетероалкила, карбамоила, замещенного карбамоила, галогеналкила, трифторметила, сульфамоила, замещенного сульфамоила и силилового простого эфира, при условии, что один из R2 и R6 является другим, чем водород;
R3 и R5, каждый, независимо друг от друга, выбраны из группы, состоящей из водорода, галогена, хлора, алкила, замещенного алкила, алкилтио, замещенного алкилтио, алкокси, замещенного алкокси, алкоксикарбонила, замещенного алкоксикарбонила, арилалкилоксикарбонила, замещенного арилалкилоксикарбонила, арилоксикарбонила, замещенного арилоксикарбонила, циклогетероалкила, замещенного циклогетероалкила, карбамоила, замещенного карбамоила, галогеналкила, сульфамоила и замещенного сульфамоила;
R4 выбран из группы, состоящей из водорода, галогена, алкила, замещенного алкила, алкилтио, замещенного алкилтио, карбамоила, замещенного карбамоила, алокси, замещенного алкокси, алкосикарбонила, замещенного алкоксикарбонила, арилалкилоксикарбонила, замещенного арилалкилоксикарбонила, арилоксикарбонила, замещенного арилоксикарбонила, диалкиламино, замещенного диалкиламино, галогеналкила, сульфамоила и замещенного сульфамоила;
R7 представляет -NR11C(O)R12;
R8, R9, R10 и R14, каждый, независимо друг от друга, выбраны из группы, состоящей из водорода, галогена и фтора;
R11 представляет водород, алкил или метил; и
R12 представляет замещенный алкил, галогеналкил, галогенметил, дигалогенметил, дихлорметил, циклогетероалкил или замещенный циклогетероалкил;
R16 и R18, каждый, независимо друг от друга, выбраны из группы, состоящей из водорода, низшего алкила, замещенного низшего алкила, низшего гетероалкила, замещенного низшего гетероалкила, циклоалкила, замещенного циклоалкила, циклогетероалкила, замещенного циклогетероалкила, низшего галогеналкила, моногалогенметила, дигалогенметила, тригалогенметила, трифторметила, низшего алкилтио, замещенного низшего алкилтио, низшего алкокси, замещенного низшего алкокси, метокси, замещенного метокси, низшего гетероалкокси, замещенного низшего гетероалкокси, циклоалкокси, замещенного циклоалкокси, циклогетероалкокси, замещенного циклогетероалкокси, низшего галогеналкокси, моногалогенметокси, дигалогенметокси, тригалогенметокси, трифторметокси, низшего ди- или моноалкиламино, замещенного низшего ди- или моноалкиламино, арила, замещенного арила, арилокси, замещенного арилокси, фенокси, замещенного фенокси, арилалкила, замещенного арилалкила, арилалкилокси, замещенного арилалкилокси, бензила, бензилокси, гетероарила, замещенного гетероарила, гетероарилокси, замещенного гетероарилокси, гетероарилалкила, замещенного гетероарилалкила, гетероарилалкилокси, замещенного гетероарилалкилокси, карбоксила, низшего алкоксикарбонила, замещенного низшего алкоксикарбонила, арилоксикарбонила, замещенного арилоксикарбонила, арилалкилоксикарбонила, замещенного арилалкилоксикарбонила, карбамата, замещенного карбамата, карбамоила, замещенного карбамоила, сульфамоила, замещенного сульфамоила и группы формулы -L-R17, где “L” представляет собой линкер и R17 представляет собой циклоалкил, замещенный циклоалкил, циклогетероалкил или замещенный циклогетероалкил.
при условии, что
(i) по крайней мере, один из A, B, D, E, G, J, K, L или M представляет собой N;
(ii) не более чем один из A, B, D, E или G представляет собой N; и
(iii) не более чем один из J, K, L или M представляет собой N.
В другом варианте осуществления соединения данного изобретения представляют собой пиридилзамещенные тиазолы и гидрированные изомеры цикла В в соответствии со структурной формулой (II):
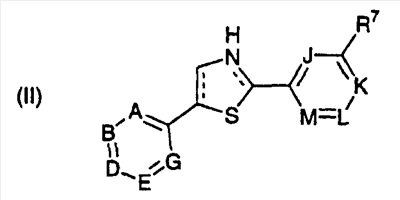
или их фармацевтически приемлемые соли, их гидраты, сольваты или N-оксиды, где A, B, D, E, G, J, K, L, M и R7 являются такими, как определено выше для структурной формулы (I), и подчиненные тем же самым условиям, и —- означает либо ароматическое, либо неароматическое (гидрированный изомер) гетероциклическое кольцо.
В одном варианте осуществления соединений структурной формулы (I), Z представляет -CH-, так что соединения представляют собой изоксазолы или пиразолы. В другом варианте осуществления соединений структурной формулы (I), Z представляет N, так что соединения представляют собой оксадиазолы или азолы. В другом варианте осуществления соединения структурной формулы (I) представляют собой изоксазолы. В конкретном варианте осуществления изоксазолов X представляет N и Y представляет O. В следующем варианте осуществления соединения структурной формулы (I) являются оксадиазолами.
В одном варианте осуществления соединений структурных формул (I) и (II), A, B, D, E или G представляет N и один из J, K, L или M представляет N. В другом варианте осуществления, один из A, B, D, E или G представляет N и ни один из J, K, L или M не является N. В следующем варианте осуществления ни один из A, B, D, E или G не является N и один из J, K, L или M представляет N. Предпочтительно, в любом из вышеописанных вариантов осуществления соединений формулы (I) и/или (II), R7 представляет -NR11C(O)R12, где R11 представляет водород или метил и R12 представляет -CHCl2.
В другом варианте осуществления соединений структурных формул (I) и (II), A представляет -CR2-, G представляет -CR6– и R7 представляет -NR11C(O)R12, где R11 представляет водород или метил и R12 представляет -CHCl2. В другом конкретном варианте осуществления B представляет -CR3-, D представляет N, E представляет -CR5-, J представляет -CR14-, K представляет -CR8-, L представляет -CR9-, M представляет -CR10-, и R3, R5, R9, R10 и R14, каждый, представляет водород. В следующем другом конкретном варианте осуществления B представляет -CR3-, D представляет -CR4-, E представляет -CR5-, J представляет -CR14-, K представляет -CR8-, L представляет -CR9-, M представляет N, и R3, R4, R5, R8, R9 и R14, каждый, представляет водород. В очередном другом конкретном варианте осуществления B представляет -CR3-, D представляет -CR4-, E представляет -CR5-, J представляет -CR14-, K представляет -CR8-, L представляет N, M представляет -CR10-, и R3, R4, R5, R8, R10 и R14, каждый, представляет водород. Предпочтительно, в указанном выше варианте осуществления, R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из хлора, фтора, метила, трифторметила, тиометила, метокси, изопропокси, N-морфолино и N-морфолиносульфамоила. Более предпочтительно, R2 и R6, каждый, независимо друг от друга, выбраны из группы, состоящей из хлора, фтора, метила, трифторметила, метокси и изопропокси. В другом варианте осуществления, R2 и R6, каждый, представляет одинаковые или различные галогены. Предпочтительно, в указанных выше вариантах осуществления, X представляет N, Y представляет O и Z представляет -CH-.
В следующем варианте осуществления соединений структурных формул (I) и (II) A представляет -CR2-, G представляет -CR6– и R7 представляет -NR11C(O)R12, где R11 представляет водород или метил и R12 представляет -CH2I. Предпочтительно, R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из хлора, фтора, метила, трифторметила, тиометила, метокси, изопропокси, N-морфолино и N-морфолиносульфамоила. Более предпочтительно, R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из хлора, фтора, метила, трифторметила, метокси и изопропокси. В другом варианте осуществления R2 и R6, каждый, является одинаковым или различным галогеном. Предпочтительно, в указанных выше вариантах осуществления, X представляет N, Y представляет O и Z представляет -CH-.
В следующем варианте осуществления соединений структурных формул (I) и (II) A представляет -CR2-, B представляет -CR3-, R7 представляет -NR11C(O)R12, где R11 представляет водород или метил и R12 представляет -CHCl2. В другом конкретном варианте осуществления D представляет -CR4-, G представляет -CR6-, E представляет -CR5-, J представляет -CR14-, K представляет -CR8-, L представляет -CR9-, M представляет N, и R4, R5, R6, R8, R9 и R14, каждый, представляет водород. В следующем другом конкретном варианте осуществления D представляет -CR4-, G представляет -CR6-, E представляет -CR5-, J представляет -CR14-, K представляет -CR8-, L представляет N, M представляет -CR10-, и R4, R5, R6, R8, R10 и R14, каждый, представляет водород. Предпочтительно, R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из хлора, фтора, метила, трифторметила, тиометила, метокси, изопропокси, N-морфолино и N-морфолиносульфамоила. Более предпочтительно, R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из дополнительного хлора, фтора, метила, трифторметила, метокси, изопропокси. В другом варианте осуществления, R2 и R6, каждый, является одинаковым или различным галогеном. Предпочтительно, в указанных выше вариантах осуществления, X представляет N, Y представляет O и Z представляет -CH-.
В следующем варианте осуществления соединений структурных формул (I) и (II) A представляет -CR2-, G представляет -CR6– и R2 и R6 являются идентичными, при условии, что они не являются водородом. В другом варианте осуществления A представляет -CR2-, B представляет -CR3– и R2 и R3 являются идентичными, при условии, что они не являются водородом. В следующем варианте осуществления B представляет -CR3-, E представляет -CR5– и R3 и R5 являются идентичными, при условии, что они не являются водородом. В следующем варианте осуществления B представляет -CR3-, D представляет -CR4-, E представляет -CR5-, J представляет -CR14-, K представляет -CR8-, и R3, R4, R5, R8 и R14, каждый, представляет водород. В следующем варианте осуществления D представляет -CR4-, E представляет -CR5-, G представляет CR6, J представляет -CR14-, K представляет -CR8-, и R4, R5, R6, R8 и R14, каждый, представляет водород.
В других вариантах осуществления соединения структурной формулы (I) и их гидрированные изомеры цикла В включают цикл С, который представляет пирид-3-ил.
В следующих вариантах осуществления соединения структурной формулы (I) и их гидрированные изомеры цикла В включают цикл С, который представляет собой пирид-4-ил.
В очередных вариантах осуществления соединения структурной формулы (I) представляют собой соединения изоксазола согласно структурным формулам (Ia), (Ib), (Ic), (Id) или (Ie):


или их фармацевтически приемлемые соли, гидраты или сольваты, где X, Y, R2, R6, R11 и R12 являются такими, как определено выше для структурной формулы (I), и —- означает либо ненасыщенную связь (ароматический гетероцикл), либо насыщенную связь (неароматический гетероцикл, например, гидрированный изомер) цикла В.
В одном варианте осуществления соединения структурных формул (Ia), (Ib), (Ic), (Id) и (Ie) имеют, независимо друг от друга, один или несколько признаков, выбранных из группы, состоящей из:
X представляет O и Y представляет N;
X представляет N и Y представляет O;
R11 представляет водород;
R12 представляет дихлорметил;
R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из метила, галогена, фтора, хлора, трифторметила и метокси; и
R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из галогена, фтора и хлора.
В другом аспекте данного изобретения X представляет N, Y представляет O, Z представляет CH, T и U представляют C (изоксазольное кольцо), A представляет -CR2-, G представляет -CR6-.
В следующем аспекте данного изобретения X представляет N, Y представляет O, Z представляет CH, T и U представляют C (изоксазольное кольцо), A представляет -CR2-, G представляет -CR6-, где R6 представляет пиперазин или замещенный пиперазин. Подходящие замещенные пиперазины включают, например,


В очередном аспекте данного изобретения X представляет N, Y представляет O, Z представляет CH2, T и U представляют C (изоксазольное кольцо), A представляет -CR2-, G представляет -C-O-R6-, так что R6 образует сложный эфир, простой эфир или силиловый простой эфир. Подходящие группы R6, которые образуют сложные эфиры, простые эфиры или силиловые простые эфиры, включают, например, алкил, метил, замещенный алкил, алкилтио, замещенный алкилтио, алкокси, метокси, изопропокси, замещенный алокси, алкоксикарбонил, замещенный алкоксикарбонил, арилалкилоксикарбонил, замещенный арилалкилоксикарбонил, арилоксикарбонил, замещенный арилоксикарбонил, циклогетероалкил, замещенный циклогетероалкил, карбамоил, замещенный карбамоил, галогеналкил, трифторметил и силиловый простой эфир.
Иллюстративные соединения данного изобретения представлены на Фиг.1 и в Таблице 1.
Для специалистов в данной области очевидно, что описываемые соединения данного изобретения могут включать функциональные группы, которые могут быть маскированы пролекарственными группами, чтобы создать пролекарства. Такие пролекарства обычно являются, но необязательно, фармакологически неактивными пока не будут превращены в их активную лекарственную форму. В пролекарствах данного изобретения любая доступная функциональная часть может быть маскирована пролекарственной группой с получением пролекарства. В данной области известно значительное число пролекарственных групп, подходящих для маскирования таких функциональных групп, чтобы получить предшественник, который легко расщепляется в желаемых условиях применения.
7.1 Способы синтеза
Соединения данного изобретения могут быть получены синтетическими способами, проиллюстрированными на Фиг. 2-7. Следует иметь в виду, что на Фиг. 2-7, A, B, D, E, G, J, K, L, M и R7 являются такими, как определено выше для структурной формулы (I), и содержат те же самые ограничения.
Исходные вещества, используемые для получения соединений данного изобретения и их полупродуктов, коммерчески доступны или могут быть получены известными синтетическими способами (см., например, Harrison et al., “Compendium of Synthetic Organic Methods”, Vols. 1-8, John Wiley and Sons, 1971-1996; “Beilstein Handbook of Organic Chemistry,” Beilstein Institute of Organic Chemistry, Frankfurt, Germany; Feiser et al, “Reagents for Organic Synthesis,” Volumes 1-17, Wiley Interscience; Trost et al., “Comprehensive Organic Synthesis,” Pergamon Press, 1991; “Theilheimer’s Synthetic Methods of Organic Chemistry,” Volumes 1-45, Karger, 1991; March, “Advanced Organic Chemistry,” Wiley Interscience, 1991; Larock “Comprehensive Organic Transformations,” VCH Publishers, 1989; Paquette, “Encyclopedia of Reagents for Organic Synthesis,” John Wiley & Sons, 1995). Другие способы синтеза описываемых соединений и/или исходных продуктов либо описаны в данной области, либо они являются очевидными для специалистов в данной области. Альтернативы реагентам и/или защитным группам, проиллюстрированным на Фиг.2-7, приведены выше в ссылках и в других кратких руководствах, общеизвестных специалистам в данной области. Рекомендации для подбора подходящих защитных групп можно найти, например, в Greene & Wuts, “Protective Groups in Organic Synthesis,” Wiley Interscience, 1999. Соответственно, представленные в данном описании способы и стратегия синтеза соединений носят скорее иллюстративный, чем исчерпывающий характер.
Один способ синтеза замещенных изоксазолов в соответствии со структурной формулой (I) (когда Z представляет -CH-), представлен на Фиг.2A. Ссылаясь на Фиг.2A, альдольная конденсация метилкетона 201 с бензальдегидом 203 в щелочных условиях с последующей дегидратацией in situ, дает  – – ненасыщенный енон 205, который может быть легко превращен в изоксазол 207 обработкой гидроксиламином. Восстановление 207 дает аминоизоксазол 209, который может быть превращен в конечный продукт 211 различными способами, известными специалистам в данной области. Конкретным иллюстративным примером способа синтеза Фиг.2А является получение изоксазола 9, представленное на Фиг.2В. ненасыщенный енон 205, который может быть легко превращен в изоксазол 207 обработкой гидроксиламином. Восстановление 207 дает аминоизоксазол 209, который может быть превращен в конечный продукт 211 различными способами, известными специалистам в данной области. Конкретным иллюстративным примером способа синтеза Фиг.2А является получение изоксазола 9, представленное на Фиг.2В.
Другой способ синтеза замещенных изоксазолов структурной формулы (I) (когда Z представляет -CH-) представлен на Фиг.3A. Конденсация по Кляйзену метилкетона 201 со сложным эфиром 223 в щелочных условиях дает 1,3-дикетон 229, который может быть превращен в смесь изоксазолов 207 и 231 обработкой гидроксиламином. Как и выше, восстановление 207 дает аминоизоксазол 209, который может быть превращен в изоксазол 211 известными синтетическими способами. Следует отметить, что изоксазол 231 может быть превращен в соответствующий региоизомер изоксазола 211 тем же самым синтетическим путем. Конкретным иллюстративным примером способа синтеза Фиг.3А является получение изоксазола 9, представленное на Фиг.3В.
В альтернативном варианте осуществления синтеза, проиллюстрированном на Фиг.3A, сложный эфир 225 конденсируют с метилкетоном 227, получая 1,3-дикетон 229, который затем проводят через оставшуюся часть описанного выше синтетического пути.
Следующий способ синтеза замещенных изоксазолов структурной формулы (I) (когда Z означает -CH-) представлен на Фиг.4A. Нуклеофильное присоединение гидроксиламина к бензальдегиду 245 дает промежуточный оксим, который может быть превращен обработкой N-хлорсукцинимидом (NCS) в  -хлороксим 247. Дегидрогалогенирование -хлороксим 247. Дегидрогалогенирование  -хлороксима 247 дает неустойчивый илид, который подвергают реакции 1,3-диполярного циклоприсоединения к ацетилену 249 с получением желаемого изоксазола 211. Ацетилен 249 можно легко получить из коммерчески доступных предшественников известными синтетическими способами. -хлороксима 247 дает неустойчивый илид, который подвергают реакции 1,3-диполярного циклоприсоединения к ацетилену 249 с получением желаемого изоксазола 211. Ацетилен 249 можно легко получить из коммерчески доступных предшественников известными синтетическими способами.
Конкретным иллюстративным примером способа синтеза Фиг.4А является получение изоксазола 9, представленное на Фиг.4В. Фиг.4C иллюстрирует получение ацетилена 255, представленного на Фиг.4B. Аналогичные способы могут быть использованы для получения других соединений пиридилацетилена.
Следующий способ синтеза замещенных изоксазолов структурной формулы (I) (когда Z означает -CH-) представлен на Фиг.5A. Нуклеофильное присоединение гидроксиламина к бензальдегиду 245 дает промежуточный оксим, который может быть непосредственно превращен в илид 257 с NaOCl. 1,3-Диполярное циклоприсоединение илида 257 к метилкетону 259 дает желаемый изоксазол 211. Метилкетон 259 можно легко получить из коммерчески доступных предшественников известными синтетическими способами. Конкретным иллюстративным примером способа синтеза Фиг.5А является получение изоксазола 9, представленное на Фиг.5В.
Способы, представленные на Фиг.2-5 выше, могут быть легко адаптированы для синтеза пиразолов заменой в последовательности реакций гидроксиламина гидразином. Кроме того, для специалистов в данной области очевидно, что региоизомеры изоксазолов, изображенных на вышеуказанных Фиг.2-5, могут быть синтезированы простым обменом реакционноспособных функциональных групп двух различных ароматических колец. Пример такого подхода изображен на Фиг.4D для “обращенного” изоксазола 262. Как можно видеть на Фиг.4D, взаимообмен функциональных групп хлороксима и алкина двух различных ароматических колец (т.е. цикла A и C) дает региоизомерный изоксазол 262 (сравни 253 и 255 с 254 и 256). Кроме того, некоторые схемы синтеза могут обеспечить непосредственно оба региоизомера изоксазола (например, Фиг.3A и 3B), которые могут быть отделены друг от друга, используя стандартные методы разделения.
Один способ синтеза замещенных оксадиазолов структурной формулы (I) (когда Z представляет -N-) представлен на Фиг.6A. Ссылаясь на Фиг.6A, нуклеофильное присоединение гидроксиламина к фенилцианиду 265 дает  -аминооксим 267, который может быть конденсирован с хлорангидридом уксусной кислоты 269 с получением оксадиазола 271 после циклодегидратации и восстановления. Аминооксадиазол 271 может быть превращен различными способами, известными специалистам в данной области, в конечный продукт 273. Конкретным иллюстративным примером способа синтеза Фиг.6А является получение оксадиазола 283, представленное на Фиг.6В. -аминооксим 267, который может быть конденсирован с хлорангидридом уксусной кислоты 269 с получением оксадиазола 271 после циклодегидратации и восстановления. Аминооксадиазол 271 может быть превращен различными способами, известными специалистам в данной области, в конечный продукт 273. Конкретным иллюстративным примером способа синтеза Фиг.6А является получение оксадиазола 283, представленное на Фиг.6В.
Другой способ синтеза замещенных оксадиазолов структурной формулы (I) (когда Z означает -N-), которые представляют собой региоизомеры полученных выше оксадиазолов, представлен на Фиг.7A. Ссылаясь на Фиг.7A,  -аминооксим 287 (полученный конденсацией гидроксиламина с фенилцианидом) может быть конденсирован с хлорангидридом уксусной кислоты 285 с получением оксадиазола 289 после циклодегидратации и восстановления. Аминооксадиазол 289 может быть превращен в конечный продукт 291 различными способами, известными специалистам в данной области. Конкретным иллюстративным примером способа синтеза Фиг.7А является получение оксадиазола 301, представленное на Фиг.7В. -аминооксим 287 (полученный конденсацией гидроксиламина с фенилцианидом) может быть конденсирован с хлорангидридом уксусной кислоты 285 с получением оксадиазола 289 после циклодегидратации и восстановления. Аминооксадиазол 289 может быть превращен в конечный продукт 291 различными способами, известными специалистам в данной области. Конкретным иллюстративным примером способа синтеза Фиг.7А является получение оксадиазола 301, представленное на Фиг.7В.
Следует отметить, что способы, представленные на Фиг.6 и 7 выше, могут быть легко адаптированы для синтеза триазолов заменой в изображенных последовательностях реакций гидроксиламина гидразином. Триазолы структурной формулы (II) можно получить путем стандартной методики адаптации способов, описанных на Фиг.2-7, или другими известными способами.
7.2 Испытания на модуляцию HCV
Соединения данного изобретения являются сильнодействующими ингибиторами репликации и/или пролиферации HCV. Активность соединений данного изобретения может быть подтверждена в анализах in vitro, подходящих для измерения ингибирования репликации или пролиферации вируса или ретровируса. Такие испытания известны в данной области. Конкретный пример анализа репликона, подходящего для подтверждения активности определенных соединений, рассматривается в разделе “Примеры”. Альтернативно, активность соединений может быть подтверждена, используя количественный метод вестерн-блоттинга с использованием меченых антител, специфичных для белков HCV. Другой анализ, который может быть использован для подтверждения активности различных соединений данного изобретения против HCV, описан в Fournier et al., 1998; J. Gen. Virol. 79(10):2367-2374, содержание которого включено в настоящее описание в виде ссылки. Согласно этому методу гепатоциты могут быть исследованы в присутствии и отсутствии конкретного испытуемого соединения и определены IC50 соединения.
Обычно, активными соединениями являются соединения, которые демонстрируют в конкретном испытании IC50 (например, концентрация соединения, которая дает уменьшение репликации на 50% или уменьшение на 50% количества измеряемого белка HCV) в пределах около 1 мМ или менее. Соединения, которые демонстрируют IC50, например, в пределах около 100 мкМ, 10 мкМ, 1 мкМ, 100 нМ, 10 нМ, 1 нМ или даже ниже, являются особенно полезными в качестве терапевтических средств или профилактических средств для лечения или профилактики инфекционных заболеваний, вызванных HCV. Альтернативно, активными соединениями являются соединения, которые демонстрируют LD50 (т.е. концентрация соединения, которая убивает 50% вируса) в пределах около 1мМ или менее. Соединения, которые демонстрируют более низкую LD50, например, в пределах около 100 мкМ, 10 мкМ, 1 мкМ, 100 нМ, 10 нМ, 1 нМ или даже ниже, являются особенно полезными в качестве терапевтических средств или профилактических средств для лечения или профилактики инфекционных заболеваний, вызванных HCV.
7.3 Применения и введение
Благодаря своей способности ингибировать репликацию и/или пролиферацию HCV, соединения данного изобретения и/или композиции на их основе могут иметь ряд применений. Например, соединения данного изобретения могут быть использованы в качестве контролей в анализах in vitro для идентификации дополнительных более или менее действующих против HCV соединений. В качестве другого примера, соединения данного изобретения и/или их композиции могут быть использованы в качестве консервантов или дезинфицирующих средств в клинических установках для защиты медицинских инструментов от заражения вирусом HCV. При использовании в этом случае, соединение данного изобретения и/или их композиции можно нанести на инструмент, подлежащий дезинфекции, при концентрации, которая является кратной, например, 1X, 2X, 3X, 4X, 5X или даже выше, измеренной IC50 для соединения.
Соединения данного изобретения и/или их композиции находят конкретное применение в лечении и/или профилактике инфекционных заболеваний, вызванных HCV, у животных и людей. При использовании в этом контексте соединения могут вводиться сами по себе, однако, как правило, их включают в фармацевтическую композицию и вводят в этой форме. Точный состав композиции, который требуется, обычно зависит, наряду с другими факторами, от способа введения и является очевидным для специалистов в данной области. Большое разнообразие подходящих фармацевтических композиций описано, например, в Remington’s Pharmaceutical Sciences, 17th ed., 1989.
Препараты, подходящие для перорального введения, могут состоять из (а) жидких растворов, а именно, в виде эффективного количества активного соединения, суспендированного в разбавителях, таких как вода, физиологический раствор или PEG 400; (b) капсул, саше или таблеток, при этом каждая лекарственная форма содержит заранее определенное количество активного компонента, в виде жидкостей, твердых веществ, гранул или желатина; (c) суспензий в соответствующей жидкости; и (d) подходящих эмульсий. Лекарственные формы в виде таблеток могут включать одно или несколько вспомогательных веществ, выбранных из лактозы, сахарозы, маннита, сорбита, фосфатов кальция, кукурузного крахмала, картофельного крахмала, микрокристаллической целлюлозы, желатина, коллидного диоксида кремния, стеарата магния, стеариновой кислоты, и другие эксципиенты, пигменты, наполнители, связующие, разбавители, буферные средства, увлажняющие средства, консерванты, ароматизаторы, красители, дезинтегрирующие средства, и фармацевтически совместимые носители. Лекарственные формы в виде леденца могут включать активный компонент в корригенте, например, сахарозе, а также пастилки, содержащие активный компонент в инертной основе, такой как желатин и глицерин, или эмульсии, гели сахарозы или аравийской камеди, и т.п., содержащие, помимо активного компонента, носители, известные в данной области.
Выбранное соединение, само по себе или в комбинации с другими подходящими компонентами, может быть включено в составы аэрозоля (т.е. они могут быть распылены), которые вводят путем ингаляции. Аэрозольные составы могут быть помещены в находящиеся под давлением приемлемые пропелленты, такие как дихлордифторметан, пропан, азот и т.п.
Подходящие препараты для ректального введения включают, например, суппозитории, которые состоят из нуклеиновой кислоты, объединенной с основой суппозитория. Подходящие основы для суппозитория включают природные или синтетические триглицериды или парафиновые углеводороды. Кроме того, возможно также использование желатиновых ректальных капсул, которые состоят из комбинации выбранного соединения с основой, включая, например, жидкие триглицерилы, полиэтиленгликоли и парафиновые углеводороды.
Препараты, подходящие для парентерального введения, например, такими путями как внутрисуставный, внутривенный, внутримышечный, внутридермальный, внутрибрюшинный и подкожный, включают водные и неводные, изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические факторы и растворенные вещества, которые делают состав изотоническим в отношении крови предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства, солюбилизатоы, загустители, стабилизаторы и консерванты. В практике данного изобретения композиции можно вводить, например, внутривенной инфузией, перорально, местно, интраперитонеально, внутрипузырно или внутриоболочечно. Парентеральное введение, пероральное введение и внутривенное введение представляют собой предпочтительные способы введения. Препараты соединений могут быть представлены в герметизированных контейнерах, содержащих дозу на один прием или многократную дозу, таких как ампулы или флаконы. Растворы и суспензии для инъекций могут быть получены из стерильных порошков, гранул и таблеток описанного выше типа.
Фармацевтический препарат находится предпочтительно в единичной дозированной форме. В такой форме препарат подразделяется на унифицированные дозы, содержащие соответствующие количества активного компонента. Единичная дозированная форма может представлять собой упакованный препарат, при этом каждая упаковка содержит дискретные количества препарата, как, например, таблетки, капсулы в упаковке и порошки в пузырьках и ампулах. Кроме того, единичная дозированная форма может представлять собой капсулу, таблетку, саше или леденец, саму по себе, или она может представлять соответствующее число любых из вышеуказанных форм в упаковке. Композиция может, при желании, также содержать другие совместимые терапевтические средства.
При терапевтическом применении для лечения HCV-инфекции, соединения, используемые в фармацевтическом способе изобретения, вводят пациентам с установленным диагнозом HCV-инфекции, при уровнях доз, подходящих для достижения терапевтической пользы. Под терапевтической пользой подразумевается, что введение соединений окажет благоприятное воздействие на пациента через некоторое время. Например, терапевтическая польза достигается, когда титр или нагрузка HCV у пациента либо уменьшается, либо когда прекращается его увеличение. Терапевтическая польза также достигается, если введение соединение замедляет или останавливает, в целом, начало повреждения органа или проявление других неблагоприятных симптомов, которые обычно сопровождают течение инфекционных заболеваний, вызванных HCV, независимо от титра или нагрузки HCV у пациента.
Соединения данного изобретения и/или композиции на их основе могут также применяться с профилактической целью для пациентов с повышенным риском развития HCV-инфекции, или которые были подвергнуты воздействию HCV, для предотвращения развития HCV-инфекции. Например, соединения данного изобретения и/или композиции на их основе можно вводить работникам больницы, случайно поранившим себя иглами при работе с пациентами HCV, для снижения риска или для того, чтобы избежать в целом, развития инфекционного заболевания, вызванного HCV.
Начальные дозы, подходящие для введения людям, могут быть определены, исходя из анализов in vitro или животных моделей. Например, начальная доза может быть сформулирована как доза, достигшая сывороточной концентрации, которая включает IC50 конкретного соединения, подлежащего введению, определенная в испытании in vitro. Альтернативно, начальная доза для людей может быть основана на дозах, которые, как установлено, являются эффективными на животных моделях HCV-инфекции, как известно в данной области. Иллюстративные подходящие системы моделей описаны в Muchmore, 2001, Immumol. Rev. 183:86-93 and Lanford & Bigger, 2002. Virology 293(i):1-9 и в ссылках, цитируемых там, содержание которых включено в настоящее описание в виде ссылки. В качестве одного примера, начальная доза может находиться в диапазоне от около 0,001 мг/кг до около 1000 мг/кг, ежедневно. Можно также использовать диапазон суточной дозы от около 0,01 мг/кг до около 500 мг/кг, или от около 0,1 мг/кг до около 200 мг/кг, или от около 1 мг/кг до около 100 мг/кг, или от около 10 мг/кг до около 50 мг/кг. Дозы, однако, могут изменяться в зависимости от потребности пациента, тяжести состояния, подлежащего лечению, и соединения, которое будет использовано. Величина дозы также будет определяться наличием, природой и степенью проявления любых неблагоприятных побочных воздействий, которые сопровождают введение отдельному пациенту конкретного соединения. Определение надлежащей дозы для конкретной ситуации находится в пределах квалификации практикующего врача. Как правило, лечение начинают с меньших доз, которые меньше, чем оптимальная доза соединения. Впоследствии дозу увеличивают небольшими приращениями до тех пор, пока не будет достигнуто оптимального эффекта в данных обстоятельствах. Для удобства, при желании, суммарная суточная доза может быть поделена на части и вводиться по частям в течение дня.
7.4 Комбинированная терапия
В некоторых вариантах осуществления настоящего изобретения соединения по данному изобретению и/или композиции на их основе могут быть использованы в комбинированной терапии с, по крайней мере, одним другим терапевтическим средством. Соединение изобретения и/или композиция на его основе и терапевтическое средство могут действовать дополнительно или, более предпочтительно, синергически. В предпочтительном варианте осуществления соединение изобретения и/или композицию на его основе вводят одновременно с введением другого терапевтического средства. В другом варианте осуществления соединение изобретения и/или композицию на его основе вводят до или после введения другого терапевтического средства.
В одном варианте осуществления соединения изобретения и/или композиции на их основе могут быть использованы в комбинированной терапии с другими противовирусными средствами. В одном варианте осуществления изобретения соединения изобретения и/или композиции на их основе могут быть использованы в комбинированной терапии вместе с интерфероном- . В другом варианте осуществления соединения изобретения и/или композиции на их основе могут использоваться в комбинированной терапии с рибаварином и интерфероном- . В другом варианте осуществления соединения изобретения и/или композиции на их основе могут использоваться в комбинированной терапии с рибаварином и интерфероном- . .
8. Примеры
Следующий пример приводится только в качестве иллюстрации, а не ограничения. Для специалистов в данной области очевидно наличие ряда несущественных параметров, которые можно изменять или модифицировать, чтобы получить, по существу, аналогичные результаты.
8.1 Иллюстративные соединения данного изобретения, которые ингибируют трансляцию или репликацию HCV
Ингибирующая активность некоторых иллюстративных соединений данного изобретения подтверждали, используя анализ репликона HCV. Репликон HCV может включать такие признаки, как HCV IRES, нетранслируемую область HCV 3′, отдельные гены HCV, кодирующие полипептиды HCV, селектируемые маркеры и репортерный ген, такой как люцифераза, GFP и т.д. В анализе активно делящиеся 5-2Luc репликон-содержащие клетки засевали при плотности от около 5000 до 7500 клеток/лунка в 96-луночные планшеты (около 90 мкл клеток на лунку) и инкубируют при 37°C и 5% CO2 в течение 24 часов. Затем в каждую лунку добавляли испытуемое соединение (в объеме около 10 мкл) при различных концентрациях и клетки инкубировали в течение дополнительных 24 часов до анализа на люциферазу. Клетки собирали и репликацию или трансляцию HCV контролировали посредством анализа репортерного гена, например, анализа репортера-люциферазы. Среду удаляли с каждой клетки аспирацией и в каждую лунку добавляли реагенты Bright-Glo (Pharmacia, Peapack, NJ) для анализа люциферазы в соответствии с инструкциями производителя. В этом анализе определяли количество испытуемого соединения, которое дает уменьшение эмиссии люциферазы на 50% (IC50).
Некоторые иллюстративные соединения данного изобретения также испытывали на их способность ингибировать репликацию HCV, используя количественный метод Вестерн-блоттинга с использованием антител, специфичных для определенных белков HCV. В этом анализе определяли количество испытуемого соединения, которое дает уменьшение количества определенного белка HCV на 50% по сравнению с контрольным образцом (IC50).
Результаты анализов репликона и методом Вестерн-блоттинга приведены в Таблице 1, ниже. Структуры указанных соединений представлены на Фиг.1. В Таблице 1, значение “+” означает IC50 10 мкМ или менее для определенного анализа; значение “-” означает IC50 более чем 10 мкМ для определенного анализа. Ряд соединений демонстрировали в анализе репликона IC50 в наномолярном диапазоне концентраций.
    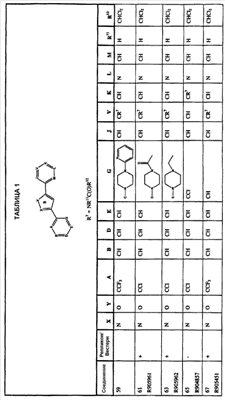 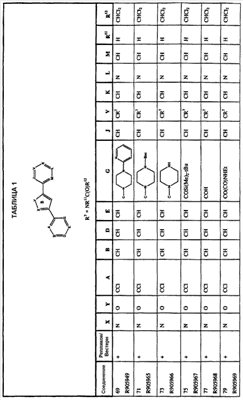  
Для идентификации неспецифичных ингибиторов репортерного гена использовали скрининг. В скрининге, для идентификации соединений, которые ингибируют репортерный ген, а не HCV, использовали клеточную линию, несущую конструкцию, такую как CMV-активированный ген люцеферазы. В анализе ингибирования люцеферазы методом скрининга для многих соединений значения IC50 оказались более чем 10 мкМ. Для определения цитотоксичности соединений данного изобретения использовали методы стандартной клеточной пролиферации. Измеренные значения LD50 для многих соединений оказались больше 10 мкМ, которые подтвердили, что результаты отражают снижение продуцирования вируса, а не гибель клеток.
TaqMan RT-PCR анализ (Roche Molecular Systems, Pleasanton, CA) использовали для исследования количества копий РНК HCV, который подтвердил, что геном вируса не реплицируется. Активно делящиеся 9-13 репликон-содержащие клетки высевали при плотности 3×104 клеток/лунка в объеме 1 мл/лунка в 24-луночные планшеты. Затем клетки инкубировали при 37°C и 5% CO2 в течение 24 часов. Через 24 часа после посева клеток в каждую лунку добавляли соединения при различных концентрациях (в объеме 10 мкл). Клетки инкубировали с соединениями в течение еще 24 часов, среду удаляли аспирацией и из каждой лунки получали пробы РНК. Одностадийный TaqMan RT-PCR осуществляли, используя свежеполученные пробы РНК в соответствии с инструкцией производителя. Отношение РНК HCV к клеточной РНК GAPDH использовали в качестве индикатора специфичности ингибирования HCV и для подтверждения того, что геном вируса не реплицировался.
8.2 Соединения нетоксичны на клеточных и животных моделях
8.2.1 Цитотоксичность
Соединения 1, 3, 7, 9, 11, 13, 17, 19, 21, 27, 29, 31, 33, 35, 37, 39, 47, 49, 51, 57 и 69 испытывали в анализе на цитотоксичность в отношении клеток печени, включающих репликон HCV (5-2 Luc клетки, 9-13 клетки или Huh-7 клетки). В этом анализе клетки засевали в 96-луночные планшеты (приблизительно 7500 клеток/лунка в объеме 90 мкл) и культивировали в течение 24 час при 37°C. На день 2 в лунки добавляли различные концентрации испытуемого соединения (в объеме 10 мкл) и клетки культивировали в течение дополнительных 48 ч при 37°C. На день 4 осуществляли анализ АТФ-зависимой R-Люциферазы (определение клеточного титра по Glo), чтобы определить количество жизнеспособных клеток. За исключением соединений 13, 19 и 57, все испытуемые соединения показали IC50 более чем или равную 10 мкМ, подтверждая, что соединения являются нетоксичными. Из оставшихся соединений, все, кроме соединения 13, которое показало IC50 3 мкМ, имели IC50 более чем 5 мкМ, демонстрируя, что эти соединения к тому же хорошо переносятся.
8.3 Синтез соединений
8.3.1 Соединения 3 (R909794) и 9 (R909921)
Стадия A
В соответствии с Фиг.4C соединение 230 (25 г, 98,1 ммоль) добавляют к 96% H2SO4 (50 мл) при 0°C с последующим добавлением 96% HNO3 (17,5 мл) и полученную смесь нагревают при 130°C в течение 3 часов. Реакционную смесь охлаждают, затем выливают в лед, добавляют карбонат натрия, чтобы вызвать образование осадка (pH>7). Продукт выделяют фильтрованием, промывают водой и сушат, получая желтое твердое вещество 232 (17,0 г, 79%).
Стадия В
К соединению 232 (17 г, 78 ммоль) в CHCl3 (200 мл) добавляют PBr3 (7,4 мл) и полученную смесь кипятят с обратным холодильником в течение около 1 часа или до завершения реакции, ход которой контролируют методом тонкослойной хроматографии. Реакционную смесь охлаждают, бóльшую часть растворителя удаляют при пониженном давлении и остаток выливают на лед, получая желтое твердое вещество. Продукт выделяют фильтрованием, получая 234 (14,5 г, 92%).
Стадия С
К смеси 234 (6 г, 0,029 моль), PdCl2(Ph3)2 (620 мг, 3 мол.%), CuI (338 мг, 6 мол.%) в атмосфере азота добавляют диизопропилэтиламин (100 мл). Полученную смесь перемешивают при температуре окружающей среды в течение нескольких минут до введения TMS-ацетилена (6,3 мл, 1,5 экв.). Затем содержимое нагревают при 60°C в течение 24 часов. Растворитель удаляют при пониженном давлении и неочищенный продукт фильтруют через колонку с силикагелем (смесь гексаны:EtOAc 10:1), получая 236 в виде желтого твердого вещества, 4,9 г (76%).
Стадия D
Смесь соединения 236 (1,4 г), порошка Fe (3,55 г, 10 экв.), концентрированной HCl (1 мл) и метанола (100 мл) кипятят с обратным холодильником в течение 3 часов. После охлаждения реакционную смесь фильтруют, раствор концентрируют, остаток разбавляют NaHCO3 и экстрагируют EtOAc (несколько раз). Объединенные экстракты EtOAc сушат, фильтруют и концентрируют, получая неочищенный продукт (1,0 г) в виде смеси 238 и десилилированного (не содержащего TMS-группу) продукта 240. Маслянистую смесь растворяют в метаноле (100 мл) и обрабатывают K2CO3 (приблизительно 2 экв.). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь концентрируют в вакууме. Остаток растворяют в EtOAc, промывают водой, сушат, фильтруют и концентрируют в вакууме. Получают продукт 240 (513 мг) в виде темно-пурпурного масла.
Стадия Е
Соединение 240 (513 мг) растворяют в сухом дихлорметане (50 мл) и добавляют в атмосфере азота Et3N (0,786 мл, 1,3 экв.). Смесь охлаждают на бане со льдом и по каплям добавляют раствор хлорангидрида дихлоруксусной кислоты (0,483 мл, 1,1 экв.) в сухом дихлорметане (5 мл). Реакционной смеси дают возможность нагреться до комнатной температуры в течение 6 часов и затем разбавляют EtOAc, промывают насыщенным бикарбонатом натрия, сушат, фильтруют и концентрируют в вакууме. Неочищенный продукт пропускают через слой силикагеля, элюируют смесью гексаны/EtOAc, 1:1. Фракции концентрируют, получая пурпурное масло, которое отверждалось при высоком вакууме, давая соединение 255 (658 мг).
Стадия F
Хлороксим 2-фтор-6-трифторметилбензальдегида (645 мг, 1,1 экв.) и соединение 255 (658 мг) растворяют в сухом ТГФ (30 мл) и добавляют Et3N (0,521 мл, 1,3 экв.). Смесь перемешивают при комнатной температуре в течение 1 часа и затем кипятят с обратным холодильником в течение 5 часов до завершения реакции. Растворитель удаляют в вакууме, остаток растворяют в EtOAc, промывают водой, промывают насыщенным хлоридом натрия, сушат, фильтруют и концентрируют. Неочищенный продукт очищают хроматографией (смесь 3:2 гексаны:EtOAc), получая соединение 3 (800 мг). Соединение 9 получают аналогичным образом из хлороксима 2,6-дихлорбензальдегида и 255.
8.3.2 Синтез соединения 49 (R905952)
Получение 3-(2-метокси-6-трифторметилфенил)-5-(4-аминопиридил)изоксазола
К раствору N-гидрокси-(2-метокси-6-трифторметилбензол)карбоксимидоилхлорида (1 г, 3,94 ммоль) и 4-амино-2-этинилпиридина (310 мг, 2,63 ммоль) в ТГФ добавляют триэтиламин (550 мл, 3,94 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение одного часа и затем кипятят с обратным холодильником в течение трех часов. Смесь охлаждают до комнатной температуры, добавляют этилацетат и воду. Органический слой отделяют, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме, получая неочищенный продукт. Конечный продукт, 3-(2-метокси-6-трифторметилфенил)-5-(4-аминопиридил)изоксазол (609 мг), получают очисткой флэш-хроматографией, используя смесь гексаны:этилацетат (4:1).
ММ=335,28 подтверждена методом ЖХ-МС, tr=8,38 мин. (Методика Y) M+=335,28. ЯМР (300 МГц, CDCl3): 8,24 (м, 1H), 7,48 (м, 1H), 7,4 (м, 1H), 7,26 (м, 1H), 7,2 (м, 1H), 7,0 (с, 1H), 6,6 (м, 1H), 4,8 (шс, 2H), 3,8 (с, 3H).
Получение 2,2-Дихлор-N-[2-[3-(2-метокси-6-трифторметилфенил)-5-изоксазолил]-(4-пиридил)ацетамида
Смесь 3-(2-метокси-6-трифторметилфенил)-5-(4-аминопиридил)изоксазола (609 мг, 1,82 ммоль) и триэтиламина (1,8 мл, 12,9 ммоль) в дихлорметане охлаждают на бане со льдом. Добавляют по каплям раствор хлорангидрида дихлоруксусной кислоты (1,3 мл, 12,9 ммоль) в дихлорметане. После перемешивания в течение еще одного часа добавляют воду и этилацетат. Органический слой отделяют, промывают насыщенным гидрокарбонатом натрия, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Конечный продукт, 2,2-дихлор-N-[2-[3-(2-метокси-6-трифторметилфенил)-5-изоксазолил]-(4-пиридил)ацетамид (300 мг), получают флэш-хроматографией, используя смесь гексаны:этилацетат (4:1).
MM=446, подтверждена методом ЖХ-МС, tr=9,84 мин. (Методика Y) MH+=447,21. ЯМР (300 МГц, CDCl3): 9,84 (с, 1H), 8,63 (м, 1H), 7,9 (м, 1H), 7,62 (м, 1H), 7,41 (м, 1H), 7,22 (м, 1H), 5,64 (с, 1H), 3,8 (с, 3H).
(Активность: репликон ++)
8.3.3 Синтез соединения 57 (R905948)
Получение 3-(2,2-дихлорацетамидо)-5-этинилпиридина
Смесь 3-амино-5-этинилпиридина (2,73 г, 23,1 ммоль) и триэтиламина (3,54 мл, 25,42 ммоль) в дихлорметане охлаждают на бане со льдом. Добавляют по каплям раствор хлорангидрида дихлоруксусной кислоты (2,57 мл, 25,42 ммоль) в дихлорметане. После перемешивания в течение еще одного часа добавляют воду и этилацетат. Органический слой отделяют, промывают насыщенным гидрокарбонатом натрия, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме, получая 3-(2,2-дихлорацетамидо)-5-этинилпиридин (3,5 г).
ММ=229,31 подтверждена методом ЖХ-МС, tr=9,76 мин. (Методика Y) MH+=230,3. ЯМР (300 МГц, CDCl3): 8,7 (с, 1H), 8,52 (с, 1H), 8,2 (м, 2H), 6,08 (с, 1H), 3,21 (с, 1H).
Получение 2,2-дихлор-N-[3-[3-(2-метокси-6-трифторметилфенил)-5-изоксазолил]-(5-пиридил)ацетамида
К раствору N-гидрокси-(2-метокси-6-трифторметилбензол)карбоксимидоилхлорида (111 мг, 0,44 ммоль) и 3-(2,2-дихлорацетамидо)-5-этинилпиридина (100 мг, 0,44 ммоль) в ТГФ добавляют триэтиламин (0,91 мл, 0,65 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение одного часа и затем кипятят с обратным холодильником в течение трех часов. Смесь охлаждают до комнатной температуры, добавляют этилацетат и воду. Органический слой отделяют, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме, получая неочищенный продукт. Конечный продукт, 2,2-дихлор-N-[3-[3-(2-метокси-6-трифторметилфенил)-5-изоксазолил]-(5-пиридил)ацетамид (103 мг), получают очисткой флэш-хроматографией, используя смесь гексаны:этилацетат (4:1).
ММ=446,31 подтверждена методом ЖХ-МС, tr=13,45 мин. (Методика Y) MH+=7,31. ЯМР (300 МГц, CDCl3): 9,4 (шс, 1H), 9,0 (с, 1H), 8,9 (с, 2H), 7,58 (м, 1H), 7,4 (м, 1H), 7,24 (м, 1H), 6,8 (с, 1H), 6,2 (с, 1H), 3,8 (с, 3H).
(Активность: репликон ++)
8.3.4 Общие синтезы соединений изобретения
Кроме того, соединения данного изобретения можно получить способами, в общих чертах описанных на Фиг. 8-63. Специалист в данной области может легко получить соединения, входящие в объем данного изобретения, исходя из представленных в данном описании рекомендаций, а также иллюстраций, представленных на Фиг. 1-63, ссылок, цитируемых на фигурах, и учитывая экспериментальные методики, предлагаемые в предварительной заявке на патент США 60/467650, поданной 2 мая 2003г. (регистрационный номер в делах поверенного P-71847-2), содержание которых включено в настоящее описание в виде ссылки. Например, см. разделы 5.3 и 6.1 и последующие, касающиеся общего синтеза изомеров не содержащего азот цикла “C”. Пирид-2-ил, пирид-3-ил или пирид-4-ил могут быть использованы в цикле “C” в качестве замены для не содержащих гетероатомы ароматических колец, изображенных там. Кроме того, следует иметь в виду, что для удобства на всех Фиг.1-63 используют изомеры положения цикла “C”. Следует иметь в виду, что пиридильное кольцо может представлять собой либо пирид-2-ил, пирид-3-ил, либо пирид-4-ил. Кроме того, следует иметь в виду, что многие из синтезов касаются цикла “A”, который представляет собой 2,6-дихлорфенил. Последнее носит иллюстративный характер, и, как предполагается, никоим образом не является ограничением.
Исходные вещества, используемые для получения соединений данного изобретения и их полупродуктов, коммерчески доступны или их можно получить известными синтетическим способами (см., например, Harrison et al; “Compendium of Synthetic Organic Methods”, Vols. 1-8 (John Wiley and Sons, 1971-1996); “Beilstein Handbook of Organic Chemistry,” Beilstein Institute of Organic Chemistry, Frankfurt, Germany; Feiser et al., “Reagents for Organic Synthesis,” Volumes 1-21, Wiley Interscience; Trost et al., “Comprehensive Organic Synthesis,” Pergamon Press, 1991; “Theilheimer’s Synthetic Methods of Organic Chemistry,” Volumes 1-45, Karger, 1991; March, “Advanced Organic Chemistry,” Wiley Interscience, 1991; Larock “Comprehensive Organic Transformations,” VCH Publishers, 1989; Paquette, “Encyclopedia of Reagents for Organic Synthesis,” 3d Edition, John Wiley & Sons, 1995). Другие способы синтеза описываемых соединений и/или исходных веществ либо описаны в данной области, либо они очевидны для квалифицированных специалистов в данной области. Альтернативы реагентам и/или защитным группам, проиллюстрированным на Фиг.1-63, можно найти в приведенных выше ссылочных материалах и в других кратких руководствах, известных квалифицированным специалистам в данной области. Рекомендации по подбору подходящих защитных групп можно найти, например, в Greene & Wuts, “Protective Groups in Organic Synthesis,” Wiley Interscience, 1999. Соответственно, представленные в данном описании способы и стратегия синтеза соединений носят скорее иллюстративный, чем исчерпывающий характер.
В частности, способы синтеза замещенных дифенил-содержащих изоксазолов в соответствии со структурной формулой (I) (когда Z означает -CH-) представлены на Фиг. 2А-7b и 12С-12Е.
Фиг.4C, 4D и 15-18, которые описывают получение ацетиленовых соединений, обсуждаются в разделе “Примеры”.
Следует иметь в виду, что на Фиг.1-63 и на протяжении большой части описания, мета-изомеры цикла “C” показаны только в качестве примера. Методология получения орто-, мета- или пара-позиционных изомеров цикла “С” может быть выбрана квалифицированными специалистами в данной области. Поэтому, если на Фиг.1-63 внимание сконцентрировано на получении мета-изомеров цикла “C”, то аналогичная методология может быть использована и для получения орто- или пара-изомеров цикла “С.” Мета-изомер выбран на Фиг. 1-63 для удобства и последовательности изложения, чтобы продемонстрировать возможность получения представляющих интерес соединений.
На фиг.1-63, заместители R2, R3, R4, R5, R6, R8, R9, R10 и R14 могут содержать реакционноспособные функциональные группы, которые требуют защиты во время синтеза. Выбор подходящих защитных групп обычно зависит от природы функциональной группы и применяемого способа синтеза, и этот выбор очевиден для специалистов в данной области. Рекомендации по выбору подходящих защитных групп можно найти у Greene & Wuts, см. выше, и различных других ссылочных материалах, цитируемых в данном описании.
Дополнительные сведения по осуществлению реакций 1,3-диполярного циклоприсоединения, также называемых реакциями 1,3-диполярного присоединения, [3+2] циклизации или [3+2] циклоприсоединения, можно найти в “Cycloaddition Reactions in Organic Synthesis”, (Kobayashi, S. and Jorgensen, K.A., Editors), 2002, Wiley-VCH Publishers, pp. 1-332 pages (specifically, Chapters 6 and 7 on [3+2] cycloadditions and 1,3-dipolar additions, pp. 211-248 and 249-300); “1,3-Dipolar Cycloaddition”, Chemistry of Heterocyclic Compounds, Vol. 59, (Padwa, A. and Pearson, W., Editors), 2002, John Wiley, New York. pp.1-940; “Nitrile Oxides, Nitrones, Nitronates in Organic Synthesis: Novel Strategies in Synthesis”, Torssel, K. B. G., 1988, VCH Publishers, New York, pp. 1-332; Barnes & Spriggs, 1945, J. Am. Chem Soc. 67:134; Anjaneyulu et al., 1995, Indian J. Chem., Sect. 5 34(11):933-938); and T.L. Gilchrist, Pitman Publishing Ltd, 1985 ISBNO-273-02237-7; Strategies for Organic Drug Synthesis and Design, Lednicer, D., John Wiley and Sons, 1998.
Дополнительные сведения по синтезу изоксазолов и их гидрированных изомеров можно найти у M. Sutharchanadevi, R. Murugan in Comprehensive Heterocyclic Chemistry II, A.R. Katritzky, C.W. Rees, E.F.V. Scriven, Eds.; Pergamon Press, Oxford, Vol. 3, p. 221; R. Grünager, P, Vita-Finzi in Heterocyclic Compounds, Vol. 49, Isoxazoles, Part one, John Wiley and Sons, New York, 1991; K.B. G. Torssell, Nitrile Oxides, Nitrones, and Nitronates in Organic Synthesis, VCH Publishers, New York, 1988; Y-Y. Ku, T. Grieme, P. Sharma, Y.-M. Pu, P. Raje, H. Morton, S. King Organic Letters, 2001, 3, 4185; V.G. Desai, S.G. Tilve Synth. Comm., 1999, 29, 3017; X. Wei, J. Fang, Y. Hu, H. Hu Synthesis, 1992, 1205; C. Kashima, N. Yoshihara, S. Shirai Heterocycles, 1981, 16, 145; A.S.R. Anjaneyulu, G.S. Rani, K.G. Annapurna, U.V. Mallavadhani, Y.L.N. Murthy Indian J. Chem. Sect B, 1995, 34, 933; R.P. Barnes, A.S. Spriggs, J. Am. Chem. Soc., 1945, 67, 134; A. Alberola, L. Calvo, A.G. Ortega, M.L. Subada, M.C. Sacudo, S.G. Granda, E.G. Rodriguez Heterocycles, 1999, 51, 2675; X. Wang, J. Tan, K. Grozinger Tetrahedron Lett. 2000, 41, 4713; A.R. Katritzky, M. Wang, S. Zhang, M.V. Voronkov J. Org. Chem., 2001, 66, 6787; J. Bohrisch, M. Pätzel, C. Mügge, J. Liebscher Synthesis, 1991, 1153; SHANKAR, B.B.; Yang, D.Y.; Girton, S.; Ganguly, A.K.; Tetrahedron Lett (TELEAY) 1998, 39(17), 2447-2448. CHENG, W.C.; Wong, M.; Olmstead, M.M.; Kurth, M.J.; Org Lett (ORLEF7) 2002, 4(5), 741-744. KHAN, M.S.Y.; Bawa, S.; Indian J. Chem, Sect B: Org Chem Incl Med Chem (USBDB) 2001, 40(12), 1207-1214. SIMONI, D.; et al; J Med Chem (JMCMAR) 2001, 44(14) 2308-2318. NUGIEL, D.A.; Tetrahedron Lett (TELEAY) 2001, 42(21), 3545-3547. ARAI N.; Iwakoshi, M.; Tanabe, K.; Narasaka, K.; Bull Chem Soc Jpn (BCSJA8) 1999, 72(10), 2277-2285. SAGINOVA, L.G.; Grigorev, E.V.; Chem Heterocyd Compd (NY) (CHCCAL) 1999, 35(2), 244-247. MURI, D.; Bode, J.W.; Carreira, E.M.; Org Lett (ORLEF7) 2000, 2(4), 539-541. KANEMASA, S.; Matsuda, H.; Kamimura, A.; Kakinami, T.; Tetrahedron (TETRAB) 2000, 56(8), 1057-1064. MOCHALOV, S.S.; Kuzmin, Y.I.; Fedotov, A.N.; Trofmova, E.V.; Gazzaeva, R.A.; Shabarov, Y.S.; Zefirov, N.S.; Zh Org Khim (ZORKAE) 1998, 34(9), 1379-1387. DAVIES, C.D.; Marsden, S.P.; Stokes, E.S.E.; Tetrahedron Lett (TELEAY) 1998, 39(46), 8513-8516. KANEMASA, S.; Matsuda, H.; Kamimura, A.: Kakinami, T.; Tetrahedron (TETRAB) 2000, 56(8), 1057-1064. WEIDNER WELLS, M.A.; Fraga Spano, S.A.; Turchi, I.J.; J Org Chem (JOCEAH) 1998, 63(18), 6319-6328. PADMAVATHI, V.; Bhaskar Reddy, A.V.; Sumathi, R.P.; Padmaja, A.; Bhaskar Reddy, D.; Indian J Chem, Sect B: Org Chem Incl Med Chem (IJSBDB) 1998, 37(12), 1286-1289. WILLIAMS, A.R.; Angel, A.J.; French, K.L.; Hurst, D.R.; Beckman, D.D.; Beam, C.F.; Synth Commun (SYNCAV) 1999, 29(11), 1977-1988. CARAMELLA, P.; Reami, D.; Falzoni, M.; Quadrelli, P.; Tetrahedron (TETRAB) 1999, 55(22), 7027-7044. KIDWAJ, M.; Misra, P.; Synth Commun (SYNCAV) 1999, 29 (18), 3237-3250. SYASSI. B.; El Bakkali, B.; Benabdellah, G.A.; Hassikou, A.; Dinia, M.N.; Rivere, M.; Bougrin, K.; Soufiaoui, M.; Tetrahedron Lett (TELEAY) 1999, 40(40), 7205-7209. SYASSI, B.; Bougrin. K.; Soufiaoui. M.; Tetrahedron Lett (TELEAY) 1997, 38(51), 8855-8858. LI, P.; Gi, H.J.; Sun, L.; Zhao, K.; J Org Chem (JOCEAH) 1998, 63(2), 366-369. BOUGRIN, K.; Lamri, M.; Soufiaoui, M.; Tetrahedron Lett (TELEAY) 1998, 39(25), 4455-4458. SRIVASTAVA, Y.K.; Sukhwai, S.; Ashawa, A.; Verma, B.L.; J Indian Chem Soc (JICSAH) 1997, 74(7) 573-574. CORSARO, A.; Buemi, G.; Chiacchio, U.; Pistara, V.; Rescifina, A.; Heterocycles (HTCYAM) 1998, 48(5) 905-918. CORSARO. A.; Librando, V.; Chiacchio, U.; Pistara, V.; Rescifna, A.; Tetrahedron (TETRAB) 1998, 54(31), 9187-9194. CORSARO, A.; Librando, V.; Chiacchio, U.; Pistara, V.; Tetrahedron (TETRAB) 1996, 52(40), 13027-13034. BELENKII, L.I.; Gromova, G.; Lichitshii, B.V.; Krayushkin, M.M.; Izv Akad Nauk, Ser Khim (IASKEA) 1997, (1), 106-109. KASHIMA, C.; Takahashi, K.; Fukuchi, I.; Fukusaka, K.; Heterocycles (HTCYAM) 1997, 44(1) 289-304. BASEL, Y.; Hassner, A.; Synthesis (SYNTBF) 1997, (3), 309-312. BANNIKOV, G.F.; Ershov, V.V.; Nikiforov, G.A.; Izv Akad Nauk. Ser Khim (IASKEA) 1996 (2), 426-429. TOKUNAGA, Y.; lhara, M.; Fukumoto, K.; Heterocycles (HTCYAM) 1996, 43(8), 1771-1775. AHMED, G.A.; J Indian Chem Soc (JICSAH) 1995, 72(3) 181-183. LU, T.J.; Yang, J.F.; Sheu, L.J.; J Org Chem (JOCEAH) 1995, 60(23) 7701-7705. EASTON, C.J.; Hughes, C.M.M.; Tiekink, E.R.T.; Savage, G.P.; Simpson, G.W.; Tetrahedron Lett (TELEAY) 1995, 36(4) 629-632. WALLACE, R.H.; Liu, J.; Tetrahedron Lett (TELEAY) 1994, 35(41) 7493-7496. BALDOLI, C.; Gioffreda, F.; Zecchi, G.; J Heterocycl Chem (JHTCAD) 1994, 31(1), 251-253. WEIDNER WELLS, M.A.; Fraga, S.A.; Demers, J.P.; Tetrahedron Lett (TELEAY) 1994, 35(35), 6473-6476. HANSEN, J.F.; Georgiou, P.J.; J Heterocycl Chem (JHTCAD) 1994, 31(6), 1487-1491. ANKHIWALA, M.D.; Hathi, M.V.; J Indian Chem Soc (JICSAH) 1994, 71(9) 587-589. KAMIMURA, A.; Hori. K.; Tetrahedron (TETRAB) 1994, 50(27) 7969-7980. ABBADY, M.A.; Hebbachy, R.; Indian J Chem, Sect B (IJSBDB) 1993, 32(11), 1119-1124. MORIYA, O.; Takenaka, H.; Iyoda, M.; Urata, Y.; Endo, T.; J Chem Soc, Perkin Trans 1 (JCPRB4) 1994 (4), 413-417. TANAKA, S.; Kohmoto, S.; Yamamoto, M.; Yamada, K.; Nippon Kagaku Kaishi (NKAKB8) 1992 (4), 420-422. NAGARAJAN, A.; Pillay, M.K.; Indian J Chem, Sect B (IJSBDB) 1993, 32(4), 471-474. STOYANOVICH, F.M.; Bulgakova, V.N.; Krayushkin, M.M.; Lzv Akad Nauk SSSR, Ser Khim (IASKA6) 1991 (11), 2606-2611. BALDOLI, C.; Del Buttero, P.; Manorana, S.; Zecchi, G.; Moret, M.; Tetrahedron Lett (TELEAY) 1993, 34(15), 2529-2532. MIZUNO, K.; Ichinose, N.; Tamai, T.; Otsuji, Y.; J Org Chem (JOCEAH) 1992, 57(17), 4669-4675. HUANG, Z.T.; Wang, M.X.; Synth Commun (SYNCAV) 1991, 21, 1167-1176. MOHAMED, T.A.; Kandeel, M.M.; Awad, I.M.A.; Youssef, M.S.K.; Collect Czech Chem Commun (CCCCAK) 1991, 56(12), 2999-3005. MORIYA, O.; Urata, Y.; Endo, T.; J Chem Soc. Chem Commun (JCCCAT) 1991 (13), 884-885. HUANG, Z.T.; Wang, M.X.; Synth Commun (SYNCAV) 1991, 21, 1167-1176. MORIYA. O.; Takenaka, H.; Urata, Y.; Endo, T.; J Chem Soc, Chem Commun (JCCCAT) 1991 (23), 1671-1672. SOUFIAOUI, M.; Syassi, B.; Daou, B.; Baba, N.; Tetrahedron Lett (TELEAY) 1991, 32(30), 3699-3700. SAGINOVA, L.G.; Kukhareva, I.L.; Lebedev, A.T.; Shabarov, YU, S.; Zh Org Khim (ZORKAE) 1991, 27 (9) 1852-1860. KANEMASA, S.; Nishiuchi, M.; WADA, E.; Tetrahedron Lett (TELEAY) 1992, 33(10), 1357-1360. MAMAEVA, O.O.; Krayushkin, M.M.; Stoyanovich, F.M.; Izv Akad Nauk SSSR, Ser Khim (IASKAG) 1990 (4), 913-916. BRTOKHOVETSKII, D.B.; Belenkii, L.I.; Krayushkin, M.M.; Izv Akad Nauk SSSR, Ser Khim (IASKAG) 1990 (7), 1692-1693. ITO, S.; Sato, M.; Bull Chem Soc Jpn (BCSJA8) 1990, 63(9), 2739-2741. MORIYA, O.; Urata, Y.; Endo, T.; J Chem Soc, Chem Commun (JCCCAT) 1991 (1), 17-18. ALMTORP, G.T.; Bachmann, T.L.; Torssell, K.B.G.; Acta Chem Scand (ACHSE7) 1991, 45(2), 212-215. KHAN, M.S.Y.; Khan, M.H.; Kumar, M.; Javed, K.; J Indian Chem Soc (JICSAH) 1990, 67(8), 689-691. KHALIL, Z.H.; Yanni, A.S.; Abdel-Hafez, A.A.; Khalaf, A.A.; J Indian Chem Soc (JICSAH) 1990, 67(10), 821-823. SHIMIZU, T.; Hayashi, Y.; Furukawa, N.; Teramura, K.; Bull Chem Soc Jpn (BCSJA8) 1991, 64(1), 318-320. FADDA, A.A.; Indian J Chem, Sect B (IJSBDB) 1991, 30(8), 749-753, RAMA RAO, K.; Bhanumathi, N.; Srinivasan, T.N.; Sattur, P.B.; Tetrahedron Lett (TELEAY) 1990, 31, 899. ICHINOSE, N.; Mizuno, K.; Yoshida, K.; Otsuji, Y.; Chem Lett (CMLTAG) 1988, 723. SINISTERRA, J.V.; Marinas, J.M.; Bull Soc Chim Belg (BSCBAG) 1987, 96(4), 293. BALABAN, A.T.; Zugravescu, L; Avramovici, S.; Silhan, W.; Monatsh Chem (MOCMB7) 1970, 101, 704. LITINAS, K.E.; Nicolaides, D.N.; Varelia, E.A.; J Heterocycl Chem (JHTCAD) 1990, 27, 769. ICHINOSE. N.; Mizuno, K.; Tamai, T.; Otsuji, Y.; Chem Lett (CMLTAG) 1988, 233. THOSEN, I.; Torsseli, K.B.G.; Acta Chem Scand, Ser B (ACBOCV) 1988, 42, 303. ROCHE; Synthesis (SYNTBF) 1984 (12), 1083. CURRAN, D.P.; J Am Chem Soc (JACSAT) 1983, 105(18), 5826. JAGER, V.; et al.; Bull Soc Chim Belg (BSCBAG) 1983, 92, 1039. RAO, C.J.; Reddy, K.M.; Murthy, A.K.; Indian J Chem, Sect B (IJSBDB) 1981, 20, 282. EIKASABY, M.A.; Salem, M.A.I.; Indian J Chem (IJOCAP) 1950, 19, 571. CHINCHOLKAR, M.M.; Jamoda, V.S.; Indian J Chem (IJOCAP) 1979, 17 610. SHABAROV, Y.S.; Saginova, L.G.; Gazzaeva. R.A.; J Org Chem USSR (Engl Transl) (JOCYA9) 1982, 18, 2319. SHIMIZU, T.; Hayashi, Y.; Yamada, K.; Nishlo, T.; Teramura, K.; Bull Chem Soc Jpn (BCSJA8) 1981, 54, 217. WTTZCAK, Z.; Heterocycles (HTCYAM) 1980, 14, 1319. DEMINA, L.A.; et al.; Zh Org Khim (ZORKAE)1979, 15, 735. CHEM ABSTRA (CHABA8), 91 (74512). ARCHIBALD, A.T.; Nielsen, T.G.; Tetrahedron Lett (TELEAY) 1968, 3375. KOHLER, E.P.; Barrett, G.R.; J Am Chem Soc (JACSAT) 1924, 46, 2105. DEMINA, L.A.; Khismutdinov, G.K.; Tkachev, S.V.; Fainzilberg, A.A.; J Org Chem USSR (Engl Transl) (JOCYA9) 1979, 15, 654. BAAVA, L.N.; Demina, L.A.; Trusova, T.V.; Furin, G.G.; Khisamutdinov, G.K.; J Org Chem USSR (Engl Transl) (JOCYA9) 1979, 15, 2179. CARAMELLA, P.; Cellerino, G.; Houk, K.N.; Albini, F.M.; Santiago, C.; J Org Chem (JOCEAH) 1978, 43, 3007. CARAMELLA, P.; Cellerino, G.; Houk, K.; Albini, F.M.; Santiago, C.; J Org Chem (JOCEAH) 1978, 43, 3006. SAUTER, F.; Buyuk, G.; Monatsh Chem (MOCMB7) 1974, 105, 254. ELKASABY, M.A.; Salem, M.A.I; Indian J Chm (IJOCAP) 1980, 19, 571. BAEVA, L.N.; Demina, L.A.; Trusova, T.V.; Furin, G.G.; Khisamutdinov, G.K.; J Org Chem USSR (Engl Transl) (JOCYA9) 1979, 15, 2179. MAKSOUD, A.A.; Hosnig, G.; Hassan, O.; Shafik, S.; Rev Roum Chim (RRCHAX) 1978, 23, 1541. FUKUNAGA, K.; Synthesis (SYNTBF) 1978, 55. FARAGHER, R.; Gilchrist, T.L.; J Chem Soc, Perkin Trans 1 (JCPRB4) 1977, 1196. BIANCHI, G.; De Micheli, C.; Gandolfi, R.; J Chem Soc, Perkin Trans 1 (JCPRB4) 1976, 1518. LO VECCHIO, G.; Atti Accad Peloritana Periocolanti, CI Sci Fis, Mat Nat (AAPFAO) 1972, 52, 207. JURD, L.; Chem Ind (London) (CHINAG) 1970, 2, 624. BELTRAME, P.L.; Cattania, M.G.; Redaelli, V.; Zecchi, G.; J Chem Soc, Perkin Trans 2 (JCPKBH) 1977, 706. PARK, C.A.; Beam, C.F.; Kaiser, E.M.; Hauser, C.R.; et al.; J Heterocycl Chem (JHTCAD) 1976, 13, 449. LO VECCHIO, G.; Atti Accad Peloritana Pericolanti, CI Sci Fis, Mat Nat (AAPFAO) 1972, 52, 217. BORKHADE, K.T.; Marathey, M.G.; Indian J Chem (IJOCAP) 1970, 8, 796. WAKEFIELD, B.J.; Wright, D.J.; J Chem Soc C (JSOOAX) 1970,1165. UNTERHALT, B.; Pham Zentralhalle (PHZEBE) 1968, 107, 356. NIELSEN, A.T.; Archibald, T.G.; Tetrahedron Lett (TELEAY) 1968, 3375. KIRTZ, D.W.; Shechter, H.; J Chem Soc, Chem Commun (JCCCAT) 1965, 689. JOSHI, K.C.; Jauhar, A.K.; J Indian Chem Soc (JICSAH) 1965, 42, 733. NIELSEN, A.T.; Archibald, T.G.; J Org Chem (JOCEAH) 1969, 34, 984. BATTAGLIA, A.; Dondoni, A.; Rio Sci (RISCAZ) 1968, 38, 201. MONIORTE, F.; Lo Vecchio, G.; Atti Accad Peloritana Periocolanti, CI Sci Fis, Mat Nat (AAPFAO) 1966, 49, 169. ARBASINO, M.; Finzi, P.V.; Rio Sci (RISCAZ) 1966, 36, 1339. ROTH, H.J.; Schwartz, M.; Arch Pharm Ber Dtsch Pharm Ges (APBDAJ) 1961, 294, 769. ROTH, H.J.; Schwarz, M.; Arch Pharm Ber Dtsch Pharm Ges (APBDAJ) 1961, 294, 761. GRUNANGER, P.; Gandini, C.; Quilico, A.; Rend – 1st Lomb Accad Sci Lett, A: Sci Mat, Fis, Chim Geol (RLMAAK) 1959, 93, 467. RUPE, H.; Schneider, F.; Chem Ber (CHBEAM) 1895, 28, 957. BARLUENGA, J.; Aznar, F.; Palomero, M.A.; Chem Eur J (CEUJED) 2001, 7(24), 5318-5324. ASCHWANDEN, P.; Frantz, D.E.; Carreira, E.M.; Org Lett (ORLEF7) 2000, 2(15), 2331-2333. BALASUNDARAM, B.; Veluchamy, T.P.; Velmurugan, D.; Perumal, P.T.; Indian J Chem, Sect B (IJSBDB) 1995, 34 (5), 367-371. CHAN, K.S.; Yeung, M.L.; Chan, W.; Wang, R.-J.; Mak, T.C.W.; J Org Chem (JOCEAH) 1995, 60(6), 1741-1747. CHIACCHIO, U.; Casuscelli, F.; Liguori, A.; Rescifina, A.; Romeo, G.; Sindona, G.; Uccella, N.; Heterocycles (HTCYAM) 1993, 36(3), 585-600. CHAN, K.S.; J Chem Soc, Perkin Trans 1 (JCPRB4) 1991 (10), 2602-2603. LIGUORI, A.; Ottana, R.; Romeo, G.; Sindona, G.; Uccelia, N.; Heterocycles (HTCYAM) 1988, 27, 1365. STAMM, H.; Staudie, H.; Arch Pharm (Weinheim, Ger) (ARPMAS) 1976, 309, 1014. TASZ, M.K.; Plenat, F.; Christau, H.-J.; Skowronski, R.; Phosphorus, Sulfur Silicon Relat Elem (PSSLEC) 1991, 57, 143-146. ALBEROIA, A.; Gonzalez, A.M.; Laguna, M.A.; Pulido, F.J.; Synthesis (SYNTBF) 1982, 1067. JACOB K.C.; Jadhar, G.V.; Vakharia, M.N.; Pesticides (PSTDAN) 1972, 6, 94. CLERICI, F.; Gelmi, M.L; Pini, E.; Valle, M.; Tetrahedron [TETRAB] 2001, 57(25), 5455-5459. JURD, L.; Chem Ind (London) [CHINAG] 1970, 2, 624. JURD, L.; Tetrahedron [TETRAB] 1975, 31, 2884.
Дополнительные сведения по синтезу пиразолов можно найти у J. Elguero in Comprehensive Heterocyclic Chemistry II, A.R. Katritzky, C.W. Reees, E.F.V. Scriven., Eds.; Pergamon Press, Oxford, 1996; Vol. 3, p.1.
Руководство для синтеза соединений, описанных на Фиг.8A и 8B, можно найти у LHOTAK, P.; Kurfuerst, A.; Collect Czech Chem Commun [CCCCAK] 1993, 58 (11), 2720-2728. BRAIN, C.T.; Paul, J.M.; Synlett [SYNLES] 1999, (10), 1642-1644. VARMA, R.S.; Kumar, D.; J Heterocycl Chem [JHTCAD] 1998, 35(6), 1533-1534. FEDYUNYAEVA, I.A.; Yushko, E.G.; Bondarenko, V.E.; Khim Geterotsiki Soedin [KGSSAQ] 1996 (3), 333-337. DOROSHENKO, A.O.; Patsenker, L.D.; Baumer, V.N.; Chepeleva, L.V.; Vankevich, A.V.; Shilo, O.P.; Yarmolenko, S.N.; Shershukov, V.M.; Mitina, V.G.; Ponomarev, O.A.; Zh Obshch Khim [ZOKHA4] 1994, 64(4), 646-652. FEDYUNYAEVA, I.A.; Shershukov, V.M.; Khim Geterotsiki Soedin [KGSSAQ] 1993 (2), 234-237. KLEIN, R.F.X.; Horak, V.; Baker. G.A.S.; Collect Czech Chem Commun [CCCCAK] 1993, 58 (7), 1631-1635. KERR, V.N.; Hayes, F.N.; Ott, D.G.; Lier, R.; Hansbury, E., J Org Chem (JOCEAH] 1959, 24, 1864. NISHIO. T.; Ori, M.; Helv Chim Acta [HCACAV] 2001, 84(8), 2347-2354. LHOTAK, P.; Kurfuerst, A.; Collect Czech Chem Commun [CCCCAK] 1993, 58(11), 2720-2728. SIEGREST, A.E.; Helv Chim Acta [HCACAV] 1967, 50, 906; and GABRIEL, S.; Chem Ber [CHBEAM] 1910, 43, 134.
Руководство для синтеза соединений, описанных на Фиг.9A и 9B, можно найти у ZHANG, P.-F.; Chen, Z.-C; Synthesis (SYNTBF) 2001, (14), 2075-2077. BUTLER, R.N.; Cloonan, M.O.; McMahon. J.M.; Burke, L.A.; J Chem Soc, Perkin Trans 1 (JCPRB4) 1999, (12), 1709-1712. NAKAWISHI, S.; Otsuji, Y.; Nantaku, J.; Chem Lett (CMLTAG) 1983, 341. POCAR, D.; Stradi, R.; Tetrahedron Lett (TELEAY) 1976, 1839. POPILIN, O.N.; Tishchenko, V.G.; Khim Geterotsiki Soedin (KGSSAQ) 1972, 1264; and KUNCKELL, F.; Chem Ber (CHBEAM) 1901, 34, 637.
Руководство для синтеза соединений, описанных на Фиг.10A и 10B, можно найти у VARLAMOV, A.V.; Turchin, K.F.; Chernyshev, A.I.; Zubkov, F.I.; Borisova, T.N.; Chem Heterocycl Compd (N Y) [CHCCAL] 2000, 36 (5), 621-622. CASUSCELLI, F.; Chiacchio, U.; Rescifina, A.; Romeo, R.; Romeo, G.; Tommasini, S.; Uccella, N.; Tetrahedron (TETRAB) 1995, 51 (10), 2979-2990. CHIACCHIO, U.; Casuscelli, F.; Corsaro, A.; Rescifina, A.; Romeo, G.; Uccella, N.; Tetrahedron (TETRAB) 1994, 50 (22), 6671-6680. MUKAI, C.; Kim, I.J.; Cho, W.J.; Kido, M.; Hanaoka, M.; J Chem Soc, Perkin Trans 1 (JCPRB4) 1993 (20), 2495-2503. MINAMI, T.; Isonaka. T.; Okada, Y.; Ichikawa, J.; J Org Chem (JOCEAH) 1993, 58 (25), 7009-7015. TANAKA, K.; Mori, T; Mitsuhashi, K.; Bull Chem Soc Jpn (BCSJA8) 1993, 66 (1), 263-268. HUISGEN, R.; et al.; Tetrahedron Lett (TELEAY) 1960, 12, 5. CHEM BER (CHBEAM) 1968, 101, 2043. CHEM BER (CHBEAM) 1968, 101, 2568. CHEM BER (CHBEAM) 1969, 102, 117. SASAKI, T.; Bull Soc Chim Fr (BSCFAS) 1968, 41, 2960; and SASAKI, T.; Bull Chem Soc Jpn (BCSJA8) 1968, 41, 2964.
Руководство для синтеза соединений, описанных на Фиг.11A и 11B, можно найти у KATRIZKY, A.R.; Qi, M.; Feng, D.; Zhang, G.; Griffith, M.C.; Watson, K.; Org Lett (ORLEF7) 1999, 1 (8), 1189-1191. FRANCIS, J.E.; Cash, W.D.; Barbaz, B.S.; Bernard, P.S.; Lovell, R.A.; Mazzenga, G.C.; Friedmann, R.C.; Hyun, J.L.; Braunwalder, A.F.; Loo, P.S.; Bennett, D.A.; J Med Chem (JMCMAR) 1991, 34 (1), 281-290. POTTS, K.T.; J Chem Soc (JCSOA9) 1954, 3461. EDMHORN, A.; Justus Liebigs Ann Chem (JLACBF) 1905, 343, 207. SHBA, S.A.; El-Khamry, A.A.; Shaban, M.E.; Atia. K.S.; Pharmazie (PHARAT) 1997, 52 (3), 189-194; and MOLINA, P.; Tarranga, A.; Espinosa, A.; Lidon, M.J.; Synthesis (SYNTBF) 1987 (2), 128.
Руководство для синтеза соединений, описанных на Фиг.12A и 12B, можно найти в ASCHWANDEN, P.; Frantz, D.E.; Carreira, E.M.; Org Lett (ORLEF7) 2000, 2 (15), 2331-2333. BALASUNDARAM, B.; Veluchamy, T.P.; Velmurugan, D.; Perumal, P.T.; Indian J Chem, Sect B (IJSBDB) 1995, 34 (5), 367-371. CHAN, K.S.; Yeung, M.L,; Chan, W.; Wang, R.-J.; Mak, T.C.W.; J Org Chem (JOCEAH) 1995, 60(6), 1741 -1747. ALBEROLA, A.; Gonzalez, A.M.; Laguna, M.A.; Pulido, F.J.; Synthesis (SYNTBF) 1982, 1067; and JACOB, K.C.; Jadhar, G.V.; Vakharia, M.N.; Pesticides (PSTDAN) 1972, 6, 94.
Следующие соединения представляют собой типичные примеры данного изобретения. Идентифицированные ниже соединения получают способами, описанными в общих чертах на протяжении всего описания.
Методы определения температуры плавления
Температуры плавления определяют на электротермическом цифровом приборе для определения точки плавления серии IA9100. Все точки плавления приводятся без поправки.
Элементный анализ
Элементный анализ выполняли на приборе Desert Analytics, Tucson, AZ.
Методы ЯМР
ЯМР-спектры получали на приборе Varian Mercury с частотой 300 МГц.
Методы ЖХ-МС
Общие
Анализ методом ЖХ-МС выполняли на приборе Waters Micromass ZQ с электрораспылительной ионизацией. Система ВЭЖХ представляла собой разделительный модуль Waters Model 2690, соединенный с фотодиодным матричным детектором.
Методика W
По этой методике использовали 2,1×250 мм колонку (Alltech) с обращенной фазой C-18 Altima с размером частиц 5 мкМ при объемном расходе 0,25 мл/мин и градиенте 5-85% ацетонитрила с водой, содержащей 0,1% трифторуксусной кислоты на протяжении 36 мин. Затем градиент линейно менялся до 100% ацетонитрила на протяжении 0,5 мин и далее эти условия сохраняли (100% ацетонитрил) на протяжении 3,5 мин.
Методика X
По этой методике использовали 2,1×250 мм колонку (Alltech) с обращенной фазой C-18 Altima с размером частиц 5 мкМ при объемном расходе 0,25 мл/мин и градиенте 5-85% ацетонитрила с водой, содержащей 0,1% трифторуксусной кислоты на протяжении 15 мин. Затем градиент линейно менялся до 100% ацетонитрила на протяжении 0,5 мин и далее эти условия сохраняли (100% ацетонитрил) на протяжении 25 мин.
Методика Y
По этой методике использовали 2,1×150 мм колонку с обращенной фазой C-18 Agilent Zorbax с размером частиц 5 мкМ при объемном расходе 0,3 мл/мин и градиенте 10-100% ацетонитрила с водой, содержащей 0,1% трифторуксусной кислоты на протяжении 16 мин, затем продолжение в течение 2 мин при 100% ацетонитрила.
Методика Z
При этой методике использовали 2,1×5 мм колонку с обращенной фазой C-18 Agilent Zorbax с размером частиц 5 мкМ при объемном расходе 0,5 мл/мин и градиенте 5-100% ацетонитрила с водой, содержащей 0,1% трифторуксусной кислоты на протяжении 8 мин, затем продолжение в течение 2 мин при 100% ацетонитрила.
Соединение 1. (R909850) 2,2-Дихлор-N-[2-[3-(2-хлор-6-фторфенил)-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=401 подтверждена методом ЖХ-МС, tr=32,63 мин (Методика W) MH+=399-403
Соединение 3. (R909794) 2,2-Дихлор-N-[2-[3-(2-фтор-6-трифторметилфенил)-5-изоксазолил]-(4-пиридил)]ацетамид
MM=434 подтверждена методом ЖХ-МС, tr=34,01 мин (Методика W) MH+=432-436
Соединение 5. (R911427) 2,2-Дихлор-N-[2-[3-(2-фтор-6-метоксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид
MM=396 подтверждена методом ЖХ-МС, tr=31,28 мин (Методика W) MH+=394-398
Соединение 7. (R911418) 2,2-Дихлор-N-[5-[3-(2,6-дихлорфенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=417 подтверждена методом ЖХ-МС, tr=33,10 мин (Методика W) MH+=415-419
Соединение 9. (R909921) 2,2-Дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=417 подтверждена методом ЖХ-МС, tr=34,25 мин (Методика W) MH+=415-419
Т.пл.=187-188°C
Соединение 11. (R909833) 2,2-Дихлор-N-[3-[3-[(2,6-дихлор)-4-пиридил]-5-изоксазолил]фенил]ацетамид
ММ=417 подтверждена методом ЖХ-МС, tr=34,13 мин (Методика W) MH+=415-419
Соединение 13. (R909845) 2,2-Дихлор-N-[5-[3-(2-хлор-6-фторфенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=401 подтверждена методом ЖХ-МС, tr=32,55 мин (Методика W) MH+=399-403
Соединение 17. (R911424) 2,2-Дихлор-N-[5-[3-(2-фтор-6-метоксифенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=396 подтверждена методом ЖХ-МС, tr=30,47 мин (Методика W) MH+=394-398
Соединение 19. (R909851) 2,2-Дихлор-N-[2-[3-(2,6-диметилфенил)-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=376 подтверждена методом ЖХ-МС, tr=34,63 мин (Методика W) MH+=374-378
Соединение 21. (R909846) 2,2-Дихлор-N-[5-[3-(2,6-диметилфенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=376 подтверждена методом ЖХ-МС, tr=29,69 мин (Методика W) MH+=374-378
Соединение 27. (R911422) 2,2-Дихлор-N-[5-[3-(2,6-дифторметил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=384 подтверждена методом ЖХ-МС, tr=31,64 мин (Методика W) MH+=382-386
Соединение 29. (R911423) 2,2-Дихлор-N-[5-[3-(2,3-дихлорфенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=417 подтверждена методом ЖХ-МС, tr=34,99 мин (Методика W) MH+=415-419
Соединение 31. (R909864) 2,2-Дихлор-N-[2-[3-(2-морфолино-6-трифторметилфенил])-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=501 подтверждена методом ЖХ-МС, tr=6,97 мин (Методика Z) MH+=499-503
Соединение 33. (R904855) 2,2-Дихлор-N-[3-[3-(3-метил-2-пиридил)-5-изоксазолил]фенил]ацетамид
ММ=362 подтверждена методом ЖХ-МС, tr=30,89 мин (Методика W) MH+=360-364
Соединение 35. (R904800) 2,2-Дихлор-N-[6-[3-(2,6-дихлорфенил)-5-изоксазолил]-(2-пиридил)]ацетамид
ММ=417 подтверждена методом ЖХ-МС, tr=20,74 мин (Методика X) MH+=415-419
Соединение 37. (R909793) 2,2-Дихлор-N-[5-[3-(2-фтор-6-трифторметилфенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=434 подтверждена методом ЖХ-МС, tr=32,79 мин (Методика W) MH+=432-436
Соединение 43. (R909873) 2,2-Дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-[4-(1-оксипиридил)]ацетамид
ММ=433 подтверждена методом ЖХ-МС, tr=6,44 мин (Методика Z) MH+=431-435
Соединение 45. (R909878) 2,2-Дихлор-N-[3-[3-[(3-этоксикарбонил)-2-пиридил]-5-изоксазолил]фенил]ацетамид
ММ=420 подтверждена методом ЖХ-МС, tr=6,65 мин (Методика Z) MH+=418-422
Соединение 47. (R909884) 2,2-Дихлор-N-[2-[3-(2-фтор-6-морфолиносульфамоилфенил)-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=515 подтверждена методом ЖХ-МС, tr=6,32 мин (Методика Z) MH+=513-517
Соединение 49. (R905952) 2,2-Дихлор-N-[2-[3-(2-метокси-6-трифторметилфенил)-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=446 подтверждена методом ЖХ-МС, tr=14,41 мин (Методика Y) MH+=444-448
Соединение 51. (R909909) 2,2-Дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-(4-пиридил)]-N-метилацетамид
ММ=431 подтверждена методом ЖХ-МС, tr=14,99 мин (Методика Y) MH+=429-433
Соединение 53. (R905954) 2,2-Дихлор-N-[2-[3-[2-хлор-6-[4-(N-2-пиридил)пиперазино]фенил])-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=544 подтверждена методом ЖХ-МС, tr=11,81 мин (Методика Y) MH+=542-546
Соединение 57. (R905948) 2,2-Дихлор-N-[5-[3-(2-метокси-6-трифторметилфенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=446 подтверждена методом ЖХ-МС, tr=13,45 мин (Методика Y) MH+=444-448
Соединение 61. (R905961) 2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-ацетил)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=509 подтверждена методом ЖХ-МС, tr=12,11 мин (Методика Y) MH+=507-511
Соединение 63. (R905962) 2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-этил)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=495 подтверждена методом ЖХ-МС, tr=9,48 мин (Методика Y) MH+=493-497
Соединение 65. (R904857) 2,2-Дихлор-N-[5-[3-(2,6-дихлорфенил)-5-изоксазолил]-(2-пиридил)]ацетамид
ММ=417 подтверждена методом ЖХ-МС, tr=35,19 мин (Методика W) MH+=415-419
Соединение 67. (R905451) 2,2-Дихлор-N-[5-[3-(2-трифторметилфенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=416 подтверждена методом ЖХ-МС, tr=13,81 мин (Методика Y) MH+=414-418
Соединение 69. (R905949) 2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-2-пиридил)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=544 подтверждена методом ЖХ-МС, tr=11,29 мин (Методика Y) MH+=542-546
Соединение 71. (R905965) 2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-трет-бутоксикарбонил)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=567 подтверждена методом ЖХ-МС, tr=15,91 мин (Методика Y) MH+=565-569
Соединение 73. (R905966) 2,2-Дихлор-N-[5-[3-(2-хлор-6-пиперазинофенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=467 подтверждена методом ЖХ-МС, tr=9,51 мин (Методика Y) MH+=465-469
Соединение 75. (R905967) 2,2-Дихлор-N-[5-[3-(2-хлор-6-трет-бутилдиметилсилилоксифенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=513 подтверждена методом ЖХ-МС, tr=17,49 мин (Методика Y) MH+=511-515
Соединение 77. (R905968) 2,2-Дихлор-N-[5-[3-(2-хлор-6-гидроксифенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=399 подтверждена методом ЖХ-МС, tr=12,51 мин (Методика Y) MH+=397-401
Соединение 79. (R905969) 2,2-Дихлор-N-[5-[3-(2-хлор-6-N-этилкарбамоилоксифенил)-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=470 подтверждена методом ЖХ-МС, tr=12,85 мин (Методика Y) MH+=468-472
Соединение 81. (R905970) 2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-этилкарбоксамидо)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид
ММ=538 подтверждена методом ЖХ-МС, tr=12,77 мин (Методика Y) MH+=536-540
Соединение 83. (R905971) 2,2-Дихлор-N-[2-[3-(2-хлор-6-трет-бутилдиметилсилилоксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=513 подтверждена методом ЖХ-МС, tr=17,96 мин (Методика Y) MH+=511-515
Соединение 85. (R905973) 2,2-Дихлор-N-[2-[3-(2-хлор-6-N-пропилкарбамоилоксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=484 подтверждена методом ЖХ-МС, tr=13,36 мин (Методика Y) MH+=482-486
Соединение 87. (R905982) 2,2-Дихлор-N-[2-[3-(2-хлор-6-метоксиметоксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=443 подтверждена методом ЖХ-МС, tr=14,65 мин (Методика Y) MH+=441-445
Соединение 89. (R905983) 2,2-Дихлор-N-[2-[3-(2-хлор-6-гидроксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=399 подтверждена методом ЖХ-МС, tr=13,53 мин (Методика Y) MH+=397-401
Соединение 91. (R905984) 2,2-Дихлор-N-[3-[3-[(4-хлор-2-диметиламино)-3-пиридил]-5-изоксазолил]фенил]ацетамид
ММ=426 подтверждена методом ЖХ-МС, tr=13,33 мин (Методика Y) MH+=424-428
Соединение 93. (R905985) 2,2-Дихлор-N-[3-[3-[(2,4-дихлор)-3-пиридил]-5-изоксазолил]фенил]ацетамид
ММ=417 подтверждена методом ЖХ-МС, tr=15,37 мин (Методика Y) МН+=4l5-4l9
Соединение 95. (R905987) 2,2-Дихлор-N-[3-[3-[(2-хлор-4-морфолино)-3-пиридил]-5-изоксазолил]фенил]ацетамид
ММ=468 подтверждена методом ЖХ-МС, tr=13,73 мин (Методика Y) MH+=466-470
Соединение 97. (R909874) 2,2-Дихлор-N-[3-[3-[(6-бром)-2-пиридил]-5-изоксазолил]-(4-пиридил)]ацетамид
ММ=427 подтверждена методом ЖХ-МС, tr=36,03 мин (Методика W) MH+=425-429
(R904871) Гидрохлоридная соль 2,2-Дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-(4-пиридил)]ацетамида
ММ=453
Т.пл=240-241°С
Элементный анализ: C16H10Cl5N2O2, вычислено: C, 42,37; H, 2,22; Cl, 39,09; N, 9,27; найдено: C, 42,51; H, 2,18; Cl, 39,06; N, 9,05
(R909919) Толуолсульфонатная соль 2,2-Дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-(4-пиридил)]ацетамида
ММ=589
Т.пл.=246-247°C
Элементный анализ: C23H17Cl4N3O5S, вычислено: C, 46,88; H, 2,91; N, 7,13; S, 5,44; найдено: C, 47,05; H, 3,06; N, 7,00; S, 5,30
(R909920) Этансульфонатная соль 2,2-Дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-(4-пиридил)]ацетамида
ММ=527
Т.пл.=210-211°C
Элементный анализ: C18H15Cl4N3O5S, вычислено: C, 41,01; H, 2,87; N, 7,97; S, 6,08; найдено: C, 41,00; H, 2,77; N, 7,72; S, 5,80
(R909923) Мононитратная соль 2,2-дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-(4-пиридил)]ацетамида
ММ=480
Т.пл.=175-176°C
Элементный анализ: C16Н10Cl4N4O5, вычислено: C, 40,03; H, 2,10; N, 11,67; найдено: C, 40,33; H, 1,94; N, 11,25
Нижеследующее представляет собой дополнительные экспериментальные приемы синтеза, используемые для получения некоторых соединений данного изобретения.
Способ F (См. Фиг.15)
Стадия 1. Реакции перекрестного ацетиленового сочетания
Соответствующим образом замещенный o-бромнитробензол или замещенный o-иоднитробензол растворяют в подходящем растворителе, таком как п-диоксан или ТГФ, и затем обрабатывают, по крайней мере, пятью молярными эквивалентами подходящего аминного основания, которым может быть триэтиламин, диэтиламин или диизопропилэтиламин. Альтернативно, аминное основание, само по себе, может быть использовано в качестве растворителя. Затем через раствор в течение нескольких минут барботируют поток газа-аргона с последующим добавлением дихлорбис(трифенилфосфин)палладия (II) (3-4 мольных процента), CuI (6-8 мольных процента) и, наконец, триметилсилилацетилена (1,2-1,5 молярных эквивалентов). Затем реакционную смесь нагревают при 50-80°C до тех пор, пока не завершится реакция, ход которой контролируют ТСХ или ЖХ-МС. В тех случаях, когда используют более реакционноспособные замещенные о-иоднитробензолы, указанная выше реакция сочетания может быть осуществлена при комнатной температуре. Если реакция протекает замедленно, добавляют дополнительное количество триметилсилилацетилена. Этот общий способ известен в литературе, как связывание по Sonogashira (K. Sonogashira et.al., Tetrahedron Lett., 1975, 4467). Затем реакционную смесь разбавляют этилацетатом и полученный раствор несколько раз промывают насыщенным раствором соли. Альтернативно, неочищенную реакционную смесь фильтруют через слой целита, затем разбавляют этилацетатом и промывают насыщенным раствором соли. Полученный таким образом органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют досуха при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесями этилацетата и гексанов, с получением желаемых замещенных o-(триметилсилилэтинил)нитробензолов.
Стадия 2. Восстановление нитрогруппы до аминов.
Замещенный o-(триметилсилилэтинил)нитробензол, полученный на стадии 1, растворяют в смеси 10-15 объемных процентов концентрированной хлористоводородной кислоты в метаноле. Затем добавляют порошок железа (Aldrich Chemical Co.) (5-10 молярных эквивалентов) и смесь нагревают при 70-80°C в течение 3-4 ч. Эта реакция может быть сильно экзотермической при проведении ее в большом масштабе. После охлаждения до комнатной температуры реакционную смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении. Остаток растворяют в этилацетате и затем осторожно промывают либо водным гидроксидом натрия, либо водным раствором бикарбоната натрия. Водный слой отбрасывают и органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия, фильтруют и концентрируют досуха при пониженном давлении. При необходимости, неочищенный продукт может быть очищен колоночной хроматографией на силикагеле, элюируя смесями гексанов и этилацетата, с получением желаемых замещенных o-(триметилсилилэтинил)анилинов.
Стадия 3. Удаление триметилсилильной группы из ацетиленов
Замещенный o-(триметилсилилэтинил)анилин, полученный на стадии 2, растворяют в метаноле, содержащем 2-5% воды. Если растворимость анилина в метаноле недостаточна, используют соответствующее количество тетрагидрофурана (ТГФ) в качестве сорастворителя. Затем добавляют безводный карбонат калия (1 молярный эквивалент) и смесь перемешивают при комнатной температуре в течение 1-24 ч до завершения реакции согласно анализу ТСХ. Реакционную смесь концентрируют при пониженном давлении, остаток растворяют в этилацетате и промывают насыщенным раствором соли. Органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Замещенные o-аминофенилацетилены, по необходимости, могут быть очищены колоночной хроматографией на силикагеле, элюируя смесями гексанов и этилацета.
Стадия 4. Введение галогенацетамидных или дигалогенацетамидных боковых цепей
Замещенный o-аминофенилацетилен, полученный на стадии 3, растворяют в дихлорметане. Добавляют триэтиламин (1,3 молярных эквивалентов) и раствор охлаждают на бане со льдом в атмосфере азота. Затем по каплям добавляют раствор хлорангидрида галогенуксусной кислоты или хлорангидрида дигалогенуксусной кислоты (1,0 молярных эквивалентов) в дихлорметане. После завершения добавления реакционной смеси дают возможность перемешиваться 0,5-1 ч при 0°C и затем предоставляют возможность нагреться до комнатной температуры. Спустя 1-4 час. суммарного времени течения реакции реакционную смесь разбавляют водой. Органический слой отделяют и далее промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая замещенный 2-галоген- или 2,2-дигалоген-N-(2-этинилфенил)ацетамид. Альтернативно, исходный продукт, замещенный o-аминофенилацетилен, растворяют в дихлорметане и последовательно обрабатывают гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида (1 молярный эквивалент), галоген- или дигалогенуксусной кислотой (1 молярный эквивалент) и, наконец, триэтиламином (1 молярный эквивалент). Затем реакционную смесь перемешивают при комнатной температуре до тех пор, пока не израсходуется исходный продукт, замещенный o-аминофенилацетилен, что определяется анализом ТСХ. Смесь промывают водой и органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют досуха при пониженном давлении, получая либо замещенные 2-галоген-, либо 2,2-дигалоген-N-(2-этинилфенил)ацетамиды.
Способ G (См. Фиг.15)
Исходный продукт, соответствующим образом замещенный o-иоданилин или o-броманилин, связывают с триметилсилилацетиленом, как описано на стадии 1 Способа F. Затем у полученного замещенного o-(триметилсилилэтинил)анилина снимают защиту, используя методику, описанную на стадии 3 Способа F, с получением замещенного o-аминофенилацетилена, который затем превращают в желаемый 2-галоген- или 2,2-дигалоген-N-(2-этинилфенил)ацетамид, как описано на стадии 4 Способа F.
Общие методики получения 2-галоген- или 2,2-дигалоген-N-(4-этинилфенил)ацетамидов.
Способ H (См. Фиг.17)
Введение галогенацетамидных или дигалогенацетамидных боковых цепей
п-Аминофенилацетилен, закупленный у Aldrich Chemical Co., растворяют в дихлорметане. Добавляют триэтиламин (1,3 молярных эквивалентов) и раствор охлаждают на бане со льдом в атмосфере азота. Затем по каплям добавляют раствор хлорангидрида галогенуксусной кислоты или хлорангидрида дигалогенуксусной кислоты (1,0 молярных эквивалентов) в дихлорметане. После завершения добавления реакционной смеси дают возможность перемешиваться 0,5-1 час при 0°C и затем дают возможность нагреться до комнатной температуры. По истечении 1-4 час суммарного времени реакции реакционную смесь разбавляют водой. Органический слой отделяют и далее промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая замещенный 2-галоген- или 2,2-дигалоген-N-(4-этинилфенил)ацетамид. Альтернативно, исходное вещество, замещенный п-аминофенилацетилен, растворяют в дихлорметане и последовательно обрабатывают гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида (1 молярный эквивалент), галоген- или дигалогенуксусной кислотой (1 молярный эквивалент) и, наконец, триэтиламином (1 молярный эквивалент). Затем реакционную смесь перемешивают при комнатной температуре до тех пор, пока не израсходуется исходное вещество, замещенный п-аминофенилацетилен, что определяется анализом ТСХ. Смесь промывают водой и органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют досуха при пониженном давлении, получая либо замещенный 2-галоген-, либо 2,2-дигалоген-N-(4-этинилфенил)ацетамиды.
Все цитируемые публикации, патенты и патентные заявки включены в настоящее описание в виде ссылки, как если бы имелось в виду, что каждая индивидуальная публикация, патент или патентная заявка конкретно и индивидуально включена в настоящее описание в виде ссылки.
Хотя приведенное выше изобретение описано довольно подробно посредством иллюстраций и примера с целью внесения ясности в его понимание, среднему специалисту в данной области будет очевидно, исходя из раскрытия данного изобретения, что в него могут быть внесены некоторые изменения и модификации, не отходя от существа или объема представленной ниже формулы изобретения.
Формула изобретения
1. Соединение, соответствующее структурной формуле (I):

или его фармацевтически приемлемая соль или N-оксид,
где цикл В представляет собой ароматическое или неароматическое кольцо, которое включает два гетероатома,
где Х и Y, каждый, независимо друг от друга, выбран из С, СН, N или О, при условии, что Х и Y, оба, не являются О и что Х и Y, оба, не являются N;
U и Т представляют собой С;
Z представляет собой -СН-;
А представляет собой N или -CR2-;
В представляет собой -CR3-;
D представляет собой N или -CR4-;
Е представляет собой N или -CR5-;
G представляет собой N или -CR6-;
J представляет собой N или -CR14-;
К представляет собой -CR8-;
L представляет собой N или -CR9-;
М представляет собой N или -CR10-;
R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из водорода, галогена, C1-С6алкила, замещенного C1-С6алкила, C1-С6алкокси, C1-С6замещенного алкокси, C1-С6алкоксикарбонила, циклогетероалкила, замещенного циклогетероалкила, -O-карбамоила, замещенного -O-карбамоила, галоген C1-С6алкила, диС1-С6алкиламино, замещенного диС1-С6алкиламино и силиловых простых эфиров, где циклогетероалкил представляет 3-7-членное кольцо, включающее 1-2 гетероатома, выбранных из N и О, при условии, что один из R2 и R6 отличается от водорода;
R3 и R5, каждый, независимо друг от друга, выбран из группы, состоящей из водорода, галогена;
R4 представляет собой водород;
R7 представляет -NR11C(O)R12;
R8, R9, R10 и R14, каждый, независимо друг от друга, представляет водород;
R11 представляет водород, С1-С6алкил; и
R12 выбран из группы, состоящей из галоген С1-С6алкила;
где каждая замещенная группа замещена одной или несколькими группами, выбранными из -Q, -R40, -OR40, -C(O)R40, -C(O)OR40, где каждый Q независимо представляет галоген, R40 и R41 независимо выбран из группы, состоящей из водорода, C1-С6алкила, C1-С6алкокси;
при условии, что:
(i) по крайней мере, один из A, D, Е, G, J, L или М представляет собой N;
(ii) не более чем один из А, D, Е или G представляет собой N; и
(iii) не более чем один из J, L или М представляет собой N.
2. Соединение по п.1, в котором один из А, D, Е или G представляет собой N, и один из J, L или М представляет собой N.
3. Соединение по п.1, в котором один из А, D, Е или G представляет собой N, и ни один из J, К, L или М не является N.
4. Соединение по п.1, в котором ни один из А, В, D, Е или G не является N, и один из J, L или М представляет собой N.
5. Соединение по п.1, в котором цикл В представляет собой изоксазол.
6. Соединение по любому одному из пп.1-5, в котором R7 представляет -NR11C(O)R12, где R11 представляет собой водород или метил и R12 представляет собой -CHCl2.
7. Соединение по п.6, в котором Х представляет собой N, Y представляет собой О и Z представляет собой -СН-.
8. Соединение по п.6, в котором А представляет собой -CR2-, G представляет собой -CR6-, R7 представляет собой -NR11C(O)R12, где R11 представляет собой водород или метил и R12 представляет собой -CHCl2.
9. Соединение по п.8, в котором В представляет собой -CR3-, D представляет N, Е представляет -CR5-, J представляет -CR14-, К представляет -CR8-, L представляет -CR9-, M представляет -CR10-, и R3, R5, R9, R10 и R14, каждый, представляет водород.
10. Соединение по п.8, в котором В представляет -CR3-, D представляет -CR4-, E представляет -CR5-, J представляет -CR14-, К представляет -CR8-, L представляет -CR9-, M представляет N, и R3, R4, R5, R8, R9 и R14, каждый, представляет водород.
11. Соединение по п.8, в котором В представляет -CR3-, D представляет -CR4-, E представляет -CR5-, J представляет -CR14-, К представляет -CR8-, L представляет N, M представляет -CR10-, и R3, R4, R5, R8, R10 и R14, каждый, представляет водород.
12. Соединение по п.8, в котором R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из хлора, фтора, метила, трифторметила, метокси, изопропокси, N-морфолино.
13. Соединение по п.8, в котором R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из хлора, фтора, метила, трифторметила, метокси или изопропокси.
14. Соединение по п.8, в котором R2 и R6, каждый, является одинаковым или различным галогеном.
15. Соединение по п.8, в котором Х представляет N, Y представляет О и Z представляет -СН-.
16. Соединение по п.1, в котором А представляет -CR2-, В представляет -CR3-, R7 представляет -NR11C(O)R12, где R11 представляет водород или метил и R12 представляет -CHCl2.
17. Соединение по п.16, в котором D представляет -CR4-, G представляет -CR6-, E представляет -CR5-, J представляет -CR14-, К представляет -CR8-, L представляет -CR9-, M представляет N, и R4, R5, R8, R9 и R14, каждый, представляет водород.
18. Соединение по п.16, в котором D представляет -CR4-, G представляет -CR6-, E представляет -CR5-, J представляет -CR14-, К представляет -CR8-, L представляет N, M представляет -CR10-, и R4, R5, R8, R10 и R14, каждый, представляет водород.
19. Соединение по любому одному из пп.16-18, в котором R2 представляет хлор, фтор, метил, трифторметил, метокси, изопропокси, N-морфолино и R3 представляет хлор, фтор, метил, трифторметил или метокси.
20. Соединение по любому одному из пп.16-18, в котором R2 представляет хлор, фтор, метил, трифторметил и R3 представляет хлор.
21. Соединение по любому одному из пп.16-18, в котором R2 и R3, каждый, является одинаковым или различным галогеном.
22. Соединение по любому одному из пп.16-18, в котором Х представляет N, Y представляет О и Z представляет -СН-.
23. Соединение по п.1, в котором А представляет -CR2-, G представляет -CR6– и R и R6 являются идентичными, при условии, что R2 и R6 не являются водородом.
24. Соединение по п.1, в котором А представляет -CR2-, В представляет -CR3– и R2 и R3 являются идентичными, при условии, что R2 и R3 не являются водородом.
25. Соединение по п.1, в котором В представляет -CR3-, D представляет -CR4-, E представляет -CR5-, J представляет -CR14-, К представляет -CR8-, и R3, R4, R5, R8 и R14, каждый, представляет водород.
26. Соединение по п.1, в котором -D представляет -CR4-, Е представляет -CR5-, G представляет CR6, J представляет -CR14-, К представляет -CR8-, и R4, R5, R6, R8 и R14, каждый, представляет водород.
27. Соединение по п.1, которое имеет структурную формулу (Ia), (Ib), (Ic), (Id) или (1е):





или его фармацевтически приемлемые соли, где X, Y, R2, R6, R11 и R12 являются такими, как определено выше для п.1 и — означает двойную связь.
28. Соединение по п.34, в котором R11 представляет водород, R12 представляет дихлорметил и R2 и R6, каждый, независимо друг от друга, выбран из группы, состоящей из фтора, хлора, трифторметила и метокси.
29. Соединение по п.1, которое имеет структурную формулу (If):

или его фармацевтически приемлемые соли, где R2, R3, R4, R5, R6, R8, R9, R11, R12 и R14 такие, как определено для п.1 и подчиненные тем же самым условиям, и —- означает двойную связь.
30. Соединение, которое ингибирует репликацию и/или пролиферацию HCV, как измерено в анализе in vitro, выбранное из следующей группы:
2,2-Дихлор-N-[2-[3-(2-хлор-6-фторфенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 1),
2,2-Дихлор-N-[2-[3-(2-фтор-6-трифторметилфенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 3),
2,2-Дихлор-N-[2-[3-(2-фтор-6-метоксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 5),
2,2-Дихлор-N-[5-[3-(2,6-дихлорфенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 7),
2,2-Дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 9),
2,2-Дихлор-N-[3-[3-[(2,6-дихлор)-4-пиридил]-5-изоксазолил]фенил]ацетамид (Соединение 11),
2,2-Дихлор-N-[5-[3-(2-хлор-6-фторфенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 13),
2,2-Дихлор-N-[5-[3-(2-фтор-6-метоксифенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 17),
2,2-Дихлор-N-[2-[3-(2,6-диметилфенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 19),
2,2-Дихлор-N-[5-[3-(2,6-диметилфенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 21),
2,2-Дихлор-N-[5-[3-(2,6-дифторфенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 27),
2,2-Дихлор-N-[5-[3-(2,3-дихлорфенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 29),
2,2-Дихлор-N-[2-[3-(2-морфолино-6-трифторметилфенил])-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 31),
2,2-Дихлор-N-[3-[3-(3-метил-2-пиридил)-5-изоксазолил]фенил]ацетамид (Соединение 33),
2,2-Дихлор-N-[6-[3-(2,6-дихлорфенил)-5-изоксазолил]-(2-пиридил)]ацетамид (Соединение 35),
2,2-Дихлор-N-[5-[3-(2-фтор-6-трифторметилфенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 37),
2,2-Дихлор-N-[2-[3-(2-метокси-6-фторфенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 39),
2,2-Дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-[4-(1-оксипиридил)]ацетамид (Соединение 43),
2,2-Дихлор-N-[3-[3-[(3-этоксикарбонил)-2-пиридил]-5-изоксазолил]фенил]ацетамид (Соединение 45),
2,2-Дихлор-N-[2-[3-(2-фтор-6-морфолиносульфамоилфенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 47),
2,2-Дихлор-N-[2-[3-(2-метокси-6-трифторметилфенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 49),
2,2-Дихлор-N-[2-[3-(2,6-дихлорфенил)-5-изоксазолил]-(4-пиридил)]-N-метилацетамид (Соединение 51),
2,2-Дихлор-N-[2-[3-[2-хлор-6-[4-(N-2-пиридил)пиперазино]фенил])-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 53),
2,2-Дихлор-N-[5-[3-(2-метокси-6-трифторметилфенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 57),
2,2-Дихлор-N-[5-[3-(2-хлор-6-[4-(N-2-пиридил)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 59),
2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-ацетил)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 61),
2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-этил)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 63),
2,2-Дихлор-N-[5-[3-(2,6-дихлорфенил)-5-изоксазолил]-(2-пиридил)]ацетамид (Соединение 65),
2,2-Дихлор-N-[5-[3-(2-трифторметилфенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 67),
2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-2-пиридил)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 69),
2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-трет-бутоксикарбонил)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 71),
2,2-Дихлор-N-[5-[3-(2-хлор-6-пиперазинофенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 73),
2,2-Дихлор-N-[5-[3-(2-хлор-6-трет-бутилдиметилсилилоксифенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 75),
2,2-Дихлор-N-[5-[3-(2-хлор-6-гидроксифенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 77),
2,2-Дихлор-N-[5-[3-(2-хлор-6-N-этилкарбамоилоксифенил)-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 79),
2,2-Дихлор-N-[5-[3-[2-хлор-6-[4-(N-этилкарбоксамидо)пиперазино]фенил])-5-изоксазолил]-(3-пиридил)]ацетамид (Соединение 81),
2,2-Дихлор-N-[2-[3-(2-хлор-6-трет-бутилдиметилсилилоксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 83),
2,2-Дихлор-N-[2-[3-(2-хлор-6-N-пропилкарбамоилоксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 85),
2,2-Дихлор-N-[2-[3-(2-хлор-6-метоксиметоксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 87),
2,2-Дихлор-N-[2-[3-(2-хлор-6-гидроксифенил)-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 89),
2,2-Дихлор-N-[3-[3-[(4-хлор-2-диметиламино)-3-пиридил]-5-изоксазолил]фенил]ацетамид (Соединение 91),
2,2-Дихлор-N-[3-[3-[(2,4-дихлор)-3-пиридил]-5-изоксазолил]фенил]ацетамид (Соединение 93),
2,2-Дихлор-N-[3-[3-[(2-хлор-4-морфолино)-3-пиридил]-5-изоксазолил]фенил]ацетамид (Соединение 95),
2,2-Дихлор-N-[3-[3-[(6-бром)-2-пиридил]-5-изоксазолил]-(4-пиридил)]ацетамид (Соединение 97), …
и их фармацевтически приемлемые соли.
31. Способ ингибирования репликации или пролиферации вириона гепатита С (“НС”), включающий стадию контактирования вириона НС с соединением по любому одному из пп.1-4 в количестве, эффективном для ингибирования репликации вириона НС.
32. Способ по п.31, который осуществляют на практике in vitro.
33. Фармацевтическая композиция, обладающая свойством ингибитора репликации и/или пролиферации HCV, содержащая соединение по любому одному из пп.1-4 и фармацевтически приемлемый носитель.
Приоритет по признакам и пунктам:
23.08.2002 и 11.10.2002 в равной степени относятся к пп.1-29, 31-33, за исключением соединений формулы (I), в которых В является неароматическим кольцом, a U и Т представляют СН;
15.05.2003 и 22.08.2003 в равной степени относятся к пп.1-29, 31-33 для соединений формулы (I), в которых В является неароматическим кольцом, а U и Т представляют СН.
РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 23.08.2008
Извещение опубликовано: 27.12.2009 БИ: 36/2009
|
|