|
|
(21), (22) Заявка: 2006123869/15, 03.07.2006
(24) Дата начала отсчета срока действия патента:
03.07.2006
(43) Дата публикации заявки: 20.01.2008
(46) Опубликовано: 10.08.2008
(56) Список документов, цитированных в отчете о
поиске:
JOHN G. et al. Bergey s Manual of determinative bacterioloji Ninth Edition – Baltimor – Philadelphia – Hon-Kong – London et al. 1997, v.2, p.553-559. RU 2231070 C2, 20.06.2006. ЛАБИНСКАЯ А.С., Микробиология с техникой микробиологических исследований. – М., 1978, с.164-174. САСОВА В.А. и др. Методы идентификации энтеробактерий и стафилококков с
Адрес для переписки:
618510, Пермская обл., г. Соликамск, ул. Сильвинитовая, 18, кв.101, Ю.А. Захаровой
|
(72) Автор(ы):
Захарова Юлия Александровна (RU),
Фельдблюм Ирина Викторовна (RU),
Николаева Алевтина Максимовна (RU)
(73) Патентообладатель(и):
Захарова Юлия Александровна (RU),
Фельдблюм Ирина Викторовна (RU),
Николаева Алевтина Максимовна (RU)
|
(54) СПОСОБ ВИДОВОЙ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ СТАФИЛОКОККОВ
(57) Реферат:
Изобретение относится к области медицины, а именно к микробиологии и эпидемиологии. В способе дифференциации тестов по определению биологических свойств стафилококков, выделенных из клинического материала и из внешней среды, используют классические питательные среды и стандартный режим инкубации, определяют ведущие признаки: фактор хлопьеобразования, ферменты плазмокоагулазы и уреазы, чувствительность к новобиоцину. Это позволяет сформировать стафилококки в группы, в каждой из которых используют комбинации признаков, выбранных из группы: определение гемолитической активности, размера колоний,  -галактозидазы, пигментообразования, роста культуры в режиме инкубации при температуре 45°С в анаэробных условиях, способность к разложению сахарозы, галактозы, маннита, маннозы, ксилозы и арабинозы, и по этим признакам определяют видовую принадлежность возбудителя. Изобретение обеспечивает повышение степени достоверности видовой дифференциальной диагностики стафилококков и сокращение сроков определения. 8 табл., 1 ил. -галактозидазы, пигментообразования, роста культуры в режиме инкубации при температуре 45°С в анаэробных условиях, способность к разложению сахарозы, галактозы, маннита, маннозы, ксилозы и арабинозы, и по этим признакам определяют видовую принадлежность возбудителя. Изобретение обеспечивает повышение степени достоверности видовой дифференциальной диагностики стафилококков и сокращение сроков определения. 8 табл., 1 ил.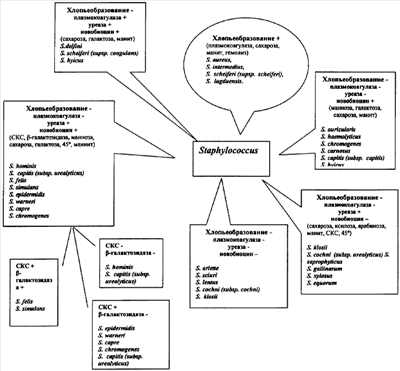
(56) (продолжение):
CLASS=”b560m”помощью пластин биохимических дифференцирующих энтеробактерий (ПБДЭ) и стафилококки (ПБДС) – НПО Диагностические системы, 2003. JOSEPH T. – PARISI. Coagulase-Negative Staphylococcus epidermidis. Microbiological reviews, June 1985, p.126-139 (реферат), [он лайн] [01.01.2007], найдено из БД PubMed.
Изобретение относится к медицине, а именно к микробиологии и эпидемиологии, и может быть использовано при бактериологической диагностике и эпидемиологическом анализе гнойно-септических и нозокомиальных стафилококковых инфекций.
Род Staphylococcus, включающий 31 вид, играет важную роль в инфекционной патологии. Наибольшее значение в медицинской микробиологии имеют золотистый (S.aureus), эпидермальный (S.epidermidis) и сапрофитический (S.saprophyticus) стафилококки. Однако в последние годы в клиническом материале и во внешней среде лечебно-профилактических учреждений все чаще обнаруживают стафилококки, идентификация которых затруднена.
Известен способ видовой дифференциальной диагностики стафилококков, включающий изучение комплекса биологических свойств: ферментов ДНК-азы, плазмокоагулазы, фосфатазы, нитратредуктазы, уреазы, продукции ацетоина, разложение маннозы, мальтозы, маннита, сахарозы, гемолитическую активность. (Алеушкина А.В. Медицинская микробиология: Учебное пособие. – Ростов На-Дону: Феникс, 2003. – С.144). Данным способом удается диагностировать S.aureus, S.epidermidis, S.saprophyticus, S.intermedius, S.chleiferi, S.capitis, S.warneri, S.haemoluticus, S.hominis, S.luqduensis, S.cohnii, S.xylosis. Недостатком этого способа является отсутствие возможности достоверно определить все виды стафилококков.
Наиболее близким аналогом представленного в заявке метода является способ видовой дифференциальной диагностики стафилококков согласно Определителю бактерий Берджи. (John G., Holt, Noel R. Krieg, Peter H.A. Sneath, James Т Stanley T. Williams Bergey’s Manual of determinative bacterioloji Ninth Edition – Baltimor-Philadelphia-Hon Kong-London et al. – 1997. – V.2. – P.553-559). Идентификация стафилококков, выделенных от больных с гнойно-септической патологией и из внешней среды, осуществляется данным способом после определения их семейственной и родовой принадлежности по классическим методикам на стандартных питательных средах и режиме культивирования с использованием 48 признаков, включающих диаметр колоний, наличие пигмента, характер роста в различных условиях инкубации и при определенном составе питательных сред, образование кислоты из аминокислот, сахаров, спиртов, ферментативной активности, устойчивости к новобиоцину и др.
Его недостатком является большое количество и сложность постановки дифференцирующих тестов, используемых при проведении исследований.
Техническим результатом изобретения является повышение степени достоверности видовой дифференциальной диагностики стафилококков и сокращение сроков анализа.
Определение 4-х ведущих биологических свойств у стафилококков: фактора хлопьеобразования, ферментов плазмокоагулазы и уреазы, чувствительности к новобиоцину с последующим включением в ход микробиологического анализа 12-ти дифференцирующих тестов (вместо 48), позволяет достоверно определить их принадлежность к виду и значительно сократить сроки диагностики (3-4 дня).
Сущность изобретения заключается в следующем. Путем дифференциации тестов по определению биологических свойств стафилококков, выделенных из клинического материала и из внешней среды с использованием классических питательных сред и стандартного режима инкубации, исследуют ведущие признаки по определению фактора хлопьеобразования, ферментов плазмокоагулазы и уреазы, чувствительности к новобиоцину. Это позволит сформировать стафилококки в группы, в каждой из которых используют комбинации признаков, включающих определение гемолитической активности, размера колоний,  -галактозидазы, пигментообразования, роста культуры в режиме инкубации при 45°С в анаэробных условиях, способность к разложению сахарозы, галактозы, маннита, маннозы, ксилозы и арабинозы, и по этим признакам определяют видовую принадлежность возбудителя. -галактозидазы, пигментообразования, роста культуры в режиме инкубации при 45°С в анаэробных условиях, способность к разложению сахарозы, галактозы, маннита, маннозы, ксилозы и арабинозы, и по этим признакам определяют видовую принадлежность возбудителя.
Определение принадлежности стафилококков к 31-му виду представлено на чертеже.
При этом в группе стафилококков, обладающих фактором хлопьеобразования, исследуют наличие плазмокоагулазы, способность к разложению сахарозы, маннита и гемолитическую активность. В группе коагулазоположительных стафилококков с уреазной активностью, чувствительных к новобиоцину, – наличие  -галактозадазы, способность к росту при 45°С, разложению маннозы, сахарозы галактозы и маннита. В группе коагулазоотрицательных стафилококков с уреазной активностью, чувствительных к новобиоцину, – -галактозадазы, способность к росту при 45°С, разложению маннозы, сахарозы галактозы и маннита. В группе коагулазоотрицательных стафилококков с уреазной активностью, чувствительных к новобиоцину, –  -галактозидазы, утилизацию сахарозы, маннозы, галактозы, маннита, способность к росту в условиях анаэробиоза, при температурном режиме 45°С. В группе коагулазоотрицательных стафилококков без уреазной активности, чувствительных к новобиоцину, – образование кислоты из маннозы, галактозы, сахарозы, маннита, наличие -галактозидазы, утилизацию сахарозы, маннозы, галактозы, маннита, способность к росту в условиях анаэробиоза, при температурном режиме 45°С. В группе коагулазоотрицательных стафилококков без уреазной активности, чувствительных к новобиоцину, – образование кислоты из маннозы, галактозы, сахарозы, маннита, наличие  -галактозидазы и гемолиза. В группе коагулазоотрицательных стафилококков с уреазной активностью, устойчивых к новобиоцину, – разложение сахарозы, ксилозы, арабинозы, маннита, способность к росту при 45°С и в условиях анаэробиоза. В группе коагулазоотрицательных стафилококков, не обладающих уреазной активностью, устойчивых к новобиоцину – разложение сахарозы, ксилозы, арабинозы, рост в анаэробных условиях, цвет и размер колоний. Это позволит определить принадлежность стафилококков к 31 виду (чертеж). -галактозидазы и гемолиза. В группе коагулазоотрицательных стафилококков с уреазной активностью, устойчивых к новобиоцину, – разложение сахарозы, ксилозы, арабинозы, маннита, способность к росту при 45°С и в условиях анаэробиоза. В группе коагулазоотрицательных стафилококков, не обладающих уреазной активностью, устойчивых к новобиоцину – разложение сахарозы, ксилозы, арабинозы, рост в анаэробных условиях, цвет и размер колоний. Это позволит определить принадлежность стафилококков к 31 виду (чертеж).
Способ осуществляется следующим образом: исследуемую чистую культуру-колонию стафилококка после определения родовой принадлежности со среды первичного посева исследуют на фактор слипания (хлопьеобразования). Этот признак является определяющим для данной группы.
Группа стафилококков, обладающая фактором хлопьеобразования: S.aureus, S.intermedius, S.scheiferi (supsp. scheiferi), S.lugduensis. У них оценивают 3 признака: способность коагулировать кроличью плазму, образовывать из кислоты в аэробных условиях сахарозу и маннит. Данные тесты можно выполнить непосредственно с чашки первичного посева клинического материала. Оценка производится после 18-20 часовой инкубации при 36°С. Пробу на плазмокоагулазу возможно оценить уже через 2 часа. Отнести стафилококк к виду S.aureus позволяют положительные пробы на плазмокоагулазу, сахарозу и маннит, к виду S.intermedius – на плазмокоагулазу и сахарозу, к виду S.lugduensis – на сахарозу. Если стафилококк не обладает ни одним из 3 перечисленных признаков, его относят к виду S.scheiferi (supsp. scheiferi). Данные о группе стафилококков, обладающих фактором хлопьеобразования, представлены в таблице 1.
Таблица 1.
Стафилококки, обладающие фактором хлопьеобразования (или слипания) |
| вид |
плазмокоагулаза |
сахароза |
маннит |
гемолиз |
| Staphylococcus aureus |
+ |
+ |
+ |
+ |
| S.intermedius |
+ |
+ |
d |
d |
| S.lugduensis |
– |
+ |
… |
… |
| S.scheiferi |
– |
– |
… |
… |
Примечание:
«+» – положительный признак
«-» – отрицательный признак
«d» – вариабельный признак (10-20% положительных находок)
«…» – не определен |
При отсутствии фактора слипания стафилококки определяют в другие группы, где используют тесты на наличие ферментов плазмокоагулазы, уреазы и определяют чувствительность штамма к новобиоцину (в минимальной подавляющей концентрации антибиотика >1,6 мкг/мл). Испытание непосредственно проводят с чашки первичного посева. Результат оценивают после 18-20 часовой инкубации. Принадлежность стафилококка к той или иной группе зависит от наличия или отсутствия этих признаков.
Группа коагулазо- и уреазоположительных стафилококков, чувствительных к новобиоцину: S.delfini, S.scheiferi (supsp. coagulans), S.hyicus. У них определяют три признака: способность образовывать кислоту из сахарозы, галактозы и маннита. S.delfini образует кислоту из сахарозы и маннита, S.scheiferi (supsp. coagulans) – только из галактозы, S.hyicus – из сахарозы (табл.2).
Таблица 2.
Коагулазоположительные стафилококки с уреазной активностью, чувствительные к новобиоцину |
| вид |
сахароза |
галактоза |
маннит |
| S.delfini |
+ |
… |
+ |
| S.hyicus |
+ |
– |
– |
| S.schleiferi (coagulans) |
d |
+ |
d |
В группу коагулазоотрицательных и уреазоположительных стафилококков, чувствительных к новобиоцину входят S.hominis, S.capitis (subsp. urealyticus), S.felis, S.simulans, S.epidermidis, S.warneri, S.capre, S.chromogenes. Их идентифицируют по 7 признакам: росту в анаэробных условиях (на тиогликолевой среде), образованию кислоты из сахарозы, маннозы, галактозы, маннита,  -галактозидазы и росту на мясо-пептонном агаре при 45°С. -галактозидазы и росту на мясо-пептонном агаре при 45°С.
При наличии роста в анаэробных условиях, положительного теста на  -галактозидазу учитывают способность стафилококка образовывать кислоту из маннозы. У S.felis данный тест положительный, у S.simulans – отрицательный (табл.3). -галактозидазу учитывают способность стафилококка образовывать кислоту из маннозы. У S.felis данный тест положительный, у S.simulans – отрицательный (табл.3).
Таблица 3.
Коагулазоотрицательные стафилококки с уреазной активностью, чувствительные к новобиоцину, растущие в анаэробных условиях, обладающие  -галактозидазой -галактозидазой |
| вид |
манноза |
сахароза |
галактоза |
МПА 45°С. |
маннит |
| S.felis |
+ |
d |
d |
+ |
d |
| S.simulans |
– |
+ |
d |
+ |
+ |
Хороший рост в анаэробных условиях и отрицательный тест на  -галактозидазу определяет стафилококк в подгруппу (S.capre, S.warneri, S.epidermidis, S.capitis (subsp. urealyticus), S.chromogenes), где единственным видом, не образующим кислоту из сахарозы, является S.capre, а из маннозы – S.varneri. S.epidermidis отличается от S.chromogenes способностью расти при 45°С, а от S.capitis (subsp. urealyticus) – отсутствием кислотообразования из маннита. Дифференцирующим признаком S.chromogenes от S.capitis (subsp. urealyticus) является тест на образование кислоты из галактозы. У S.chromogenes он положительный, у S.capitis (subsp. urealyticus) – отрицательный (таб.4). -галактозидазу определяет стафилококк в подгруппу (S.capre, S.warneri, S.epidermidis, S.capitis (subsp. urealyticus), S.chromogenes), где единственным видом, не образующим кислоту из сахарозы, является S.capre, а из маннозы – S.varneri. S.epidermidis отличается от S.chromogenes способностью расти при 45°С, а от S.capitis (subsp. urealyticus) – отсутствием кислотообразования из маннита. Дифференцирующим признаком S.chromogenes от S.capitis (subsp. urealyticus) является тест на образование кислоты из галактозы. У S.chromogenes он положительный, у S.capitis (subsp. urealyticus) – отрицательный (таб.4).
Таблица 4.
Коагулазоотрицательные стафилококки с уреазной активностью, чувствительные к новобиоцину, растущие в анаэробных условиях, не имеющие  -галактозидазу -галактозидазу |
| вид |
сахароза |
МПА 45°C |
манноза |
галактоза |
маннит |
| S.epidermidis |
+ |
+ |
+ |
d |
– |
| S.warneri |
+ |
+ |
– |
d |
d |
| S.capre |
– |
+ |
+ |
+ |
d |
| S.chromogenes |
+ |
– |
+ |
+ |
d |
| S.capitis (urealyticum) |
+ |
… |
+ |
– |
+ |
Отсутствие роста в анаэробных условиях и отрицательная проба с  -галактозидазой позволяет отнести стафилококк в подгруппу: S.hominis, S.capitis (subsp. urealyticus). При этом варианте оценивают тесты с маннозой и маннитом. S.capitis (urealyticus) разлагает эти углевод и сахар, S.hominis – не разлагает (табл.5). -галактозидазой позволяет отнести стафилококк в подгруппу: S.hominis, S.capitis (subsp. urealyticus). При этом варианте оценивают тесты с маннозой и маннитом. S.capitis (urealyticus) разлагает эти углевод и сахар, S.hominis – не разлагает (табл.5).
| Таблица 5. Коагулазоотрицательные стафилококки с уреазной активностью, чувствительные к новобиоцину, не растущие в анаэробных условиях |
| вид |
 -гал. -гал. |
манноза |
сахароза |
галактоза |
маннит |
| S.hominis |
– |
– |
+ |
d |
– |
| S.capitis (urealyticum) |
– |
+ |
+ |
– |
+ |
Группа коагулазоотрицательных стафилококков без уреазной активности, чувствительных к новобиоцину, включает S.auricularis, S.haemolyticus, S.chromogenes, S.carnosus, S.capitis (subsp. capitis) и S.hyicus. Их дифференцируют с помощью 4 тестов: с маннозой, галактозой, сахарозой и маннитом. Маннозоположительные стафилококки (S.chromogenes, S.carnosus, S.capitis (subsp. capitis) и S.hyicus) оценивают по свойству образовывать кислоту из галактозы. Галактозоположительные – S.chromogenes и S.carnosus – отличают друг от друга по способности разлагать сахарозу. Утилизирует этот углевод S.chromogenes, a S.carnosus – нет. Галактозоотрицательные стафилококки – S.capitis (subsp. capitis) и S.hyicus – дифференцируют по маниту. S.capitis (subsp. capitis) разлагает этот спирт, a S.hyicus – не разлагает. Маннозоотрицательные стафилококки – S.auricularis и S.haemolyticus – отличаются друг от друга способностью разлагать галактозу и маннит. У S.auricularis оба эти признаки отсутствуют, также он не обладает гемолитической активностью (табл.6).
| Таблица 6.Коагулазоотрицательные стафилококки без уреазной активности, чувствительные к новобиоцину |
| вид |
манноза |
галактоза |
сахароза |
маннит |
гемолиз |
| S.auricularis |
– |
– |
d |
– |
– |
| S.haemolyticus |
– |
d |
+ |
d |
+ |
| S.chromogenes |
+ |
+ |
+ |
d |
… |
| S.carnosus |
+ |
+ |
– |
+ |
… |
| S.hyicus |
+ |
– |
+ |
– |
… |
| S.capitis (capitis) |
+ |
– |
+ |
+ |
… |
Коагулазоотрицательные стафилококки с уреазной активностью, устойчивые к новобиоцину, составляют группу из 6 видов: S.klosii, S.cochni (subsp. urealyticus), S.saprophyticus, S.gallinarum, S.xylosus, S.equorum. В ней видовую принадлежность определяют по следующим признакам: образованию кислоты из сахарозы, ксилозы, арабинозы и маннита, росту в анаэробных условиях и росту при температуре 45°С. По способности разлагать сахарозу стафилококки делят на две подгруппы. Из подгруппы сахарозоположительных (S.saprophyticus, S.gallinarum, S.xylosus, S.equorum) лишь один вид – S.saprophyticus не разлагает ксилозу и арабинозу. S.gallinarum в отличие от S.xylosus и S.equorum не растет при 45 градусов, a S.xylosus в отличие от S.equorum не разлагает манит. В подгруппу сахарозоотрицательных входят S.klosii и S.cochni (subsp. urealyticus). Друг от друга они отличаются ростом в анаэробных условиях. В глубине тиогликолевой среды не растет S.klosii, а у S.cochni (subsp. urealyticus) этот тест положительный (табл.7)
Таблица 7.
Коагулазоотрицательные стафилококки с уреазной активностью, устойчивые к новобиоцину |
| вид |
сахароза |
ксилоза |
арабиноза |
СКС |
МПА 45°C |
маннит |
| S.kloosii |
– |
– |
d |
– |
… |
… |
| S.cohni (urealuticum) |
– |
– |
– |
+ |
+ |
… |
| S.saprophyticus |
+ |
– |
– |
+ |
d |
… |
| S.gallinarum |
+ |
+ |
+ |
+ |
+ |
… |
| S.xylosus |
+ |
+ |
+ |
d |
– |
– |
| S.equorum |
+ |
+ |
+ |
– |
– |
+ |
В группу коагулазоотрицательных стафилококков, не разлагающих мочевину и устойчивых к новобиоцину, входят 5 видов: S.arlette, S.sciuri, S.lentus, S.cochni (subsp. cochni), S.klosii. Здесь оценивают 4 теста: способность штамма образовывать кислоту из сахарозы, ксилозы, арабинозы и расти в анаэробных условиях. Все указанные признаки имеет S.arlette, в том числе образовывать кислоту из сахарозы. Кроме него в подгруппу сахарозоположительных стафилококков входят S.sciuri и S.lentus. Они отличаются друг от друга ростом в анэробных условиях. У S.sciuri этот признак присутствует. В подгруппе сахарозоотрицательных стафилококков (S.cochni (subsp. cochni), S.klosii) помимо этого оценивают способность к росту в условиях анаэробиоза. Растет в анаэробных условиях S.cochni (subsp. cochn), a S.klosii – нет (табл.8).
Таблица 8.
Коагулазоотрицательные стафилококки без уреазной активности, устойчивые к новобиоцину |
| вид |
сахароза |
ксилоза |
СКС |
арабиноза |
Вид колоний |
| S.arlettae |
+ |
+ |
+ |
+ |
оранжево-желтые |
| S.sciuri |
+ |
– |
+ |
d |
более 5 мм |
| S.lentus |
+ |
– |
– |
d |
менее 5 мм |
| S.cochni (cochni) |
– |
– |
+ |
– |
… |
| S.klosii |
– |
– |
– |
d |
|
Примеры конкретного выполнения.
Пример 1.
Материал, взятый из пупочной ранки новорожденного К. (ист. бол. №453) с диагнозами «омфалит, пузырчатка новорожденного», был посеян на желточно-солевой агар. После суточной инкубации при 37°C на поверхности агара выросли желтые колонии диаметром 2,5 мм, окруженные зоной лецитиназы. В мазках – грамположительные мелкие кокки с характерным «ситцевым» окрашиванием. Тест на фактор слипания – положительный. Культуре, отнесенной в группу стафилококков, обладающих фактором хлопьеобразования, были поставлены тесты, определяющие способность коагулировать кроличью плазму, образовывать кислоту из маннита и сахарозы. Через 2 часа инкубации при 36°С в растворе кроличьей плазмы с испытуемой культурой образовался сгусток. Через 18 часов сработали индикаторы кислотообразования из маннита и сахарозы.
Таким образом, у новорожденного ребенка с клиническим диагнозом «омфалит» и «пузырчатка» из пупочной ранки был выделен стафилококк, имеющий фактор хлопьеобразования, коагулирующий кроличью плазму и образующий кислоту из маннита и сахарозы, что позволяет его отнести к виду S.aureus.
Пример 2.
При бактериологическом исследовании содержимого трофической раны у больной 3. (ист. бол. №2178) на секторе 5% кровяного агара через 20 часов инкубации выросли крупные колонии диаметром 3 мм. В мазках – грамположительные кокки, каталазоположительные. Тест на фактор хлопьеобразования – отрицательный. Через 18 часов после пересева культуры были положительными тесты с кроличьей плазмой и уреазой. Зона задержки роста вокруг диска с новобиоцином составила 23 мм. Через 20 часов инкубации после постановки дифференцирующих тестов произошло образование кислоты из сахарозы, пробы с галактозой и маннитом – отрицательные.
Таким образом, у больной З. с трофической раной из клинического материала выделен коагулазоположительный стафилококк с уреазной активностью, чувствительный к новобиоцину, не обладающий фактором слипания. А отсутствие способности разлагать галактозу и маннит, но при этом утилизировать сахарозу позволяет отнести стафилококк к виду S.hyicus.
Пример 3.
После первичного посева и 20 часов инкубации при температуре 36°С содержимого цервикального канала, взятого у больной М. (история болезни №123) с кольпитом, на поверхности кровяного агара выросли белые колонии диаметром 3 мм. В мазке, окрашенном по Грамму, обнаружены тетрады грамположительных кокков. Проба с каталазой положительная. Эти признаки позволяют отнести культуру к роду стафилококка. Тест на хлопьеобразование – отрицательный. Изучаем признаки на чувствительность к новобиоцину, образование уреазы и плазмокоагулазы. Через 18 часов инкубации проба с мочевиной положительная, с плазмокоагулазой отрицательная. Зона задержки роста культуры (разведенной по стандарту мутности 0,5 McFarland и посеянной на среду Мюллера-Хинтона) вокруг диска с новобиоцином (концентрация препарата в диске 5 мкг) составила 18 см, что говорит о чувствительности штамма стафилококка к новобиоцину. Культуру определяем к группе коагулазоотрицательных стафилококков с уреазной активностью, чувствительных к новобиоцину. На следующем этапе в состав изучаемых признаков у испытуемого штамма включаем: способность к образованию кислоты из сахарозы, маннозы, галактозы, маннита, образование  -галактозидазы, росту на тиогликолевой среде (в условиях анаэробиоза) и при 45°C на мясопептонном агаре. После 18 часовой инкубации тест с галактозой отрицательный, рост в анаэробных условиях отсутствовал, но были положительными тесты с маннозой, сахарозой и маннитом. Аэробный характер роста и отрицательный тест с -галактозидазы, росту на тиогликолевой среде (в условиях анаэробиоза) и при 45°C на мясопептонном агаре. После 18 часовой инкубации тест с галактозой отрицательный, рост в анаэробных условиях отсутствовал, но были положительными тесты с маннозой, сахарозой и маннитом. Аэробный характер роста и отрицательный тест с  -галактозидазой определяет культуру в подгруппу с видами S.hominis и S.capitis (subsp. urealyticus). А положительные тесты с маннозой и маннитом позволяют дифференцировать штамм как S.capitis (subsp. urealyticus). -галактозидазой определяет культуру в подгруппу с видами S.hominis и S.capitis (subsp. urealyticus). А положительные тесты с маннозой и маннитом позволяют дифференцировать штамм как S.capitis (subsp. urealyticus).
Таким образом, у больной с кольпитом из цервикального канала был выделен стафилококк, не обладающий фактором слипания, чувствительный к новобиоцину, разлагающий уреазу, не коагулирующий кроличью плазму, образующий кислоту из маннозы, сахарозы и манита и не образующий – из галактозы, а также не растущий в анаэробных условиях, что позволяет его отнести к виду S.capitis (subsp. urealyticus).
Пример 4.
После забора содержимого эндотрахеальной трубки у больного М. (ист. бол. №357), посева на кровяной агар и инкубации в стандартном режиме на поверхности питательной среды выросли колонии размером 3-4 мм с зоной гемолиза. Фактор слипания – отрицательный. Тесты по образованию плазмокоагулазы и уреазы данные ферменты не выявили. Культура показала высокую чувствительность к новобиоцину (диаметр зоны отсутствия роста вокруг диска с антибиотиком составил 30 см). Определение сахаролитической активности выявило: отсутствие образования кислоты из маннозы и галактозы и, напротив, образование – из сахарозы и маннита. Выделенная культура не обладала  -галактозидазой. -галактозидазой.
Таким образом, из эндотрахеальной трубки больного М. был выделен коагулазоотрицательный стафилококк, не обладающей уреазной активностью, чувствительный к новобиоцину, разлагающий сахарозу и манит и не разлагающий маннозу и галактозу, имеющий фермент  -галактозидазу и обладающий гемолитической активностью, что позволяет его определить к виду S.haemolyticus. -галактозидазу и обладающий гемолитической активностью, что позволяет его определить к виду S.haemolyticus.
Пример 5.
При посеве средней порции мочи у беременной Ш. (ист. бол. №1321) с пиелонефритом на секторе кровяного агара после 24 часовой инкубации при 36°С, выросли белые негемолитические колонии диаметром 4 мм. В мазках – грамположительные кокки, расположенные тетрадами. Фактор слипания – отрицательный. Тест с мочевиной – положительный, зона задержки роста вокруг диска с новобиоцином отсутствует, тест на плазмокоагулазу – отрицательный. Культуру отнесли к группе коагулазоотрицательных сафилококков с уреазной активностью, устойчивых к новобиоцину, и включили в дифференцирующие тесты: сахарозу, ксилозу, арабинозу, маннит, произвели посев в тиогликолевую среду (для оценки роста в анаэробных условиях) и на мясопептонный агар при 45°C. Через 22 часа штамм образовал кислоту из сахарозы. Остальные пробы были отрицательные. Это позволяет отнести микроорганизм в подгруппу сахарозоположительных стафилококков (S.saprophyticus, S.gallinarum, S.xylosus, S.equorum), а отрицательные тесты с ксилозой и арабинозой определяют его принадлежность к виду S.saprophyticus.
Таким образом, у беременной с клиническим диагнозом «пиелонефрит» был выделен стафилококк, не имеющий фактора слипания, не обладающий плазмокоагулазой, устойчивый к новобиоцину, разлагающий мочевину, сахарозу и не разлагающий ксилозу, арабинозу, манит, не растущий в условиях анаэробиоза, что позволяет его отнести к виду S.saprophyticus.
Пример 6.
При исследовании смыва с поверхности стола в операционной гинекологического отделения после посева на желточно-солевой агар и 20 часовой инкубации при 37°C, на поверхности среды выросли белые колонии диаметром 3 мм. После постановки тестов было установлено отсутствие фактора слипания, плазмокоагулазы, уреазы, чувствительности к новобиоцину. После дополнительного изучения признаков – неспособность штамма разлагать сахарозу, ксилозу, арабинозу, но произошел рост испытуемой культуры в глубине среды для контроля стерильности.
Таким образом, из внешней среды гинекологического отделения был выделен коагулазоотрицательный стафилококк, не обладающий уреазной активностью, устойчивый к новобиоцину, не разлагающий сахарозу, ксилозу, арабинозу, растущий в анаэробных условиях, что позволяет отнести его к виду S.cochnii (cochnii).
Используемый метод видовой дифференциальной диагностики стафилококков, указанный в заявке проверен на штаммах Staphylococcus aureus ATCC 25923, Staphylococcus aureus ATCC 25293, S.epidermidis ATCC 29457, других контрольных штаммах НИИ им. Тарасовича и более чем на 2000 культурах стафилококков, выделенных из клинического материала от больных с гнойно-септической патологией. Выявленная общность фенотипических признаков у разных видов стафилококков позволяет их объединить в группы и подгруппы для дальнейшего использования минимального количества дифференцирующих признаков, с помощью которых и определяется видовая принадлежность стафилококков.
Предложенный способ видовой дифференциальной диагностики стафилококков информативен и позволяет идентифицировать 31 вид. Он достоверен, может быть отнесен к классическим методам исследования, так как проводится на стандартных питательных средах и по классическим методикам, не требует для производства дорогостоящего оборудования, удобен при постановке, несложен в методическом плане. Поэтому без значительных материальных затрат и в короткие сроки может быть внедрен в работу любой бактериологической лаборатории.
Формула изобретения
Способ видовой дифференциальной диагностики стафилококков, выделенных от больных с гнойно-септической патологией и из внешней среды, путем определения их принадлежности по биологическим признакам к семейству и роду с использованием стандартных питательных сред и режима инкубации, отличающийся тем, что после установления семейства и рода у стафилококков определяют способность к хлопьеобразованию, наличие ферментов плазмокоагулазы, уреазы и чувствительность к новобиоцину с последующим определением в группы, в каждой из которых используют комбинации признаков, выбранных из: определение гемолитической активности, размера колоний, наличия  -галактозидазы, пигментообразования, роста культуры в режиме инкубации при 45°С и в анаэробных условиях, а также способность к разложению до кислых продуктов сахарозы, галактозы, маннита, маннозы, ксилозы и арабинозы, и по этим признакам определяют видовую принадлежность возбудителя. -галактозидазы, пигментообразования, роста культуры в режиме инкубации при 45°С и в анаэробных условиях, а также способность к разложению до кислых продуктов сахарозы, галактозы, маннита, маннозы, ксилозы и арабинозы, и по этим признакам определяют видовую принадлежность возбудителя.
РИСУНКИ
|
|