Патент на изобретение №2330850
|
||||||||||||||||||||||||||||||||||||
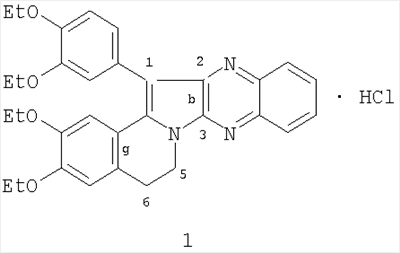
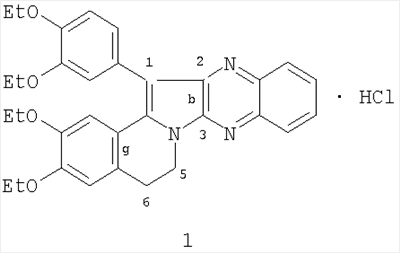
(54) 1-(3,4-ДИЭТОКСИФЕНИЛ)-2,3,5,6-ТЕТРАГИДРО-(3,4-ДИЭТОКСИБЕНЗО)[g]ХИНОКСАЛИНО[2,3-b]ИНДОЛИЗИНА ГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ ПРЯМОЕ АНТИКОАГУЛЯНТНОЕ ДЕЙСТВИЕ
(57) Реферат:
Изобретение относится к новому 1-(3,4-диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлориду формулы: который проявляет прямое антикоагулянтное действие, достоверно увеличивая время свертывания нитратной крови и процент изменения свертываемости в концентрации 1 мг/мл на 36,5%. ЛД50 при внутрибрюшинном введении белым мышам составила 355,0 (310,0÷410,0) мг/кг. Тпл 160-161°С (изопропанол). 1 табл.
Изобретение относится к области органической химии, производным индолизина, а именно новому биологически активному 1-(3,4-диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлориду (1) формулы: обладающего прямым антикоагулянтным действием, что позволяет предположить его использование в медицине в качестве антикоагулянта прямого действия.
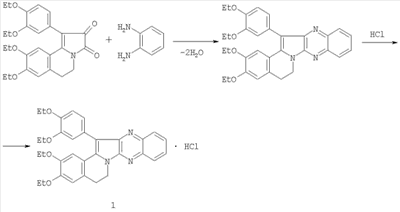
Для получения дикарбонильной составляющей используется основание дротаверина (но-шпы). Субстанция нош-шпы – относительно недорогой продукт промышленного производства, что делает данный метод перспективным. Все вспомогательные вещества также доступны и выпускаются промышленностью. Синтез основания соединения 1 описан [Полыгалова Н.Н., Михайловский А.Г., Вихарева Е.В., Сб. «Азотсодержащие гетероциклы». – М.: ICSPF-Press, 2006. T.2, с.417]. Методика получения 1-(3,4-диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлорида 1. К раствору 4,52 г (0,01 моль) 1-(3,4-диэтоксифенил)-2,3-диоксо-8,9-диэтокси-2,3,5,6-тетрагидропирроло[2,1-а]изохинолина в 15 мл ледяной уксусной кислоты добавляют 1,08 г (0,01 моль) о-фенилендиамина. Смесь кипятят 1 ч, охлаждают, разбавляют 100 мл 25% аммиака, выпавший осадок отфильтровывают, промывают водой, сушат, растворяют в 150 мл этилацетата и пропусканием сухого HCl получают гидрохлорид 1. При переходе вещества из основания в гидрохлорид желтая окраска переходит в ярко-красную. Полученное соединение перекристаллизовывают из изопропанола. Выход гидрохлорида 1 составляет 3,51 г (67%). Заявляемое соединение представляет собой ярко-красное кристаллическое вещество, трудно растворимое в воде, растворимое в хлороформе, ДМСО, ДМФА. Тпл 160-161°С. Вычислено, %: С 68,6; Н 6,1; N 7,5; Cl 6,3. C32H33N3О4·HCl. Найдено, %: С 68,5; Н 6,0; N 7,6; Cl 6,2. В спектре ЯМР 1Н (Varian Mercury 300, 300 МГц, внутренний стандарт – ГМДС) гидрохлорида 1, снятом в CDCl3, имеются сигналы: четыре триплета протонов четырех групп СН3CH2О (1,20-1,80 м.д., J=6,7 Гц); один квадруплет протонов группы ОСН2СН3 в области 3,8 м.д. (J=3,6 Гц) и три квадруплета протонов остальных трех групп ОСН2СН3 в области 4,10-4,33 м.д. (J=3,6 Гц); 3,2 м.д., м, (2Н, 4-СН2-С); 4,82 м.д., м, (2Н, СН2-N); ароматические мультиплеты в области 6,72 – 7,23 м.д. (5Н дротаверина) и 7,70-8,23 м.д. (4Н хиноксалина); 9,1 с (NH+). Масс-спектр основания соединения 1 содержит пик молекулярного иона M=523 (100%) (прибор MAT-311, 70 эв, ЭУ). Соединение 1 исследовали на наличие прямой антикоагулянтной активности. Исследования проведены с помощью коагулометра «Минилаб 701». Для исследования использовали нитратную (3,8%) кровь (9:1). Влияние соединения и эталона сравнения по структуре папаверина гидрохлорида на свертывание крови изучали в одинаковой концентрации 1 мг/мл. В качестве эталона прямой антикоагулянтной активности использовали гепарин, который испытывали в концентрации 1 ЕД/мл крови.
Как видно из таблицы, исследуемое соединение достоверно увеличивает время свертывания цитратной крови на 35,6%, папаверина гидрохлорид в той же концентрации – на 16,8%. Острую токсичность определяли на нелинейных белых мышах массой 20-25 г. Исследуемое вещество вводили внутрибрюшинно в виде водного раствора из расчета 0,5 мл на 10 г массы животного в возрастающих дозах. Результаты обрабатывали по Прозоровскому с вычислением средней смертельной дозы (ЛД50 Острая токсичность (ЛД50) заявляемого соединения составила 355,0 (310,0÷400,9) мг/кг, папаверина гидрохлорида – 96,0 (78,0÷119,0) мг/кг. Таким образом, заявляемое соединение – 1-(3,4-диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлорид – проявляет прямое антикоагулянтное действие, превосходящее по уровню активности аналог по структуре папаверина гидрохлорид при меньшей токсичности, поэтому может найти применение в медицине в качестве антикоагулянта прямого действия. БИБЛИОГРАФИЧЕСКИЙ СПИСОК 4. Полыгалова Н.Н., Михайловский А.Г., Вихарева Е.В. Сб. «Азотсодержащие гетероциклы». – М.: ICSPF-Press, 2006. Т.2, с.417. Формула изобретения
1-(3,4-Диэтоксифенил)-2,3,5,6-тетрагидро-(3,4-диэтоксибензо)[g]хиноксалино[2,3-b]индолизина гидрохлорид, проявляющий прямое антикоагулянтное действие
|
||||||||||||||||||||||||||||||||||||