|
|
(21), (22) Заявка: 2007106607/15, 22.02.2007
(24) Дата начала отсчета срока действия патента:
22.02.2007
(46) Опубликовано: 20.07.2008
(56) Список документов, цитированных в отчете о
поиске:
Валуев Л.И. и др. Ж. Высокомолекулярные соединения, 1993, т.35, №1, с.83-86. Платэ Н.А. и др. Физиологически активные полимеры. – М.: Химия, 1986, с.45. SU 936512 A1, 10.01.1998. RU 2205027 C1, 27.05.2003. RU 2248801 C2, 27.03.2005. RU 2129429 С1, 27.04.1999. RU 2132195 С1, 27.06.1999.
Адрес для переписки:
119991, Москва, ГСП-1, Ленинский пр-кт, 29, ИНХС РАН, патентная группа
|
(72) Автор(ы):
Платэ Николай Альфредович (RU),
Валуев Лев Иванович (RU),
Сытов Геннадий Алексеевич (RU),
Валуев Иван Львович (RU),
Талызенков Юрий Афанасьевич (RU)
(73) Патентообладатель(и):
Ордена Трудового Красного Знамени Институт нефтехимического синтеза им. А.В. Топчиева РАН (ИНХС РАН) (RU)
|
(54) СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННЫХ ФИЗИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
(57) Реферат:
Изобретение относится к области биохимии и медицины, а именно к способу получения иммобилизованных физиологически активных веществ, в частности антикоагулянтов крови, используемых для профилактики и лечения тромбозов, тромбофлебита, тромбоэмболии, тромбоэмболических осложнений и т.д. Способ получения иммобилизованных физиологически активных веществ осуществляют путем взаимодействия физиологически активного вещества с сополимером N-акрилоилгидроксифталимида, имеющим нижнюю критическую температуру смешения, в качестве физиологически активного вещества используют гепарин или гирудин, а в качестве сополимера N-акрилоилгидроксифталимида используют сополимер 1-5 мол.% N-акрилоилгидроксифталимида, 88-98 мол.% N-изопропилакриламида или N,N-диэтилакриламида и 1-7 мол.% акриламида, имеющий молекулярную массу 8900-18000. Способ дает возможность получить полимерные производные антикоагулянтов крови с пониженной молекулярной массой. 3 табл., 1 ил.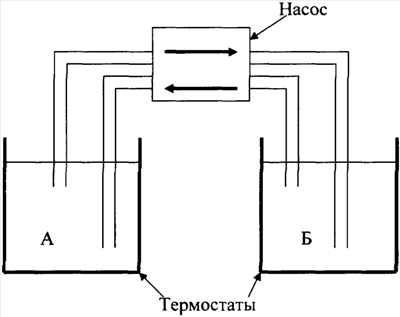
Изобретение относится к области биохимии и медицины, а именно к способу получения иммобилизованных физиологически активных веществ, в частности антикоагулянтов крови, используемых для профилактики и лечения тромбозов, тромбофлебита, тромбоэмболии, тромбоэмболических осложнений и т.д.
Наибольшее распространение в качестве антикоагулянта крови в настоящее время находит гепарин – кислый мукополисахарид, состоящий из остатков глюкуроновой кислоты и глюкозамина, этерифицированных серной кислотой. Относительная молекулярная масса гепарина около 16000. В наибольших количествах он содержится в печени и легких, меньше – в скелетных мышцах, селезенке, мышце сердца. Добывается из легких крупного рогатого скота [Ульянов A.M., Ляпина Л.А. Современные данные о гепарине и его биохимических свойствах. Успехи современной биологии. 1977. Т.83. №1. С.69-85].
Гепарин является естественным противосвертывающим фактором. Механизм действия гепарина, в основном, заключается в нейтрализации свертывающей активности тромбина путем ускорения его реакции с антитромбином III. В наибольшей степени гипокоагуляционный эффект наблюдается при внутривенном введении гепарина. Однако для профилактических целей гепарин часто вводят внутримышечно и подкожно. Применяют для профилактики и терапии различных тромбоэмболических заболеваний и их осложнений: для предотвращения или ограничения (локализации) тромбообразования при остром инфаркте миокарда, при тромбозах и эмболиях магистральных вен и артерий, сосудов мозга, глаза, при операциях на сердце и кровеносных сосудах, для поддержания жидкого состояния крови в аппаратах искусственного кровообращения и аппаратуре для гемодиализа, а также для предотвращения свертывания крови при лабораторных исследованиях [Машковский А.Д. Лекарственные средства. М.: Медицина. 1993. Т.2. С.79-81].
Все известные способы введения антикоагулянтов крови не обеспечивают локальное концентрирование препарата в области тромбообразования, и антикоагулянты распространяются по всему организму, вызывая нежелательное повышение фибринолитической активности во всей кровеносной системе.
Недостатком этого подхода является его сложность и не универсальность: для каждого конкретного лекарства и органа-мишени необходимо искать или синтезировать свои молекулы-векторы и разрабатывать методы иммобилизации, не изменяющие транспортные свойства носителя и физиологическую активность лекарства.
Из приведенных примеров видно, что во всех случаях для придания физиологически активным веществам способности к направленному транспорту их необходимо иммобилизовать на соответствующем носителе.
Известен способ получения иммобилизованных физиологически активных веществ путем взаимодействия физиологически активного вещества с полимерным носителем непосредственно или с помощью специального сочетающего агента [Иммобилизованные ферменты. Под редакцией И.В.Березина, В.К.Антонова и К.Мартинека. Изд-во Московского университета. 1976. T.1. C.213-223]. В качестве физиологически активного вещества используют белки, ферменты, гормоны и т.д., а в качестве полимерного носителя – природные и синтетические полимеры. Среди используемых физиологически активных веществ отсутствуют природные антикоагулянты крови, а среди используемых носителей нет синтетических полимеров, обладающих нижней критической температурой (НКТС). Все это не позволяет использовать полученные иммобилизованные соединения в качестве антикоагулянтов для направленного транспорта.
Известно использование иммобилизованных физиологически активных соединений в качестве гемосовместимых полимерных материалов. Такие материалы получают иммобилизацией ненасыщенного производного гепарина на полимерном носителе [Авторское свидетельство СССР №749071, C08F 267/10, 1980; Авторское свидетельство СССР №1120679, С08F 291/00, 1984]. В результате иммобилизации время свертывания крови при контакте с таким материалом повышается с 3-5 минут (для исходного полимера) до более 20 минут.
Известно использование иммобилизованного гирудина для повышения гемосовместимости полимерных материалов [B.Seifert, P.Romaniuk, T.Groth. Covalent immobilization of hirudin improves the haemocompatibility of polylactide-polyglycolide in vitro. Biomaterials. V.18(22). P.1495-1502. 1997]. Процесс проводят путем иммобилизации гирудина на сополимерах лактидов с гликолидами с помощью глутарового альдегида.
Все полученные гемосовместимые материалы не растворимы в крови, и их используют для изготовления протезов кровеносных сосудов, трубок в аппаратах искусственного кровообращения, деталей имплантируемых в живой организм имплантатов.
Известно получение растворимых производных антикоагулянтов крови, например, гирудина [M.D. Phaneuf, С.К. Ozaki, M.T. Johnstone, J.P. Loza, W.C. Quist, F.W. LoGerfo. Covalent linkage of streptokinase to recombinant hirudin: a novel thrombolytic agent with antithrombotic properties. Thromb. Haemost. V.71 (4). P.481-487. 1994]. Растворимые производные получают реакцией гирудина с природным полимером – стрептокиназой, в присутствии сшивающего агента. Получаемые производные обладают тромболитической и антитромбиновой активностью, но не способны к направленному транспорту.
Известен способ получения растворимых производных гирудина путем взаимодействия гирудина с сополимером N-акрилоилгидроксифталимида, имеющем нижнюю критическую температуру смешения (НКТС) [И.Л.Валуев, А.В.Пан, М.А.Розенфельд, Л.И.Валуев, Н.А.Платэ. Полимерные системы с антитромбиновой активностью для термоактивируемого направленного транспорта. Прикладная биохимия и микробиология. Т.39. №3. С.359-362. 2003]. В качестве сополимера N-акрилоилгидроксифталимида используют сополимер 1-5 мол.% N-акрилоилгидроксифталимида с 95-99 мол.% N,N-диэтилакриламида.
Недостатком этого способа является низкая антитромбиновая активность полученного препарата, которая не превышает 1500 антитромбиновых единиц, что составляет около 6% от активности исходного гирудина. Кроме того, полученный препарат имеет молекулярную массу выше 30000. Это приводит к накапливанию полимера в организме после выполнения лекарственной функции, так как известно, что молекулярная масса синтетических полимеров, при которой полимер способен полностью выводиться из организма, не должна превосходить 30000 [Н.А.Платэ, А.Е.Васильев. Физиологически активные полимеры. М.: Химия. 1986. С.45].
Наиболее близким к заявляемому является способ получения иммобилизованных физиологически активных веществ путем взаимодействия физиологически активного вещества с сополимером N-акрилоилгидроксифталимида, имеющим нижнюю критическую температуру смешения [Л.И.Валуев, О.Н.Зефирова, И.В.Обыденнова, Н.А.Платэ. Водорастворимые полимеры с нижней критической температурой смешения для направленного транспорта лекарственных препаратов и других веществ. Высокомолекулярные соединения. 1993. Т.35. №1. С.83-86]. В качестве физиологически активного вещества используют трипсин, а в качестве сополимера N-акрилоилгидроксифталимида – сополимер 1 мол.% N-акрилоилгидроксифталимида с 91-99 мол.% N-изопропилакриламида 0-8 мол.% акриламида. Получаемый препарат имеет нижнюю критическую температуре смешения 32-38°С и способен растворять фибриновые сгустки.
Недостатком известного подхода является высокая молекулярная масса используемого полимера, равная 150000-200000, а также невозможность использования получаемого препарата в качестве антикоагулянта крови.
Целью предлагаемого изобретения является получение полимерных производных антикоагулянтов крови с пониженной молекулярной массой.
Решение поставленной цели достигается тем, что в способе получения иммобилизованных физиологически активных веществ путем взаимодействия физиологически активного вещества с сополимером N-акрилоилгидроксифталимида, имеющим нижнюю критическую температуру смешения, в качестве физиологически активного вещества используют гепарин или гирудин, а в качестве сополимера N-акрилоилгидроксифталимида используют сополимер 1-5 мол.% N-акрилоилгидроксифталимида, 88-98 мол.% N-изопропилакриламида или N,N-диэтилакриламида и 1-7 мол.% акриламида, имеющий молекулярную массу 8900-18000.
Пример 1. В реакционный сосуд вносят 150 мл диметилформамида, 0,217 г N-акрилоилгидроксифталимида (АФИ), 11,074 г N-изопропилакриламида, 0,071 г акриламида (АА) и 0,45 г катализатора полимеризации – азо-бис-изобутиронитрила. Сосуд вакуумируют до 1-2 мм рт.ст. и выдерживают при 80°С в течение 8 часов. Диметилформамид удаляют испарением, а сополимер очищают путем растворения в холодной воде (5-10°С) с последующим нагреванием раствора до 45-50°С для осаждения сополимера. Молекулярную массу сополимера определяют методом светорассеяния. НКТС сополимера определяют как точку помутнения 0,3%-ного водного раствора при нагревании со скоростью 1 град./мин.
Примеры 2-12. Процесс проводят по примеру 1, используя различные количества сомономеров и катализатора (табл.1). При использовании N,N-диэтилакриламида вместо N-изопропилакриламида в качестве растворителя применяют тетрагидрофуран, а полимеризацию проводят в течение 24 часов при 65°С.
| Таблица 1 |
| № примера |
Состав реакционной смеси, г |
Мольное отношение АФИ:I(II):АА |
Молекулярная масса |
НКТС, °C |
| АФИ |
I или II* |
АА |
Кт |
| 1 |
0.217 |
11.074(I) |
0.071 |
0.45 |
1:98:1 |
8900 |
26 |
| 2 |
0.651 |
10.622(I) |
0.213 |
0.45 |
3:94:3 |
9100 |
28 |
| 3 |
0.868 |
10.396(I) |
0.284 |
0.45 |
4:92:4 |
11200 |
31 |
| 4 |
1.085 |
11.176(II) |
0.497 |
0.45 |
5:88:7 |
10900 |
36 |
| 5 |
0.217 |
11.074(I) |
0.071 |
0.30 |
1:98:1 |
14400 |
22 |
| 6 |
0.651 |
10.622(I) |
0.213 |
0.30 |
3:94:3 |
12200 |
22 |
| 7 |
0.868 |
11.684(II) |
0.284 |
0.30 |
4:92:4 |
15800 |
27 |
| 8 |
1.085 |
9.944(I) |
0.497 |
0.30 |
5:88:7 |
14100 |
33 |
| 9 |
0.217 |
12.446(II) |
0.071 |
0.15 |
1:98:1 |
17300 |
21 |
| 10 |
0.651 |
10.622(I) |
0.213 |
0.15 |
3:94:3 |
17000 |
20 |
| 11 |
0.868 |
10.396(I) |
0.284 |
0.15 |
4:92:4 |
18000 |
24 |
| 12 |
1.085 |
11.176(II) |
0.497 |
0.15 |
5:88:7 |
18300 |
29 |
| * I – N-изопропилакриламид, II – N,N-диэтилакриламид |
Пример 13. В 50 мл воды растворяют 0,1 г сополимера, полученного по примеру 1, и 0,01 г гирудина. Раствор выдерживают при комнатной температуре в течение 24 часов. Раствор нагревают до 45°С. Образующийся осадок отделяют фильтрованием.
Примеры 14-24. Процесс проводят по примеру 1, используя сополимеры, полученные по примерам 2-12, соответственно. Количества соединений, вводимых в реакцию, и свойства полученных продуктов приведены в таблице 2.
НКТС продуктов взаимодействия сополимеров с гирудином или гепарином определяют как точку помутнения 0,3%-ного водного раствора при нагревании раствора со скоростью 1 град./мин.
Для определения антикоагулянтной активности гирудина в составе полученного продукта к 10 мл плазмы крови человека добавляют 0,005 мг продукта, содержащего 0,0005 мг иммобилизованного гирудина, и 0,1 мг тромбина. Измеряют время образования сгустка, которое составляет 36 минут. В контрольном эксперименте время образования сгустка в присутствии 0,0005 мг исходного гирудина равно 50 минут. Таким образом, активность гирудина в составе полученного продукта составляет 72% от активности исходного гирудина.
Время образования сгустка при взаимодействии 10 мл плазмы крови человека с 0,1 мг тромбина в отсутствии исходного и иммобилизованного гирудина равно 52 секундам.
Для определения антикоагулянтной активности гепарина в составе полученного продукта в 10 мл плазмы крови человека растворяют 0,005 мг продукта, содержащего 0,0005 мг иммобилизованного гепарина, и 0,02 мг тромбина. Время образования сгустка равно 27 минутам. Время образования сгустка при использовании 0,0005 мг исходного гепарина равно 32 минутам. Таким образом, активность гепарина в составе полученного продукта составляет 84%.
Для изучения возможности термоактивируемого направленного транспорта полученных продуктов было использовано устройство, изображенное на чертеже. Через отдельно термостатированные сосуды А и Б с помощью насоса прокачивают 100 мл плазмы крови человека. К плазме добавляют 0,005 мг исходного гирудина или продукт взаимодействия гирудина с сополимером, полученный по примеру 16 и содержащий 0,005 мг иммобилизованного гирудина, и 1 мг тромбина. Измеряют время образования сгустка в зависимости от температуры в сосудах и в зависимости от природы добавленного антикоагулянта. Результаты приведены в таблице 3.
| Таблица 2 |
| № примера |
Количество сополимера, г |
Физиологически активное вещество и его количество, г |
НКТС, °С |
Активность физиологически активного вещества, % от исх. |
| 13 |
0,1 |
Гирудин, 0,01 |
31 |
72 |
| 14 |
0,1 |
Гепарин, 0,02 |
33 |
84 |
| 15 |
0,1 |
Гепарин, 0,02 |
37 |
61 |
| 16 |
0,1 |
Гирудин, 0,02 |
42 |
50 |
| 17 |
0,1 |
Гепарин, 0,01 |
26 |
58 |
| 18 |
0,1 |
Гирудин, 0,01 |
29 |
54 |
| 19 |
0,1 |
Гирудин, 0,01 |
34 |
59 |
| 20 |
0,1 |
Гепарин, 0,03 |
42 |
63 |
| 21 |
0,1 |
Гепарин, 0,02 |
28 |
62 |
| 22 |
0,1 |
Гирудин, 0,02 |
29 |
53 |
| 23 |
0,1 |
Гепарин, 0,03 |
35 |
56 |
| 24 |
0,1 |
Гепарин, 0,03 |
40 |
51 |
| Таблица 3 |
| Добавленные к плазме вещества и порядок их добавления |
Время образования сгустка в сосудах. В скобках температура сосуда. |
| А |
Б |
| Гирудин и затем тромбин |
45 мин (37°С) |
45 мин (37°С) |
| Гирудин и затем тромбин |
49 мин (43°С) |
49 мин (37°С) |
| Гирудин в составе продукта и затем тромбин |
33 мин (37°С) |
33 мин (37°С) |
| Гирудин в составе продукта и затем тромбин |
41 мин (43°С) |
4 мин (37°С) |
Видно, что при использовании исходного антикоагулянта время образования сгустка фибрина в обоих сосудах одинаково, независимо от их температуры. При использовании антикоагулянта в составе полученного продукта время образования сгустка зависит от температуры сосуда. При 37°С (ниже НКТС) время образования сгустка в обоих сосудах одинаково. Если температуру в сосуде А поднять до 43°С, то есть выше НКТС, которая для используемого продукта НКТС равно 42°С, то время образования сгустка в этом сосуде равно 41 минуте, в то время как в сосуде Б сгусток образуется за 4 минуты. Это означает, что практически весь продукт и химически связанный с ним антикоагулянт собирается в сосуде А. Таким образом, осуществляется направленный транспорт антикоагулянта в область с повышенной температурой.
В отличие от известного способа получения иммобилизованных антикоагулянтов [И.Л.Валуев, А.В.Пан, М.А.Розенфельд, Л.И.Валуев, Н.А.Платэ. Полимерные системы с антитромбиновой активностью для термоактивируемого направленного транспорта. Прикладная биохимия и микробиология. Т.39. №3. С.359-362. 2003] использование тройного сополимера строго определенного состава обеспечивает получение препарата, в котором антикоагулянтная активность сохраняется на уровне 50% и выше (в известном способе эта величина равна 6%). В отличие от способа-прототипа предлагаемый способ обеспечивает получение способного к термонаправленному транспорту антикоагулянта крови на полимерном носителе с молекулярной массой не выше 18000. В способе-прототипе эта величина превосходит 150000, что делает невозможным практическое применение полученных продуктов из-за их накапливания в организме.
Количественный состав используемого сополимера определяется растворимостью сополимера в воде (при содержании N-акрилоилгидроксифталимида выше 5% сополимер не растворим в воде), а также значениями НКТС в области 28-42°С (при содержании акриламида выше 7% сополимеры не имеют НКТС, то есть непригодны для направленного транспорта).
Формула изобретения
Способ получения иммобилизованных физиологически активных веществ путем взаимодействия физиологически активного вещества с сополимером N-акрилоилгидроксифталимида, имеющем нижнюю критическую температуру смешения, отличающийся тем, что в качестве физиологически активного вещества используют гепарин или гирудин, а в качестве сополимера N-акрилоилгидроксифталимида используют сополимер 1-5 мол.% N-акрилоилгидроксифталимида, 88-98 мол.% N-изопропилакриламида или N,N-диэтилакриламида и 1-7 мол.% акриламида, имеющий молекулярную массу 8900-18000.
РИСУНКИ
|
|