|
|
(21), (22) Заявка: 2006145518/04, 20.12.2006
(24) Дата начала отсчета срока действия патента:
20.12.2006
(46) Опубликовано: 27.06.2008
(56) Список документов, цитированных в отчете о
поиске:
Андриянова Т.А., Минакова С.М. и др. Синтез и противоопухолевая активность диаминовых производных, содержащих  -хлор- -хлор- -гидроксипропильную группу. Химико-фармацевтический журнал, 16(12), с.1460-1463, 1982. Biniecki S., Kabzinska Z. Synthesis of some analogs of 1-(1-naphthoxy)-3-isopropylamino-2-propanol. Acta Poloniae Pharmaceutica, 40(3), p.285-288, 1983. -гидроксипропильную группу. Химико-фармацевтический журнал, 16(12), с.1460-1463, 1982. Biniecki S., Kabzinska Z. Synthesis of some analogs of 1-(1-naphthoxy)-3-isopropylamino-2-propanol. Acta Poloniae Pharmaceutica, 40(3), p.285-288, 1983.
Адрес для переписки:
428015, г.Чебоксары, Московский пр., 15, ЧГУ, ОИС, Н.Б. Шалуновой
|
(72) Автор(ы):
Кузьмин Михаил Владимирович (RU),
Кольцов Николай Иванович (RU)
(73) Патентообладатель(и):
Федеральное государственное образовательное учреждение высшего профессионального образования Чувашский государственный университет им. И.Н. Ульянова (RU)
|
(54) СПОСОБ ПОЛУЧЕНИЯ АЛКАНОЛАМИНОВ
(57) Реферат:
Изобретение относится к способу получения новых алканоламинов общей формулы  где 1. R1=(CH2)2, R2=С6Н5ОСН2; 2. R1=(СН2)6, R2=С6Н5ОСН2; 3. R1=(CH2)2, R2=CH2=CHCH2OCH2; 4. R1=(CH2)6, R2=СН2=СНСН2ОСН2; 5. R1=(CH2)2, R2=HOCH2; 6. R1=(СН2)6, R2=HOCH2; 7. R1=(СН2)6, R2=ClCH2, заключающийся во взаимодействии оксирансодержащих соединений с алифатическими аминами в среде ароматического растворителя при температуре 40-60°С. Соединения формулы (I) могут найти применение в качестве отвердителей-модификаторов эпоксидных и уретановых композиций, а также в качестве промежуточных соединений в органическом синтезе и основы для биологически активных препаратов. 2 з.п. ф-лы, 3 табл. где 1. R1=(CH2)2, R2=С6Н5ОСН2; 2. R1=(СН2)6, R2=С6Н5ОСН2; 3. R1=(CH2)2, R2=CH2=CHCH2OCH2; 4. R1=(CH2)6, R2=СН2=СНСН2ОСН2; 5. R1=(CH2)2, R2=HOCH2; 6. R1=(СН2)6, R2=HOCH2; 7. R1=(СН2)6, R2=ClCH2, заключающийся во взаимодействии оксирансодержащих соединений с алифатическими аминами в среде ароматического растворителя при температуре 40-60°С. Соединения формулы (I) могут найти применение в качестве отвердителей-модификаторов эпоксидных и уретановых композиций, а также в качестве промежуточных соединений в органическом синтезе и основы для биологически активных препаратов. 2 з.п. ф-лы, 3 табл.
Настоящее изобретение относится к органической химии, а именно к способам получения алканоламинов, содержащих амино- и гидроксигруппы, связанные с ациклическими атомами углерода одного и того же углеродного скелета, а именно к способам получения алканоламинов общей формулы:
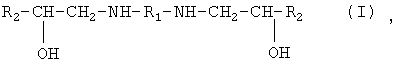
где 1. R1=-(СН2)2 –, R2=С6Н5-O-СН2-;
2. R1=-(СН2)6 –, R2=С6Н5-O-СН2-;
3. R1=-(СН2)2 –, R2=СН2=СН-СН2-O-СН2-;
4. R1=-(СН2)6 –, R2=СН2=СН-СН2-O-СН2-;
5. R1=-(СН2)2 –, R2=НО-СН2-;
6. R1=-(СН2)6 –, R2=НО-СН2-;
7. R1=-(СН2)6 –, R2=Cl-СН2-.
которые широко используются в качестве биологически активных препаратов, промежуточных соединений в органическом синтезе, а также в качестве отвердителей – модификаторов эпоксидных и уретановых композиций.
Известны способы получения этаноламинов взаимодействием окиси этилена и безводного аммиака в реакторе смешения при повышенных температуре и давлении, взаимодействие проводят при различных мольных соотношениях аммиак:окись этилена.
Полученную смесь продуктов взаимодействия направляют на стадию разделения. RU 2167147 7 С07С 215/08, С07С 213/04, 2001.05.20; RU 2162461 7 C07C 213/04, C07C 215/08, 2001.01.27.
Однако данные способы получения алканоламинов из окиси этилена и аммиака включает две основные стадии – синтез и выделение целевых продуктов. В результате проведения стадии синтеза образуется сложная смесь, состав которой зависит от способа синтеза. Это в свою очередь диктует условия проведения стадии разделения реакционной смеси. Причем при разделении получаются моно-, ди- и триэтаноламины, что ограничивает арсенал средств данного назначения.
Известен способ взаимодействия  -окисей (оксирансодержащих соединений) с ароматическими аминами, при этом в качестве -окисей (оксирансодержащих соединений) с ароматическими аминами, при этом в качестве   -окисей с алифатическими аминами [Пирожная Л.Н. Взаимодействие -окисей с алифатическими аминами [Пирожная Л.Н. Взаимодействие 
Известен способ получения новых производных этилендиамина, заключающийся во взаимодействии оксирансодержащего соединения (фенилглицидилового эфира) с алифатическими аминами (этилендиамином) в этиловом спирте путём кипячения в течение 2 часов [Пат. ПНР № 53677, кл. 12q, 1/01 (с07е), заявл. 04.04.65, опубл. 20.07.67].
Наиболее близким аналогом является способ получения 1,2-бис(у-хлор-(3-оксипропиламино)этана взаимодействием этилендиамина с эпихлоргидрином в водном этаноле при температуре 28-30°С при мольном соотношении оксирансодержащие соединения: алифатические амины как 2,3:1,0 и с выходом 50% (Андриянова Т.А., Минакова С.М. и др. “Синтез и противоопухолевая активность производных диаминов, содержащих у-хлор-р-оксипропильные группы”, Химико-фармацевтический журнал, 16(12), стр.1460-1463, 1982).
Однако не известно получение указанным способом алканоламинов общей формулы:  , где 1. R1= (CH2)2, R2=C6H5OCH2; 2. R1=(CH2)6, R2=С6Н5ОСН2; 3. R1=(CH2)2, R2=CH2=CHCH2OCH2; 4. R1=(CH2)6, R2=CH2=CHCH2OCH2; 5. R1=(CH2)2, R2=HOCH2; 6. R1=(CH2)6, R2=HOCH2; 7. R1=(CH2)6, R2=ClCH2 –. , где 1. R1= (CH2)2, R2=C6H5OCH2; 2. R1=(CH2)6, R2=С6Н5ОСН2; 3. R1=(CH2)2, R2=CH2=CHCH2OCH2; 4. R1=(CH2)6, R2=CH2=CHCH2OCH2; 5. R1=(CH2)2, R2=HOCH2; 6. R1=(CH2)6, R2=HOCH2; 7. R1=(CH2)6, R2=ClCH2 –.
При создании изобретения ставилась задача получить алканоламины общей формулы:  , где 1. R1=(CH2)2, R2=C6H5OCH2; 2. R1=(CH2)6, R2=С6Н5ОСН2; 3. R1=(CH2)2, R2=СН2=СНСН2ОСН2; 4. R1=(CH2)6, R2= CH2=CHCH2OCH2; 5. R1=(CH2)2, R2=HOCH2; 6. R1=(CH2)6, R2=HOCH2; 7. R1=(CH2)6, R2=ClCH2 –. , где 1. R1=(CH2)2, R2=C6H5OCH2; 2. R1=(CH2)6, R2=С6Н5ОСН2; 3. R1=(CH2)2, R2=СН2=СНСН2ОСН2; 4. R1=(CH2)6, R2= CH2=CHCH2OCH2; 5. R1=(CH2)2, R2=HOCH2; 6. R1=(CH2)6, R2=HOCH2; 7. R1=(CH2)6, R2=ClCH2 –.
Техническим решением задачи является получение не описанных в литературе соединений, расширяющих арсенал средств данного назначения.
Это достигается тем, что способ получения алканоламинов общей формулы:  , где 1. R1=(CH2)2, R2=C6H5OCH2; 2. R1=(CH2)6, R2=С6Н5ОСН2; 3. R1=(CH2)2, R2=СН2=СНСН2ОСН2; 4. R1=(CH2)6, R2=CH2=CHCH2OCH2; 5. R1=(CH2)2, R2=HOCH2; 6. R1=(CH2)6, R2=HOCH2; 7. R1=(CH2)6, R2=ClCH2 –, включающий взаимодействие оксирансодержащих соединений с алифатическими аминами в среде ароматического растворителя при температуре 40-60°С. , где 1. R1=(CH2)2, R2=C6H5OCH2; 2. R1=(CH2)6, R2=С6Н5ОСН2; 3. R1=(CH2)2, R2=СН2=СНСН2ОСН2; 4. R1=(CH2)6, R2=CH2=CHCH2OCH2; 5. R1=(CH2)2, R2=HOCH2; 6. R1=(CH2)6, R2=HOCH2; 7. R1=(CH2)6, R2=ClCH2 –, включающий взаимодействие оксирансодержащих соединений с алифатическими аминами в среде ароматического растворителя при температуре 40-60°С.
При этом способ в качестве оксирансодержащих соединений может содержать глицидиловые эфиры.
При этом способ в качестве оксирансодержащих соединений может содержать эпихлоргидрин.
Отличием заявленного способа от прототипа заключается в том, что взаимодействие проводят в ароматическом растворителе и при температуре 40-60°С.
Такие условия позволяют получить алканоламины взаимодействием двух молекул оксирансодержащего соединения с алифатическими аминами, проводить реакцию без побочных процессов с получением новых целевых продуктов. При этом получают алканоламины, неописанные в литературе, что расширяет арсенал средств данного назначения.
Для осуществления способа использовали следующие соединения:
Фенилглицидиловый эфир ТУ 6-09-08-715-75; аллилглицидиловый эфир ТУ 6-09-5136-83; эпихлоргидрин ГОСТ 12844-74; глицидол ТУ 6-09-3861-75; гексаметилендиамин ТУ 6-09-36-73; этилендиамин ТУ 6-09-147-75.
Сущность предлагаемого изобретения состоит в том, что способ получения алканоламинов включает взаимодействие оксирансодержащих соединений с алифатическими аминами в среде ароматического растворителя при температуре 40-60°С.
Пример 1. В колбу поместили 10,67 г (0,175 моль) этилендиамина и 10 мл толуола. Затем при постоянном перемешивании и нагревании до 40°С гомогенизировали смесь. В полученную смесь при интенсивном перемешивании добавили через капельную воронку по каплям 52,87 г (0,350 моль) фенилглицидилового эфира, поддерживая температуру 50°С. Через 15 мин после начала прибавления фенилглицидилового эфира начал выпадать осадок. После полного прибавления фенилглицидилового эфира реакционную смесь прогревали еще 3 часа при постоянной температуре и оставляли на 24 часа. Об окончании реакции судили методом ТСХ. Полученный осадок алканоламина отфильтровали и сушили при комнатной температуре. Выход, температура плавления (Тпл), фактор замедления (Rf), брутто-формула полученного соединения приведены в табл.3.
Пример 2. Способ осуществляли аналогично примеру 1. Условия, мольные соотношения и продолжительность способа приведены в табл.1. Выход, температура плавления (Тпл), фактор замедления (Rf), брутто-формула полученного соединения приведены в табл.3.
Пример 3. В колбу поместили 6,13 г (0,102 моль) этилендиамина и 15 мл бензола. Смесь при перемешивании гомогенизировали. В полученную смесь при интенсивном перемешивании добавили по каплям 29,30 г (0,257) аллилглицидилового эфира, поддерживая температуру 40°С. После полного прибавления аллилглицилилового эфира реакционную смесь прогревали еще 3 часа при температуре 50°С и оставляли на 24 часа. Об окончании реакции судили методом ТСХ. Полученный осадок отфильтровали и сушили при комнатной температуре. Выход, температура плавления (Тпл), факторы замедления (Rf), брутто-формула полученного соединения приведены в табл.3.
Пример 4. Способ осуществляли аналогично примеру 3. Условия, мольные соотношения и продолжительность способа приведены в табл.1. Выход, температура плавления (Тпл), факторы замедления (Rf), брутто-формула полученного соединения приведены в табл.3.
Пример 5. В колбу поместили 6,06 г (0,101 моль) этилендиамина и 15 мл толуола. Затем при перемешивании и нагревании до температуры 40°С гомогенизировали смесь. Далее в полученную смесь при интенсивном перемешивании добавили по каплям 16,87 г (0,228 моль) глицидола, поддерживая температуру 40°С. После полного прибавления реакционную смесь прогревали еще 4 часа при постоянной температуре до полного израсходования диамина и оставляли на 24 часа. Об окончании реакции судили методом ТСХ. Полученный осадок отфильтровывали и сушили при комнатной температуре. Выход, температура плавления (Тпл), фактор замедления (Rf), брутто-формула полученного соединения приведены в табл.3.
Пример 6. Способ осуществляли аналогично примеру 1. Условия, мольные соотношения и продолжительность способа приведены в табл.1. Выход, температура плавления (Тпл), фактор замедления (Rf), брутто-формула полученного соединения приведены в табл.3.
Пример 7. Способ осуществляли аналогично примеру 1. Условия, мольные соотношения и продолжительность способа приведены в табл.1. Выход, температура плавления (Тпл), фактор замедления (Rf), брутто-формула полученного соединения приведены в табл.3.
| Таблица 1 |
| № при мера |
Оксирансодержащее соединение |
Алифатический амин |
N1, моль амина |
N2, моль оксирансодержащее соединение |
Условия синтеза |
Растворитель |
V, мл |
| T, °C |
t, ч |
| 1 |
Фенилглицидиловый эфир |
Этилендиамин |
0,175 |
0,350 |
50 |
4 |
толуол |
10 |
| 2 |
Фенилглицидиловый эфир |
Гексаметилендиамин |
0,133 |
0,266 |
60 |
5 |
бензол |
10 |
| 3 |
Аллилглицидиловый эфир |
Этилендиамин |
0,102 |
0,257 |
40-50 |
3 |
бензол |
15 |
| 4 |
Аллилглицидиловый эфир |
Гексаметилендиамин |
0,104 |
0,405 |
50 |
4 |
толуол |
20 |
| 5 |
Глицидол |
Этилендиамин |
0,101 |
0,228 |
40 |
4 |
толуол |
15 |
| 6 |
Глицидол |
Гексаметилендиамин |
0,142 |
0,361 |
45 |
5 |
толуол |
20 |
| 7 |
Эпихлоргидрин |
Гексаметилендиамин |
0,165 |
0,351 |
40-45 |
6 |
бензол |
15 |
Индивидуальность полученных алканоламинов доказывали хроматографированием синтезированных соединений на силуфольной пластинке “Silufol UV-254”, проявление осуществляли парами йода, факторы замедления приведены в табл.3.
Наличие полос поглощения характерных групп, таких как вторичные гидроксигруппы и аминогруппы доказывает структуру полученных алканоламинов. Также присутствие характерных групп в структуре доказывается сигналами 1Н ЯМР спектроскопией.
Данные ИК- и ЯМР 1Н спектров, подтверждающих строение полученных соединений представлены в таблице 2.
| Таблица 2 |
| Данные ИК- и ЯМР 1Н-спектроскопических исследований |
| Соед. |
|
С6Н4 |
-ОН |
=NH |
СН2=СН- |
-СН2– |
-Cl |
| (I) |
ИК |
|
3430-3280 |
1570-1590 |
– |
|
|
| ЯМР 1Н |
6,82 м; 7,2 т |
5,0 с |
4,0 с |
– |
4,3 м; 2,63 м |
|
| (II) |
ИК |
|
3440-3290 |
1570-1590 |
– |
|
|
| ЯМР 1Н |
6,8 м; 7,2 т |
5,0 с |
4,0 с |
– |
1,23 м; 2,33 м; 4,2 д |
|
| (III) |
ИК |
– |
1075-1150 (1134) |
2920-2960 (2945)- |
2975 (2850 ср.) |
1450-1150 (1030-1180)- |
|
| ЯМР 1Н |
|
3,30 с |
1,65 с |
3,95; 5,3 с |
2,60 т |
|
| (IV) |
ИК |
– |
1075-1150 (1134) |
2920-2960 (2945)- |
2975 (2850 ср.) |
1450-1150 (1030-1180)- |
|
| ЯМР 1Н |
|
3,30 с |
1,65 с |
3,95; 5,2 с |
2,60 т, 1,2 д |
|
| (V) |
ИК |
ИК |
3190, 1460 |
3273 |
– |
2950 |
|
| (VI) |
ИК |
ИК |
3190, 1457 |
3270 |
– |
2955 |
|
| (VII) |
ИК |
ИК |
3200, 1460 |
3268 |
|
2950 |
1220, 860 |
Выхода, температуры плавления (Тпл), факторы замедления (R×), брутто-формулы полученных соединений представлены в табл.3.
Таким образом, заявляемым способом были получены алканоламины, не описанные в литературе, с увеличенным выходом целевых продуктов, расширяющие арсенал средств данного назначения.
| Таблица 3 |
| Выход, температуры плавления (Тпл), факторы замедления (Rf), брутто-формулы полученных соединений |
| Алканоламин |
Номер соед-ия |
Выход, % |
Tпл, °C |
Rf * (система)1 |
Брутто-формула |
 |
I |
71,5 |
171-3 |
0,32(А) |
C20H28N2O4 |
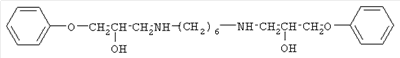 |
II |
68,3 |
131-4 |
0,45(Б) |
C24H36N2O4 |
 |
III |
71,9 |
85 |
0,22(А) 0,16(Б) |
C14H28N2O4 |
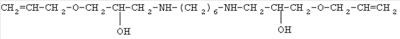 |
IV |
78,3 |
65-66 |
0,74(А) 0,49(Б) |
C18H36N2O4 |
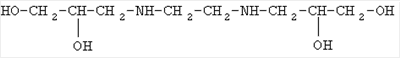 |
V |
43,2 |
104-5 |
0,21(А) |
C8H20N2O4 |
 |
VI |
39,6 |
114-5 |
0,26(А) |
C12H28N2O4 |
 |
VII |
43,2 |
116-7 |
0,52(Б) |
C12H26N2O2Cl2 |
| – элюент: А – этиловый спирт, Б – изопропиловый спирт: бензол (1:2). |
Формула изобретения
1. Способ получения алканоламинов общей формулы  , ,
где 1: R1=(CH2)2, R2=С6Н5ОСН2; 2: R1=(CH2)6, R2=С6Н5ОСН2; 3: R1=(CH2)2, R2=CH2=CHCH2OCH2; 4: R1=(CH2)6, R2=СН2=СНСН2ОСН2; 5 R1=(CH2)2, R2=HOCH2; 6: R1=(CH2)6, R2=HOCH2; 7: R1=(CH2)6, R2=ClCH2, заключающийся в взаимодействии оксирансодержащих соединений с алифатическими аминами в среде ароматического растворителя при температуре 40-60°С.
2. Способ по п.1, заключающийся в том, что он в качестве оксирансодержащих соединений содержит глицидиловые эфиры.
3. Способ по п.1, заключающийся в том, что он в качестве оксирансодержащих соединений содержит эпихлоргидрин.
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 21.12.2008
Извещение опубликовано: 20.09.2010 БИ: 26/2010
|
|