Патент на изобретение №2327679
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 1,2,3,4-ТЕТРААЛКИЛ-1,4-ДИИОД-1,3-БУТАДИЕНОВ
(57) Реферат:
Изобретение относится к способу получения 1,2,3,4-тетраалкил-1,4-дииод-1,3-бутадиенов. Процесс осуществляют путем взаимодействия 1,2-дизамещенных ацетиленов с н-BuMgCl, I2 и CuCl в присутствии катализатора цирконацендихлорида в диэтиловом эфире при 20°С и мольном соотношении R-
Предлагаемое изобретение относится к органической химии, конкретно к усовершенствованному способу получения 1,2,3,4-тетраалкил-1,4-дииод-1,3-бутадиенов общей формулы (I):
где R=C2H5, н-С3Н7, н-С4Н9 Замещенные 1,4-дииод-1,3-бутадиены могут найти применение в тонком органическом и металлоорганическом синтезе в качестве исходных полупродуктов при получении комплексов на основе переходных металлов, замещенных тиофенов, фуранов, циклопентадиенов и пиридинов, а также при получении веществ, обладающих биологической активностью. iMgCl в присутствии стехиометрического количества Ti(OPri)4 в диэтиловом эфире при -50°С, с последующей обработкой реакционной массы эфирным раствором I2 при -50°С по схеме: Известным способом не могут быть получены 1,2,3,4-тетраалкил-1,4-дииод-1,3-бутадиены (1). 2ZrCl2), предварительно обработанного двумя эквивалентами бутиллития (n-BuLi) при -78°С в тетрагидрофуране, с последующим добавлением I2 при температуре -78°С в присутствии 2 экв. CuCl по схеме: Известный способ получения 1,2,3,4-тетраалкил-1,4-дииод-1,3-бутадиенов (1) предполагает использование стехиометрического количества дорогостоящего цирконацендихлорида (Cp2ZrCl2), пирофорного n-BuLi, кроме того, этот процесс энергозатратный, так как в ходе реакции необходимо поддерживать низкую температуру -78°С. Предлагается усовершенствованный способ синтеза 1,2,3,4-тетраалкил-1,4-дииод-1,3-бутадиенов (1). Сущность способа заключается во взаимодействии дизамещенных ацетиленов формулы R- Реакция протекает по схеме: R=C2H5, н-C3H7, н-C4H9 Целевые продукты (1) образуются только лишь с участием дизамещенного ацетилена, н-BuMgCl, I2 и катализатора Cp2ZrCl2. В присутствии других катализаторов на основе комплексов переходных металлов (например, Zr(acac)4, Cp2TiCl2, Pd(acac)2, Ni(acac)2, Fe(асас)3) целевые продукты (1) не образуются. Проведение реакции в присутствии катализатора Cp2ZrCl2 больше 14 мол. % по отношению к ацетилену не приводит к существенному увеличению выхода целевых продуктов (1). Использование в реакции катализатора Cp2ZrCl2 менее 10 мол.% снижает выход МОС (1), что связано со снижением каталитически активных центров в реакционной массе. Опыты проводили при комнатной температуре 20°С. При более высокой температуре (например, 50°С) увеличивается содержание продуктов уплотнения, при меньшей температуре (например, 0°С) снижается скорость реакции. Изменение соотношения исходных реагентов в сторону увеличения содержания н-BuMgCl по отношению к ацетилену не приводит к значительному повышению выхода целевых продуктов (1). Снижение количества н-BuMgCl по отношению к ацетилену уменьшает выход МОС (1). Существенные отличия предлагаемого способа 1. В предлагаемом способе используются в качестве исходного реагента доступный н-BuMgCl и каталитические количества Cp2ZrCl2. В известном способе 1,4-дииод-1,3-бутадиены (1) получают из стехиометрических количеств Cp2ZrCl2 и бутиллития с дополнительной стадией восстановления Cp2ZrCl2 бутиллитием при низкой температуре. Предлагаемый способ обладает следующими преимуществами 1. Способ позволяет получать с высокой селективностью 1,2,3,4-тетраалкил-1,4-дииод-1,3-бутадиены (1) с использованием не стехиометрических, а каталитических количеств дорогостоящего цирконацендихлорида без применения пирофорного н-BuLi. Способ поясняется следующими примерами. ПРИМЕР 1. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке, в атмосфере аргона помещают 1.2 ммоль Cp2ZrCl2, 10 ммоль окт-4-ина и при температуре 0°С 24 ммоль н-BuMgCl (2M раствор в Et2O). Перемешивают при комнатной температуре 3 часа. Далее реакционную массу охлаждают до 0°С, добавляют 1 ммоль CuCl и по каплям прибавляют 26.4 ммоль I2 (эфирный раствор). Температуру доводят до комнатной и перемешивают 4 часа. Получают индивидуальный 4,7-дииод-5,6-дипропил-4,6-декадиен (3) с выходом 51%. Спектральные характеристики 4,7-дииод-5,6-дипропил-4,6-декадиена (3).
Другие примеры, подтверждающие способ, приведены в таблице 1.
Все опыты проводили при комнатной температуре (20°С) в диэтиловом эфире.
Формула изобретения
Способ получения 1,2,3,4-тетраалкил-1,4-дииод-1,3-бутадиенов общей формулы (I)
где R=C2H5, н-С3Н7, н-С4Н9, включающий взаимодействие 1,2-дизамещенных ацетиленов с металлоорганическим соединением в присутствии катализатора цирконацендихлорида (Cp2ZrCl2) в среде растворителя с последующим добавлением I2 в присутствии CuCl, отличающийся тем, что в качестве металлорганического соединения используют BuMgCl при мольном соотношении R-
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -R:н-BuMgCl:Cp2ZrCl2, равном 10:(22-26):(1.0-1.4). Причем добавление хлорида меди (I) и эфирного раствора I2 проводят при 0°С и мольном соотношении компонентов н-BuMgCl:I2=1:1.1 и R-
-R:н-BuMgCl:Cp2ZrCl2, равном 10:(22-26):(1.0-1.4). Причем добавление хлорида меди (I) и эфирного раствора I2 проводят при 0°С и мольном соотношении компонентов н-BuMgCl:I2=1:1.1 и R-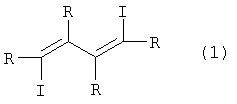



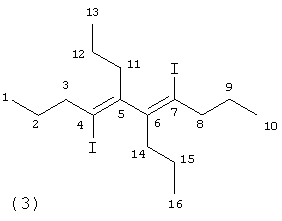
 , м.д.): 13.57 (С13,16), 14.44 (С1,10), 22.45 (С2,9), 22.51 (С12,15), 32.32 (С11,14), 54.75 (С3,8), 115.18 (С4,7), 158.8 (С5,6).
, м.д.): 13.57 (С13,16), 14.44 (С1,10), 22.45 (С2,9), 22.51 (С12,15), 32.32 (С11,14), 54.75 (С3,8), 115.18 (С4,7), 158.8 (С5,6).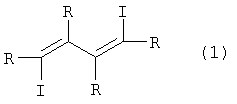 ,
,