|
|
(21), (22) Заявка: 2006143748/14, 12.12.2006
(24) Дата начала отсчета срока действия патента:
12.12.2006
(46) Опубликовано: 27.06.2008
(56) Список документов, цитированных в отчете о
поиске:
Руководство по иммуногистохимической диагностике опухолей человека./ Под ред. С.В.ПЕТРОВА и др. – Казань, 2000, с.287. RU 2244934 С2, 20.01.2005. RU 2147373 C1, 10.04.2000. US 4507391 А, 26.03.1985. ЛИХВАНЦЕВА В.Г. Роль цитокинов в патогенезе и прогнозе увеальной меланомы. – Цитокины и воспаление, 2002, №4. FOLBERG R. et al. The prognostic value of
Адрес для переписки:
119021, Москва, ул. Россолимо, 11, НИИГБ РАМН, Э.П. Тюриной
|
(72) Автор(ы):
Лихванцева Вера Геннадьевна (RU),
Анурова Ольга Александровна (RU),
Верещагина Марина Владимировна (RU)
(73) Патентообладатель(и):
ГУ Научно-исследовательский институт глазных болезней РАМН (RU)
|
(54) СПОСОБ ОДНОВРЕМЕННОЙ ВЕРИФИКАЦИИ И ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ УВЕАЛЬНОЙ МЕЛАНОМЫ
(57) Реферат:
Изобретение относится к области медицины, в частности к офтальмологии, а именно к офтальмоонкологии, и предназначено для одновременной верификации увеальной меланомы и прогнозирования вероятности развития ее метастазов. Способ обеспечивает упрощение исследования при высокой специфичности и чувствительности одновременной верификации увеальной меланомы и прогнозирования ее метастазирования. Проводят иммуногистохимический анализ экспрессии белка S-100 и меланина-А в опухолевых клетках с одновременным подсчетом количества S-100-позитивных клеток в поле зрения. Увеальную меланому верифицируют при положительной реакции S-100 и меланина-А с прогнозированием высокой вероятности метастазирования опухоли при наличии в ней менее 50 S-100-позитивных клеток. 1 табл., 1 ил.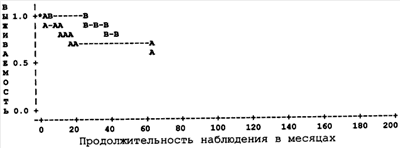
(56) (продолжение):
CLASS=”b560m”tumor blood vessel morphology in primary uveal melanoma., Ophthalmology. 1993 Sep; 100(9): 1389-98.
Изобретение относится к офтальмологии, а именно к офтальмоонкологии, и предназначено для одновременной диагностики и прогнозирования метастазирования увеальной меланомы (УМ).
Согласно современным требованиям к диагностике опухолей человека каждая опухоль должна быть подтверждена не только на световом или гистологическом уровне, но и на иммуногистохимическом (ИГХ) уровне. Сегодня в распоряжении гистологов имеется широкий ряд тканедифферентационных маркеров, с помощью которых проводят верификацию опухолей. Под термином «верификация» подразумевают определение ее тканевого происхождения или гистогенез.
В связи с чем, для уточнения ситуации, а также с целью повышения качества ИГХ-диагностики, мы попытались найти наиболее надежные и точные маркеры для верификации этих опухолей среди других внутриглазных неоплазм. Для этого мы взяли из архива нашего института парафиновые блоки тканей УМ, полученных от 82 пациентов, прооперированных более 5 лет назад, и провели собственные ИГХ-исследования. Целью этих исследований являлась оценка надежности применения того или иного маркера в диагностике или, иными словами, оценка их чувствительности. Это можно было сделать по количеству ложно отрицательных случаев. Для оценки специфичности маркеров мы также взяли и другие внутриглазные опухоли – лейомиосаркому и лимфому. Специфичность ИГХ-маркеров, как правило, анализируется по выявлению ложно позитивных реакций меланоцитарных маркеров в опухолях немеланоцитарного ряда. Попутно мы проводили ретроспективный анализ результатов ИГХ-исследования в корреляции с клиническими данными по выживаемости пациентов.
Оказалось, что практически все маркеры в подавляющем большинстве случаев (94,9-100%) дают позитивную реакцию с S-100, тирозиназой, меланином-А, HMB-45 и MITF. Однако чувствительность различных меланомаспецифических маркеров действительно различается. Справедливости ради, заметим, что эта разница оказалась намного ниже, чем описывали упомянутые авторы (см. табл.1). Результаты проведенных исследований показали, что с помощью одного S-100 нельзя с абсолютной убежденностью утверждать, что S-100-позитивная опухоль – меланома. К этому маркеру давали позитивную реакцию и опухоли миогенного ряда – лейомиосаркома. То есть идет речь о том, что этот маркер не является высокоспецифичным, как например, маркеры меланоцитарного ряда тирозиназа, меланин-А, HMB-45, MITF. Именно последние являются высоко специфичными маркерами и не дают ложно позитивных результатов. Следовательно, их присутствие необходимо для верификации меланом. Вместе с тем они дают ложно негативные результаты. Так, из 82 меланом в 1 случае реакция с тирозиназой оказалась негативной. На практике это означает, что использование только одной тирозиназы в ИГХ-диагностике привело бы к диагностической ошибке. Аналогичная ситуация сложилась бы и при использовании только одного MITF. Этот маркер также давал ложно негативную реакцию с меланомами. Идеальными меланомаспецифическими маркерами оказались НМВ-45 и меланин-А (см. табл).
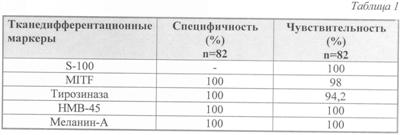
Как показали собственные исследования, применение двух маркеров (S-100 и одного из меланомаспецифических маркеров: меланина-А или НМВ-45) повышает степень надежности ИГХ-диагностики. Преимуществом меланина-А перед НМВ-45 является тот факт, что меланин-А окрашивает премеланосомы, в то время как НМВ-45 – зрелые меланосомы, и не окрашивает опухоли другого генеза. То есть эти два маркера отвечают за 2 различные стадии созревания меланосом. И поскольку различные популяции опухолевых клеток, как правило, находятся на разной стадии зрелости и, следовательно, на разных стадиях меланогенеза, то в УМ обязательно обнаружатся меланин-А-позитивные опухолевые клетки. Что, собственно, и получили мы эмпирическим путем.
Наш ретроспективный анализ также показал, что существует прямая тесная связь между экспрессией S-100 и выживаемостью пациентов. Этот факт по каким-то причинам не нашел отражения в литературе или просто не был замечен другими авторами. Оказалось, что чем меньше в опухоли выявляется S-100-позитивных клеток, тем хуже прогноз. Статистический ретроспективный анализ показал, что критичное количество S-100-позитивных клеток для прогноза – 50. То есть, говоря иными словами, при выявлении в опухоли менее 50 S-100-позитивных клеток вероятность развития метастазов становилась высокой и достигала 82,2%. В качестве доказательства приводим график выживаемости пациентов с двумя диаметрально противоположными показателями в опухоли. Так, согласно этому графику (см. чертеж), среди 28 пациентов, с менее 50 S-100-позитивными клетками в опухоли (страта А), метастазы развились в 9 случаях (32% случаев), а частота их 5-летней выживаемости составила 68%, соответственно. Среди 29 пациентов с  50 S-100-позитивных клеток в опухоли (страта В) метастазирование наступило у 5 человек (17,8% случаев), а показатель выживаемости достиг 82,2%. Разница в показателях выживаемости достоверна. Это подтверждено 3 различными тестами контроля качества проведения исследования. 50 S-100-позитивных клеток в опухоли (страта В) метастазирование наступило у 5 человек (17,8% случаев), а показатель выживаемости достиг 82,2%. Разница в показателях выживаемости достоверна. Это подтверждено 3 различными тестами контроля качества проведения исследования.
В связи с чем в последующей нашей работе мы стали использовать эти два маркера в целях верификации увеальной меланомы, а количественный анализ S-100-позитивных клеток в опухоли служил нам в качестве маркера для прогнозирования метастазирования.
Задачей предлагаемого изобретения является разработка такого способа, который позволял бы одновременно не только верифицировать увеальную меланому, но и прогнозировать вероятность развития ее метастазов.
Техническим результатом является решение одновременно двух задач (верификация опухоли и прогнозирование вероятности ее метастазирования) с помощью только двух маркеров (S-100 и меланина-А) и одноэтапного иммуногистохимического исследования, что обеспечивает упрощение способа с позитивным экономическим эффектом.
Технический результат достигается за счет использования двух тканедифферентационных маркеров S-100 и меланина-А, отвечающих за принадлежность опухоли к неоплазмам меланоцитарного ряда.
Предлагаемый нами способ прогнозирования осуществляют следующим образом.
1. После энуклеации глаза с увеальной меланомой готовят парафиновые срезы толщиной 3-5 микрон по стандарной методике, депарафинируют в ксилоле и регидратируют в батарее спиртов.
2. Иммуногистохимическое исследование проводят по стандартной методике. Для открытия антигенных детерминант проводят обработку срезов в цитратном буфере [рН 6,0] в течение 30 минут при 95°С на водяной бане.
3. Инкубацию с первичными антителами проводят в течение ночи при 4°С. Для визуализации реакции антиген-антитело используют стрептавидинбиотиновую тест-систему LSAB+kit [DAKO Corp] согласно инструкции. В качестве хромогена используют ДАБ+[DAKO Corp]. В качестве первичных антител используют кроличьи поликлональные антитела к S-100 (разведение 1:500, DAKO Corp) и меланина-А (разведение 1:80, DAKO Corp).
4. Затем срезы докрашивают гематоксилином Майера и заключают в канадский бальзам.
5. Реакцию оценивают с применением светового микроскопа (увеличение ×400) по следующим критериям. Отрицательной считали реакцию при отсутствии специфического окрашивания опухолевых клеток на всей площади опухолевой ткани. Положительную реакцию расценивали при окрашивании опухолевых клеток. При позитивной реакции опухолевых клеток с двумя маркерами опухоль верифицируют как увеальную меланому.
6. Количественную оценку экспрессии маркера S-100 по срезу определяют как число иммунопозитивных клеток в поле зрения микроскопа при увеличении × 400. В случае, где число S-100-позитивных клеток не достигает 50, определяют высокий риск развития метастазов. Если число S-100 позитивных клеток в опухоли более или равно 50, то считают, что риск развития метастазов для пациента невысок.
Пример 1. Пациент 54 года. Диагноз: УМ в стадии Т3NoMo на правом глазу. Проведено органосохранное лечение в объеме иридоциклхориоидэктомии. Иммуногистохимические исследования парафинового среза опухоли по указанному способу выявили S-100-позитивную и меланин-А-позитивную опухоль, которую верифицировали как меланому. Подсчитали количество S-100-позитивных клеток на срезе УМ при увеличении × 400: их оказалось 17. Больной отнесен в группу высокого риска развития метастазов. Назначены укороченные интервалы между визитами врача. По истечении 8 месяцев наблюдения после проведенной операции у больного выявлены метастазы в печени. Проведена иммунотерапия с целью замедления скорости метастазирования.
Пример 2. Пациентка 72 лет. Перенесла энуклеацию левого глаза по поводу УМ в стадии T4NoMo. Иммуногистохимически выявили S-100-позитивную и меланин-А-позитивную опухоль, которую верифицировали как увеальную меланому. Подсчитали количество S-100-позитивных клеток. На срезе УМ при увеличении × 400 их оказалось 87. Пациент отнесен к группе низкого риска развития метастазов. Продолжительное наблюдение за пациентом в течение 3-х лет показало благоприятное течение заболевание и отсутствие метастазов.
Таким образом, предложенный способ с высокой степенью вероятности позволяет одновременно проводить как верификацию увеальной меланомы, так и оценивать прогноз ее течения, что позволяет осуществлять отбор пациентов в группу риска развития метастазов и обосновывает тактику ведения больных с данной патологией. При этом использование всего двух маркеров позволяет сократить продолжительность исследования и экономические затраты на их проведение.
Формула изобретения
Способ одновременной верификации увеальной меланомы и прогнозирования ее метастазирования, включающий проведение иммуногистохимического анализа экспрессии белка S-100 и меланина-А с одновременным подсчетом количества S-100-позитивных опухолевых клеток в поле зрения, и верификацию увеальной меланомы при положительной реакции S-100 и меланина-А с прогнозированием высокой вероятности метастазирования опухоли при наличии в ней менее 50 S-100-позитивных клеток.
РИСУНКИ
|
|