|
|
(21), (22) Заявка: 2006137395/04, 23.10.2006
(24) Дата начала отсчета срока действия патента:
23.10.2006
(46) Опубликовано: 20.06.2008
(56) Список документов, цитированных в отчете о
поиске:
Адрес для переписки:
630090, г.Новосибирск, просп. Акад. Лаврентьева, 8, ИХБФМ СО РАН, директору
|
(72) Автор(ы):
Абрамова Татьяна Вениаминовна (RU),
Васильева Светлана Викторовна (RU),
Серпокрылова Инна Юрьевна (RU),
Власов Валентин Викторович (RU),
Сильников Владимир Николаевич (RU)
(73) Патентообладатель(и):
Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук (СО РАН) (RU),
Общество с ограниченной ответственностью “НаноТех-С” (RU)
|
(54) СПОСОБ ПОЛУЧЕНИЯ СОЛЕЙ 5′-ТРИФОСФАТОВ ДЕЗОКСИРИБО- И РИБООЛИГОНУКЛЕОТИДОВ
(57) Реферат:
Изобретение относится к способу получения солей 5′-трифосфатов дезоксирибо- и рибоолигонуклеотидов общей формулы, указанной в описании. Исходный реагент тетраалкиламмониевую или триалкиламмониевую соль 5′-монофосфата дезокси- или рибоолигонуклеотида в виде 0,1-0,5 М раствора активируют в среде растворителя, представляющего смесь диметилсульфоксида и диметилформамида в соотношении 2:1, пяти-пятнадцатикратным избытком окислительно-восстановительной смеси трифенилфосфина и дипиридилдисульфида, взятых в соотношении 1:1, в присутствии 50-80 кратного избытка 1-метилимидазола или N,N-диметиламинопиридина в течение 5-10 минут, а далее добавляют 10-20 кратный избыток раствора бис-трибутиламмонийной соли пирофосфата в ацетонитриле и выдерживают реакционную смесь в течение 15-30 минут с последующим выделением и очисткой целевого продукта. Способ обеспечивает повышение выхода целевых продуктов, сокращение избытка используемых реагентов и объемов растворителей. 1 ил., 3 табл.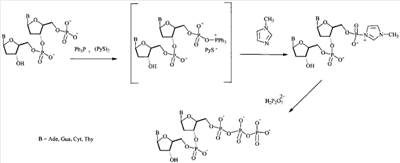
Изобретение относится к области биоорганической химии, в частности к усовершенствованному способу получения 5′-трифосфатов дезоксирибо- и рибоолигонуклеотидов общей формулы:
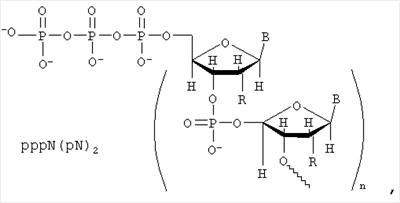
где В – Thy, Ade, Cyt, Gua, Ura или другое гетероциклическое основание;
R – Н или ОН;
n- 1. 1.
5′-Трифосфаты дезоксирибо- и рибоолигонуклеотидов применяются в молекулярно-биологических и генно-инженерных исследованиях, однако коммерчески малодоступны из-за отсутствия универсального и эффективного способа синтеза этих соединений. Доступность 5′-трифосфатов дезоксирибо- и рибоолигонуклеотидов позволит широко использовать эти соединения при изучении процессов нуклеинового обмена (например, процессинга пре-мРНК).
Недостатком этого способа является то, что при обработке исходного динуклеотида хлорокисью фосфора на первой стадии синтеза происходит полная изомеризация межнуклеотидной фосфодиэфирной связи с образованием смеси 2′(3′)-5′-фосфодиэфирных связей, что снижает выход целевого соединения в 2 раза и усложняет процедуру его очистки.
2+ с последующим получением 5′-трифосфатного производного олигорибонуклеотида ферментативным путем.
Недостатком этого способа является то, что он не пригоден для получения 5′-трифосфатов олигорибонуклеотидов с природными 3′-5′-фосфодиэфирными связями. Кроме того, с помощью указанного способа можно синтезировать только производные аденозина.
2, pppdT3, pppdT9, pppdT15, pppd(ACTGT) и pppdC2. Выходы продуктов после очистки составляют 15-30%.
Недостатками указанного способа являются:
1) Использование огромных избытков реагентов (до 3000-х кратного для 2-хлоро-4Н1,3,2-бензодиоксафосфорин-4-она и до 6000-ти кратного для пирофосфата), а также больших объемов растворителей в расчете на мкмоль исходного соединения.
2) Низкие выходы целевых соединений – 15-30%.
3) Малое количество получаемого продукта, не превышающего 2-5 мкмоль (2-5 мг), и трудности в масштабировании процесса.
4) Наличие значительных количеств побочных продуктов.
Технической задачей изобретения является повышение выхода целевых продуктов, сокращение избытка используемых реагентов и растворителей, а также расширение функциональных возможностей способа за счет обеспечения возможности получения 5′-трифосфатов олигонуклеотидов не только дезоксирибо, но и риборяда
Поставленная техническая задача достигается предлагаемым новым способом получения 5′-трифосфатов олигонуклеотидов как дезксирибо-, так и риборяда с формулой pppN(pN)n, заключающимся в следующем.
На чертеже представлена схема синтеза 5′-трифосфата дезоксирибо- и рибоолигонуклеотида на примере синтеза 5′-трифосфата дезоксидинуклеотида, где В – Ade, Gua, Cyt, Thy.
Синтез осуществляют в две стадии в растворе при комнатной температуре. На первой стадии исходный реагент – тетраалкиламмониевую или триалкиламмониевую соль 5′-монофосфата дезокси- или рибоолигонуклеотида в виде 0,1-0,5 М раствора активируют в органическом растворителе, в качестве которого используют смесь диметилсульфоксида (ДМСО) и диметилформамида (ДМФ) в соотношении 2:1, пяти-пятнадцатикратным избытком окислительно-восстановительной смеси трифенилфосфина с дипиридилдисульфидом (Ph3Р/(PyS)2), взятых в соотношении 1:1, в присутствии 50-80-кратного избытка нуклеофильного катализатора, преимущественно 1-метилимидазола или N,N-диметиламинопиридина, в течение 5-10 мин с получением активированного производного 5′-монофосфата дезокси- или рибоолигонуклеотида. На второй стадии в раствор активированного монофосфорилированного олигонуклеотида добавляют 10-20 кратный избыток раствора бис-трибутиламмонийной соли пирофосфата в ацетонитриле и выдерживают смесь в течение 15-30 минут. На момент окончания реакции 5′-трифосфаты дезоксирибо- и рибоолигонуклеотидов находятся в виде смеси тетраалкиламмониевых или триалкиламмониевых солей (целевые продукты). Коммерческие (конечные формы целевых продуктов) продукты получают преимущественно в виде литиевых солей, поскольку они наиболее стабильны при хранении. Для этого, после завершения реакции целевой продукт, а также избыток пирофосфата, осаждают десятикратным объемом 6% раствора перхлората лития в ацетоне. Осадок промывают ацетоном и серным эфиром и высушивают.Очистку целевого продукта проводят с помощью двух последовательных анионообменных хроматографий на сорбенте Полисил СА и ДЕАЕ-Сефадексе А-25. Чистота полученных соединений более 95% по данным аналитической высокоэффективной жидкостной хроматографии (ВЭЖХ).
Выходы целевых 5′-трифосфатов дезокси- и рибоолигонуклеотидов после очистки составляют 52-92% в зависимости от нуклеотидной последовательности и длины олигонуклеотида. Количество получаемых продуктов составляет 10-100 мкмоль (10-100 мг) и выше. Выходы 5′-трифосфатов дезокси- и рибоолигонуклеотидов приведены в Таблице 1, а выходы солевых форм целевых продуктов в Таблице 3.
Строение полученных соединений подтверждено с помощью 31P- и 1Н-ЯМР-спектроскопии. Данные по некоторым соединениям приведены в Таблицах 2 и 3.
 260 260
Определяющими отличиями предлагаемого способа от прототипа, являются:
1. Синтез проводят в растворе, при этом в качестве исходного реагента используют 0.1-0.5 М раствор тетраалкиламмониевой или триалкиламмониевой соли 5′-монофосфата дезокси- или рибоолигонуклеотида, что позволяет избежать высоких избытков реагентов, а также больших объемов растворителей в расчете на мкмоль исходного реагента, а также легко масштабировать процесс, что обеспечивает получение больших (милимолярных) количеств продукта. В прототипе получение продукта осуществляют в твердофазном варианте, а в качестве исходного реагента используют соответствующим образом защищенный дезоксиолигонуклеотид (защитные группы на гетероциклических основаниях нуклеозидов и межнуклеотидных фосфатных группах, свободная 5′-оксигруппа дезоксиолигонуклеотидной цепи), взятый непосредственно из реакционной смеси в процессе синтеза олигонуклеотида. Таким образом, в заявляемом способе получения 5′-трифосфатов дезокси- и рибоолигонуклеотидов стадии введения 5′-монофосфата в олигонуклеотид и активации фосфомоноэфирной группировки разделены, что позволяет проводить синтез без применения защитных групп на гетероциклических основаниях нуклеозидов и межнуклеотидных фосфатных группах.
2. Исходный реагент активируют в органическом растворителе, представляющем смесь диметилсульфоксида и диметилформамида в соотношении 2:1, пяти-пятнадцатикратным избытком окислительно-восстановительной смеси трифенилфосфина и дипиридилдисульфида (соотношение 1:1) в присутствии 50-80-кратного избытка нуклеофильного катализатора, преимущественно 1-метилимидазола или N,N-диметиламинопиридина, в течение 5-10 минут, что позволяет селективно активировать только концевую моноэфирную фосфатную группу, не затрагивая межнуклеотидных фосфодиэфирных связей и гетероциклических оснований, и использовать в качестве исходных соединений деблокированные и очищенные 5′-монофосфорилированные дезокси- или рибоолигонуклеотиды.
В прототипе в качестве активирующего реагента используют 3000-кратный избыток 2-хлоро-4Н1,3,2-бензодиоксафосфорин-4-она.
3. Активированный монофосфорилированный олигонуклеотид обрабатывают 10-20 кратным избытком раствора бис-трибутиламмонийной соли пирофосфата в ацетонитриле, и выдерживают реакционную смесь в течение 15-30 минут, что позволяет повысить выход целевого продукта и существенно сократить расход пирофосфата. В прототипе используют 6000-кратный избыток пирофосфата.
Способ иллюстрируется следующими примерами конкретного выполнения.
Пример 1.
Получение 5′-[2′-дезокситимидин-(3′-5′)-2′-дезокситимидилил]трифосфата.
В круглодонную колбу вместимостью 50 мл загружают 20 мл раствора цетилтриметиламмониевой соли 5′-[2′-дезокситимидин-(3′-5′)-2′-дезокситимидилил]фосфата (pdT2) концентрацией 42 О.Е./мл в 40%-ном водном этаноле. Раствор упаривают на ротационном испарителе при пониженном давлении при температуре 40°С досуха, добавляют к остатку в колбе 10 мл сухого ацетонитрила, упаривают раствор досуха. Повторяют эту операцию дважды. Остаток в колбе растворяют в 10 мл смеси диметилсульфоксида и диметилформамида (2:1) (концентрация дезоксидинуклеотида 0.5 М), добавляют в раствор 65,6 мг трифенилфосфина, 55,1 мг дипиридилдисульфида (пятикратный избыток пары Ph3Р/(PyS)2) и 0,213 мл (50-кратный избыток) 1-метилимидазола. Реакционную смесь перемешивают 5 минут при комнатной температуре, затем в раствор добавляют 1 мл 0.5 М раствора бис(трибутил)аммонийной соли пирофосфата (10-кратный избыток) в сухом ацетонитриле. Перемешивание продолжают 30 минут, затем реакционную смесь выливают в 100 мл 6% раствора перхлората лития в ацетоне. Осадок отделяют фильтрованием, промывают ацетоном и серным эфиром и высушивают в вакууме. После высушивания осадок растворяют в 20 мл воды, раствор наносят на колонку 4.6×250 мм с анионообменным сорбентом Полисил СА (НПО Вектор, Россия). Элюцию осуществляют в линейном градиенте сульфата аммония (0-0,8 М) в течение 1.5 часов со скоростью 2 мл/мин в 20% водном ацетонитриле. Фракции, содержащие целевой продукт, разбавляют в 10 раз водой. Раствор наносят на колонку 3×9 см с ДЭАЭ-сефадексом А-25 (Pharmacia, Швеция). Элюцию осуществляют в линейном градиенте бикарбоната аммония (0-1 М) в 20% водном этаноле. Объем градиента 600 мл. Фракции, содержащие целевой продукт, упаривают в вакууме с помощью ротационного испарителя при температуре 40°С. Остаток упаривают несколько раз с водным этанолом для удаления следов буфера. Продукт – 5′-[2′-дезокситимидилил-(3′-5′)-2′-дезокситимидин]трифосфат pppd(TT) – растворяют в 1 мл воды и осаждают добавлением 10 мл 6% раствора перхлората лития в ацетоне. Осадок отделяют центрифугированим или фильтрованием, промывают ацетоном и высушивают до постоянного веса в вакууме. Выход pppd(TT) 37.0 мг, 46 мкмоль, 92% (в виде литиевой соли).
Пример 2.
Получение 5′-[уридилил-(3′-5′)-уридин]трифосфата (pppUU) проводят также, как в примере 1, за исключением того, что в качестве исходного соединения берут 5′-[уридилил-(3′-5′)-уридин]фосфат pU2 в виде тетрабутиламмониевой соли. В качестве нуклеофильного катализатора применяют N,N-диметиламинопиридин. Из 960 ОЕ260 (50 мкмоль) 5′-монофосфата 5′-[уридилил-(3′-5′)-уридин]фосфата pU2 получают 34 мг pppUU (в виде литиевой соли, 42 мкмоль, выход 84%).
Пример 3.
Получение 5′-трифосфата дезокситридекануклеотида pppd[Т(СТ)6] проводят аналогично примеру 1, со следующими отличиями. В качестве исходного соединения берут цетилтриметиламмониевую соль 5′-монофосфатдезокситридекануклеотида pd[Т(СТ)6]. Концентрация исходного соединения в реакционной смеси 0.1 М. Избыток активирующей окислительно-восстановительной пары Ph3Р/(PyS)2 15-кратный. Избыток нуклеофильного катализатора 1-метилимидазола 80-кратный. Стадию активации проводят в течение 10 минут. Избыток бис-трибутиламмониевой соли пирофосфата 20-кратный, при этом реакционную смесь выдерживают 15 минут. Из 10 мкмоль исходного 5′-монофосфатдезокситридекануклеотида pd[Т(СТ)6] получают 20 мг 5′-трифосфат pppd[Т(СТ)6] (в виде литиевой соли, 4.85 мкмоль, выход 48%).
Пример 4.
Получение 5′-трифосфата риботетрацитидилата ррр(С)4 проводят аналогично примеру 3, за исключением того, что в качестве исходного соединения берут трибутиламмониевую соль 5′-монофосфата тетрацитидилата р(С)4. Из 10 мкмоль исходного р(С)4 получают 12 мг ррр(С)4 (в виде литиевой соли, 8.5 мкмоль, выход 85%).
Пример 5.
Получение 5′-[2′-дезокситимидин-(3′-5′)-2′-дезокситимидилил]трифосфата проводят аналогично примеру 1, за исключением того, что для осаждения целевого продукта берут 6% раствор перхлората натрия в ацетоне. Выход pppd(TT) 38.3 мг, 45 мкмоль, 90% (в виде натриевой соли).
Пример 6.
Получение 5′-[2′-дезокситимидин-(3′-5′)-2′-дезокситимидилил]трифосфата проводят аналогично примеру 1, за исключением того, что остаток после упаривания с водным этанолом высушивают до постоянного веса в вакууме. Выход pppd(TT) 37.7 мг, 45 мкмоль, 90% (в виде аммониевой соли).
Таким образом, разработан универсальный способ получения 5′-трифосфатов дезокси- и рибоолигонуклеотидов в милимолярных количествах с высокими выходами, меньшим избытком реагентов и объемов растворителей, необходимых при синтезе.
Способ получения 5-трифосфатов дезоксирибо- и рибоолигонуклеотидов
Таблица 1 |
| Олигонуклеотид |
pppd(AA) |
pppd(AC) |
pppd(AG) |
pppd(AT) |
pppd(CA) |
| Выход, в %, |
61 |
58 |
52 |
69 |
59 |
| Олигонуклеотид |
pppd(GG) |
pppd(GT) |
pppd(TA) |
pppd(TC) |
pppd(TG) |
| Выход, в % |
56 |
56 |
54 |
88 |
62 |
| Олигонуклеотид |
pppd(CC) |
pppd(CG) |
pppd(CT) |
pppd(GA) |
pppd(GC) |
| Выход, в % |
87 |
73 |
91 |
54 |
61 |
| Олигонуклеотид |
ррр(ТТ) |
ppp(UU) |
ррр(СА) |
ррр(С)4 |
pppd(CA)2 |
| Выход, в % |
92 |
84 |
73 |
85 |
78 |
| Таблица 3. |
| Продукт |
Солевая форма (противоион) |
Выход, % |
31P,  (ppm) (ppm) |
| ррр(ТТ) |
Литиевая соль |
92 |
1.23 (s, 1P, PТТ,); -7.17 (d, 1P, P , J , J  , 20); -9.10 (d, 1P, P , 20); -9.10 (d, 1P, P , J , J  , 19.5); -20.21 (t, 1P, P , 19.5); -20.21 (t, 1P, P ) ) |
| |
Натриевая соль |
90 |
1.22 (s, 1P, PTT,); -7.15 (d, 1P, P , J , J  , 20); -9.14 (d, 1P, P , 20); -9.14 (d, 1P, P , J , J  , 19.5); -20.20 (t, 1Р, Р , 19.5); -20.20 (t, 1Р, Р ) ) |
| |
Аммониевая соль |
90 |
1.25 (s, 1P, PTT,); -8.95 (d, 1P, P , J , J  , 20); -10.15 (d, 1P, P , 20); -10.15 (d, 1P, P , J , J  , 19.5); -20.50 (t, 1P, P , 19.5); -20.50 (t, 1P, P ) ) |

Формула изобретения
Способ получения солей 5′-трифосфатов дезокси- и рибоолигонуклеотидов, заключающийся в том, что исходный реагент тетраалкиламмониевую или триалкиламмониевую соль 5′-монофосфата дезокси- или рибоолигонуклеотида в виде 0,1-0,5 М раствора активируют в среде растворителя, представляющего смесь диметилсульфоксида и диметилформамида в соотношении 2:1, пяти-пятнадцатикратным избытком окислительно-восстановительной смеси трифенилфосфина и дипиридилдисульфида, взятых в соотношении 1:1, в присутствии 50-80-кратного избытка 1-метилимидазола или N,N-диметиламинопиридина в течение 5-10 мин, а далее добавляют 10-20-кратный избыток раствора бис-трибутиламмонийной соли пирофосфата в ацетонитриле и выдерживают реакционную смесь в течение 15-30 мин с последующим выделением и очисткой целевого продукта.
РИСУНКИ
|
|