Патент на изобретение №2326878
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ЗАМЕЩЕННЫЕ 2-(1,2,4-ТРИАЗОЛ-1-ИЛМЕТИЛ)-6-БЕНЗИЛИДЕН-1,4-ДИОКСАСПИРО[4.5]ДЕКАНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ
(57) Реферат:
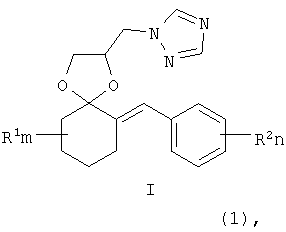
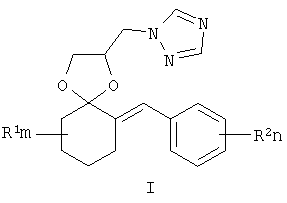
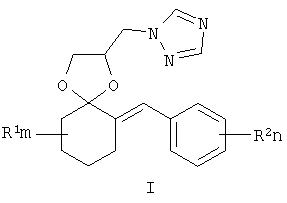
Изобретение относится к новым замещенным 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканам формулы I:
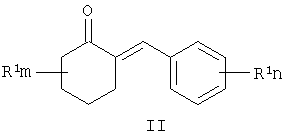
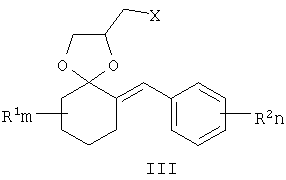
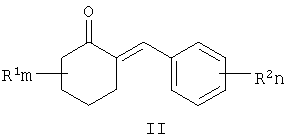
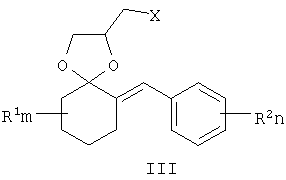
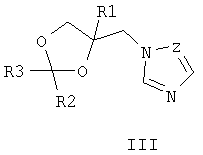
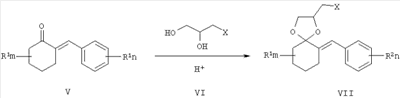
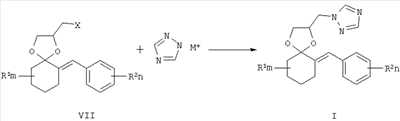
где R1, R=H, Hal и др., m, n=0-5, и способу их получения, который заключается в конденсации замещенных 2-бензилиденциклогексанонов II с 3-галоген-1,3-пропандиолами при катализе кислотами с азеотропной отгонкой воды в органических растворителях с получением замещенных 2-галогенметил-6-бензилиден-1,4-диоксаспиро[4.5]деканов формулы III и алкилированием их 1,2,4-триазолатами щелочных металлов в среде полярных апротонных растворителей при температуре от 60 до 180°С.
Изобретение также относится к фунгицидной композиции, содержащей замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы формулы I, например оксалат 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана, который показывает фунгитоксичность выше, чем у эталона триадимефона. 3 н.п. ф-лы, 1 табл.
Изобретение относится к химии гетероциклических соединений, а именно к замещенным 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5] деканам общей формулы I:
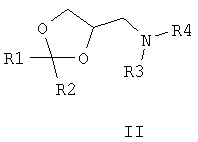
где R1 – одинаковые или разные, означают атом водорода, алкильную группу с числом атомов углерода от 1 до 6; где R2 – одинаковые или разные, означают атом водорода или галогена; m и n означают целые числа от 0 до 5; к их солям с кислотами, или комплексам с солями металлов, обладающими фунгицидной активностью. Соединения общей формулы I могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов. Изобретение относится также к способам получения соединений общей формулы I, к использованию этих соединений в композициях с другими активными и вспомогательными соединениями для борьбы с грибными болезнями растительных организмов, животных или человека. Известны многие продукты с азольными и диоксолановыми циклами, в частности замещенные 4-аминометил-1,3-диоксоланы, общей формулы II, где R1, R2, R3, R4 означают алкильный, циклоалкильный, алкенильный, арильный, гетероциклический заместители [патент США №4503059, МКИ C07D 317/16, заявл. 20.05.1983, опубл. 05.03.85], проявляющие фунгицидные свойства.
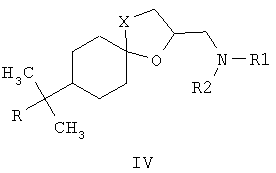
Известны 4-азолилметилзамещенные 1,3-диоксоланы с фунгицидной активностью общей формулы III, где R1 означает атом водорода, алкильный, циклоалкильный или ароматический заместители, R2 и R3 означают атом водорода, алкильный, арильный, а также R2 и R3 совместно могут представлять полиметиленовую группу, Z означает атом углерода или атом азота [патент Великобретании №2095236, МКИ A01N 43/50, заявл. 22.02.1982, опубл. 29.09.1982]. Наиболее близкими к заявленным замещенным 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканам по структуре и по способу получения являются соединения общей формулы IV, где R представляет собой атом водорода, алкильный заместитель с разветвленной или неразветвленной цепью и с числом атомов углерода от 1 до 6, а также циклогексильный и фенильный фрагменты, замещенные атомами водорода или имеющими от 1 до 3 разных или одинаковых алкильных заместителей с числом атомов углерода или галогенов от 1 до 4; R1 и R2 могут представлять собой атом водорода, алкил, с числом углеродных атомов от 1 до 12, алкенил или алкинил, с числом атомов углерода от 3 до 8, гидроксиалкил, с числом атомов углерода от 3 до 6, алкоксикарбонил, с числом атомов углерода от 1 до 6, циклоалкил, циклоалкилалкил, с числом атомов углерода от 3 до 7, диоксоланилалкил, диоксанилалкил, оксоланилалкил, с числом атомов углерода от 1 до 4, арилалкил, арилалкенил, арилалкинил, с числом атомов углерода от 6 до 10; R1 вместе с R2 и совместно с атомом азота могут представлять собой гетероциклические радикалы: пирролидинил-, морфолинил-, пиперидинил-, тиоморфолинил-, азепанил-, замещенные алкильными или гидроксиалкильными заместителями с числом атомов углерода от 1 до 4 [патент ФРГ №3735555, МКИ C07D 317/72, заявл. 21.10.1987, опубл. 15.09.1988], обладающие фунгицидной активностью. Соединения общей формулы IV получают взаимодействием 2-хлорметил-1,4-диоксаспиро[4.5]деканов с аминами в среде амина или диметилформамида при нагревании. Наиболее эффективным из упомянутых в патенте соединений является спироксамин (8-трет-бутил-1,4-диокса[4.5]декан-2-илметил(этил)(пропил)амин), находящий применение для борьбы с грибными болезнями растений в период вегетации. Нормы расхода этого препарата при защите, например, зерновых культур сравнительно высоки и составляют 500-750 г/га, в то время как такой широко используемый фунгицид как триадимефон на зерновых культурах применяют с нормами расхода 125-500 г/га [The world compendium. The e-Pesticides Manual 2000-2001. 12th Version 2.0. Ed. C.D.S. Tomlin-British Crop Protection Council]. Техническая задача данного изобретения состоит в увеличении эффективности фунгицидных препаратов и расширении их ассортимента. Поставленная задача заключается в получении соединений общей формулы I, обладающих фунгицидной активностью, а также в увеличении эффективности фунгицидных препаратов за счет применения замещенных 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканов I и расширении ассортимента фунгицидных препаратов. Согласно настоящему изобретению, замещенные 2-галогенметил-6-бензилиден-1,4-диоксаспиро[4.5]деканы VII получают взаимодействием 2-бензилиденциклогексанонов V, где R1 – одинаковые или разные, означают атом водорода, алкильную группу с числом атомов углерода от 1 до 6; где R2 – одинаковые или разные, означают атом водорода или галогена; тип означают целые числа от 0 до 5, с 3-галоген-1,2-пропандиолами VI, где Х означает хлор, бром и йод, например, с 3-хлор-1,2-пропандиолом, при катализе кислотами, например n-толуолсульфокислотой, серной кислотой и др., при кипячении в органическом растворителе, например бензоле или толуоле с азеотропной отгонкой воды. Согласно настоящему изобретению, замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы формулы I получают взаимодействием замещенных 2-галогенметил-6-бензилиден-1,4-диоксаспиро[4.5]деканов VII, где R1 – одинаковые или разные, означают атом водорода, алкильную группу с числом атомов углерода от 1 до 6; где R2 – одинаковые или разные, означают атом водорода или галогена; m и n означают целые числа от 0 до 5, Х означает хлор, бром и йод, с 1,2,4-триазолатом щелочного металла, где М+ означает щелочной метал, например натрий, калий и т.п., в среде полярного апротонного растворителя например, диметилформамида, при температуре от 60 до 180°С. Техническим результатом изобретения являются новые вещества – замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы общей формулы I и способ их получения. В указанном патенте [патент ФРГ №3735555, 1988 г.] предлагается получать замещенные 2-аминометил-1,4-диоксаспиро[4.5]деканы технической чистоты в виде смеси основного продукта с продуктами побочных реакций. Авторы предлагают получать новые соединения 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы очищенными от примесей, выделяя их в индивидуальном виде, с помощью флеш-хроматографии. Помимо этого, авторы предлагают получать указанные соединения в стабильной при хранении кристаллической форме, например в виде их солей с щавелевой кислотой. Успешное применение пестицидов для борьбы с различными вредными организмами в большой степени зависит от препаративной формы препарата и условий, при которых действующее вещество контактирует с вредителями и возбудителями заболеваний растений. В зависимости от физико-химических свойств препарата, его назначения и способа применения выбирается наиболее эффективная и экономичная препаративная форма (композиция), это могут быть, например, дусты, гранулы, микрокапсулированные препараты, смачивающиеся порошки, концентраты эмульсий, мази, вододиспергируемые гранулы, суспензионные концентраты. Препаративные формы помимо действующего вещества могут включать в свой состав наполнители, растворители, поверхностно-активные вещества, смягчители воды, синергические добавки и др. Известен препарат гетерофос, который применяют в виде 7.5%-ных гранул для защиты картофеля от нематоды и сахарной свеклы от корневой тли. [Пестициды и регуляторы роста растений: Справ. изд. / Н.Н.Мельников, К.В.Новожилов, С.Р.Белан. – М.: Химия, 1995, с.24, с.347]. Техническим результатом изобретения также является разработка фунгицидных композиций, состоящих из замещенных 2-азол-1-илметил-6-бензилиден-1,4-диоксаспиро[4.5]деканов общей формулы I в концентрации 0,1-99% и вспомогательных веществ, которые успешно могут быть применены для борьбы с вредоносными грибковыми болезнями сельскохозяйственных культур, животных или человека. По результатам фунгицидных испытаний in vitro замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы, например оксалат 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана (5), превосходят используемый в качестве эталонного известный фунгицид – триадимефон (3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-2-бутанон) по отношению к большинству из испытанных видов грибов-патогенов. Упомянутый в патенте-прототипе наиболее эффективный фунгицид спироксамин предлагают применять, например, для борьбы с грибными болезнями зерновых культур с более высокими нормами расхода, чем триазольный широко применяемый фунгицид триадимефон, который уступает по фунгицидной активности соединению 5. Изобретение может быть проиллюстрировано следующими примерами. Пример 1. 2-(4-Хлорбензилиден)-6-метилциклогексанон (1). К раствору 22,4 г (0,2 моль) 2-метилциклогексанона и 25,4 (0,24 моль) 4-хлорбензальдегида в 50 мл метанола добавляли по каплям 33 мл 15% водного раствора гидроксида калия, перемешивали при комнатной температуре 1 час, затем кипятили на водяной бане при перемешивании 2 часа. После охлаждения экстрагировали реакционную массу хлороформом (2×70 мл), промывали органический слой разбавленной соляной кислотой, водой, сушили над сульфатом магния, хлороформ удаляли в вакууме, остаток перекристаллизовывали из изопропанола и получали 29,2 г (62%) 2-(4-хлорбензилиден)-6-метилциклогексанона (1) с т.пл. 67-68°С. Спектр ЯМР 1Н (CDCl3, Пример 2. 2-(4-хлорбензилиден)-4-метилциклогексанон (2). К раствору 14,05 (0,1 моль) 4-хлорбензальдегида в 112 г (1 моль) 4-метилциклогексанона добавляют 1,17 л воды. При эффективном перемешивании добавляют 10,14 мл (0,875 М) раствора гидроксида натрия порциями, в течение 10 минут, перемешивают 10 часов, отделяют органический слой, водный слой экстрагируют хлороформом (3×60 мл), органические фазы объединяют, промывают 100 мл воды, 100 мл хлористого аммония, затем 50 мл воды, сушат над сульфатом магния, переносят в литровую круглодонную колбу. Под вакуумом отгоняют хлороформ и избыток 4-метилциклогексанона. К остатку массой 26,2 г, представляющему собой в основном 2-[(4-хлорфенил)(гидрокси)метил]-4-метилциклогексанон в виде светло-жетлого масла, добавляют 450 мл бензола, добавляют к нему 0,534 г (0,003 моль) n-толуолсульфокислоты и кипятят в течение 9 ч. По охлаждении реакционную массу промывают 5% раствором соды (2×10 мл), водой (2×30 мл), рассолом, сушат на сульфатом магния, отгоняют растворитель при пониженном давлении, остаток вакуумируют при комнатной температуре 2 часа при 0,5 мм рт.ст, затем добавляют к нему 35 мл изопропанола. Выпавшие желтые кристаллы отфильтровывают. Получают 10,1 г (43%) 2-(4-хлорбензилиден)-4-метилциклогексанона (2) в виде желтоватых кристаллов, т.пл.=71-72°С. Спектр ЯМР 1Н (CDCl3, ИК-спектр, Пример 3. 2-Хлорметил-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декан (3). Смесь 20 г (0,085 моль) 2-(4-хлорбензилиден)-6-метилциклогексанона (1), 18,83 г (0,170 моль) 3-хлор-1,2-пропандиола, 0,731 г (0,00425 моль) n-толуолсульфокислоты в 120 мл бензола кипятят в течение 8 ч с насадкой Дина-Старка до отделения 1,7 мл воды. После охлаждения реакционную массу промывают 5% раствором гидроксида натрия (2×50 мл), водой, сушат над сульфатом магния, отгоняют бензол в вакууме. Получают 25,4 г (91%) 2-хлорметил-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана (3) в виде желтого масла, nD 20=1,5604. Спектр ЯМР 1Н (CDCl3, ИК-спектр, Последующее соединение, упомянутое в примере 4, получают аналогично способу, приведенному в примере 3. Пример 4. 2-Хлорметил-6-(4-хлорбензилиден)-8-метил-1,4-диоксаспиро[4.5]декан (4), выход 92%, nD 20=1.5561. Спектр ЯМР 1Н (CDCl3, ИК-спектр, Пример 5. Оксалат 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана (5). Смесь 10,8 г (0,033 моль) 2-хлорметил-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана (3), 3,03 г (0,033 моль) триазолата натрия и 40 мл сухого ДМФА кипятят при перемешивании в течение 20 ч. Реакционную массу охлаждают, отфильтровывают, фильтрат упаривают при пониженном давлении. Остаток растворяют в хлороформе и промывают водой (2×40 мл), сушат над сульфатом магния и упаривают при пониженном давлении. Продукт очищают с помощью градиентной флеш-хроматографии: силикагель “Acros Organics” 35/70), система: смесь гексана с ацетоном (от 10 до 40 об.% ацетона). Получают 10,33 г (87%) 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диоксаспиро[4.5]декана в виде желоватого масла. При перемешивании к маслу прибавляют раствор 2,58 г (0,287 моль) щавелевой кислоты в 30 мл ацетона. Выпавшие белые кристаллы отфильтровывают, промывают гексаном и сушат на воздухе, получают 12,71 г оксалата 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-10-метил-1,4-диокса-спиро[4.5]декана (5) с т.пл. 108-109°C. Спектр ЯМР 1Н (CDCl3, Последующее соединение, упомянутое в примере 6, получают аналогично способу, приведенному в примере 5. Пример 6. Оксалат 2-(1,2,4-триазол-1-илметил)-6-(4-хлорбензилиден)-8-метил-1,4-диоксаспиро[4.5]декана (6), выход 47%, т.пл. 140-141°С. Спектр ЯМР 1Н (CDCl3, ИК-спектр, Пример 7. Композиция концентрата эмульсии Действующее вещество: (замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы) – 70 г (7%). Алкилбензолсульфокислоты кальциевая соль (АБСК) – 15 г (1,5%) Оксиэтилированный октилфенол (ОП-7) – 70 г (7%) Циклогексанон – 280 г (28%) Смесь ксилололов – 110 г (11%) 1-Метилнафталин – 45 г (4,5%) Керосин 410 г (41%). Пример 8. Испытания на фунгицидную активность соединений проводили в экспериментах in vitro. [Методические рекомендации по испытанию химических веществ на фунгицидную активность. Черкассы: НПО «Защита растений», ВНИИХСЗР, 1990. – 68 с.] Действие препаратов на радиальный рост мицелия определяли растворением композиции соединения в ацетоне и внесением аликвоты в картофеле-сахарозный агар при 50°C до концентрации 30 мг/л по действующему веществу. Конечная концентрация ацетона в контрольных растворах и в растворах с действующими веществами составили 1%. В чашки Петри, содержащей 15 мл агаровой среды, наносили иглой культуры грибов на агаровую поверхность. Образцы выдерживали в инкубаторе при 25°C и измеряли радиальный рост через 3 суток. Процент ингибирования рассчитывали по Эбботу по отношению к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в таблице 3.
Применение соединений общей формулы I как в индивидуальном виде, так и в композициях с другими активными и вспомогательными соединениями позволяет более эффективно бороться с грибковыми заболеваниями сельскохозяйственных культур в сравнении с применяющимся сельскохозяйственным фунгицидом – триадимефоном.
Формула изобретения
1. Замещенные 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканы общей формулы I,
где R1, одинаковые или разные, означают атом водорода, алкильную группу с числом атомов углерода от 1 до 6, где R2 – одинаковые или разные, означают атом водорода, галогена, тип означает целое число от 0 до 5, к их солям с кислотами, или комплексам с солями металлов. 2. Способ получения замещенных 2-(1,2,4-триазол-1-илметил)-6-бензилиден-1,4-диоксаспиро[4.5]деканов общей формулы I,
где R1, одинаковые или разные, означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 6, где R2 – одинаковые или разные, означают атом водорода, галогена, тип означает целое число от 0 до 5, заключающийся в том, что замещенные 2-бензилиденциклогексаноны II, где R1, R2, m и n имеют те же значения, что и в формуле I, конденсируют с 3-галоген-1,3-пропандиолами при катализе кислотами с азеотропной отгонкой воды в органических растворителях с получением замещенных 2-галогенметил-6-бензилиден-1,4-диоксаспиро[4.5]деканов общей формулы III, где R, m, n имеют те же значения, что и в формуле I, X означает галоген, которые подвергают взаимодействию с 1,2,4-триазолатами щелочных металлов в среде полярного апротонного растворителя при температуре от 60 до 180°С
3. Фунгицидная композиция, содержащая действующее вещество в концентрации 0,1-99% и вспомогательные вещества, отличающаяся тем, что в качестве фунгицида используют замещенные 2-азол-1-илметил-6-бензилиден-1,4-диоксаспиро[4.5]деканы формулы 1, где R1 – одинаковые или разные, означают атом водорода, алкильную группу с числом атомов углерода от 1 до 6, где R2 – одинаковые или разные, означают атом водорода, галогена, m и n означает целое число от 0 до 5, и их соли с кислотами, или комплексы с солями металлов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||

 , м.д., J, Гц): 1.13 (д, 3 Н, СН3), 1.56-1.78 (м, 2Н, 2СН цикл.), 1.87-1.95 (м, 1Н, СН цикл.), 2.08-2.14 (м, 1Н, СН цикл.), 2.40-2.50 (м, 1Н, СН цикл.), 2.64-2.75 (м, 1Н, СН цикл.), 2.96-3.04 (м, 1Н, СН цикл.) 7.26 (т, 1Н, СН=С, J=6.2), 7.48 (с 4Н аром.); ИК-спектр,
, м.д., J, Гц): 1.13 (д, 3 Н, СН3), 1.56-1.78 (м, 2Н, 2СН цикл.), 1.87-1.95 (м, 1Н, СН цикл.), 2.08-2.14 (м, 1Н, СН цикл.), 2.40-2.50 (м, 1Н, СН цикл.), 2.64-2.75 (м, 1Н, СН цикл.), 2.96-3.04 (м, 1Н, СН цикл.) 7.26 (т, 1Н, СН=С, J=6.2), 7.48 (с 4Н аром.); ИК-спектр,  /см-1: 1670 (С=O), 1580 (СН=С), 730 (С-Cl).
/см-1: 1670 (С=O), 1580 (СН=С), 730 (С-Cl).