Патент на изобретение №2325375
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ПРИМЕНЕНИЕ 2-ИМИДОЗОЛИЛПРОПАН-2-СУЛЬФОКИСЛОТЫ В КАЧЕСТВЕ БАКТЕРИСТАТИЧЕСКОГО, ИММУНОСТИМУЛИРУЮЩЕГО, АНТИАГРЕГАЦИОННОГО, ДЕЗАГРЕГАЦИОННОГО В ОТНОШЕНИИ ТРОМБОЦИТОВ И УСИЛИВАЮЩЕГО СОКРАТИТЕЛЬНУЮ АКТИВНОСТЬ СКЕЛЕТНЫХ МЫШЦ СРЕДСТВА
(57) Реферат:
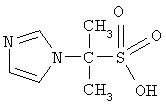
Изобретение относится к гетероциклическим соединениям, в частности к применению 2-имидозолилпропан-2-сульфокислоты формулы
в качестве бактеристатического, иммуностимулирующего, антиагрегационного, дезагрегационного в отношении тромбоцитов и усиливающего сократительную активность скелетных мышц средства. Технический результат – новые свойства 2-имидозолилпропан-2-сульфокислоты, позволяют более широко использовать соединение в медицине и ветеринарии. 9 табл.
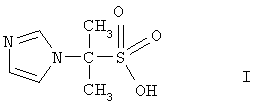
Изобретение относится к гетероциклическим соединениям, в частности к применению 2-имидозолилпропан-2-сульфокислоты формулы I
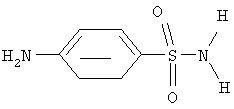
в качестве бактеристатического, иммуностимулирующего, антиагрегационного, дезагрегационного в отношении тромбоцитов и усиливающего сократительную активность скелетных мышц средства, что может быть использовано в медицине и ветеринарии. Заявляемые в данном изобретении свойства для этого соединения ранее описаны не были. В качестве прототипа выбран n-аминобензолсульфонамид стрептоцид формулы
проявляющий антимикробную активность, см. М.Д.Машковский “Лекарственные средства”, часть 2, Москва “Медицина”, 1985 г., с 275. Недостатками известного препарата является то, что он, обладая антимикробной активностью, неактивен в отношении стафилококков, к тому же в связи с активным участием указанного соединения в метаболических процессах оно оказывает побочные действия и имеет противопоказания. При длительном употреблении в почках могут образовываться трудно растворимые соединения, уменьшается содержание гемоглобина, возникает цианоз, агранулоцитоз, лейкопения. Более чувствительны к препарату молодые животные. Противопоказания к применению стрептоцида следующие: общий ацидоз, гепатит, гемолитическая анемия, агранулоцитоз, нефриты, нефрозы. Он не обладает выраженной антивирусной и иммуностимулирующей активностью. Применение одних и тех же соединений в качестве антимикробных средств в течение продолжительного времени, как правило, сопровождается привыканием к ним микроорганизмов и появлением устойчивых к ним форм возбудителей. Это вызывает необходимость пополнения арсенала средств против патогенных возбудителей. Задача изобретения – расширение арсенала средств, проявляющих бактеристатическую активность, соединением, относящимся к имидазолдилсульфокислотам, проявляющем как бактеристатическую, так и иммуностимулирующую, антиагрегационную, дезагрегационную в отношении тромбоцитов активность, а также усиливающем сократительную активность скелетных мышц без проявления кумулятивных свойств и патологических изменений в органах и тканях животных. Техническая задача решается применением 2-имидозолилпропан-2-сульфокислоты, которая проявляет, кроме бактеристатической, иммуностимулирующую, антиагрегационную, дезагрегационную в отношении тромбоцитов активность, а также усиливает сократительную активность скелетных мышц. 2-имидозолилпропан-2-сульфокислоту получают путем взаимодействия имидазола с сернистым ангидридом и пропаноном-2 в присутствии воды. Способ получения 2-имидозолилпропан-2-сульфокислоты включает растворение имидазола в растворителе, выбранном из ряда низших спиртов или ацетона, барботировании в него газообразного сернистого ангидрида при температуре не выше 20°С в течение 20-25 минут при массовом соотношении имидазол: сернистый ангидрид – 1:1, добавлении пропанона-2 и воды в массовом соотношении имидазол:пропанон-2:вода 1:1:1. Пример 1. Получение 2-имидозолилпропан-2-сульфокислоты. К 5 грамм (0,073 моль) имидазола добавляют 50 мл ацетона. Затем при 20°С в течение 20 мин барботируют сернистый ангидрид 4,67 г (0,073 моль) (контроль за количеством ангидрида проводился весовым методом), добавляют 1,3 мл (0,073 моль) воды и перемешивают еще 5 минут. Выпавший осадок отфильтровывают и перекристаллизуют из этанола. Выход 92% Тпл.=69-70°С. ИК (KBr):
Найдено, %: С 36,81; Н 5,19; N 14,64; S 16,62 Вычислено, %: С 37,89; Н 5,26; N 14,73; S 16,84. Вещество представляет собой кристаллический порошок белого цвета, растворимый в воде и органических растворителях. Пример 2. Определение бактериостатической активности. Определение бактериостатической активности in vitro в отношении грамположительных (стрептококки, стафилококки, листерии) и грамотрицательных (сальмонеллы, эшерихии) микроорганизмов проводят методом серийных последовательных разведении, [Игудин Л.И. и др. “Стандарты, штаммы, методы контроля бактериальных и вирусных препаратов”, М. 1982 г.]. Для этого берут ряд пробирок с 4,5 мл питательной среды. В первую пробирку вносят 0,5 мл вещества (разведение 1:10). Смесь тщательно перемешивают и из нее переносят 0,5 мл смеси во вторую пробирку. После тщательного перемешивания 0,5 мл переносят в третью пробирку и т.д. В последнюю пробирку вещество не вносят, она является контролем роста культуры. Засев в пробирки проводят 0,1 мл суточной бульонной культурой (50000 микроорганизмов), а после засева пробирки встряхивают и термостатируют при 37°С. Опыты проводят с троекратной повторяемостью. Учет результатов ведут через 18-24-48 часов инкубации в термостате. Наименьшая концентрация вещества, при которой не происходит размножения микробов и пробирка остается прозрачной, служит показателем бактериостатической концентрации. Бактериостатическая концентрация заявляемого вещества и прототипа n-аминобензолсульфонамида (стрептоцида) соответствует разбавлению 1:100 в г на 1 мл среды в таблицах 1-3. В результате эксперимента показано, что 2-имидазолилпропан-2-сульфокислота проявляет бактериостатическую активность как в отношении грамположительных, так и в отношении грамотрицательных бактерий. Испытания заявляемого вещества, 2-имидазолилпропан-2-сульфокислоты, были неоднократно проведены на группах сельскохозяйственных животных от 10 до 50 голов. 2-имидазолилпропан-2-сульфокислоту использовали для лечения и профилактики респираторных и желудочно-кишечных болезней. Для лечения и профилактики респираторных болезней 2-имидазолилпропан-2-сульфокислоту вводят телятам, поросятам и ягнятам внутримышечно или аэрогенно в камерных условиях. Внутримышечно вводят 5% водные растворы (на дистиллированной воде) из расчета 15 мг/кг живой массы поросятам и ягнятам, а телятам из расчета 6 мг/кг живой массы. Курс лечения два раза в сутки до клинического выздоровления. При аэрогенном введении используют камеры-ингаляторы, габариты которых определяются из расчета на одного теленка 1-1,5 м3, ягненка и поросенка 0,3-0,5 м3 объема камеры. Необходимое количество для распыления 2-имидазолилпропан-2-сульфокислоты при лечебной и профилактической обработке определяют из расчета 0,7-0,75 г/м3 камеры. Расчетное количество 2-имидазолилпропан-2-сульфокислоты растворяют дистиллированной водой. Курс лечения – один раз в сутки до клинического выздоровления, а с профилактической целью животных обрабатывают один раз в течение 3-х суток. При необходимости курс лечебных обработок повторяют через 6-7 суток, профилактических – через 8-10 суток. Как показали исследования на животных, симптомы бронхолегочных заболеваний исчезли через 4-5 дней со средней тяжестью заболевания, у тяжелобольных – через 10 дней, тогда как в контрольной группе состояние животных за время проведения исследований существенно ухудшилось. Для лечения и профилактики желудочно-кишечных болезней животным выпаивают водные растворы 2-имидазолилпропан-2-сульфокислоты поросятам и ягнятам в 5% концентрации до 10-дневного возраста в объеме 3 и 6 мл/гол., а старше 10 дней – 5 и 10 мл/гол соответственно; телятам 1-60 дневного возраста в 5% концентрации в объеме 30-40 мл/гол. Курс лечения 2 раза в день до клинического выздоровления, а с профилактической целью выпаивают 1 раз в течение 3-х суток. Как показали исследования на животных, симптомы диареи исчезли в течение 2 дней, тогда как в контрольной группе диарея не прекратилась до окончания исследований. 2-имидазолилпропан-2-сульфокислота, по данным изучения экстрактов из внутренних органов методом высокоэффективной жидкостной хроматографии, не обладает кумулятивными свойствами. По данным патологоанатомических исследований она не вызывает патологических изменений в организме животных при длительном (свыше 30 дней) использовании. Таким образом 2-имидазолилпропан-2-сульфокислота обладает выраженной бактериостатичностью в отношении грамположительных и грамотрицательных бактерий, обладает выраженной иммуностимулирующей активностью, сопоставимой с эталоном ЛПС Е coli (липополисахарид), не проявляет кумулятивных свойств, не вызывает патологических изменений в органах и тканях животных. Противопоказаний для ее использования не обнаружено, соединение успешно прошло испытания в сельском хозяйстве, в частности в ветеринарии. Из представленных в таблицах 1-3 данных видно, что минимальная бактериостатическая концентрация (МБСК) для Е.coli – 31.25 мкг/мл; Salmonella pullorum – gallinarum – 62.5 мкг/мл; St. aureus – 31.25 мкг/мл. Пример 3 Изучение иммуномоделирующих свойств 2-имидазолинпропан-2-сульфокислоты. Изучение иммуномоделирующих свойств 2-имидазолинпропан-2-сульфокислоты проводили в реакции локального гемолиза в геле. В работе использовали беспородных белых мышей обоего пола в возрасте 8-12 недель. Животных иммунизировали внутрибрюшным введением липополисахарида /ЛПС/ Shigella flexnerii, в концентрации 0,05 мг/кг физиологического раствора. Исследуемые соединения вводили одновременно иммунизацией ЛПС в дозах, равных 1/1Т МТД. Через 4 суток животных брали в опыт. Мышей забивали цервикальной дислокацией, асептически извлекали селезенку, взвешивали и помещали в холодную среду RPMI-1640 /SERVIA ФРГ/ с добавлением пенициллина /100 Ед/мл/ и стрептомицина /50 мкг/мл/. Затем орган измельчали в гомогенизаторе и подсчитывали число ядросодержащих клеток в полученной клеточной суспензии с помощью камеры Горячева. Конечную концентрацию клеток /106/0.5 мл/ готовили, добавляя необходимое количество среды RPMI-1640 /SERVIA ФРГ/ с добавлением антибиотиков. Клеточные суспензии хранили при 4°С. В день опыта чашки Петри /*100 мм/ покрывали 1,4%-ным раствором агарозы /SERVIA ФРГ/ на среде RPMI-1640 /SERVIA ФРГ/. После застывания геля чашки помещали в термостат при 37°С на 1 ч вверх дном, чтобы из геля испарилось некоторое количество воды (около 1 г). После инкубации чашки вынимали и хранили при комнатной температуре. В водную баню KL-I /Lab. Pcistroge/ помещали штатив с вассермановскими пробирками и нагревали ее до 49°С. Через 30 минут в пробирки помещали 0,5 мл 1,4 раствора агарозы на дистилляте и 0,5 мл двойного концентрата среды RPMI-1640. В полученную смесь помещали 0.5 мл суспензии клеток селезенки и 0,1 мл 20% взвеси эритроцитов барана, покрытых ЛПС Shigella flexnerii. Смесь перемешивали и наслаивали на чашке Петри с агарозным покрытием и оставляли до застывания при 21°С. Затем чашки Петри инкубировали 2 часа в термостате при 37°С. После чего на агарозный гель наслаивали комплемент из сыворотки крови морской свинки в разведении 1:10 и инкубировали еще 1 ч при 37°С. Затем производили подсчет зон гемолиза (антителообразующих клеток), видимых как маленькие (1-2 мм) просветления на красном матовом фоне. По изменению зон гемолиза (числа антителообразующих клеток) оценивали влияние препаратов на иммунный ответ к липополисахариду Shigella flexnerii (Таблица 4). Как видно из таблицы 4, коэффициент стимуляции 2-имидазолинпропан-2-сульфокислоты в 1,4 раза превышает коэффициент стимуляции диуцифона. Пример 4. Исследования агрегации тромбоцитов. Для исследования агрегации тромбоцитов использовали классические индукторы агрегации (АДФ, адреналин и др.). Кровь доноров, стабилизированную 0.1 м цитратом натрия (9:1), центрифугировали при 12°С, 250 g, 10 мин. Супернатант содержал тромбоцитарную плазму без примеси других форменных элементов. Бестромбоцитарную плазму получали центрифугированием крови при 4°С, 3000 g, 30 мин. Счет тромбоцитов проводили методом фазовоконтрастной микроскопии в камере Горячева. Для измерения агрегации использовали плазму, содержащую 150·106-300·106 тромбоцитов в 1 мкл. Исходная агрегационная активность тромбоцитов в плазме сохранялась при 4°С в течение 4 часов после взятия крови у доноров. Агрегацию тромбоцитов измеряли при помощи агреометра, представляющего собой термостатированный фотометр с присоединенным к нему самописцем, непрерывно регистрирующем изменения светопропускающей способности тромбоцитарной плазмы при перемешивании с индукторами агрегации. В качестве редукторов агрегации использовали АДФ в конечной концентрации 10; 5,0; 2,5 мг/мл = 2,0; 1,0; 0,5; 10-6 М. В кювету агреометра вносили 1,0 мл исследуемой тромбоцитарной плазмы и производили настройку агреометра. При настроенном приборе тромбоцитарная плазма имеет 100%, а бестромбоцитарная плазма 0% оптической плотности по шкале регистратора. Для измерения агрегации в кювету, содержащую 0,1 мл тромбоцитарной плазмы, вносили 0,1 мл индуктора агрегации и записывали изменения оптической плотности тромбоцитарной плазмы. Для изучения антиагрегационной активности 2-имидазолилпропан-2-сульфокислоты препарат в конечной концентрации 1,68 мг/мл вводили в тромбоцитарную плазму и регистрировали агрегацию тромбоцитов, индуцированную АДФ и адренолином. В параллельном эксперименте вместо препарата в тромбоцитарную плазму вводили гепарин в концентрации 500 ед/мл. В контрольном эксперименте регистрировали агрегацию тромбоцитов в тромбоцитарной плазме, индуцированную АДФ и адренолином. Результаты экспериментов представлены в таблице 5. Анализ результатов показывает, что 2-имидазолилпропан-2-сульфокислота обладает выраженной способностью ингибировать агрегацию тромбоцитов, индуцированную АДФ и адренолином. Антиагрегационный эффект 2-имидазолилпропан-2-сульфокислоты в 4,5 раза выше антиагрегационного эффекта гепарина в указанных концентрациях. Пример 5. Изучение дезагрегационной активности 2-имидазолилпропан-2-сульфокислоты. Для изучения дезагрегационной активности препарат вводили в тромбоцитарную плазму через 1, 2, 3 минуты после введения агрегирующего агента (АДФ, адренолин). Результаты исследований представлены в таблицах 6-9. Анализ результатов показывает выраженную дезагрегационную активность 2-имидазолилпропан-2-сульфокислоты 1-3 минуты после начала агрегации тромбоцитов, индуцированной АДФ и адренолином. Гепарин дезагрегационным эффектом не обладает. Пример 6. Изучение сократительных свойств скелетных мышц. Изучение сократительных свойств скелетных мышц производили на полосках диафрагменной мышцы морской свинки. Диафрагменная мышца забиралась у умерщвленного под гексеналовым наркозом посредством кровопускания животного и помещалась в физиологический раствор следующего состава: мМ: Na+ – 142,90, К+ – 5,88, Са2+ – 1,26, Mg2+ – 1,18, Cl– – 125,22, /НСО3/– – 24,90, /SO4/2- – 1,18, /H2PO4/– – 1,18, через который 40 минут пропускали карбоген (95% О2 и 5% СО2); рН доводился до 7,35-7,42. Производилась калибровка датчика фотоэлектрического преобразователя – отклонение самописца 14 мм вызывалось нагрузкой в 200 мг. Полоска диафрагмальной мышцы из центральной части левой ее половинки шириной 5 мм помещалась в перфузионную термостатируемую (38°С) ванночку рабочим объемом 5 мл, прикреплялась к датчику фотоэлектрического преобразователя и растягивалась до 2 г в течение 20 минут при постоянной перфузии физиологическим раствором. Измерение сократительной реакции препарата диафрагмы производилось с помощью фотоэлектрического преобразователя, изменение напряжения на выходе которого регистрировалось самописцем Н 327-1 со скоростью лентопротяжки 1 мм/с. Таким образом, в исследованиях наблюдалось условие измерения сокращения в изотермическом режиме при помощи электронной аппаратуры. Подача физиологического раствора из основного резервуара к термостатируемой ванночке осуществлялась с помощью одноразовой системы для переливания крови. Скорость перфузии регулировалась зажимом и контролировалась с помощью капельницы и в среднем составляла 1 каплю в 1 с. При необходимости прекращения перфузии перекрывали приток жидкости в термостатируемую камеру и с целью сохранения термостатируемого режима на уровне 38°С изменялся режим работы ультратермостата. Первое контрольное сокращение вызывалось добавлением в ванночку карбахолина, раствор которого готовился на дистиллированной воде и вносился в камеру в объеме 50 мл (соблюдение условия введения раствора в отношении 1/100 к объему термостатируемой камеры) с конечной концентрацией карбахолина в объеме физиологического раствора термостатируемой камеры – 2·10-4 м. Для изучения сократительной реакции с последующей математической обработкой в каждом случае регистрировались следующие параметры: сила одиночного сокращения (мг), временные параметры: латентный период, время развития максимального напряжения, время полурасслабления, время релаксации, плато, длительность сокращения. После регистрации контрольного сокращения на карбахолин, занимающего 2-4 минуты, в течение 30-60 сек обеспечивается стабильная перфузия, после чего препарат перфузируется при равных условиях физиологическим раствором, содержащим изучаемую концентрацию исследуемого вещества. Через 20 минут перфузия физиологическим раствором с исследуемым веществом прекращается и в камеру, при соблюдении описанных условий, добавляется раствор карбахолина. Полученные данные по сократительной реакции сравнивают с полученным контрольным результатом и выражают в процентном отношении к ним. За МТД исследуемых веществ для клеток диафрагмы морской свинки in vitro принимали минимальную концентрацию, инкубация с которой приводила к отсутствию сократительной реакции на карбахолин. Данные по сократительным свойствам диафрагмальной мышцы морской свинки после 20-минутной перфузии ее 2-имидазолилпропан-2-сульфокислоты приведены в таблице 9. Как видно из таблицы 9, 2-имидазолилпропан-2-сульфокислота вызывает увеличение силы сокращения скелетной мышцы по сравнению с базовым объектом (АТФ). Таким образом, заявлено применение 2-имидазолилпропан-2-сульфокислоты в качестве бактеристатического средства, обладающего выраженной бактериостатичностью в отношении грамположительных и грамотрицательных бактерий, которое, кроме того, обладает выраженной иммуностимулирующей активностью, сопоставимой с эталоном ЛПС Е coli (Липополисахарид), не проявляет кумулятивных свойств, не вызывает патологических изменений в органах и тканях животных, противопоказаний для его использования не обнаружено, соединение успешно прошло испытания в сельском хозяйстве, в частности в ветеринарии. Кроме того, предлагаемое соединение проявляет антиагрегационную, дезагрегационную в отношении тромбоцитов активность, а также усиливает сократительную активность скелетных мышц.
Формула изобретения
Применение 2-имидозолилпропан-2-сульфокислоты в качестве бактеристатического, иммуностимулирующего, антиагрегационного, дезагрегационного в отношении тромбоцитов и усиливающего сократительную активность скелетных мышц средства.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 s(SO2) 1010 см-1, с.;
s(SO2) 1010 см-1, с.;