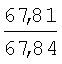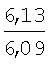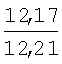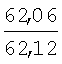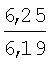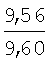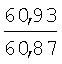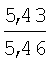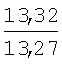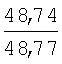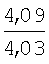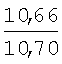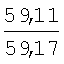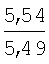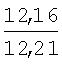Патент на изобретение №2323939
|
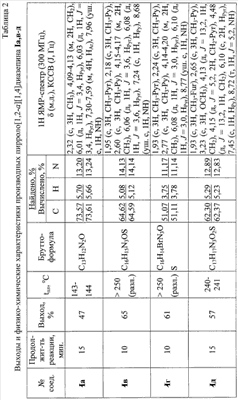
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРРОЛО[1,2-а][1,4]ДИАЗЕПИНА
(57) Реферат:
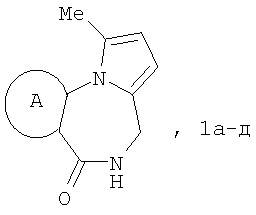
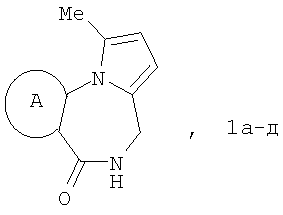
Изобретение относится к области органической химии – синтезу гетероциклических соединений, содержащих пирроло[1,2-а][1,4]диазепиновый фрагмент, аннелированный с ароматическим и гетероароматическим кольцом. Описывается способ получения производных пирроло[1,2-а][1,4]диазепина общей формулы 1
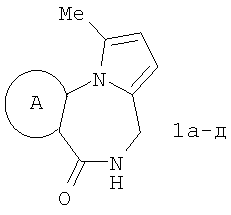
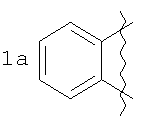
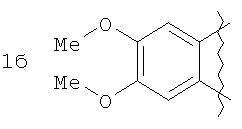
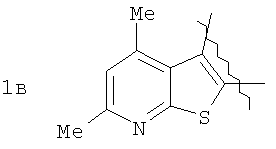
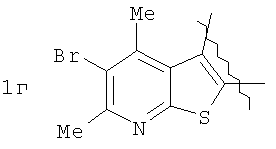
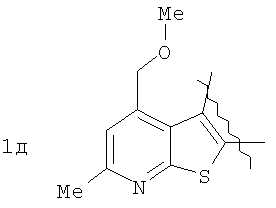
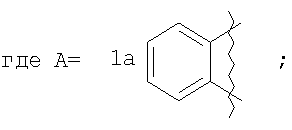
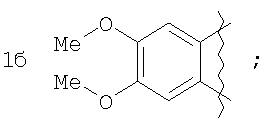
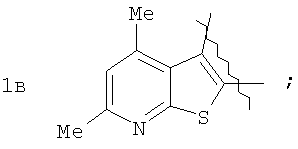
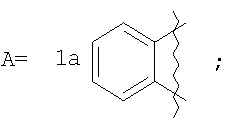
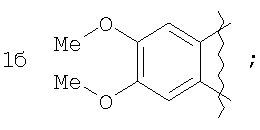
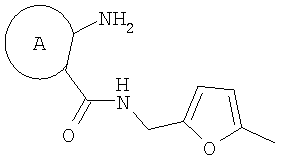
где А=
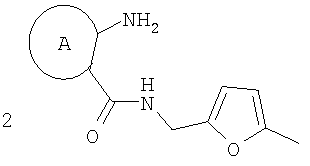
которые могут найти применение как вещества, обладающие потенциальной активностью в отношении ЦНС, проявляющие потенциальное анальгезирующее, антибактериальное и противогрибковое действие. Способ заключается в рециклизации фуранового кольца 5-метил-фурфуриламидов общей формулы 2,
где А имеет указанные выше значения, при выдерживании при температуре 60-70°С в смеси ледяной уксусной и концентрированной соляной кислот при объемном соотношении 1:0,15 в течение 10-15 минут. Это позволяет обеспечить одновременное формирование пиррольного и диазепинового колец и повысить выходы конечных продуктов за счет уменьшения количества стадий процесса. 2 табл.
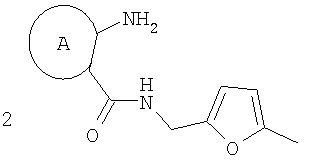
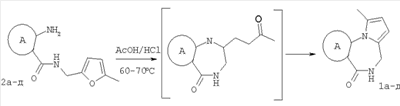
Изобретение относится к области органической химии – синтезу гетероциклических соединений, содержащих пирроло[1,2-а][1,4]диазепиновый фрагмент, аннелированный с ароматическим и гетероароматическим кольцом. Изобретение относится к разработке способа получения производных пирроло[1,2-а][1,4]диазепина общей формулы 1
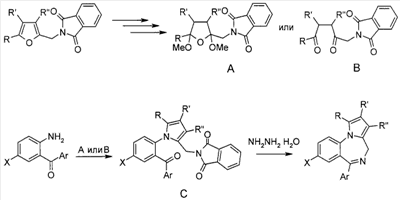
которые могут найти применение как вещества, обладающие потенциальной активностью в отношении ЦНС [Mai, A.; Di Santo, R.; Massa, S.; Artico, M.; Pantaleoni, G.C.; Giorgi, R.; Coppolino, M.F.; Barracchini, A. Eur. J. Med. Chem., 1995, 30, 593], проявляющие потенциальное анальгезирующее и антибактериальное [Ivashchenko, A.V.; Vvedensky, V.Yu.; Ilyn, A.P.; Kysel, V.M.; Khvat, A.V.; Kuzovkova, Yu.A.; Kutepov, S.A.; Dmitrieva, I.G.; Zolotarev, D.A.; Tkachenko, S.Ye.; Okun, I.M.; Kravchenko, D.V.; Kobak, V.V.; Trifilenkov, A.S.; Mishunina, Yu.S.; Loseva, M.V.; Rizhova, E.A.; Parchinsky, V.Z.; Tsirulnikov, S. A.; Kyselev, A.S. Pat. WO 2005105805 (2005)] и противогрибковое [Meerpoel, L.; Van Gestel, J.; Van Gerven, F.; Woestenborghs, F.; Marichal, P.; Sipido, V.; Gilkerson, Т.; Nash, R.; Corens, D.; Richards, R. D. Bioorg. Med. Chem. Lett, 2005, 75(14), 3453] действие. В настоящее время среди существующих методов образования пирроло[1,2-а][1,4]диазепинового каркаса широко известен подход, в котором замыкание диазепинового цикла происходит при готовом пиррольном ядре. Производные пирролодиазепина синтезированы на основе 1-(2-аминометилфенил)-1Н-пиррола в условиях реакции Бишлера-Напиральского [Massa, S.; Di Santo, R.; Costi, R.; Artico, M. J. Heterocyclic Chem., 1993, 30, 749;], внутримолекулярным алкилированием пиррольного ядра N-ацилиминиевыми ионами [Othman, M; Pigeon, P.; Netchitailo, P.; Daich, A.; Decroix, B. Heterocycles, 2000, 52, 273;], в результате взаимодействия с карбонильными соединениями [Rault, I.; Rault, S.; Robba, M. Heterocycles, 1994, 38, 811]. Примером использования других производных 1-арилпиррола для получения пирролодиазепиновой системы является синтез пирроло[1,2-а][1,4]диазепинового фрагмента на основе бифункционального 1-(2-карбоксиарил)пирролкарбальдегида в условиях реакции Ugi [Ilyn, A.P.; Trifilenkov, A.S.; Kuzovkova, Ju. A.; Kutepov, S.A.; Nikitin, A.V.; Ivachtchenko, A.V. J. Org Chem. 2005, 70, 1478]. К основным недостаткам аналогов можно отнести применение труднодоступных реагентов, а также многостадийность процесса, что снижает суммарный выход целевого продукта. Кроме того, большинство известных методов пригодны для получения производных пирролодиазепина, аннелированных с бензольным кольцом, тогда как способы синтеза пирролодиазепинов, конденсированных с гетероциклическими системами, немногочисленны. Наиболее близким к заявляемому среди известных методов синтеза является метод, в котором для формирования пирролодиазепиновой структуры используется производное фурана [Hara, Т.; Kayama, Y.; Mori, Т.; Itoh, К.; Fujimori, H.; Sunami, Т.; Hashimoto, Y.; Ishimoto, S. J. Med. Chem., 1978, 27(3), 263]. Ключевыми реакциями этой стратегии являются: а) образование пиррольного ядра как результат рециклизации производного фурана при взаимодействии промежуточных продуктов раскрытия фуранового кольца – тетрагидрофурана А или 1,4-дикетона В – с аминогруппой ароматического кетона и б) формирование диазепинового кольца в ходе внутримолекулярной циклизации продукта гидрогенолиза полученного фталимида С. К существенным недостаткам этого метода можно отнести его многостадийность, поскольку метод включает последовательные стадии получения замещенных пирролов и их циклизации в пирролодиазепиновую структуру, и, как следствие, невысокие суммарные выходы конечных продуктов (25-38%). Техническим результатом является обеспечение одновременного формирования пиррольного и диазепинового колец и повышение выхода конечных продуктов за счет уменьшения количества стадий процесса. Технический результат достигается тем, что в способе получения производных пирроло[1,2-а][1,4]диазепина общей формулы 1
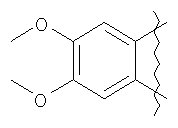
5-метилфурфуриламид общей формулы 2, где А имеет указанные выше значения, выдерживают при температуре 60-70°С в смеси ледяной уксусной и концентрированной соляной кислот при объемном соотношении 1:0,15 в течение 10-15 мин. Применение производных фурана для синтеза различных гетероциклов известно [Butin, A.V.; Stroganova, T.A.; Abaev, V.T; Gutnov, A.V. Targets in Heterocyclic systems: Chemistry and Properties, 2001, 5, 131], однако какие-либо сведения о внутримолекулярных рециклизациях фурановых соединений, приводящих к образованию пирролодиазепиновой системы, в литературе отсутствуют. Отличием предлагаемого способа получения производных пирроло[1,2-а][1,4]диазепина (1) является использование в качестве исходного соединения производных 5-метилфурфуриламидов 2-аминобензойных или 3-аминотиено[2,3-b]пиридин-2-карбоновых кислот, фурановый цикл которых выступает в роли скрытого 1,4-дикарбонильного соединения, участвующего в образовании двух гетероциклических колец – диазепинового и пиррольного. Выбор в качестве растворителя уксусной кислоты объясняется хорошей растворимостью в ней исходных веществ, что позволяет добиться полной конверсии исходных фурфуриламидов в производные пирроло[1,2-а][1,4]диазепина в течение непродолжительного времени и тем самым за счет сокращения длительности реакции избежать сильного осмоления реакционной массы и повысить суммарный выход целевых продуктов. На основании полученных экспериментальных данных установлено, что оптимальным является проведение реакции при 60-70°С, поскольку в этом случае выходы производных пирроло[1,2-а][1,4]-диазепина достигают 47-65%, а длительность процесса составляет 10-15 мин. Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата. Индивидуальность и строение синтезированных соединений 1 подтверждены данными 1Н ЯМР-спектроскопии и элементного анализа. Ниже приведены примеры осуществления заявляемого способа получения производных пирроло[1,2-а][1,4]диазепина (1). Исходные фурфуриламиды бензойных кислот получены последовательным ацилированием 5-метилфурфуриламина хлорангидридами 2-нитробензойных кислот и восстановлением продуктов ацилирования гидразин гидратом в присутствии никеля Ренея по методикам, аналогичным приведенным в [Титце Л., Айхер Т. Препаративная органическая химия: Реакции и синтезы в практикуме органической химии и научно-исследовательской лаборатории: Пер. с нем. – М.: Мир, 2004. – 704 с]. 5-Метилфурфуриламиды 3-аминотиено[2,3-b]пиридин-2-карбоновых кислот синтезированы с выходами 80-87% реакцией пиридинтионов с 5-метилфурфуриламидом хлоруксусной кислоты в условиях реакции Торпа-Циглера по методу, аналогичному представленному в работе [Кайгородова Е.А., Конюшкин Л.Д., Михайличенко С.Н., Василин В.К., Кульневич В.Г., Химия гетероцикл. соедин., 1996, 10, 1432]. Физико-химические характеристики фурфуриламидов бензойных и 3-аминотиено[2,3-b]пиридин-2-карбоновых кислот приведены в таблице 1.
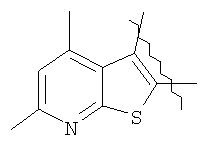
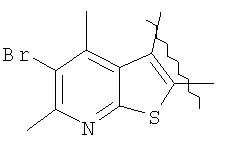
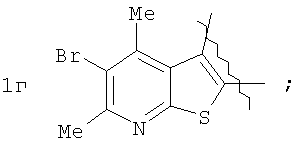
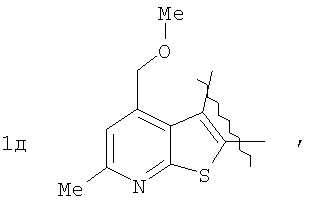
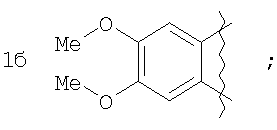
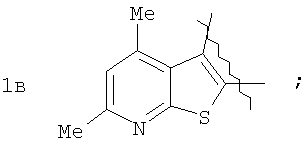
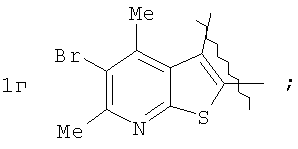
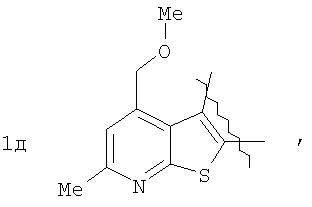
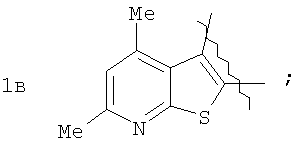
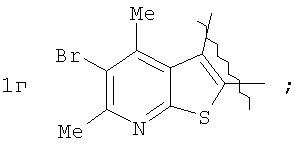
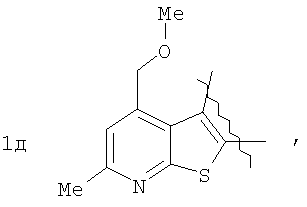
Пример 1. 8,9-Диметокси-1-метил-5,6-дигидро-4Н-бензо[f]пирроло[1,2-а][1,4]-диазепин-6-он (1б) Смесь N-(5-метилфурфурил)амида 2-амино-4,5-диметоксибензойной кислоты (2 ммоль), ледяной уксусной кислоты (10 мл) и конц. соляной кислоты (1,5 мл) выдерживают при температуре 40-50°С 40 мин до полного расходования исходного вещества (контроль ТСХ). После окончания реакции реакционную смесь выливают в ледяную воду (100 мл), нейтрализуют NaHCO3 до рН7. Выпавший кристаллический осадок отделяют фильтрацией, сушат на воздухе. Горячий раствор полученного продукта в смеси этилацетат/петролейный эфир (в объемном соотношении 4:1) пропускают через слой силикагеля и оставляют для кристаллизации, получая соединение 1б в виде прозрачных бесцветных кристаллов с выходом 42%. Тпл. 195-196°С. 1Н NMR (300 MHz, CDCl3): Вычислено для C15Hi6N2O3: С 66,16, Н 5,92, N 10,29. Найдено: С 66,10, Н 5,99, N 10,23. Пример 2. 8,9-Диметокси-1-метил-5,6-дигидро-4H-бензо[f]пирроло[1,2-a][1,4]-диазепин-6-он (1б) получают аналогично, проводя реакцию при температуре 60-70°С. Длительность реакции в этом случае составляет 15 мин (контроль ТСХ), выход продукта реакции 53%. Пример 3. 8,9-Диметокси-1-метил-5,6-дигидро-4Н-бензо[f]пирроло[1,2-а][1,4]-диазепин-6-он (1б) получают аналогично, проводя реакцию при температуре 80-90°С. Продолжительность реакции составляет 10 мин (контроль ТСХ), выход продукта реакции 48%. Пример 4. 8,9-Диметокси-1-метил-5,6-дигидро-4Н-бензо[а]пирроло[1,2-а][1,4]-диазепин-6-он (1б) получают аналогично, проводя реакцию при кипячении реакционной смеси. Продолжительность реакции составляет 5 мин (контроль ТСХ), выход продукта реакции 40%. Как следует из приведенных примеров, понижение температуры реакции вызывает увеличение продолжительности процесса, что приводит к большему осмолению реакционной смеси и, как следствие, к снижению выхода целевого продукта. Сильное осмоление и уменьшение выхода пирролодиазепина наблюдались также при попытке рециклизации 5-метилфурфуриламида 2-аминовератровой кислоты при 80-90°С (Пример 3) и при кипячении реакционной смеси (Пример 4). Таким образом, оптимальным вариантом является проведение реакции при 60-70°С, поскольку в этом случае выход 8,9-диметокси-1-метил-5,6-дигидро-4Н-бензо[f]пирроло[1,2-а][1,4]-диазепин-6-она (1б) достигает 53%, а длительность процесса составляет 15 мин. Заявляемым способом получен ряд производных пирроло[1,2-a][1,4]диазепина (1a, в-д), для которых в таблице 2 приведены длительность реакции, выходы, температуры плавления и спектральные характеристики.
Формула изобретения
Способ получения производных пирроло[1,2-а][1,4]диазепина общей формулы 1
А=
заключающийся в том, что 5-метилфурфуриламид общей формулы 2
где А имеет указанные выше значения, выдерживают при температуре 60-70°С в смеси ледяной уксусной и концентрированной соляной кислот при объемном соотношении 1:0,15 в течение 10-15 мин.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


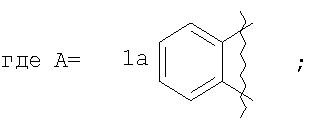

 (м.д.), КССВ (J, Гц)
(м.д.), КССВ (J, Гц)