Патент на изобретение №2319690
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ЭФИРОВ ЛЕВУЛИНОВОЙ КИСЛОТЫ
(57) Реферат:
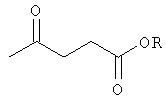
Изобретение относится к области органического синтеза, в частности к способу получения эфиров левулиновой кислоты, используемых в качестве ароматизирующих агентов в парфюмерии, табачной и пищевой промышленности. Способ получения эфиров левулиновой кислоты общей формулы
где R=алкил, заключается во взаимодействии фурфурилового спирта с алифатическими спиртами в присутствии катализатора, в котором в качестве катализатора используется ацетилацетонат железа Fe(асас)3, реакцию проводят в растворе CCl4 при мольном соотношении: [Fe(асас)3] : [фурфуриловый спирт] : [ROH] : [CCl4]=1:50-200:100-400:100-400 при температуре кипения спирта в течение 2-5 часов. Выход эфиров левулиновой кислоты составляет 80-98%. 1 табл.
(56) (продолжение): CLASS=”b560m”Хуснутдинов А.А. и др. Генерирование алкилгипохлоритов в прецессе катализируемого соединениями ванадия и марганца окисления спиртов четыреххлористым углеродом. Изв. АН. Сер. “Химия”. 2002, 11, с.1919-1924. DATABASE. Online. CASREACT. AN 138:304190. Cuiling W. Synthesis of ketals of levilinic acid esters from furfuryl alcohol. HUAQIAO DAXUE. 2002, 23(3), 257-259, ISSN 1000-5013.
Изобретение относится к области органического синтеза, в частности к способу получения эфиров левулиновой кислоты. Эфиры левулиновой кислоты используются в качестве ароматизирующих агентов в парфюмерии, табачной и пищевой промышленности. Известны способы получения эфиров левулиновой кислоты из фурановых производных. Способ заключается в следующем: смесь 0.2 моль фурфурилацетатата, 5 г безводного катионита в Н-форме и 5-6 моль низшего спирта нагревают при 40-50°С и перемешивании 1-2 час. Затем в реакционную смесь добавляют еще 5 г КУ-2 и продолжают реакцию при кипении еще 2-2.5 часа. Катионит отфильтровывают, растворитель отгоняют и очищают эфир перегонкой в вакууме. Этиловый эфир левулиновой кислоты получают с выходом 73%, н-бутиловый – с выходом 68%. Недостатком данного способа является двухстадийность, т.к. фурфурилацетат получают ацилированием уксусным ангидридом фурфурилового спирта, образующегося при гидрировании очищенного фурфурола. В а.с [А. с.СССР №598869, Б.И. №11, 1978] предложен способ получения эфиров левулиновой кислоты из более доступного и дешевого сырья – 5-метилфурфурола, который является отходом фурфурольного производства. 5-Метилфурфурол подвергают окислению 20-30% спиртовым раствором H2O2 при мольном соотношении 5-метилфурфурола и перекиси водорода 1:2 с последующим вводом в реакционную массу катализатора и удалением образовавшейся воды азеотропной перегонкой. Процесс осуществляется при 70-75°С, в качестве катализатора используется серная кислота или бензосульфокислота в количестве 4,5-9 вес.%, считая на 5-метилфурфурол. Полученный продукт после охлаждения, отмывают раствором бикарбоната натрия и водой, растворитель и избыток спирта отгоняют. Целевой продукт выделяют ректификацией в вакууме. Выход этилового эфира левулиновой кислоты 40% от теоретического, н-бутилового эфира – 70% от теоретического. Разработан способ получения эфиров левулиновой кислоты из В качестве катализаторов используются сульфокатиониты Amberlist 15, 13% NAFION, CBV-3020E. Синтез метилового эфира левулиновой кислоты проводят при температуре 25°С, 0.1 МПа за 1 час в присутствии катализатора Amberlist 15. В этих условиях конверсия исходного реагента составляет 85% при селективности по метиловому эфиру левулиновой кислоты 55%. Этиловый эфир левулиновой кислоты получают с конверсией Недостатки метода 1. Использование дорогостоящего у-лактона 4-гидрокси-3-пентановой кислоты. 2. Все процессы проходят при пониженном давлении, что усложняет технологический процесс и аппаратурное оформление. Наиболее близким к предлагаемому по технической сущности и достигаемому результату является способ получения эфиров левулиновой кислоты из фурфурилового спирта и алифатических спиртов (ROH). Он заключается в том, что к 4 моль безводного спирта в присутствии газообразного HCl или HBr в качестве катализатора при температуре кипения ROH прибавляют 1 моль фурфурилового спирта (с содержанием воды не более 0,5%) в течение 30 мин, так чтобы количество непрореагировавшего фурфурилового спирта не превышало 2 об.% от количества алканола. Затем реакционную массу кипятят в течение 30 мин. Избыток спирта отгоняют, конечный продукт перегоняют под вакуумом. Выход метилового эфира левулиновой кислоты 52%, этилового эфира 67%, н-пропилового 89%, изопропилового 57% [Патент США № 2763665, 1956]. Недостатки метода 1. Использование в качестве катализатора газообразных галогенводородов HCl и HBr. 2. Низкий выход эфиров (52-67%) На основании сходства по трем признакам (исходные реагенты-фурфуриловый спирт, алифатический спирт, образование в результате реакции эфира левулиновой кислоты), за прототип взят метод синтеза эфиров левулиновой кислоты из фурфурилового спирта и алифатического спирта [Патент США № 2763665, 1956]. Задачей предлагаемого изобретения является увеличение выхода эфиров левулиновой кислоты, исключение из процесса заведомо взятых агрессивных кислот, вызывающих коррозию оборудования и упрощение технологии в целом. Указанный выше технический результат достигается за счет взаимодействия реакции фурфурилового спирта с алифатическими спиртами в присутствии катализатора – ацетилацетоната железа в среде CCl4 при мольном соотношении [Fe(асас)3] : [фурфуриловый спирт] : [ROH] : [CCl4]=1:50-200:100-400:100-400. Реакция фурфурилового спирта с метанолом проходит за 3,5-4 ч при Т=70°С и постоянном перемешивании, при полной конверсии (1) и приводит к образованию метилового эфира левулиновой кислоты с выходом 98%. Аналогично проходит взаимодействие фурфурилового спирта с этиловым, пропиловым и изопропиловым спиртами. Выходы соответствующих эфиров (3-5)составляют: 95%, 85% и 80% соответственно. (См. табл.1)
Мы установили, что катализатором образования эфиров левулиновой кислоты является не только Fe(асас)3, но и HCl, который выделяется в условиях реакции при разложении алкилгипохлорита, образующегося при окислении метанола и других спиртов с помощью CCl4 под действием Fe(асас)3. Образование HCl подтверждается титриметрическим анализом, а хлороформа и карбонильных соединений (формальдегида, ацетальдегида, пропаналя и ацетона в зависимости от исходного спирта) – данными ГЖХ и хроматомасс-спектрометрии. Преимущества предлагаемого способа. 1. Высокий выход эфиров левулиновой кислоты (80-98%). 2. Доступность реагентов. 3. Отказ от использования заведомо взятого газообразного HCl, генерирование его in situ, из инертных CCl4 и спирта. 4. Простота аппаратурного оформления. 5. Незначительный расход катализатора. 6. Уменьшение трудо- и энергозатрат и экологическая безопасность. Способ поясняется примером. Пример 1. В реактор (V=100 мл) помещали под аргоном 0,1 ммоль Fe(асас)3, 10 ммоль фурфурилового спирта, 40 ммоль алифатического спирта и 20 ммоль CCl4, реакцию проводили при постоянном перемешивании в течение 2-5 ч при температуре кипения алифатического спирта. В ходе реакции цвет раствора меняется от красно-коричевого до темно-коричневого. Кислотность реакционной массы меняется от нейтральной до кислой, что свидетельствует о генерировании in situ HCl из алканола и CCl4 под действием катализатора Fe(асас)3. Затем реактор охлаждали до комнатной температуры, реакционную массу фильтровали через слой силикагеля (элюент – гексан: эфир=1:1). Растворитель отгоняли, остаток перегоняли. Строение полученных соединений доказано спектральными данными, а также сравнением с известными образцами и справочными данными. [Словарь органических соединений. / Под. ред. Хейльброна И. и Бэнбери Г.М., т.2. – Изд-во: иностранной литературы.: М.-1949]. Метиловый эфир левулиновой кислоты. Выход 98%, т.кип.=76°С/10 Торр (Лит.: т.кип.=196°С). Спектр ЯМР 1H (CDCl3, Масс-спектр, m/z (Iотн. (%)): 130 [M]+(10), 43 (96), 45(7), 51(1), 53(3), 55(57), 57(38), 59(40), 60(4), 70(2), 71(32). 75(6). 76(1), 81(4), 83(1), 87(25), 88(45), 89(3), 90(0.5), 98(44), 99(100), 100(10), 101(2), 110(0.5), 115(98), 116(6), 117(2), 120(0.5). Этиловый эфир левулиновой кислоты. Выход 95%, т.кип.=73-74°С/6 Торр (Лит.: т.кип.=205-208°С). Спектр ЯМР 1Н (CDCl3, ЯМР 13С ( Масс-спектр, m/z (Iотн. (%)): 144 [М]+ (5), 43(100), 45(7), 55(8), 71(10), 73(15), 74(20), 98(13), 99(80), 101 (24), 102 (22), 129 (30). Изопропиловый эфир левулиновой кислоты. Выход 85%, т.кип.86-87°С/10 Торр. (Лит.: т.кип.=209-203°С). Масс-спектр, m/z (Iотн. (%)): 158[М]+ (0.3), 41(12), 43(93), 71(8). 73(7), 74(29), 98(5), 99(100), 101(19), 116(13), 117(15), 130(3), 143(7), 144(0.2). Пропиловый эфир левулиновой кислоты. Выход 80%, т.кип.95-96°C/10 Торр. (Лит.: т.кип.=221-222°С). Спектр ЯМР 1Н (CDCl3, Масс-спектр, m/z (Iотн. (%)): 158[M]+(0.3), 43(99), 71(12), 73(14), 74(21), 98(18), 99(100), 101(31), 129(39).
Формула изобретения
Способ получения эфиров левулиновой кислоты общей формулы
где R=алкил, взаимодействием фурфурилового спирта с алифатическими спиртами в присутствии катализатора, отличающийся тем, что в качестве катализатора используется ацетилацетонат железа Fe(асас)3, реакцию проводят в растворе CCl4 при мольном соотношении [Fe(асас)3]: [фурфуриловый спирт]: [ROH]:[CCl4]=1:50-200:100-400:100-400, при температуре кипения спирта, в течение 2-5 ч.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -лактона 4-гидрокси-3-пентеновой кислоты и спиртов (ROH) при мольном соотношении 3:7 [Патент США №20060063948 A1, 2006].
-лактона 4-гидрокси-3-пентеновой кислоты и спиртов (ROH) при мольном соотношении 3:7 [Патент США №20060063948 A1, 2006].

 , м.д., TMS, Гц): 3.66 (3Н, с, СН3), 2.19(3Н, с, СОСН3), 2.56(2Н, т, СН2, J=5.5), 2.70(2Н, т, СН2, J=6.3), ЯМР 13С (
, м.д., TMS, Гц): 3.66 (3Н, с, СН3), 2.19(3Н, с, СОСН3), 2.56(2Н, т, СН2, J=5.5), 2.70(2Н, т, СН2, J=6.3), ЯМР 13С (