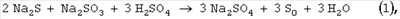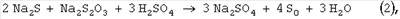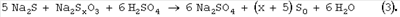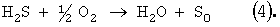Патент на изобретение №2319671
|
||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ОБЕЗВРЕЖИВАНИЯ СУЛЬФИДСОДЕРЖАЩИХ ЩЕЛОЧНЫХ РАСТВОРОВ
(57) Реферат:
Изобретение относится к области химических технологий и может найти применение для очистки щелочных растворов сульфидов на предприятиях нефтеперерабатывающей, химической, целлюлозно-бумажной, кожевенной и других отраслей промышленности. Способ обезвреживания сульфидсодержащих щелочных растворов с получением элементной серы включает обработку раствора, содержащего до 100 г/л сульфидов металлов, молекулярным кислородом и/или воздухом в присутствии катализатора окисления сероводорода. Процесс осуществляют в две стадии – на первой стадии при pH
Изобретение относится к области химических технологий и может найти применение для очистки щелочных растворов сульфидов на предприятиях нефтеперерабатывающей, химической, целлюлозно-бумажной, кожевенной и других отраслей промышленности. На практике очистку моторных топлив, масел, нефти и нефтепродуктов от сероводорода проводят обработкой углеводородного топлива щелочными растворами. Это приводит к удалению из углеводородных топлив коррозионных и нестабильных кислых примесей, включающих фенолы, органические кислоты, продукты предварительной очистки нефтепродуктов серной кислотой (сульфокислот и алкилсульфатов) [Черножуков Н.И. Технология переработки нефти и газа. Часть 3. Очистка и разделение нефтяного сырья, производство товарных нефтепродуктов. М.: Химия. – 1978. – С.53]. Значительные трудности вызывает проблема утилизации отработанных сульфидных щелочных растворов. При их нейтрализации или попадании в общий сток выделяется сероводород. На практике перед сбросом отработанных щелочных растворов в общую канализационную систему сероводород удаляют отдувкой дымовыми газами с последующим сжиганием его в печах. Однако этот способ приводит к выбросам в атмосферу токсичных и вызывающих коррозию оксидов серы. Поэтому в последнее время получили распространение жидкостные окислительные методы утилизации отработанных сернистых щелочных растворов. В этом случае окисление щелочных растворов, содержащих сульфиды, осуществляется продувкой воздухом. Для ускорения процесса окисления применяются катализаторы – активированный уголь, растворимые производные фталоцианина кобальта [Патент РФ 2109033, C10G 27/10, 20.04.98]. Несмотря на широкое распространение жидкофазного способа очистки отработанных сульфидсодержащих щелочных растворов возникают проблемы, связанные с последующим удалением соединений серы из раствора. В процессе окисления образуются тиосульфат, сульфит, политионаты. Эти соединения потребляют кислород, поэтому при попадании в водоемы происходит снижение концентрации растворенного кислорода, что отрицательно влияет на биологические процессы в водоемах. Для снижения вредного влияния промежуточных продуктов окисления рекомендуется проводить окисления до образования сульфатов, которые не обладают токсичностью. Но процесс окисления сероводорода в сильно щелочных растворах (рН na2s=0,1÷1,0 моль/л, рН=11-14) в температурном интервале 100-130°С и давлении кислорода 1 МПа с использованием в качестве катализатора пористого графитоподобного материала Сибунит позволяет конвертировать Na2S на 99.95% при селективности по Na2SO4 – 97% и избежать образования побочных продуктов – сульфита и тиосульфата. Описанный способ принят по наибольшему количеству сходных с предлагаемыми признаков за прототип изобретения, а именно способа получения серы из сульфидсодержащих щелочных растворов. Хотя окисление при повышенных температурах и давлениях позволяет осуществить окисление сернистых соединений до сульфатов, недостатками прототипа являются, во-первых, значительные энергетические затраты на сжатие кислорода до 1 МПа, а в пересчете на воздух – до 4.8 МПа, во-вторых, необходимость использования повышенных температур (100-130°С), что вызывает интенсивную коррозию оборудования и отдувку летучих соединений, которые необходимо обезвреживать перед выбросом в атмосферу. Изобретение решает задачу существенного упрощения технологии окисления отработанных сульфидных щелочных растворов и снижения энергетических затрат. Задача решается способом, включающим обработку раствора, содержащего до 100 г/л сульфидов металлов, молекулярным кислородом и/или воздухом в присутствии катализатора окисления сероводорода, и процесс проводят в две стадии, на первой стадии при рН Процесс каталитического окисления сульфидов в растворе разделяется на две стадии за счет изменения рН раствора. На первой стадии при рН При этом для этого процесса можно использовать как жидкофазные (например, производные фталоцианина кобальта, соли либо комплексные соединения солей переходных металлов), так и твердофазные катализаторы (например, активные угли). Для нейтрализации могут быть использованы неорганические (соляная, серная, фосфорная) или органические (уксусная, щавелевая) кислоты, а также карбоновые кислоты, которые содержатся в отходах производства синтетических жирных кислот, и кислые стоки процессов алкилирования, изомеризации, полимеризации и сернокислотной очистки углеводородов в нефтепереработке, нефтехимии и при производстве продуктов органического синтеза. Кислые отходы на нефтеперерабатывающих заводах требуют нейтрализации известью или содой. Поэтому предлагаемый способ позволяет утилизировать кислые отходы, что дает возможность упростить технологию их обезвреживания и добиться экономии нейтрализующих реагентов. Образовавшаяся сера отделяется от раствора фильтрованием либо плавлением при температуре 120°С с последующим отстаиванием раствора. Учитывая высокую токсичность сероводорода, окисление раствора сульфидов необходимо проводить до степени поглощения кислорода, соответствующего реакции
На первой стадии процесса окисления кислород расходуется на образование промежуточных продуктов окисления – сульфита, тиосульфата, политионатов. В результате нейтрализации раствора происходит образование серы по уравнениям (1-3) и при соблюдении стехиометрии окисления по уравнению 4 все образовавшиеся сернистые соли и неокисленный сероводород в форме сульфидов превращаются в серу. Так как сероводород является наиболее токсичным компонентом по сравнению с окисленными соединениями серы, для предотвращения выделения H2S при нейтрализации возможно некоторое переокисление щелочного раствора сверх требуемого по уравнению (4). Избыток поглощенного кислорода сверх 5÷10%, требуемого по уравнению (4), позволяет при подкислении полностью связать сероводород и не допустить его попадания в атмосферу и сточные воды. Способ осуществляют следующим образом. В очищаемый раствор, содержащий сульфиды металлов с концентрацией до 100 г/л и катализатор окисления сероводорода, имеющий рН Реакцию окисления водных растворов сульфидов с концентрацией 0.1-100 мг/л в присутствии катализатора, например тетрасульфофталоцианина кобальта (ТСФК), проводят в статическом реакторе с перемешиванием, соединенном с газовой бюреткой, заполненной кислородом, при температуре 20-50°С, предпочтительно комнатной, и атмосферном давлении до степени поглощения кислорода, соответствующего мольному соотношению O2/S2-=0.5÷0.7. Далее подачу кислорода прекращают и подкисляют очищаемый раствор кислотой до рН 3-5. После подкисления раствора реактор оставляют в закрытом виде без перемешивания на несколько минут для того, чтобы произошло образование элементной серы и нейтрализация щелочи. Содержание сульфида, сульфита, тиосульфата определяют йодометрическим титрованием по методикам, описанным в [Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. М.: Химия, 1984. – С.207-210]. Элементную серу отделяют от раствора на пористом стеклянном фильтре и определяют гравиметрическим методом [Крешков А.П. Основы аналитической химии. Т.2, М.: Химия, 1971. – С.269-270]. Конкретные условия реакции, время опыта, состав очищенного раствора и количество образовавшейся элементной серы представлены в приведенных ниже примерах и таблице. Пример 1. В раствор объемом 25 мл, содержащий 0.05 М (3.9 г/л) Na2S и 15 мг/л тетрасульфофталоцианина кобальта, подают кислород в течение 120 мин. Процесс осуществляют при температуре 25°С и давлении воздуха 0.1 МПа. Объем поглощенного кислорода – 41.4 мл. Состав очищенного раствора – 0.02 М (3.2 г/л) Na2S2O3 и 0.005 М (0.6 г/л) Na2SO3, следы Na2S (5×10-5 М). Сера не образуется. Пример 2. В раствор объемом 25 мл, содержащий 0.05 М (3.9 г/л) Na2S и 15 мг/л тетрасульфофталоцианина кобальта, подают кислород до поглощения 16 мл. Процесс осуществляют при температуре 25°С и давлении воздуха 0.1 МПа. Время окисления – 7 мин. Далее подачу кислорода прекращают и подкисляют очищаемый раствор серной кислотой до рН 3-5. В течение 5 мин после подкисления происходит образование серы. Состав очищенного раствора – 0.0013 М (0.2 г/л) Na2S2O3 и 0.048 М (6.8 г/л) Na2SO4. Количество образовавшейся элементной серы – 1.6 г. Пример 3. В раствор объемом 25 мл, содержащий 0.15 М (11.7 г/л) Na2S и 15 мг/л тетрасульфофталоцианина кобальта, подают кислород до поглощения 46 мл. Процесс осуществляют при температуре 20°С и давлении воздуха 0.1 МПа. Время окисления – 13 мин. Далее подачу кислорода прекращают и подкисляют очищаемый раствор соляной кислотой до рН 3-5. В течение 5 мин после подкисления происходит образование серы. Состав очищенного раствора – 0.0002 М (0.03 г/л) Na2S2O3 и 0.30 М (17.5 г/л) NaCl. Количество образовавшейся элементной серы – 4.8 г. Пример 4. В раствор объемом 25 мл, содержащий 0.5 М (39 г/л) Na2S и 15 мг/л тетрасульфофталоцианина кобальта, подают кислород до поглощения 154 мл. Процесс осуществляют при температуре 25°С и давлении воздуха 0.1 МПа. Время окисления – 41 мин. Далее подачу кислорода прекращают и подкисляют очищаемый раствор уксусной кислотой до рН 3-5. В течение 5 мин после подкисления происходит образование серы. Состав очищенного раствора – 0.0002 М (0.03 г/л) Na2S2O3 и 1.0 М (59.0 г/л) CN3COONa. Количество образовавшейся элементной серы – 16 г. Пример 5. В раствор объемом 25 мл, содержащий 1.2 М (93.6 г/л) Na2S и 15 мг/л тетрасульфофталоцианина кобальта, подают кислород до поглощения 370 мл. Процесс осуществляют при температуре 25°С и давлении воздуха 0.1 МПа. Время окисления – 110 мин. Далее подачу кислорода прекращают и подкисляют очищаемый раствор серной кислотой до рН 3-5. В течение 5 мин после подкисления происходит образование серы. Состав очищенного раствора – 0.002 М (0.3 г/л) Na2S2O3 и 1.2 М (170.4 г/л) Na2SO4. Количество образовавшейся элементной серы – 38.4 г. Как видно из приведенных примеров и таблицы, предлагаемый способ окислительного обезвреживания сульфидсодержащих щелочных растворов с получением элементной серы при температурах, близких к комнатной, и атмосферном давлении позволяет полностью превратить сульфиды в элементную серу. Увеличение температуры и давления будет приводить к сокращению времени протекания процесса.
Формула изобретения
1. Способ обезвреживания сульфидсодержащих щелочных растворов с получением элементной серы, включающий обработку раствора кислородом и/или воздухом в присутствии катализатора окисления сероводорода, отличающийся тем, что процесс проводят в две стадии, на первой стадии при pH 2. Способ по п.1, отличающийся тем, что способ осуществляют при температуре не ниже 20°С и давлении воздуха не ниже 0,1 МПа. 3. Способ по п.1, отличающийся тем, что для подкисления используют неорганические, такие как соляная, серная, фосфорная, или органические, такие как уксусная, щавелевая кислоты, а также карбоновые кислоты, которые содержатся в отходах производства синтетических жирных кислот, и кислые стоки процессов алкилирования, изомеризации, полимеризации и серно-кислотной очистки углеводородов в нефтепереработке, нефтехимии и при производстве продуктов органического синтеза. 4. Способ по п.1, отличающийся тем, что вторую стадию проводят в закрытом реакторе.
|
||||||||||||||||||||||||||||||||||||||||||||

 11 окисление проводят до поглощения кислорода, соответствующего мольному соотношению O2/S2-=0.5÷0.7, а на второй стадии подачу кислорода и/или воздуха прекращают и подкисляют раствор до pH=3÷5. Способ осуществляют при температуре не ниже 20°С и давлении воздуха не ниже 0.1 МПа. Способ обеспечивает полное превращение сульфидов в элементную серу, упрощение технологии окисления отработанных сульфидных щелочных растворов и снижение энергетических затрат. 3 з.п. ф-лы, 1 табл.
11 окисление проводят до поглощения кислорода, соответствующего мольному соотношению O2/S2-=0.5÷0.7, а на второй стадии подачу кислорода и/или воздуха прекращают и подкисляют раствор до pH=3÷5. Способ осуществляют при температуре не ниже 20°С и давлении воздуха не ниже 0.1 МПа. Способ обеспечивает полное превращение сульфидов в элементную серу, упрощение технологии окисления отработанных сульфидных щелочных растворов и снижение энергетических затрат. 3 з.п. ф-лы, 1 табл.