Патент на изобретение №2159936
|
||||||||||||||||||||||||||
(54) СПОСОБ ВЫБОРА ТИПА ИММУНОМОДУЛИРУЮЩЕЙ ТЕРАПИИ И ОПРЕДЕЛЕНИЯ ПРОГНОЗА ИСХОДА ЗАБОЛЕВАНИЯ НА ОСНОВЕ АНАЛИЗА ИНТЕРФЕРОНОВОГО СТАТУСА БОЛЬНОГО
(57) Реферат: Изобретение относится к медицине, а именно к вирусологии и микробиологии, и касается способа выбора иммуномодулирующей терапии и определения прогноза заболевания на основе интерферонового статуса больного. Способ включает определение активности общих сывороточных интерферонов (S-ИФН), продукции лейкоцитами in vitro интерферона  / / и интерферона и интерферона  . Определение проводят в образцах цельной крови, инкубированных в среде RPMI-1640, в присутствии стандартных индукторов синтеза ИФН, посредством титрования исследуемых образцов на культуре клеток с последующей инкубацией с вирусом везикулярного стоматита. При этом используют перевиваемые культуры, чувствительные к действию ИФН. После инкубации клеток с вирусом их окрашивают раствором кристаллического фиолетового. Связавшийся краситель растворяют и его количество, пропорциональное активности ИФН, фотометрически измеряют при длине волны 570 – 590 нм. При активности S-ИФН 0 – 10 МЕ/мл, ИФН . Определение проводят в образцах цельной крови, инкубированных в среде RPMI-1640, в присутствии стандартных индукторов синтеза ИФН, посредством титрования исследуемых образцов на культуре клеток с последующей инкубацией с вирусом везикулярного стоматита. При этом используют перевиваемые культуры, чувствительные к действию ИФН. После инкубации клеток с вирусом их окрашивают раствором кристаллического фиолетового. Связавшийся краситель растворяют и его количество, пропорциональное активности ИФН, фотометрически измеряют при длине волны 570 – 590 нм. При активности S-ИФН 0 – 10 МЕ/мл, ИФН  / / 250 – 520 МЕ, ИФН 250 – 520 МЕ, ИФН  110 – 250 МЕ считают обследуемого здоровым. При S-ИФН 25 – 35 МЕ/мл, ИФН 110 – 250 МЕ считают обследуемого здоровым. При S-ИФН 25 – 35 МЕ/мл, ИФН  / / 60 – 110 МЕ/мл, ИФН 60 – 110 МЕ/мл, ИФН  30 – 55 МЕ/мл прогнозируют благоприятный исход заболевания и назначают химиопрепараты, препараты ИФН. При активности S-ИФН более 35 МЕ/мл, ИФН 30 – 55 МЕ/мл прогнозируют благоприятный исход заболевания и назначают химиопрепараты, препараты ИФН. При активности S-ИФН более 35 МЕ/мл, ИФН  / / – менее 60 МЕ, ИФН – менее 60 МЕ, ИФН  менее 30 МЕ прогнозируют тяжелое протекание заболевания, требующее срочного терапевтического вмешательства. При активности S-ИФН 12 – 25 МЕ/мл, ИФН менее 30 МЕ прогнозируют тяжелое протекание заболевания, требующее срочного терапевтического вмешательства. При активности S-ИФН 12 – 25 МЕ/мл, ИФН  / / – 85 – 250 МЕ, ИФН – 85 – 250 МЕ, ИФН  45 – 110 МЕ прогнозируют эронизацию патологического процесса и назначают препараты ИФН. При активности S-ИФН 0 – 10 МЕ/мл, ИФН 45 – 110 МЕ прогнозируют эронизацию патологического процесса и назначают препараты ИФН. При активности S-ИФН 0 – 10 МЕ/мл, ИФН  / / менее 40 МЕ, ИФН менее 40 МЕ, ИФН  менее 20 МЕ прогнозируют неблагоприятный исход заболевания. При активности S-ИФН 12 – 40 МЕ/мл, ИФН менее 20 МЕ прогнозируют неблагоприятный исход заболевания. При активности S-ИФН 12 – 40 МЕ/мл, ИФН  / / 60 – 400 МЕ, ИФН 60 – 400 МЕ, ИФН  более 250 МЕ прогнозируют развитие нейроиммунной патологии. Способ информативен и достоверен. 2 з.п. ф-лы, 1 табл., 1 ил. более 250 МЕ прогнозируют развитие нейроиммунной патологии. Способ информативен и достоверен. 2 з.п. ф-лы, 1 табл., 1 ил.
Изобретение относится к медицине, а именно к вирусологии и иммунологии, и касается способа выбора иммуномодулирующей терапии и определения прогноза исхода заболевания на основе анализа интерферонового статуса больного. Система интерферона (ИФН) обеспечивает противовирусную резистентность организма и влияет на весь комплекс его специфических и неспецифических защитных реакций. Отражением функционального состояния системы ИФН является ИФН статус (1, 4), оценка которого проводится по нескольким показателям, основные из которых: 1. Количество (активность) циркулирующего в крови ИФН (общий сывороточный ИФН). 2. Уровень продукции ИФН –  / / лейкоцитами (или лимфоцитами) in vitro при его индукции вирусными индукторами (интерфероновая реакция лейкоцитов – ИРЛ).
3. Уровень продукции ИФН – лейкоцитами (или лимфоцитами) in vitro при его индукции вирусными индукторами (интерфероновая реакция лейкоцитов – ИРЛ).
3. Уровень продукции ИФН – при его индукции митогенами в лейкоцитах (лимфоцитах) in vitro (2).
Исследование ИФН статуса позволяет определить количественные параметры физиологического интерферонового ответа у здоровых людей (1, 3, 5) и выявить интерферонодефицитные синдромы при острых, хронических, рецидивирующих инфекционных и аутоиммунных заболеваниях, первичных и вторичных иммунодефицитах (9, 11). Определение ИФН статуса достаточно информативно и может служить надежным клиническим ориентиром при диагностике, лечении и прогнозе исхода заболевания, как вирусной, так и невирусной этиологии.
Известен способ определения активности ИФН в сыворотке и плазме крови на основе торможения роста микроорганизмов в культуре. Однако данный метод не обладает достаточной чувствительностью и воспроизводимостью, не дает возможности выражения результатов в общепринятых международных единицах (ME), а также, выбора иммуномодулирующей терапии и прогноза исхода заболевания (МКИ 5 A 61 K 37/66, AC N 1082422, 1984 г.). Известен способ определения интерферонового статуса и прогноза исхода заболевания, включающий следующие стадии: кровь доноров или больных в объеме 1-1,5 мл берут из вены, добавляют гепарин, далее в 2 центрифужные пробирки вносят по 800 мкл Среды RPMI-1640, 100 мкл цельной крови, 100 мкл вируса болезни Ньюкасла (NDV) и фитогемагглютинин (ФГА) для индукции ИФН – при его индукции митогенами в лейкоцитах (лимфоцитах) in vitro (2).
Исследование ИФН статуса позволяет определить количественные параметры физиологического интерферонового ответа у здоровых людей (1, 3, 5) и выявить интерферонодефицитные синдромы при острых, хронических, рецидивирующих инфекционных и аутоиммунных заболеваниях, первичных и вторичных иммунодефицитах (9, 11). Определение ИФН статуса достаточно информативно и может служить надежным клиническим ориентиром при диагностике, лечении и прогнозе исхода заболевания, как вирусной, так и невирусной этиологии.
Известен способ определения активности ИФН в сыворотке и плазме крови на основе торможения роста микроорганизмов в культуре. Однако данный метод не обладает достаточной чувствительностью и воспроизводимостью, не дает возможности выражения результатов в общепринятых международных единицах (ME), а также, выбора иммуномодулирующей терапии и прогноза исхода заболевания (МКИ 5 A 61 K 37/66, AC N 1082422, 1984 г.). Известен способ определения интерферонового статуса и прогноза исхода заболевания, включающий следующие стадии: кровь доноров или больных в объеме 1-1,5 мл берут из вены, добавляют гепарин, далее в 2 центрифужные пробирки вносят по 800 мкл Среды RPMI-1640, 100 мкл цельной крови, 100 мкл вируса болезни Ньюкасла (NDV) и фитогемагглютинин (ФГА) для индукции ИФН – / / и ИФН – и ИФН – соответственно. Конечное разведение цельной крови в объеме 1 мл – 1/10. Оставшееся количество крови использовали для получения проб сывороточного ИФН. Индукцию ИФН – соответственно. Конечное разведение цельной крови в объеме 1 мл – 1/10. Оставшееся количество крови использовали для получения проб сывороточного ИФН. Индукцию ИФН – / / и ИФН – и ИФН – проводили в течение 24 часов при 37oC в атмосфере 5% CO2. После инкубации пробы центрифугировали, надосадочную жидкость отсасывали. В пробах с индукцией синтеза ИФН – проводили в течение 24 часов при 37oC в атмосфере 5% CO2. После инкубации пробы центрифугировали, надосадочную жидкость отсасывали. В пробах с индукцией синтеза ИФН – / / лейкоцитами in vitro проводили инактивацию NDV инкубацией при pH до 2.0 в течение 2-3 суток при 4oC с последующим восстановлением до рН 7.4. Пробы хранили при 4oC до титрования. При постановке титрования микрометодом использовали 96-луночные микропланшеты. Для титрования использовали клетки линии М-19 (фибробласты человека). Каждую реакцию ставили в объеме 200 мкл с двумя повторами, общий расход цельной крови при этом составлял 200 мкл. В качестве тест-вируса использовали вирус везикулярного стоматита (ВВС), штамм Индиана. За единицу активности ИФН принимали величину, обратную его разведению, задерживающую деструкцию монослоя на 50%. У здоровых доноров уровень общего сывороточного ИФН соответствовал 2-8 ед/мл, индукция ИФН- лейкоцитами in vitro проводили инактивацию NDV инкубацией при pH до 2.0 в течение 2-3 суток при 4oC с последующим восстановлением до рН 7.4. Пробы хранили при 4oC до титрования. При постановке титрования микрометодом использовали 96-луночные микропланшеты. Для титрования использовали клетки линии М-19 (фибробласты человека). Каждую реакцию ставили в объеме 200 мкл с двумя повторами, общий расход цельной крови при этом составлял 200 мкл. В качестве тест-вируса использовали вирус везикулярного стоматита (ВВС), штамм Индиана. За единицу активности ИФН принимали величину, обратную его разведению, задерживающую деструкцию монослоя на 50%. У здоровых доноров уровень общего сывороточного ИФН соответствовал 2-8 ед/мл, индукция ИФН- / / в культуре лейкоцитов равняется 1280 ед, ИФН- в культуре лейкоцитов равняется 1280 ед, ИФН- – 256 ед, при острой вирусной инфекции сывороточный ИФН равнялся 128 ед/мл, продукция ИФН- – 256 ед, при острой вирусной инфекции сывороточный ИФН равнялся 128 ед/мл, продукция ИФН- / / – 10 ед, ИФН- – 10 ед, ИФН- – 64 ед. При хронической вирусной инфекции эти показатели составляли: сывороточный ИФН 32-64 ед/мл, продукция ИФН – – 64 ед. При хронической вирусной инфекции эти показатели составляли: сывороточный ИФН 32-64 ед/мл, продукция ИФН – / / – 80 ед, ИФН – – 80 ед, ИФН – <2 ед. (Григорян С. С. Оценка интерферонового статуса людей по пробам цельной крови. Вопросы вирусологии, 1988, т. 3, N 4, с. 433-436).
Сущность изобретения состоит в том, что для анализа ИФН статуса в стерильные пробирки отбирают венозную кровь объемом от 0.5 до 5 мл. В часть пробирок предварительно вносится необходимое количество стерильного гепарина в виде концентрированного (для исключения разбавления исходного образца) раствора на среде RPMI- 1640 или на физиологическом растворе, так, чтобы конечная концентрация гепарина составила 10-15 ед/мл. Отобранная таким образом кровь может храниться 5-6 часов при 4oC без потери всех необходимых свойств.
Цельную негепаринизированную кровь центрифугируют 10-15 мин при 1000 g, после чего в стерильный эппендорф отбирают 50-200 мкл сыворотки для анализа содержания общего сывороточного ИФН. Для типирования ИФН в сыворотке крови (ИФН – <2 ед. (Григорян С. С. Оценка интерферонового статуса людей по пробам цельной крови. Вопросы вирусологии, 1988, т. 3, N 4, с. 433-436).
Сущность изобретения состоит в том, что для анализа ИФН статуса в стерильные пробирки отбирают венозную кровь объемом от 0.5 до 5 мл. В часть пробирок предварительно вносится необходимое количество стерильного гепарина в виде концентрированного (для исключения разбавления исходного образца) раствора на среде RPMI- 1640 или на физиологическом растворе, так, чтобы конечная концентрация гепарина составила 10-15 ед/мл. Отобранная таким образом кровь может храниться 5-6 часов при 4oC без потери всех необходимых свойств.
Цельную негепаринизированную кровь центрифугируют 10-15 мин при 1000 g, после чего в стерильный эппендорф отбирают 50-200 мкл сыворотки для анализа содержания общего сывороточного ИФН. Для типирования ИФН в сыворотке крови (ИФН – , ИФН – , ИФН – , ИФН – , ИФН – ) образцы инкубируются с моноклональными антителами (MAT) к различным типам ИФН в течение 1 часа при 37oC. Содержание ИФН каждого типа определяют, исходя из активности общего сывороточного ИФН и величины падения активности ИФН в каждом образце после инкубации с МАТ. Образцы хранят при -25oC.
Для определения содержания кислотолабильного ИФН – ) образцы инкубируются с моноклональными антителами (MAT) к различным типам ИФН в течение 1 часа при 37oC. Содержание ИФН каждого типа определяют, исходя из активности общего сывороточного ИФН и величины падения активности ИФН в каждом образце после инкубации с МАТ. Образцы хранят при -25oC.
Для определения содержания кислотолабильного ИФН – в сыворотке крови в исследуемые образцы добавляют раствор 0.1 н. HCl до pH 2.0, образцы инкубируют в течение 1 часа при 37oC, после чего pH доводят до 7.4 добавлением 0.1 н. NaOH. Параллельно с этим, другую аликвоту исследуемого образца инкубируют с МАТ к ИФН – в сыворотке крови в исследуемые образцы добавляют раствор 0.1 н. HCl до pH 2.0, образцы инкубируют в течение 1 часа при 37oC, после чего pH доводят до 7.4 добавлением 0.1 н. NaOH. Параллельно с этим, другую аликвоту исследуемого образца инкубируют с МАТ к ИФН – 1 час при 37oC для осаждения сывороточного ИФН – 1 час при 37oC для осаждения сывороточного ИФН – . Содержание кислотолабильного ИФН – . Содержание кислотолабильного ИФН – определяют как разность активностей образца, инкубированного с МАТ к ИФН – определяют как разность активностей образца, инкубированного с МАТ к ИФН – , и образца, инкубированного при pH 2.0. Образцы хранят до анализа при -25oC.
Для определения уровня продукции различных типов ИФН лейкоцитами крови in vitro в стерильные эппендорфы вносят среду RPMI-1640 с добавлением глутамина, антибиотиков (пенициллин, стрептомицин до 100 ед/мл), 2% сыворотки КРС, растворы индукторов ИФН (5-7 lg ЭИД50 NDV для ИФН – , и образца, инкубированного при pH 2.0. Образцы хранят до анализа при -25oC.
Для определения уровня продукции различных типов ИФН лейкоцитами крови in vitro в стерильные эппендорфы вносят среду RPMI-1640 с добавлением глутамина, антибиотиков (пенициллин, стрептомицин до 100 ед/мл), 2% сыворотки КРС, растворы индукторов ИФН (5-7 lg ЭИД50 NDV для ИФН – / / ) и энтеротоксин St. aureus (СЭА, 10 мг/мл) для ИФН – ) и энтеротоксин St. aureus (СЭА, 10 мг/мл) для ИФН – и цельную гепаринизированную кровь в соотношении 8/1/1 (например, 100 мкл PRMI-1640, 12.5 мкл раствора индуктора ИФН и 12.5 мкл цельной крови). Для определения уровня спонтанной продукции ИФН вместо раствора индуктора вносят эквивалентный объем питательной среды. Полученную индукционную смесь инкубируют 24 часа при 37oC, затем в эппендорфы, в которых производится индукция ИФН – и цельную гепаринизированную кровь в соотношении 8/1/1 (например, 100 мкл PRMI-1640, 12.5 мкл раствора индуктора ИФН и 12.5 мкл цельной крови). Для определения уровня спонтанной продукции ИФН вместо раствора индуктора вносят эквивалентный объем питательной среды. Полученную индукционную смесь инкубируют 24 часа при 37oC, затем в эппендорфы, в которых производится индукция ИФН – / / , добавляют 0.1 н. раствор HCl до pH 2.0, пробы инкубируют 1 час при 37oC, после чего в них вносят 0.1 н. раствор NaOH до pH 7.4. Таким же образом обрабатывают пробы спонтанно продуцированного ИФН, в которых определяют содержание ИФН – , добавляют 0.1 н. раствор HCl до pH 2.0, пробы инкубируют 1 час при 37oC, после чего в них вносят 0.1 н. раствор NaOH до pH 7.4. Таким же образом обрабатывают пробы спонтанно продуцированного ИФН, в которых определяют содержание ИФН – по падению активности ИФН в закисленной/восстановленной пробе (ее активность соответствует активности спонтанно-продуцируемого ИФН – по падению активности ИФН в закисленной/восстановленной пробе (ее активность соответствует активности спонтанно-продуцируемого ИФН – / / ) по сравнению с обычной. Обработанные таким образом пробы с индуцированным и спонтанно продуцированным ИФН хранятся до анализа при -25oC. Непосредственно перед анализом пробы, подвергшиеся закислению/восстановлению (индуцированный и спонтанный ИФН – ) по сравнению с обычной. Обработанные таким образом пробы с индуцированным и спонтанно продуцированным ИФН хранятся до анализа при -25oC. Непосредственно перед анализом пробы, подвергшиеся закислению/восстановлению (индуцированный и спонтанный ИФН – / / ), центрифугируют 10-20 мин при 3000-4000 g для осаждения коагулированных макромолекул.
При определении индуцированной продукции кислотолабильного ИФН- ), центрифугируют 10-20 мин при 3000-4000 g для осаждения коагулированных макромолекул.
При определении индуцированной продукции кислотолабильного ИФН- , индукцию его синтеза проводят в тех же условиях и параллельно индукции общего ИФН – , индукцию его синтеза проводят в тех же условиях и параллельно индукции общего ИФН – / / с той разницей, что вместо закисления/восстановления после инкубации и NDV образцы инкубируют с поликлональной сывороткой к NDV 1 час при 37oC. Обработанные таким образом пробы центрифугируют при 4000-7000 g для осаждения NDV и хранят до анализа при -25oC.
Определение активности ингибиторов/активаторов действия ИФН в физиологических жидкостях производят совместным титрованием исследуемого образца на фоне постоянной концентрации референс- препарата ИФН при прочих условиях, соответствующих обычному титрованию (см. ниже). Активность ингибиторов/активаторов действия ИФН определяют по отношению активности стандартного препарата ИФН к активности стандартного препарата той же концентрации в присутствии исследуемой сыворотки крови и выражают как коэффициент стимуляции. Образцы физиологических жидкостей (сыворотка крови, цереброспинальная, синовиальная и пр. жидкости) аликвотируют и хранят до анализа при -25oC.
Активность ингибиторов/активаторов синтеза ИФН в физиологических жидкостях определяют следующим образом: в индукционную систему контрольных проб, аналогичную таковой для оценки индуцированной продукции ИФН, вносят стандартные индукторы ИФН – с той разницей, что вместо закисления/восстановления после инкубации и NDV образцы инкубируют с поликлональной сывороткой к NDV 1 час при 37oC. Обработанные таким образом пробы центрифугируют при 4000-7000 g для осаждения NDV и хранят до анализа при -25oC.
Определение активности ингибиторов/активаторов действия ИФН в физиологических жидкостях производят совместным титрованием исследуемого образца на фоне постоянной концентрации референс- препарата ИФН при прочих условиях, соответствующих обычному титрованию (см. ниже). Активность ингибиторов/активаторов действия ИФН определяют по отношению активности стандартного препарата ИФН к активности стандартного препарата той же концентрации в присутствии исследуемой сыворотки крови и выражают как коэффициент стимуляции. Образцы физиологических жидкостей (сыворотка крови, цереброспинальная, синовиальная и пр. жидкости) аликвотируют и хранят до анализа при -25oC.
Активность ингибиторов/активаторов синтеза ИФН в физиологических жидкостях определяют следующим образом: в индукционную систему контрольных проб, аналогичную таковой для оценки индуцированной продукции ИФН, вносят стандартные индукторы ИФН – / / и ИФН – и ИФН – (NDV и СЭА соответственно) и, вместо цельной крови, клетки линии Namalva (до концентрации 106 кл/мл) в эквивалентном объеме. Опытные пробы, кроме этого, содержат раститрованные образцы исследуемых физиологических жидкостей. Индукцию синтеза ИФН проводят при тех же условиях и количественных соотношениях компонентов, как при определении индукции ИФН – (NDV и СЭА соответственно) и, вместо цельной крови, клетки линии Namalva (до концентрации 106 кл/мл) в эквивалентном объеме. Опытные пробы, кроме этого, содержат раститрованные образцы исследуемых физиологических жидкостей. Индукцию синтеза ИФН проводят при тех же условиях и количественных соотношениях компонентов, как при определении индукции ИФН – / / и ИФН – и ИФН – лейкоцитами in vitro. По соотношению активностей ИФН в опытных и контрольных пробах определяют активность ингибиторов/активаторов синтеза ИФН в исследуемых образцах как коэффициент стимуляции/ингибирования синтеза ИФН in vitro. После индукции пробы замораживаются и хранятся до анализа при -25oC.
Определение чувствительности естественных потенциальных продуцентов ИФН (лейкоциты крови) к применяемым в медицинской практике и экспериментальным лекарственным препаратам проводится при тех же условиях, как и определение индуцированной продукции ИФН лейкоцитами in vitro. При этом, вместо стандартных индукторов ИФН (NDV и СЭА) используют препараты, чувствительность к которым определяют. Оценивают влияние интересующего препарата на процессы продукции ИФН клетками донора in vitro. Чувствительность к препарату считают положительной, если активность ИФН в пробе на чувствительность в 1.5 и более раза выше общей активности спонтанно-продуцируемого лейкоцитами ИФН. Методически данный тест повторяет тест на индуцированную продукцию ИФН – лейкоцитами in vitro. По соотношению активностей ИФН в опытных и контрольных пробах определяют активность ингибиторов/активаторов синтеза ИФН в исследуемых образцах как коэффициент стимуляции/ингибирования синтеза ИФН in vitro. После индукции пробы замораживаются и хранятся до анализа при -25oC.
Определение чувствительности естественных потенциальных продуцентов ИФН (лейкоциты крови) к применяемым в медицинской практике и экспериментальным лекарственным препаратам проводится при тех же условиях, как и определение индуцированной продукции ИФН лейкоцитами in vitro. При этом, вместо стандартных индукторов ИФН (NDV и СЭА) используют препараты, чувствительность к которым определяют. Оценивают влияние интересующего препарата на процессы продукции ИФН клетками донора in vitro. Чувствительность к препарату считают положительной, если активность ИФН в пробе на чувствительность в 1.5 и более раза выше общей активности спонтанно-продуцируемого лейкоцитами ИФН. Методически данный тест повторяет тест на индуцированную продукцию ИФН – / / и ИФН – и ИФН – лейкоцитами in vitro с соблюдением всех соответствующих условий. Подготовленные таким образом пробы хранят до анализа при -25oC.
Анализ активности ИФН в подготовленных вышеописанными методами пробах проводят с помощью титрования исследуемых проб в 96- луночных микропланшетах над монослоем клеток перевиваемых культур (L-41, Нер-2, A-549, MG-63, L-929), инкубации 24 часа при 37oC в атмосфере 5% CO2, последующей инкубации в тех же условиях в присутствии 100 ЦПД50 вируса везикулярного стоматита (ВВС), штамм Индиана. После этого, для стандартизации и автоматизации учета результатов анализа микропланшеты окрашивают 5-10 мин 0.1% раствором кристаллического фиолетового на 30% этаноле, отмывают и высушивают на воздухе. Дальнейший учет результатов проводят либо визуально, либо автоматически с помощью ридера для иммуноферментного анализа, растворением окрашенного монослоя клеток 2% раствором додецилсульфата натрия на 5% глицерине (или экстракцией 30% этанолом 1 час при 37oC) и измерением оптической плотности полученных растворов при длине волны 570-590 нм.
Активность ИФН в анализируемом образце определяется с помощью калибровочной кривой зависимости (% сохранившихся клеток)/(активность стандартного препарата ИФН) для визуального учета или (оптическая плотность)/(активность стандартного препарата ИФН). Это дает возможность выражать результаты анализа в стандартных (международных) единицах (ME), а также значительно повысить точность получаемых результатов до лейкоцитами in vitro с соблюдением всех соответствующих условий. Подготовленные таким образом пробы хранят до анализа при -25oC.
Анализ активности ИФН в подготовленных вышеописанными методами пробах проводят с помощью титрования исследуемых проб в 96- луночных микропланшетах над монослоем клеток перевиваемых культур (L-41, Нер-2, A-549, MG-63, L-929), инкубации 24 часа при 37oC в атмосфере 5% CO2, последующей инкубации в тех же условиях в присутствии 100 ЦПД50 вируса везикулярного стоматита (ВВС), штамм Индиана. После этого, для стандартизации и автоматизации учета результатов анализа микропланшеты окрашивают 5-10 мин 0.1% раствором кристаллического фиолетового на 30% этаноле, отмывают и высушивают на воздухе. Дальнейший учет результатов проводят либо визуально, либо автоматически с помощью ридера для иммуноферментного анализа, растворением окрашенного монослоя клеток 2% раствором додецилсульфата натрия на 5% глицерине (или экстракцией 30% этанолом 1 час при 37oC) и измерением оптической плотности полученных растворов при длине волны 570-590 нм.
Активность ИФН в анализируемом образце определяется с помощью калибровочной кривой зависимости (% сохранившихся клеток)/(активность стандартного препарата ИФН) для визуального учета или (оптическая плотность)/(активность стандартного препарата ИФН). Это дает возможность выражать результаты анализа в стандартных (международных) единицах (ME), а также значительно повысить точность получаемых результатов до  0.5 ME. Учет проводится по той титровочной точке, в которой сохранилось 30-50% клеток от исходного числа (при визуальном учете) или по точке, оптическая плотность которой лежит в интервале 0.2-0.7 ед оптич. плотности (при автоматическом учете).
Приведенный комплекс показателей представляет собой полный вариант анализа ИФН статуса. На практике бывает достаточно использовать три основных показателя: задержание общего ИФН сыворотки крови (sИФН), продукция ИФН – 0.5 ME. Учет проводится по той титровочной точке, в которой сохранилось 30-50% клеток от исходного числа (при визуальном учете) или по точке, оптическая плотность которой лежит в интервале 0.2-0.7 ед оптич. плотности (при автоматическом учете).
Приведенный комплекс показателей представляет собой полный вариант анализа ИФН статуса. На практике бывает достаточно использовать три основных показателя: задержание общего ИФН сыворотки крови (sИФН), продукция ИФН – / / и ИФН – и ИФН – лейкоцитами крови при индукции in vitro.
В норме, содержание в крови sИФН соответствует диапазону 0-10 МЕ/мл, продукция ИФН – лейкоцитами крови при индукции in vitro.
В норме, содержание в крови sИФН соответствует диапазону 0-10 МЕ/мл, продукция ИФН – / / 250-520 ME, ИФН – 250-520 ME, ИФН – 110-250 ME. Низкое содержание ИФН в сыворотке крови сочетается с высокой потенциальной способностью к продукции различных типов ИФН.
При содержании sИФН 110-250 ME. Низкое содержание ИФН в сыворотке крови сочетается с высокой потенциальной способностью к продукции различных типов ИФН.
При содержании sИФН  25 МЕ/мл, продукции ИФН – 25 МЕ/мл, продукции ИФН – / /  110, ИФН – 110, ИФН –  55 прогнозируют благоприятный исход при остром течении заболевания, поскольку система ИФН адекватно реагирует на патологию выбросом достаточного количества ИФН. Действию естественных механизмов защиты не препятствует этиотропная терапия (антибиотики, химиопрепараты), с которой целесообразно сочетать препараты ИФН (виферон и др.) для предотвращения развития ИФН- и иммунодефицитов и усиления эффективности лечения. Применение индукторов ИФН малоэффективно (система ИФН не в состоянии ответить на дополнительную стимуляцию синтеза ИФН). Назначение препаратов ИНФ позволит компенсировать возможный дефицит активности систем защиты, что приведет к повышению способности к продукции ИФН – 55 прогнозируют благоприятный исход при остром течении заболевания, поскольку система ИФН адекватно реагирует на патологию выбросом достаточного количества ИФН. Действию естественных механизмов защиты не препятствует этиотропная терапия (антибиотики, химиопрепараты), с которой целесообразно сочетать препараты ИФН (виферон и др.) для предотвращения развития ИФН- и иммунодефицитов и усиления эффективности лечения. Применение индукторов ИФН малоэффективно (система ИФН не в состоянии ответить на дополнительную стимуляцию синтеза ИФН). Назначение препаратов ИНФ позволит компенсировать возможный дефицит активности систем защиты, что приведет к повышению способности к продукции ИФН – / / и ИФН – и ИФН – , и, в дальнейшем, позволит эффективно применять индукторы ИФН и иммуномодуляторы микробного происхождения.
При содержании sИФН >35, продукции ИФН – , и, в дальнейшем, позволит эффективно применять индукторы ИФН и иммуномодуляторы микробного происхождения.
При содержании sИФН >35, продукции ИФН – / / <60, ИФН – <60, ИФН – <30 прогнозируют тяжелое острое протекание заболевания, требующего срочного терапевтического вмешательства. От применения иммуномодулирующей терапии лучше воздержаться до стабилизации состояния пациента.
При содержании sИФН 12-25 МЕ/мл, продукции ИФН – <30 прогнозируют тяжелое острое протекание заболевания, требующего срочного терапевтического вмешательства. От применения иммуномодулирующей терапии лучше воздержаться до стабилизации состояния пациента.
При содержании sИФН 12-25 МЕ/мл, продукции ИФН – / / 85-250 ME, ИФН – 85-250 ME, ИФН – 45-110 ME прогнозируют подострый характер протекания заболевания и высокую вероятность хронизации, поскольку реакция системы ИФН недостаточна для обеспечения защиты организма. Назначают иммуностимулирующие препараты (индукторы ИФН, препараты микробного происхождения, полимерные препараты: циклоферон, неовир, пирогенал, ликопид, полирем и др.). Для усиления их эффекта их комбинируют с препаратами ИФН (виферон) по схемам: 1-й день виферон (2 приема по одной свече 150000 – 1000000 ME), 2-й день индуктор ИФН (циклоферон, неовир – 1 инъекция, 2 мл 12.5% р- р) и т.д. в течение 20-30 дней; 1-2 10-дневных курса виферона (2 раза в день через 10-12 часов по 1 свече 150000 – 1000000 ME, перерыв между курсами 5-7 дней) и через 5-7 дней 1-2 курса индукторов ИФН (циклоферон, неовир, по 1 инъекции 2 мл 12.5% р-ра на 1, 2, 4, 6, 8 дни, перерыв между курсами 5-7 дней). Чем выше sИФН и ниже продукция ИФН – 45-110 ME прогнозируют подострый характер протекания заболевания и высокую вероятность хронизации, поскольку реакция системы ИФН недостаточна для обеспечения защиты организма. Назначают иммуностимулирующие препараты (индукторы ИФН, препараты микробного происхождения, полимерные препараты: циклоферон, неовир, пирогенал, ликопид, полирем и др.). Для усиления их эффекта их комбинируют с препаратами ИФН (виферон) по схемам: 1-й день виферон (2 приема по одной свече 150000 – 1000000 ME), 2-й день индуктор ИФН (циклоферон, неовир – 1 инъекция, 2 мл 12.5% р- р) и т.д. в течение 20-30 дней; 1-2 10-дневных курса виферона (2 раза в день через 10-12 часов по 1 свече 150000 – 1000000 ME, перерыв между курсами 5-7 дней) и через 5-7 дней 1-2 курса индукторов ИФН (циклоферон, неовир, по 1 инъекции 2 мл 12.5% р-ра на 1, 2, 4, 6, 8 дни, перерыв между курсами 5-7 дней). Чем выше sИФН и ниже продукция ИФН – / / и ИФН – и ИФН – (острее протекание заболевания), тем более показаны препараты интерферона (виферон). Наибольшая эффективность достигается при 1-2 курсах виферона и, затем, сочетании виферона и индукторов ИФН по вышеприведенной схеме.
При содержании sИФН 0-10 ME, продукции ИФН – (острее протекание заболевания), тем более показаны препараты интерферона (виферон). Наибольшая эффективность достигается при 1-2 курсах виферона и, затем, сочетании виферона и индукторов ИФН по вышеприведенной схеме.
При содержании sИФН 0-10 ME, продукции ИФН – / / <40 ME, ИФН- <40 ME, ИФН- <20 ME делают неблагоприятный прогноз исхода заболевания. Для компенсации ИФН- и иммунодефицита назначают иммунозаместительную терапию: препараты ИФН (виферон), гамма-глобулина, интерлейкинов (ронколейкин) и других препаратов, содержащих экзогенные защитные факторы. Использование препаратов этой группы может предварять назначение антибиотиков и химиопрепаратов или они могут применяться совместно. При повышении резервов системы (повышение способности к продукции ИФН – <20 ME делают неблагоприятный прогноз исхода заболевания. Для компенсации ИФН- и иммунодефицита назначают иммунозаместительную терапию: препараты ИФН (виферон), гамма-глобулина, интерлейкинов (ронколейкин) и других препаратов, содержащих экзогенные защитные факторы. Использование препаратов этой группы может предварять назначение антибиотиков и химиопрепаратов или они могут применяться совместно. При повышении резервов системы (повышение способности к продукции ИФН – / / и ИФН – и ИФН – ) продолжают этиотропное лечение в сочетании с иммуномодулирующим (при этом в лечебные схемы уже можно включать и препараты иммуностимулирующего ряда – индукторы ИФН, полимеры микробного происхождения и др.). Также возможно и комбинирование различных видов иммунокорригирующих воздействий. При дальнейшей стабилизации состояния продолжают этиотропное и патогенетическое лечение.
При содержании sИФН 12-40 МЕ/мл, продукции ИФН – ) продолжают этиотропное лечение в сочетании с иммуномодулирующим (при этом в лечебные схемы уже можно включать и препараты иммуностимулирующего ряда – индукторы ИФН, полимеры микробного происхождения и др.). Также возможно и комбинирование различных видов иммунокорригирующих воздействий. При дальнейшей стабилизации состояния продолжают этиотропное и патогенетическое лечение.
При содержании sИФН 12-40 МЕ/мл, продукции ИФН – / / 60-400 МЕ и значительно повышенной продукции лейкоцитами ИФН 60-400 МЕ и значительно повышенной продукции лейкоцитами ИФН 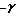 (свыше 250 ME) прогнозируют развитие нейроиммунной патологии (рассеянный склероз и др.), назначают препараты ИФН – (свыше 250 ME) прогнозируют развитие нейроиммунной патологии (рассеянный склероз и др.), назначают препараты ИФН – (бетаферон) в комплексе с традиционными методами лечения.
Изобретение поясняется следующими примерами: (бетаферон) в комплексе с традиционными методами лечения.
Изобретение поясняется следующими примерами:Пример 1. У больного А определяли интерфероновый статус в полном объеме по вышеописанной методике. Для этого у него отбирали по 3 мл венозной крови в две стерильные пробирки: сухую и с добавлением 30 ед. гепарина в 15 мкл физиологического раствора. Из негепаринизированной крови выделяли сыворотку центрифугированием 10 мин при 1000 g. Отдельные аликвоты (по 50 мкл) сыворотки инкубировали в присутствии МАТ к ИФН –  , ИФН- , ИФН- , ИФН- , ИФН- 1 час при 37oC для типирования ИФН (коэффициент дополнительного разведения – 2). К одной из аликвот нативной сыворотки добавляли 0.1 н. HCl до pH 2.0, инкубировали 1 час при 37oC, доводили pH до 7.4 0.1 н. NaOH для определения активности кислотолабильного ИФН- 1 час при 37oC для типирования ИФН (коэффициент дополнительного разведения – 2). К одной из аликвот нативной сыворотки добавляли 0.1 н. HCl до pH 2.0, инкубировали 1 час при 37oC, доводили pH до 7.4 0.1 н. NaOH для определения активности кислотолабильного ИФН- (коэффициент дополнительного разведения – 2). Оставшуюся нативную сыворотку аликвотировали на 3 аликвоты. Все образцы сыворотки хранили при -25oC до титрования.
Для определения индуцированной продукции различных типов ИФН лейкоцитами в 100 мкл питательной среды RPMI- 1640 (с добавлением глутамина, 2% сыворотки КРС, пенициллина и стрептомицина по 100 ед./мл) вносили по 12.5 мкл гепаринизированной цельной крови и по 12.5 мкл стандартных индукторов ИФН: NDV (5 lgЭИД50) для ИФН – (коэффициент дополнительного разведения – 2). Оставшуюся нативную сыворотку аликвотировали на 3 аликвоты. Все образцы сыворотки хранили при -25oC до титрования.
Для определения индуцированной продукции различных типов ИФН лейкоцитами в 100 мкл питательной среды RPMI- 1640 (с добавлением глутамина, 2% сыворотки КРС, пенициллина и стрептомицина по 100 ед./мл) вносили по 12.5 мкл гепаринизированной цельной крови и по 12.5 мкл стандартных индукторов ИФН: NDV (5 lgЭИД50) для ИФН – / / (2 образца), СЭА (10 мг/мл) для ИФН – (2 образца), СЭА (10 мг/мл) для ИФН – . Для определения спонтанной продукции различных типов ИФН (2 образца) вместо 12.5 мкл раствора индуктора вносили такой же объем питательной среды. В другую часть образцов, вместо стандартного индуктора, вносили 12.5 мкл (2 мг/мл) раствора циклоферона на питательной среде для определения чувствительности к данному препарату. Для определения активности сывороточных ингибиторов/активаторов продукции ИФН в 100 мкл суспензии клеток Namalva (106 кл/мл) в питательной среде вносили по 12.5 мкл стандартных индукторов ИФН – . Для определения спонтанной продукции различных типов ИФН (2 образца) вместо 12.5 мкл раствора индуктора вносили такой же объем питательной среды. В другую часть образцов, вместо стандартного индуктора, вносили 12.5 мкл (2 мг/мл) раствора циклоферона на питательной среде для определения чувствительности к данному препарату. Для определения активности сывороточных ингибиторов/активаторов продукции ИФН в 100 мкл суспензии клеток Namalva (106 кл/мл) в питательной среде вносили по 12.5 мкл стандартных индукторов ИФН – / / (NDV) и ИФН – (NDV) и ИФН – (СЭА) и по 12.5 мкл нативной сыворотки крови (параллельно ставились контрольные образцы, содержащие вместо сыворотки крови эквивалентное количество питательной среды). Все образцы инкубировали 24 часа при 37oC. Затем, к одному из образцов спонтанной продукции ИФН, к одному из образов с индуцированным ИФН – (СЭА) и по 12.5 мкл нативной сыворотки крови (параллельно ставились контрольные образцы, содержащие вместо сыворотки крови эквивалентное количество питательной среды). Все образцы инкубировали 24 часа при 37oC. Затем, к одному из образцов спонтанной продукции ИФН, к одному из образов с индуцированным ИФН – / / и к образцам, содержащим NDV и клетки Namalva, добавляли 0.1 н. HCl до pH 2.0, инкубировали 1 час при 37oC, добавляли 0.1 н. NaOH до pH 7.4 (коэффициент дополнительного разведения – 2). Ко второму образцу с индуцированным ИФН – и к образцам, содержащим NDV и клетки Namalva, добавляли 0.1 н. HCl до pH 2.0, инкубировали 1 час при 37oC, добавляли 0.1 н. NaOH до pH 7.4 (коэффициент дополнительного разведения – 2). Ко второму образцу с индуцированным ИФН – / / (кровь + NDV) добавляли поликлональную антисыворотку к NDV, инкубировали 1 час при 37oC (коэффициент дополнительного разведения – 2). Все образцы хранили при -25oC до титрования.
Непосредственно перед титрованием все образцы, ранее инкубированные с антисыворотками или при pH 2.0, центрифугировали 10 мин при 5000 g.
Титрование проводили в 96-луночных микропланшетах над монослоем клеток линии L-41. Параллельно с изучаемыми образцами титровали стандартный референс-препарат ИФН – (кровь + NDV) добавляли поликлональную антисыворотку к NDV, инкубировали 1 час при 37oC (коэффициент дополнительного разведения – 2). Все образцы хранили при -25oC до титрования.
Непосредственно перед титрованием все образцы, ранее инкубированные с антисыворотками или при pH 2.0, центрифугировали 10 мин при 5000 g.
Титрование проводили в 96-луночных микропланшетах над монослоем клеток линии L-41. Параллельно с изучаемыми образцами титровали стандартный референс-препарат ИФН – с известной активностью для построения калибровочной зависимости. Кроме того, один из образцов нативной сыворотки крови титровали на фоне постоянной концентрации референс-препарата ИФН, для чего в лунки микропланшета, содержащие раститрованную сыворотку, дополнительно вносили раствор стандартного препарата ИФН до конечной концентрации 2 МЕ/мл. Микропланшеты с раститрованными образцами инкубировали 24 часа при 37oC в атмосфере 5% CO2. Затем, питательная среда с раститрованными пробами заменялась на раствор ВВС (100 ЦПД50) в питательной среде и микропланшеты инкубировались 24 часа при 37oC в атмосфере 5% CO2. После этого, микропланшеты окрашивали 10 мин при комнатной температуре 0.1% раствором кристаллического фиолетового на 30% этаноле, промывали проточной водой и высушивали. Связавшийся краситель растворяли 2% раствором додецилсульфата натрия на 5% глицерине в тех же микропланшетах и оптическую плотность полученных растворов измеряли на ридере для иммуноферментного анализа при 570 нм. С помощью калибровочной кривой для стандартного референс-препарата (см. чертеж) в образцах определяли активность ИФН (табл. 1) с учетом коэффициентов разведения при титровании для точки учета (учетный титр) и дополнительных коэффициентов разведения.
Были получены следующие результаты (см. табл. 1).
Содержание ИФН различных типов в сыворотке крови высчитывали как разность общей активности сывороточных ИФН (образец N1) и активности образцов сыворотки, инкубированных с соотв. МАТ (N 2- 4). Содержание кислотолабильного ИФН – с известной активностью для построения калибровочной зависимости. Кроме того, один из образцов нативной сыворотки крови титровали на фоне постоянной концентрации референс-препарата ИФН, для чего в лунки микропланшета, содержащие раститрованную сыворотку, дополнительно вносили раствор стандартного препарата ИФН до конечной концентрации 2 МЕ/мл. Микропланшеты с раститрованными образцами инкубировали 24 часа при 37oC в атмосфере 5% CO2. Затем, питательная среда с раститрованными пробами заменялась на раствор ВВС (100 ЦПД50) в питательной среде и микропланшеты инкубировались 24 часа при 37oC в атмосфере 5% CO2. После этого, микропланшеты окрашивали 10 мин при комнатной температуре 0.1% раствором кристаллического фиолетового на 30% этаноле, промывали проточной водой и высушивали. Связавшийся краситель растворяли 2% раствором додецилсульфата натрия на 5% глицерине в тех же микропланшетах и оптическую плотность полученных растворов измеряли на ридере для иммуноферментного анализа при 570 нм. С помощью калибровочной кривой для стандартного референс-препарата (см. чертеж) в образцах определяли активность ИФН (табл. 1) с учетом коэффициентов разведения при титровании для точки учета (учетный титр) и дополнительных коэффициентов разведения.
Были получены следующие результаты (см. табл. 1).
Содержание ИФН различных типов в сыворотке крови высчитывали как разность общей активности сывороточных ИФН (образец N1) и активности образцов сыворотки, инкубированных с соотв. МАТ (N 2- 4). Содержание кислотолабильного ИФН – определяли как суммарную активность ИФН – определяли как суммарную активность ИФН – и ИФН – и ИФН – в сыворотке крови (N4) за вычетом активности ИФН в пробе сыворотки, инкубированной при pH 2.0 (N 5). Активность индуцированной продукции лейкоцитами кислотолабильного ИФН – в сыворотке крови (N4) за вычетом активности ИФН в пробе сыворотки, инкубированной при pH 2.0 (N 5). Активность индуцированной продукции лейкоцитами кислотолабильного ИФН – определяли по разности активностей ИФН в пробах N7 и 6. Уровень спонтанной продукции ИФН – определяли по разности активностей ИФН в пробах N7 и 6. Уровень спонтанной продукции ИФН – / / считали как активность пробы N10, ИФН – считали как активность пробы N10, ИФН – – разность активностей проб N9 и 10. За активность ингибиторов/активаторов действия ИФН принимали отношение активностей проб N11 и 12. За активность ингибиторов/активаторов продукции ИФН – – разность активностей проб N9 и 10. За активность ингибиторов/активаторов действия ИФН принимали отношение активностей проб N11 и 12. За активность ингибиторов/активаторов продукции ИФН – / / принимали отношение активностей проб N13 и 14, а ИФН – принимали отношение активностей проб N13 и 14, а ИФН – – N15 и 16. Чувствительность к циклоферону – отношение активностей проб N17 и 9.
Окончательные результаты полного исследования ИФН статуса: – N15 и 16. Чувствительность к циклоферону – отношение активностей проб N17 и 9.
Окончательные результаты полного исследования ИФН статуса:1) ИФН сыворотки крови. Общий – 22 МЕ/мл, ИФН –  – 16 МЕ/мл, ИФН – – 16 МЕ/мл, ИФН – – 4 МЕ/мл, ИФН – – 4 МЕ/мл, ИФН – – 2 МЕ/мл, кислотолабильный ИФН – – 2 МЕ/мл, кислотолабильный ИФН – – 2 МЕ/мл.
2) Продукция ИФН лейкоцитами крови in vitro. ИФН – – 2 МЕ/мл.
2) Продукция ИФН лейкоцитами крови in vitro. ИФН – / / – 231 ME; кислотолабильный ИФН – – 231 ME; кислотолабильный ИФН – – 7 ME; ИФН – – 7 ME; ИФН – – 88 МЕ; спонтанная продукция ИФН – – 88 МЕ; спонтанная продукция ИФН – / / – 12 ME, ИФН – – 12 ME, ИФН – – 2 ME.
3) Активность ингибиторов/активаторов действия ИФН (коэффицент стимуляции) – 1.
4) Активность ингибиторов/активаторов синтеза ИФН – – 2 ME.
3) Активность ингибиторов/активаторов действия ИФН (коэффицент стимуляции) – 1.
4) Активность ингибиторов/активаторов синтеза ИФН – / / (коэффициент стимуляции) – 1, ИФН- (коэффициент стимуляции) – 1, ИФН- – 1.
5) Чувствительность к препарату циклоферон – 2 (положительная).
Больному А на основании клинических и микроскопических обследований был поставлен диагноз: обострение хронической урогенитальной хламидийной инфекции.
На основании результатов исследования интерферонового статуса было сделано следующее заключение: из-за слабой реакции систем защиты организма (незначительно повышенное содержание ИФН – – 1.
5) Чувствительность к препарату циклоферон – 2 (положительная).
Больному А на основании клинических и микроскопических обследований был поставлен диагноз: обострение хронической урогенитальной хламидийной инфекции.
На основании результатов исследования интерферонового статуса было сделано следующее заключение: из-за слабой реакции систем защиты организма (незначительно повышенное содержание ИФН – в сыворотке крови и недостаток сывороточного ИФН – в сыворотке крови и недостаток сывороточного ИФН – , невысокие значения спонтанной продукции ИФН лейкоцитами) прогнозируется дальнейшее развитие заболевания, частые обострения; так как резервы системы ИФН истощены не полностью (продукция ИФН in vitro не достигает критических значений), и организм в состоянии вырабатывать нормальные ИФН (низкие значение содержания и продукции кислотолабильного ИФН – , невысокие значения спонтанной продукции ИФН лейкоцитами) прогнозируется дальнейшее развитие заболевания, частые обострения; так как резервы системы ИФН истощены не полностью (продукция ИФН in vitro не достигает критических значений), и организм в состоянии вырабатывать нормальные ИФН (низкие значение содержания и продукции кислотолабильного ИФН – ); не выявлена активность факторов, препятствующих действию и синтезу ИФН в организме (активность ингибиторов/активаторов). Было рекомендовано лечение иммуностимулирующими препаратами (индуктор ИФН циклоферон) в сочетании в этиотропной терапией (антибиотики).
После проведенного курса лечения было сделано повторное исследование ИФН статуса (сокращенный вариант: определение активности общего сывороточного ИФН, продукция ИФН – ); не выявлена активность факторов, препятствующих действию и синтезу ИФН в организме (активность ингибиторов/активаторов). Было рекомендовано лечение иммуностимулирующими препаратами (индуктор ИФН циклоферон) в сочетании в этиотропной терапией (антибиотики).
После проведенного курса лечения было сделано повторное исследование ИФН статуса (сокращенный вариант: определение активности общего сывороточного ИФН, продукция ИФН – / / и ИФН – и ИФН – лейкоцитами in vitro) вышеописанным методом: лейкоцитами in vitro) вышеописанным методом:1) sИФН – 9 МЕ/мл. 2) Продукция ИФН –  / / – 306 ME.
3) Продукция ИФН – – 306 ME.
3) Продукция ИФН – – 164 ME.
Нормализация показателей ИФН статуса, отсутствие маркеров инфекции в мазках и сыворотке крови, улучшение клинических показателей свидетельствовало о правильности сделанного прогноза и рекомендаций по выбору терапии.
Пример 2.
Пациент Б поступил с диагнозом хронический вирусный гепатит В. При анализе интерферонового статуса (сокращенный вариант, описанный в примере 1) были получены следующие результаты: – 164 ME.
Нормализация показателей ИФН статуса, отсутствие маркеров инфекции в мазках и сыворотке крови, улучшение клинических показателей свидетельствовало о правильности сделанного прогноза и рекомендаций по выбору терапии.
Пример 2.
Пациент Б поступил с диагнозом хронический вирусный гепатит В. При анализе интерферонового статуса (сокращенный вариант, описанный в примере 1) были получены следующие результаты:1) sИФН – 8 МЕ/мл. 2) Продукция ИФН –  / / – 34 ME.
3) Продукция ИФН – – 34 ME.
3) Продукция ИФН – – 12 ME.
Заключение: тяжелая ИФН- и иммунодепрессия, неблагоприятный прогноз течения и исхода заболевания. Кроме симптоматической была рекомендована ИФН-терапия (препарат виферон или аналоги) совместно с методами экстракорпоральной гемокоррекции (плазмаферез). Результаты анализа ИФН статуса после проведенного курса лечения: – 12 ME.
Заключение: тяжелая ИФН- и иммунодепрессия, неблагоприятный прогноз течения и исхода заболевания. Кроме симптоматической была рекомендована ИФН-терапия (препарат виферон или аналоги) совместно с методами экстракорпоральной гемокоррекции (плазмаферез). Результаты анализа ИФН статуса после проведенного курса лечения:1) sИФН – 22 МЕ/мл. 2) Продукция ИФН –  / / – 94 ME.
3) Продукция ИФН – – 94 ME.
3) Продукция ИФН – – 52 ME.
Тенденция к нормализации показателей ИФН статуса коррелировала с клиническим улучшением, что подтвердило правильность сделанного прогноза и выбранной схемы лечения.
Пример 3.
Пациент В поступил с диагнозом обострение рассеянного склероза (в анамнезе более 5 лет). Результаты сокращенного анализа ИФН статуса (как это описано в примере 1): – 52 ME.
Тенденция к нормализации показателей ИФН статуса коррелировала с клиническим улучшением, что подтвердило правильность сделанного прогноза и выбранной схемы лечения.
Пример 3.
Пациент В поступил с диагнозом обострение рассеянного склероза (в анамнезе более 5 лет). Результаты сокращенного анализа ИФН статуса (как это описано в примере 1):1) sИФН – 36 МЕ/мл. 2) Продукция ИФН –  / / – 76 ME.
3) Продукция ИФН – – 76 ME.
3) Продукция ИФН – – 315 ME.
Заключение: высокие значения sИФН и продукции ИФН – – 315 ME.
Заключение: высокие значения sИФН и продукции ИФН – показывают ИФН – показывают ИФН – – зависимое обострение нейроиммунной патологии; неблагоприятный прогноз исхода заболевания; рекомендовано лечение препаратами ИФН – – зависимое обострение нейроиммунной патологии; неблагоприятный прогноз исхода заболевания; рекомендовано лечение препаратами ИФН – (бетаферон) в сочетании с традиционной терапией.
Результаты сокращенного анализа ИФН статуса после проведенного лечения: (бетаферон) в сочетании с традиционной терапией.
Результаты сокращенного анализа ИФН статуса после проведенного лечения:1) sИФН – 10 МЕ/мл. 2) Продукция ИФН –  / / – 274 ME.
3) Продукция ИФН – – 274 ME.
3) Продукция ИФН – – 204 ME.
Выраженная стабилизация показателей ИФН статуса (что соответствовало нормализации клинических показателей и переходу пациента в состояние устойчивой ремиссии) подтвердила правильность прогноза и выбора методов лечения.
Пример 4.
Пациент Г. При первичном клиническом обследовании наличия заболеваний не было выявлено. Был сделан сокращенный анализ ИФН статуса (как описано в примере 1): – 204 ME.
Выраженная стабилизация показателей ИФН статуса (что соответствовало нормализации клинических показателей и переходу пациента в состояние устойчивой ремиссии) подтвердила правильность прогноза и выбора методов лечения.
Пример 4.
Пациент Г. При первичном клиническом обследовании наличия заболеваний не было выявлено. Был сделан сокращенный анализ ИФН статуса (как описано в примере 1):1) sИФН – 14 МЕ/мл. 2) Продукция ИФН –  / / – 116 ME.
3) Продукция ИФН – – 116 ME.
3) Продукция ИФН – – 68 ME.
На основании результатов ИФН статуса было сделано заключение о предрасположенности пациента к частым инфекционным заболеваниям и возможности наличия вялотекущей хронической инфекции. Данная информация подтвердилась анамнестическими данными о многочисленных респираторных и бронхолегочных инфекциях в прошлом, а на основании лабораторного обследования у пациента был выявлен хронический хламидиоз.
Список литературы – 68 ME.
На основании результатов ИФН статуса было сделано заключение о предрасположенности пациента к частым инфекционным заболеваниям и возможности наличия вялотекущей хронической инфекции. Данная информация подтвердилась анамнестическими данными о многочисленных респираторных и бронхолегочных инфекциях в прошлом, а на основании лабораторного обследования у пациента был выявлен хронический хламидиоз.
Список литературы1. Ершов Ф.И., Готовцева Е.П. Иммунология, 1986 г., N 3, с. 52-54. 2. Соловьев В.Д. и другие. Интерферон в теории и практике медицины, 2-е издание, М., 1981 г. 3. Bocci V., Biol. Rew., 1981, vol. 56, p. 49-51. 4. Bocci V., Advances of Immodulation, New York, 1984, p. 131-154. 5. Bocci V., Immunol. Today, 1985, vol. 6, p 7-9. 6. Lewin S., Clin. Exp.lmmunol, 1981, vol. 46, p. 475-483, МКИ 5 A 61 K 37/66, AC N 1082422, 1984 г. 7. Григорян С.С. Оценка интерферонового статуса людей по пробам цельной крови. Вопросы вирусологии, 1988 г., том 3, N 4, стр. 433-436. Формула изобретения
 / / (ИФН (ИФН / / ) и интерферона ) и интерферона  (ИФН (ИФН ) в образцах цельной крови, инкубированных в среде RPMI – 1640 в присутствии стандартных индукторов синтеза ИФН, посредством титрования исследуемых образцов на культуре клеток с последующей инкубацией с вирусом везикулярного стоматита (ВВС), отличающийся тем, что используют перевиваемые культуры клеток, чувствительные к действию ИФН, а именно, L-41, Hep-2, A-549, MG-63, L-929, после инкубации клеток с ВВС их окрашивают раствором кристаллического фиолетового, связавшийся краситель растворяют и его количество, пропорциональное активности ИФН исследуемого образца, измеряют фотометрически при длине волны 570 – 590 нм, активность ИФН в образце определяют по калибровочной кривой зависимости для стандартного препарата ИФН и выражают результат в международных единицах (МЕ), при этом при активности S-ИФН 0 – 10 МЕ/мл, ИФН ) в образцах цельной крови, инкубированных в среде RPMI – 1640 в присутствии стандартных индукторов синтеза ИФН, посредством титрования исследуемых образцов на культуре клеток с последующей инкубацией с вирусом везикулярного стоматита (ВВС), отличающийся тем, что используют перевиваемые культуры клеток, чувствительные к действию ИФН, а именно, L-41, Hep-2, A-549, MG-63, L-929, после инкубации клеток с ВВС их окрашивают раствором кристаллического фиолетового, связавшийся краситель растворяют и его количество, пропорциональное активности ИФН исследуемого образца, измеряют фотометрически при длине волны 570 – 590 нм, активность ИФН в образце определяют по калибровочной кривой зависимости для стандартного препарата ИФН и выражают результат в международных единицах (МЕ), при этом при активности S-ИФН 0 – 10 МЕ/мл, ИФН / / 250 – 520 МЕ, а ИФН 250 – 520 МЕ, а ИФН 110 – 250 МЕ считают обследуемого здоровым, при активности S-ИФН 25 – 32 МЕ/мл, ИФН 110 – 250 МЕ считают обследуемого здоровым, при активности S-ИФН 25 – 32 МЕ/мл, ИФН / / – 60 – 110 МЕ, ИФН – 60 – 110 МЕ, ИФН – 30 – 55 МЕ прогнозируют благоприятный исход заболевания и назначают этиотропную терапию, антибиотики, химиопрепараты, препараты ИФН, а именно виферон, интерлейкинов, а именно ронколейкин, гаммаглобулин, при активности S-ИНФ более 35 МЕ/мл, ИФН – 30 – 55 МЕ прогнозируют благоприятный исход заболевания и назначают этиотропную терапию, антибиотики, химиопрепараты, препараты ИФН, а именно виферон, интерлейкинов, а именно ронколейкин, гаммаглобулин, при активности S-ИНФ более 35 МЕ/мл, ИФН / / – менее 60 МЕ, ИФН – менее 60 МЕ, ИФН – менее 30 МЕ прогнозируют тяжелое протекание заболевания, требующее срочного терапевтического вмешательства, при активности S-ИНФ 12 – 25 МЕ/мл, ИФН – менее 30 МЕ прогнозируют тяжелое протекание заболевания, требующее срочного терапевтического вмешательства, при активности S-ИНФ 12 – 25 МЕ/мл, ИФН / / – 85 – 250 МЕ, ИФН – 85 – 250 МЕ, ИФН – 45 – 110 МЕ прогнозируют хронизацию патологического процесса и назначают препараты ИФН, а именно виферон, индукторы ИФН, а именно циклоферон, неовир, и полимерные иммуномодуляторы, а именно полирем, пирогенал, ликопид, при активности S-ИФН 0 – 10 МЕ/мл, ИФН – 45 – 110 МЕ прогнозируют хронизацию патологического процесса и назначают препараты ИФН, а именно виферон, индукторы ИФН, а именно циклоферон, неовир, и полимерные иммуномодуляторы, а именно полирем, пирогенал, ликопид, при активности S-ИФН 0 – 10 МЕ/мл, ИФН / / – менее 40 МЕ, ИФН – менее 40 МЕ, ИФН – менее 20 МЕ прогнозируют неблагоприятный исход заболевания и назначают препараты ИФН, а именно виферон, гаммаглобулина, интерлейкинов, а именно ронколейкин и другие иммунозаместительные препараты, при активности S-ИФН 12 – 40 МЕ/мл, ИФН – менее 20 МЕ прогнозируют неблагоприятный исход заболевания и назначают препараты ИФН, а именно виферон, гаммаглобулина, интерлейкинов, а именно ронколейкин и другие иммунозаместительные препараты, при активности S-ИФН 12 – 40 МЕ/мл, ИФН / / – 60 – 400 МЕ, ИФН – 60 – 400 МЕ, ИФН – более 250 МЕ прогнозируют развитие нейроиммунной патологии, а именно рассеянного склероза, и назначают препараты ИФН- – более 250 МЕ прогнозируют развитие нейроиммунной патологии, а именно рассеянного склероза, и назначают препараты ИФН- , а именно бетаферон.
2. Способ по п.1, отличающийся тем, что при определении уровня продукции различных типов ИФН лейкоцитами крови in vitro используют среду RPMI-1640 с добавлением глутамина и антибиотиков, в частности, пенициллина и стрептомицина до 100 ед/мл, и 2% сыворотки КРС, дополнительно вносят растворы индукторов ИФН, в частности для ИФН , а именно бетаферон.
2. Способ по п.1, отличающийся тем, что при определении уровня продукции различных типов ИФН лейкоцитами крови in vitro используют среду RPMI-1640 с добавлением глутамина и антибиотиков, в частности, пенициллина и стрептомицина до 100 ед/мл, и 2% сыворотки КРС, дополнительно вносят растворы индукторов ИФН, в частности для ИФН / / вносят вирус болезни Ньюкасла 5 – 7 lg ЭИД50, для ИФН вносят вирус болезни Ньюкасла 5 – 7 lg ЭИД50, для ИФН -энтеротоксин St. aureus 10 мг/мл, и цельную гепаринизированную кровь, при этом среду RPMI-1640, индуктор ИФН и кровь берут при объемном соотношении 8 : 1 : 1, соответственно, инкубируют полученную смесь 24 ч при 37oC, в образцы с ИФН -энтеротоксин St. aureus 10 мг/мл, и цельную гепаринизированную кровь, при этом среду RPMI-1640, индуктор ИФН и кровь берут при объемном соотношении 8 : 1 : 1, соответственно, инкубируют полученную смесь 24 ч при 37oC, в образцы с ИФН / / добавляют раствор 0,1 н HCl до pH 2,0, инкубируют 1 ч при 37oC и 0,1 н раствором NaOH доводят pH до 7,4, при этом все полученные образцы хранят до начала проведения дальнейшего анализа при -25oC.
3. Способ по п.1 или 2, отличающийся тем, что при прогнозировании хронизации патологического процесса для усиления эффекта назначаемые препараты комбинируют по схемам: 1 день назначают виферон в 2 приема по одной свече 150000 – 1000000 МЕ через 10 – 12 ч, на 2 день – индуктор ИФН, а именно циклоферон, неовир по 1 инъекции 2 мл 12,5% раствора в течение 20 – 30 дней, либо назначают 1 – 2 10-дневных курса по 2 раза в день по одной свече 150000 – 1000000 МЕ через 10 – 12 ч с перерывом между курсами 5 – 7 дней, и через 5 – 7 дней назначают 1 – 2 курса индуктора ИФН, а именно циклоферон, неовир, по 1 инъекции 2 мл 12,5% раствора в 1,2,4,6,8 дни с перерывом между курсами 5 – 7 дней. добавляют раствор 0,1 н HCl до pH 2,0, инкубируют 1 ч при 37oC и 0,1 н раствором NaOH доводят pH до 7,4, при этом все полученные образцы хранят до начала проведения дальнейшего анализа при -25oC.
3. Способ по п.1 или 2, отличающийся тем, что при прогнозировании хронизации патологического процесса для усиления эффекта назначаемые препараты комбинируют по схемам: 1 день назначают виферон в 2 приема по одной свече 150000 – 1000000 МЕ через 10 – 12 ч, на 2 день – индуктор ИФН, а именно циклоферон, неовир по 1 инъекции 2 мл 12,5% раствора в течение 20 – 30 дней, либо назначают 1 – 2 10-дневных курса по 2 раза в день по одной свече 150000 – 1000000 МЕ через 10 – 12 ч с перерывом между курсами 5 – 7 дней, и через 5 – 7 дней назначают 1 – 2 курса индуктора ИФН, а именно циклоферон, неовир, по 1 инъекции 2 мл 12,5% раствора в 1,2,4,6,8 дни с перерывом между курсами 5 – 7 дней.
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 31.03.2001
Номер и год публикации бюллетеня: 1-2003
Извещение опубликовано: 10.01.2003
|
||||||||||||||||||||||||||
