Патент на изобретение №2159814
|
||||||||||||||||||||||||||
(54) АНАЛОГ ЭРИТРОПОЭТИНА
(57) Реферат: Изобретение относится к биотехнологии и касается аналога эритропоэтина. Сущность изобретения состоит в том, что аналоги эритропоэтина включают, по крайней мере, один дополнительный сайт для гликозилирования или перегруппировку, по крайней мере, одного сайта для гликозилирования, а также ДНК, кодирующие указанные аналоги и клетки для экспрессии аналога. Изобретение обеспечивает заявленным формам аналогов эритропоэтина, содержащих определенное количество сиаловой кислоты, обладать терапевтически полезным действием. 10 с. и 4 з.п.ф-лы, 10 табл., 15 ил. Настоящее изобретение относится к аналогам эритропоэтина, имеющим, по крайней мере, один дополнительный сайт для гликозилирования или включающим перегруппировку, по крайней мере одного сайта для гликозилирования. Изобретение также относится к последовательностям ДНК, кодирующим указанные аналоги эритропоэтина, и рекомбинантным плазмидам и клеткам хозяевам для экспрессии аналога. Эритропоэтин (ЕРО) является гликопротеиновым гормоном, вовлеченным в созревание эритроидных клеток-предшественников в эритроцитах. Он является необходимым при регулировании уровней эритроцитов в кровообращении. Эритропоэтин естественного происхождения образуется легкими в процессе фетальной жизни и почкой взрослых индивидуумов, и циркулирует в крови, и стимулирует образование эритроцитов в костном мозге. Анемия является почти без сомнения следствием почечной недостаточности, обусловленной пониженным образованием эритропоэтина из почки. Рекомбинантный эритропоэтин, полученный с помощью генной инженерии, включающей экспрессию протеинового продукта из клетки хозяина, превращенной геном, кодирующим эритропоэтин, как было найдено, является эффективным, если используется при лечении анемии, возникшей при хронической почечной недостаточности. В моче человека обычно присутствуют низкие уровни эритропоэтина, тогда как у пациентов, страдающих гипопластической анемией, обнаружены повышенные уровни мочевого эритропоэтина. Для очистки мочевого эритропоэтина человека Miyake et.al. J.Biol.Chem.,252, 5558 /1977/ использовали, в качестве исходного материала, мочу от пациентов с гипопластичной анемией. До сих пор, однако, мочевой эритропоэтин, как было показано, является терапевтически полезным. Идентификацию, клонирование и экспрессию генов, кодирующих эритропоэтин, описывают в патенте США N 4703008, Lin. Описание способа очистки рекомбинантного эритропоэтина из клеточной среды содержится в патенте США N 4667016. Экспрессия и выделение биологически активного рекомбинантного эритропоэтина из клеток хозяина млекопитающего, содержащих ген эритропоэтина или рекомбинантные плазмиды, впервые сделала доступными количества эритропоэтина, пригодные для терапевтических применений. Кроме того, знание генной последовательности и доступность больших количеств очищенного протеина привело к лучшему пониманию характера действия этого протеина. Многие поверхностные протеины клеток и секреторные протеины, полученные с помощью клеток эукариотов, модифицируют одной или более олигосахаридными группами. Эта модификация, отнесенная к гликозилированию, может драматически влиять на физические свойства протеинов и может оказывать важное влияние на стабильность протеина, секрецию и субклеточную локализацию. Нужное гликозилирование может являться существенным для биологической активности. Фактически, некоторые гены из организмов эукариотов, если они экспрессированы в бактерию (например, E. coli), которая благоприятствует клеточным процессам гликозилирования протеинов, дают протеины, которые выделяются почти или совсем неактивными в силу их недостаточного гликозилирования. Гликозилирование происходит в специфических положениях вдоль полипептидного скелета и бывает обычно двух типов: О-связанные олигосахариды присоединяются к сериновым или треониновым остаткам, в то время как N-связанные олигосахариды присоединяются к аспарагиновым остаткам, если они являются частью последовательности Asn-X-Ser/Thr, где X может быть любой аминокислотой, за исключением пролина. Структуры N-связанных и О-связанных олигосахаридов и остатков сахаров, найденные в каждом типе, являются различными. Один тип сахара, который обычно находят на обеих структурах, является N-ацетилнейраминовой кислотой (далее употребляется как сиаловая кислота). Сиаловая кислота является обычно терминальным остатком обоих N-связанных и О-связанных олигосахаридов, и, в силу ее отрицательного заряда, может сообщать кислотные свойства гликопротеину. Оба эритропоэтина: и мочевой эритропоэтин человека, и рекомбинантный эритропоэтин (экспрессированный в клетки млекопитающего), имеющие аминокислотную последовательность 1-165 эритропоэтина человека, содержат три N-связанных и одну О-связанную олигосахаридные цепи, которые вместе составляют около 40% общего молекулярного веса гликопротеина. N-связанное гликозилирование протекает в аспарагиновых остатках, расположенных в положениях 24, 38 и 83, в то время как О-связанное гликозилирование протекает в сериновом остатке, расположенном в положении 126 (Lai et al. J. Biol. Chem. 261, 3116 /1986/; Broudy et al. Arch. Biochem. Biophys. 265, 329 /1988/). Олигосахаридные цепи, как показано, являются модифицированными терминальными остатками сиаловой кислоты. Ферментативная обработка гликозилированного эритропоэтина с удалением всех остатков сиаловой кислоты приводит к потере активности in vivo, но не влияет на активность in vitro (Lowy et al., Nature, 185, 103 /1960/; Goldwasser et al. , J. Biol. Chem. 249, 4202 /1974/). Это поведение объясняется быстрым выведением азиало-эритропоэтина из кровообращения при взаимодействии с почечным азиалогликопротеином, связывающим протеин (Morrell et al. J.Biol. Chem. 243, 155/1968/; Briggs et al. Am.J.Physiol. 227, 1385 /1974/; Ashwell et al. Methods Enzymol. 50, 287 /1978/). Таким образом, эритропоэтин обладает биологической активностью in vivo только, если он сиалилирован для того, чтобы избежать его связывания почечным связывающим протеином. Роль других компонентов в олигосахаридных цепях эритропоэтина является недостаточно определенной. Было показано, что частично дегликозилированный эритропоэтин имеет сильно пониженную активность in vivo, по сравнению с гликозилированной формой, но не сохраняет активность in vitro (Dordal et al. Endocrinology 116, 2293 /1985/: Lin). В другом исследовании, однако, удаление N-связанных или О- связанных олигосахаридных цепей поодиночке или совместно с помощью мутагенеза аспарагинового или серинового остатков, которые являются сайтами гликозилирования, резко снижает активность in vitro измененного эритропоэтина, который получают в клетках млекопитающего (Dube et al J.Biol.Chem. 263,17516 /1988/). Гликопротеины, такие как эритропоэтин, могут быть разделены в различных заряженных формах, используя технику, такую как изоэлектрическое фокусирование (IEF). Несколько исследовательских групп сообщали о IEF изучении неочищенных и частично очищенных эритропоэтиновых препаратов (Lukowsky et al. J. Biochem. 50, 909 /1972/; Sheitton et al. Biochem.Med. 12, 45 /1975/; Fuhr et al. Biochem.Biophys.Res. Comm. 98, 930 /1981/). Самое большее, три или четыре фракции, имеющие эритропоэтиновую активность, были определены с помощью IEF в этих исследованиях и ни одна из них не была охарактеризована в отношении содержания карбогидрата. Кроме того, не было проведено корреляции между изоэлектрическими точками фракций и их биологической активностью. В процессе очистки мочевого эритропоэтина из мочи человека, обсуждавшемся Miyake et al., сообщалось о двух эритропоэтиновых фракциях, полученных при хроматографировании на гидроксиаппатите, обозначенных как II и IIIA, которые имели подобную специфическую активность. Последующий карбогидратный анализ фракций II и IIIA показал, что фракция II имеет большее среднее содержание сиаловой кислоты, чем фракция IIIA (Dordal et al.). Целью настоящего изобретения является обеспечение разделенных и выделенных изоформ эритропоэтина, имеющих определенное содержание сиаловой кислоты и биологическую активность. Фармацевтические композиции, содержащие такие молекулы, будут обладать терапевтически полезным действием. Объект изобретения относится к аналогам эритропоэтина человека, содержащим аминокислотную последовательность, которая включает, по крайней мере, один дополнительный сайт для гликозилирования. Добавленные сайты для гликозилирования могут давать большее число карбогидратных цепей и более высокое содержание сиаловой кислоты, чем эритропоэтин человека. Аналоги эритропоэтина, включающие аминокислотные последовательности, которые включают перегруппировку, по крайней мере, одного сайта для гликозилирования, также охватываются настоящим изобретением. Аналоги, включающие дополнительно одну или более аминокислот с карбокси терминальным концом эритропоэтина, где обеспечивается дополнительно, по крайней мере, один сайт гликозилирования, также включаются в настоящее изобретение. Изобретение далее включает последовательности ДНК, кодирующие такие аналоги эритропоэтина и рекомбинантные плазмиды и клетки хозяев для экспрессии аналога. Фиг. 1 показывает аналитический изоэлектрический фокусирующий гель разделенных рекомбинантных изоформ эритропоэтина. Полосы геля 1-11 показывают изоформы в области от менее кислой (более высокая величина р1) в полосе 1 до более кислой (более низкая величина р1) в полосе 11. Очищенный рекомбинантный эритропоэтин, содержащий смесь изоформ 9-14, также показан в дальних левых и правых полосах геля. Фиг. 2 показывает взаимосвязь между количеством сиаловой кислоты на изоформу эритропоэтина и специфической активностью in vivo каждой изоформы, выраженной в единицах на мг полипептида эритропоэтина. На фиг.2А концентрацию каждой изоформы эритропоэтина определяли с помощью анализа на протеин по Брэдфорду; на фиг.2В концентрацию определяли по поглощению при 280 нм, на фиг.2С концентрацию определяли с помощью анализа RIA. Фиг. 3 показывает аналитический изоэлектрический фокусирующий гель определенных смесей рекомбинантных изоформ эритропоэтина, приготовленных с помощью анионообменной хроматографии в различных условиях. Полосы геля 1-6 представляют, соответственно, изоформы эритропоэтина, элюированные в высококонцентрированный солевой промывной раствор после промывания колонки с Q-сефарозой быстрым потоком (“fast flow”) 150 ммоль/л уксусной кислоты, pH 4.7, 250 ммоль/л уксусной кислоты, pH 4.7, 300 ммоль/л уксусной кислоты, pH 4.7 или 300 ммоль/л уксусной кислоты (небуферной). Очищенный рекомбинантный эритропоэтин, содержащий смесь изоформ, полученный с использованием процедуры, описанной в Примере 2, Lai et al., за исключением того, что хроматографию cDEAE-агарозой заменяют хроматографией с Q-сефарозой, показывают также в левой дальней полосе геля. Фиг.4 показывает разделение изоформ эритропоэтина с 8 по 12, достигнутое путем воздействия на кондиционированную среду клеток на колонке с Q-сефарозой, градиентом уменьшения pH и увеличения ионной силы. Аликвоты равномерно распределенных фракций от фракции 2 до фракции 40 подвергали аналитическому изоэлектрическому фокусированию. Очищенный рекомбинантный эритропоэтин, содержащий смесь изоформ, полученный с использованием процедур, описанных в Примере 2 Lai et al., за исключением того, что хроматографию с DEAE-агарозой заменяют хроматографией с Q-сефарозой, также показывают в дальней левой полосе геля. Фиг.5 показывает аминокислотную последовательность эритропоэтина человека. Квадраты указывают на аспарагиновые остатки, к которым присоединяются N-связанные карбогидратные цепи, и звездочки указывают на сериновый остаток, модифицированный О- связанной карбогидратной цепью. Фиг. 6А, 6В и 6С показывают серии стадий клонирования, использованных в генерировании плазмид для конструирования и анализа аналогов эритропоэтина человека. Эти аналоги имеют измененные аминокислоты, как показано на фиг.5, которые обеспечивают дополнительные сайты гликозилирования. Фиг. 7 показывает Western blot анализ супернатантов клеток COS эритропоэтина, с последовательностью, подобной эритропоэтину человека и указанных аналогов эритропоэтина. Аналоги [Asn9, Ser11] EPO, [Asn69] EPO, [Asn125, Ser127] EPO и [Pro124, Thr125] EPO конструируют, как описано в Примере 6. Дополнительные аналоги [Pro125, Thr127] EPO и [Asn126, Ser128] EPO, которые не содержат дополнительных карбогидратных цепей, показывают для сравнения. Фиг. 8 показывает Western blot анализ супернатантов клеток COS эритропоэтина с последовательностью, подобной эритропоэтину человека и указанных аналогов эритропоэтина после обработки N- гликаназой. Аналоги [Thr125] EPO и [Pro124, Thr125] EPO были сконструированы, как описано в Примере 6. Аналоги [Val126] EPO, [Pro124] EPO, [Pro125] EPO, [Thr127] EPO, [Pro125, Ser127] EPO и [Thr125, Ser127] EPO показывают для сравнения. Фиг. 9 показывает изоэлектрический фокусирующий гель пулов 2, 3 и 4, полученных с помощью хроматографии с Q-сефарозой и C4 обращенной фазой среды клеток, которая поддерживала рост CHO клеток, трансфекцированных эритропоэтиновой сДНК, содержащей [Thr125] мутацию. Очищенный рекомбинантный эритропоэтин, содержащий смесь изоформ, которые были получены с использованием процедур, описанных в Примере 2 Lai et.al., за исключением того, что хроматографию с DEAE-агарозой заменяют хроматографией с Q-сефарозой, также показывают в левой и правой полосах геля. Фиг. 10 показывает Western blot анализ супернатантов COS клетки рекомбинантного эритропоэтина человека (rHuEPO) и выбранных аналогов. Конструкцию аналогов описывают в Примере 6. Аналоги N9, N14, N18, N19, N21, N24 и N39 имеют, по крайней мере, одну дополнительную карбогидратную цепь, как это свидетельствует из меньшей подвижности геля. Фиг. 11 показывает Western blot анализ супернатантов COS клетки рекомбинантного эритропоэтина человека и EPO N14 аналога в процессе усваивания N-гликаназы. Были выбраны точки при 0, 4, 12 и 45 минутах и после усваивания в течение ночи. Фиг. 12 показывает изоэлектрический фокусирующий гель препаратов изоформы EPO N14 аналога. Низкий пул изоформы содержит EPO N14 аналог, включающий главным образом 6-12 сиаловых кислот на молекулу, средний пул изоформы содержит EPO N14 аналог, содержащий главным образом 10-15 сиаловых кислот на молекулу, и высокий пул изоформы содержит EPO N 14 аналог, имеющий главным образом 12-17 сиаловых кислот на молекулу. Фиг. 13 показывает фармакокинетические данные рекомбинантного эритропоэтина человека, выделенной изоформы 14 и EPO N 14 аналога (изоформы 15-17) после внутривенной инъекции крысам. Фиг. 14 показывает данные анализа по холодной замене I125 меченного рекомбинантного эритропоэтина человека, связанного с эритропоэтиновым рецептором, в присутствии изменяющихся количеств немеченного rHuEPO, выделенной изоформы 14 или EPO N14 аналога. Фиг. 15 показывает гематокритное исследование мыши, сравнивающее активность высокого пула изоформы EPO N14 (0.036 и 0.0712 мкг), выделенной изоформы 14 (0.036 и 0.0712 мкг), низкого пула изоформы EPO 177 (0.0712 мкг) и rHuEPO (0.071 мкг). Объект изобретения включает изоформы эритропоэтина. Специфические изоформы эритропоэтина, полученные в соответствии с настоящим изобретением, и их свойства, могут меняться в зависимости от источника исходного материала. Например, изоформы мочевого эритропоэтина человека отличаются от изоформ рекомбинантного эритропоэтина. В предпочтительном варианте, изобретение относится к изоформе эритропоэтина, имеющей специфическое число (т.е. фиксированное число больше 0) сиаловых кислот на молекулу эритропоэтина, указанное число выбрано из группы, состоящей из 1-14. Преимущественно, указанное число составляет 9, 10, 11, 12, 13 или 14. В другом варианте, указанное число больше 14, преимущественно 16-23. Термин “изоформа эритропоэтина,” как он использован здесь, относится к препаратам эритропоэтина, имеющим одну изоэлектрическую точку (р1) и имеющим одинаковую аминокислотную последовательность. Термин “эритропоэтин”, как он использован здесь, включает эритропоэтин естественного происхождения, мочевой эритропоэтин человека, а также полипептиды ненатурального происхождения, имеющие аминокислотную последовательность и гликозилирование, достаточно точно воспроизводящее то, которое свойственно эритропоэтину естественного происхождения, что позволяет им обладать биологическими свойствами in vivo, вызывающими в клетках костного мозга повышенное продуцирование ретикулоцитов и эритроцитов. Было найдено, что дискретные изоформы рекомбинантного эритропоэтина, имеющие аминокислотную последовательность мочевого эритропоэтина человека, соответствуют молекулам эритропоэтина, имеющим 1-14 сиаловых кислот, и каждая изоформа, присутствующая в очищенном рекомбинантном эритропоэтине, обладает активностью in vivo, которую связывают с числом сиаловых кислот, которым обладает изоформа. В предпочтительном варианте, эритропоэтин представляет продукт экспрессии экзогенной ДНК последовательности, которая трансфекцирована в нечеловеческую клетку хозяина эукариота, таким образом, в предпочтительном варианте эритропоэтин представляет “рекомбинантный эритропоэтин”. Рекомбинантный эритропоэтин получают, преимущественно, согласно процедуре, описанной в патенте США 4703008. Рекомбинантный эритропоэтин может быть очищен согласно обычной процедуре, описанной в Примере 2 патента США 4667016 Lai et al. или, напротив, согласно процедуре, описанной в Примере 2 Lai et. al. , где хроматографию с DEAE-агарозой заменяют хроматографией с Q-сефарозой. Эритропоэтин, очищенный согласно Примеру 2 Lai et al., содержит преимущественно шесть изоформ, при анализе с помощью IEF. Кроме того, по крайней мере одна дополнительная изоформа большей кислотности обнаружена с использованием процедуры хроматографирования, описанной в Примере 4. (Эта более кислая форма, мигрирующая при более 14 сиаловых кислотах на IEF геле, может содержать отрицательные заряды несиаловой кислоты, что проявляется в сопротивлении усваиванию сиалидазы некоторым зарядом). Эти изоформы отличаются друг от друга содержанием сиаловой кислоты. Как показано в Примерах, это демонстрируется выделением 10 из этих изоформ с помощью препаративной IEF и определением содержания сиаловой кислоты в пяти из них. Анализом изоформ на содержание сиаловой кислоты найдено, что пять изоформ содержали либо 9, 10, 11, 12 либо 13 остатков сиаловой кислоты. Существует взаимосвязь между относительной специфической активностью in vivo эритропоэтина и числом остатков сиаловой кислоты на молекулу эритропоэтина изоформ от 5 до 11 (каждая изоформа обозначена здесь числом сиаловых кислот на молекулу эритропоэтина). Изоформы с 11 по 14 имеют приблизительно одинаковую относительную специфическую активность in vivo. Изоформы 5-14 подвергали анализу на активность in vivo с помощью эксгипоксинового полицитемического биоанализа на мышах и количество каждой присутствующей изоформы определяли с помощью анализа на протеин по Брэдфорду, по поглощению при 280 нм или с помощью радиоиммунного анализа (RIA) для эритропоэтина. RIA определения (Ergie et al. Immunobiology 172, 213 /1986/), выраженные в единицах/мл, делят на 212,770 единиц/мг эритропоэтинового полипептида среднюю специфическую активность очищенного эритропоэтина, определенную с помощью RIA, получая концентрации протеина выделенных изоформ или смесей изоформ, выраженные в мг полипептида эритропоэтина/мл. Как показано в Примерах, относительные специфические активности in vivo увеличиваются ступенчато от изоформы 5 до изоформы 11 (смотри Таблицу 2). Специфические активности in vivo, на которые ссылаются здесь, являются показателями относительных специфических активностей in vivo и не являются показателями абсолютных специфических активностей in vivo. Для целей этой заявки, специфические активности используют только для сравнения относительных активностей изоформ, которые подвергали анализу, используя один и тот же анализ, используя те же условия, включающие тот же внутренний стандарт, тот же тип животных, имеющих тот же анализ данных, использованных для расчета специфической активности, тот же анализ для определения содержания протеина. Не имеется в виду, что любая величина специфической активности in vivo, приведенная для любой изоформы, представляет характеристическую или абсолютную величину для такой изоформы. Это изобретение также включает композиции, содержащие две или более изоформы эритропоэтина. В одном варианте композиции включают смесь изоформ, имеющих больше, чем предварительно определенное число сиаловых кислот на молекулу эритропоэтина, например, больше чем 11 сиаловых кислот на молекулу эритропоэтина, или больше чем 12 сиаловых кислот на молекулу, например, смесь изоформ 12, 13 и 14. В другом варианте, композиции содержат смеси изоформ, имеющих предварительно определенное число сиаловых кислот на молекулу эритропоэтина, например, меньше 12, но больше 8 сиаловых кислот на молекулу, как, например, смесь изоформ 9, 10 и 11. Изобретение также включает композиции изоформ эритропоэтина, где относительные количества изоформ являются одинаковыми или разными. Например, смесь изоформ 9, 10 и 11 может иметь изоформы, присутствующие в различных отношениях, таких как 1:1:1, 2:3:1 или 20:20:1. Преимущественно, композиции включают смеси менее чем четырех изоформ, например, смесь изоформ 11, 12 и 13, или смесь 12 и 14, или смесь 7 и 13. Для того чтобы получить смеси изоформ эритропоэтина, это изобретение также включает способы выделения выбранных изоформ эритропоэтина. Эти способы включают выделение индивидуальных изоформ с помощью такой техники, как препаративное изоэлектрическое фокусирование или приготовление смесей изоформ, имеющих предварительно определенное число сиаловых кислот на молекулу (например, больше 11), с помощью такой техники, как ионообменная хроматография или хроматофокусирование. Все эти приемы имеют в качестве основы разделение протеинов в соответствии с зарядом. В общем, ионообменная хроматография и хроматофокусирование включают применение либо неочищенного эритропоэтина человека (клетка кондиционированной среды), или вещества, очищенного на колонке со смолой в условиях, которые позволяют связывать некоторые или все изоформы эритропоэтина со смолой. Для неочищенных препаратов эритропоэтина предпочтительно применять протеин с колонки при pH около 7, в то время как для очищенных препаратов протеин может быть применен с колонки с pH 7 и ниже, до pH 4. После промывания колонки буфером с pH около 4, те изоформы эритропоэтина, которые остаются связанными с ионообменной колонкой, элюируют с помощью повышения pH и концентрации соли в буфере, или с помощью применения градиента повышения pH и увеличения ионной силы при pH около 4. Для хроматофокусирования, изоформы элюируют из колонки с помощью градиента повышения pH или путем промывания колонки раствором с повышенной концентрацией соли. В предпочтительном варианте, индивидуальные изоформы выделяют, используя ионообменную хроматографию. Как например, изоформу 14 выделяют, используя ионообменную хроматографию, как описано в Примере 8. Изобретение также включает некоторые аналоги эритропоэтина человека. Фраза “аналог эритропоэтина человека”, как она использована здесь, относится к эритропоэтину с одним или более изменениями в аминокислотной последовательности эритропоэтина человека, которая приводит в результате к увеличению числа сайтов для присоединения сиаловой кислоты. Аналоги генерируют сайт-направленным мутагенезом, включающим присоединения, делеции или замещения аминокислотных остатков, которые увеличивают или изменяют сайты, которые являются пригодными для гликозилирования. Такие аналоги могут иметь большее число карбогидратных цепей, чем эритропоэтин человека. Аналоги эритропоэтина согласно настоящему изобретению включают аминокислотную последовательность, которая включает, по крайней мере, один дополнительный сайт для гликозилирования. Аналоги, имеющие уровни сиаловой кислоты большие чем те, которые найдены в эритропоэтине человека, генерируют добавлением сайтов гликозилирования, которые не нарушают вторичную или третичную конформацию, требуемую для биологической активности. Преимущественно, аналог эритропоэтина человека имеет 1, 2 или 3 дополнительных сайта для N-гликозилирования или О-гликозилирования, которые приводят в результате к добавлению 1, 2 или 3 дополнительных N-связанных или О-связанных карбогидратных цепей. Например, лейцин в положении 69 заменяют аспарагином с получением последовательности Asn-Leu-Ser, которая служит в качестве четвертого сайта для N-гликозилирования. Такое изменение может вообще обеспечивать вплоть до четырех дополнительных сиаловых кислот на молекулу. Примерами изменений, которые генерируют дополнительные сайты О-гликозилирования, являются аланин в положении 125 к треонину и аланины в положениях 124 и 125 к пролину и треонину, соответственно. Могут быть сконструированы аналоги, которые имеют одну или более дополнительных N-связанных и О-связанных цепей, например, аналоги N01 и N02, описанные в Таблице 5. Как будет понятно специалистам в этой области, объект изобретения включает многие другие аналоги эритропоэтина человека, имеющие дополнительные сайты для гликозилирования. Аналоги, имеющие повышенные уровни присоединенного карбогидрата у сайта гликозилирования, также включаются изобретением. Такие аналоги обычно включают замещение одной или более аминокислот, которые находятся в непосредственной близости к N-связанному или О-связанному сайту. В результате этих изменений аминокислоты, большее количество полипептидов эритропоэтина будет содержать карбогидратную модификацию. Сайты гликозилирования могут быть естественного происхождения или генерированы с помощью мутации. Например, аналог N 13 не генерирует дополнительную карбогидратную цепь даже через сайт гликозилирования, введенный в положение 88. Однако, аналоги N 14 и N 18, которые содержат сериновые и валиновые остатки, соответственно, замещенные в положение 87, имели дополнительную карбогидратную цепь в положении 88. Изобретение также включает аналоги, которые содержат одну или более аминокислот, простирающихся от карбоксиконцевой области эритропоэтина и где карбоксиконцевое расширение обеспечивает, по крайней мере, один дополнительный карбогидратный сайт. В одном из вариантов, аналог конструировали слиянием карбоксиконцевых 28 аминокислот хорионического гонадотропина человека (HCG) с аргининовым остатком в положении 166 эритропоэтина человека. HCG карбоксиконцевой фрагмент содержал четыре сайта для О-гликозилирования (Kessler et.al. J.Biol.Chem. 254, 7907 /1979/). Таблицы 3, 4 и 5 представляют аналоги эритропоэтина, которые имеют дополнительные сайты для N-связанных и/или О-связанных карбогидратных цепей. Аналоги имеют последовательность Asn-X-Ser/Thr, замещенную в различных положениях в полипептидной цепи эритропоэтина человека для создания N-связанных сайтов или имеют введенные сериновые или треониновые остатки для создания О-связанных сайтов. Таблица 6 представляет те аналоги, которые добавляют, по крайней мере, одну дополнительную N-связанную или одну дополнительную О-связанную карбогидратную цепь, или добавляют одновременно дополнительные N-связанные и О-связанные цепи, как следует из данных миграции гликопротеинов на SDS гелях (Пример 7). Как можно заметить из таблиц 3-6, аналоги, имеющие один или более дополнительных сайтов для присоединения карбогидрата, необязательно приводят к молекулам эритропоэтина, имеющим дополнительные карбогидратные цепи. Например, замещение треониновых остатков в положениях 123 и 125 приводит в результате к добавлению О-связанной карбогидратной цепи, в то время как замещение серина или треонина в другие положения не приводит к аналогам с дополнительными О-связанными цепями (смотри Таблицу 4). Однако, замещение аспарагиновых остатков в положениях 30, 51, 57, 69, 88, 89, 136 и 138 в аминокислотной последовательности эритропоэтина человека приводит к добавлению N-связанной цепи в этих сайтах. Слияние HCG полипептидного фрагмента с аспарагиновым остатком в положении 166 эритропоэтина человека приводит к слиянию молекулы эритропоэтин-HCG, имеющей, по крайней мере, две дополнительные О- связанные карбогидратные цепи. Аналоги эритропоэтина согласно настоящему изобретению также включают эритропоэтин, имеющий аминокислотную последовательность, которая включает перегруппировку, по крайней мере, одного сайта для гликозилирования. Перегруппировка сайта гликозилирования, как использовано здесь, относится к делеции одного или более сайтов гликозилирования в эритропоэтине человека и присоединению одного или более сайтов гликозилирования неестественного происхождения. Аналоги R1, R2 и R3 представляют, например, такие перегруппировки и были сконструированы путем делеции N-связанных сайтов в положениях 24, 38 или 83, соответственно, и добавлением N- связанного сайта в положение 88. Однако, другие многочисленные типы перегруппировок карбогидратного сайта являются возможными и полученные аналоги могут иметь, а могут и не иметь большее число сайтов гликозилирования, по сравнению с эритропоэтином человека. Аналоги R1, R2 и R3 анализировали in vivo на биологическую активность и результаты показаны в Таблице 7. Введение N-связанной цепи в Asn 88 восстанавливало биологическую активность в эритропоэтине, в котором уничтожен один из трех N-связанных сайтов естественного происхождения. Эти результаты указывают на то, что положения карбогидратных цепей в эритропоэтине могут быть изменены с тем, чтобы генерировать полезные аналоги без значительного влияния на биологическую активность. Настоящее изобретение включает также ДНК последовательности, кодирующие аналоги эритропоэтина, имеющие дополнительные сайты для N-связанных и/или О-связанных цепей, аналоги, включающие перегруппировку, по крайней мере, одного добавленного сайта для карбогидратной цепи, и аналоги, имеющие одну или более аминокислот, простирающихся от карбоксиконцевой области эритропоэтина. Процедуры, использованные для введения изменений в ДНК последовательность эритропоэтина человека с целью создания и изменения добавленных сайтов для карбогидратов, раскрыты в Примере 6. Эти аналоги эритропоэтина могут быть продуктом экспрессии экзогенной ДНК последовательности, т. е. продуцированной через рекомбинантную ДНК технологию, или могут быть синтезированными продуктами. Экзогенная ДНК последовательность включает ДНК, ДНК геном или химически полученную ДНК, кодирующую аналог эритропоэтина. Рекомбинантные ДНК плазмиды и клетки хозяева эукариота, полезные для экспрессии указанных аналогов, также охватываются изобретением. Векторы экспрессии включают любой вектор, который способен экспрессировать клонированные ДНК последовательности в клетку хозяина эукариота, в частности, эти векторы используют для экспрессии в клетки COS и CHO. Примеры таких векторов включают плазмиды pTC и pDEC дельта, описанные в Примере 6 заявки. Культивирование COS и CHO клеток хозяина, экспрессирующих аналоги эритропоэтина, проводили, используя процедуры, известные специалистам в этой области. Выделенные изоформы и смеси изоформ, полученные из аналогов эритропоэтина, получают, используя способы, описанные выше для приготовления изоформ эритропоэтина человека. Эти способы могут включать изоэлектрическое фокусирование, ионообменную хроматографию и хроматофокусирование. Предпочтительно, используют ионообменную хроматографию для приготовления индивидуальных изоформ и смесей изоформ, полученных из аналогов эритропоэтина. Увеличение числа карбогидратных цепей в эритропоэтине, и, соответственно, числа сиаловых кислот в молекуле эритропоэтина может придавать предпочтительные свойства, такие как повышение растворимости, большее сопротивление протеолизу, понижение иммуногенности, повышение времени полураспада сыворотки и повышения биологической активности. Кондиционированная среда из CHO клеток, экспрессирующих аналоги эритропоэтина, была анализирована на биологическую активность in vivo и результаты показаны в Таблице 6. Некоторые испытанные аналоги имели активность, которая в три или больше раз превышала активность эритропоэтина человека. В частности, аналоги, имеющие дополнительную N-связанную карбогидратную цепь, либо в положении 30, либо в положении 88 проявляли в 2 или 3 раза большую активность, чем у эритропоэтина человека, в то же время аналоги, имеющие дополнительные О-связанные цепи в результате слияния эритропоэтина человека с HCG полипептидным фрагментом, имели, по крайней мере, в два раза большую активность. Два аналога эритропоэтина, имеющие дополнительные карбогидратные цепи, были очищены, и смеси изоформ, имеющие различное содержание сиаловых кислот, были выделены (Пример 8). Аналоги Thr125 и Ser87Asn88Thr90 (EPO N14) были разделены на три отдельные фракции изоформ, и была для каждой фракции определена биологическая активность in vivo. Результаты, представленные в Таблице 8, демонстрируют, что фракции EPO N14 изоформы, имеющие более высокое содержание сиаловой кислоты, обладали большей активностью in vivo. Пул изоформ с высоким содержанием сиаловой кислоты аналога EPO N14 и рекомбинантного эритропоэтина человека (изоформы 9-14) были изучены по данным анализов по рецепторному связыванию, фармакокинетическим экспериментам и экспериментам с повышением гематокрита мыши. Результаты этих анализов указывают на то, что существует прямая связь между содержанием сиаловой кислоты, периодом полураспада клиренса и способностью к повышению гематокрита мышей, подвергнутых обработке. Таким образом, как показано на фиг. 13, 14 и 15, EPO N14 пул изоформы с высоким содержанием сиаловой кислоты имел значительно более продолжительный период полураспада in vivo и способствовал большему повышению гематокрита, чем это было в случае выделенной изоформы 14 или рекомбинантного эритропоэтина человека, даже несмотря на то, что пул изоформы N 14 с высоким содержанием сиаловой кислоты не связан так сильно с рецептором. Другой объект изобретения относится к клеткам хозяевам млекопитающего (например, Chinese Hamster Ovary, CHO), которые предпочтительно синтезируют изоформы эритропоэтина человека или аналоги эритропоэтина, имеющие большее чем определенное число сиаловых кислот на молекулу, например, больше чем 10 сиаловых кислот на молекулу. Молекулы эритропоэтина содержат N-связанные и О- связанные олигосахаридные структуры, которые могут ограничивать содержание сиаловой кислоты в молекуле. Например, четырехусиковые (четырехразветвленные) N-связанные олигосахариды наиболее вероятно обеспечивают четыре возможных сайта для присоединения сиаловой кислоты, в то время как двух и трехусиковые олигосахаридные цепи, которые могут заменять четырехусиковую форму в аспарагин-связанных сайтах, обычно имеют не более двух или трех присоединенных сиаловых кислот. О-связанные олигосахариды обычно обеспечивают два сайта для присоединения сиаловой кислоты. Таким образом, молекулы эритропоэтина могут аккомодировать полностью 14 остатков сиаловой кислоты при условии, что все три N-связанных олигосахарида являются четырехусиковыми. Культуры клеток млекопитающего отсевают от тех клеток, которые предпочтительно присоединяют четырехусиковые цепи к рекомбинантному эритропоэтину, тем самым минимизируя число сайтов для присоединения сиаловой кислоты. N-связанные олигосахариды мочевого эритропоэтина содержат сиаловую кислоту в обоих положениях в альфа 2,3 и альфа 2,6 связях с галактозой /Takeuchi et. al. J.Biol.Chem. 263, 3657 /1988/. Обычно, сиаловую кислоту в альфа 2,6 связи присоединяют к галактозе на маннозное альфа 1,6 ответвление и сиаловую кислоту в альфа 2,6 связи присоединяют к галактозе на маннозное альфа 1,3 ответвление. Ферменты, которые присоединяют эти сиаловые кислоты (бета- галактозид альфа 2,3 сиалилтрансфераза и бета-галактозид альфа 2,6 сиалилтрансфераза), являются наиболее эффективными при присоединении сиаловой кислоты к маннозе альфа 1,6 и маннозе альфа 1,3 ответвлениям соответственно. Неполные Chinease Hamster Ovary (CHO) клетки дигидрофолат редуктазы (DHFR) обычно используют клетку хозяина для продуцирования рекомбинантных гликопротеинов, включая рекомбинантный эритропоэтин. Эти клетки не экспрессируют фермент бета-галактозид альфа 2,6 силилтрансферазы и поэтому не добавляют сиаловую кислоту в альфа 2,6 связь с N-связанными олигосахаридами гликопротеинов, полученных в этих клетках (Mutsaers et.al. Eur.J.Biochem. 156, 651 /1986/; Takeuchi et.al. J.Chromatogr. 400, 207 /1987/). Следовательно, рекомбинантный эритропоэтин, полученный в CHO клетках, испытывает недостаток сиаловой кислоты в 2,6 связи с галактозой (Sasaki et.al. /1987/; Takeuchi et.al /1987/). В другом варианте объекта изобретения эритропоэтин человека или аналог эритропоэтина получают в CHO клетках, которые трансфекцируют геном функциональной бета-галактозид альфа 2,6 силилтрансферазой с встраиванием сиаловой кислоты в альфа 2,6 связь с галактозой. Полученные изоформы будут содержать сиаловую кислоту, имеющую обе связи альфа 2,3 и альфа 2,6 с галактозой. (Смотри Lee et. al. J.Biol. Chem. 264, 13848 /1989/, для раскрытия техники создания модифицированных CHO клеток или других клеток хозяина млекопитающего). Изобретение также включает фармацевтические композиции, содержащие терапевтически эффективное количество определенной изоформы или смеси изоформ вместе с соответствующим разбавителем, адъювантом и/или носителем, полезные в эритропоэтиновой терапии. Фармацевтические композиции, содержащие терапевтически эффективное количество аналога эритропоэтина вместе с соответствующим разбавителем, адъювантом и/или носителем, также включает настоящее изобретение. Термин “терапевтически эффективное количество”, как он использован здесь, относится к такому количеству, которое обеспечивает терапевтический эффект для данного условия и режима введения. Введение изоформ эритропоэтина человека или аналогов эритропоэтина осуществляется, предпочтительно, парентеральными путями. Выбор специфического пути введения будет зависеть от состояния, которое подвергается лечению. Введение изоформ эритропоэтина человека или аналогов эритропоэтина осуществляют, предпочтительно, частями композиции, содержащей соответствующий носитель, такой как сывороточный альбумин человека, соответствующий разбавитель, такой как буферный солевой раствор, и/или соответствующий адъювант. Требуемые дозы будут находиться в количествах, достаточных для повышения гематокрита пациента, и будут меняться в зависимости от тяжести состояния, которое подвергается лечению, использованного способа введения и им подобных. Следующие примеры предназначены для более полной иллюстрации изобретения, но не ограничивают его объема. Стандартный эритропоэтин, использованный в биоопытах in vivo, примененный в примерах, является стандартным рекомбинантным эритропоэтином, который был стандартизован по отношению к стандартному частично очищенному мочевому эритропоэтину. Таким образом, измеренными являлись только относительные специфические активности in vivo. Специфические активности in vivo выражают также в “единицах/мл”, “единицах/мг” и “единицах/A280“, а не в “IU/ml”, “IU/mg” и IU/A280, потому что примененный стандартный эритропоэтин не был непосредственно скоррелирован с любым существующим международным стандартом. Пример 1. Выделение изоформ рекомбинантного эритропоэтина Рекомбинантный эритропоэтин получают как описано Lin (патент США 4703008). Рекомбинантный эритропоэтин, использованный в качестве исходного материала для первого и третьего посевов изоформ, очищают согласно процедуре, описанной в Примере 2, Lai et al. Исходный материал для второго и пятого посева изоформы очищают согласно Lai et al., используя хроматографию, модифицированную Q-сефарозой. Эти препараты содержат смесь изоформ рекомбинантного эритропоэтина, имеющую ту же аминокислотную последовательность, как у мочевого эритропоэтина, и содержат преимущественно изоформы с 9 по 14. Исходный материал для препарата четвертой изоформы представляет материал, который элюируют в процессе промывания анионообменной колонки, как в Примере 2 Lai et.al., раствором 5 ммоль/л уксусной кислоты/ 1 ммоль/л глицина/ 6 моль/л мочевины. Эта фракция содержит изоформы с меньшим или равным 9 количеством сиаловых кислот и далее ее очищали с помощью гель фильтрационной хроматографии, как описано в Примере 2 Lai et al., до использования в препаративной изоэлектрической фокусирующей процедуре. Препарат шести изоформ использовали в качестве исходного материала для очищенного препарата рекомбинантного эритропоэтина, содержащего от 4 до 13 сиаловых остатков. Этот материал очищали, как представлено в Примере 2 Lai et al., за исключением модификации ионообменной колонки (элюирование рекомбинантного эритропоэтина раствором хлористого натрия с градиентом при pH 8.4 и пропускание смеси уксусная кислота/мочевина для промывания), которая приводит к удерживанию большей части изоформ, присутствующих в исходном материале. Шесть различных препаратов индивидуальных изоформ получают с помощью препаративного изоэлектрического фокусирования в ложе гранулированного геля (Ultrodex, LKB), особенно как в LKB описании 198. Используют фармалит (Pharmacia) 2.5-5 амфолиты (Pharmacia) и ложе геля, содержащее 5 моль/л мочевины. В первом препарате в гель вводят 20 мг рекомбинантного эритропоэтина в 6.8 мл смеси 20 ммоль/л цитрата натрия/ 100 ммоль/л хлористого натрия, pH 7.0, фокусируют при 8 Вт приблизительно 16 часов. После изоэлектрического фокусирования, полосы изоформы в геле визуализируют с помощью контактной печати на бумагу ложа геля. Получают печать и затем проявляют погружением в 3 заменяющихся (приблизительно каждые 10 минут, температура комнатная) проявляющих раствора (40% метанола/ 10% уксусной кислоты/ 10% TCA/ 3.5% сульфосалициловой кислоты), которые подвергают одной замене (приблизительно 10 минут) 40% метанола/ 10% уксусной кислоты (30-60 градусов Цельсия), окрашивают в течение 15 минут при 60 градусах Цельсия в 0.125 % Кумасиновом голубом (Coomassie Blue) R-250/ 40% метаноле/ 10% уксусной кислоте и затем обесцвечивают в 7.5% метаноле/ 10% уксусной кислоте, для того, чтобы визуализировать разделенные изоформы. Область ложа гранулированного геля, содержащую изоформы (около 50% смолы), удаляют, добавляют воду (около 16 мл), и суспензию выливают в поднос (15 х 50 см) и выпаривают до чистого веса около 40 г. Этот препарат фокусируют второй раз и контактную печать ложа геля осуществляют, как было проведено ранее. Часть геля, содержащую каждую из шести различающихся изоформ, удаляют из ложа геля. Для того чтобы элюировать изоформы из геля, к каждой изоформе добавляют раствор, содержащий 10 ммоль/л трис-HCl, pH 7.0/ 5 ммоль/л Chaps, с тем чтобы получить суспензию. Суспензии помещают в маленькие колонки и промывают буфером Tris-Chaps. Проходящие потоки собирают и отдельно добавляют в маленькие колонки (колонка открытой конфигурации), содержащие в качестве обращенной фазы смолу Vydac C4, равновесно распределенную в 20% этанола/ 10 ммоль/л трис-HCl, pH 7.0. Колонки постадийно проявляют 20% этанолом/ 10 ммоль/л трис-HCl, pH 7.0, 35% этанолом/ 10 ммоль/л трис-HCl, pH 7.0 и 65% этанолом/ 10 ммоль/л трис-HCl, pH 7.0. Фракцию, элюированную 65% этанолом/ 10 ммоль/л трис-HCl, разбавляют 1:1 10 ммоль/л трис-HCl, pH 7.0 и подвергают концентрированию, и затем заменяют буфер на 10 ммоль/л трис-HCl, pH 7.0, используя Centricon-10 (Amicon) микроконцентратор. Аналитическое изоэлектрическое фокусирование этого препарата проводят, в основном, как описано в LKB техническом описании 250, используя Servalyte 3-5 амфолины (Serva) в полиакриламидном геле, содержащем 5 моль/л мочевины. Во втором препарате приблизительно 26 мг рекомбинантного эритропоэтина в 6.5 мл деионизированной воды добавляют к гелю и фокусируют при 2.5 Вт в течение 35 минут и при 10 Вт в течение приблизительно 17 часов. Полосы фокусированного протеина, которые видны в ложе геля, удаляют в виде 11 различных пулов. Каждый пул вымывают 7.5 мл деионизованной воды, и 20 мл каждого из супернатантов полученных пулов подвергают аналитическому изоэлектрическому фокусированию, как описано выше. К каждому из пулов добавляют 5 мл 1.5 моль/л трис-HCl, pH 8.8, и каждую из суспензий помещают в маленькие колонки и позволяют жидкой фазе протекать через колонку. Смолу промывают приблизительно тремя объемами 0.5 ммоль/л трис-HCl, pH 7, и промывной раствор объединяют с прошедшим через колонку раствором. Элюанты концентрируют и заменяют буфер на 20 ммоль/л цитрата натрия/ 100 ммоль/л хлористого натрия, pH 7.0, используя доступные ультрафильтрационные устройства Amicon, содержащие смолу с определенным молекулярным весом 10000 дальтон. Концентрированные растворы (приблизительно 0.5 мл) затем пропускают через определенный фильтр 0.22 микрон из ацетата целлюлозы. На основании аналитического изоэлектрического фокусирования находят пять пулов с преобладающим содержанием единственной изоформы 10, 11, 12, 13 и 14. В третьем препарате приблизительно 30 мг рекомбинантного эритропоэтина в 21.8 мл дистиллированной воды добавляют к гелю и фокусируют при 2 Вт в течение 25 минут, при 10 Вт в течение 20 часов и при 15 Вт в течение 15 минут. Полосы протеина, соответствующие индивидуальным изоформам, визуально наблюдают и удаляют из ложа геля. К изоформам, выделенным из геля, добавляют дистиллированную воду для получения суспензии, и полученные супернатанты анализируют с помощью аналитического изоэлектрического фокусирования. К каждой суспензии добавляют равный объем 1 моль/л трис-HCl, pH 7.2, суспензии помещают в отдельные маленькие колонки, и жидкой фазе позволяют протекать через колонку с элюированием изоформ. Каждый поток, прошедший через колонку, концентрируют и заменяют буфер на 20 ммоль/л цитрата натрия/ 100 ммоль/л хлористого натрия, pH 7.0, используя доступное ультрафильтрационное устройство Amicon со смолой определенного молекулярного веса 10000. Аналитический изоэлектрический фокусирующий гель обнаруживает, что получены пулы, содержащие преобладающие единичные изоформы 9, 10, 11, 12, 13 и 14. Четвертый препарат изоформы использовали в качестве исходного материала изоформ 3-9, содержащих эритропоэтин (полученный как описано выше). Предварительное препаративное изоэлектрическое фокусирование проводят, в основном, как описано для препаратов 1-3 выше, амфолиты (Pharmalyte 2,5-5/ предварительно фракционировали в Rotofor /Bio-Rad, Richmond, CA) с жидкофазной изоэлектрической фокусирующей ячейкой с получением участка амфолита, более пригодного для самых низких изоэлектрических точек исходного материала. Предварительное фракционирование проводили путем смешения 6.7 мл Pharmalyte 2.5-5 с 15 г мочевины и добавления очищенной воды с доведением до объема 50 мл. Эту смесь фракционировали в Rotofor при 100 Вт, 1 градусе Цельсия, в течение пяти с половиной часов, используя 0.1 моль/л фосфорную кислоту и 0.1 моль/л гидроокись натрия в качестве анолита и католита соответственно. Фракции амфолита, имеющие измеренные величины pH между 4.5 и приблизительно 6, использовали в изоэлектрическом фокусировании с плоским ложем (flat-bed). Амфолиты удаляли из изоформ, используя Centrieluter (Amicon, Danvers, МА) и определенного молекулярного веса 10000 Centricon (Amicon), используя следующие параметры: 0.18 трис буфер pH 8,8, 100 вольт, 25-30 мА в течение 3 часов. Обменивали буфер в изоформах на 0.1 ммоль/л хлористого натрия путем гель-фильтрации, используя Сефадекс G-25 (Pharmacia). Аналитическое изоэлектрическое фокусирование пяти полученных пулов показывало содержание в них изоформ 4, 5, 6, 7 и 8. Изоформа 4 выходит в виде нескольких полос, указывая на то, что она может подвергаться деструкции в некоторой степени. Пятый препарат изоформы модифицировали добавлением стадии предварительного фокусирования к процедуре изоэлектрического фокусирования. В этой модификации протеин не добавляли к смеси амфолит/мочевина/ гель до электрофореза, но добавляли к изоэлектрическому фокусирующему аппарату вслед за генерированием градиента pH в ложе геля. После предварительного фокусирования в течение 75 минут (1500 вольт-час) отрезок ложа геля в 2,25-4,25 см от катода удаляли, смешивали с раствором эритропоэтина и вновь возвращали в ложе геля. Вслед за изоэлектрическим фокусированием изоформы 10, 11, 12, 13 и 14 элюировали из ложа геля и отделяли от амфолитов путем ультрафильтрации, используя устройство Centricon-10 (Amicon). Модификация предварительного фокусирования была проведена для того, чтобы получить характеристики ультрафиолетового поглощения препаратов изоформ, более похожие на характеристики исходного рекомбинантного эритропоэтина. Это улучшение спектральных характеристик можно видеть для отношения поглощения при 280 и 260 нм для выделенных изоформ. Среднее отношение поглощения при 280 нм к поглощению при 260 нм (A280/A260) для изоформ из препаратов 2 и 3 (не подвергнутых предварительному фокусированию) составляет 1.36  0.11, в то время как среднее A280/A260 отношение для препаратов 5 и 6 (предварительно фокусированных) составляет 1.68 0.11, в то время как среднее A280/A260 отношение для препаратов 5 и 6 (предварительно фокусированных) составляет 1.68 0.20. Если изоформу #14 исключают из расчета, средние отношения A280/A260 составляют 1.39 0.20. Если изоформу #14 исключают из расчета, средние отношения A280/A260 составляют 1.39 0.11 и 1.74 0.11 и 1.74 0.09 для препаратов 2 и 3, 5 и 6 соответственно. (Изоформа 14 может иметь наиболее нетипичный спектр, потому что она присутствует в самых малых количествах, и таким образом, в большей степени подвергается интерференции следами загрязнения компонентами амфолита, или потому что она находится наиболее близко к электроду в процессе процедуры изоэлектрического фокусирования плоского ложа). Среднее отношение A280/A260 для рекомбинантного эритропоэтина, полученного согласно Примеру 2 Lai et al. (модифицированного как описано ранее с использованием Q-сефарозы в качестве анионообменной смолы), составляет 1.91 0.09 для препаратов 2 и 3, 5 и 6 соответственно. (Изоформа 14 может иметь наиболее нетипичный спектр, потому что она присутствует в самых малых количествах, и таким образом, в большей степени подвергается интерференции следами загрязнения компонентами амфолита, или потому что она находится наиболее близко к электроду в процессе процедуры изоэлектрического фокусирования плоского ложа). Среднее отношение A280/A260 для рекомбинантного эритропоэтина, полученного согласно Примеру 2 Lai et al. (модифицированного как описано ранее с использованием Q-сефарозы в качестве анионообменной смолы), составляет 1.91 0.04.
Как описано выше, исходным материалом для препарата, содержащего изоформы # 6, был препарат рекомбинантного эритропоэтина, содержащий изоформы 4-13. Амфолиты предварительно фокусировали в аппарате Rotofor как для четвертого препарата. Фракции амфолита, имеющие измеренные величины pH между 3.7 и 4.8, использовали для изоэлектрического фокусирования в плоском ложе. Плоское ложе предварительно фокусировали как в опыте #5, и изоформы 9, 10, 11, 12 и 13 получали после ультрафильтрации (centricon-10) для удаления амфолитов, использованных в качестве носителя.
Пример 2. Содержание сиаловой кислоты изоформ рекомбинантного эритропоэтина.
В изоформах, выделенных как описано в Примере 1, и эритропоэтине, очищенном согласно процедурам, описанным Lai et al. (смесь изоформ с 9 по 14), заменяли буфер на 0.10-0.15 моль/л хлористого натрия и анализировали на содержание сиаловой кислоты с помощью модификации процедуры Jourdian et al. (J. Biol. Chem. 246, 430 /1971/). Остатки сиаловой кислоты вырезали из гликопротеинов гидролизом 0.35 моль/л серной кислотой при 80 градусах Цельсия в течение 30 минут, и растворы нейтрализовали гидроокисью натрия до анализа. Для того чтобы установить количество присутствующего протеина эритропоэтина, проводили анализ протеина по Брэдфорду (Bradford Anal. Biochem., 72, 248 /1976/), используя рекомбинантный эритропоэтин, имеющий аминокислотную последовательность эритропоэтина человека, в качестве стандарта, используя реагенты и процедуру микро-способа, примененную Bio-Rad. Результаты, выраженные в молях сиаловых кислот на моль эритропоэтина, показаны в Таблице 1. Изоформы обозначают согласно числу сиаловых кислот на молекулу, и области от наименее кислой (изоформа 9) до более кислой (изоформа 13). Изоформы 9-13 показаны в полосах геля 6-10 фиг. 1. Количества изоформы 14 оказались недостаточными для точного измерения содержания сиаловой кислоты. Содержание кислоты в этой изоформе выводят из ее миграций на IEF гелях относительно других изоформ. Содержание сиаловой кислоты в изоформах 5-8 (препарат #4) не было измерено, но аналогично выведено из их миграций на IEF гелях.
Таблица 1 0.04.
Как описано выше, исходным материалом для препарата, содержащего изоформы # 6, был препарат рекомбинантного эритропоэтина, содержащий изоформы 4-13. Амфолиты предварительно фокусировали в аппарате Rotofor как для четвертого препарата. Фракции амфолита, имеющие измеренные величины pH между 3.7 и 4.8, использовали для изоэлектрического фокусирования в плоском ложе. Плоское ложе предварительно фокусировали как в опыте #5, и изоформы 9, 10, 11, 12 и 13 получали после ультрафильтрации (centricon-10) для удаления амфолитов, использованных в качестве носителя.
Пример 2. Содержание сиаловой кислоты изоформ рекомбинантного эритропоэтина.
В изоформах, выделенных как описано в Примере 1, и эритропоэтине, очищенном согласно процедурам, описанным Lai et al. (смесь изоформ с 9 по 14), заменяли буфер на 0.10-0.15 моль/л хлористого натрия и анализировали на содержание сиаловой кислоты с помощью модификации процедуры Jourdian et al. (J. Biol. Chem. 246, 430 /1971/). Остатки сиаловой кислоты вырезали из гликопротеинов гидролизом 0.35 моль/л серной кислотой при 80 градусах Цельсия в течение 30 минут, и растворы нейтрализовали гидроокисью натрия до анализа. Для того чтобы установить количество присутствующего протеина эритропоэтина, проводили анализ протеина по Брэдфорду (Bradford Anal. Biochem., 72, 248 /1976/), используя рекомбинантный эритропоэтин, имеющий аминокислотную последовательность эритропоэтина человека, в качестве стандарта, используя реагенты и процедуру микро-способа, примененную Bio-Rad. Результаты, выраженные в молях сиаловых кислот на моль эритропоэтина, показаны в Таблице 1. Изоформы обозначают согласно числу сиаловых кислот на молекулу, и области от наименее кислой (изоформа 9) до более кислой (изоформа 13). Изоформы 9-13 показаны в полосах геля 6-10 фиг. 1. Количества изоформы 14 оказались недостаточными для точного измерения содержания сиаловой кислоты. Содержание кислоты в этой изоформе выводят из ее миграций на IEF гелях относительно других изоформ. Содержание сиаловой кислоты в изоформах 5-8 (препарат #4) не было измерено, но аналогично выведено из их миграций на IEF гелях.
Таблица 1Изоформа эритропоэтина – Моли сиаловой кислоты/моль эритропоэтина Изоформа 13 – 12.9  0.5 0.5Изоформа 12 – 11.8  0.2 0.2Изоформа 11 – 11.0  0.2 0.2Изоформа 10 – 9.8  0.3 0.3Изоформа 9 – 8.9  0.6 0.6Смесь изоформ /9-14/ – 11.3  0.2 0.2Пример 3. Активность изоформ рекомбинантного эритропоэтина Изоформы, выделенные как описано в Примере 1, анализируют по поглощению при 280 нм, с помощью анализа на протеин по Брэдфорду и с помощью RIA для определения присутствующего количества рекомбинантного эритропоэтина. Эксгипоксический полицитемический биоанализ на мышах (Cotes et.al. Nature 191, 1065 /1961/) используют для определения относительной биологической активности in vivo. Расчет количества присутствующего эритропоэтинового протеина с использованием радиоиммунного анализа для полученного эритропоэтина давал результаты, имеющие более высокую специфическую активность in vivo для определенных изоформ из-за кажущегося уменьшения иммунореакционной способности изоформ, содержащих большие количества сиаловых кислот, приводящего к недооценке концентрации эритропоэтина и, таким образом, к переоценке относительной специфической активности in vivo для более отрицательных изоформ. Определения биоанализа на мышах, выраженные в единицах/мл, делят на соответствующие концентрации протеина с получением специфической активности in vivo, выраженной в единицах/мг эритропоэтинового полипептида. Эти специфические активности показаны в Таблице 2. В Таблице 2 “n” представляет число независимых препаратов изоформ, которое вносит вклад в специфическую активность. В большинстве случаев были выполнены несколько анализов in vivo на каждом препарате изоформы. Вклад тех же данных in vivo в расчеты специфической активности для всех трех колонок, единицы/мг эритропоэтинового полипептида определяют по поглощению при 280 нм, по данным радиоиммунного анализа или по результатам анализов на протеин по Брэдфорду. Очищенный рекомбинантный эритропоэтин, содержащий изоформы 9-14, использовали в качестве стандарта в анализе на протеин по Брэдфорду. Величина “n” может быть меньше для расчета, проведенного с использованием анализа на протеин по Брэдфорду, так как некоторые препараты не были пригодны для выполнения анализов по Брэдфорду. Эритропоэтин, очищенный согласно процедурам, описанным Lai et al., и содержащий смесь изоформ с 9 по 14, используют в качестве стандарта для анализов RIA и in vivo. Относительные специфические активности, выраженные в виде единиц/мг эритропоэтинового полипептида, могут быть превращены в единицы/A280 путем умножения на 0.807 мг эритропоэтинового полипептида/A280. Фактор превращения получают умножением коэффициента экстинкции эритропоэтина (1.345 мг/A280) на содержание протеина в эритропоэтиновом гликопротеине (около 60 весовых %, Davis et.al. Biochemistry 26, 2633 /1987/) с получением мг эритропоэтинового полипептида/A280 (т.е. 1.345 мг эритропоэтина/A280 х 0.60 мг полипептида/мг эритропоэтина = 0.807 мг эритропоэтина/A280). Кроме того, специфические активности, выраженные в единицах/мг эритропоэтинового полипептида, могут быть умножены на фактор 0.60 мг полипептида/мг эритропоэтинового гликопротеина с получением специфических активностей, выраженных в единицах/мг эритропоэтинового гликопротеина. Данные Таблицы 2 представлены также графически на фиг. 2A, 2B и 2C. Эти данные показывают, что относительная активность in vivo эритропоэтина увеличивается как функция содержания сиаловой кислоты вплоть до изоформы #11. Изоформы 11-14 имели, по существу, одинаковые относительные биоактивности in vivo. (Это является наиболее очевидным, если концентрацию изоформы 14 выражают, используя величину анализа по Брэдфорду. Величина по Брэдфорду может быть более точной для изоформы 14 из-за низких уровней, которые создают трудности в определении с помощью поглощения при A280, и наиболее очевидно уменьшают реакционную способность по данным RIA очень отрицательных форм, что обсуждалось ранее). Большая относительная специфическая активность in vivo изоформ эритропоэтина, имеющего большее количество сиаловой кислоты, наиболее вероятно обусловлена более продолжительным временем полураспада этих изоформ в процессе кровообращения. Изоформы 9 и 13 метили радиоактивным иодом (125I), и определяли скорость их выведения на крысах. Период полураспада в процессе кровообращения был значительно больше для изоформы 13, по сравнению с изоформой 9. Пример 4, Отбор смеси изоформ рекомбинантного эритропоэтина с помощью хроматографии с Q-сефарозой Кондиционированную клетками среду при получении рекомбинантного эритропоэтина, согласно процедурам, описанным Lin, концентрируют и подвергают диафильтрованию относительно раствора 10 ммоль/л Трис, pH 7.2. Концентрацию протеина определяют по данным анализа на микропротеин по Брэдфорду, используя в качестве стандарта бычий сывороточный альбумин. 19.6 мл раствора, содержащего 40 мг общего протеина, готовят с 20 мкмоль/л сульфата меди, фильтруют через фильтр, вырезающий 0.45 мкм, и загружают в колонку в виде слоя объемом 4 мл (1.05 см в высоту х 2.2 см диаметром), колонку, заполненную Q- сефарозой быстрого потока (Fast Flow) (Pharmacia), которую уравновешивают 10 ммоль/л Трис, pH 6.8 до 7.0 при 4 градусах C. После пропускания образца через колонку, ее промывают раствором, равным двум объемам колонки, того же самого буфера. Скорость потока в колонке около 1 мл/мин. Шесть отдельных колонок загружают, используя эту процедуру для отбора определенных смесей изоформ эритропоэтина. Колонки промывают раствором буфера, равным 6-9 объемам колонки, с низким pH, состоящим из: Колонка 1: 150 мл уксусной кислоты, 1 ммоль/л глицина, 20 мкмоль/л сульфата меди, 6 моль/л мочевины, доведенным до pH 4.7 гидроокисью натрия; Колонка 2: 200 ммоль/л уксусной кислоты, 1 ммоль/л глицина, 20 мкмоль/л сульфата меди, 6 моль/л мочевины, доведенным до pH 4.7 гидроокисью натрия; Колонка 3: 250 ммоль/л уксусной кислоты, 1 ммоль/л глицина, 20 мкмоль/л сульфата меди, 6 моль/л мочевины, доведенным до pH 4.7 гидроокисью натрия; Колонка 4: 300 ммоль/л уксусной кислоты, 1 ммоль/л глицина, 20 мкмоль/л сульфата меди, 6 моль/л мочевины, доведенным до pH 4.7 гидроокисью натрия; Колонка 5: 150 ммоль/л уксусной кислоты, 1 мкмоль/л глицина, 20 мкмоль/л сульфата меди, 6 моль/л мочевины; Колонка 6: 300 ммоль/л уксусной кислоты, 1 ммоль/л глицина, 20 мкмоль/л сульфата меди, 6 моль/л мочевины. pH колонок повышают приблизительно до 7 промыванием каждой из них раствором, равным 8-11 объемам колонки, 10 ммоль/л Трис-HCl, 55 ммоль/л хлористого натрия, 20 мкмоль/л сульфата меди, pH 7. Определенные смеси изоформ эритропоэтина элюируют из колонок промыванием раствором 10 ммоль/л Трис-HCl, 140 ммоль/л хлористого натрия, 20 мкмоль/л сульфата натрия, pH 7.0. Пулы изоформ, элюированные из каждой колонки, концентрируют и растворитель заменяют на воду, используя Amicon Centricon-10 микроконцентратор. Результаты аналитического изоэлектрического фокусирования этих концентрированных пулов показаны на фиг. 3. Полосы геля 1-6 представляют определенные смеси изоформы эритропоэтина, элюированные из колонок 1-6 соответственно. “Смесь изоформ”, показанная в дальней правой полосе геля (фиг.3), представляет клеточную среду, которую пропускают через колонку с Q-сефарозой, как описано выше, колонку промывают раствором 5 ммоль/л уксусной кислоты, 1 ммоль/л глицина, 20 мкмоль/л сульфата меди, 6 моль/л мочевины и смесь изоформ эритропоэтина элюируют из колонки, используя процедуры, описанные выше. Эту элюированную смесь изоформ далее очищают, согласно процедурам, описанным Lai et.al. до аналитического изоэлектрического фокусирования. Пример 5. Фракционирование изоформ рекомбинантного эритропоэтина с использованием низкого градиента pH на Q-сефарозе. В другой процедуре, изоформы эритропоэтина разделяют, используя градиент понижения pH и увеличения ионной силы раствора. Среду, содержащую концентрированный диализованный эритропоэтин, загружали в колонку с Q-сефарозой при отношении приблизительно 40 мг общего количества протеина/мл геля. Затем колонку промывали раствором, равным приблизительно двум объемам колонки, 10 ммоль/л Трис HCl, pH 7.0, и затем раствором, приблизительно равным 10 объемам колонки, 2 ммоль/л уксусной кислоты/ 1 ммоль/л глицина/ 20 мкмоль/л сульфата меди/ 6 моль/л мочевины (pH приблизительно 4.8) для удаления загрязняющих протеинов и изоформ эритропоэтина, содержащих меньше чем приблизительно 7 остатков сиаловой кислоты. Изоформы, содержащие от приблизительно 8 до приблизительно 12 сиаловых кислот, элюировали из колонки, используя градиент, начиная с 2 ммоль/л уксусной кислоты в 6 моль/л мочевины/ 1 ммоль/л глицина/ 20 мкмоль/л сульфата меди до 40 ммоль/л уксусной кислоты/ 6 моль/л мочевины/ 1 ммоль/л глицина/ 20 мкмоль/л сульфата меди (pH приблизительно 4). Общий объем градиента составлял приблизительно около 40 объемов колонки, и фракции объемом, приблизительно равным объему одной колонки, каждую собирали в сосуды, содержащие буфер Трис с объемом, достаточным для доведения pH до 6-8.5, для того чтобы избежать выдерживания фракций в течение продолжительного времени при низком pH. Аликвоты фракций подвергали аналитическому изоэлектрическому фокусированию с управлением разделения. Фиг.4 показывает разделение изоформ 8-11, которое может быть достигнуто этой процедурой. Изоформы 12-14, которые остаются связанными с колонкой по окончании градиента, элюируют промыванием буфером, состоящим из 10 ммоль/л Трис HCl, 140 ммоль/л хлористого натрия, 20 мкмоль/л сульфата меди (pH 7.0). Изоформы (выделенные в процессе градиента или элюирования раствором хлористого натрия) освобождали от примесных протеинов с помощью хроматографии с обращенной фазой с последующей гель фильтрационной хроматографией, как описано в Примере 2 Lai et.al. Пример 6. Конструирование аналогов эритропоэтина человека Положения существующих присоединенных карбогидратных сайтов в пределах аминокислотной последовательности эритропоэтина человека показаны на фиг.5 (SEQ 1D. N0:26). Процедуры для генерирования дополнительных сайтов гликозилирования для эритропоэтина суммированы на фиг.6A-C и описаны ниже. Олигонуклеотидные затравки А получали для использования в метагенезе in vitro (см. в конце описания) Подчеркнутые кодоны показывают несовместимые участки, где аминокислоты, указанные в скобках, заменяют аминокислотами дикого типа. [Asn4, Ser6] EPO конструируют для добавления сайта N-гликозилирования у Asn4. [Asn9, Ser11] EPO конструируют для добавления сайта N-гликозилирования у Asn9. [Asn69] EPO конструируют для добавления сайта гликозилирования у Asn69. [Asn125, Ser127] EPO конструируют для добавления сайта N- гликозилирования у Asn125. [Thr125] EPO и [Pro124, Thr125] EPO конструировали для добавления сайта О-гликозилирования у Thr125. Олигонуклеотидные затравки (Б) были получены для использования в мутагенезе in vitro (см. в конце описания). Исходя из [Pro124, Thr125] EPO сДНК используют олигонуклеотидную затравку 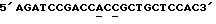 (SEQ ID. N0: 16) для генерирования [Pro124, Thr125, Thr126] EPO. Олигонуклеотидную затравку (SEQ ID. N0: 16) для генерирования [Pro124, Thr125, Thr126] EPO. Олигонуклеотидную затравку 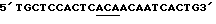 (SEQ ID. N0:17) используют затем для генерирования [Pro124, Thr125, Thr126, Thr131] EPO.
[Asn69, Thr71] EPO и [Ser68, Asn69, Thr71] EPO конструируют добавлением сайта N-гликозилирования в Asn 69 и усилением N-гликозилирования в этом сайте. [Asn125, Thr127 EPO, [Asn125, Thr127, Thr131] EPO, [Pro124, Asn125, Ser127] EPO и [Pro124, Asn125, Thr127] EPO конструируют добавлением сайта N- гикозилирования в Asn 125 и увеличением гликозилирования в этом сайте. [Thr125, Thr126] EPO и [Pro124, Thr125, Thr126, Ser131] EPO конструируют добавлением сайта О-гликозилирования в Thr 125 и увеличением гликозилирования в этом сайте.
Источником эритропоэтиновой ДНК для мутагенеза in vitro была плазмида Hu13 эритропоэтина человека сДНК, клонированная в pUC 8 (Law et.al. Proc Natl. Acad. Sci. 83, 6920 /1986/). Плазмида ДНК, полученная из Hu13, переваривалась ферментами рестрикции BstEII и BglII, давая фрагмент ДНК, который подвергали электрофорезу в геле агарозы, и выделяли из геля эритропоэтиновый фрагмент ДНК с 810 парами оснований, используя GeneClean kit и процедуры, используемые производителем (BIO 101 Inc.). Плазмида pBRgHuEPO содержит ген эритропоэтинового генома, такой как BamHI фрагмент, включенный в производное pBR322 как описано Lin. pBRgHuEPO усваивался также BstEII и BglII, и был выделен фрагмент вектора с 6517 парами оснований. Лигирование двух фрагментов давало IGT1. Для конструирования pEC-1, pDSVL (описанный в общих чертах Lin и показанный на фиг.5 B) усваивался BamHI и выделенный фрагмент BamHI 2.8 килооснований из IGT1, содержащий эритропоэтиновую сДНК, лигировали в него.
Для того чтобы генерировать одноцепочечную ДНК для мутагенеза in vitro, pEC-1 усваивался BamHI и BglII, и выделялся фрагмент эритропоэтиновой сДНК с 820 парами оснований. Его лигировали в сайт BamHI m13mp18 с получением m13-EC-1. Одноцепочечную ДНК выделяли из супернатантов штамма E.coli RZ1032, инфицированного m13-EC-1, как описано Kunkel et al. (Methods in Enzymol. 154, 367 /1987/) и Messing (Methods in Enzymol. 101, 20 /1983/). Для мутагенеза in vitro приблизительно 1 мкг одноцепочечной ДНК и 0.2 м.д. моля одной из синтетических затравок, описанных выше, смешивали с 6 мкл буферного раствора (250 ммоль/л Трис, pH 7.8, 50 ммоль/л хлористого магния и 50 ммоль/л дитиотретола). Для отжига затравки с матрицей, реакционный объем доводили до 10 мкл водой, смесь нагревали до 65 градусов С в течение 5 минут и затем позволяли охладиться до комнатной температуры. Для увеличения продолжительности реакции 2.5 мкл каждого из dTTP, dATP, dGTP, dCTP и ATP (все по 10 мкмоль/л) с последующим добавлением 1 мкл (1 единица) E.coli ДНК полимеразы (фрагмент Kltnow) и 1 мкл (1 единица) T4 ДНК лигазы. Затем смесь инкубировали в течение ночи при 14 градусах C и использовали для превращения E. coli JM 109 (Yanisch-Perron et al, Gene, 33, 103 /1985/), как описано Messing.
Для идентификации мутантных клонов с помощью дифференциальной гибридизации, бляшки с питательного агара переносили на фильтры Gene Screen (New England Nuclear). Фильтры сушили под действием тепла лампы и затем инкубировали в течение одного часа в 6х SSC, содержащий 1% SDS при 60 градусах C. Для гибридизации, олигонуклеотидную затравку, указанную выше (8 м.д. моля), метили по концу T4 полинуклеотидкиназой и гамма 32 p- меченным ATP, и инкубировали с фильтрами в течение ночи в 6х SSC, и 100 мг/мл ДНК спермы лосося при 37 градусах C для [Asn124] мутации, 55 градусах C для [Asn4, Ser6] мутации, 65 градусах C для [Thr125] и [Pro124, Thr125] мутации и 70 градусах C для [Asn9, Ser11] и [Asn163, Ser165] мутаций. На следующий день фильтры промывали три раза 6х SSC при комнатной температуре и подвергали авторадиографии. Если необходимо, фильтры затем промывали 6х SSC при повышенных температурах до тех пор, пока обнаруживали очень мало или совсем не обнаруживали бляшек, содержащих эритропоэтиновую сДНК последовательность дикого типа. Клоны, которые давали положительные сигналы гибридизации, в этих условиях были идентифицированы и повторно трансфекцировали в JM109 для выделения чистого клона. Анализ цепи с дидеокси терминационнной последовательностью указывал на то, что мутации присутствовали у аспарагинового, серинового, треонинового и пролинового остатков.
Двухцепочечные m13 EC-1 ДНК, несущие [Asn4, Ser6] , [Asn9, Ser11], [Asn69] , [Asn124], [Asn125], [Ser127], [Asn163, Ser165] [Thr125] и [Pro124, Thr125] замены регенерировали из JM109 трансфекцированных клеток методом кипячения (Holmes et al. Anal. Bichem., 117, 193 /1981/). ДНК усваивались BstEII и XhoII и выделяли эритропоэтиновые ДНК фрагменты с 810 парами оснований. pEC-1 усваивался BstEII с последующим частичным усваиванием BglII и 5′ концевую область полученных фрагментов дефосфорелировали бактериальной щелочной фосфатазой в 10 ммоль/л Трис, pH 8 при 60 градусах C в течение 60 минут. 7 килооснований векторный фрагмент, фрагмент BstEII-BglII, испытывающий недостаток 810 пар оснований, выделяли и лигировали в эритропоэтиновые фрагменты, приведенные выше. Полученные плазмиды (обозначенные pEC-X, где X представляет аналоговое число) содержали аналоги ДНК, кодирующие эритропоэтин, имеющий измененные аминокислотные остатки в указанных положениях.
Напротив, аналог эритропоэтина (pEC34) был сконструирован мутагенезом in vitro, который уничтожал аминокислотные остатки 41-55. Это давало в результате меньший (775 пар оснований) EPO, содержащий фрагмент BstEII-BglII. Фрагмент встраивали в pEC1 как описано выше. Для клонирования аналогов эритропоэтина, pEC34 усваивался BstEII, частично усвоенный BglII, дефосфорелировали и выделяли вектор, как описано выше. Векторный фрагмент 7 килооснований затем лигировали с эритропоэтиновыми фрагментами, как описано выше. Клонирование pEC34 позволяет легко провести различие между рекомбинантами и простыми повторно закрытыми фрагментами. Повторно закрытые фрагменты дают меньший BstEII- BglII фрагмент, чем аналоги, и они могут быть легко дифференцированы в гелях агарозы.
Эти общие процедуры, использованные для конструирования аналогов эритропоэтина, показаны в Таблицах 3, 4 и 5. Показаны замены ДНК последовательности для каждого из аналогов; кроме того, олигонуклеотидные затравки, использованные для мутагенеза, имели последовательности, комплементарные с последовательностями эритропоэтина человека.
Плазмиды, обозначенные pDEC-X (где X представляет аналоговое число), конструировали встраиванием эритропоэтиновой сДНК в pDECдельта, которая является производной плазмиды pDSальфа2. Вектор экспрессии pDSальфа2 в общем описан в Заявке PCT N WO 90/14363. pDECдельта был получен из pDSальфа2 следующими стадиями: (SEQ ID. N0:17) используют затем для генерирования [Pro124, Thr125, Thr126, Thr131] EPO.
[Asn69, Thr71] EPO и [Ser68, Asn69, Thr71] EPO конструируют добавлением сайта N-гликозилирования в Asn 69 и усилением N-гликозилирования в этом сайте. [Asn125, Thr127 EPO, [Asn125, Thr127, Thr131] EPO, [Pro124, Asn125, Ser127] EPO и [Pro124, Asn125, Thr127] EPO конструируют добавлением сайта N- гикозилирования в Asn 125 и увеличением гликозилирования в этом сайте. [Thr125, Thr126] EPO и [Pro124, Thr125, Thr126, Ser131] EPO конструируют добавлением сайта О-гликозилирования в Thr 125 и увеличением гликозилирования в этом сайте.
Источником эритропоэтиновой ДНК для мутагенеза in vitro была плазмида Hu13 эритропоэтина человека сДНК, клонированная в pUC 8 (Law et.al. Proc Natl. Acad. Sci. 83, 6920 /1986/). Плазмида ДНК, полученная из Hu13, переваривалась ферментами рестрикции BstEII и BglII, давая фрагмент ДНК, который подвергали электрофорезу в геле агарозы, и выделяли из геля эритропоэтиновый фрагмент ДНК с 810 парами оснований, используя GeneClean kit и процедуры, используемые производителем (BIO 101 Inc.). Плазмида pBRgHuEPO содержит ген эритропоэтинового генома, такой как BamHI фрагмент, включенный в производное pBR322 как описано Lin. pBRgHuEPO усваивался также BstEII и BglII, и был выделен фрагмент вектора с 6517 парами оснований. Лигирование двух фрагментов давало IGT1. Для конструирования pEC-1, pDSVL (описанный в общих чертах Lin и показанный на фиг.5 B) усваивался BamHI и выделенный фрагмент BamHI 2.8 килооснований из IGT1, содержащий эритропоэтиновую сДНК, лигировали в него.
Для того чтобы генерировать одноцепочечную ДНК для мутагенеза in vitro, pEC-1 усваивался BamHI и BglII, и выделялся фрагмент эритропоэтиновой сДНК с 820 парами оснований. Его лигировали в сайт BamHI m13mp18 с получением m13-EC-1. Одноцепочечную ДНК выделяли из супернатантов штамма E.coli RZ1032, инфицированного m13-EC-1, как описано Kunkel et al. (Methods in Enzymol. 154, 367 /1987/) и Messing (Methods in Enzymol. 101, 20 /1983/). Для мутагенеза in vitro приблизительно 1 мкг одноцепочечной ДНК и 0.2 м.д. моля одной из синтетических затравок, описанных выше, смешивали с 6 мкл буферного раствора (250 ммоль/л Трис, pH 7.8, 50 ммоль/л хлористого магния и 50 ммоль/л дитиотретола). Для отжига затравки с матрицей, реакционный объем доводили до 10 мкл водой, смесь нагревали до 65 градусов С в течение 5 минут и затем позволяли охладиться до комнатной температуры. Для увеличения продолжительности реакции 2.5 мкл каждого из dTTP, dATP, dGTP, dCTP и ATP (все по 10 мкмоль/л) с последующим добавлением 1 мкл (1 единица) E.coli ДНК полимеразы (фрагмент Kltnow) и 1 мкл (1 единица) T4 ДНК лигазы. Затем смесь инкубировали в течение ночи при 14 градусах C и использовали для превращения E. coli JM 109 (Yanisch-Perron et al, Gene, 33, 103 /1985/), как описано Messing.
Для идентификации мутантных клонов с помощью дифференциальной гибридизации, бляшки с питательного агара переносили на фильтры Gene Screen (New England Nuclear). Фильтры сушили под действием тепла лампы и затем инкубировали в течение одного часа в 6х SSC, содержащий 1% SDS при 60 градусах C. Для гибридизации, олигонуклеотидную затравку, указанную выше (8 м.д. моля), метили по концу T4 полинуклеотидкиназой и гамма 32 p- меченным ATP, и инкубировали с фильтрами в течение ночи в 6х SSC, и 100 мг/мл ДНК спермы лосося при 37 градусах C для [Asn124] мутации, 55 градусах C для [Asn4, Ser6] мутации, 65 градусах C для [Thr125] и [Pro124, Thr125] мутации и 70 градусах C для [Asn9, Ser11] и [Asn163, Ser165] мутаций. На следующий день фильтры промывали три раза 6х SSC при комнатной температуре и подвергали авторадиографии. Если необходимо, фильтры затем промывали 6х SSC при повышенных температурах до тех пор, пока обнаруживали очень мало или совсем не обнаруживали бляшек, содержащих эритропоэтиновую сДНК последовательность дикого типа. Клоны, которые давали положительные сигналы гибридизации, в этих условиях были идентифицированы и повторно трансфекцировали в JM109 для выделения чистого клона. Анализ цепи с дидеокси терминационнной последовательностью указывал на то, что мутации присутствовали у аспарагинового, серинового, треонинового и пролинового остатков.
Двухцепочечные m13 EC-1 ДНК, несущие [Asn4, Ser6] , [Asn9, Ser11], [Asn69] , [Asn124], [Asn125], [Ser127], [Asn163, Ser165] [Thr125] и [Pro124, Thr125] замены регенерировали из JM109 трансфекцированных клеток методом кипячения (Holmes et al. Anal. Bichem., 117, 193 /1981/). ДНК усваивались BstEII и XhoII и выделяли эритропоэтиновые ДНК фрагменты с 810 парами оснований. pEC-1 усваивался BstEII с последующим частичным усваиванием BglII и 5′ концевую область полученных фрагментов дефосфорелировали бактериальной щелочной фосфатазой в 10 ммоль/л Трис, pH 8 при 60 градусах C в течение 60 минут. 7 килооснований векторный фрагмент, фрагмент BstEII-BglII, испытывающий недостаток 810 пар оснований, выделяли и лигировали в эритропоэтиновые фрагменты, приведенные выше. Полученные плазмиды (обозначенные pEC-X, где X представляет аналоговое число) содержали аналоги ДНК, кодирующие эритропоэтин, имеющий измененные аминокислотные остатки в указанных положениях.
Напротив, аналог эритропоэтина (pEC34) был сконструирован мутагенезом in vitro, который уничтожал аминокислотные остатки 41-55. Это давало в результате меньший (775 пар оснований) EPO, содержащий фрагмент BstEII-BglII. Фрагмент встраивали в pEC1 как описано выше. Для клонирования аналогов эритропоэтина, pEC34 усваивался BstEII, частично усвоенный BglII, дефосфорелировали и выделяли вектор, как описано выше. Векторный фрагмент 7 килооснований затем лигировали с эритропоэтиновыми фрагментами, как описано выше. Клонирование pEC34 позволяет легко провести различие между рекомбинантами и простыми повторно закрытыми фрагментами. Повторно закрытые фрагменты дают меньший BstEII- BglII фрагмент, чем аналоги, и они могут быть легко дифференцированы в гелях агарозы.
Эти общие процедуры, использованные для конструирования аналогов эритропоэтина, показаны в Таблицах 3, 4 и 5. Показаны замены ДНК последовательности для каждого из аналогов; кроме того, олигонуклеотидные затравки, использованные для мутагенеза, имели последовательности, комплементарные с последовательностями эритропоэтина человека.
Плазмиды, обозначенные pDEC-X (где X представляет аналоговое число), конструировали встраиванием эритропоэтиновой сДНК в pDECдельта, которая является производной плазмиды pDSальфа2. Вектор экспрессии pDSальфа2 в общем описан в Заявке PCT N WO 90/14363. pDECдельта был получен из pDSальфа2 следующими стадиями:(1) HindIII сайт pDSальфа2 был подвергнут делеции путем усваивания pdsальфа2 ДНК фрагментом HindIII, обработкой HindIII “липких концов” ДНК полимеразой (фрагмент Klenow) E.coli dNTPs и повторным лигированием дефосфорелированного вектора. Полученная плазмида была pDSафльфа2дельтаH. (2) pDSальфа2дельтаH был усвоен SalI и синтетический олигонуклеотид, содержащий SV40 сплайс сигнал с SalI линкером, присоединенным к 3 концу сплайс сигнала, был лигирован в него. Синтетический олигонуклеотид имел последовательность (SEQ ID. N0: 18) (см. в конце описания). Полученная плазмида была сплайс pDSaльфa2дeльтaH. (3) сплайс pDSaльфa2дeльтaH была усвоена SalI и дефосфорелирована обработкой “липких концов” T4ДНК полимеразой и dNTPs. сДНК фрагмент BamHI- BglII эритропоэтина человека с 820 парами оснований, который был дефосфорелирован таким же способом и лигирован с плазмидой. Полученная плазмида была pDEC-1. (4) pDEC был усвоен KpnI и PvuII и дефосфорелирован обработкой “липких концов” нуклеазой фасоли маш. Плазмида была повторно лигирована с делецией отрезанного фрагмента KpnI-PvuII с получением плазмиды pDECдельта. pDEC-X плазмиды были получены из pDECдельта путем полного усваивания BstEII, вслед за частичным усваиванием BglII. Векторный фрагмент недостающих кодирующих последовательностей эритропоэтина был выделен и лигирован с фрагментами BstEII-BglII с 810 парами оснований, содержащими желаемую плазмиду. Детали конструирования некоторых аналогов, содержащих многочисленные аминокислотные замены, описывают ниже. Конструирование pDEC(N47) и pDEC(N48) pDEC(N47), который содержит asn30 thr32 va187 asn88 и thr90 мутации, был сконструирован из pDEC(N18) и pDEC(N4). pDEC(N18) был усвоен HindII и BglII, и выделяли фрагмент с 445 парами оснований. pDEC(N4) был усвоен BstEII и HindII, и был выделен фрагмент с 377 парами оснований. Эти два фрагмента были лигированы в pDECдельта, вырезанный BstEII и BglII, как описано выше, давая pDEC(N47). pDEC(N48), который содержит asn69 thr71 ser87 asn88 и thr90 мутации был сконструирован из pDEC(N14) и pDEC(N11). pDEC(N14) был усвоен HindII и BglII, был выделен фрагмент с 445 парами оснований. pDEC(N11) – был усвоен BstEII и HindII, и был выделен фрагмент с 377 парами оснований. Эти два фрагмента лигировали в pDECдельта, вырезанную BstEII и BglII, как описано выше, давая pDEC(N48). Конструирование pDEC(062) (HCG-слияние эритропоэтина) pDEC(062) был собран из pEC1 и 107 пар оснований StuI-BglII синтетического ДНК линкера, содержащего карбокси концевые области 28 аминокислот из хронического гонадотропина человека (ser-ser- ser-ser-lys-ala-pro-pro-pro-ser-leu-pro-ser-pro-ser-arg-leu-pro- gly-pro-ser-asp-thr-pro-ile-leu-pro-gln) (SEQ ID. N0: 25) (Pierce et al. Ann.Rev.Biochem. 50, 465 /1981/). Последовательность линкера представлена в конце описания. pECI был усвоен StuI и BglII и был выделен ДНК фрагмент с 610 парами оснований. Синтетический линкер был фосфорелирован ATP и полинуклеотид киназой и лигирован pEC1 фрагментом в pDECдельта, предварительно усвоенную BstEII и частично усвоенную BglII как описано выше. Конструирование pDEC(N01) pDEC(N01) был собран из pDEC(062) (HCG-EPO) и pDEC(N14) (Ser87Asn88Thr90). pDEC177 был усвоен StuI и BglII, и фрагмент ДНК с 610 парами оснований, содержащий мутации Ser87Asn88Thr90был выделен чистым геном. pDEC(062) был усвоен StuI и BglII, и был выделен фрагмент с 107 парами оснований. Эти два фрагмента ДНК были лигированы в pDECдельта, предварительно усвоенную BstEII и частично усвоенную BglII, как описано выше. Конструирование pDEC(N02) pDEC(N02) был собран из pDEC(062) (HCG-EPO) и pDEC(N47) (Asn30Thr32Val87Asn88Thr90). pDEC(N47) был усвоен StuI и BglII, и фрагмент ДНК с 610 парами оснований, содержащий мутации Asn30Thr32Val87Asn88Thr90 был выделен с помощью GeneClean. pDEC(062) был усвоен StuI и BglII, и был выделен фрагмент с 107 парами оснований. Эти два фрагмента ДНК лигировали в pDECдельта, предварительно усвоенную BstEII и частично усвоенную BglII, как описано выше. Конструирование pDEC(N16) (Ser87Asn88Thr90Ala162) pDEC(N16) был собран из pDEC(N14) (Ser87Asn88Thr90) и pDEC258 (Ala162). pDEC258 был сконструирован с использованием процедур для мутагенеза in vitro, описанных выше, и заменой AGG кодона на GCG в положении 162. pDEC(N14) был усвоен StuI и BglII и фрагмент ДНК с 610 парами оснований, содержащий мутации Ser87Asn88Thr90 был выделен с помощью GeneClean. pDEC258 был усвоен StuI и BglII, был выделен фрагмент с 210 парами оснований. Эти два фрагмента ДНК были лигированы в pDECдeльтa, предварительно усвоенную BstEII и частично усвоенную BglII как описано выше. Конструирование pDEC(R1), (R2) и (R3) Для удаления сайтов гликозилирования из pDEC(N14), m13-EPO(N14), содержащий ser87 asn88 и thr90 мутации, подвергали мутагенезу in vitro как описано выше, используя следующие затравки: 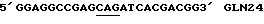 (SEQJD. N0: 21) 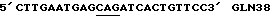 (SEQ ID. N0: 22) 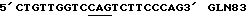 (SEQ ID. N0: 23) Полученные плазмиды были обозначены pDEC(R1) (gln24 ser87 asn88 thr90), pDEC(R2) (gln38 ser87 asn88 thr90) и pDEC(R3) (gln83 ser87 asn88 thr90). m13EC-1 также был подвергнут мутагенезу in vitro с вышеуказанными олигонуклеотидными затравками, давая pCE10 (gln24) и pEC8 (gln38). pEC9 (gln83) был сконструирован с использованием затравки 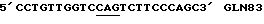 (SEQID.N0:24) сДНК клоны эритропоэтина человека и аналоги, соответствующие [Asn4, Ser6] EPO, [Asn9, Ser11] EPO, [Asn69 EPO, [Asn124] EPO, [Asn125, Ser127] EPO, [Asn163, Ser165] EPO, [Thr125] EPO и [Pro124, Thr125] EPO и сДНК клоны аналогов, описанных в Таблицах 3, 4 и 5, были перенесены в клетки COS-1 (АТСС N CRL- 1650) путем электропорации. Клетки COS-1 собирали из полуслитых чашек, промывали средой (Dulbecco модифицированной, по существу, средой, содержащей 5% фетальной сыворотки теленка и 1% L-глутамина/пенициллина/стрептомицина (Irvine Scientific) и повторно суспендировали 4х106 клеток/мл. Один мл клеток переносили в кювету для электропорации (Bio-Rad) и подвергали электропорации с Bio-Rad Gene Pulser при 25 мкФ и 1600 Вт в присутствии 100-200 мкг носителя ДНК и 2-20 мкг плазмиды ДНК, кодирующей аналог эритропоэтина. Электропорированные клетки помещали с 2  106 клеток в 60 мм чашки с культурой ткани в 5 мл среды. Два-четыре часа спустя после высевания среду заменяли 5 мл свежей среды. Кондиционированную среду собирали через 3-5 суток после электропорации.
Пример 7. Характеристика аналогов эритропоэтина 106 клеток в 60 мм чашки с культурой ткани в 5 мл среды. Два-четыре часа спустя после высевания среду заменяли 5 мл свежей среды. Кондиционированную среду собирали через 3-5 суток после электропорации.
Пример 7. Характеристика аналогов эритропоэтинаA. Определение присоединения карбогидрата Объем супернатанта, содержащий 5-20 единиц из клеток COS трансфекцированных сДНК аналогом эритропоэтина, как описано в Примере 6, были подвергнуты иммунозащите в течение ночи при комнатной температуре поликлональным антителом антиэритропоэтина кролика. 20-80 мкл 1:1 Протеин-A-сефароза в солевом фосфатном буфере (PBS) добавляли для иммуноосаждения и позволяли инкубироваться в течение одного часа при комнатной температуре. Образцы центрифугировали, промывали PBS и, где указано, шарики обрабатывали N-гликоназой для удаления N-связанных карбогидратных цепей. Образцы анализировали с помощью электрофореза на 15% SDS- полиакриламидном геле, переносили на нитроцеллюлозу и подвергали Western анализу как описано (Burnette et al. Anal. Biochem. 112, 195-203 /1981/; Elliott et al., Gene, 79, 167-180 /1989/), используя смесь моноклональных антител анти-эритропоэтина мышей. Одно из таких антител 9G8A описано у Elliott et al. /1989/, Blood.74, Supp.l, A. 1228. Анализ супернатантов COS клетки трансфекцированных [Asn69] EPO и [Asn125, Ser127] EPO сДНК свидетельствует об увеличенном размере протеина, по сравнению с последовательностью эритропоэтина человека. Этот увеличенный размер указывает на присутствие N-связанной карбогидратной цепи (фиг.7). Обработка супернатантов их COS клеток трансфекцированных [Thr125] EPO и [Pro124, Thr125] EPO сДНК N- гликоназой свидетельствует об увеличении размера протеина, по сравнению с последовательностью эритропоэтина человека. Этот увеличенный размер указывает на наличие дополнительной О-связанной карбогидратной цепи (фиг. 8). Western blot анализ других выбранных аналогов показан на фиг. 10. Для определения числа N-связанных карбогидратных цепей, присоединенных к EPO, было проведено частичное усваивание N- гликаназы. Аналоги или rHuEPO были экспрессированы в CHO клетки и была собрана кондиционированная свободной сывороткой среда. Трубки содержали 40 единиц EPO (объем доводили до 15 мкл водой). К каждой трубке добавляли 10 мкл 0.5% SDS и каждый образец кипятили в течение 3 минут. Затем добавляли следующие компоненты 10.8 мкл 0.5 моль/л фосфата натрия, pH 8.6, 5 мкл 7.5% нонидет Р40м и 1.5 мкл 250 единиц/мл N-гликаназы /Genzyme/. Образцы инкубировали в течение указанных промежутков времени при 37 градусах C. Реакцию останавливали добавлением SDS-PAGE образца буфера (смотри выше) и затем подвергали SDS-PAGE western анализу (10% акриламид), используя поликлональное антитело анти-EPO и анти-кроликовый Vectastain kit (Vector laboratories) с 4-хлорнафтолом в качестве субстрата. Анализ N-связанных цепей с использованием этого метода показан на фиг. 11 для эритропоэтина человека и аналога N14. В. Анализы активности аналога эритропоэтина RIA были выполнены согласно Ergie et.al. EIA были выполнены с CLINIGEN EIA kit (R и D систем), используя процедуры, предложенные производителем. Биологическую активность in vivo аналогов эритропоэтина определяли на супернатантах из кондиционированной CHO клетками среды, как описано ниже, используя эксгипоксический полицитемический биоанализ на мышах (Cotes et al). Активность эритропоэтина in vitro определяли с помощью анализа эритроид образующей колонии, как описано Iscove et al. Cell Physiol. 83, 309-320 /1974/ с модификацией. Мононуклеированные клетки из клеток костного мозга человека были частично очищены на ficol-paque cussion и промыты в среде Iscove до высевания, для удаления адгезированных клеток. Культура среды содержала 0.9% метилцеллюлозы и не включала никакого бычьего сывороточного альбумина. Эритроидные колонии были обнаружены через 8-10 суток культивирования. Аналоги эритропоэтина, трансфекцированные и экспрессированные в COS клетки, как описано в Примере 6, были анализированы в неочищенных супернатантах COS клетки, используя RIA, EIA и анализ на образующие эритроидные колонии. Очищенная последовательность эритропоэтина человека имела активность in vitro, которая была сравнима с RIA активностью, определенной с помощью вышеупомянутых анализов. Аналоги [Asn69] EPO, [Thr125] EPO и [Pro124, Thr125] EPO обнаруживали активность m vitro, которая была сравнима с RIA активностью и свидетельствовала о наличии дополнительных карбогидратных цепей (как определено в части A). [Thr125] EPO и аналоги N4, N11 N14, N16, N18, N47, N48, N62, N01 и N02 анализировали далее путем трансфекции сДНК клона, кодирующего аналог эритропоэтина в CHO клетках, и путем анализа CHO клеток супернатантов RIA и EIA и биологическим анализом in vivo. Результаты показаны в Таблице 6. Активности in vivo аналогов R1, R2 и R3, экспрессированных в супернатанты CHO клетки, показаны в Таблице 7. Обозначения к Таблице 6. a) Число дополнительных N-связанных цепей, установленное на основании подвижности аналогов полипептидов в SDS гелях, как описано в Примере 7A. b) Отношение активности аналога in vivo к количеству аналога эритропоэтина. Измерения активности были проведены на супернатантах аналогов CHO клетки, используя полицитемический биоанализ на мышах. Количество аналогов в супернатантах CHO клетки определяли с помощью анализов RIA и EIA, как описано в тексте. c) Подтверждение числа дополнительных карбогидратных цепей было проведено с помощью изучения миграции гликопротеина в SDS-гелях после частичного переваривания N-гликаназы, как описано выше в Примере 7A. d) О-связанная цепь у Ser присутствует в 70% молекул эритропоэтина человека. e) Аналоги, имеющие пониженное О-гликозилирование, содержат карбогидратную цепь в Ser126 меньше, чем в 70% молекул. f) Thr123 EPO имел две О-связанные цепи на более чем 60% молекул. Thr125 EPO имел две О-связанные цепи на около 40% молекул. Pro124-Thr125 EPO имел две О-связанные цепи на более чем 80% молекул. g) Эти аналоги имели, по крайней мере, три О-связанные цепи и могли иметь четыре или пять. Один HCG, как известно, имел четыре О- связанных цепей. N.T. не испытывали Отношение активности in vivo по данным RIA или EIA определяли, как описано в приложении к Таблице 6. C. Получение смесей изоформ, приготовленных из аналогов эритропоэтина [Thr125 EPO (EPO O50) Аналог [Thr125] EPO был сконструирован, как описано в разделе A Примера 6. сДНК фрагмент эритропоэтина с 810 парами оснований, несущий мутацию [Thr125] выделяли путем разрыва плазмиды pEC, содержащей мутацию [Thr125], вызванную BstEII и BglII и лигирования фрагмента pDECдельта (производное pDECальфа2) (описанной в Примере 6). Плазмиду pDECдельта, содержащую [Thr125] эритропоэтиновой сДНК, трансфекцировали в DHFR-CHO клетки. 770 мл среды, кондиционированной CHO клетками, концентрировали, используя вырезанную мембрану с молекулярным весом 10000 дальтон и диафильтрацией по отношению к 10 ммоль/л Трис-HCl, pH 8.6, до конечного объема 34 мл. 17 мл аликвоты концентрата загружали в колонку с Q-сефарозой быстрого потока (ложе объемом 5 мл), уравновешенную тем же буфером, и элюировали с линейным градиентом 0-250 ммоль/л хлористого натрия в 10 ммоль/л Трис-HCl, pH 8.6. Аликвоты фракций с колонки, либо необработанные, либо переваренные N-гликаназой, анализировали с помощью SDS-PAGE или EIF и пулы (обозначенные 2, 3 и 4) были получены из фракций изоформы и/или карбогидратной композиции. Каждый пул загружали в колонку Vydac C4 /214ТВР 2030; 1 см диаметра; 1.8-2.5 мл объемом ложа; 0.34 мл/мин/ и промывали раствором, равным двум объемам колонки 20% этанола в 10 ммоль/л Трис-HCl, pH 7.0. Колонки элюировали с линейными градиентами 20-94% этанола 10 ммоль/л Трис-HCl, pH 7.0. Пулы получали, разбавляли в 10 ммоль/л Трис- HCl, pH 7.0 и загружали в колонки с Q-сефарозой быстрого потока. Вслед за промыванием в 10 ммоль/л Трис-HCl, pH 7.0, образцы элюировали 20 ммоль/л цитрата натрия, 250 ммоль/л хлористого натрия, pH 7.0. Очищенные пулы [Thr] анализировали с помощью IEF, они показаны на фиг.9. Эти пулы были также анализированы на биологическую активность in vivo, как описано выше (Cotes et al.), и результаты показаны в Таблице 8. Ser87Asn88Thr90 EPO (EPO N14) Препарат 1 Аналог EPO N14 очищали, используя трехстадийную процедуру, состоящую из ионообменной хроматографии, хроматографии с обращенной фазой и гель фильтрационной хроматографии. В процессе ионообменной стадии, стадии полученных пулов давали смесь изоформ, содержащую более высокие уровни сиаловых кислот. Два дополнительных пула были получены в процессе хроматографии с обращенной фазой, содержащие аналог с агрегатом или без агрегата. Детали очистки представлены ниже. 1. Кондицированную CHO клетками среду, экспрессирующую аналог EPO N14, собирали и концентрировали приблизительно в 2.5 раза, используя мембрану YM10 (Amicon) с перемешанной клеткой и проводя диафильтрацию по отношению к 10 ммоль/л Трис pH 8.5. 2. Концентрированную среду загружали в приблизительно 12 А280/мл смолы с Q-сефарозой FF (Pharmacia) колонку, уравновешенную 10 ммоль/л Трис pH 8.5 при скорости потока 0.2 см/мин. 3. Вслед за загрузкой колонку промывали раствором, равным трем объемам колонки (CV) 10 ммоль/л Трис pH 8.5, и элюировали с градиентом 0-0.5 моль/л хлористого натрия/ 10 ммоль/л Трис pH 8.5 в 50 CV. Собирали 1 CV фракции. 4. Образец каждой фракции был пропущен на IEF геле pH 3-5. На основании распределения изоформы на IEF, получали фракцию пула, содержащего больше изоформ 11-18. Добавляли к пулу EDTA до конечной концентрации 1 ммоль/л. 5. Пул изоформы загружали в приблизительно 5 А280/мл смолы колонку C4 с обращенной фазой (Vydac), уравновешенную в 20% этанол/ 10 ммоль/л Трис-HCl pH 7.0 при скорости потока 2.5 см/мин. Колонку промывали 1CV 20% этанол/ 10 ммоль/л Трис pH 7.0 и элюировали с градиентом 20-94% этанол/ 10 ммоль/л Трис pH 7.0 в 30 CV при скорости потока 1 см/мин. Собирали 0.2 CV фракции. 6. Образец каждой фракции анализировали путем невосстанавливающей 12% SDS-PAGE. Два раздельных пула были получены на основании присутствия агрегата, наблюдавшегося на SDS гелях. Пул #1 содержал аналог EPO, но не агрегат. Пул #2 содержал оба варианта: и аналог EPO, и агрегат. 7. Пул #1 подвергали концентрированию приблизительно в 65 раз, а пул#2 приблизительно в 250 раз, используя Centricon 10 (Fvicon). В каждом пуле был заменен буфер на 20 ммоль/л цитрат натрия/ 100 ммоль/л хлористого натрия pH 7.0. 8. Каждый пул был очищен индивидуально на колонке BioSil SEC-250 (Dio Rad) для гель проникающей хроматографии, уравновешенной 20 ммоль/л цитрата натрия/ 100 ммоль/л хлористого натрия pH 7.0. Пулы были загружены при менее 6 А280/мл смолы при скорости потока 2.26 см/мин. Для каждого опыта были выбраны пики, соответствующие мономерным аналогам. 9. Было измерено поглощение каждого пула и части каждого пула, которые были сконцентрированы для анализа с помощью SDS-PAGE и IEF гелей. Пул #1 имел распределение изоформ 15-17 и был использован для фармакокинетических исследований и исследований по рецепторному связыванию. Препарат 2 Аналог EPO N14 был очищен с использованием трехстадийной процедуры, состоящей из ионообменной хроматографии, гель проникающей жидкостной хроматографии с обращенной фазой и хроматографии с гидроксилаппатитом. В процессе стадии ионного обмена, аналог разделяли на три пула, содержащих различные смеси изоформ. Детали очистки представлены ниже. 1. Супернатант из CHO клеток, экспрессирующих EPO N14, был собран и подвергнут приблизительно 10-кратному концентрированию, с использованием Filtron Mini-Ultrasette устройства с тангенциальным потоком и подвергнут диафильтрации по отношению к 10 ммоль/л Трис pH 8.5. 2. Концентрированную среду загружали при приблизительно 10 А280/мл смолы в колонку с Q-сефарозой FF (Pharmacia), уравновешенную в 10 ммоль/л Трис pH 8.5 при скорости потока 0.2 см/мин. 3. Вслед за загрузкой колонку промывали раствором, равным трем объемам колонки (CV), 10 ммоль/л Трис pH 8.5 и элюировали 50 объемами CV. Собирали фракцию, равную одному объему колонки CV. 4. Образец каждой фракции был подвергнут анализу на IEF геле pH 3-5. Пулы трех раздельных фракций были приготовлены на основании распределения изоформы как определено с помощью IEF. Были получены пул низкой изоформы (изоформа 4-12), пул средней изоформы (изоформа 5-15) и пул высокой изоформы (изоформа 6-18). 5. Пул каждой изоформы был очищен индивидуально на колонке Vydac C4 для гель проникающей жидкостной хроматографии с обращенной фазой. Колонка была проявлена градиентом от 0.1% TFA/вода до 0.1%/TFA/75% ацетонитрила при скорости 1% увеличения акрилонитрила в минуту. 6. Был собран пик аналога из каждого пула и разбавлен 4 объемами 80 ммоль/л Трис HCl/ 20 ммоль/л основания Трис, затем концентрирован, и буфер заменен на 10 ммоль/л Трис pH 7.2, используя растворитель, резистентный Centricon 3’S. 7. Каждый образец был разбавлен до 2 A280/мл в 10 ммоль/л Трис pH 7.2, и был добавлен равный объем 4 моль/л гидрохлорида гуанидина /GuHCl/, 10 ммоль/л CHAPS, 10 ммоль/л Трис pH 7.2 для конечной концентрации образца 1 A280/мл. Каждый образец был загружен в миниколонку с гидроксиаппатитом, уравновешенную 2 моль/л GuHC1, 5 ммоль/л CHAPS, 10 ммоль/л Трис pH 7.2. Колонка была промыта уравновешивающим буфером, и были собраны фракции, равные одному объему колонки CV, прошедшие через колонку. 8. Было измерено поглощение фракций, и были получены пулы, и буфер заменен на 10 ммоль/л Трис pH 7.2, используя Centricon 10. Было измерено поглощение каждого пула. Полученные пулы были анализированы с помощью SDS-PAGE и IEF гелей. IEF гели показаны на фиг. 12. RIA и анализ на активность in vivo были проведены как описано в Примере 7A. Активность in vivo полученных пулов изоформы представлена в Таблице 8. Пул изоформы с высоким содержанием сиаловой кислоты был использован в опытах для определения увеличения гематокрита мышей. a миллиграммы эритропоэтинового пептида были рассчитаны из данных поглощения A280 Ser87Asn88Thr90 EPO пулов изоформы, используя коэффициенты экстинкции, равные 0.93 для 1 мг/мл раствора. b стандартные отклонения для Thr125 EPO пулов изоформы не сообщаются, так как анализы по активности были проведены либо один раз, либо дважды. Пример 8 Биологические свойства аналога EPO N14 Активности пулов изоформы аналога EPO N14 рекомбинантного эритропоэтина человека (rHuEPO), и выделенной rHuEPO изоформы 14, были сравнены по данным фармакокинетических анализов, полученных из 1 ультрафиолетовых спектров, анализов по рецепторному связыванию и по изучению гематокрита. Пулы изоформы EPO N14 были приготовлены, как описано в Примере 7C. rHUEPO был приготовлен согласно Lai et al. rHuEEPO изоформа 14 была очищена следующим образом: rHuEPO, состоящий из смеси изоформ 10, II, 12, 13, 14 и 15, был загружен в колонку с Q-сефарозой быстрого потока (размером = 2.2 см диам. х 3.4 см высоты), уравновешенную 10 ммоль/л Трис pH 7.2. Загруженная колонка была приведена в равновесие 2 ммоль/л уксусной кислоты/ 6 моль/л мочевины (“A” буфер), затем был осуществлен многофазный градиент, предназначенный для оптимизации очистки изоформ 13 и 14. Градиент был 0% – 7.3% 800 ммоль/л уксусной кислоты/ 6 моль/л мочевины (“B” буфер) в 750 мл, 7.3% – 11.4% “B” буфера в 750 мл, 11.4% – 26.8% “B” буфера в 1250 мл, 26.8% – 62.4% “B” буфера в 1250 мл, затем 62.4% – 100% “B” буфера в 700 мл. Были собраны фракции 12.5 мл, нейтрализованы гидроокисью аммония, затем анализированы с помощью изоэлектрического фокусирования в полиакриламидных гелях. Эти фракции, содержащие чистую изоформу 14, были соединены вместе, концентрированы с помощью Amicon перемешиваемой кюветы, оборудованной мембраной YM- 10, и затем буфер заменен на воду. A. IV Фармакокинетические исследования Были проведены два раздельных исследования для сравнения фармакокинетических параметров аналога EPO N14 (изоформы 15-17) и выделенной изоформы 14 rHuEPO. В каждом опыте 1 мк Ci либо 125I выделенной изоформы 14, либо аналога 125I-EPO N14, или 125I-рекомбинантного эритропоэтина человека (Amersham) была проведена внутривенная инъекция в каротидную канюлю самцам крыс Spraque-Dawley весом между 310-378 г. Через различные интервалы времени после введения была собрана кровь и приготовлена сыворотка центрифугированием. Концентрация 125I-EPO (либо рекомбинантного эритропоэтина человека, выделенной изоформы 14, либо аналога EPO N14) в 0.1 мл каждого образца сыворотки были затем определены вслед за инкубированием в течение ночи при 4 градусах C в 90% этаноле. В каждом образце сыворотки, осажденном в этанол – 125I-EPO, рассчитывали гамма-счетчиком, и полученные фармакокинетические кривые показаны на фиг. 13. Были определены фармакокинетические параметры для каждой крысы с использованием PCNONLIN 4.0 нелинейного регрессионного анализа (Statistical Consultants, 1992), и результаты для каждой группы были усреднены. Результаты фармакокинетических исследований для аналога EPO N14 и выделенной изоформы 14 суммированы в Таблице 9. Как видно из Таблицы 9, существует значительное различие в выделенной сыворотке аналога EPQ N14 по сравнению с рассчитанной для рекомбинантного эритропоэтина человека. Рекомбинантный эритропоэтин человека затухает наиболее быстро в случае бета времени полураспада 3.10 часа, по сравнению с 3.97 часа для выделенной изоформы 14 и 4.36 часа для аналога EPO N14. Группа рекомбинантного эритропоэтина человека также имеет наиболее быстрое выделение – 1.78 часа, по сравнению с 2.40 часа для выделенной изоформы 14 и 3.03 часа для аналога EPO N14. В. Анализы по рецепторному связыванию Взаимодействие аналога EPO N14 (изоформы 15-17) с эритропоэтиновым рецептором было изучено с помощью анализа холодного замещения с использованием эритролейкемийных OCIMI клеток человека (Papayannopoulou et al. Blood 64 (supp. l), 116a /1984/). Повышение концентраций немеченного EPO N14 было осуществлено инкубированием клетками OCIMI вместе с постоянной концентрацией 125I-rHuEPO для определения количества EPO N14, необходимого для сравнения с 125I rHuEPO для связывания с рецептором. Для сравнения, увеличение концентраций немеченного rHuEPO сравнивалось с постоянной концентрацией 125I-rHuEPO. Немеченный EPO N14 был разбавлен буфером и добавлен в количестве 0.03 нг, 0.1 нг, 0.3 нг, 1.0 нг, 3.0 нг, 10.0 нг и 30.0 нг (на массу пептида). 0.5 нг 125I-рекомбинанты EPO человека было добавлено ко всем анализируемым трубкам с последующим добавлением приблизительно 0.5  106 OCIMI клеток. Анализируемые трубки были затем инкубированы при 37 градусах C в водяной бане на качалке в течение 2 часов. Вслед за инкубированием, растворы центрифугировали через масляный раствор дибутилфталата/дифталата с выделением несвязанного 125I-rHuEPO из 125I-rHuEPO, связанного с клетками OCIMI. Были выделены шарики клеток, и было определено количество 125I-rHuEPO, связанного с клетками, с помощью гамма-счетчика. Расчеты, связанные с клетками, были проведены, и была определена концентрация немеченного протеина, требуемая для 50% конкуренции по связыванию 125I-rHuEPO в отсутствие конкурирующего агента, с помощью анализа линейной регрессии.
Результаты трех опытов указывают на то, что средняя величина 2.67+0.73 нг немеченного EPO N14 пептида была необходима для снижения 125I-rHuEPO связывания с OCIMI клетками на 50%. В тех же трех опытах, немеченный rHuEPO, требуемый для конкуренции по связыванию 0.5 нг 125I-rHuEPO, составлял 0.51+0.15 нг. На основании этих результатов 5.25-кратный избыток EPO N14 был необходим для конкурирования связывания 125I-rHuEPO с EPO рецептором по сравнению с немеченным r-HuEPO (p меньше 0.01).
Были проведены дополнительные эксперименты для прямого сравнения между аналогом EPO N14, выделенной изоформой 14 и рекомбинантным эритропоэтином по связыванию эритропоэтинового рецептора. Результаты этого эксперимента указывают на то, что аналог EPO N14 обладает более низким сродством к рецептору, чем выделенная изоформа 14. Был необходим приблизительно двухкратный избыток аналога EPO N14 для конкуренции по связыванию 125I-rHuEPO с рецептором, по сравнению с немеченной изоформой 14 (фиг. 14).
C. Изучение гематокрита 106 OCIMI клеток. Анализируемые трубки были затем инкубированы при 37 градусах C в водяной бане на качалке в течение 2 часов. Вслед за инкубированием, растворы центрифугировали через масляный раствор дибутилфталата/дифталата с выделением несвязанного 125I-rHuEPO из 125I-rHuEPO, связанного с клетками OCIMI. Были выделены шарики клеток, и было определено количество 125I-rHuEPO, связанного с клетками, с помощью гамма-счетчика. Расчеты, связанные с клетками, были проведены, и была определена концентрация немеченного протеина, требуемая для 50% конкуренции по связыванию 125I-rHuEPO в отсутствие конкурирующего агента, с помощью анализа линейной регрессии.
Результаты трех опытов указывают на то, что средняя величина 2.67+0.73 нг немеченного EPO N14 пептида была необходима для снижения 125I-rHuEPO связывания с OCIMI клетками на 50%. В тех же трех опытах, немеченный rHuEPO, требуемый для конкуренции по связыванию 0.5 нг 125I-rHuEPO, составлял 0.51+0.15 нг. На основании этих результатов 5.25-кратный избыток EPO N14 был необходим для конкурирования связывания 125I-rHuEPO с EPO рецептором по сравнению с немеченным r-HuEPO (p меньше 0.01).
Были проведены дополнительные эксперименты для прямого сравнения между аналогом EPO N14, выделенной изоформой 14 и рекомбинантным эритропоэтином по связыванию эритропоэтинового рецептора. Результаты этого эксперимента указывают на то, что аналог EPO N14 обладает более низким сродством к рецептору, чем выделенная изоформа 14. Был необходим приблизительно двухкратный избыток аналога EPO N14 для конкуренции по связыванию 125I-rHuEPO с рецептором, по сравнению с немеченной изоформой 14 (фиг. 14).
C. Изучение гематокритаБыли проведены исследования in vivo для сравнения способности высоких и низких пулов изоформы EPO N14 (из препарата 2, описанного в Примере 7C), выделенной изоформы 14 и рекомбинантного EPO человека к увеличению гематокрита у обработанных мышей. Распределение изоформы в высоких и низких пулах изоформы EPO N14, использованное в этих исследованиях, показано на фиг. 12. Были проведены внутрибрюшинные инъекции три раза в неделю в течение полных шести недель CD1 мышам (весом около 30 г) одним и больше препаратом, приготовленным в 0.25% сывороточном альбумине мышей, или с placebo (PBS с 0.25% сывороточного альбумина мышей). Дозы эритропоэтиновых препаратов рассчитывали на массу пептида, так что мыши весом 30 г получали 0.71 мкг пептида/доза для EPO N14 высокого пула, или EPO N14 низкого пула, или изоформы 14, или стандарта r-HuEPO. Дополнительная группа доз 0.36 мкг пептид/доза была включена для EPO N14 высокого пула и изоформы 14. Гематокриты всех мышей были определены у базовой линии, и спустя две недели путем ретроорбитального кровотечения. В заключение эксперимента была собрана сыворотка от всех животных и подвергнута анализу на антитела по отношению к продукту, инъекция которого была осуществлена. Данные от животных, оцененные как отрицательные для нейтрализации антител, были использованы для последующих анализов. Как показано на фиг. 15, животные, обработанные EPO N14 пулом высокой изоформы, достигают самой высокой группы среднего гематокрита по сравнению с другими препаратами. Изоформа 14, рекомбинантный EPO человека, и EPO N14 низкий пул изоформы увеличивают гематокрит до меньшей величины. Для того чтобы сравнить различные препараты эритропоэтина в количественной форме, были рассчитаны средняя начальная скорость повышения гематокрита (0-11 суток), площадь под кривой (0-39 суток) и общее увеличение гематокрита (Таблица 10). По любому из этих критериев, EPO N14 высокий пул изоформы обнаруживал большую активность по массе пептида, чем любой другой испытанный препарат. Оба препарата: EPO N 14 высокий пул изоформы, и изоформа 14 были более активны, чем рекомбинантный EPO человека. Низкий пул EPO N14 имел самую низкую активность при использовании для сравнения любых анализов. В то время как изобретение было описано в его предпочтительных вариантах, оно не ограничивается раскрытыми вариантами, а, напротив, включает различные модификации и эквиваленты, включенные в объем изобретения, и прилагаемую формулу изобретения, объем которой находится в соответствии с более широкой интерпретацией, таким образом, что включает все такие модификации и эквиваленты. Формула изобретения
РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 17.08.2001
Номер и год публикации бюллетеня: 14-2004
Извещение опубликовано: 20.05.2004
|
||||||||||||||||||||||||||
