Патент на изобретение №2159758
|
||||||||||||||||||||||||||
(54) ЦИКЛОПЕНТАДИЕНИЛЬНЫЕ ПРОИЗВОДНЫЕ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
(57) Реферат: Изобретение описывает циклопентадиенильные производные общей формулы (I), где R, R1 и R2-H, R4-H или алкильный радикал, имеющий 1 – 5 атомов углерода, n = 6 – 10 целое число. Изобретение также описывает способ получения указанных циклопентадиенильных производных, применяемых в качестве лигандов в получении комплексов с переходными металлами, в частности с цирконием, типичными компонентами катализаторов в (со)полимеризации  -олефинов. Технический результат – использование в качестве исходных продуктов легко доступных циклоалканов, предусматривает довольно простые химические стадии, повышение выхода. 3 с. и 14 з.п. ф-лы. -олефинов. Технический результат – использование в качестве исходных продуктов легко доступных циклоалканов, предусматривает довольно простые химические стадии, повышение выхода. 3 с. и 14 з.п. ф-лы.
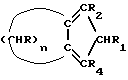
Изобретение относится к новым циколопентадиенильным производным и способу их получения. Известно, что наиболее ценные растворимые катализаторы для гомо-и сополимеризации  -олефинов состоят из комплексов циркония или титана, несущих лиганды типа бис-инденила, бис-флуоренила или смешанного флуоренила циклопентадиенильного типа (P.C. Mohring, N.J. Coville, J. Organomet. Chem. 479, 1, 1994).
Известно также, что соответствующие производные тетрагидроиндена, кроме того, что ни имеют более высокую активность, являются более эффективными во включении со/мономеров и тройных мономеров и, следовательно, являются катализаторами, находящимися в числе предпочтительных катализаторов.
Производные индена или флуорена легко доступны, но соответствующие тетрагидроинденильные производные получают прямой гидрогенизацией комплекса циркония, поскольку трудно гидрогенизировать хемоселективно исходные лиганды.
Процесс гидрогенизации комплекса показывает, тем не менее, некоторые неудобства. В самом деле, как сообщалось некоторыми специалистами (см. Е. Samuel, Bull. Soc. Chim. Fr., 3548, 1966 и S. Collins et al. в Organometallic Chem, 342, 21, 1988), было обнаружено, что в результате указанные затруднения в гидрогенизации приводят к низким выходам и/или неблагоприятным условиям.
Теперь были обнаружены новые циклопентадиенильные производные, позволяющие избежать этих недостатков, благодаря их структуре они не требуют вышеупомянутой стадии гидрогенизации комплекса с цирконием.
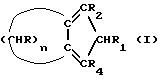
В соответствии с этим, данное изобретение касается циклопентадиенильных производных, имеющих общую формулу (I) -олефинов состоят из комплексов циркония или титана, несущих лиганды типа бис-инденила, бис-флуоренила или смешанного флуоренила циклопентадиенильного типа (P.C. Mohring, N.J. Coville, J. Organomet. Chem. 479, 1, 1994).
Известно также, что соответствующие производные тетрагидроиндена, кроме того, что ни имеют более высокую активность, являются более эффективными во включении со/мономеров и тройных мономеров и, следовательно, являются катализаторами, находящимися в числе предпочтительных катализаторов.
Производные индена или флуорена легко доступны, но соответствующие тетрагидроинденильные производные получают прямой гидрогенизацией комплекса циркония, поскольку трудно гидрогенизировать хемоселективно исходные лиганды.
Процесс гидрогенизации комплекса показывает, тем не менее, некоторые неудобства. В самом деле, как сообщалось некоторыми специалистами (см. Е. Samuel, Bull. Soc. Chim. Fr., 3548, 1966 и S. Collins et al. в Organometallic Chem, 342, 21, 1988), было обнаружено, что в результате указанные затруднения в гидрогенизации приводят к низким выходам и/или неблагоприятным условиям.
Теперь были обнаружены новые циклопентадиенильные производные, позволяющие избежать этих недостатков, благодаря их структуре они не требуют вышеупомянутой стадии гидрогенизации комплекса с цирконием.
В соответствии с этим, данное изобретение касается циклопентадиенильных производных, имеющих общую формулу (I)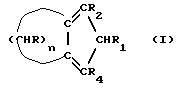 где R, R1, R2, R4 – одинаковые или различные, выбраны из: – H, – радикалов алкила, имеющих 1-5 атомов углевода, – циклоалкильных радикалов, имеющих 5-8 атомов углерода, – арильных и алкиларильных радикалов, имеющих 6-8 атомов углерода, – аралкильных радикалов, имеющих 7-9 атомов углерода; n – целое число от 2 до 18; при условии, что число R, отличающихся от H, не превышает 2, за исключением соединения, имеющего n=3, R=R1=R2=R4=H. Типичными примерами алкильных радикалов, имеющих 1-5 атомов углерода, являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил. Типичными примерами циклоалкильных радикалов, имеющих 5-8 атомов углерода, являются циклопентил, циклогексил, метилциклопентил, метилциклогексил. Типичными примерами арильных и алкиларильных радикалов, имеющих 6-8 атомов углерода, являются фенил, метилфенил, этилфенил, диметилфенил. Типичными примерами аралкильных радикалов, имеющих 7-9 атомов углерода, являются бензил, метилбензил, этилбензил, пропилбензил. В предпочтительном варианте R, R1, R2 и R4 выбирают из H и алкильных радикалов с 1-3 атомами углерода. В еще более предпочтительном варианте n выбирают из 3, 5, 6, 10, R=R2= R1=H, R4 выбирают из H и алкильных радикалов с 1-3 атомами углерода. Типичными примерами соединений, имеющих общую формулу (I), являются: – 2,4,5,6,7,8-гексагидроазулен (соединение 1а в схеме 1, где R=R1=R2=H, n=5); – 4,5,6,7,8,9-гексагидро-2H-циклопентациклооктен (соединение 1а в схеме 1, где R=R1=R2=H, n=6); – 4,5,6,7,8,9,10,11,12,13-декагидро-2H-циклопентациклододецен (соединение 1а в схеме 1, где R=R1=R2=H, n=10); – 1-метил-4,5,6,7,8,9,10,11,12,13-декагидро-2Н- циклопентациклододецен (соединение 1b в схеме 1, где R=R1=R2=H, R4=CH3, n=10). Соединения, имеющие общую формулу (I), применимы в качестве лигандов в получении комплексов с переходными металлами, в частности, с цирконием, типичными компонентами катализаторов в (со)полимеризации  – олефинов.
Способ получения химических соединений, имеющих общую формулу (I), представляет собой другой объект данного изобретения.
Этот способ, схематически представленный в схеме 1 (см. в конце описания), где соединения общей формулы (I) подразделены на соединения (2а) и (Ib) в зависимости от того, представляет ли собой R4 водород (H), или R4 отличается от H, предусматривает некоторые общие стадии и равные конечные стадии в зависимости от R4.
Способ данного изобретения, простой и оригинальный, схематически представлен в схеме 1.
В соответствии с этим данное изобретение относится к способу получения соединений общей формулы (Ia), где n обозначает целое число от 2 до 18, предпочтительно n выбирают из 3,5,6,10 и R, R1 и R2 имеют указанные выше значения, предпочтительно R=R1=R2H, включающему следующие стадии: – олефинов.
Способ получения химических соединений, имеющих общую формулу (I), представляет собой другой объект данного изобретения.
Этот способ, схематически представленный в схеме 1 (см. в конце описания), где соединения общей формулы (I) подразделены на соединения (2а) и (Ib) в зависимости от того, представляет ли собой R4 водород (H), или R4 отличается от H, предусматривает некоторые общие стадии и равные конечные стадии в зависимости от R4.
Способ данного изобретения, простой и оригинальный, схематически представлен в схеме 1.
В соответствии с этим данное изобретение относится к способу получения соединений общей формулы (Ia), где n обозначает целое число от 2 до 18, предпочтительно n выбирают из 3,5,6,10 и R, R1 и R2 имеют указанные выше значения, предпочтительно R=R1=R2H, включающему следующие стадии:а) конденсация Штоббе между кетоном общей формулы (II) (-CHR-)n+1C = O и сложным эфиром янтарной кислоты общей формулы (III) R3OOC-CHR2-CHR1-COOR3, где группы R3, одинаковые или различные, выбраны из монофункциональных алкильных радикалов с 1-5 атомами углерода, R3 предпочтительно выбирают из CH3 и C2H3 для получения  -( -(  – циклоалкенил)- – циклоалкенил)- -гидроксикарбонил-алкилпропионата, имеющего общую формулу (IV); -гидроксикарбонил-алкилпропионата, имеющего общую формулу (IV);b) вмутримолекулярная конденсация соединения (IV), полученного на стадии (а), с образованием соединения с конденсированными кольцами общей формулы (V); с) гидролиз и декарбоксилирование соединения (V), полученного на стадии (b), с образованием  – – -ненасыщенного кетона с конденсированными кольцами, имеющего общую формулу (VI); -ненасыщенного кетона с конденсированными кольцами, имеющего общую формулу (VI);d) восстановление  – – – ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (с), с образованием сопряженного (конъюгированного) диена с конденсированными кольцами, имеющего общую формулу (Ia), – ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (с), с образованием сопряженного (конъюгированного) диена с конденсированными кольцами, имеющего общую формулу (Ia),при этом стадии (b) и (c) можно проводить в обратном порядке, по сравнению с вышеуказанным, или и виде одной стадии, предпочтительно в последовательности (а), (b), (c), (d). Стадия (а) данного изобретения представляет собой типичную конденсацию между кетонами и сложными эфирами янтарной кислоты, известную как реакция Штоббе. Эта реакция (см. H. House Modern Synthetic Reactions, pp. 663-666, Organic Reactions, Volume IV, pp. 2-58) состоит в конденсации карбонильного производного с диэфиром янтарной кислоты. В случае, когда карбонильное производное представляет собой циклоалканон, как в вышеуказанном случае, образуется полуэфир замещенной циклоалкенилом янтарной кислоты, имеющей общую формулу (IV). Стадию (а) проводят в присутствии сильных оснований, таких как метоксид натрия, гидрид натрия, алкоголятов третичных спиртов, предпочтительно трет-бутилата калия, типичного не-нуклеофильного сильного основания. В отношении других экспериментальных деталей реакции Штоббе можно обратиться к указанным выше ссылкам. Типичными циклическими кетонами общей формулы (II) являются циклобутанон, циклопентанон, циклогексанон, циклогептанон, циклооктанон, циклодеканон, 2-, 3-, 4-метилциклогексанон, фенилциклогексанон, бензилциклогексанон. Одно из преимуществ способа данного изобретения состоит в том, что многие кетоны общей формулы (II) являются коммерчески доступными продуктами. Конденсация стадии (a) происходит с диэфиром янтарной кислоты общей формулы (III), предпочтительно диэтил- или диметилсукцинатом, возможно монозамещенными или дизамещенными. Стадия (b) способа данного изобретения состоит во внутримолекулярной конденсации с элиминированием (удалением) воды, продукта общей формулы (IV), полученного на стадии (a), с образованием соединения с конденсированными кольцами, имеющего общую формулу (V). Эту стадию проводят в присутствии обычных агентов конденсации, например, сильных кислот, таких как серная кислота, фтористоводородная кислота, фосфорная кислота, полифосфорная кислота, предпочтительно в присутствии полифосфорной кислоты. Вышеуказанная кислота может быть использована в виде коммерчески доступной кислоты или получена in situ смешиванием фосфорной кислоты и P2O5. В случае применения полифосфорной кислоты предпочтительно проводить стадию (b) при температуре между 70o и 110oC. Альтернативно, стадию (b) можно проводить в присутствии ZnCl2 в уксусной кислоте – уксусном ангидриде, как описано в приведенном выше цитировании из Organic Reactions. Стадия (с) состоит в гидролизе эфирной группы и в последующем декарбоксилировании соединения общей формулы (V) с образованием  – – – ненасыщенного кетона с конденсированными кольцами общей формулы (VI). Предпочтительно, реакцию проводят в кислой среде и при таких температурах, которые способствуют элиминированию и удалению CO2, предпочтительно в смеси уксусная кислота/соляная кислота при температуре флегмы. – ненасыщенного кетона с конденсированными кольцами общей формулы (VI). Предпочтительно, реакцию проводят в кислой среде и при таких температурах, которые способствуют элиминированию и удалению CO2, предпочтительно в смеси уксусная кислота/соляная кислота при температуре флегмы.
 – – – ненасыщенный кетон (VI), образованный на стадии (c), затем восстанавливают (стадия d) до циклопентадиенильного производного, имеющего общую формулу (Ia), в присутствии восстановителей, таких как боргидрид натрия или лития, гидрид натрия, гидрид лития, гидрид лития-алюминия, предпочтительно в присутствии LiAlH4.
Согласно другому варианту способа данного изобретения, стадию (с), т.е. гидролиз до карбоновой кислоты и последующее декарбоксилирование, можно проводить перед стадией внутримолекулярной конденсации (b) или эти две стадии можно проводить в виде единой стадии путем выбора наиболее пригодных условий реакции.
Способ данного изобретения необязательно требует выделения отдельных продуктов реакции в конце отдельных стадий.
Кроме того, преимущества, что способ использует в качестве исходных продуктов легко доступные циклоалканоны, способ предусматривает довольно простые химические стадии и имеет удовлетворительный общий выход.
Данное изобретение откосится также к способу получения соединений формулы (Ib), где n обозначает целое число от 2 до 18, предпочтительно выбирают из 3,5,6,10, R, R1, R2, R4 имеют указанное значение, но с условием, что R4 отличается от H, предпочтительно R=R1=R2=H, включающими следующие стадии: – ненасыщенный кетон (VI), образованный на стадии (c), затем восстанавливают (стадия d) до циклопентадиенильного производного, имеющего общую формулу (Ia), в присутствии восстановителей, таких как боргидрид натрия или лития, гидрид натрия, гидрид лития, гидрид лития-алюминия, предпочтительно в присутствии LiAlH4.
Согласно другому варианту способа данного изобретения, стадию (с), т.е. гидролиз до карбоновой кислоты и последующее декарбоксилирование, можно проводить перед стадией внутримолекулярной конденсации (b) или эти две стадии можно проводить в виде единой стадии путем выбора наиболее пригодных условий реакции.
Способ данного изобретения необязательно требует выделения отдельных продуктов реакции в конце отдельных стадий.
Кроме того, преимущества, что способ использует в качестве исходных продуктов легко доступные циклоалканоны, способ предусматривает довольно простые химические стадии и имеет удовлетворительный общий выход.
Данное изобретение откосится также к способу получения соединений формулы (Ib), где n обозначает целое число от 2 до 18, предпочтительно выбирают из 3,5,6,10, R, R1, R2, R4 имеют указанное значение, но с условием, что R4 отличается от H, предпочтительно R=R1=R2=H, включающими следующие стадии:а) конденсация Штоббе между кетоном, имеющим общую формулу (II) (-CHR-)n+1C = O, и сложным эфиром янтарной кислоты, имеющим общую формулу (III) R3OOC-CHR2-CHR1-COOR3, где группы R3, одинаковые или различные, выбраны ив монофункциональных алкильных радикалов с 1-5 атомами углерода, предпочтительно R3, выбирают из CH3 и C2H5, с образованием  -( -(  – циклоалкенил)- – циклоалкенил)-  – гидроксикарбонилалкилпропионата, имеющего общую формулу (IV); – гидроксикарбонилалкилпропионата, имеющего общую формулу (IV);b) внутримолекулярная конденсация соединения (IV), полученного на стадии (а), с образованием соединения с конденсированными кольцами обшей формулы (V); c) гидролиз и декарбоксилирование соединения (V), полученного на стадии (b), с образованием  – – – ненасыщенного кетона с конденсированными кольцами общей формулы (VI); – ненасыщенного кетона с конденсированными кольцами общей формулы (VI);d) реакция  – – – ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (с), с алкильным, аралкильным, алкиларильным, циклоалкильными производным щелочного металла и последующий гидролиз с образованием сопряженного (коньюгированного) диена с конденсированными кольцами, имеющего общую формулу (Ib), причем стадии (b) и (c) можно проводить в обратном порядке по сравнению с вышеуказанными или в виде одной стадии, предпочтительно в последовательности (а), (b), (c), (d).
Что касается стадий (а)-(c), то их проводят при тех же самых условиях, которые указаны для синтеза соединений (Ia). Стадию (d) проводят посредством реакции – ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (с), с алкильным, аралкильным, алкиларильным, циклоалкильными производным щелочного металла и последующий гидролиз с образованием сопряженного (коньюгированного) диена с конденсированными кольцами, имеющего общую формулу (Ib), причем стадии (b) и (c) можно проводить в обратном порядке по сравнению с вышеуказанными или в виде одной стадии, предпочтительно в последовательности (а), (b), (c), (d).
Что касается стадий (а)-(c), то их проводят при тех же самых условиях, которые указаны для синтеза соединений (Ia). Стадию (d) проводят посредством реакции  – – – ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (с), с алкильным, аралкильным, алкиларильным, циклоалкильным производным щелочного металла, предпочтительно лития. Углеводородное производное лития является функцией R4, который хотят ввести в соединение общей формулы (Ib). Так, например, а случае, когда хотят получить соединение (Ib), в котором R4 представляет собой CH3, используют метиллитий; в случае, когда хотят получить соединение (Ib), в котором R4 представляет собой -C2H5, используют этиллитий.
Затем стадия (d) предусматривает стадию последующего гидролиза, предпочтительно проводимого при кислотном катализе, а затем стадию дегидратации, предпочтительно проводимой также в присутствии кислотного катализа. Полученный таким образом продукт (Ib) можно выделить в соответствии с обычными способами.
Следующие далее примеры даются для лучшей иллюстрации данного изобретения.
Пример 1 – ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (с), с алкильным, аралкильным, алкиларильным, циклоалкильным производным щелочного металла, предпочтительно лития. Углеводородное производное лития является функцией R4, который хотят ввести в соединение общей формулы (Ib). Так, например, а случае, когда хотят получить соединение (Ib), в котором R4 представляет собой CH3, используют метиллитий; в случае, когда хотят получить соединение (Ib), в котором R4 представляет собой -C2H5, используют этиллитий.
Затем стадия (d) предусматривает стадию последующего гидролиза, предпочтительно проводимого при кислотном катализе, а затем стадию дегидратации, предпочтительно проводимой также в присутствии кислотного катализа. Полученный таким образом продукт (Ib) можно выделить в соответствии с обычными способами.
Следующие далее примеры даются для лучшей иллюстрации данного изобретения.
Пример 1Синтез 2,4,5,6,7,8-гексагидроазулена (соединения схемы 1, в котором R= R1=R2=H, n=5). К раствору циклопентанона, соединения (II), где n=5, (56 г, 0,5 моль) и диэтилсукцината, соединения (III), где оба R3 равны -C2H5, 110 г (0,63 моль), в 500 мл N,N-диметилформамида (DMF) медленно добавляют трет-бутилат калия (75 г, 0,67 моль) (приблизительно в течение 1 часа), поддерживая температуру между 20 и 30oC. В конце получают желтую суспензию, которую после приблизительно одного часа опять растворяют, получая затем полное отверждение продукта реакции. Всю массу выливают приблизительно в 2 л воды, получая прозрачный раствор. Раствор экстрагируют несколько раз этиловым эфиром и затем водный раствор подкисляют до pH 2-3 при помощи разбавленной HCl. Подкисленный водный раствор экстрагируют затем эфиром, и органический экстракт, после промывания водой до нейтрального pH и после высушивания, упаривают. 118 г (99% выход)  -( -(  – циклогептинил )- – циклогептинил )- – гидроксикарбонилэтилпропионата (соединения IV) получают в чистом виде согласно анализу ЯМР.
Затем полуэфир (IV) добавляют к смеси, состоящей из 400 г H3PO4 (85%) и 650 г P2O3, поддерживая температуру между 90 и 92oC.
По окончании добавления эту температуру поддерживают в течение дополнительных 4 ч, во время которых происходит обильное образование пены.
Затем смесь гидролизуют водой и экстрагируют диэтиловым эфиром. Эфирный экстракт нейтрализуют и сушат. После выпаривания растворителя получают 35 г неочищенного остатка (64% выход продукта V), который высыпают в 100 мл AcOH, 100 мл воды и 10 мл концентрированной HCl и затем поддерживают при температуре флегмы в течение одной ночи. Реакционную массу разбавляют водой и экстрагируют петролейным эфиром. После нейтрализации, сушки и выпаривания растворителя получают 16 г 3,4,5,6,7,8-гексагидро-2Н-азулен-1-она (64% выход продукта VI).
16 г продукта (VI), растворенного в 200 мл диэтилового эфира, добавляют к раствору 3,0 г LiAlH4 в 300 мл диэтилового эфира, поддерживая температуру между 5 и 10oC. Затем реакционную смесь гидролизуют, эфирный слой отделяют и водную фазу экстрагируют опять 200 мл диэтилового эфира.
Эфирные экстракты (800 мл) после нейтрализации и обезвоживания обрабатывают 1,0 г п-толуолсульфокислоты в течение 1,5 ч при комнатной температуре. Затем органическую фазу нейтрализуют NaHCO3 и выпаривают. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя ее петролейным эфиром.
14 г 2,4,5,6,7,8-гексагидроазулена (соединения Ia с n = 5) получают с выходом 98% от продукта (VI) и 40% от исходного циклогептанона. Соединение имеет следующий ЯМР-спектр: – гидроксикарбонилэтилпропионата (соединения IV) получают в чистом виде согласно анализу ЯМР.
Затем полуэфир (IV) добавляют к смеси, состоящей из 400 г H3PO4 (85%) и 650 г P2O3, поддерживая температуру между 90 и 92oC.
По окончании добавления эту температуру поддерживают в течение дополнительных 4 ч, во время которых происходит обильное образование пены.
Затем смесь гидролизуют водой и экстрагируют диэтиловым эфиром. Эфирный экстракт нейтрализуют и сушат. После выпаривания растворителя получают 35 г неочищенного остатка (64% выход продукта V), который высыпают в 100 мл AcOH, 100 мл воды и 10 мл концентрированной HCl и затем поддерживают при температуре флегмы в течение одной ночи. Реакционную массу разбавляют водой и экстрагируют петролейным эфиром. После нейтрализации, сушки и выпаривания растворителя получают 16 г 3,4,5,6,7,8-гексагидро-2Н-азулен-1-она (64% выход продукта VI).
16 г продукта (VI), растворенного в 200 мл диэтилового эфира, добавляют к раствору 3,0 г LiAlH4 в 300 мл диэтилового эфира, поддерживая температуру между 5 и 10oC. Затем реакционную смесь гидролизуют, эфирный слой отделяют и водную фазу экстрагируют опять 200 мл диэтилового эфира.
Эфирные экстракты (800 мл) после нейтрализации и обезвоживания обрабатывают 1,0 г п-толуолсульфокислоты в течение 1,5 ч при комнатной температуре. Затем органическую фазу нейтрализуют NaHCO3 и выпаривают. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя ее петролейным эфиром.
14 г 2,4,5,6,7,8-гексагидроазулена (соединения Ia с n = 5) получают с выходом 98% от продукта (VI) и 40% от исходного циклогептанона. Соединение имеет следующий ЯМР-спектр:1H ЯМР (CDCl3,  м.д. отн. TMs): 5,96 (с, шир. 2H), 2,84 (т, 2H, J = 2 Гц), 2,47 (м, 4H), 1,61 (м, 6H).
Пример 2 м.д. отн. TMs): 5,96 (с, шир. 2H), 2,84 (т, 2H, J = 2 Гц), 2,47 (м, 4H), 1,61 (м, 6H).
Пример 2Синтез 4,5,6,7,8,9-гексагидро-2Н-циклопентациклооктена (соединения Ia схемы 1, где R=R1=R2=H, n=6). Готовят раствор 63 г (0,5 моль) циклооктанона (п) и 110 г (0,63 моль) диэтилсукцината. К этому раствору малыми порциями добавляют 75 г (0,67 моль) трет-бутилата калия. После добавления смесь оставляют при перемешивании в течение 4 чв. Оранжевую массу гидролизуют водой и льдом, подкисляют и экстрагируют диэтиловым эфиром. При выпаривании получают 140 г неочищенного полутвердого вещества, содержащего два продукта в соотношении 84:16. 70 г полученного таким образом неочищенного эфира добавляют к полифосфорной кислоте (состоящей из 300 г 85% H3PO4 и 450 г P2O5). Экзотермическая реакция имеет место, и при 70oC эфир переходит в раствор, масса буреет и температура поднимается до 92oC. Реакционную смесь перемешивают приблизительно в течение 1/2 ч. Температура снижается до 80oC. Реакционную смесь выливают в лед, экстрагируют диэтиловым эфиром, нейтрализуют водным раствором NaHCO3, обезвоживают и растворитель выпаривают. Получают 35 г коричневого масла. Готовят смесь, содержащую 35 г неочищенного указанного выше масла, 100 мл AcOH, 100 мл воды 10 мл концентрированной HCl. Эту смесь поддерживают при температуре флегмы в течение 6 ч, в конце этого периода времени гидролизуют и экстрагируют диэтиловым эфиром. При этом отделяется много пеков. Смесь промывают NaOH (пеки растворяются) и водой, обезвоживают и растворитель выпаривают. Получают 12 г желтого масла. Эти 12 г желтого масла (соответствующего продукту VI), растворенного в 100 мл диэтилового эфира, добавляют к раствору 3,0 г LiAlH4 в 200 мл диэтилового эфира, поддерживая температуру между 5 и 10oC. Затем реакционную смесь гидролизуют, эфирный слой отделяют и водную фазу экстрагируют 100 мл диэтилового эфира. Эфирные экстракты (400 мл) после нейтрализации и обезвоживания обрабатывают 1,0 г п-толуолсульфокислоты в течение 1,5 ч при комнатой температуре. Затем органическую фазу нейтрализуют NaHCO3 и выпаривают. Полученный остаток очищают хроматографией на колонке с силикагелем посредством элюирования петролейным эфиром. 7 г продукта (Ia), чистого согласно ЯМР и ГХ-анализам, получают с выходом, по сравнению к исходному циклооктанону (II), 20%. (П), 201. Спектр ЯМР полученного таким образом 4,5,6,7,8,9-гексагидро-2Н- циклопентациклооктена следующий: 1H ЯМР (CDCl3,  м.д. относ. TMS): 6,02 (т, 2H), 2,88 (шир.с, 2H), 2,50 (т, 4H), 1,70-1,40 (м, 8H).
Пример 3 м.д. относ. TMS): 6,02 (т, 2H), 2,88 (шир.с, 2H), 2,50 (т, 4H), 1,70-1,40 (м, 8H).
Пример 3Синтез 4,5,6,7,8,9,10,11,12,13-декагидро-2Н-циклопентациклододецена (соединения Ia схемы 1, где R=R1=R2=H, n=10). К раствору 100 г (0,549 моль) циклододеканона (соединения II, n =10) в 700 мл THF (тетрагидрофурана) медленно (приблизительно в течение 1 ч) добавляют 70 г трет-бутилата калия. В конце добавления получают желтую суспензию, которую перемешивают в течение 1 ч. Все содержимое реакции выливают приблизительно в 2 л воды, получая прозрачный раствор. Водный раствор промывают несколько раз диэтиловым эфиром и затем подкисляют до pH при помощи разбавленной HCl. Затем водный раствор экстрагируют эфиром и органический экстракт после промывания водой до нейтральности и после высушивания выпаривают. Получают 160 г (94% выход) продукта, имеющего низкую точку плавления (продукта IV в схеме 1, где n=10, R=R1=R2=H, R3=Et). Полученный таким образом эфир (120 г, 0,387 моль) добавляют (переливают) а течение 1 ч в колбу, поддерживаемую приблизительно 93-95oC, содержащую 2,5 кг полифосфорной кислоты, имеющей содержание P2O5 84%. По завершении добавления температуру повышают до 96-97oC и смесь оставляют при перемешивании на 4 ч. Затем смесь гидролизуют водой и экстрагируют диэтиловым эфиром. Эфирный экстракт нейтрализуют и сушат. После выпаривания растворителя получают 90 г неочищенного остатка, чистого при анализе ГХ (продукта V в схеме 1, где n= 10, R=R1=R2=H, R3=Et). Полученное твердое вещество помещают в раствор, состоящий из 125 мл AcOH, 125 мл воды и 10 мл концентрированной HCl, и поддерживают при температуре флегмы в течение 20 ч. Реакционную массу разбавляют водой к экстрагируют петролейным эфиром. После нейтрализации, высушивания и выпаривания растворителя остаток перегоняют под вакуумом и собирают фракцию, которая отгоняется при 125-130oC/0,2 мм рт.ст. Получают 43 г (51% выход) продукта VI в схеме 1, имеющего n=10, R=R1=R2=H). 24 г (0,11 моль) полученного таким образом продукта растворяют в 200 мл диэтилового эфира и затем добавляют к раствору 3,0 г LiAlH4, в 300 мл диэтилового эфира, поддерживая температуру между 5 и 10oC. Затем реакционную смесь гидролизуют некоторым количеством разбавленной HCl, эфирный слой отделяют и водную фазу экстрагируют еще раз 200 мл диэтилового эфира. Эфирные экстракты (800 мл) после нейтрализации в обезвоживания обрабатывают 2,7 г п-толуолсульфокислоты в течение 1,5 ч при комнатной температуре, затем при 30-35oC в течение 5-6 ч, до исчезновения спирта (TLC, тонкослойная хроматография). Затем органическую фазу нейтрализуют NaHCO3 и выпаривают. Полученный остаток очищают хроматографией на колонке с силикагелем путем элюирования петролейным эфиром. Получают 21 г (99% выход) смеси, состоящей из двух продуктов, в соотношении 81:19, в которой основной продукт представляет собой 4,5,6,7,8,9,10,11,12,13-декагидро-2H-циклопентациклододецил (соединение Ia в схеме 1, n = 10, R=R1=R2=H). Пример 4 Синтез 1-метил-4,5,6,7,8,9,10,1,12,13-декагидро-2H-циклопентациклододецена (соединения Ib в схеме 1, где R=R1=R2=H, R4=CH3, n=10). К раствору в 100 мл диэтилового эфира 10 г (0,045 моль) карбонильного производного, полученного в примере 3 (продукта VI в схеме 1, n=0, R=R1=R2= H), поддерживаемому при -70oC, добавляют 30 мл раствора 1,6 М MeLi в диэтиловом эфире. Смесь оставляют при перемешивании на ночь, затем гидролизуют эфирную фазу отделяют, добавляют 1 г п-толуолсульфокислоты и смесь оставляют при перемешивании на 2 ч. Смесь нейтрализуют насыщенным раствором бикарбоната натрия, сушат на Na2SO4 и растворитель выпаривают. Продукт элюируют на колонке с силикагелем, используя петролейный эфир, и собирая первую фракцию. Получают 7 г продукта, состоящего из двух изомеров в соотношении 3:1, в результате газовой хроматографии. Основной продукт этой смеси состоит из 1-метил- 4,5,6,7,8,9,10,11,12,13-декагидро-2Н-циклопентациклододецена. Формула изобретения
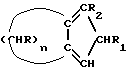 где n = 5 – 10, целое число; R=R1=R2=H, отличающийся тем, что он включает следующие стадии: a) конденсация Штоббе между кетоном общей формулы (II) 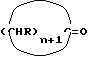 где R – водород; n = 5 – 10, целое число, и сложным эфиром янтарной кислоты общей формулы (III) 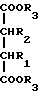 где группы R3, одинаковые или различные, выбирают из монофункциональных алкильных радикалов, имеющих 1 – 5 атомов углерода, предпочтительно R3 выбирают из CH3 или C2H5; R1 и R2 имеют указанные значения, с образованием  -( -(  -циклоалкенил)- -циклоалкенил)- -гидроксикарбонилпропионата общей формулы (IV) -гидроксикарбонилпропионата общей формулы (IV)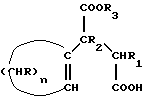 где R, R1, R2, R3 и n имеют указанные значения; b) внутримолекулярная конденсация соединения (IV), полученного на стадии (a), с образованием соединения с конденсированными кольцами, имеющего общую формулы (V) 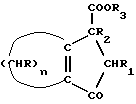 где R, R1, R2, R3 и n имеют указанные значения; c) гидролиз и декарбоксилирование соединения (V), полученного на стадии (b), с образованием  – – -ненасыщенного кетона с конденсированными кольцами, имеющего общую формулу (VI) -ненасыщенного кетона с конденсированными кольцами, имеющего общую формулу (VI)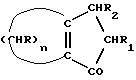 где R, R1, R2 и n имеют указанные значения; d) восстановление  – – -ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (c), с образованием сопряженного (конъюгированного) диена с конденсированными кольцами, имеющего общую формулу (Ia).
7. Способ по п.6, отличающийся тем, что в соединении формулы (Ia) n = 5 и 10.
8. Способ по п.6, отличающийся тем, что стадию (a) проводят в присутствии трет-бутилата калия.
9. Способ по п.6, отличающийся тем, что стадию (b) проводят в присутствии полифосфорной кислоты как таковой или приготовленной in situ.
10. Способ по п.6, отличающийся тем, что стадию (c) проводят при кислых pH.
11. Способ по п.6, отличающийся тем, что восстановление на стадии (d) проводят LiAlH4.
12. Способ получения циклопентадиенильных производных общей формулы (Ib) -ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (c), с образованием сопряженного (конъюгированного) диена с конденсированными кольцами, имеющего общую формулу (Ia).
7. Способ по п.6, отличающийся тем, что в соединении формулы (Ia) n = 5 и 10.
8. Способ по п.6, отличающийся тем, что стадию (a) проводят в присутствии трет-бутилата калия.
9. Способ по п.6, отличающийся тем, что стадию (b) проводят в присутствии полифосфорной кислоты как таковой или приготовленной in situ.
10. Способ по п.6, отличающийся тем, что стадию (c) проводят при кислых pH.
11. Способ по п.6, отличающийся тем, что восстановление на стадии (d) проводят LiAlH4.
12. Способ получения циклопентадиенильных производных общей формулы (Ib)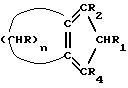 где R, R1, R2 = H; n = 5 – 10, целое число; R4 – алкильный радикал, имеющий 1 – 5 атомов углерода, отличающийся тем, что он включает следующие стадии: a) конденсация Штоббе между кетоном общей формулы (II) 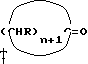 где R=R1=R2=H; n = 5 – 10, целое число, и сложным эфиром янтарной кислоты, имеющим общую формулу (III) 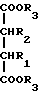 где группы R3, одинаковые или различные, выбирают из монофункциональных алкильных радикалов, имеющих 1 – 5 атомов углерода; R1 и R2 имеют указанное значение, с образованием  -( -(  -циклоалкенил)- -циклоалкенил)- -гидроксикарбонил-алкилпропионата общей формулы (IV) -гидроксикарбонил-алкилпропионата общей формулы (IV)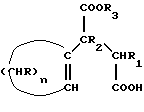 где R, R1, R2, R3 и n имеют указанные значения; b) внутримолекулярная конденсация соединения (IV), полученного на стадии (a), с образованием соединения с конденсированными кольцами, имеющего общую формулы (V) 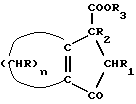 где R, R1, R2, R3 и n имеют указанные значения; c) гидролиз и декарбоксилирование соединения (V), полученного на стадии (b), с образованием  – – -ненасыщенного кетона с конденсированными кольцами, имеющего общую формулу (VI) -ненасыщенного кетона с конденсированными кольцами, имеющего общую формулу (VI)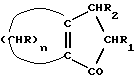 где R, R1, R2 и n имеют указанные значения; d) реакция  – – -ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (c), с соединением формулы LiR4, где R4 – алкильный радикал, имеющий 1 – 5 атомов углерода, и последующий гидролиз с образованием сопряженного (конъюгированного) диена с конденсированными кольцами, имеющего общую формулу (Ib).
13. Способ по п.12, отличающийся тем, что R3 – CH3 или C2H5.
14. Способ по п.12, отличающийся тем, что n = 10.
15. Способ по п.12, отличающийся тем, что стадию (a) проводят в присутствии трет-бутилата калия.
16. Способ по п.12, отличающийся тем, что стадию (b) проводят в присутствии полифосфорной кислоты как таковой или приготовленной in situ.
17. Способ по п.12, отличающийся тем, что стадию (c) проводят при кислых pH.
Приоритет по пунктам: -ненасыщенного кетона с конденсированными кольцами (VI), полученного на стадии (c), с соединением формулы LiR4, где R4 – алкильный радикал, имеющий 1 – 5 атомов углерода, и последующий гидролиз с образованием сопряженного (конъюгированного) диена с конденсированными кольцами, имеющего общую формулу (Ib).
13. Способ по п.12, отличающийся тем, что R3 – CH3 или C2H5.
14. Способ по п.12, отличающийся тем, что n = 10.
15. Способ по п.12, отличающийся тем, что стадию (a) проводят в присутствии трет-бутилата калия.
16. Способ по п.12, отличающийся тем, что стадию (b) проводят в присутствии полифосфорной кислоты как таковой или приготовленной in situ.
17. Способ по п.12, отличающийся тем, что стадию (c) проводят при кислых pH.
Приоритет по пунктам:30.08.95 по пп.7 – 11, 13 – 17; 21.12.95 по пп.1 – 6 и 12. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 30.08.2009
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||