Патент на изобретение №2317074
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) ИНГИБИТОР ДИФФЕРЕНЦИРОВКИ КРОВЕТВОРНЫХ КЛЕТОК-ПРЕДШЕСТВЕННИКОВ
(57) Реферат:
Изобретение относится к области медицины и может быть использовано для лечения людей с заболеваниями, связанными с дифференцировкой кроветворных клеток-предшественников. В качестве ингибитора дифференцировки кроветворных клеток-предшественников используется органическое соединение селена, а именно: 9-фенил-симметричный – октагидроселеноксантен. Данное изобретение обеспечивает повышение эффективности применения облучения и цитостатиков за счет снижения повреждающего действия указанных агентов на процесс кроветворения, тем самым, обеспечивая более эффективную защиту нормальных тканей. 10 табл.
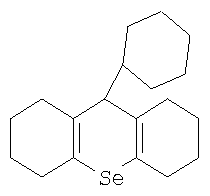
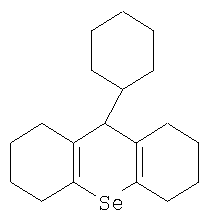
Изобретение относится к области медицины и может быть использовано при лечении людей с заболеваниями, сопровождающимися дифференцировкой кроветворных клеток-предшественников, а также для их профилактики. Кроветворение представляет собой сложный многостадийный процесс клеточных делений и дифференцировок, в результате которого образуются зрелые, функционально полноценные клетки крови. Система крови представляет собой чрезвычайно динамичную, постоянно обновляющуюся ткань, в норме быстро и точно реагирующую на изменяющиеся запросы организма. Выделяют 6 основных классов клеток крови, из которых 3 класса включают в себя клетки-предшественницы кроветворения. Класс стволовых клеток состоит из наиболее ранних кроветворных клеток, дающих начало всем клеткам системы крови. Для дифференцировки и пролиферации стволовых клеток необходимо кроветворное микроокружение, состоящее из клеток стромы (макрофагов, фибробластов, эндотелиальных, жировых и ретикулярных клеток), микрососудов и внеклеточного матрикса (фибронектин, гемонектин, ламинин, коллаген и мукополисахариды – сульфат гепарана). Следующий класс клеток составляют ближайшие потомки стволовой клетки – полипотентные или бипотентные (коммитированные) клетки-предшественницы, дифференцировочный потенциал которых ниже стволовых. Эти клетки образуют колонии в различных средах, поэтому их называют колониеобразующими единицами (КОЕ). Следующий класс клеток составляют унипотентные клетки предшественницы, которые могут дифференцироваться только в направлении определенного ростка. Известные способы защиты органов кроветворения от цитотоксического действия радиации и химиотерапии включают использование различных препаратов, большинство из которых являются антиоксидантами. Повышение устойчивости клеток к вредным агентам, вызываемое антиоксидантами обусловлено двумя различными механизмами. Основной из них, как общеизвестно, обусловлен способностью антиоксидантов связывать окислительные радикалы образующихся в клетках, главным образом в момент облучения. Указанный механизм эффективен только в тех случаях, когда антиоксидант присутствует в клетках в момент образования радикалов, например в момент действия ионизирующей радиации или цитостатиков. Эффективность защиты с помощью этого механизма в довольно широких пределах прямо пропорционально содержанию антиоксидантов в клетках. При этом радиопротекторные свойства проявляются при действии излучения и в малых и в больших дозах. Основным недостатком этого механизма действия антиоксидантов при лечении онкологических больных является то, что радиозащитный эффект при их введении в организм проявляется не только в отношении нормальных, но и злокачественно перерожденных клеток, что сильно ограничивает использование антиоксидантов для защиты кроветворных и других клеток организма при противоопухолевой терапии. Радиозащитный эффект антиоксидантов может нивелировать максимально две трети, поражающего действия ионизирующего излучения. Второй механизм повышения радиоустойчивости описан в патенте РФ №2234918 /А61К 31/375, 2004/ и связан с прооксидантными свойствами антиоксидантов. Он обусловлен изменением биологических свойств клеток, происходящих при введении антиоксидантов, и выражающимся проявлением так называемого адаптивного ответа. Адаптивный ответ возникает при введении только определенных количеств антиоксидантов и проявляется, в основном, после элиминации введенного экзогенного антиоксиданта из клеток. Основное достоинство этого механизма повышения радиоустойчивости заключается в длительности его проявления. Он регистрируется, начиная с 4 часа после введения препарата, и длится в течение 7 и более дней. Основным недостатком этого механизма является то, что он действует в основном при облучении в небольших повреждающих дозах. При этом повышении радиочувствительности не происходит более чем в 1,3-1,5 раза. В настоящее время исследователи сфокусировали свои усилия на изучении клеток-предшественников у животных, подвергавшихся различным онкогенным или лучевым воздействиям. Полагают, что стволовые и другие ранние клетки-предшественники гемопоэза играют важную роль в процессах злокачественного роста и метастазирования опухолей. Известно, что регулируют пролиферацию и дифференцировку клеток-предшественниц кроветворения, а также функцию зрелых клеток крови гемопоэтические факторы роста, такие как эритропоэтин и фактор роста – ликвер, которые сейчас используются в клинической практике. Данные факторы являются естественными стимуляторами роста и дифференциации кроветворных клеток и используются при различного рода иммунных нарушениях. В то же время существенное значение имеют и ингибиторы указанных функций кроветворных клеток. В частности, было показано, что коррекция пролиферации и дифференцировки СКК in vitro с помощью ингибирующего воздействия может создать условия для более эффективной аутотрансплантации гемопоэтических клеток при аутоиммунной патологии. В качестве ближайшего аналога может быть указан способ дифференциальной защиты нормальных стволовых клеток млекопитающего от воздействия химиотерапии или излучения, заключающийся в назначении защищающей стволовые клетки ингибирующей их пролиферацию композиции, полипептида, выбранного из группы, включающей альфа-глобиновую цепь гемоглобина, бета-глобиновую цепь гемоглобина, гамма-глобиновую цепь гемоглобина, дельта-глобиновую цепь гемоглобина, ипсилон-глобиновую цепь гемоглобина и зета-глобиновую цепь гемоглобина, и (b) фармацевтически приемлемый носитель (RU 2186579 С1, 2002.08.10). Данное решение касается регуляции путем воздействия на пролиферацию стволовых клеток, которые относятся к одному из типов кроветворных клеток-предшественников. Однако о средствах для лечения состояний, сопровождающихся дифференцировкой, вызывающих временное блокирование дифференцировки кроветворных клеток-предшественников и тем самым обеспечивающих протекцию нормальных тканей, нам не известно. Задача настоящего изобретения заключается в создании способа временного ингибирования дифференцировки кроветворных клеток-предшественников. Предложено ингибирование дифференцировки кроветворных клеток-предшественников осуществлять введением в организм больного органического соединения селена, а именно 9-фенил-симметричного-октагидроселеноксантена формулы
В частности, применение 9-фенил-симметричного-октагидроселеноксантена в качестве ингибитора дифференцировки позволяет защитить клетки-предшественники костного мозга от действия радиации в дозе до 1,5 Гр и от действия цитостатиков. В случае, если дифференцировка клеток-предшественников связана с опухолью, на которую воздействуют радиацией или химиотерапевтическим препаратом, за 5-9, предпочтительно за 7 суток до момента воздействия в организм однократно вводят 9-фенил-симметричный – октагидроселеноксантен, вызывающий блокирование дифференцировки стволовых кроветворных клеток. Введение в организм может быть произведено перорально или инъекционно в предпочтительной дозе от 0,1 до 5 мг на кг массы тела. В момент применения радиационного воздействия или введения цитостатиков дифференцирующиеся клетки-предшественники находятся на стадии дифференцировки, которая более устойчива к действию цитотоксических агентов. Биологическая активность обусловлена главным образом не самим селеном, а молекулярным строением соединения в целом. В пользу такого утверждения свидетельствует следующее. Соединения ксантенового ряда, к которым относится заявляемое вещество, обладают достаточно широким спектром биологических свойств. Причем их активность напрямую связана с химическим строением. Так, некоторые тиоксантены и тиоксантоны обладают высокой активностью в отношении шистоматоз, но замена метальной группы в них на метоксильную или атом хлора приводит к полной утрате их биологической активности / В.Г.Харченко, Т.И.Крупина, А.Ф.Блинохватов. Тиоксантены, гидротиоксантены и их производные. Издательство Саратовского университета, 1979, с.68-71/. Далее, среди соединений этой группы имеются вещества, обладающие антимикробным, депрессивным и антидепрессивным действием, антигистаминной и жаропонижающей активностью, противоопухолевым действием. Следовательно, химическая природа данных соединений является определяющей. Отметим, что в соединениях, о которых идет речь, селен отсутствует. Оказалось, что ксантеновые соединения являются хорошим предшественником для создания биологически активных соединений. Заявленное соединение, относящееся к ксантеновому ряду, помимо всего прочего характеризуется тем, что в него введен селен. Установлено, что данное соединение способно активизировать некоторые системы организма. Однако о заявленных в изобретении свойствах ничего ранее не сообщалось. Разумеется, исключить то, что наблюдаемые эффекты отчасти связаны с селеном нельзя, но в то же время, очевидно, что в данном случае целое больше частей, т.е. мы имеем дело с соединением с новыми свойствами. 9-фенил-симметричный – октагидроселеноксантен может быть получен описанными ранее известными способами, например, по способу согласно RU 2221793, опубл. 2004.01.20. Для доказательства соответствия изобретения условию применимости выполнены эксперименты на мышах с целью определения чувствительности к различного рода воздействий клеток костного мозга после введения препарата в оптимальных дозах. Пример 1. Изучение влияния 9-фенил-симметричный – октагидроселеноксантена на популяцию ранних кроветворных клеток-предшественников при различных повреждающих воздействиях. Использовали 950 мышей двух линий – (СВАх С 57 В1/6) F1 самок. Облучение проводили на радитерапевтической установке «Луч-1» гамма-лучами 60Со при мощности дозы 0,9 Гр/мин. 9-фенил-симметричный – октагидроселеноксантен вводили мышам-донорам костного мозга per os, в дозе 5,0 мг/кг в 0,2 мл масляного раствора за 1 или 3 или 7 суток до облучения повреждающий дозой 1,5 Гр, через 10-15 мин после облучения извлекали костный мозг, готовили суспензию клеток и вводили летально облученным мышам-реципиентам (8 Гр) той же линии для определения их колониеобразующей активности методом экзогенных селезеночных колоний. Через 9 суток мышей умерщвляли, извлекали селезенки и подсчитывали число колоний.
Усредненные результаты трех независимых экспериментов по влиянию 9-фенил-симметричного – октагидроселеноксантена на относительное содержание КОЕ-С в костном мозге, представленные в таблице 1, свидетельствуют, что его введение мышам-донорам в дозе 5,0 мг/кг за 1 или 3 или 7 суток перед облучением в дозе 1,5 Гр приводит к тому, что выживаемость клеток данного компартмента значительно превышает таковую в облученном контроле. Эффект сохраняется в течение 7 суток. При этом отмечена выраженная зависимость от сроков введения препарата: минимальное действие (увеличение относительного содержания КОЕ-С в 2 раза по сравнению с облученным контролем) наблюдается при применении его за 1 сутки до облучения, а максимальный – за 7 суток, когда повреждающее действие ионизирующей радиации на популяцию КОЕ-С ослабляется почти в три раза. Следует заметить, что препарат, введенный в дозе 5 мг/кг в различные сроки до взятия костного мозга, сам по себе практически не влияет на относительное содержание КОЕ-С в костном мозге мышей-доноров. Для того чтобы оценить возможность 9-фенил-симметричного – октагидроселеноксантена восстанавливать популяцию стволовых кроветворных клеток при большей степени их повреждения, изучено его влияние на относительное содержание КОЕ-С в костном мозге при облучении в различных повреждающих дозах. В экспериментах использовали 300 мышей линии (СВА × С57В1/6) F1 самок. Облучение проводили на радиотерапевтической установке «Луч-1» гамма-лучами 60Со при мощности дозы 0,9 Гр/мин. Препарат вводили мышам-донорам костного мозга per os, в дозе 5,0 мг/кг в 0,2 мл масляного раствора за 7 суток до облучения повреждающими дозами: 1,5, 2,0, 3,0 или 5,0 Гр. Через 10-15 мин после облучения извлекали костный мозг, готовили суспензию клеток и вводили летально облученным мышам-реципиентам (8 Гр) той же линии для определения их колониеобразующей активности методом экзогенных селезеночных колоний. Через 9 суток мышей умерщвляли, извлекали селезенки и подсчитывали число колоний. Усредненные результаты трех независимых экспериментов представлены в таблице 2 и свидетельствуют, что через 7 суток после введения 9-фенил-симметричного – октагид-роселеноксантена мышам-донорам в дозе 5,0 мг/кг наблюдается статистически значимое повышение устойчивости КОЕ-С к воздействию ионизирующей радиации в дозах 1,5, 2,0, 3,0 и 5,0 Гр. Выживаемость клеток при всех повреждающих дозах, кроме 1,5 Гр, вдвое превышают значения облученного контроля, а при облучении 1,5 Гр – выживаемость КОЕ-С практически не отличается от значения интактного контроля. Проведена оценка способности 9-фенил-симметричного – октагидроселеноксантена восстанавливать популяцию КОЕ-С в костном мозге после действия цитостатиков. В экспериментах использовали 150 мышей линии (СВА × C57B1/6)F1 самок. Облучение реципиентов проводили на радиотерапевтической установке «Луч-1» гамма-лучами 60Со при мощности дозы 0,9 Гр/мин. 9-фенил-симметричного – октагидроселеноксантен вводили мышам-донорам костного мозга per os, в дозе 5,0 мг/кг в 0,2 мл масляного раствора за 7 суток до инъекции цисплатина (цисплатин-лэнс, «ЛЭНС-ФАРМ» Москва) в дозах: 2,5, 5,0 и 7,5 мкг/кг. Через 24 часа после цисплатина извлекали костный мозг, готовили суспензию клеток и вводили летально облученным мышам-реципиентам (8 Гр) той же линии для определения их колониеобразующей активности методом экзогенных селезеночных колоний. Через 9 суток мышей умерщвляли, извлекали селезенки и подсчитывали число колоний. Результаты экспериментов представлены в таблице 3 и свидетельствуют, что через 7 суток после введения 9-фенил-симметричного – октагидроселеноксантена мышам-донорам в дозе 5,0 мг/кг наблюдается статистически значимое повышение устойчивости КОЕ-С к воздействию цисплатина в дозах 2,5, 5,0 и 7,5 мкг/кг. Выживаемость клеток при всех повреждающих дозах статистически значимо превышают значения цисплатинового контроля, а при дозе препарата 2,5 мкг/мышь выживаемость КОЕ-С практически не отличается от значения интактного контроля.
Пример 2 Модифицирующее действие заявленного ингибитора при облучении животного организма неионизирующим излучением. Исследовали защитные свойства 9-фенил-симметричного – октагидроселеноксантена при облучении животного организма неионизирующим излучением на модели изучения образования микроядер в полихроматофильных эритроцитах периферической крови мышей линии С57 В1. Микроядра в интерфазном ядре, как правило, представляет собой ацентрические фрагменты хромосом. Животных подвергали воздействию электромагнитного излучения (ЭМИ) миллиметрового диапазона волн, частота 39,5 ГГц, длина 7,5 мм в течение 1 часа. Плотность потока энергии (ППЭ) составляла около 3 мкВт/см2, что в 300 раз меньше уровней, при которых возможен перегрев биообъекта из-за поглощения энергии поля. Одной из групп мышей (n=5) за 7 суток до облучения вводили 9-фенил-симметричный – октагидроселеноксантен из расчета 5 мг/кг массы тела перорально в 0,2 мл подсолнечного масла. Второй группе мышей (n=5) за 7 суток до облучения вводили исключительно 0,2 мл подсолнечное масло. В качестве контроля использовали интактных мышей. Через сутки после облучения животных забивали и определяли количество микроядер в полихроматофильных эритроцитах периферической крови. Из каждого образца проанализировано по 150 тыс. полихроматофильных эритроцитов. Результаты исследования представлены в таблице 4.
Таким образом, ингибитор дифференцировки клеток обуславливает не только радио-протекторное действие, но и защиту от любого другого рода облучения. Пример 3. Исследование влияния 9-фенил-симметричного – октагидроселеноксантена на относительное количество низкодифференцированных предшественников клеток (CD34+) крови нормальных мышей, а также на состояние периферической крови у мышей на 2-ые сутки после облучения в дозе 1,5 Гр. Проведено 4 серии экспериментов. Работа выполнена на 170 мышах гибридах (СВА × C57B1/6)F1 самках. При исследовании на нормальных мышах 9-фенил-симметричный – октагидроселеноксантен вводили per os в дозе 5 мг/кг за 7 суток до взятия органов. В экспериментах на облученных мышах препарат вводили за 7 суток до облучения в дозе 1,5 Гр. Органы брали через 2 суток после облучения. Анализ периферической крови проведен на гемоцитометре. Аликвоты образцов периферической крови и костного мозга были исследованы с помощью проточной цитометрии на содержание низкодифференцированных CD34+ предшественников клеток крови мышей. Для этого доля CD34+клеток и плотность этого поверхностного маркера определены одновременно в периферической крови и костном мозге. В каждом образце крови проанализировано 80 тыс. клеток, в костном мозге – 40 тыс. В таблицах представлены усредненные результаты 4-х опытов. Оценивали относительное количество CD34+ клеток и плотность этого поверхностного маркера в периферической крови и костном мозге. Введение препарата не влияет на относительное количество низкодифференцированных клеток стволового типа (CD34+). Однако к 7-м суткам после введения препарата увеличивается плотность этого маркера на поверхности клеток (р<0,05), свидетельствуя о перераспределении клеток по степени дифференцировки за счет увеличения доли наименее дифференцированных клеток. Аналогичная картина наблюдается и в периферической крови: по данным 4-х опытов доля CD34+ клеток в крови не меняется после введения 9-фенил-симметричного – октагидроселеноксантена, но на 7-е сутки более дифференцированных предшественников становится меньше (Таблица 5).
Анализ качественных и количественных показателей клеточного состава периферической крови и костного мозга у облученных животных позволяет предположить, что 9-фенил-симметричный-октагидроселеноксантен вызывает блок дифференцировки кроветворных клеток-предшественников гранулоцитарно-макрофагального ростка, т.е. через 7 суток после введения препарата, к моменту облучения, в костном мозге накапливаются низкодифференцированные предшественники, более устойчивые к повреждающему действию радиации. Вероятно, облучение и последующее опустошение кроветворных органов отменяют блок дифференцировки, что приводит к увеличению численности в периферической крови уже на 2-е сутки после облучения лейкоцитов, гранулоцитов и моноцитов. Анализ качественных и количественных показателей клеточного состава периферической крови и костного мозга свидетельствует, что 9-фенил-симметричный-октагидроселеноксантен вызывает блок дифференцировки кроветворных клеток-предшественников, т.е. через 7 суток после введения препарата, к моменту облучения, в костном мозге происходит перераспределение стволовых клеток в пуле по степени дифференцировки: а именно, увеличивается количество низкодифференцированных предшественников, более устойчивых к повреждающему действию радиации. Вероятно, облучение и последующее опустошение кроветворных органов отменяет блок дифференцировки, что приводит к увеличению численности лейкоцитов, гранулоцитов и моноцитов в периферической крови уже на вторые сут после облучения (Таблица 6).
Накопление низкодифференцированных предшественников в костном мозге под действием 9-фенил-симметричного – октагидроселеноксантена через 7 суток после введения препарата должно приводить к увеличению численности КОЕ-12, которые формируют селезеночные колонии на 12-е сутки роста. КОЕ-12 – низкодифференцированные, полипотентные предшественники, которые способны дать начало всем рядам кроветворения. В экспериментах использовали 120 мышей линии (СВА × C57B1/6)F1 самок. Облучение проводили на радиотерапевтической установке «Луч-1» гамма-лучами 60Со при мощности дозы 0,9 Гр/мин. 9-фенил-симметричный – октагидроселеноксантен мыши-доноры получали per os, в дозе 5,0 мг/кг в 0,2 мл масляного раствора за 7 суток до извлечения костного мозга. Суспензию клеток вводили летально облученным мышам-реципиентам (8 Гр) той же линии для определения их колониеобразующей активности методом экзогенных селезеночных колоний. Через 8 или 12 суток мышей умерщвляли, извлекали селезенки и подсчитывали число колоний. Усредненные результаты двух независимых экспериментов, представленные в таблице 7, свидетельствуют, что через 7 суток после введения 9-фенид-симметричного-октагидроселеноксантена мышам-донорам в дозе 5,0 мг/кг в костном мозге последних происходит увеличение относительного количества низкодифференцированных КОЕ-С-12 при отсутствии влияния препарата на число более коммитированных КОЕ-С-8. Полученные данные свидетельствуют о накоплении в костном мозге на 7-ые сутки после действия 9-фенил-симметричного – октагидроселеноксантена низкодифференцированных клеток-предшественников кроветворения.
Пример 4. В следующей серии экспериментов исследовано влияние 9-фенил-симметричного – октагидроселеноксантена на опухолевые клетки при воздействии стандартного химиотерапевтического препарата – платидиама. Результаты проведенного опыта приведены в таблице 8.
Как можно видеть из данной таблицы, воздействие платидиама оказывает относительно слабое, но достоверное противоопухолевое действие по двум показателям – масса опухоли и число метастазов в легких. Введение мышам за 30 минут до химиопрепарата 9-фенил-симметричного – октагидроселеноксантена не оказало существенного влияния на рост опухоли и на число метастазов в легких. Таким образом, в условиях данного эксперимента препарат 9-фенил-симметричный – октагидроселеноксантен не влияет на рост и метастазирование опухоли, подвергнутой лечебному воздействию стандартного химиопрепарата – платидиама. Так как ингибитор в примененной концентрации способен снижать вредное действие препаратов цис-платины на некоторые нормальные ткани, то это может служить обоснованием для применения его в качестве избирательного протектора нормальных тканей при проведении химиотерапии злокачественных новообразований. Усредненные результаты 3-х экспериментов по изучению влияния 9-фенил-симметричного – октагидроселеноксантена в комплексе с радиотерапией на рост карциномы Льюис представлены в таблицах 9 и 10. Оказалось, что, как и в предыдущих экспериментах, ингибитор практически не влияет на рост опухоли, хотя значения ИР для этой группы и несколько меньше контрольных, но различия статистически не значимы. Тот же вывод можно сделать и в результате анализа совместного действия на опухоль 9-фенил-симметричного – октагидроселеноксантена и облучения. В этом случае значения ИР для групп «облучение» и «9-фенил-симметричного – октагидроселеноксантена + облучение» во все сроки наблюдения статистически значимо не отличаются. На 21-е сутки роста опухоли у выживших экспериментальных мышей было определено число метастазов в легких. Как видно из данных, представленных в таблице 10, 9-фенил-симметричный – октагидроселеноксантен не оказывает значимого влияния на процесс метастазирования как у необлученных, так и подвергнутых лучевому воздействию мышей – опухоленосителей. И так, сочетанием действий 9-фенил-симметричного – октагидроселеноксантена и локального облучения препарат не защищает опухолевые клетки от воздействия радиации и статистически значимо не усиливает метастазирование опухоли.
Применение изобретения позволит повысить эффективность применения облучения и цитостатиков за счет снижения повреждающего действия указанных агентов на процесс кроветворения, посредством введения 9-фенил-симметричного – октагидроселеноксантена. Введение 9-фенил-симметричного – октагидроселеноксантена не повышает резистентность опухоли к облучению.
Формула изобретения
Применение органического соединения селена формулы
в качестве ингибитора дифференцировки кроветворных клеток-предшественников.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||