|
(21), (22) Заявка: 2006134125/15, 27.09.2006
(24) Дата начала отсчета срока действия патента:
27.09.2006
(46) Опубликовано: 10.02.2008
(56) Список документов, цитированных в отчете о
поиске:
RU 2122740 С1, 27.11.1998. RU 2192304 C2, 10.11.2002. Лабораторные методы исследования в клинике. / Под ред. В.В.Меньшикова. – М.: Медицина, 1987, с.215-219, 199. Артеменко А.И. и др. Справочное руководство по химии. – М.: Высшая школа, 2002, с.233, 234, 238. Химическая энциклопедия. – М.: Советская энциклопедия, 1990, т.2, с.148-150. RU 93056485 А, 10.01.1997. WO 9220771, 26.11.1992.
Адрес для переписки:
142290, Московская обл., г.Пущино, мкр.В, 32, кв.50, пат.пов. Л.Г.Садовниковой
|
(72) Автор(ы):
Сухоруков Борис Иванович (RU),
Сабурова Екатерина Андреевна (RU),
Шабарчина Людмила Ивановна (RU),
Дубровский Алексей Владимирович (RU),
Тихоненко Сергей Алексеевич (RU)
(73) Патентообладатель(и):
Институт теоретической и экспериментальной биофизики Российской академии наук (RU)
|
(54) МИКРОДИАГНОСТИКУМ И СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА
(57) Реферат:
Изобретение относится к области биохимии. Для анализа биологической жидкости используется микродиагностикум, который выполнен в виде по меньшей мере одной капсулы нано- или микроразмера с мультислойной полупроницаемой оболочкой из полиэлектролитов, в которую инкапсулирован фермент, для которого анализируемое вещество является субстратом, или ингибитором, или активатором. Способ ферментативного определения концентрации анализируемого вещества в биологической жидкости с помощью микродиагностикума состоит в том, что его вносят в исследуемую жидкость, а концентрацию анализируемого вещества определяют по количеству продукта реакции, катализируемой ферментом микродиагностикума, или по изменению активности фермента микродиагностикума, при этом анализируемое вещество является субстратом, или ингибитором, или активатором для фермента микродиагностикума. Способ обеспечивает возможность проведения анализа интактных биологических жидкостей без их освобождения от протеаз, а также возможность использования простых и доступных методов анализа, например, по изменению скорости седиментации микродиагностикума. 2 н. и 11 з.п. ф-лы, 10 ил., 1 табл.
Настоящее изобретение относится к области биохимического анализа жидких биологических материалов с помощью ферментов и может быть использовано как в лабораторной практике, преимущественно медицинской и пищевой, так и научных исследованиях для ферментативного определения концентрации анализируемого вещества.
Преимущественно данное изобретение относится к средствам для определения концентрации анализируемых веществ в пробах биологических жидкостей, а именно микродиагностикуму, под которым в данной заявке понимается капсула микро- или наноразмерной величины, представляющая собой заключенное в оболочку средство, которое позволяет распознавать и количественно определять низкомолекулярные вещества в биологической жидкости сложного состава.
Это изобретение относится также к ферментативным способам определения концентрации анализируемого вещества.
Известен ферментативный способ определения концентрации анализируемого вещества, в частности мочевины, основанный на ее гидролизе свободным ферментом – уреазой до ионов аммония и их дальнейшем определении в присутствии катализатора («Инструкция по применению набора реактивов для определения мочевины уреазным методом по конечной точке с салицилатно-гипохлоритным реактивом в сыворотке крови и моче КТ «ДДС», утвержденная Департаментом госконтроля качества, эффективности, безопасности лекарственных средств и медицинской технике Минздрава РФ от 28.04.99). Способ основан на реакции взаимодействия аммиака с салицилатом и гипохлоритом натрия, которую катализирует в щелочной среде нитропруссид. Реакция протекает с образованием окрашенного соединения, интенсивность окраски которого прямо пропорциональна концентрации мочевины и измеряется фотометрически при длине волны 540 нм.
Набор готовых форм содержит салицилат, гипохлорид натрия, нитропруссид и уреазу.
Близким к этому способу является ферментативный способ (RU 2122740) определения мочевины, также основанный на ее гидролизе ферментом – уреазой до ионов аммония и их дальнейшем определении в присутствии катализатора по их реакции со щелочным раствором гипохлорита натрия в присутствии акцептора аммиака – 4-оксикумарина и катализатора – феррицианида калия.
Набор готовых форм реактивов для определения мочевины в биологических жидкостях (RU 2122740) содержит уреазу, нитропруссид натрия в качестве катализатора, щелочь, раствор гипохлорита натрия и дополнительно в качестве акцептора аммиака 4-оксикумарин в виде смеси с феррицианидом калия, являющимся дополнительным катализатором. Уреаза, нитропруссид натрия и смесь 4-оксикумарина и феррицианида калия содержатся в составе набора в таблетированном виде, а щелочь и гипохлорит натрия в виде их концентрированных растворов.
Известен набор реагентов (JP 2004065078) для определения концентрации пировиноградной кислоты в ферментированном дрожжами продукте, например “Саке”, содержащий лактатдегидрогеназу, восстановленный никотинамид аденин динуклеотид (NADH), соль тетразолия, катализатор, и сравнительный агент, проявляющий цвет в том случае, когда пировиноградная кислота содержится в заданной концентрации. Способ (JP 2004065078) определения концентрации пировиноградной кислоты состоит в том, что указанный набор реагентов помещают в исследуемую жидкость, при этом реагенты берут в определенной концентрации, необходимой для измерения заданной концентрации пировиноградной кислоты.
Известен реагент (RU 2184778) для ферментативного определения концентрации анализируемого вещества в пробе биологической жидкости субъекта по измерению степени окисления кофермента, стабилизированного против окисления при помощи системы восстановления кофермента.
В частности, для ферментативного определения мочевины (RU 2184778) реагент содержит Глюкозо-6-фосфат-дегидрогеназу, как систему восстановления кофермента, D-глюкозу и уреазу – фермент, специфичный для анализируемого вещества,  -кетоглутарат субстрат, никотинамидадениндинуклеотид фосфат (NADPH) восстановленный кофермент, К2НРО4 и глутаматдегидрогеназу. -кетоглутарат субстрат, никотинамидадениндинуклеотид фосфат (NADPH) восстановленный кофермент, К2НРО4 и глутаматдегидрогеназу.
Известный ферментативный способ (RU 2184778) определения концентрации анализируемого вещества в пробе биологической жидкости субъекта заключается в измерении степени окисления кофермента с помощью реагента, стабилизированного против окисления при помощи системы восстановления кофермента, состоящей из пары фермента и субстрата, подобранного для обеспечения постоянного восстановления соответствующего кофермента на протяжении всего срока хранения данного реагента.
Недостаток всех описанных выше средств ферментативного определения концентрации анализируемого вещества и способов, использующих эти средства, состоит в том, что в них использован фермент, незащищенный от действия протеаз, присутствующих практически во всех биологических жидкостях, и, таким образом, все вышеописанные ферментные средства являются средствами одноразового использования. Кроме того, такие средства плохо хранятся даже в условиях охлаждения, так как активность свободного фермента обычно исчезает в течение нескольких дней, что требует добавления к раствору фермента токсичных консервантов, например азида натрия, и небезопасно для выполняющего анализы человека.
Задача, на решение которой направлено предлагаемое изобретение, состоит в создании микродиагностикума, обеспечивающего увеличение продолжительности сохранения активности и высокой специфичности фермента, устойчивости к наличию в анализируемой среде протеиназ, а также обеспечение возможности его многократного использования при минимизации количества фермента, необходимого для проведения анализа. Подобные микродиагностикумы пока неизвестны.
Поставленная задача решена тем, что предложен микродиагностикум для ферментативного определения концентрации анализируемого вещества в биологической жидкости, характеризующийся тем, что он выполнен в виде по меньшей мере одной капсулы нано- или микроразмера, в которую инкапсулирован фермент, с мультислойной полупроницаемой оболочкой из полиэлектролитов, при этом анализируемое вещество является субстратом, или ингибитором, или активатором для инкапсулированного фермента
Указанная капсула содержит полость, в которой находится указанный фермент, а указанная оболочка имеет проницаемость, достаточную для проникновения внутрь капсулы анализируемого вещества и, при необходимости, кофакторов инкапсулированного фермента, и препятствующую проникновению внутрь капсулы белков и их комплексов, повреждающих инкапсулированный фермент.
Капсула имеет размер преимущественно 2-10 микрометров, а ее оболочка – толщину преимущественно 30-100 нанометров.
Оболочка капсулы выполнена из полиэлектролитов с чередующимися слоями из полианионов и поликатионов, преимущественно линейной структуры.
В частном случае выполнения микродиагностикума инкапсулированный фермент является уреазой.
В другом частном случае выполнения микродиагностикума инкапсулированный фермент является лактатдегидрогеназой.
Поставленная задача решена также тем, что предложен способ ферментативного определения концентрации анализируемого вещества в биологической жидкости с помощью предложенного микродиагностикума, выполненного в виде, по меньшей мере, одной капсулы нано- или микроразмера, в которую инкапсулирован фермент, с мультислойной полупроницаемой оболочкой из полиэлектролитов, который вносят в исследуемую жидкость, а концентрацию анализируемого вещества определяют по количеству продукта реакции, катализируемой ферментом микродиагностикума, или по изменению активности фермента микродиагностикума, при этом анализируемое вещество является субстратом, или ингибитором, или активатором для фермента микродиагностикума.
В частном случае реализации способа в исследуемую жидкость вносят кофактор, если он необходим для реакции, катализируемой ферментом микродиагностикума.
При необходимости в исследуемую жидкость также вносят индикатор продукта реакции, катализируемой ферментом микродиагностикума.
При этом в качестве указанного индикатора берут вещество, изменяющее свои оптические характеристики в присутствии продукта реакции, катализируемой ферментом микродиагностикума, или образующее нерастворимый осадок с продуктом реакции, катализируемой ферментом микродиагностикума, при этом концентрацию анализируемого вещества определяют по изменению седиментационных характеристик микродиагностикума.
В частном случае анализируемым веществом является мочевина, микродиагностикум содержит в качестве инкапсулированного фермента – уреазу, а продуктом реакции расщепления мочевины уреазой являются ионы СО3 2- и NH4 +, образуемые по схеме:
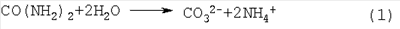
Концентрацию мочевины определяют либо по количеству ионов СО3 2-, для чего в исследуемую жидкость вносят ионы металлов, образующие с ионами СО3 2- нерастворимый осадок, например, ионы бария или кальция, и измеряют седиментационные характеристики микродиагностикума, либо по количеству NH4 +, для чего в исследуемую жидкость вносят индикатор, изменяющий свои оптические характеристики в присутствии ионов NH4 + в качестве которого берут, например, салицилат, гипохлорит натрия и нитропруссид.
Такое определение мочевины наиболее эффективно при анализе буфферных смесей, какими и являются интактные биологические жидкости. В небуфферных средах ферментативное (энзимологическое) определение мочевины может быть проведено по изменению рН среды.
В другом частном случае анализируемое вещество является пируватом, микродиагностикум содержит в качестве инкапсулированного фермента – лактатдегидрогеназу (ЛДГ), в исследуемую жидкость вносят кофактор NADH, продуктом реакции восстановления пирувата лактатдегидрогеназой (ЛДГ) в присутствии NADH является лактат и NAD, а концентрацию пирувата определяют по количеству прореагировавшего при этом NADH, которое равно концентрации образовавшегося лактата и соответственно – прореагировавшего пирувата, или по скорости изменения концентрации NADH, которая пропорциональна начальной концентрации пирувата. Схематически превращение анализируемого пирувата можно представить следующим образом:

Сущность изобретения состоит в том, что удалось инкапсулировать фермент в мультислойные полиэлектролитные (ПЭ) микрокапсулы, основная особенность которых состоит в том, что их мультислойная полиэлектролитная оболочка проницаема для низкомолекулярных соединений и мелких агрегатов и непроницаема для высокомолекулярных веществ и крупных частиц. При этом удалось сохранить активность фермента и его высокое сродство к субстрату.
Экспериментальным путем было установлено, что такая полиэлектролитная оболочка предохраняет фермент от находящихся в среде протеаз, липопротеидов и других белковых комплексов, способных инактивировать или модифицировать фермент. Это позволяет использовать инкапсулированный (включенный) в ПЭ-микрокапсулу фермент в качестве микродиагностикума для количественного анализа специфического для фермента микродиагностикума субстрата, или ингибитора, или активатора в нативной биологической жидкости порою без ее предварительного фракционирования.
Предложенное изобретение иллюстрируется следующим графическим материалом.
На фиг.1 показана электронно-микроскопическая фотография ультратонкого среза микродиагностикума в виде полиэлектролитной микрокапсулы из 7 слоев полиэлектролитов [(ПСС/ПАА)3ПСС], нагруженной ферментом. Увеличение 24 тыс.
На фиг.2 показана зависимость активности уреазы в свободном состоянии (кривая 1) и в виде микродиагностикума с числом полиэлектролитных слоев 7 – (ПСС/РАА)3ПСС – (кривая 2) от концентрации мочевины.
На фиг.3 показана зависимость активности лактатдегидрогеназы в свободном состоянии (кривая: ЛДГ) и в виде микродиагностикума с числом полиэлектролитных слоев 6 [(ПАА/ДС)2ПАА/ПСС] – (кривая: ЛДГ-капсулы) от концентрации пирувата.
На фиг.4 показано изменение стабильности ферментов в микродиагностикуме и в свободном состоянии при длительном хранении в Н2O при 15°С.
ЛДГ – в свободном состоянии – (кривая 1) и в виде микродиагностикума (ПАА/ДС)2(ПАА/ПСС) – (кривая 3).
Уреаза – в свободном состоянии – (кривая 2) и в виде микродиагностикума (ПСС/ПАА)3ПСС – (кривая 4).
На фиг.5 приведены зависимости ферментативной активности лактатдегидрогеназы в свободном состоянии (кривая ЛДГ) и в виде микродиагностикума (в инкапсулированном состоянии) (кривая ЛДГ-капсулы) от времени инкубации с протеиназой К при 37°С.
На фиг.6 приведена зависимость скорости изменения оптической плотности dD(400 HM)/dt от концентрации мочевины, измеренная в течение первых 5 минут после начала осаждения микродиагностикума с 9 слоями полиэлектролитов [(ПСС/ПАА)4ПСС] с инкапсулированной в нем уреазой.
На фиг.7 показаны диаграммы, иллюстрирующие содержание мочевины в моче разных пациентов, определенное уреазным методом по конечной точке, с помощью свободной (столбик Е) уреазы и с помощью предлагаемого микродиагностикума (столбик К) с уреазой.
На фиг.8 показана возможность многократного использования предлагаемого микродиагностикума с уреазой (ПСС/ПАА)4ПСС для анализа содержания мочевины в анализируемой жидкости по конечной точке.
На фиг.9 показана диаграмма, иллюстрирующая содержание пирувата в растворах с разной концентрацией пирувата, определенная по конечной точке с помощью свободной (столбик Е) лактатдегидрогеназы и с помощью предлагаемого микродиагностикума (столбик К) с лактатдегидрогеназой. На врезке дана градуировочная кривая, полученная аналогичным способом для микродиагностикума с лактатдегидрогеназой в диапазоне концентраций пирувата от 20 до 80 мкМ.
На фиг.10 показаны диаграммы, иллюстрирующие содержание пирувата в сыворотке крови разных пациентов, определенное спектрофотометрическим методом по изменению поглощения добавленного NADH по конечной точке, с помощью свободной (столбик Е) лактатдегидрогеназы и с помощью микродиагностикума с лактатдегидрогеназой (столбик К).
Для подтверждения возможности осуществления предлагаемого изобретения использовали следующие реактивы:
Лактатдегидрогеназу (E.C..1.1.1.27) (ЛДГ) из скелетных мышц свиньи (изоформа М4) выделяли согласно методу, используемому в работе [Сабурова Е.А., Хечинашвили Н.Н. и Елфимова Л.И. “Полиол-белковые взаимодействия. Микрокалориметрические исследования денатурации лактатдегидрогеназы”. Молек. биол. 1996. т.30. С.1219-1228];
Уреазу (ЕС.3.5.1.5, jack bean) использовали фирмы Fluka, №94285 с активностью =97,0 U/mg;
Полистиролсульфонат натрия (ПСС, 70 кДа) и полиаллиламингидрохлорид (ПАА, 70 кДа) фирмы Aldrich (Germany);
Декстрансульфат (ДС, 10 кДа) и этилендиаминтетрауксусную кислоту (EDTA) фирмы “Sigma” (Germany);
Хлорид кальция (CaCl2·2Н2О), карбонат и хлорид натрия фирмы «Реахим» (Россия).
Пример 1. Получение микродиагностикума, содержащего уреазу.
К 0,33М раствору CaCl2, содержащему 2,0 мг/мл уреазы и интенсивно перемешиваемому на магнитной мешалке, быстро добавляли равный объем 0,33М раствора Na2CO3. Смесь перемешивали в течение 30 с, после чего перемешивание прекращали, а образовавшуюся суспензию выдерживали 15 мин до полного просветления надосадочной жидкости. В результате этой процедуры получали составной микросферолит СаСО3 – уреаза. Этот процесс «созревания» микросферолитов контролировали с помощью светового микроскопа.
Затем надосадочную жидкость декантировали, осадок промывали водой. Количество включенного в сферолит белка – фермента определяли спектрофотометрически при сравнении абсорбции ( =280 нм) исходных растворов белка и супернатанта, отобранного при осаждении указанных микросферолитов СаСО3 – уреаза. Содержание белка определяли также по методу Бредфорда (Anal. Bioch. 1976. V.72. P.248-254) с использованием красителя Coomassie Brilliant Blue G-250 ( =280 нм) исходных растворов белка и супернатанта, отобранного при осаждении указанных микросферолитов СаСО3 – уреаза. Содержание белка определяли также по методу Бредфорда (Anal. Bioch. 1976. V.72. P.248-254) с использованием красителя Coomassie Brilliant Blue G-250 ( =595 нм). =595 нм).
Средний диаметр микросферолитов составлял 4,5 микрон, содержание фермента в одной капсуле – 60 пикограмм.
Далее, на составных микросферолитах СаСО3-уреаза, используя их как коровые частицы, формировали мультислойные полиэлектролитные микрокапсулы путем поочередной адсорбции противоположно заряженных полиэлектролитов на коровые частицы. Затем на завершающей стадии неорганический компонент составного микросфералита растворяли в ЭДТА.
В качестве полиэлектролитов использовали полианион-полистиролсульфонат (ПСС) и поликатион-полиаллиламин (ПАА), которые готовили с концентрацией 2 мг/мл в 0,5М растворе NaCl.
Эта полиэлектролитная пара была предварительно выбрана в результате изучения ингибиторного действия ряда противоположно заряженных полиэлектролитов на фермент. Оказалось, что именно пара ПСС/ПАА обеспечивает наиболее оптимальные условия для функционирования уреазы.
Формирование микрокапсул проводили с использованием охлажденных (5-10°С) растворов в условиях поддержания нейтральной рН. Для предотвращения агрегации частиц в процессе адсорбции полиэлектролитов, суспензию микрочастиц периодически через каждые 5 минут обрабатывали ультразвуком в течение 1-3-х секунд. При этом за агрегацией частиц следили с помощью светового микроскопа. После адсорбции на коровую частицу каждого полиэлектролитного слоя суспензию центрифугировали при 1 тыс. об/мин и осадок тщательно промывали от не связавшегося полиэлектролита. Процедуру промывки повторяли трижды. Затем после заданного числа послойной адсорбции полиэлектролитов коровую частицу растворяли в 0,2М растворе ЭДТА при рН 7,5 в течение 12 часов.
Таким образом был получен микродиагностикум с различным числом противоположно заряженных полиэлектролитов в оболочке, содержащий в качестве фермента уреазу. Общая формула такой оболочки имела следующий вид: (ПСС/ПАА)nПСС, где n=3-5. Основные структурные и энзимологические исследования были проведены с микродиагностикумом с n=3 и 5, т.е. содержащим соответственно 7 и 11 полиэлектролитных слоев. Средний размер микрокапсулы составлял 5 мкм, а средняя толщина оболочки для 7- и 11-слойной микрокапсулы составляла 46 и 61 нм соответственно. Полученный по методике Д.А.Мошкова [Мошков Д.А. «Адаптация и ультаструктура нейрона» 1985 г., М.: Наука] электронно-микроскопический ультратонкий срез микрокапсулы, содержащей 7 слоев, приведен на фиг.1.
Определение активности и каталитических характеристик уреазы. Определяли активность уреазы, свободной и инкапсулированной в ПЭ-микрокапсулы, по расщеплению мочевины (см. уравнение 1), используя рН-чувствительный краситель – бромкрезол фиолетовый.
Для этого предварительно строили калибровочную кривую, в связи с чем готовили реакционную смесь, содержащую мочевину заданной концентрации в диапазоне 1-100 мМ, и 0.015 мМ бромкрезола, предварительно дотитрованных до рН 6.2. В реакционную смесь добавляли 80 мкл приготовленного, как описано выше, микродиагностикума в виде микрокапсул, содержащих уреазу, или свободную уреазу в количестве, соответствовавшем содержанию ее в капсуле, и далее регистрировали скорость изменения оптического поглощения красителя при 588 нм, которая соответствует активности уреазы.
Начальные стационарные скорости ферментативных реакций определяли по наклону линейной части кривой накопления продукта во времени в течение первых 10-30 с после начала реакции. Кинетические параметры – максимальную скорость реакции V и константу Михаэлиса КM – находили из зависимости 1/V от 1/S (S – концентрация мочевины) по уравнению Михаэлиса-Ментен с помощью метода наименьших квадратов.
Исследовали зависимости стационарной скорости превращения субстрата-мочевины, катализируемого уреазой, от концентрации субстрата. На фиг.2 приведены кривые зависимости скорости расщепления мочевины в виде микродиагностикума с уреазой (т.е. инкапсулированной уреазой) и свободной уреазой от концентрации мочевины. Как видно из фиг.2, зависимости скоростей каталитических реакций от концентрации субстрата для инкапсулированной уреазы (7 слоев, кривая 2), в общем виде повторяют ход кривой для свободного фермента (кривая 1), с небольшой лишь разницей в константах сродства к субстратам. Так, константа Михаэлиса Км по мочевине составляет около 7 мМ для уреазы в микродиагностикуме, в то время как для свободной уреазы эта величина равна 2,5 мМ. Микрокапсулы с уреазой, составленные из 7 и 11 слоев, по каталитическим характеристикам – Км и Vmax, практически не отличаются.
Пример 2. Получение микродиагностикума, содержащего в качестве фермента лактатдегидрогеназу (ЛДГ), осуществляли так же, как описано в примере 1, за исключением выбора противоположно заряженных полиэлектролитных пар. Принципиальным различием было включение в некоторые слои оболочки капсулы в качестве полианиона декстрансульфата. Были изучены микродиагностикумы с включенным ЛДГ, содержащие оболочки следующего состава: (ПАА/ПСС)3, (ПАА/ДС)(ПАА/ПСС)2; (ПАА/ДС)2(ПАА/ПСС); (ПАА/ДС)3.
Среди них наиболее оптимальной для функционирования микродиагностикума с ЛДГ оказалась оболочка (ПАА/ДС)2ПАА/ПСС.
При этом средний размер капсулы составлял 4,5 микрометров, а средняя толщина стенки оболочки – 0,06 микрометров, среднее содержание лактатдегидрогеназы в одной капсуле около 40 пикограмм.
Определение активности и каталитических характеристик лактатдегидрогеназы.
Определяли активность лактатдегидрогеназы, свободной и инкапсулированной в ПЭ-микрокапсулы, по реакции восстановления пирувата в присутствии NADH согласно уравнению (2) по изменению оптической плотности в полосе поглощения NADH при 340 нм как описано в справочной литературе [Passonneau J.V., Lowry O.H. – In: Methods of Enzymatic Analysis (Edited by Bergmeyer H.U.), V.3, N.Y., Acad. Press, 1974, P.1452].
Для определения активности ЛДГ концентрацию ЛДГ в свободном (растворенном) состоянии измеряли спектрофотометрически, используя известные для ЛДГ молярные коэффициенты экстинкции:  280 нм 1 мг/мл 280 нм 1 мг/мл
Реакцию запускали введением небольшого количества концентрированного раствора фермента в реакционную смесь, содержащую пируват, NADH.
Исследование каталитических свойств ЛДГ в микрокапсуле проводили по зависимости стационарной скорости восстановления пирувата от его концентрации. Определение Км (константа Михаэлиса) по пирувату для микродиагностикума с ЛДГ не обнаруживало различий между свободным и инкапсулированным ферментом (данные приведены на фиг.3 и в таблице 1).
Значения константы Михаэлиса Км и максимальной скорости реакции Vmax вычислены согласно уравнению Михаэлиса-Ментен и приведены в таблице 1.
| Таблица 1. |
| рН |
объект |
КМ мМ |
Vmax, % |
| 6.5 |
ЛДГ |
0.07±0.01 |
100* |
| микродиагностикум с ЛДГ |
0.075±0.015 |
14 |
Ниже будут рассмотрены два свойства микродиагностикума в виде инкапсулированных ферментов, иллюстрирующих их явное преимущество перед свободными ферментами.
Пример 3. Влияние длительности хранения и воздействия протеиназы К на фермент, находящийся в инкапсулированном и в свободном состоянии.
На фиг.4 приведена зависимость остаточной активности свободных ферментов (ЛДГ – кривая 1, уреазы – кривая 2) и в виде микродиагностикума (инкапсулированных) (ЛДГ – кривая 3, уреазы – кривая 4) от времени хранения в воде. Как видно из фиг.4, инкапсулированные (как описано в примерах 1 и 2) ферменты в отличие от свободных сохраняют ферментативную активность в течение нескольких месяцев. Кроме того, содержание предлагаемого микродиагностикума в воде предотвращает развитие бактерий, что позволяет избежать использования таких токсичных реактивов как азид натрия.
Данные по разрушающему действию протеиназы К представлены на фиг.5, из которых следует, что в присутствии протеолитического фермента активность инкапсулированной ЛДГ абсолютно не изменяется, в то время как для свободной ЛДГ резко падает. Таким образом, при использовании в аналитических целях предлагаемого микродиагностикума полностью исключается необходимость удаления протеиназ из анализируемой биологической жидкости, что само по себе достаточно трудоемко. Эти данные были получены следующим образом.
К двум пробам, содержащим по 1 мл водной суспензии полученного, как описано в примере 2, микродиагностикума с ЛДГ (5·106 капсул), дотитрованных предварительно до рН 7,0, приливали по 100 мкл в одну из них раствора протеиназы К концентрации 25 мг/мл, в другую буфера (0,05 М трис-HCl, рН 7) и инкубировали при 37°С. При этом из каждой пробы отбирали каждые 10 мин по 50 мкл инкубированной смеси и определяли активность ЛДГ, как описано выше, при концентрации пирувата 5 мМ и 0,2 мМ NADH. Аналогично инкубировали две пробы, содержащие свободный фермент, в одну из которых добавляли протеиназу К.
Пример 4. Определение концентрации мочевины с помощью предлагаемого микродиагностикума, содержащего уреазу.
Концентрацию мочевины в анализируемой среде определяли по изменению седиментационнных характристик микродиагностикума, или по изменению спектральных параметров индикатора-красителя, на один из продуктов ферментативного разрушения мочевины.
Определение концентрации мочевины в анализируемой среде по изменению физических свойств микродиагностикума, а точнее седиментационных характристик, основано на том, что в присутствии катионов двухвалентных металлов Me+2, анион СО3 -2, возникающий в соответствии с уравнением (1) при ферментативном разложении мочевины, образует нерастворимый карбонат. Me2++СО3 2- МеСО3 МеСО3
Установлено, что когда уреаза инкапсулирована в мультислойные полиэлектролитные капсулы, каталитическое разложение мочевины и образование карбоната происходит непосредственно внутри этих капсул. Взаимодействие образующегося карбонат-аниона с катионом металла из окружающего раствора приводит к образованию осадка МеСО3 внутри капсулы и резко повышает ее вес и соответственно скорость ее осаждения.
Эксперименты по определению содержания мочевины проводили следующим образом. Полученный как описано выше (пример 1) микродиагностикум с уреазой, титром 2·107 частиц/мл, помещали в раствор хлорида бария с концентрацией 1 моль/л на 15 минут. Микродиагностикум, насыщенный ионами Ba+2, добавляли в растворы мочевины с различной концентрацией. Смесь инкубировали в течение 30 минут при температуре 25°С. Затем суспензию микродиагностикума центрифугировали при 3000 об/мин, супернатант сливали, а осадок ресуспендировали в трис-HCl буфере с рН 6.2. Далее полученную дисперсную систему анализировали по скорости осаждения микрокапсул, заполненных карбонатом бария, фиксируя изменение оптической плотности от времени при  =400 нм. =400 нм.
Исследовались микродиагностикумы, содержащие уреазу с числом полиэлектролитных слоев в оболочке 7 и 9: (ПСС/ПАА)3ПСС и (ПСС/ПАА)4ПСС.
На фиг.6 приведена зависимость скорости изменения оптической плотности dD(400 нм)/dt от концентрации мочевины, измеренная в течение первых 5 минут после начала осаждения микродиагностикума.
Как видно из кривой, представленной на фиг.6, линейная зависимость скорости изменения оптической плотности от концентрации мочевины демонстрирует возможность использования простого доступного метода определения концентрации мочевины по изменению физических свойств микродиагностикума – скорости его осаждения.
Из этой же зависимости следует, что предлагаемым методом может быть охвачен не только весь диапазон концентраций мочевины в моче, но и в сыворотке крови [«Медицинские лабораторные технологии». Т.2, стр.98, 2002 г. СПб., «Интермедика»].
Для определения мочевины в анализируемой жидкости можно также использовать специфические реагенты на аммиак, образующийся при разложении мочевины. С этой целью проводили определение содержания мочевины в растворах и в биологической жидкости – моче пациетов с помощью набора реагентов ««МОЧЕВИНА КТ» ДДС»» фирмы «Диакон-ДС», содержащего помимо раствора уреазы определенной концентрации, также индикаторную на аммиак смесь (салицилат, гипохлорит натрия и нитропруссид). Результаты анализа мочевины, проведенные с использованием этого набора, сопоставлялись с данными, когда вместо «свободной» уреазы в растворе использовался микродиагностикум с уреазой, полученный, как описано в примере 1. С этой целью в анализируемую пробу, содержащую индикаторную смесь (салицилат, гипохлорит натрия и нитропруссид) добавляли 50 мкл суспензии (1·107 микрокапсул) микродиагностикума с уреазой. В обоих случаях, как при использовании уреазы в растворе, так и предлагаемого микродиагностикума с уреазой, интенсивность окраски индикатора измеряемая фотометрически на длине волны 540 нм была пропорциональна концентрации мочевины в среде. На фиг.7 приведены результаты исследования содержания мочевины в моче двух пациентов, с использованием уреазы в свободном состоянии, и в виде микродиагностикума.
Как видно из диаграммы, результаты анализа, выполненного с помощью предлагаемого микродиагностикума и широко распространенным энзимологическим клинико-биохимическим методом, совпадают.
При этом, хотя количество свободного фермента на проведение одного анализа составляет 20 мкг, и количество фермента в составе предложенного микродиагностикума также составляет 20 мкг=(40 пикограмм/капсулу)×(107 капсул/мл)×(0,05 мл), раствор свободного фермента должен быть использован немедленно после его приготовления, а предлагаемый микродиагностикум может храниться при 15°С не менее двух месяцев (Пример 3). Кроме этого принципиальное преимущество предлагаемого микродиагностикума состоит в возможности многократного использования его для анализа.
Это подтверждается результатами следующих экспериментов.
После проведения анализа вышеуказанную реакционную смесь, содержащую микродиагностикум с уреазой, подвергали центрифугированию при 4 тыс. об/мин в течение 10 мин с дальнейшей отмывкой водой осажденных микрокапсул микродиагностикума. Далее к осажденному микродиагностикуму добавляли раствор мочевины известной концентрации и после инкубации в течение 15 минут полученную суспензию вторично центрифугировали, надосадочную жидкость отбирали для определения концентрации мочевины с помощью реагентов «МОЧЕВИНА КТ ДДС» фирмы «Диакон-ДС», а оставшийся микродиагностикум снова центрифугировали трижды с промыванием водой. Такую процедуру повторяли несколько раз и после каждого промывания микродиагностикума с уреазой добавляли свежий раствор мочевины и определяли количество образовавшегося продукта описанным выше образом. Полученные данные представлены на фиг.8. Высокая воспроизводимость результатов подтверждает возможность многократного использования микродиагностикума.
Микродиагностикум может быть отделен также путем фильтрования.
Пример 5. Сравнительное определение концентрации пирувата с помощью предлагаемого микродиагностикума, содержащего лактатдегидрогеназу.
Концентрацию анализируемого вещества – пирувата определяли по изменению оптической плотности в полосе поглощения NADH спектрофотометрически при 340 нм. Для этого к 1,8 мл буферного (0,05 М трис-HCl) раствора пирувата заданной концентрации добавляли 100 мкл раствора NADH концентрации 4·10-3 М и 20 мкл раствора свободной лактатдегидрогеназы с концентрацией 2 мг/мл или 50 мкл микродиагностикума с лактатдегидрогеназой, полученного, как описано в примере 2, и содержащего 0,5·106 микрокапсул, и инкубировали полученные растворы в течение 15 мин при 25°С. Далее регистрировали уменьшение оптической плотности, соответствующее превращению NADH в NAD в соответствии с уравнением (2), катализируемое свободным ферментом или микродиагностикумом. Это изменение оптической плотности соответствует концентрации пирувата.
Полученный результат представлен на фиг.9, где «столбик К» – это значения концентрации пирувата, полученные с помощью микродикродиагностикума с ЛДГ, а «столбик Е» – с помощью свободного фермента ЛДГ для трех концентраций пирувата. Как видно из этой фигуры, значения концентрации пирувата, определенные с помощью свободного и инкапсулированного ферментов, практически не различаются. Полное совпадение результатов, выполненных с использованием свободного фермента и микродиагностикума, получено нами и для широкого диапазона изменений концентраций пирувата, представленного на врезке фиг.9.
Определение пирувата в сыворотке крови пациентов.
Определение пирувата выполняли так же, как описано выше, за исключением того, что вместо раствора пирувата заданной концентрации брали сыворотку крови пациентов из клинико-биохимической лаборатории больницы г. Пущино, используя при этом как свободный фермент, так и микродиагностикум с лактатдегидрогеназой. Результаты измерений представлены на Фиг 10. Количество пирувата, определенное с помощью предлагаемого микродиагностикума, соответствовало 56±6 и 47±5 мМ для 1-го и 2-го пациентов соответственно. Как видно из диаграммы (фиг.10), результаты анализа, выполненного с использованием предлагаемого микродиагностикума и известным широко распространенным клинико-биохимическим (энзимологическим) методом, совпадают.
При этом отметим, что преимущество предлагаемого микродиагностикума состоит в следующем:
1) раствор свободного фермента должен быть использован сразу после его приготовления, а предлагаемый микродиагностикум может храниться при 15°С не менее двух месяцев;
3) микродиагностикум может быть многократно использован, что было проиллюстрировано нами на микродиагностикуме с уреазой (см. Пример 4).
Очевидно, что определение лактата в биологическом образце предлагаемым способом возможно подобно определению пирувата, за исключением того, что в качестве кофермента должен быть использован NAD.
Как видно из приведенных примеров 1 и 2, можно получить микродиагностикумы с любым ферментом и любым заранее заданным количеством слоев полиэлектролитов.
Очевидно, что предлагаемый микродиагностикум может быть использован не только для определения концентрации веществ, которые являются субстратом для инкапсулированного в микродиагностикуме фермента, но также и для определения количества веществ-ингибиторов ферментов, в частности, в следующих системах:
– фосфорорганические соединения, карбоматы натрия, эзерин, четвертичные аммониевые основания и т.д. – ингибиторы реакции гидролиза ацетилхолина, катализируемой ацетилхолинэстеразой, регистрируя уменьшение активности инкапсулированного фермента (ацетилхолинэстеразы) в присутствии указанных ингибиторов;
– оксалатные и оксаматные соли щелочных металлов – ингибиторы прямой и обратной реакций, катализируемых лактатдегидрогеназой, регистрируя уменьшение активности инкапсулированного фермента в присутствии указанных ингибиторов.
Микродиагностикум может быть также использован для определения количества веществ-активаторов ферментов, в частности, в следующих системах:
– цинк – активатор уреазы, ионы калия и аммония – активаторы для реакции дезаминирования аланина, катализируемой аланиндегидрогеназой, регистрируя увеличение активности инкапсулированного фермента (уреазы или аланиндегидрогеназы) в присутствии указанных активаторов.
Приведенные выше примеры демонстрируют возможность получения предлагаемого микродиагностикума и возможность его многократного использования для определения концентрации анализируемых низкомолекулярных веществ в интактных биологических жидкостях.
Таким образом, по сравнению с существующими в настоящее время ферментативными клинико-биохимическими методами анализа предлагаемый нами микродиагностикум и способ ферментативного определения концентрации анализируемого вещества имеет следующие преимущества:
– фермент, включенный в мультислойную полиэлектролитную капсулу, как следует из наших данных, сохраняет свою активность в течение нескольких месяцев, в то время как активность фермента в растворе, “в свободном” состоянии, падает практически до нуля в течение нескольких дней;
– фермент, включенный в полиэлектролитную капсулу, полностью сохраняет свою активность в анализируемой биологической жидкости, содержащей протеазы, что исключает необходимость удаления протеиназ из анализируемой биологической жидкости, что достаточно трудоемко;
– предлагаемый способ дает возможность многократного использования микродиагностикума, обеспечивая тем самым дополнительное уменьшение количества фермента;
– предлагаемый способ в перспективе позволяет определять концентрации анализируемого вещества с помощью нескольких или даже одной капсулы, например, когда оболочка капсулы помечена флуоресцентной или радиоактивной меткой, а также когда в результате взаимодействия фермента с анализируемым веществом возникает интенсивная хемилюминесценция;
– предлагаемый способ позволяет использовать простые и доступные методы анализа, например, по изменению скорости седиментации микродиагностикума.
Формула изобретения
1. Микродиагностикум для ферментативного определения концентрации анализируемого вещества в биологической жидкости, характеризующийся тем, что он выполнен в виде по меньшей мере одной капсулы нано- или микроразмера, в которую инкапсулирован фермент, с мультислойной полупроницаемой оболочкой из полиэлектролитов с чередующимися слоями из полианионов и поликатионов, преимущественно линейной структуры, при этом анализируемое вещество является субстратом, или ингибитором, или активатором для инкапсулированного фермента.
2. Микродиагностикум по п.1, отличающийся тем, что указанная оболочка капсулы имеет проницаемость, достаточную для проникновения внутрь капсулы анализируемого вещества и при необходимости кофакторов инкапсулированного фермента, и препятствующего проникновению внутрь капсулы белков и их комплексов, повреждающих указанный фермент.
3. Микродиагностикум по п.1, отличающийся тем, что капсула имеет размер преимущественно 2-10 мкм, а ее оболочка – толщину преимущественно 30-100 нм.
4. Микродиагностикум по п.1, отличающийся тем, что в частном случае инкапсулированный фермент является уреазой.
5. Микродиагностикум по п.1, отличающийся тем, что в частном случае инкапсулированный фермент является лактатдегидрогеназой.
6. Способ ферментативного определения концентрации анализируемого вещества в биологической жидкости с помощью микродиагностикума по любому из пп.1-5, который вносят в исследуемую жидкость, а концентрацию анализируемого вещества определяют по количеству продукта реакции, катализируемой ферментом микродиагностикума, или по изменению активности фермента микродиагностикума.
7. Способ по п.6, отличающийся тем, что в исследуемую жидкость вносят кофактор, если он необходим для реакции, катализируемой ферментом микродиагностикума.
8. Способ по любому из пп.6 и 7, отличающийся тем, что в исследуемую жидкость вносят индикатор продукта реакции, катализируемой ферментом микродиагностикума.
9. Способ по п.8, отличающийся тем, что в качестве указанного индикатора берут вещество, изменяющее свои оптические характеристики в присутствии продукта реакции, катализируемой ферментом микродиагностикума.
10. Способ по п.8, отличающийся тем, что в качестве указанного индикатора берут вещество, образующее нерастворимый осадок с продуктом реакции, катализируемой ферментом микродиагностикума, при этом концентрацию анализируемого вещества определяют по изменению седиментационных характеристик микродиагностикума.
11. Способ по п.8, отличающийся тем, что в частном случае анализируемое вещество является мочевиной, микродиагностикум содержит в качестве инкапсулированного фермента уреазу, продуктом реакции расщепления мочевины уреазой являются ионы СО3 2- и NH4 +, а концентрацию мочевины определяют по количеству ионов СО3 2-, для чего в исследуемую жидкость вносят ионы металлов, образующие с ионами СО3 -2 нерастворимый осадок, например ионы бария или кальция, и измеряют седиментационные характеристики микродиагностикума, или по количеству NH4 +, для чего в исследуемую жидкость вносят индикатор, изменяющий свои оптические характеристики в присутствии ионов NH4 +, в качестве которого берут, например, салицилат, гипохлорит натрия и нитропруссид.
12. Способ по п.6, отличающийся тем, что в частном случае анализируемое вещество является пируватом, микродиагностикум содержит в качестве инкапсулированного фермента лактатдегидрогеназу, в исследуемую жидкость вносят кофактор NADH, продуктом реакции восстановления пирувата лактатдегидрогеназой в присутствии NADH является лактат и NAD, a концентрацию пирувата определяют по количеству прореагировавшего при этом NADH, которое равно концентрации образовавшегося лактата и соответственно прореагировавшего пирувата.
13. Способ по п.12, отличающийся тем, что концентрацию пирувата определяют по скорости изменения концентрации NADH, которая пропорциональна начальной концентрации пирувата.
РИСУНКИ
QB4A – Регистрация лицензионного договора на использование изобретения
Лицензиар(ы): Учреждение Российской академии наук Институт теоретической и экспериментальной биофизики Российской Академии Наук
Вид лицензии*: НИЛ
Лицензиат(ы): Общество с ограниченной ответственностью “Полимерные нанотехнологии”
Договор № РД0053115 зарегистрирован 27.07.2009
Извещение опубликовано: 10.09.2009 БИ: 25/2009
* ИЛ – исключительная лицензия НИЛ – неисключительная лицензия
PD4A – Изменение наименования обладателя патента СССР или патента Российской Федерации на изобретение
(73) Новое наименование патентообладателя:
Учреждение Российской академии наук Институт теоретической и экспериментальной биофизики РАН (RU)
Адрес для переписки:
142290, Московская обл., г. Пущино, мкр. В, д. 32, кв. 50, пат.пов. Л.Г. Садовниковой
Извещение опубликовано: 27.09.2009 БИ: 27/2009
|