|
|
(21), (22) Заявка: 2006100412/04, 10.01.2006
(24) Дата начала отсчета срока действия патента:
10.01.2006
(43) Дата публикации заявки: 20.07.2007
(46) Опубликовано: 10.02.2008
(56) Список документов, цитированных в отчете о
поиске:
БЕРГ Л.Г. Введение в термографию. – М.: Наука, 1961, с.278. SU 748209 A1, 18.07.1980. SU 109422 A1, 19.10.1955. SU 324572 A1, 04.09.1972. SU 162318 A1, 16.04.1964. US 4025309 A, 24.05.1977. GB 1388609 A, 26.03.1975. БАБАЕВСКИЙ П.Г. Практикум по полимерному материаловедению. – М.: Химия, 1980, с.182, 183. ИВАНОВА М.А., БЕЛОГЛАЗКИНА М.В., БОГОМОЛОВА
Адрес для переписки:
350040, г.Краснодар, ул. Ставропольская, 149, Кубанский государственный университет, отдел интеллектуальной собственности
|
(72) Автор(ы):
Офлиди Алексей Иванович (RU),
Фролов Владимир Юрьевич (RU),
Назаренко Максим Андреевич (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования Кубанский государственный университет (КубГУ) (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ КОЛИЧЕСТВА ВОДОРОДА В ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ И В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ С ОРГАНИЧЕСКИМИ ЛИГАНДАМИ
(57) Реферат:
Изобретение относится к аналитической химии, точнее к методам количественного определения водорода. Способ включает удаление и нахождение массы воды, образовавшейся в результате сжигания анализируемого вещества в инертной атмосфере и определяемой по разности масс веществ, измерение общего объема выделившихся углекислого газа и азота, удаление с помощью поглотителя углекислого газа из измеренного объема, определение объема азота, нахождение объема углекислого газа по разности общего объема и объема азота и предусматривает использование устройства для газоволюметрического CHN-анализа, причем перед измерением общего объема выделившихся углекислого газа и азота находят суммарную массу углекислого газа, азота и воды (m1), выделившихся в результате сжигания анализируемого вещества, находящегося в реакционном сосуде, как разность масс реакционного сосуда до и после сжигания анализируемого вещества, удаление воды осуществляют из реакционного сосуда (2), размещенного в кварцевой печи (1) с кварцевыми палочками (6), а после нахождения объема углекислого газа по известным соотношениям определяют массы углекислого газа и азота, сложив которые получают значение m2, после чего находят  m=m1-m2 (определение количества заданного компонента газовой смеси по разности найденных ранее общего количества данной смеси и количеств остальных компонентов этой смеси). Достигается простота и доступность определения количества водорода в ходе CHN-анализа. 1 ил. m=m1-m2 (определение количества заданного компонента газовой смеси по разности найденных ранее общего количества данной смеси и количеств остальных компонентов этой смеси). Достигается простота и доступность определения количества водорода в ходе CHN-анализа. 1 ил.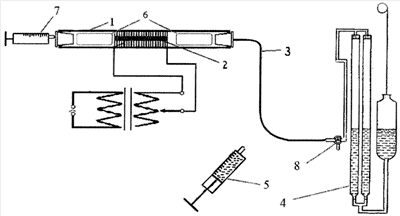
(56) (продолжение):
CLASS=”b560m”И.В., ФЕДОРЕНКО Е.В. Аналитическая химия и физико-химические методы анализа. Учебное пособие. – М.: РИОР, 2006, с.190.
Изобретение относится к аналитической химии, точнее к методам количественного определения водорода.
Определение количества водорода (Н) в органических веществах и комплексных соединениях с органическими лигандами всегда идет совместно с определением количества углерода (С) и азота (N) (при его наличии). Такое совместное определение трех вышеуказанных элементов в химических соединениях называется CHN-анализом (Методы количественного органического элементного микроанализа / Под. ред. Н.Э.Гельмана. – М.: Химия, 1987. С.8). CHN-анализ позволяет получить информацию о количественном соотношении элементов в соединении и помогает определить строение вещества. Все известные способы CHN-анализа основаны на сжигании анализируемого вещества, в результате которого происходит выделение углекислого газа (СО2), воды (Н2О) и азота (N2), количество которых находится по-разному.
Известны способы определения количества водорода, предусматривающие использование хроматографических CHN-анализаторов и основанные на хроматографическом разделении газовой смеси из СО2, Н2 и N2 и последующем детектировании разделенных компонентов (Методы количественного органического элементного микроанализа / Под. ред. Н.Э.Гельмана. – М.: Химия, 1987. С.11). Эти способы позволяют определять водород с высокой точностью и экспрессностью, но они недоступны большинству химических лабораторий из-за высокой стоимости хроматографических CHN-анализаторов.
Известен способ газоволюметрического определения количества водорода при одновременном определении количества углерода (Берг Л.Г. Введение в термографию. – М.: Наука, 1961. С.275), заключающийся в том, что на 1-й стадии навеску анализируемого вещества подвергают сжиганию, в результате которого происходит выделение углекислого газа и воды. При выходе из реакционного сосуда воду конденсируют, а углекислый газ попадает в газовую бюретку, где измеряют его объем, а затем рассчитывают количество углерода. После этого на 2-й стадии сжигают другую навеску этого же вещества. Но в данном случае выделившуюся воду не конденсируют, а пропускают через поглотитель (СаН2), взаимодействие воды с которым идет в соответствии с уравнением реакции:
СаН2+2Н2O=Са(ОН)2+2Н2
Образовавшийся в результате реакции водород вместе с углекислым газом поступает в газовую бюретку, где определяют суммарный объем этих газов. По найденному на 1-й стадии процентному содержанию углерода и измеренному на 2-й стадии объему углекислого газа и водорода рассчитывают количество водорода в анализируемом веществе.
Данный способ трудоемок и длителен, так как осуществляется в две стадии. Кроме того, обязательное использование поглотителя воды создает дополнительные сложности.
Наиболее близким аналогом к заявляемому способу является способ определения количества водорода в ходе CHN-анализа органических веществ и комплексных соединений с органическими лигандами (Берг Л.Г. Введение в термографию. – М.: Наука, 1961. С.278), заключающийся в нахождении массы воды, выделяющейся в виде пара в ходе реакции сжигания анализируемого вещества в атмосфере инертного газа. Пары воды связывают с предварительно взвешенным поглотителем (CaCl2), который затем снова взвешивают и по разности масс находят массу воды. Чтобы не происходило конденсации водяных паров, в трубку для сжигания помещают медную спираль, которая во время анализа находится в разогретом состоянии. Количество водорода определяют, исходя из массы воды по известным соотношениям.
Недостатком данного способа является его трудоемкость и сложность, обусловленные использованием поглотителя воды и медной спирали.
Технической задачей заявляемого изобретения является разработка простого и доступного определения количества водорода в ходе CHN-анализа.
Для решения поставленной технической задачи анализируемое вещество и реагент для сжигания помещают в реакционный сосуд и взвешивают. Сжигают анализируемое вещество, разместив реакционный сосуд в устройстве для CHN-анализа, после чего вновь его взвешивают. Перед измерением общего объема выделившихся углекислого газа и азота находят m1 как разность масс реакционного сосуда до и после сжигания анализируемого вещества, которая равна суммарной массе углекислого газа, азота и воды, выделившихся в результате сжигания анализируемого вещества. Воду удаляют из реакционного сосуда, размещенного в кварцевой печи с кварцевыми палочками. Измеряют общий объем выделившихся углекислого газа и азота. С помощью поглотителя удаляют углекислый газ из измеренного объема и определяют объем азота. Находят объем углекислого газа по разности общего объема и объема азота. После нахождения объема углекислого газа по известным соотношениям определяют массы углекислого газа и азота, сложив которые получают значение m2. Определяют  m, равную массе выделившейся воды, как m1-m2. По известным соотношениям, зная массу воды, находят количество водорода в анализируемом веществе. m, равную массе выделившейся воды, как m1-m2. По известным соотношениям, зная массу воды, находят количество водорода в анализируемом веществе.
Предлагаемый способ отличается от прототипа последовательностью действий и измеряемыми физическими параметрами образовавшихся в ходе сжигания анализируемого вещества соединений.
На чертеже изображено устройство, используемое для осуществления заявляемого способа.
Устройство состоит из кварцевой печи 1, реакционного сосуда 2 для анализируемого вещества, отводной пластиковой трубки 3, автоматической газовой бюретки 4, шприца 5 с поглотителем СО2, кварцевых палочек 6, шприца-дозатора 7 инертного газа, крана 8.
Пример 1. Навеску анализируемого вещества, например нитроанилина (0,06232 г), имеющего брутто-формулу С6Н6O2N2, тщательно перемешиваем с реагентом для сжигания, например с оксидом двухвалентной меди (CuO), взятым в десятикратном избытке для полного протекания процесса сжигания, помещаем в реакционный сосуд 2, представляющий собой кварцевую трубку, и взвешиваем (22,6513 г). Реакционный сосуд 2 располагаем в кварцевой печи 1, заполняем кварцевую печь 1 инертным газом, например аргоном, с помощью шприца-дозатора 7. Для уменьшения объема вводимого инертного газа в кварцевую печь 1 помещаем кварцевые палочки 6.
Сжигаем нитроанилин в реакционном сосуде 2, создав в кварцевой печи 1 температуру 800°С в соответствии с уравнением реакции:
С6Н6О2N2+13CuО 6СО3 6СО3 +3Н2О +3Н2О +N2 +N2 +13Cu +13Cu
Выделяющиеся в ходе реакции СО2 и N2 через отводную трубку 3 поступают в автоматическую газовую бюретку 4. Сжигаем в течение 5 мин и прекращаем тогда, когда объем газов в автоматической газовой бюретке 4 не изменяется в течение 1 мин. После сжигания для вытеснения из кварцевой печи 1 в автоматическую газовую бюретку 4 остатков СО2 и N2 через кварцевую печь 1 пропускаем фиксированный объем аргона (10 мл) с помощью шприца-дозатора 7. Кварцевую печь 1 охлаждают до комнатной температуры. Изолируем автоматическую газовую бюретку 4 от печи 1, повернув кран 8, и отсоединяем от кварцевой печи 1 отводную трубку 3, которую соединяем со шприцом 5.
Воду, образовавшуюся в ходе сжигания, удаляем из реакционного сосуда 2, размещенного в кварцевой печи 1 с кварцевыми палочками 6, а реакционный сосуд 2 достаем и вновь взвешиваем (22,4945 г). Таким образом, производя взвешивание реакционного сосуда 2 до и после сжигания нитроанилина, по разности масс определяем общую массу веществ, выделившихся из реакционного сосуда 2 в результате сжигания нитроанилина – СО2, N2 и Н2О. Это масса m1=0,1568 г.
Объем образовавшейся газовой смеси равен Vобщ=0,0902 л:
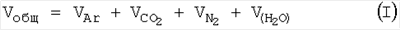
По табличным данным находим давление водяных паров над насыщенным раствором хлорида натрия 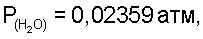 Т=298 К, далее рассчитываем Т=298 К, далее рассчитываем 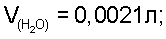 V(H2O)=0,0021 л; V(H2O)=0,0021 л;
определяем V(CO2)=0,0669 л (Р=1 атм, Т=298 К), V(N2)=0,0112 л (Р=1 атм, Т=298 К),
отсюда по уравнению Менделеева-Клапейрона:
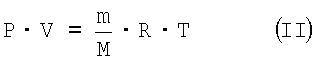
где V – объем CO2 или N2, л; Р – парциальное давление газовой смеси 4, атм; Т – температура, К; R – универсальная газовая постоянная (0,0831 атм·л/моль·К); m – масса CO2 или N2, г; М – молярная масса CO2 или N2, г/моль.
находим m(CO2)=0,1190 г, m(N2)=0,0127 г. Таким образом получаем m2=0,1270+0,0116=0,1317 г.
Следовательно, масса воды  m=m1-m2=0,1568-0,1317=0,0251 г. m=m1-m2=0,1568-0,1317=0,0251 г.
По формулам III, IV, V:
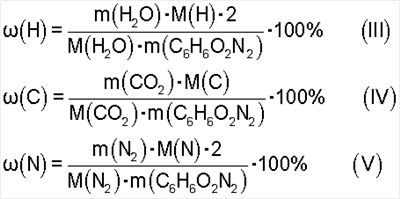
найдено Н 4,48%, С 52,08%, N 20,38%; вычислено Н 4,35%, С 52,17%, N 20,29%.
Пример 2. Аналогично тому, как описано в примере 1, определяем количество водорода в ходе CHN-анализа комплексного соединения бензимидазола с медью Cu(C7H6N2)2 (0,06755 г).
Сжигание навески комплекса проводим в смеси с оксидом меди (II) в кварцевой печи 1, предварительно взвесив реакционный сосуд 2 (22,7428 г), при 750°С согласно уравнению реакции
Cu(С7Н6N2)2+34CuO 14CO2 14CO2 +6Н2O +6Н2O +2N2 +2N2 +35Cu +35Cu
После сжигания для вытеснения из кварцевой печи 1 в автоматическую газовую бюретку 4 остатков CO2 и N2 через кварцевую печь 1 пропускаем 10 мл аргона.
Воду, образовавшуюся в ходе сжигания, удаляем из реакционного сосуда 2, размещенного в кварцевой печи 1 с кварцевыми палочками 6, а реакционный сосуд 2 взвешиваем (22,5799 г), отсюда получаем общую массу CO2, Н2O и N2 m1=22,7428-22,5799=0,1629 г. Измеряем объем образовавшейся газовой смеси
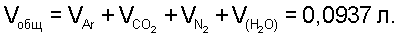
По табличным данным находим давление водяных паров над насыщенным раствором хлорида натрия 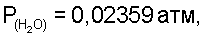 Т=298 К, далее рассчитываем Т=298 К, далее рассчитываем 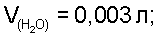 определяем V(СО2)=0,0706 л (Р=1 атм, Т=298 К), V(N2)=0,0101 л ( Р=1 атм, Т=298 К), отсюда по уравнению Менделеева-Клапейрона находим m(CO2)=0,1270 г, m(N2)=0,0116 г. Таким образом получаем m2=0,1270+0,0116=0,1386 г. определяем V(СО2)=0,0706 л (Р=1 атм, Т=298 К), V(N2)=0,0101 л ( Р=1 атм, Т=298 К), отсюда по уравнению Менделеева-Клапейрона находим m(CO2)=0,1270 г, m(N2)=0,0116 г. Таким образом получаем m2=0,1270+0,0116=0,1386 г.
Следовательно, масса воды  m=m1-m2=0,1629-0,1386=0,0243 г. m=m1-m2=0,1629-0,1386=0,0243 г.
Далее найдено Н 3,82%, С 55,71%, N 18,17%; вычислено Н 4,00%, С 56,00%, N18,66%.
Заявляемый способ определения количества водорода не снижает точность определения по сравнению с прототипом. В то же время данный способ позволяет обойтись без использования поглотителя воды и медной спирали, благодаря чему определение количества водорода в ходе газоволюметрического CHN-анализа стало менее длительным, более простым и доступным.
Формула изобретения
Способ определения количества водорода в органических веществах и в комплексных соединениях с органическими лигандами, включающий удаление и нахождение массы воды, образовавшейся в результате сжигания анализируемого вещества в инертной атмосфере и определяемой по разности масс веществ, измерение общего объема выделившихся углекислого газа и азота, удаление с помощью поглотителя углекислого газа из измеренного объема, определение объема азота, нахождение объема углекислого газа по разности общего объема и объема азота и предусматривающий использование устройства для газоволюметрического CHN-анализа, отличающийся тем, что перед измерением общего объема выделившихся углекислого газа и азота находят суммарную массу углекислого газа, азота и воды (m1), выделившихся в результате сжигания анализируемого вещества, находящегося в реакционном сосуде, как разность масс реакционного сосуда до и после сжигания анализируемого вещества, удаление воды осуществляют из реакционного сосуда (2), размещенного в кварцевой печи (1) с кварцевыми палочками (6), а после нахождения объема углекислого газа по известным соотношениям определяют массы углекислого газа и азота, сложив которые получают значение m2, после чего находят  m=m1-m2 (определение количества заданного компонента газовой смеси по разности найденных ранее общего количества данной смеси и количеств остальных компонентов этой смеси). m=m1-m2 (определение количества заданного компонента газовой смеси по разности найденных ранее общего количества данной смеси и количеств остальных компонентов этой смеси).
РИСУНКИ
|
|